Resumos
OBJETIVO: Identificar as espécies de morcegos envolvidas na manutenção do ciclo da raiva, verificar a distribuição do vírus da raiva em tecidos e órgãos de morcegos e os períodos de mortalidade dos camundongos inoculados. MÉTODOS: A positividade para o vírus da raiva foi avaliada por imunofluorescência direta em morcegos de municípios do Estado de São Paulo, de abril de 2002 a novembro de 2003. A distribuição do vírus nos morcegos foi avaliada pela inoculação de camundongos e infecção de células N2A, com suspensões a 20% preparadas a partir de fragmentos de diversos órgãos e tecidos, além de cérebro e glândula salivar. A mortalidade dos camundongos foi observada diariamente, após inoculação intracerebral. RESULTADOS: Dos 4.393 morcegos pesquisados, 1,9% foram positivos para o vírus da raiva, pertencentes a dez gêneros, com predomínio de insetívoros. A média do período máximo de mortalidade dos camundongos pós-inoculação a partir de cérebros e glândulas salivares de morcegos hematófagos foi de 15,33±2,08 dias e 11,33±2,30 dias; insetívoros, 16,45±4,48 dias e 18,91±6,12 dias; e frugívoros, 12,60±2,13 dias e 15,67±4,82 dias, respectivamente. CONCLUSÕES: As espécies infectadas com o vírus da raiva foram: Artibeus lituratus, Artibeus sp., Myotis nigricans, Myotis sp., Eptesicus sp., Lasiurus ega, Lasiurus cinereus, Nyctinomops laticaudatus, Tadarida brasiliensis, Histiotus velatus, Molossus rufus, Eumops sp. e Desmodus rotundus. A pesquisa de vírus em diferentes tecidos e órgãos mostrou-se que os mais apropriados para o isolamento foram cérebro e glândulas salivares.
Vírus da raiva; Raiva; Quirópteros; Camundongos; Técnicas de cultura de células
OBJECTIVE: To identify the species of bats involved in maintaining the rabies cycle; to investigate the distribution of the rabies virus in the tissues and organs of bats and the time taken for mortality among inoculated mice. METHODS: From April 2002 to November 2003, bats from municipalities in the State of São Paulo were screened for the presence of the rabies virus, by means of direct immunofluorescence. The virus distribution in the bats was evaluated by inoculating mice and N2A cells with 20% suspensions prepared from fragments of different organs and tissues, plus the brain and salivary glands. The time taken for mortality among the mice was monitored daily, following intracerebral inoculation. RESULTS: Out of the 4,395 bats received, 1.9% were found positive for the rabies virus. They belonged to ten genera, with predominance of insectivores. The maximum mean times taken for mortality among the mice following inoculation with brain and salivary gland material were 15.33±2.08 days and 11.33±2.30 days for vampire bats, 16.45±4.48 days and 18.91±6.12 days for insectivorous bats, and 12.60±2.13 days and 15.67±4.82 days for frugivorous bats, respectively. CONCLUSIONS: The species infected with the rabies virus were: Artibeus lituratus, Artibeus sp., Myotis nigricans, Myotis sp., Eptesicus sp., Lasiurus ega, Lasiurus cinereus, Nyctinomops laticaudatus, Tadarida brasiliensis, Histiotus velatus, Molossus rufus, Eumops sp. and Desmodus rotundus. Virus investigation in the different tissues and organs showed that the brain and salivary glands were the most suitable sites for virus isolation.
Rabies vírus; Rabies; Chiroptera; Mice; Cell culture techniques
ARTIGOS ORIGINAIS
Vírus da raiva em quirópteros naturalmente infectados no Estado de São Paulo, Brasil
Karin Corrêa SchefferI; Maria Luiza CarrieriI; Avelino AlbasII; Helaine Cristina Pires dos SantosI; Ivanete KotaitI; Fumio Honma ItoIII
IInstituto Pasteur de São Paulo. São Paulo, SP, Brasil
IIPólo Regional de Desenvolvimento Tecnológico dos Agronegócios da Alta Sorocabana. Presidente Prudente, SP, Brasil
IIIFaculdade de Medicina Veterinária e Zootecnia. Universidade de São Paulo. São Paulo, SP, Brasil
Correspondência Correspondência: Karin Corrêa Scheffer Instituto Pasteur Seção de Diagnóstico Av. Paulista, 393 Cerqueira César 01311-000 São Paulo, SP, Brasil E-mail: ksferreira@pasteur.saude.sp.gov.br
RESUMO
OBJETIVO: Identificar as espécies de morcegos envolvidas na manutenção do ciclo da raiva, verificar a distribuição do vírus da raiva em tecidos e órgãos de morcegos e os períodos de mortalidade dos camundongos inoculados.
MÉTODOS: A positividade para o vírus da raiva foi avaliada por imunofluorescência direta em morcegos de municípios do Estado de São Paulo, de abril de 2002 a novembro de 2003. A distribuição do vírus nos morcegos foi avaliada pela inoculação de camundongos e infecção de células N2A, com suspensões a 20% preparadas a partir de fragmentos de diversos órgãos e tecidos, além de cérebro e glândula salivar. A mortalidade dos camundongos foi observada diariamente, após inoculação intracerebral.
RESULTADOS: Dos 4.393 morcegos pesquisados, 1,9% foram positivos para o vírus da raiva, pertencentes a dez gêneros, com predomínio de insetívoros. A média do período máximo de mortalidade dos camundongos pós-inoculação a partir de cérebros e glândulas salivares de morcegos hematófagos foi de 15,33±2,08 dias e 11,33±2,30 dias; insetívoros, 16,45±4,48 dias e 18,91±6,12 dias; e frugívoros, 12,60±2,13 dias e 15,67±4,82 dias, respectivamente.
CONCLUSÕES: As espécies infectadas com o vírus da raiva foram: Artibeus lituratus, Artibeus sp., Myotis nigricans, Myotis sp., Eptesicus sp., Lasiurus ega, Lasiurus cinereus, Nyctinomops laticaudatus, Tadarida brasiliensis, Histiotus velatus, Molossus rufus, Eumops sp. e Desmodus rotundus. A pesquisa de vírus em diferentes tecidos e órgãos mostrou-se que os mais apropriados para o isolamento foram cérebro e glândulas salivares.
Descritores: Vírus da raiva, isolamento e purificação. Raiva, virologia. Quirópteros, virologia. Camundongos, virologia. Técnicas de cultura de células.
INTRODUÇÃO
A raiva é uma doença mantida na natureza por diferentes espécies domésticas e silvestres das ordens Carnivora e Chiroptera de diferentes hábitos alimentares, denominados reservatórios.20
O envolvimento de morcegos hematófagos na transmissão do vírus da raiva foi sugerido no início do século passado.4 A hipótese foi confirmada por Haupt & Rehaag,11 que identificaram a presença de corpúsculos de Negri no sistema nervoso central de um morcego hematófago que se alimentava em um bovino. Os morcegos hematófagos, especialmente o Desmodus rotundus, são os reservatórios do vírus da raiva nos países da América Latina,21 e endêmicos da região do norte do Chile e Argentina até o norte do México e parte do Caribe.13
Em 1953, na Flórida (EUA), um menino foi atacado pelo morcego insetívoro Lasiurus intermedius, fazendo com que os pesquisadores norte-americanos voltassem suas atenções à questão da raiva em morcegos não hematófagos.2 Pouco tempo depois, a infecção pelo vírus da raiva foi confirmada em diferentes espécies de morcegos de hábitos alimentares distintos, incluindo os insetívoros, frugívoros, omnívoros, polinívoros e piscívoros.1
Nos últimos anos, os relatos de isolamento de vírus da raiva ou de vírus aparentados à raiva a partir de morcegos de diferentes hábitos alimentares tornaram-se freqüentes em todo o mundo, e muitos deles denominados de "lissavírus" emergentes.
O vírus da raiva pertence ao gênero Lyssavirus da família Rhabdoviridae, ordem Mononegavirales, e na classificação atual o gênero Lyssavirus contém sete genótipos.10 Destes, apenas o genótipo III Mokola virus não foi isolado de morcegos insetívoros.* * Nel LH. Mokola virus: a brief review of the status quo. Presented at the 6th Conference of the Southern and Eastern African Rabies Group. Lilongwe, Malawi, June 2001. Atualmente, foram sugeridas mais quatro variantes virais para constituírem-se em novos genótipos de Lyssavirus, todas isoladas de morcegos.3 Somente no continente americano e no Caribe foi registrada a presença de genótipo I dos Lyssavirus.9
No Brasil, até 2003, o envolvimento de morcegos hematófagos na transmissão da raiva a humanos era descrito com baixa freqüência.17 Em 2005, dos 45 casos registrados de raiva humana, 42 foram transmitidos por morcegos hematófagos.** ** Ministério da Saúde - Programa Nacional de Profilaxia da Raiva. Casos de raiva humana notificados, e percentual de casos transmitidos segundo a espécie animal. Brasília; 2005 Por outro lado, tem sido raro o registro da transmissão do vírus da raiva por morcegos não hematófagos aos animais silvestres terrestres. Essa forma de transmissão, se confirmada, exige medidas específicas de controle.1
Desde que Silva & Souza19 revisaram o tema sobre a pesquisa do vírus da raiva em morcegos hematófagos, foram abertas novas perspectivas para melhor conhecimento de particularidades da raiva nesses animais. Nilsson & Nagata16 isolaram o vírus da raiva de cérebro, glândulas salivares, gordura interescapular, coração, pulmões e testículos de um espécime de Desmodus rotundus.
O conhecimento de aspectos ligados à patogenia e epidemiologia da raiva nas diferentes espécies de morcegos constitui importante instrumento para o controle da enfermidade nesses animais, bem como em herbívoros, animais de estimação e humanos.
O objetivo do presente estudo foi identificar as espécies de morcegos envolvidas na manutenção do ciclo da raiva no Estado de São Paulo e verificar a distribuição do vírus da raiva em tecidos e órgãos de morcegos e os períodos de mortalidade de camundongos inoculados.
MÉTODOS
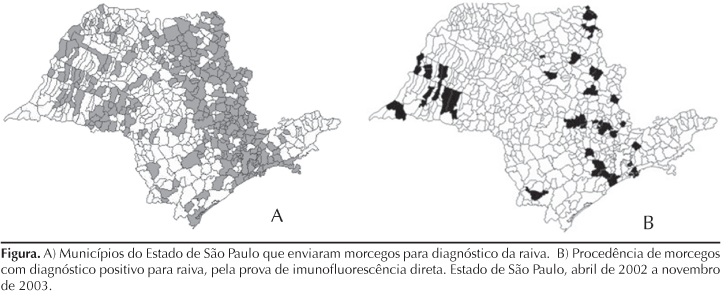
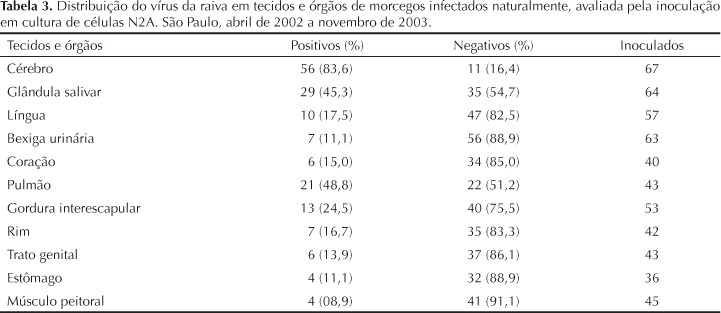
No período de abril de 2002 a novembro de 2003, a Seção de Diagnóstico do Instituto Pasteur de São Paulo recebeu 4.393 morcegos de 261 municípios do Estado de São Paulo para exame laboratorial de rotina. Os animais positivos para vírus da raiva foram identificados até gênero e/ou espécie, segundo Vizotto & Taddei.22 Além disso, registrou-se o hábito alimentar desses animais (Tabela 1).
Amostras de tecido cerebral de todos os morcegos recebidos foram submetidas à prova de imunofluorescência direta (IFD), descrita por Dean et al,6 para a pesquisa do antígeno da raiva. Utilizou-se o vírus fixo "Challenge Virus Standard" (CVS), amostra CVS/31, adaptada a cérebros de camundongos, apresentando título de 106DLIC50/0,03 mL para a obtenção da suspensão de vírus, para a absorção do conjugado anti-rábico. Os morcegos com diagnóstico positivo para raiva foram procedentes de vários municípios, destacados na Figura.
Dos animais positivos, retiraram-se fragmentos de tecido do cérebro, glândula salivar, músculo peitoral, coração, pulmões, estômago, rins, bexiga urinária, trato genital, língua e gordura interescapular. Os fragmentos foram macerados individualmente em solução fisiológica a 0,85%, adicionada de 2% de soro fetal bovino, isento de anticorpos anti-rábicos e 1mL de garamicina por litro de diluente. Essa suspensão foi mantida sob refrigeração por 30 min e centrifugada a 3000 rpm por 30 min. Nem todos os tecidos e órgãos estavam em condições de serem submetidos à prova de isolamento do vírus em camundongos e/ou em cultivo celular. Assim, para 40 espécimes foram utilizadas suspensões tanto de cérebros como de glândulas salivares.
A inoculação intracerebral em camundongos seguiu a técnica de Koprowski.14 Os camundongos empregados foram albinos suíços de 21 dias de idade, com peso entre 12 e 14 g, obtidos do biotério do Instituto Pasteur de São Paulo e inoculados com 0,03 mL de inóculo. Utilizaram-se grupos de cinco a sete indivíduos por amostra. Após a inoculação, os animais foram observados durante 30 dias. Definiu-se como período mínimo de mortalidade o número de dias entre a inoculação e a data do primeiro óbito, e o período máximo de mortalidade, o período entre a inoculação e a data do último óbito. Para a confirmação da presença do vírus da raiva nos animais que morreram no período de observação, os cérebros foram submetidos à técnica de IFD.
Para inoculação em cultivo celular, utilizou-se cultura de células de neuroblastoma murino (N2A) proveniente do American Type Culture Collection (ATCC Virginia, EUA). Em placa com 96 poços, colocou-se 40µL do inóculo previamente preparado com 160µL de meio essencial mínimo (MEM), gentamicina e aminoácidos não essenciais. Após a homogeneização, foram acrescentados 100µL (contendo 5 x 105 células) de suspensão de células N2A em cada poço. Cada amostra foi testada em triplicata. Para a revelação do teste, foi utilizada a técnica descrita por Webster & Casey23 e a leitura foi realizada em microscópio invertido de fluorescência.
A pesquisa foi conduzida dentro dos padrões éticos exigidos e aprovada pela comissão de Bioética da Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo.
RESULTADOS
Do total de 4.393 animais analisados, 3.978 (90,5%) eram morcegos não hematófagos e 415 (9,4%) morcegos hematófagos. O índice de positividade total foi de 1,9% (82/4.393), sendo 1,4% (6/415) entre os hematófagos e de 1,9% (76/3.978) entre os não hematófagos. Os morcegos positivos para a raiva pertenciam aos gêneros: Artibeus, Myotis, Eptesicus, Lasiurus, Nyctinomops, Tadarida (T. brasiliensis), Histiotus, Molossus, Eumops e Desmodus (D. rotundus).
Em relação ao hábito alimentar, dentre os morcegos positivos, 43 eram insetívoros, predominando espécies dos gêneros Myotis (15/82) e Eptesicus (10/82); 33 eram frugívoros, todos do gênero Artibeus; e seis eram hematófagos (Desmodus rotundus) (Tabela 1).
Os resultados da inoculação de fragmentos de tecidos e órgãos de morcegos com diagnóstico positivo para raiva em camundongos e em cultura celular N2A estão apresentados nas Tabelas 2 e 3. Observou-se que o número de diagnósticos falso-negativos (8) foi menor quando utilizados os camundongos do que o cultivo celular (11).
O período mínimo de mortalidade do vírus isolado das amostras do cérebro variou entre sete e 20 dias e o período máximo, entre dez e 27 dias. Por sua vez, as amostras de glândulas salivares tiveram variação no período mínimo de sete a 26 dias, e no período máximo, de nove a 31, conforme a Tabela 4.
DISCUSSÃO
A proporção de 82 (1,9%) de reagentes positivos não pode ser interpretada como prevalência real da raiva em morcegos no Estado de São Paulo, pois refere-se à positividade ao teste de IFD.
De acordo com Baer,1 nos levantamentos realizados na década de 1950 e 1960 nos Estados Unidos, a prevalência da raiva em morcegos não hematófagos era variável, porém geralmente inferior a 1%. Ainda de acordo com os estudos da década de 1950 realizados nos Estados Unidos, um dos fatores de variação da prevalência era o hábito solitário ou gregário dos morcegos. Entre os morcegos positivos, identificados nesta pesquisa, 6% apresentavam hábitos solitários; 73% formam pequenas colônias (até 20 espécimes) e 21% formam grandes colônias.
No presente trabalho, os morcegos do gênero Artibeus enviados ao Instituto Pasteur para diagnóstico da raiva foram confirmados como tendo hábito sinantrópico. Foi relatado histórico de contato e/ou agressão às pessoas ou aos animais domésticos, ou esses morcegos foram capturados para fins de vigilância epidemiológica, na maioria das vezes em ambientes urbanos.
Os morcegos insetívoros foram os mais freqüentes entre casos positivos, o que pode refletir a maior densidade deste grupo de morcegos no Estado.17 Os morcegos Artibeus lituratus e os Desmodus rotundus têm apresentado infecção pelo vírus da raiva com um perfil específico, identificado com painel de anticorpos monoclonais, e a variante do vírus é conhecida por variante 3, ou variante Desmodus rotundus.7 Por outro lado, a análise filogenética dos vírus da raiva isolados de Artibeus lituratus e Artibeus planirostris no Estado de São Paulo revelou semelhança com amostras isoladas de morcegos Desmodus rotundus.18
Têm sido raras as pesquisas do vírus da raiva em tecidos ou órgãos de morcegos naturalmente infectados. O vírus da raiva havia sido isolado, pela inoculação intracerebral em camundongos, de órgãos tais como coração, pulmão, rins, bexiga, glândula interescapular de Desmodus rotundus, porém em casos isolados.16,17
Estudos sobre infecções experimentais em Desmodus rotundus e pesquisando a presença de vírus em órgãos e tecidos destes animais, relataram o isolamento do vírus em glândulas salivares e pulmões.15 Em morcegos insetívoros Eptesicus serotinus, o vírus foi pesquisado em "swabs" da orofaringe e, pela prova da RT-PCR, os resultados foram positivos, embora não tenha sido identificado ou isolado vírus em tecido cerebral.8
O Mokola vírus (MOKV), genótipo III do gênero Lyssavirus, foi descrito na literatura como sendo vírus viscerotrópico,* * Nel LH. Mokola virus: a brief review of the status quo. Presented at the 6th Conference of the Southern and Eastern African Rabies Group. Lilongwe, Malawi, June 2001. porém pode-se depreender que os vírus do genótipo I ou os vírus clássicos de raiva isolados de morcegos do Estado de São Paulo também são viscerotrópicos. Para fins de isolamento do vírus da raiva, o material mais indicado é o cérebro, tanto em camundongos como em cultivo celular. Em seguida, a glândula salivar foi a que apresentou melhor resultado, no sistema camundongo. Em culturas de células N2A, o terceiro tecido com maior positividade foi o pulmão.
Recentemente, em estudo realizado com dois espécimes de Myotis daubentonii foi isolado e quantificado o genoma do vírus aparentado ao da raiva (EBL2) em diversos órgãos, entre eles língua, fígado, bexiga, rins, intestino e estômago.12
Em muitas amostras não foi possível isolar o vírus em células devido à contaminação bacteriana, especialmente quando os materiais eram retirados de animais encontrados mortos. Nos casos de isolamento positivo em células, 96 horas de observação foram suficientes, confirmando os dados de Webster & Casey24 que estabeleceram quatro dias como o período ideal para o isolamento de vírus da raiva, especialmente de amostras com baixo título viral.
No presente trabalho, a evidência do vírus da raiva nos pulmões reforça a teoria da transmissão da raiva por aerossóis entre os quirópteros, especialmente em cavernas densamente povoadas por morcegos infectados.5 A evidência de vírus da raiva em bexiga, rins e estômago mostra a importância da distribuição do vírus da raiva em morcegos e sugere potencial de transmissão da raiva por estes animais pela urina e fezes.12 A presença de vírus na língua e glândulas salivares permite concluir que a via de transmissão mais comum entre os morcegos é pela mordedura.
Em relação ao período de mortalidade, os resultados do presente trabalho corroboram os achados de Webster & Casey.24 As pequenas diferenças observadas na presente pesquisa quanto ao período de mortalidade podem ser decorrentes da carga viral no cérebro e na glândula salivar, presença de anticorpos neutralizantes nas suspensões de tecidos utilizados como inóculos ou temperatura ambiente elevada do biotério que podem influenciar o início dos sinais clínicos, diminuição da mortalidade e aumento da freqüência de infecção abortiva nos animais inoculados.24
Conforme ilustrado na Tabela 4, os períodos mínimos de mortalidade encontrados para os materiais do cérebro e da glândula salivar de morcegos de diferentes hábitos alimentares foram inferiores a 21 dias. A redução de nove dias na observação diária desses animais poderia significar uma economia nos gastos de manutenção e execução desta prova, se comparado com os 30 dias convencionais.
O uso de sistema de cultivo celular para o diagnóstico da raiva tem sido defendido por muitos profissionais e instituições, preocupados com o uso de animais na experimentação e na pesquisa científica.
A triagem com a prova de IFD para, em seguida, submeter os materiais às provas de inoculação intracerebral em camundongos e inoculação em cultivo celular contribuiu para a obtenção de resultados positivos em ambos os sistemas biológicos.
A disseminação do vírus da raiva em diferentes tecidos e órgãos, além do sistema nervoso central e glândulas salivares contribui para reforçar as teorias de outras formas de transmissão da raiva nestes animais. Inclusive, ratifica os riscos de infecção de seres humanos e animais domésticos, quando em contato com morcegos de qualquer espécie, mortos ou vivos, ou mesmo com urina e fezes.
Os resultados obtidos na presente pesquisa ressaltam a importância da manutenção do tratamento profilático humano pós-exposição (soro e vacina), quando ocorrer contato entre humanos e morcegos. Há necessidade de estudos de diferentes esquemas de tratamento para animais de estimação na dependência do seu status imunológico, em situações de contato com morcegos.
Recebido: 14/6/2006
Revisado: 24/10/2006
Aprovado: 7/2/2007
Artigo baseado em dissertação de mestrado de KC Scheffer, apresentada à Faculdade de Medicina Veterinária e Zootecnia da USP, em 2005. Financiado pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP processo nº 02/05855-0) e pelo Instituto Pasteur da Secretaria da Saúde de São Paulo.
- 1. Baer GM. Rabies in nonhematophagous bats. In: Baer GM. The natural history of rabies. New York: Academic Press; 1975. p. 79-97.
- 2. Bigler WJ, Hoff GL, Buff EE. Chiropteran rabies in Florida: a twenty-year analysis, 1954 to 1973. Am J Trop Med Hyg. 1974;24(2):347-52.
- 3. Botvinkin AD, Poleschuk EM, Kuzmin IV, Borisova TI, Gazaryan SV, Yager P, et al. Novel lyssaviruses isolated from bats in Russia. Emerg Infect Dis. 2003; 9(12):1623-5.
- 4. Carini A. Sur une grande épizootie de rage. Ann Inst Pasteur. 1911;25:843-6.
- 5. Constantine DG. Rabies transmission by non bite route. Publ Health Rep.1962; 77:287-9.
- 6. Dean DJ, Abelseth MK, Atanasiu P. The fluorescent antibody test. In: Meslin FX, Kaplan MM, Koprowiski H, editores. Laboratory techniques in rabies 4.ed. Geneva: World Health Organization; 1996. p.88-95.
- 7. Delpietro HA, Gury-Dhomen F, Larghi OP, Mena-Segura C, Abramo L. Monoclonal antibody characterization of rabies virus strains isolated in the River Plate Basin. Zentralbl Veterinarmed B.1997;44(8):477-83.
- 8. Eschevarria JE, Avellon A, Juste J, Vera M, Ibanez C. Screening of active lyssavirus infection in wild bat populations by viral RNA detection on oropharingeal swabs. J Clin Microb. 2001;39(10):3678-83.
- 9. Fooks AR. The challenge of new and emerging lyssaviruses. Expert Rev Vaccines. 2004;3(4):333-6.
- 10. Gould AR, Hyatt AD, Lunt R, Kattenbelt JA, Hengstberger S, BlackselL SD. Characterisation of a novel lyssavirus isolated from Pteropid bats in Australia. Virus Res. 1998;54(2):165-87.
- 11. Haupt H, Rehaag H. Raiva epizoótica nos rebanhos de Santa Catarina, sul do Brasil, transmitida por morcegos. Bol Soc Bras Med Vet.1925;2:17-47.
- 12. Johnson N, Wakeley PR, Brookes SM, Fooks AR. European bat lyssavirus type 2 RNA in Myotis daubentonii Emerg Infect Dis. 2006;12(7):1142-4.
- 13. Koopman KF. Systematics and distribution. In: Greenhall AM, Schmidt U, editores. Natural history of vampire bats. Florida: CRC Press;1988. p.7-17.
- 14. Koprowski H. The mouse inoculation test. In: Meslin FX, Kaplan MM, Koprowski H. Laboratory techniques in rabies. 4.ed. Geneva: World Health Organization 1996; p.80-7.
- 15. Moreno AJ, Baer GM. Experimental rabies in the vampire bat. Am J Trop Med Hyg. 1980;29(2):254-9.
- 16. Nilsson MR, Nagata CA. Isolamento do vírus rábico do cérebro, glândulas salivares e interescapular, coração, pulmões e testículos de morcegos Desmodus rotundus (Geoffroy, 1910), no Estado de São Paulo. Arq Inst Biol (Sao Paulo).1975; 42(23):183-8.
- 17. Rosa EST, Kotait I, Barbosa TFS, Carrieri ML, Brandão PE, Pinheiro AS, et al. Bat-transmitted human rabies outbreaks, Brazilian Amazon. Emerg Infect Dis. 2006;12(8):1197-202.
- 18. Shoji Y, Kobayashi Y, Sato G, Itou T, Miura Y, Mikami T, et al. Genetic characterization of rabies viruses isolated from frugivorous bat (Artibeus spp.) in Brazil. J Vet Med Sci. 2004;66(10):1271-3.
- 19. Silva RA, Souza AMA. Isolamento do vírus rábico de pulmão, coração, rins, bexiga e outros diferentes tecidos de morcegos hematófagos da espécie Desmodus rotundus Pesq Agrop Bras. 1968;3:291-301.
- 20. Smith JS. New aspects of rabies with emphasis on epidemiology, diagnosis, and prevention of the disease in the United States. Clin Microb Rev. 1996; 9(2):166-76.
- 21. Torres S, Queiroz Lima E. A raiva e os morcegos hematófagos infectados naturalmente. Rev Depart Nac Prod Animal1935;3(1-6):165-174.
- 22. Vizotto LD, Taddei VA. Chave para determinação de quirópteros brasileiros. Rev Fac Filos Cien Letr S José R Preto Bolm Cienc. 1973(1):1-72.
- 23. Webster WA, Casey GA. Virus isolation in neuroblastoma cell culture. In: Meslin FX, Kaplan MM, Koprowski H, editores. Laboratory techniques in rabies, 4.ed. Geneva: World Health Organization;1996. p.96-104.
- 24. Webster WA, Casey GA. Diagnosis of rabies infection. In: Campbell JB, Charlton KM, editores. Rabies. Boston: Kluwer Academic Publishers; 1988. p.20122.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
16 Maio 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Aceito
07 Fev 2007 -
Revisado
24 Out 2006 -
Recebido
14 Jun 2006