Resumos
OBJETIVO: Caracterizar os principais elementos processuais, médico-científicos e sanitários que respaldam as decisões das demandas judiciais individuais por medicamentos consideradas essenciais. MÉTODOS: Estudo descritivo retrospectivo com base em 27 ações julgadas em 2ª instância no Estado do Rio de Janeiro em 2006. Os processos originais foram solicitados ao Arquivo Central do Tribunal de Justiça do Estado do Rio de Janeiro, fotografados e analisados na íntegra. RESULTADOS: Todas as ações incluíram prescrição e atestado médicos. As prescrições estavam em desacordo com a legislação. Não houve perícia médica em nenhuma das ações e em 7,4% constavam exames complementares. Apesar da escassa informação médica contida nos autos, todos os pedidos foram deferidos. CONCLUSÕES: O acolhimento de demandas judiciais carentes de subsídios clínicos e diagnósticos traz embaraços de ordem gerencial e sanitária ao sistema de saúde, pois comprometem a assistência farmacêutica regular e fomentam o uso irracional de medicamentos.
Assistência Farmacêutica, legislação & jurisprudência; Prescrições de Medicamentos; Decisões Judiciais; Legislação Sanitária
OBJETIVO: Caracterizar los principales elementos procesales, medico-científicos y sanitarios que respaldan las decisiones de las demandas judiciales individuales por medicamentos consideradas esenciales. MÉTODOS: Estudio descriptivo retrospectivo con base en 27 acciones juzgadas en 2ª instancia en el estado de Rio de Janeiro, Sureste de Brasil, en 2006. Los procesos originales fueron solicitados al Archivo Central del Tribunal de Justicia del Estado de Rio de Janeiro, fotografiados y analizados de forma íntegra. RESULTADOS: Todas las acciones incluyeron prescripción y atestados médicos. Las prescripciones estaban en desacuerdo con la legislación. No hubo pericia médica en ninguna de las acciones y en 7,4% constaban exámenes complementarios. A pesar de la escasa información médica contenida en los autos, todos los pedidos fueron deferidos. CONCLUSIONES: El acogimiento de demandas judiciales carentes de subsidios clínicos y diagnósticos trae complicaciones de tipo gerencial y sanitaria al sistema de salud, ya que comprometen la asistencia farmacéutica regular y fomentan el uso irracional de medicamentos.
Servicios Farmacéuticos, legislación & jurisprudencia; Prescripciones de Medicamentos; Decisiones Judiciales; Legislación Sanitaria
OBJECTIVE: To characterize the main medical, scientific and health-related procedural elements upon which decisions are made in individual lawsuits demanding medicines that are considered essential to the Court of Justice. METHODS: Retrospective descriptive study based on 27 cases ruled on by the Court of Appeals in Rio de Janeiro, Southeastern Brazil, in 2006. The original proceedings were solicited from the Central Archive of the Court of Justice of the State of Rio de Janeiro and were photographed and analyzed in full. RESULTS: Prescriptions and medical certificates were present in 100% of the lawsuits. All prescriptions lacked conformity to legislation. No expert medical reports were added, and only 7.4% of the lawsuits presented complementary examinations. In spite of the scarcity of medical information present in the records, all of the demands were granted. CONCLUSIONS: The admission of judicial demands devoid of clinical and diagnostic substantiation results in managerial and health-related constraints on the health system. Besides creating havoc in standard pharmaceutical services, badly justified medicine demands may compromise rational drug use.
Pharmaceutical Services, legislation & jurisprudence; Drug Prescriptions; Judicial Decisions; Legislation, Health
Racionalidade terapêutica: elementos médico-sanitários nas demandas judiciais de medicamentos
Racionalidad terapéutica: elementos medico-sanitarios en las demandas judiciales de medicamento
João Mauricio Brambati Sant'AnaI; Vera Lúcia Edais PepeII; Tatiana Aragão FigueiredoI; Claudia Garcia Serpa Osorio-de-CastroIII; Miriam VenturaI
IPrograma de Pós-Graduação em Saúde Pública. Escola Nacional de Saúde Pública. Fundação Oswaldo Cruz. Rio de Janeiro, RJ, Brasil
IIDepartamento de Administração e Planejamento em Saúde. Escola Nacional de Saúde Pública. Fundação Oswaldo Cruz. Rio de Janeiro, RJ, Brasil
IIINúcleo de Assistência Farmacêutica. Escola Nacional de Saúde Pública. Fundação Oswaldo Cruz. Rio de Janeiro, RJ, Brasil
Correspondência | Correspondence Correspondência | Correspondence: João Maurício Brambati Sant'Ana Rua Dr. Aristides Navarro de Carvalho 300 Centro 29200-120 Guarapari, ES, Brasil E-mail: jmbrambati@gmail.com
RESUMO
OBJETIVO: Caracterizar os principais elementos processuais, médico-científicos e sanitários que respaldam as decisões das demandas judiciais individuais por medicamentos consideradas essenciais.
MÉTODOS: Estudo descritivo retrospectivo com base em 27 ações julgadas em 2ª instância no Estado do Rio de Janeiro em 2006. Os processos originais foram solicitados ao Arquivo Central do Tribunal de Justiça do Estado do Rio de Janeiro, fotografados e analisados na íntegra.
RESULTADOS: Todas as ações incluíram prescrição e atestado médicos. As prescrições estavam em desacordo com a legislação. Não houve perícia médica em nenhuma das ações e em 7,4% constavam exames complementares. Apesar da escassa informação médica contida nos autos, todos os pedidos foram deferidos.
CONCLUSÕES: O acolhimento de demandas judiciais carentes de subsídios clínicos e diagnósticos traz embaraços de ordem gerencial e sanitária ao sistema de saúde, pois comprometem a assistência farmacêutica regular e fomentam o uso irracional de medicamentos.
Descritores: Assistência Farmacêutica, legislação & jurisprudência. Prescrições de Medicamentos. Decisões Judiciais. Legislação Sanitária.
RESUMEN
OBJETIVO: Caracterizar los principales elementos procesales, medico-científicos y sanitarios que respaldan las decisiones de las demandas judiciales individuales por medicamentos consideradas esenciales.
MÉTODOS: Estudio descriptivo retrospectivo con base en 27 acciones juzgadas en 2ª instancia en el estado de Rio de Janeiro, Sureste de Brasil, en 2006. Los procesos originales fueron solicitados al Archivo Central del Tribunal de Justicia del Estado de Rio de Janeiro, fotografiados y analizados de forma íntegra.
RESULTADOS: Todas las acciones incluyeron prescripción y atestados médicos. Las prescripciones estaban en desacuerdo con la legislación. No hubo pericia médica en ninguna de las acciones y en 7,4% constaban exámenes complementarios. A pesar de la escasa información médica contenida en los autos, todos los pedidos fueron deferidos.
CONCLUSIONES: El acogimiento de demandas judiciales carentes de subsidios clínicos y diagnósticos trae complicaciones de tipo gerencial y sanitaria al sistema de salud, ya que comprometen la asistencia farmacéutica regular y fomentan el uso irracional de medicamentos.
Descriptores: Servicios Farmacéuticos, legislación & jurisprudencia. Prescripciones de Medicamentos. Decisiones Judiciales. Legislación Sanitaria.
INTRODUÇÃO
A positivação do direito à saúde no ordenamento jurídico brasileiro, aliada à persistente iniqüidade no acesso aos bens e serviços de saúde, incluindo medicamentos,11 ensejou o recurso à tutela jurisdicional e resultou em aumento das demandas judiciais para efetivação desse direito. Esse fenômeno vem sendo chamado de judicialização da saúde.
No início dos anos 1990, essas demandas tinham por objeto medicamentos para HIV/aids; atualmente abrangem variadas indicações terapêuticas. Estudos revelam deficiências no acesso a medicamentos pelos usuários do Sistema Único de Saúde (SUS).11,ª a Organização Pan-Americana da Saúde. Ministério da Saúde. Avaliação da assistência farmacêutica no Brasil: estrutura, processo e resultados. Brasília; 2005. Revelam também dificuldades do sistema de justiça e do próprio procedimento judicial para assegurar o cumprimento do dever estatal em relação à saúde sem distorcer as diretrizes da Política Nacional de Medicamentos (PNM), em especial a seleção de medicamentos essenciais e a promoção do Uso Racional de Medicamentos (URM).1,3,6,7,13,14
É dever constitucional do Estado prover assistência farmacêutica integral aos seus cidadãos e é direito dos cidadãos provocar o Poder Judiciário para coagir a Administração Pública a cumprir com esse dever. Por outro lado, uma vez que é também dever constitucional do Estado proteger a saúde de seus cidadãos e que o acesso ao medicamento somente se concretiza, de fato, com a sua utilização, só faz sentido concretizá-lo por meio de mecanismos que assegurem seu uso racional.
A prescrição de medicamentos tem papel crucial na definição das características da demanda judicial. Os profissionais médicos são responsáveis por grande parte dos gastos em saúde por meio de sua decisão diagnóstica e/ou terapêutica. Além disso, a prescrição racional é uma das bases do uso racional e da adesão aos medicamentos, interferindo no resultado final do tratamento. A prescrição é influenciada pelas condições físicas do atendimento e características do profissional de saúde, como conhecimento, perícia, formação profissional, e sua atualização sobre eficácia e segurança de antigos e novos medicamentos. Segundo Teixeira,12 a indústria farmacêutica, nos Estados Unidos, influi na educação continuada de profissionais de saúde, bem como promove a prescrição off label, obtendo retorno de até três vezes o valor investido na educação continuada.
Elemento fundamental da promoção do URM,15 a promoção da prescrição racional consiste num dos maiores desafios para a gestão pública da assistência farmacêutica, especialmente a dos medicamentos novos e mais dispendiosos. Exemplo disso é que a maior parte da demanda judicial é deferida, tendo a prescrição médica como única prova processual.3,4,14
Dada a importância da judicialização da saúde e de seus desafios para as novas relações político-institucionais estabelecidas entre o Setor Saúde e o Judiciário, o presente estudo teve por objetivo caracterizar os principais elementos processuais, médico-científicos e sanitários que respaldaram as decisões das demandas judiciais consideradas essenciais.
MÉTODOS
Foi realizado estudo descritivo retrospectivo. A unidade de análise foi o processo judicial individual para fornecimento de medicamento, movido por cidadão, contra o ente estatal, no Estado do Rio de Janeiro. Foram incluídas as ações, arquivadas até 31/12/2007, iniciadas na 1ª instância e julgadas em definitivo na 2ª instância em 2006, em cujas ementas dos acórdãos constavam os descritores "medicamento" e "essencial". Tais critérios possibilitaram a análise da tramitação dos processos nas duas instâncias judiciais, isto é, desde o pedido inicial do autor até a decisão judicial definitiva na 2ª instância, pelo Tribunal de Justiça do Estado do Rio de Janeiro (TJ/RJ), além do acesso a todos os documentos originais que compunham os processos.
Das 3.456 ações relativas a "medicamentos" decididas em 2ª instância em 2006, disponíveis no sítio do TJ/RJ, 162 haviam iniciado na 1ª instância e apresentavam os termos "medicamento" e "essencial" em suas ementas. Os 27 processos com decisão definitiva proferida e arquivados foram solicitados ao Arquivo Central do TJ/RJ e fotografados.
Foram analisados os elementos processuais, médico-científicos e sanitários das demandas sob as principais variáveis: representação judicial do autor; réu; intervalo de tempo entre os atos processuais; exigências judiciais; resultado das decisões; existência de recursos; presença de prescrição médica; adequação da prescrição médica às boas práticas de prescrição; presença de documento médico; exames complementares e perícia médica; diagnóstico; medicamentos pleiteados; registro do medicamento na Agência Nacional de Vigilância Sanitária (Anvisa); presença do medicamento na Relação Nacional de Medicamentos Essenciais (Rename) e em outras listas oficiais.
A adequação da prescrição médica aos preceitos gerais e legais de boas práticas de prescrição baseou-se em 14 critérios mínimos de normas federais - Leis Federais n.º 5991/73b b Brasil. Lei nº 5.991, de 17 de dezembro de 1973. Dispõe sobre o controle sanitário do comércio de drogas, medicamentos, insumos farmacêuticos e correlatos, e dá outras providências. Diario Oficial Uniao. 19 dez 1973:13049. e n.° 9787/99;c Diario Oficial Uniao. c Brasil. Lei nº 9.787, de 10 de fevereiro de 1999. Altera a Lei n.º. 6.360, de 26 de setembro de 1976, que dispõe sobre a vigilância sanitária, estabelece o medicamento genérico, dispõe sobre a utilização de nomes genéricos em produtos farmacêuticos e dá outras providências. 11 fev 1999:1. Portaria n.º SVS/MS 344/98d Diario Oficial Uniao. d Ministério da Saúde. Portaria n°344, de 12 de maio de 1998. Aprova o Regulamento Técnico sobre substâncias e medicamentos sujeitos a controle especial. 19 maio.1998. e Resolução CFF n.º 357/2001.e e Conselho Federal de Farmácia. Resolução 357, de 20 de abril de 2001. Aprova o Regulamento Técnico das Boas Práticas de Farmácia. In: Conselho Federal de Farmácia: a organização jurídica da profissão farmacêutica. 3. ed. Brasília; 2001. p.342. Foi considerado como "de acordo" apenas quando o critério era respeitado, caso aplicável, para todos os medicamentos prescritos.
Os medicamentos foram classificados pela Anatomical Therapeutic Chemical Classification (ATC)2 e os diagnósticos pela Classificação Internacional de Doenças, décima revisão (CID-10).8 A presença do medicamento nas listas oficiais foi verificada por meio da consulta à Rename 2002 (vigente na ocasião) e aos Programas de Assistência Farmacêutica (PAF) do Ministério da Saúde, até 2006, identificados por Pontes Júnior9 (2007). O registro na Anvisa foi verificado no respectivo sítio da agência reguladora.
O projeto foi aprovado pelo Comitê de Ética em Pesquisa da Escola Nacional de Saúde Pública Sérgio Arouca em 24 de março de 2008 (protocolo 32/08).
RESULTADOS
Dos 27 autores, 19 eram representados pela Defensoria Pública do Estado do Rio de Janeiro. O Estado do Rio de Janeiro foi o que mais freqüentemente figurou como réu (sete ações); em 11 ações havia mais de um réu, com destaque para o Estado e o Município do Rio de Janeiro (seis ações).
Todas as liminares foram concedidas e confirmadas pela sentença na 1.ª instância, sendo as sentenças também confirmadas em 2ª instância. Em três ações o juiz fez alguma exigência antes da decisão liminar. Das 27 demandas, 16 foram acolhidas nos exatos termos do pedido; em 11 foi facultado o fornecimento de medicamentos similares e em cinco o fornecimento foi vinculado à apresentação de prescrição emitida por médico do SUS. O réu recorreu da decisão liminar em apenas uma ação e da sentença em 16 ações. Não houve recurso da decisão de 2ª instância para o Superior Tribunal de Justiça e/ou Supremo Tribunal Federal.
O intervalo de tempo mediano entre os atos processuais de interesse é apresentado na Tabela 1.
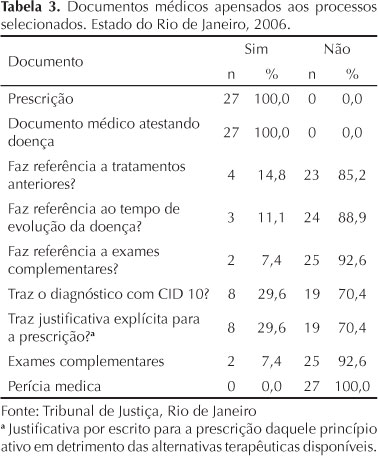
Em todos os processos havia prescrição apensada e em três deles havia duas prescrições, num total de 30 analisadas. Metade delas era oriunda do SUS (seis provenientes de hospitais universitários e nove de outras unidades do SUS), 13 de médicos particulares e duas de associações mutualistas de saúde.
Nenhuma prescrição mostrou-se adequada aos preceitos gerais e legais de boas práticas de prescrição, sendo encontrada uma mediana de cinco critérios em desconformidade por prescrição (Tabela 2).
Em sete casos de prescrições contendo substâncias sujeitas ao controle especial não havia notificação de receita apensada aos processos. Nos quatro casos em que todas as receitas especiais estavam apensadas, nenhuma delas estava de acordo com as exigências da Portariad Diario Oficial Uniao. d Ministério da Saúde. Portaria n°344, de 12 de maio de 1998. Aprova o Regulamento Técnico sobre substâncias e medicamentos sujeitos a controle especial. 19 maio.1998. que normatiza a prescrição de medicamentos controlados no Brasil.
Havia documento médico atestando a doença em todas as ações. Em cinco delas, "atestado médico" e prescrição figuravam num mesmo documento. Não houve perícia médica em nenhuma das 27 ações e em apenas duas delas havia exames complementares apensados. A Tabela 3 apresenta a relação de documentos médicos presentes e ausentes nas ações.
Cinco das oito justificativas explícitas para a prescrição referiam resposta terapêutica insatisfatória com o medicamento escolhido anteriormente, embora em apenas quatro pedidos o tratamento anterior tenha sido mencionado. Em um processo havia justificativa apenas para a prescrição de um medicamento que, no entanto, não foi solicitado na ação.
Foram mencionados 27 diagnósticos principais e 24 secundários. Considerando todos os diagnósticos, as doenças do aparelho circulatório foram as mais freqüentes (33,3%), especialmente as doenças hipertensivas (15,7%), seguidas por doenças do sistema osteomuscular e do tecido conjuntivo (13,7%), e pelos transtornos mentais e comportamentais (11,8%).
A mediana do número de medicamentos solicitados por ação foi de quatro, variando de um a 12 medicamentos. Apenas em duas ações houve solicitação de outros insumos: fitas para aferição de glicemia; soro fisiológico e seringas. No total, houve 116 medicamentos solicitados, dos quais um estava ilegível e não pôde ser identificado. Dos 115 analisados, 104 continham um único princípio ativo e 11 eram associações em dose fixa. Foi possível classificar 93 princípios ativos distintos.
Cerca de um terço (29,6%) dos medicamentos foram prescritos pelo nome genérico. A porcentagem de medicamentos prescritos pelo nome genérico foi ligeiramente maior entre médicos vinculados ao SUS (32,3%) do que não-SUS (26,4%).
Os fármacos mais solicitados, segundo o 5º nível da ATC, foram: furosemida (5,4%); digoxina (4,5%); clonazepam (4,5%); ácido acetilsalicílico (3,6%); enalapril (3,6%) e bromazepam (3,6%) (Tabela 4).
Apenas para um caso (0,9%), o da solicitação de foscarnet, não foi encontrado registro válido do princípio ativo na Anvisa.
Vinte e uma (77,8%) ações requereram todos os medicamentos prescritos. Mais da metade (57,4%) dos medicamentos solicitados pertencia a alguma lista oficial de fornecimento gratuito (45,2% pertenciam à Rename 2002 e 32,2% pertenciam às outras listas, com destaque para a lista do Programa de Medicamentos Excepcionais com 13,9%). Entretanto, em 22 (81,5%) ações havia solicitação de pelo menos um medicamento não incluído nos elencos oficiais.
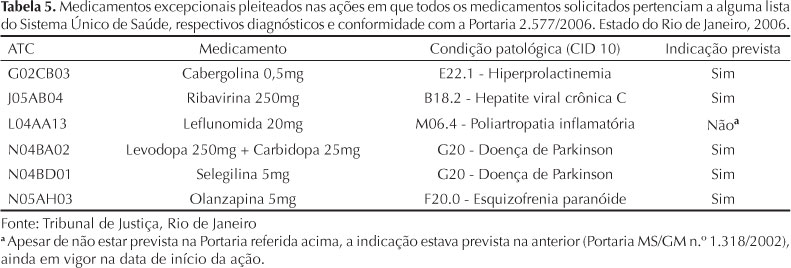
Nas cinco ações em que todos os medicamentos pleiteados pertenciam a alguma lista oficial, havia no mínimo um medicamento considerado de dispensação excepcional. Do total de sete medicamentos solicitados nessas ações, seis pertenciam à lista de medicamentos de dispensação excepcional e estavam previstos, no SUS, para o tratamento da respectiva condição patológica do autor, classificada pela CID-10. Em um desses casos, apesar de a indicação não estar prevista na atual Portaria que aprova o Componente de Medicamentos de Dispensação Excepcional (Portaria MS/GM n.º 2.577/2006),f f Ministério da Saúde. Portaria n.º 2.577 de, 27 de outubro de 2006. Aprova o componente de medicamentos de dispensação excepcional. Diario Oficial Uniao. 10 nov 2006:1. estava prevista na Portaria anterior (Portaria MS/GM n.º 1.318/2002),g g Ministério da Saúde. Portaria n.º 1.318 de 23 de julho de 2002. Define, para o grupo 36, medicamentos, da tabela descritiva do sistema de informações ambulatoriais do Sistema Único de Saúde - SIA/SUS, a forma e a redação estabelecidas no anexo desta portaria. Diario Oficial Uniao. 24 jul 2002:1. ainda em vigor na data de início da ação judicial (Tabela 5).
Dos 49 medicamentos não pertencentes às listas oficiais, 46 puderam ser classificados até o 5.º nível da ATC. Os mais freqüentes foram: bromazepam (8,7%); propatilnitrato (6,5%); e capecitabina, carvedilol, clonidina, todos apresentando freqüência de 4,3%. Nenhum deles foi incorporado à Rename 2006; no entanto, carvedilol (comprimidos de 6,25mg), dipropionato de beclometasona (aerossol 200mcg/dose) e enalapril (comprimidos 10mg) foram incluídos na Rename 2008.
DISCUSSÃO
O reduzido número de casos analisados constitui, ao mesmo tempo, a principal limitação e o ponto forte da pesquisa. Se por um lado diminuiu o potencial de generalização dos resultados, por outro possibilitou, pela primeira vez, a análise dos processos em sua íntegra.
A despeito do pequeno número de exigências judiciais iniciais, todos os pedidos liminares de antecipação de tutela foram deferidos e houve pouca disposição dos réus para recorrer das liminares. O tempo mediano entre a decisão liminar e o julgamento do mérito da ação (151 dias) indica que, em geral, o uso do medicamento fornecido por meio das ordens judiciais prolonga-se por meses, sem que a adequação do medicamento à necessidade de saúde do paciente demandante seja reavaliada, como já apontavam Messeder et al7 (2005). A ausência de qualquer indício de realização desse tipo de procedimento nos autos do processo reforça essa hipótese.
O acolhimento quase absoluto dos pedidos também é relatado por Marques & Dallari6 (2007), Borges1 (2007) e Romeroh h Romero LC. Judicialização das políticas de assistência farmacêutica: o caso do distrito federal. Brasília: Consultoria Legislativa do Senado Federal; 2008. (Textos para discussão, 41). (2008), indicando certa homogeneização, ou mesmo automação, no julgamento dessas ações. Esse aspecto, por outro lado, pode também indicar uma acomodação do ente estatal em não exercer seu papel de proteção da saúde, mediante defesas técnicas consistentes que possam demonstrar a inadequação de determinadas prescrições, a existência de alternativas terapêuticas disponíveis no SUS ou, mesmo, os possíveis malefícios que o fornecimento de determinado medicamento pode causar ao usuário.
O predomínio de prescrições originadas no SUS, observado aqui, também foi encontrado em outros trabalhos.3,7,14,h h Romero LC. Judicialização das políticas de assistência farmacêutica: o caso do distrito federal. Brasília: Consultoria Legislativa do Senado Federal; 2008. (Textos para discussão, 41). e sugere falha das políticas públicas de medicamentos, seja pela não-garantia do acesso, pelo atraso na incorporação de novos medicamentos às listas oficiais, seja pela não-adesão dos profissionais da rede pública às referidas listas.7,14
Preocupa o fato de que nenhuma das prescrições analisadas tenha respeitado todos os preceitos de boas práticas de prescrição selecionados e que tenham sido deferidas pelo Poder Judiciário sem exigência de adequação às leis sanitárias vigentes.
Erros em prescrições podem levar a uma série de problemas relacionados ao uso do medicamento, como, por exemplo, troca do medicamento e/ou substituição das formas farmacêuticas na dispensação, administração do medicamento pela via errada, na dose errada, uso do medicamento além ou aquém do tempo necessário ou não-adesão ao tratamento.5,10 Considerando que o foco das demandas judiciais de medicamentos, na perspectiva jurídica, é a saúde do paciente litigante, seria importante que a apreciação do Judiciário exigisse ao menos o cumprimento dos requisitos mínimos para uma prescrição segura e adequada, dos quais grande parte trata-se de exigências legais.
Outro fato que se destaca é o baixo percentual de medicamentos prescritos pelo nome genérico no âmbito SUS, uma vez que a Lei Federal n.º 9.787/1999c Diario Oficial Uniao. c Brasil. Lei nº 9.787, de 10 de fevereiro de 1999. Altera a Lei n.º. 6.360, de 26 de setembro de 1976, que dispõe sobre a vigilância sanitária, estabelece o medicamento genérico, dispõe sobre a utilização de nomes genéricos em produtos farmacêuticos e dá outras providências. 11 fev 1999:1. estabelece a obrigatoriedade da adoção da denominação genérica para as prescrições médicas e odontológicas de medicamentos.
A cuidadosa e responsável consideração dos casos envolvendo medicamentos, ao bem da saúde do paciente litigante, não pode prescindir de subsídios clínicos e diagnósticos. Apesar de haver atestado médico em quase todas as ações analisadas, o documento limita-se, em geral, a designar uma determinada doença, ou doenças, sem, no entanto, fornecer mais informações. Assim é que a maioria dos processos não traz justificativa explícita para a prescrição, nem informações sobre tratamento anterior, tempo de evolução da doença, exames complementares ou diagnósticos de acordo com a CID-10.
O que está em discussão em muitas das demandas judiciais é a vantagem, ou mesmo a necessidade, do uso de determinado medicamento não incorporado pelo SUS em relação às alternativas terapêuticas já incorporadas para o tratamento de certa doença.7,14 Nesses casos, não parece razoável prescindir de justificativa explícita para a prescrição daquele medicamento em detrimento desses. No mais, conquanto não haja necessidade de que o juiz consulte órgão técnico ou perito médico para o deferimento da liminar, uma vez que a demora poderia comprometer ainda mais a saúde do demandante,1 é de se estranhar a ausência absoluta desses procedimentos ao longo de todo o processo.
Queixa freqüente entre os gestores da saúde, a demanda por medicamentos sem registro na Anvisa não tem, até o momento, recebido muita atenção dos estudos sobre a judicialização da saúde publicados no País. Os poucos estudos que avaliaram esse aspecto apresentam resultados que variam entre cerca de 1% e 10% de medicamentos não registrados, solicitados judicialmente.3,6 O registro do medicamento na Anvisa é de suma importância, quando são avaliados os riscos e benefícios do fármaco, levando em consideração a doença a que se destine tratar. A Lei Federal n.º 6.360/1976i i Brasil. Lei nº. 6.360, de 23 de setembro de 1976. Dispõe a vigilância sanitária a que ficam sujeitos os medicamentos, as drogas, os insumos farmacêuticos e correlatos, cosméticos, saneantes e outros produtos e dá outras providências. Diário Oficial Uniao 1976;24 set.1976:12647. proíbe expressamente a industrialização, a venda e, até mesmo, a entrega ao consumo de medicamentos sem registro no Ministério da Saúde.
O recorte do estudo não permitiu aprofundar a análise dos diagnósticos entre os autores das ações. As doenças crônicas, como as do sistema nervoso e do sistema cardiovascular, figuraram entre as mais freqüentes, assim como no estudo de Messeder et al7 (2005), também no RJ.
A alta freqüência de solicitações de medicamentos das listas do SUS também foi reportada por Messeder et al7 (2005) e por Borges1 (2007), no Estado do Rio de Janeiro. Contudo, o presente estudo identificou que em 80% das ações pelo menos um medicamento não pertencia às listas oficiais, o que sugere um fator de relativização dos resultados concernentes aos elevados percentuais de medicamentos das listas do SUS demandados judicialmente, encontrados nos estudos sobre judicialização.1,3,7,14,h h Romero LC. Judicialização das políticas de assistência farmacêutica: o caso do distrito federal. Brasília: Consultoria Legislativa do Senado Federal; 2008. (Textos para discussão, 41). Como, em geral, as ações solicitam todos os medicamentos prescritos, é assim razoável supor que os medicamentos não pertencentes às listas são os principais motivadores das demandas judiciais.
Por outro lado, os dados sugerem também um papel de destaque dos medicamentos de dispensação excepcional na gênese das demandas judiciais. Tal fato pode indicar tanto falhas persistentes na gestão desse componente da assistência farmacêutica como tentativas bem-sucedidas de driblar os critérios oficialmente estabelecidos para a sua adequada dispensação no SUS. A simples especificação do diagnóstico, desprovida de exames médicos comprobatórios, conquanto seja reconhecidamente insuficiente para o fornecimento seguro e responsável de medicamentos de dispensação excepcional no SUS, tem sido o bastante para o fornecimento via demanda judicial.
Isso vem tornando essa via mais rápida, menos "burocrática" e, portanto, mais atrativa, a despeito das implicações financeiras e gerenciais para o SUS e sanitárias para o indivíduo. O acolhimento dessas demandas, apesar da escassez de subsídios clínicos e diagnósticos nos autos dos processos analisados, reforça essa hipótese.
O acesso racional a medicamentos é o propósito básico da assistência farmacêutica e, nesse sentido, todas as ações a ela relacionadas, sejam de iniciativa do Legislativo, do Executivo, sejam do Judiciário, devem inequivocamente contribuir com esse propósito.
As políticas de saúde, inclusive as farmacêuticas - em especial a seleção de medicamentos essenciais e seus produtos: listas de medicamento; formulários e protocolos terapêuticos -, são exemplos de iniciativas bem-sucedidas dos gestores do sistema de saúde com vistas à promoção do URM no Brasil. Infelizmente, nem sempre essas políticas atendem às necessidades do paciente, seja por negligência na sua elaboração, como é o caso da indefinição de critérios claros para o atendimento das peculiaridades individuais (procedimentos e/ou insumos não previstos nas políticas), seja por negligência na sua condução (demora na atualização das listas de medicamentos e seus protocolos).
A intervenção judicial nesses casos pode cooperar para a promoção do URM, desde que clínica e farmacologicamente subsidiados. Por outro lado, o acolhimento de demandas judiciais desprovidas desses subsídios - ou baseado apenas na prescrição médica - traz embaraços de ordem gerencial e sanitária ao sistema de saúde. Além de comprometer a formulação e implementação das políticas de assistência farmacêutica, acaba por fomentar o uso irracional de medicamentos e, muitas vezes, prejudica ainda mais a já combalida saúde do paciente demandante, cujo dever constitucional do Estado é proteger.
AGRADECIMENTOS
Ao Arquivo Central do Tribunal de Justiça do Estado Rio de Janeiro pela cessão dos dados de seus arquivos.
Recebido: 3/8/2010
Aprovado: 19/1/2011
Pesquisa financiada pela Fundação Carlos Chagas Filho de Amparo à Pesquisa (Nº Processo: E-26/170.652/20).
Artigo baseado na dissertação de mestrado de Sant'Ana JMB apresentada à Escola Nacional de Saúde Pública Sergio Arouca, Fiocruz, em 2009.
Os autores declaram não haver conflitos de interesses.
- 1. Borges DCL, Ugá MAD. Conflitos e impasses da judicialização na obtenção de medicamentos: as decisões de 1a instância nas ações individuais contra o Estado do Rio de Janeiro, Brasil, em 2005. Cad Saude Publica. 2010;26(1):59-69. DOI:10.1590/S0102-3
- 2. Capellà D. Descritive tools and analysis. In: Dukes MNG, organizer. Drug Utilization Studies: Methods and Uses. Copenhagen: World Health Organization Regional Publications; 1993. p.55-78. (European Series, 45).
- 3. Chieffi NA, Barata RB. Judicialização da política pública de assistência farmacêutica e eqüidade. Cad Saude Publica. 2009;25(8):1839-49. DOI:10.1590/S0102-311X2009000800020
- 4. Figueiredo TA, Pepe VLE, Osorio-de-Castro CGS. Um enfoque sanitário sobre a demanda judicial de medicamentos. Physis (Rio J). 2010;20(1):101-18. DOI:10.1590/S0103-73312010000100007
- 5. Guzatto P, Bueno D. Análise de prescrições medicamentosas dispensadas na farmácia de uma Unidade Básica de Saúde de Porto Alegre - RS. Rev HCPA. 2007;27(3):20-6.
- 6. Marques SB, Dallari SG. Garantia do direito social à assistência farmacêutica no Estado de São Paulo. Rev Saude Publica. 2007;41(1):101-7. DOI:10.1590/S0034-89102007000100014
- 7. Messeder AM, Osorio-de-Castro CGS, Luiza VL. Mandados judiciais como ferramenta para garantia do acesso a medicamentos no setor público: a experiência do Estado do Rio de Janeiro, Brasil. Cad Saude Publica. 2005;21(2):525-34. DOI:10.1590/S0102-311X2005000200019
-
8Organização Mundial da Saúde. CID-10 Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde. 10.ed. São Paulo: Edusp; 1997.
- 9. Pontes Jr DM, Pepe VLE, Osorio-de-Castro CGS, Massena EP, Portela MC, Miranda MC, et al. A definição de medicamentos prioritários para o monitoramento da qualidade laboratorial no Brasil: articulação entre a vigilância sanitária e a Política Nacional de Medicamentos. Cad Saude Publica. 2008;24(9):2081-90. DOI:10.1590/S0102-311X2008000900014.
- 10. Schachter M. The epidemiology of medication errors: how many, how serious? Br J Clin Pharmacol. 2009;67(6):621-3. DOI:10.1111/j.1365-2125.2009.03418.x
- 11. Szwarcwald CL, Viacava F, Vasconcellos MTL, Leal MC, Azevedo LO, Queiroz RSB, et al. Pesquisa Mundial de Saúde 2003: o Brasil em números. Radis. 2004;(23):14-33.
- 12. Teixeira M. A bilionária indústria da educação médica continuada nos EUA: mais uma forma de interferência das empresas na relação médico-paciente. Rev Latinoam Psicopatol Fundam. 2009;12(4):731-42.
- 13. Vieira FS. Ações judiciais e direito à saúde: reflexão sobre a observância aos princípios do SUS. Rev Saude Publica. 2008;42(2):365-9. DOI:10.1590/S0034-89102008005000010
- 14. Vieira FS, Zucchi P. Distorções causadas pelas ações judiciais à política de medicamentos no Brasil. Rev Saude Publica. 2007;41(2):214-22. DOI:10.1590/S0034-89102007000200007
- 15. World Health Organization. The Rational Use of Drugs - Report of the Conference of Experts, Nairobi 25-29 November 1985. Geneva; 1987.
- 16. Yamanaka TI, Pereira DG, Pedreira MLG, Peterlini MAS. Redesenho de atividades da enfermagem para redução de erros de medicação em pediatria. Rev Bras Enferm. 2007;60(2):190-6. 11X2010000100007
Diario Oficial Uniao.
Diario Oficial Uniao.
Datas de Publicação
-
Publicação nesta coleção
01 Jul 2011 -
Data do Fascículo
Ago 2011
Histórico
-
Aceito
19 Jan 2011 -
Recebido
03 Ago 2010