Resumos
OBJETIVO: Analisar condições técnicas do reprocessamento de produtos médicos em hospitais. MÉTODOS: Estudo descritivo de casos múltiplos em centros de material e esterilização de quatro hospitais da cidade de Salvador, BA, em 2010. Foram realizadas entrevista semiestruturada e observação direta, com base em modelo regulatório de reprocessamento de produtos médicos elaborado com a técnica de Conferência de Consenso como padrão de referência. As categorias analíticas utilizadas neste estudo foram: gerenciamento da prática de reprocessamento de produtos médicos, protocolos de reprocessamento, monitoramento do processo de esterilização e rastreabilidade de produtos. Essas categorias foram pontuadas segundo sua conformidade com o modelo regulatório de reprocessamento utilizado. RESULTADOS: Observou-se inadequação generalizada das condições técnicas de reprocessamento de produtos médicos, das condições estruturais dos centros de material e esterilização estudados e das condições dos processos de trabalho, além de dificuldades organizacionais e gerenciais que interferiram nas práticas analisadas. CONCLUSÕES: As práticas de reprocessamento dos produtos médicos nos hospitais analisados configuram risco para os pacientes usuários. É necessária a adoção de um sistema de gerenciamento de risco nesses hospitais e de maior controle sanitário pelo Estado, a fim de proteger a saúde dos pacientes.
Qualidade de Produtos para o Consumidor; Reutilização de Equipamento; Segurança; Esterilização; Segurança de Equipamentos; Vigilância Sanitária; Gerenciamento de Segurança
OBJETIVO: Analizar condiciones técnicas de reprocesamiento de productos médicos en hospitales. MÉTODOS: Estudio descriptivo de casos múltiples en centros de material y esterilización de cuatro hospitales de la ciudad de Salvador, BA, en 2010. Se realizaron entrevista semi-estructurada y observación directa, con base en modelo regulatorio de reprocesamiento de productos médicos elaborado con la técnica de Conferencia de Consenso como patrón de referencia. Las categorías analíticas utilizadas en este estudio fueron: gerenciamiento de la práctica de reprocesamiento de productos médicos, protocolos de reprocesamiento, monitoreo del proceso de esterilización y rastreo de productos. Esas categorías fueron calificadas según su conformidad con el modelo regulatorio de reprocesamiento utilizado. RESULTADOS: Se observó inadecuación generalizada de las condiciones técnicas de reprocesamiento de productos médicos de las condiciones estructurales de los centros de material y esterilización estudiados y de las condiciones de los procesos de trabajo, así como, dificultades organizacionales y gerenciales que interfirieron en las prácticas analizadas. CONCLUSIONES: Las prácticas de reprocesamiento de los productos médicos en los hospitales analizados configuran riesgo para los pacientes usuarios. Es necesaria la adopción de un sistema de gerenciamiento de riesgo en tales hospitales y de mayor control sanitario por el Estado, a fin de proteger la salud de los pacientes.
Seguridad de Productos para el Consumidor; Equipo Reutilizado; Seguridad; Esterilización; Seguridad de Equipos; Vigilancia Sanitaria; Administración de la Seguridad
OBJECTIVE: To analyze the technical conditions for medical product reprocessing in hospitals. METHODS: This was a descriptive study on multiple cases in materials and sterilization centers at four hospitals in the city of Salvador, Southeastern Brazil, in 2010. Semi-structured interviews were conducted and direct observations were made, based on a regulatory model for medical product reprocessing that was drawn up with the technique of consensus verification as the reference standard. The analytical categories used in this study were: management of the practice of medical product reprocessing; reprocessing protocols; monitoring of the sterilization process; and capacity for product tracking. These categories were scored according to their degree of conformity with the regulatory model for reprocessing used. RESULTS: General inadequacy of the technical conditions for medical product reprocessing was observed, with regard to the structural conditions of the materials and sterilization centers studied and the work process conditions, along with organizational and managerial difficulties that interfered with the practices analyzed. CONCLUSIONS: The practices of medical product reprocessing in the hospitals analyzed constitute a risk for the patient users. Risk management systems need to be introduced in these hospitals, with greater sanitary control by the state, in order to protect patients' health.
Consumer Product Safety; Equipment Reuse; Safety; Sterilization; Equipment Safety; Health Surveillance; Safety Management
ARTIGOS ORIGINAIS
Risco e segurança sanitária: análise do reprocessamento de produtos médicos em hospitais de Salvador, BA
Riesgo y seguridad sanitaria: análisis del reprocesamiento de productos médicos en hospitales de Salvador, Nordeste de Brasil
Eliana Auxiliadora Magalhães Costa; Ediná Alves Costa
Instituto de Saúde Coletiva. Universidade Federal da Bahia. Salvador, BA, Brasil
Correspondência | Correspondence Correspondência | Correspondence: Eliana Auxiliadora Magalhães Costa Rua Piauí, 269, apto. 902 - Pituba 41830-270 Salvador, BA, Brasil E-mail: costaeliana2003@hotmail.com
RESUMO
OBJETIVO: Analisar condições técnicas do reprocessamento de produtos médicos em hospitais.
MÉTODOS: Estudo descritivo de casos múltiplos em centros de material e esterilização de quatro hospitais da cidade de Salvador, BA, em 2010. Foram realizadas entrevista semiestruturada e observação direta, com base em modelo regulatório de reprocessamento de produtos médicos elaborado com a técnica de Conferência de Consenso como padrão de referência. As categorias analíticas utilizadas neste estudo foram: gerenciamento da prática de reprocessamento de produtos médicos, protocolos de reprocessamento, monitoramento do processo de esterilização e rastreabilidade de produtos. Essas categorias foram pontuadas segundo sua conformidade com o modelo regulatório de reprocessamento utilizado.
RESULTADOS: Observou-se inadequação generalizada das condições técnicas de reprocessamento de produtos médicos, das condições estruturais dos centros de material e esterilização estudados e das condições dos processos de trabalho, além de dificuldades organizacionais e gerenciais que interferiram nas práticas analisadas.
CONCLUSÕES: As práticas de reprocessamento dos produtos médicos nos hospitais analisados configuram risco para os pacientes usuários. É necessária a adoção de um sistema de gerenciamento de risco nesses hospitais e de maior controle sanitário pelo Estado, a fim de proteger a saúde dos pacientes.
Descritores: Qualidade de Produtos para o Consumidor. Reutilização de Equipamento. Segurança. Esterilização. Segurança de Equipamentos. Vigilância Sanitária. Gerenciamento de Segurança.
RESUMEN
OBJETIVO: Analizar condiciones técnicas de reprocesamiento de productos médicos en hospitales.
MÉTODOS: Estudio descriptivo de casos múltiples en centros de material y esterilización de cuatro hospitales de la ciudad de Salvador, BA, en 2010. Se realizaron entrevista semi-estructurada y observación directa, con base en modelo regulatorio de reprocesamiento de productos médicos elaborado con la técnica de Conferencia de Consenso como patrón de referencia. Las categorías analíticas utilizadas en este estudio fueron: gerenciamiento de la práctica de reprocesamiento de productos médicos, protocolos de reprocesamiento, monitoreo del proceso de esterilización y rastreo de productos. Esas categorías fueron calificadas según su conformidad con el modelo regulatorio de reprocesamiento utilizado.
RESULTADOS: Se observó inadecuación generalizada de las condiciones técnicas de reprocesamiento de productos médicos de las condiciones estructurales de los centros de material y esterilización estudiados y de las condiciones de los procesos de trabajo, así como, dificultades organizacionales y gerenciales que interfirieron en las prácticas analizadas.
CONCLUSIONES: Las prácticas de reprocesamiento de los productos médicos en los hospitales analizados configuran riesgo para los pacientes usuarios. Es necesaria la adopción de un sistema de gerenciamiento de riesgo en tales hospitales y de mayor control sanitario por el Estado, a fin de proteger la salud de los pacientes.
Descriptores: Seguridad de Productos para el Consumidor. Equipo Reutilizado. Seguridad. Esterilización. Seguridad de Equipos. Vigilancia Sanitaria. Administración de la Seguridad.
INTRODUÇÃO
Os produtos médicos utilizados nos procedimentos assistenciais de saúde tornam-se progressivamente mais complexos. São definidos pelo fabricante como artigos reusáveis ou de uso único. Os reusáveis são considerados bens duráveis e sua reutilização requer a ação do reprocessamento, que inclui limpeza, teste de avaliação de desempenho, desinfecção ou esterilização e controle de qualidade em todas as suas etapas, de modo a garantir a segurança em sua utilização.1-3 Os produtos de uso único são designados para serem usados uma vez, mas a prática do reuso desses materiais é uma realidade mundial. Essa tendência suscita considerações acerca dos riscos envolvidos e consequente insegurança do paciente, além de questões relativas a aspectos técnicos, regulatórios, jurídicos, econômicos, éticos e ambientais dessa prática.4,6
Dentre os eventos associados ao reprocessamento e reuso de produtos médicos estão infecção, presença de endotoxinas, biofilmes, perda da integridade do material e outros.4,7-13
Os problemas para a saúde coletiva relacionados ao reprocessamento de produtos médicos são numerosos. Esta investigação buscou responder à questão: Como se dá o reprocessamento de produtos médicos em hospitais de Salvador? Pressupõe-se que o reprocessamento de produtos médicos em serviços de saúde está condicionado a um sistema de estrutura orgânico-funcional que atenda aos requisitos de segurança intrínsecos a essa atividade e que, na ausência deste sistema, pode potencializar riscos para a saúde da população usuária.
O objetivo deste estudo foi analisar as condições técnicas de reprocessamento de produtos médicos.
MÉTODOS
Estudo descritivo de casos múltiplos14 holístico de avaliação de qualidade técnica. A unidade de análise foi a condição técnica de reprocessamento de produtos médicos em hospitais de Salvador, chamados nesta metodologia de casos, em 2010.
Participaram do estudo dois hospitais da Rede Sentinela da Agência Nacional de Vigilância Sanitária (Anvisa), sorteados aleatoriamente entre os quatro localizados em Salvador (casos 1 e 2), e dois hospitais não sentinela de mesmo porte e características, identificados pelos dados do Cadastro Nacional de Estabelecimentos de Saúde (CNES) e da Secretaria de Saúde do Estado da Bahia (Sesab) (casos 3 e 4), também escolhidos aleatoriamente. Formaram-se quatro casos múltiplos. Hospitais sentinela foram avaliados por integrarem um programa de cooperação com a Anvisa voltado ao gerenciamento de riscos e vigilância de eventos adversos relacionada a produtos, fármacos e processos assistenciais.
Os hospitais foram contatados por telefone, com agendamento de visita para coleta de dados. Encaminhou-se uma carta à diretoria de cada hospital, com informações sobre os objetivos da pesquisa e termo de consentimento para a coleta de dados. Os dados foram obtidos pela pesquisadora por meio da aplicação de um formulário para entrevista semiestruturada com o informante-chave (responsável técnico pelo reprocessamento dos produtos médicos) e da observação direta in loco a partir de um roteiro de observação.
Elaborou-se um modelo regulatório alternativo, utilizado como padrão de referência em virtude de questionamentos acerca da legislação brasileira vigente sobre reprocessamento de produtos médicos. Esse modelo foi elaborado pela Técnica de Conferência de Consenso com dois diagramas. O primeiro classificou os produtos para efeito de reprocessamento em produto reprocessável e não reprocessável, segundo critérios relacionados à possibilidade de limpeza e manutenção da integridade e funcionalidade dos artigos, independentemente de ser considerado reusável ou de uso único. O segundo diagrama apresentou um modelo lógico das etapas sequenciais do reprocessamento de produtos médicos, adequando os métodos de descontaminação aos conceitos de análise, avaliação e controle de risco e compondo o gerenciamento de risco.
O modelo regulatório utilizado permitiu excluir a lista de produtos com reuso e reprocessamento proibidos no País, como a que existe no marco regulatório vigente.ª a Agência Nacional de Vigilância Sanitária. Resolução RE nº 2.605, de 11 de agosto de 2006. Contém a lista de produtos que não podem ser reprocessados. Diário Oficial da União 2006; 14 ago. Os critérios utilizados na seleção dos produtos dessa lista não estão claros e a lista é de difícil atualização, devido ao lançamento contínuo de produtos no mercado.
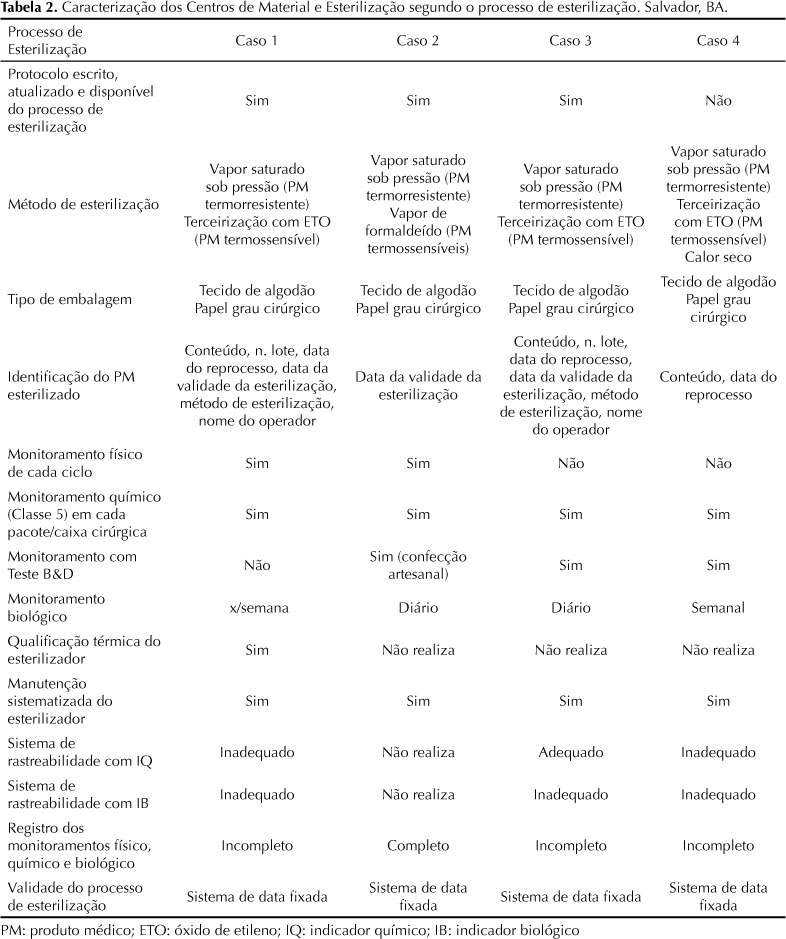
As categorias analíticas construídas foram: 1) gerenciamento da prática de reprocessamento de produtos médicos; 2) protocolos de reprocessamento com definições dos processos de limpeza, desinfecção e/ou esterilização dos produtos; 3) monitoramento do processo de esterilização; e 4) rastreabilidade de produtos médicos.
Cada categoria foi construída com as variáveis independentes que influenciavam as condições técnicas do reprocessamento dos produtos médicos. Recebeu pontuação um (1) conformidade da resposta com o modelo regulatório proposto e zero (0) inadequação da resposta, totalizando 87 pontos, alocados conforme as categorias descritas. Quanto maior o número de questões da categoria analítica, maior sua pontuação, não significando maior importância/valor de uma categoria sobre a outra. Após a pontuação de cada categoria, foram calculados os percentuais de respostas em conformidade com o modelo regulatório.
Cada unidade hospitalar recebeu um escore conforme o seu respectivo grau de condição técnica de reprocessamento de produtos médicos e foi classificada em três níveis: 0 - condição técnica inadequada (0% a 40%); 1 - condição técnica necessitando adequação (41% a 80%); 2 - condição técnica adequada (81% a 100%). A aferição das condições técnicas do reprocessamento de produtos médicos foi feita a partir do escore final obtido: escore final = pontuação obtida/pontuação máxima (87) × 100. O escore alcançado mostrou a conformidade das condições técnicas com as normativas propostas no modelo regulatório para cada hospital.
O estudo foi submetido ao Comitê de Ética em Pesquisa de cada hospital estudado e foi aprovado em todos eles.
RESULTADOS
Dois hospitais foram considerados de porte 4 (casos 1 e 4) e dois de porte 3 (casos 2 e 3). Os hospitais da Rede Sentinela realizam atendimento assistencial geral e os dois estaduais prestam assistência hospitalar especializada; um destes era hospital de referência em cardiologia cirúrgico-clínica e nefrologia (caso 3) e o outro era hospital de referência em emergência traumatológica (caso 4). Os hospitais possuíam seus próprios centros de material e esterilização (CME) e realizavam internamente o reprocessamento de seus produtos médicos.
Os CME realizavam as atividades de limpeza, desinfecção e esterilização de produtos médicos de forma descentralizada (casos 1, 3 e 4), i.e., outras unidades do hospital também realizam alguns desses processos. Os CME de todos os casos eram coordenados por enfermeiro. Esse responsável técnico conhecia apenas parcialmente a legislação vigente sobre reprocessamento de produtos médicos no caso 2; no caso 4, esse profissional desconhecia a legislação. Nesses hospitais, a coordenadora do serviço desconhecia se os produtos médicos utilizados na instituição possuíam registro na Anvisa.
Houve relato de inspeção sanitária realizada pela Vigilância Sanitária da Bahia (VISA-BA) nos casos 1 e 3. Os hospitais receberam relatórios de não conformidades acerca do reprocessamento de produtos médicos. Em dois hospitais (casos 2 e 4), os respectivos responsáveis técnicos desconheciam se a VISA-BA inspecionava os CME em que trabalhavam, não constatando registro de ação fiscalizatória sanitária nessas organizações.
Nenhum caso possuía comitê/grupo responsável pelo gerenciamento dos produtos médicos na instituição.
Dos quatro casos, dois apresentaram todas as áreas recomendadas para as atividades realizadas por um CME (casos 1 e 3). Em todos, observou-se a presença de barreira física entre as áreas consideradas contaminadas e limpas. As condições de piso, parede, portas e teto eram inadequadas em três casos (2, 3 e 4). A temperatura e umidade relativa do ar eram, igualmente, inadequadas nas áreas de todos os CME estudados. A iluminação era adequada em todos os casos. O sistema de ventilação do ar era centralizado em dois (2 e 3), inadequado no 3 e ausente nos casos 1 e 4. O fluxo operacional das atividades era unidirecional, não havendo cruzamento entre atividades limpas e sujas em dois casos (1 e 3), mas era inadequado nos casos 2 e 4. Existiam pias para a lavagem das mãos durante as atividades laborais dos profissionais do CME em dois casos (2 e 3), não existindo nos outros dois (1 e 4).
Em todos os CME dos hospitais estudados, as torneiras para limpeza dos produtos contaminados dispunham de água fria; nenhuma contava com água quente, necessária quando do uso de detergentes enzimáticos. O 3 possuía torneira com dispositivo para lavagem de produtos canulados. Os artefatos para realização da limpeza manual (buchas, escovas, serpilhos) estavam em boas condições de função em apenas dois casos (1 e 3), encontrando-se inadequados nos casos 2 e 4, o que dificultava a fricção mecânica e remoção de sujidades externas dos produtos contaminados. As bancadas de trabalho apresentavam dimensões compatíveis com as atividades a serem realizadas em três (1, 2 e 3) dos quatro casos (Tabela 1).
Nenhum CME dispunha de um sistema de água potável com filtro bacteriano (filtros < 5 µm) para retenção de conteúdos microbianos da água usada na limpeza dos artigos. Não existiam lentes intensificadoras de imagem que permitissem a visualização minuciosa dos artigos após limpeza, para examinar a presença de eventuais resíduos e avaliação visual da integridade física dos produtos limpos. Existia fonte de ar comprimido medicinal para a secagem de produtos com estruturas internas (Tabela 2).
Os recipientes plásticos que portavam soluções detergentes e desinfetantes estavam identificados com o tipo de solução e possuíam tampa em um caso (3). Nos demais, esses recipientes eram utilizados destampados, sem registro de nome, concentração e data da diluição das soluções germicidas, configurando práticas inadequadas que potencializam riscos diversos. Não existiam lavadoras ultrassônicas (imprescindíveis para a lavagem de produtos canulados) nem secadoras automatizadas em nenhum caso. As seladoras térmicas, necessárias para o adequado fechamento das embalagens de papel, estiveram presentes em todos os casos, porém não havia controle da temperatura do equipamento nem da qualidade da selagem (Tabela 3).
Nenhum CME possuía balança para o necessário controle de peso dos pacotes a serem esterilizados.
Em todos os casos eram reprocessados e reusados produtos médicos da lista da Anvisa RE nº 2605/2006,ª que categoriza os produtos de uso único de reprocessamento proibido. O caso 1 reprocessava bisturi descartável com lâmina fixa ao cabo e compressa cirúrgica descartável; o 2, agulha com componente plástico não desmontável, lâmina de Shaiver < 3 mm, pinças e tesouras não desmontáveis de videolaparoscopia e punch cardíaco plástico; o 3 cateter de hemodinâmica e dreno de tórax; o 4, bolsa coletora cirúrgica, campo cirúrgico, trocater não desmontável e expansor de pele com válvula (Tabela 4).
A classificação dos hospitais segundo sua condição técnica de reprocessamento de produtos médicos é apresentada na Tabela 5.
DISCUSSÃO
Este estudo distingue-se de outros sobre reprocessamento de produtos médicos ao analisar tais práticas com vistas à segurança sanitária. Apresenta, portanto, uma perspectiva mais abrangente de controle de riscos e saúde coletiva, utilizando um modelo regulatório desenvolvido como padrão de referência.
Os resultados desta investigação ratificam as questões emblemáticas que envolvem o reuso dos produtos médicos apresentadas nas descrições dos casos e comprovam a proposição inicial do estudo.
Nenhuma das quatro organizações hospitalares estudadas apresenta condições técnicas de reprocessamento de produtos médicos adequadas, conforme o modelo regulatório elaborado. Três apresentam condições técnicas de reprocessamento inadequadas e uma encontra-se em condição técnica com necessidade de adequação.
Inadequações nas condições técnicas de reprocessamento de produtos médicos foram constatadas em todas as categorias selecionadas para a avaliação, exceto na rastreabilidade de produtos (em um caso). Os menores percentuais de conformidade foram observados no gerenciamento das práticas e nos protocolos de reprocessamento. Esses dados apontam para uma discutível racionalidade nas práticas de reprocessamento de produtos em serviços carentes de condições estruturais para a realização das atividades básicas de reprocessamento e de reuso (básicas, mas cruciais, como limpeza validada e testes de função e integridade dos produtos), à medida que partem para ações consideradas mais elaboradas (como monitoramento e rastreamento).
Os baixos percentuais de desempenho no gerenciamento das práticas e protocolos de reprocessamento de produtos médicos refletem as inadequações estruturais e processuais dos CME estudados, como por exemplo falhas em atividades de limpeza, desinfecção e esterilização. São reflexos das dificuldades de natureza gerencial e de organização dos CME, fruto da falta de investimentos e do limitado aporte de recursos materiais.
A temática dos produtos médicos parece não ser uma prioridade política nesses hospitais, já que não existe envolvimento institucional com informações sobre o processamento de produtos, seus resultados e consequências para pacientes e profissionais de saúde, ou ainda quais dispositivos médicos são reusados e reprocessados, como e quantas vezes. As decisões são delegadas e circunscritas aos CME sem o comprometimento amplo e responsável que a questão exige.
Nenhum CME realiza inspeção visual sistematizada dos produtos em condição de reuso, nem tampouco testes de integridade e de funcionalidade, necessários para prevenir riscos relacionados a falhas de limpeza e possíveis alterações nas características dos produtos que foram submetidos aos múltiplos ciclos de reprocessamento. A verificação da funcionalidade dos produtos médicos reprocessados requer conhecimentos específicos e equipamentos especializados, raramente encontrados nos serviços hospitalares. Mas é imperativo que os CME brasileiros incorporem a cultura da avaliação e validação do processo de limpeza, atualmente restrita à esterilização, adotando a prática da sistematização da inspeção visual, mesmo nos serviços mais simples. Testes químicos são necessários para comprovar ausência de carga orgânica e inorgânica em produtos críticos (que possuem alto risco de transmitir infecções se inadequadamente descontaminados) e dispositivos de configuração complexa, em que o exame visual não é possível ou suficiente. A prática da limpeza associada aos testes de integridade e funcionalidade deve ser a etapa principal e definidora de todo o processamento de produtos médicos, sejam de uso único, sejam reusáveis, conforme proposto no modelo regulatório.
A prática de reprocessar produtos médicos de uso único constantes da lista da Anvisa mostra que os hospitais infringem as normativas que regulam o reprocessamento de produtos no País. A despeito do registro de inspeção sanitária em dois CME estudados, essa infração não foi detectada, o que põe em xeque a qualidade da ação da vigilância sanitária e sua capacidade para identificar os riscos associados ao reprocessamento de produtos médicos em CME da Bahia.
Os riscos relacionados ao reprocessamento de artigos se apresentam tanto para os produtos considerados de uso único quanto para aqueles passíveis de reprocessamento ou de múltiplo uso, dado que a maioria dos eventos adversos, ou surtos de infecção, está relacionada a falhas nas etapas do reprocessamento e não ao reprocessamento em si.5,10,11 Os processos de trabalho em um CME requerem planejamento e gerenciamento de riscos, e isso só é possível com estrutura físico-operacional adequada e sobretudo profissionais comprometidos com essa problemática. A segurança do paciente usuário desses dispositivos depende disso.
Este estudo introduziu o conceito de risco residual na temática do reuso de produtos médicos. O conceito poderá facilitar o entendimento dos fatores que contribuem para a ocorrência de eventos adversos relacionados às tecnologias de saúde e poderá ser utilizado como instrumento de planejamento, vigilância e coordenação por profissionais e gestores em serviços de saúde. Estes poderão entender que, se o risco residual é condição inerente ao produto médico reprocessado, o controle de riscos deve concentrar-se nos processos de trabalho dentro do CME.
Assim, o debate sobre a possibilidade ou impossibilidade de reprocessar produtos considerados de uso único deixa de fazer sentido. Partindo do pressuposto de que o risco residual existe tanto no processamento do produto reusável quanto no de uso único, os gestores de hospitais saberão que a decisão sobre reprocessamento e reuso deverá basear-se na capacidade organizativa dos serviços. A definição de quais materiais serão reusados será então sustentada por controles adequados de avaliação dos produtos e pelo monitoramento dos processos de descontaminação.
A incorporação do conceito de risco residual em produtos médicos obriga os profissionais do CME a atuar de forma sistematizada, aplicando ações de gerenciamento de risco em todas as instâncias, ciclos e etapas do reprocessamento desses produtos. Com base nos referenciais de riscos, poderá ser adotada certa racionalidade no uso de materiais. Assim, o CME terá uma função de destaque na organização hospitalar, como serviço autônomo, definidor e realizador de processos, sem os quais não funcionarão os demais serviços hospitalares.
Com a crescente incorporação de tecnologias que portam benefícios e riscos aos serviços de saúde, cresce também a responsabilidade do Estado como controlador sanitário de produtos, processos e serviços ligados à saúde humana. Para tanto, há que se investir na perícia de um controle sanitário que consiga controlar os riscos e proteger a saúde dos usuários dos serviços de saúde. Num país que conseguiu implementar e manter a mais abrangente política pública (o Sistema Único de Saúde), a despeito das forças interessadas em transformar a saúde em um bem de mercado e sem entrar no mérito das insuficiências de cobertura, integralidade e resolutividade dos problemas dos serviços que compõem esse sistema, esse desafio pode ser alcançado.
Recebido: 28/9/2011
Aprovado: 17/4/2012
Trabalho baseado na tese de Doutorado de Eliana Auxiliadora Magalhães Costa apresentada ao Instituto de Saúde Coletiva da Universidade Federal da Bahia em 1/3/2011. Os autores declaram não haver conflitos de interesse.
- 1. Alfa MJ, Howie R. Modeling microbial survival in buildup biofilm for complex medical devices. BMC Infect Dis. 2009;9:56. DOI:10.1186/1471-2334-9-56
- 2. Amarante JMB, Toscano CM, Pearson ML, Roth V, Jarvis WR, Levin AS. Reprocessing and reuse of single-use medical devices used during hemodynamic procedures in Brazil: a widespread and largely overlooked problem. Infect Control Hosp Epidemiol. 2008;29(9):854-8. DOI:10.1086/590357
- 3. Fireman Z. Biopsy forceps: reusable or disposablew? J Gastroenterol Hepatol. 2006;21(7):1089-92. DOI:10.1111/j.1440-1746.2006.04429.x
- 4. Forte L, Shum C. Comparative cost-efficiency of the EVOTECH endoscope cleaner and reprocessor versus manual cleaning plus automated endoscope reprocessing in a real-world Canadian hospital endoscopy setting. BMC Gastroenterol. 2011;11:105. DOI:10.1186/1471-230X-11-105
- 5. Greene VW. Reuse of medical devices labeled for single-use. In: Mayhall GC. Hospital epidemiology and infection control 3.ed. Philadelphia: Lippincott Williams & Wilkins; 2004. p.1535-45.
- 6. Grosskopf V, Jakel C. Legal framework conditions for the reprocessing of medical devices. GMS Krankenhhyg Interdiszip 2008;3(3):Doc24.
- 7. Kraft M. Framework conditions and requeriments to ensure the technical functional safety of reprocessed medical devices. GMS Krankenhhyg Interdiszip 2008;3(3):Doc23.
- 8. Kramer A, Assadian O. Ethical and hygienic aspects of the reprocessing of medical devices in Germany. GMS Krankenhhyg Interdiszip. 2008;3(3):Doc25.
- 9. Miller MA, Gravel D, Paton S. Reuse of single-use medical devices in Canadian acute-care healthcare facilities. Can Commun Dis Rep. 2001;27(23):193-9
- 10. Ribeiro SMCP. Cenário do reprocessamento de artigos de uso único: situação no Brasil e no mundo. In: Associação Paulista de Estudos e Controle de Infecção Hospitalar. Reprocessamento de artigos de uso único. São Paulo: APECIH; 2008. p.1-7.
- 11. Tessarolo F, Caola I, Nollo G, Antolini R, Guarrera GM, Caciagli P. Efficiency in endoxin removal by a reprocessing protocol for electrophysiology catheters based on hydrogen peroxide plasma sterilization. Int J Hyg Environ Health. 2006;209(6):557-65. DOI:10.1016/j.ijheh.2006.05.001
- 12. Tessarolo F, Caola I, Fedel M, Stacchiotti A, Caciagli P, Guarrera GM, et al. Different experimental protocols for decontamination affect the cleaning of medical devices: a preliminary electron microscopy analysis. J Hosp Infect 2007;65(4):326-33. DOI:10.1016/j.jhin.2006.10.015
- 13. Vickery K, Pajkos A, Cossart Y. Removal of biofilm from endoscopes: evaluation of detergent efficiency. Am J Infect Control 2004;32(3):170-6. DOI:10.1016/j.ajic.2003.10.009
- 14. Yin RK. Estudo de caso: planejamento e métodos. 3.ed. Porto Alegre: Bookman Companhia Editora; 2005.
Datas de Publicação
-
Publicação nesta coleção
03 Abr 2013 -
Data do Fascículo
Out 2012
Histórico
-
Recebido
28 Set 2011 -
Aceito
17 Abr 2012