Resumos
A hanseníase é doença infecciosa crônica causada pelo Mycobacterium leprae. A predileção pela pele e nervos periféricos confere características peculiares a esta moléstia, tornando o seu diagnóstico simples. O Brasil continua sendo o segundo país em número de casos no mundo, após a Índia. Aproximadamente 94% dos casos conhecidos nas Américas e 94% dos novos diagnosticados são notificados pelo Brasil. A doença manifesta-se em dois pólos estáveis e opostos (virchowiano e tuberculóide) e dois grupos instáveis (indeterminado e dimorfo). Em outra classificação a doença é dividida em forma tuberculóide, borderline ou dimorfa que são subdivididos em dimorfa-tuberculóide, dimorfa-dimorfa e dimorfa-virchowiana, e virchowiana. A baciloscopia é o exame complementar mais útil no diagnóstico. O tratamento da hanseníase compreende: quimioterapia específica, supressão dos surtos reacionais, prevenção de incapacidades físicas, reabilitação física e psicossocial. A poliquimioterapia com rifampicina, dapsona e clofazimina revelou-se muito eficaz e a perspectiva de controle da doença no Brasil é real no curto prazo.
Hanseníase; Lepra; Micobacteriose; Mycobacterium leprae
Leprosy or Hansen's disease is a chronic infectious disease caused by the Mycobacterium leprae. The skin and nervous manifestations of the disease present a singular clinical picture that is easily recognized. After India, Brazil still is the second country with the greatest number of cases in the world. Around 94% of the known cases and 94% of the new cases reported in America, come from Brazil. The disease presents itself in two well-defined stable and opposite poles (lepromatous and tuberculoid) and two unstable groups (indeterminate and dimorphic). The spectrum of presentation of the disease may also be classified as: tuberculoid tuberculoid (TT), borderline tuberculoid (BT), borderline borderline (BB), borderline lepromatous (BL) and lepromatous lepromatous (LL). The finding of acid fast bacillus in tissue is the most useful method of diagnosis. The effective treatment of leprosy includes the use of specific therapy, suppression of lepra reactions, prevention of physical incapacity, and physical and psychosocial rehabilitation. Chemotherapy with rifampin, dapsone and clofazimine have produced very good results and the control of the disease in Brazil in the foreseeable future is likely.
Leprosy; Hansen's disease; Mycobacterium leprae; Mycobacteriosis
ARTIGO DE ATUALIZAÇÃO
Hanseníase no Brasil
Leprosy in Brazil
Marcelo Grossi Araújo
Serviço de Dermatologia da Faculdade de Medicina da Universidade Federal de Minas Gerais, Belo Horizonte, MG
Endereço para correspondência Endereço para correspondência Dr. Marcelo Grossi Araújo R. Maranhão 99, sala 504 Bairro Santa Efigênia 30150-330 Belo Horizonte, MG e-mail: mgrossi@medicina.ufmg.br
RESUMO
A hanseníase é doença infecciosa crônica causada pelo Mycobacterium leprae. A predileção pela pele e nervos periféricos confere características peculiares a esta moléstia, tornando o seu diagnóstico simples. O Brasil continua sendo o segundo país em número de casos no mundo, após a Índia. Aproximadamente 94% dos casos conhecidos nas Américas e 94% dos novos diagnosticados são notificados pelo Brasil. A doença manifesta-se em dois pólos estáveis e opostos (virchowiano e tuberculóide) e dois grupos instáveis (indeterminado e dimorfo). Em outra classificação a doença é dividida em forma tuberculóide, borderline ou dimorfa que são subdivididos em dimorfa-tuberculóide, dimorfa-dimorfa e dimorfa-virchowiana, e virchowiana. A baciloscopia é o exame complementar mais útil no diagnóstico. O tratamento da hanseníase compreende: quimioterapia específica, supressão dos surtos reacionais, prevenção de incapacidades físicas, reabilitação física e psicossocial. A poliquimioterapia com rifampicina, dapsona e clofazimina revelou-se muito eficaz e a perspectiva de controle da doença no Brasil é real no curto prazo.
Palavras-chaves: Hanseníase. Lepra. Micobacteriose. Mycobacterium leprae.
ABSTRACT
Leprosy or Hansen's disease is a chronic infectious disease caused by the Mycobacterium leprae. The skin and nervous manifestations of the disease present a singular clinical picture that is easily recognized. After India, Brazil still is the second country with the greatest number of cases in the world. Around 94% of the known cases and 94% of the new cases reported in America, come from Brazil. The disease presents itself in two well-defined stable and opposite poles (lepromatous and tuberculoid) and two unstable groups (indeterminate and dimorphic). The spectrum of presentation of the disease may also be classified as: tuberculoid tuberculoid (TT), borderline tuberculoid (BT), borderline borderline (BB), borderline lepromatous (BL) and lepromatous lepromatous (LL). The finding of acid fast bacillus in tissue is the most useful method of diagnosis. The effective treatment of leprosy includes the use of specific therapy, suppression of lepra reactions, prevention of physical incapacity, and physical and psychosocial rehabilitation. Chemotherapy with rifampin, dapsone and clofazimine have produced very good results and the control of the disease in Brazil in the foreseeable future is likely.
Keywords: Leprosy. Hansen's disease. Mycobacterium leprae. Mycobacteriosis.
A hanseníase é doença infecciosa crônica causada pelo M. leprae. A predileção pela pele e nervos periféricos confere características peculiares a esta moléstia, tornando o seu diagnóstico simples na maioria dos casos. Em contrapartida, o dano neurológico responsabiliza-se pelas seqüelas que podem surgir. Constitui importante problema de saúde pública no Brasil e em vários países do mundo (Tabela 1), e persiste como endemia em 15 países ao final de 2000 (prevalência acima de 1,0/10.000 habitantes). Apesar de todo o empenho em sua eliminação, o Brasil continua sendo o segundo país em número de casos no mundo. Aproximadamente, 94% dos casos conhecidos nas Américas e 94% dos casos novos diagnosticados são notificados pelo Brasil. Ao longo das últimas décadas, as taxas de prevalência têm declinado ano a ano, resultado da consolidação do tratamento poliquimioterápico. Entretanto, as taxas de detecção de casos novos têm se mantido elevadas, e a expectativa é de que só se alcance a meta de eliminação da doença em 2005, quando a prevalência deverá ser inferior a 1,0/10.000 habitantes5.
Na abordagem do problema devem ser destacados a quimioterapia específica e o tratamento das reações da hanseníase. Essas são vistas como doença imunológica que pode persistir depois do término do tratamento específico em muitos pacientes. O diagnóstico precoce da doença e o reconhecimento imediato dos quadros reacionais garantem a interrupção da cadeia de transmissão e a prevenção das incapacidades físicas.
EPIDEMIOLOGIA
O Mycobacterium leprae foi descrito em 1873 pelo norueguês Amauer Hansen. É bacilo álcool-ácido resistente, parasita intracelular com predileção pela célula de Schwann e pele. Não pode ser cultivado, mas existem modelos animais utilizados no seu estudo e reprodução, como o tatu e camundongos timectomizados e irradiados3 9.
Considera-se o homem como o único reservatório natural do bacilo, apesar do relato de animais selvagens naturalmente infectados (tatus e macacos). Os pacientes portadores de formas multibacilares são considerados a principal fonte de infecção, não obstante o papel dos paucibacilares na cadeia de transmissão já ter sido demonstrado. A existência de portadores sadios tem sido relatada pelos estudos de DNA utilizando a técnica da reação em cadeia da polimerase (PCR), entretanto, o papel desses na transmissão e o seu risco de adoecimento não está definido11.
Admite-se que as vias aéreas superiores constituem a principal porta de entrada e via de eliminação do bacilo. A pele erodida, eventualmente, pode ser porta de entrada da infecção. As secreções orgânicas como leite, esperma, suor, e secreção vaginal, podem eliminar bacilos, mas não possuem importância na disseminação da infecção9 10.
Embora a hanseníase hoje se mantenha nos países mais pobres e nestes nos estratos de população menos favorecidos, não se sabe ao certo o peso de variáveis como moradia, estado nutricional, infecções concomitantes (HIV e malária), e infecções prévias por outras micobactérias. O papel de fatores genéticos tem sido avaliado há muito tempo, a distribuição da doença em conglomerados, famílias ou comunidades com antecedentes genéticos comuns sugere esta possibilidade10 11. A destruição ou a multiplicação do bacilo no interior dos macrófagos podem ser determinadas por mecanismos imunológicos que envolvem a apresentação do antígeno (complexo MHC) e pelo antígeno de histocompatibilidade HLA, ambos geneticamente determinados. Na forma tuberculóide predomina o fenótipo HLA-DR2 e HLA-DR3, padrão de não suscetibilidade à doença; na hanseníase virchowiana e dimorfo-virchowiana predomina o fenótipo HLA-DQ1, relacionado à suscetibilidade2.
A prevalência (casos em registro) tem declinado no mundo e a meta de eliminação vem sendo alcançada em vários países. O número de casos novos registrados no ano tem se mantido estável, mostrando que muitos casos novos irão surgir nos próximos anos. Outro aspecto que preocupa é a prevalência oculta, definida como os casos novos esperados que não estão sendo diagnosticados ou o são tardiamente. Enquanto a doença se torna mais rara em alguns países ou regiões, quinze países com mais de 1 milhão de habitantes foram considerados endêmicos pela Organização Mundial da Saúde ao final de 2000. No mundo existiam 597.232 casos registrados, e foram diagnosticados 719.330 casos novos. O Brasil detém o segundo lugar no mundo, em número absoluto de casos (77.676 casos - 4,6/10.000 - Tabela 1) e índice de detecção considerado muito alto (2,41/10.000 41.070 casos novos). Contudo, acredita-se que a eliminação possa ser alcançada até o ano 2005, pois os estados que tem possibilidade de alcançar a meta em curto e médio prazos têm no seu registro 48% dos doentes, detectam 46% dos casos novos e concentram 80% da população brasileira5 12.
DIAGNÓSTICO E QUADRO CLÍNICO
Para melhor entendimento do quadro clínico e classificação, alguns aspectos imunológicos devem ser mencionados. Demonstrou-se que o M. leprae é um bacilo com alto poder infectante e baixo poder patogênico. Depois da sua entrada no organismo, não ocorrendo a sua destruição, este irá se localizar na célula de Schwann e na pele. Sua disseminação para outros tecidos pode ocorrer nas formas mais graves da doença, nas quais o agente infectante não encontra resistência contra a sua multiplicação. Nesse caso, os linfonodos, olhos, testículos e fígado podem abrigar grande quantidade do bacilo3 9.
Entre os aspectos imunopatológicos da hanseníase sabe-se que apesar da produção de anticorpos específicos contra o M. leprae, em grande quantidade nas formas multibacilares, ela é ineficaz para a eliminação dos bacilos. A defesa é efetuada pela resposta imunológica celular, capaz de fagocitar e destruir os bacilos, mediada por citocinas (TNF-alfa, IFN-gama) e mediadores da oxidação, como os reativos intermediários do oxigênio (ROI), e do nitrogênio (RNI) fundamentais na destruição bacilar no interior dos macrófagos2 10. Nas lesões tuberculóides há predomínio de células T auxiliares CD4+, e citocinas Th1, como IL-2 e IFN-gama, enquanto nas lesões virchowianas o predomínio é de células T supressoras, CD8+ e citocinas Th2, como IL-4, IL-5 e IL-10. Na hanseníase tuberculóide, a exacerbação da imunidade celular e a produção de citocinas pró-inflamatórias (IL-1 e TNF-alfa) impedem a proliferação bacilar, mas pode se tornar lesiva ao organismo, causando lesões cutâneas e neurais, pela ausência de fatores reguladores. Na hanseníase virchowiana, a produção dos antígenos PGL-1 e LAM pelo bacilo, no interior do macrófago, favorece o escape do mesmo à oxidação intramacrofágica, pois estes possuem função supressora da atividade do macrófago e favorecem a sua disseminação2.
O Ministério da Saúde define como caso de hanseníase para tratamento, quando um ou mais dos seguintes achados encontram-se presentes: lesão de pele com alteração de sensibilidade, espessamento de tronco nervoso ou baciloscopia positiva na pele6 .
A descrição detalhada da execução dos testes de sensibilidade pode ser encontrada em livros texto e manuais. Este tipo de teste apresenta limitações para ser feito em crianças muito novas, adultos ansiosos, manipuladores ou incapazes de compreender as instruções dadas antes de sua execução. Em caso de dúvida deve-se lançar mão de provas complementares que são o teste da histamina e da pilocarpina. Estes são de fácil realização. A palpação de nervos e sua avaliação funcional têm como objetivo pesquisar possíveis alterações neurológicas provocadas pela hanseníase. Deve-se fazer a palpação dos troncos nervosos acessíveis e a avaliação funcional (sensitiva, motora e autonômica) daqueles mais freqüentemente comprometidos pela doença. Cumpre lembrar que qualquer ramo ou tronco nervoso superficial poderá ser afetado, especialmente nas partes mais superficiais, onde estão mais sujeitos aos traumatismos e na sua passagem por estruturas osteoligamentosas (áreas de constrição). Na palpação deve ser avaliado o calibre do nervo em comparação com o contra-lateral, a presença de dor, fibrose ou nodulações. Os nervos comumente avaliados são: nos membros superiores, o nervo ulnar, o mediano, radial e radial cutâneo; nos membros inferiores, o tibial posterior e o fibular comum; no segmento cefálico, o grande auricular e o nervo facial que é motor e não é palpável.
A avaliação da função motora de grupos musculares específicos deve ser feita principalmente nos pacientes em tratamento, com a finalidade de detecção precoce de incapacidades. Seqüelas bem definidas podem ser encontradas já no período do diagnóstico, tais como: paralisia facial do tipo periférico unilateral ou bilateral, ou paralisia do ramo orbicular do nervo zigomático, provocando o lagoftalmo, epífora e exposição da córnea; mão em garra (garra do quarto e quinto quirodátilos ou garra completa); mão caída; pé caído, garra de artelhos que pode ser acompanhada do mal perfurante plantar9.
A baciloscopia é o exame complementar mais útil no diagnóstico; é de fácil execução e baixo custo. Colhe-se o material a ser examinado (raspado de tecido dérmico) nos lóbulos das orelhas direita e esquerda, cotovelos direito e esquerdo e em lesão suspeita. A coloração é feita pelo método de Ziehl-Neelsen e apresenta-se o resultado sob a forma de índice baciloscópico (IB), numa escala que vai de 0 a 6+. A baciloscopia mostra-se negativa (IB=0) nas formas tuberculóide e indeterminada, fortemente positiva na forma virchowiana e revela resultado variável na forma dimorfa.
Outros exames podem ser necessários: realiza-se o exame histopatológico da pele nos casos em que há dúvidas diagnósticas ou na classificação, e indica-se a biópsia do nervo em casos especiais, quando há dúvida no diagnóstico diferencial com outras neuropatias. A reação de Mitsuda é um teste de aplicação intradérmica e leitura tardia - 28 dias. Utiliza-se na classificação da doença e na definição do prognóstico. Não possui valor para o diagnóstico. O antígeno glicolípide fenólico-1 (PGL-1) é específico do M. leprae e leva à formação de anticorpos das classes IgG e IgM. Os títulos de IgM correlacionam-se com a forma clínica e a atividade da doença. Níveis aumentados do anti PGL-1 têm sido descritos na Hanseníase Virchowiana e tendem a decrescer com o tratamento específico. Por outro lado, na Hanseníase Tuberculóide não há resposta desses anticorpos. Há estudos inconclusivos que procuram estabelecer uma relação entre a positividade ao anti-PGL-1 e o risco de adoecer ou de identificar infecção subclínica¹.
A identificação do Micobacterium leprae pela reação em cadeia da polimerase (PCR) tem sido estudada em centros de pesquisa, mas não é realizada rotineiramente.
As classificações mais usadas no Brasil são as de Madri (Congresso Internacional, 1953) e de Ridley e Jopling. Na de Madri, consideram-se dois pólos estáveis e opostos (virchowiano e tuberculóide) e dois grupos instáveis (indeterminado e dimorfo), que caminhariam para um dos pólos, na evolução natural da doença. A classificação proposta por Ridley e Jopling, em 1966, é utilizada em pesquisas e leva em consideração a imunidade dentro de um espectro de resistência do hospedeiro. Esta classificação não inclui a forma indeterminada no espectro e o exame histopatológico torna-se necessário para sua utilização. São descritos a forma tuberculóide (TT), os casos borderline ou dimorfos que são subdivididos em dimorfo-tuberculóide (DT), dimorfo-dimorfo (DD) e dimorfo-virchowiano (DV), virchowiano-subpolar (VVs) e virchowiano (VV)3 9.
FORMAS CLÍNICAS
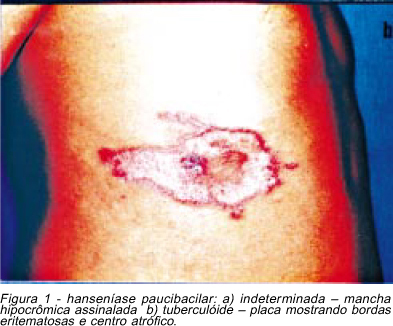
Hanseníase indeterminada (HI). As lesões da HI surgem após um período de incubação que varia, em média, de dois a cinco anos. Caracteriza-se pelo aparecimento de manchas hipocrômicas, com alteração de sensibilidade, ou simplesmente por áreas de hipoestesia na pele (Figura 1a). As lesões são em pequeno número e podem se localizar em qualquer área da pele. Freqüentemente, apenas a sensibilidade térmica encontra-se alterada. Não há comprometimento de troncos nervosos nesta forma clínica, apenas ramúsculos nervosos cutâneos. A pesquisa de BAAR revela-se negativa. A HI é considerada a primeira manifestação clínica da hanseníase e, após período de tempo que varia de poucos meses até anos, ocorre evolução para cura ou para outra forma clínica.
Hanseníase tuberculóide (HT). Nesta forma clínica, encontram-se lesões bem delimitadas, em número reduzido, anestésicas e de distribuição assimétrica. Descrevem-se lesões em placas ou anulares com bordas papulosas, e áreas da pele eritematosas ou hipocrômicas. Seu crescimento centrífugo lento leva à atrofia no interior da lesão, que pode, ainda, assumir aspecto tricofitóide, com descamação das bordas (Figura 1b). Observa-se, ainda, as variedades infantil e a forma neural pura. A primeira manifesta-se em crianças conviventes com portadores de formas bacilíferas e localiza-se principalmente na face. Pode se manifestar como nódulos, placas, lesões tricofitóides ou sarcoídicas. Na forma neural pura, não se encontram lesões cutâneas. Há espessamento do tronco nervoso e dano neural precoce e grave, em especial, quando atinge nervos sensitivo-motores. A baciloscopia resulta negativa. A HT, juntamente com a HI constituem as formas paucibacilares da hanseníase. Apesar da possibilidade de cura espontânea na HT, a orientação é de que os casos sejam tratados para reduzir o tempo de evolução da doença e o risco de dano neural.
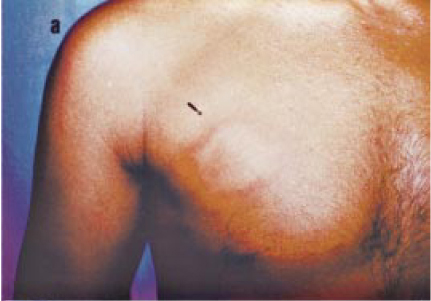
Hanseníase virchowiana (HV). Trata-se de forma multibacilar, reconhecida por corresponder ao pólo de baixa resistência, dentro do espectro imunológico da doença. Portanto, manifesta-se naqueles indivíduos que apresentam imunidade celular deprimida para o Mycobacterium leprae. Admite-se que a HV possa evoluir a partir da forma indeterminada ou se apresentar como tal desde o início. Sua evolução crônica caracteriza-se pela infiltração progressiva e difusa da pele, mucosas das vias aéreas superiores, olhos, testículos, nervos, podendo afetar, ainda, os linfonodos, o fígado e o baço. Na pele, descrevem-se pápulas, nódulos e máculas. A infiltração é difusa e mais acentuada na face e nos membros. A pele torna-se luzidia, xerótica, com aspecto apergaminhado e tonalidade semelhante ao cobre. Há rarefação dos pelos nos membros, cílios e supercílios. A queda de pelos nesse local chama-se madarose (Figura 2). A infiltração da face, incluindo os pavilhões auriculares, com madarose e manutenção da cabeleira, forma o quadro conhecido como fácies leonina. O comprometimento nervoso ocorre nos ramúsculos da pele, na inervação vascular e nos troncos nervosos. Estes últimos vão apresentar deficiências funcionais e seqüelas tardias. São sinais precoces de HV, a obstrução nasal, rinorréia serossangüinolenta e edema de membros inferiores. A HV apresenta baciloscopia fortemente positiva e representa nos casos virgens de tratamento, importante foco infeccioso ou reservatório da doença.
Hanseníase dimorfa (HD). Este grupo é caracterizado por sua instabilidade imunológica, o que faz com que haja grande variação em suas manifestações clínicas, seja na pele, nos nervos, ou no comprometimento sistêmico. As lesões da pele revelam-se numerosas e a sua morfologia mescla aspectos de HV e HT, podendo haver predominância ora de um, ora de outro tipo. Compreendem placas eritematosas, manchas hipocrômicas com bordas ferruginosas, manchas eritematosas ou acastanhadas, com limite interno nítido e limites externos imprecisos, placas eritemato-ferruginosas ou violáceas, com bordas internas nítidas e limites externos difusos (lesões foveolares) (Figura 3a). Quando numerosas, são chamadas lesões em renda ou queijo suíço. A infiltração assimétrica da face, dos pavilhões auriculares, e a presença de lesões no pescoço e nuca são elementos sugestivos desta forma clínica. As lesões neurais são precoces, assimétricas e, com freqüência, levam a incapacidades físicas (Figura 3b). A pesquisa de BAAR pode ser negativa ou positiva com índice bacilar variável.
SURTOS REACIONAIS NA HANSENÍASE
Os surtos reacionais representam episódios inflamatórios que se intercalam no curso crônico da hanseníase. Devem ser prontamente diagnosticados e tratados. Os tipos de reação mais importantes são a reação reversa ou reação do tipo 1 e a reação do tipo 2 ou eritema nodoso da hanseníase (ENH). As reações seguem-se a fatores desencadeantes, tais como: infecções intercorrentes, vacinação, gravidez e puerpério, medicamentos iodados, estresse físico e emocional. Os quadros reacionais, às vezes, antecedem o diagnóstico da hanseníase, surgem durante o tratamento ou após a alta. A reação do tipo 1 tende a surgir mais precocemente no tratamento, entre o 2º e o 6º meses, caracteristicamente na hanseníase dimorfa. É considerada reação mediada pela imunidade celular e representa melhora (up-grading) ou piora (down-grading). Clinicamente são indistinguíveis e se caracterizam por exacerbação das lesões pré-existentes, que se tornam edemaciadas, eritematosas, brilhantes, podendo chegar a ulceração (Figura 4a). Os sintomas sistêmicos variam. Surgem lesões novas à distância e as neurites mostram-se freqüentes, podendo ser a única manifestação clínica. As neurites podem ser silenciosas, ou seja, o dano funcional do nervo se instala sem quadro clínico de dor e espessamento do nervo. Os nervos mais comprometidos são os ulnares e medianos nos membros superiores, fibular comum e tibial posterior nos membros inferiores e facial e grande auricular no segmento cefálico3 8 9. Observa-se a reação do tipo 2 ou ENH nas formas virchowianas e dimorfas, em geral, após seis meses de tratamento. Trata-se de síndrome desencadeada por imunocomplexos, mas a imunidade celular possui importância em etapas iniciais do processo. Há aumento de citocinas séricas, como o fator de necrose tumoral alfa e o interferon gama sem, contudo, haver mudança definitiva da condição imunológica do paciente2 8. Na pele, a lesão típica é o eritema nodoso (ENH) que se caracteriza por lesões eritematosas, dolorosas, de tamanhos variados incluindo pápulas e nódulos localizados em qualquer região da pele (Figura 4b). Ainda na pele, descreveu-se o eritema nodoso necrotizante e o eritema polimorfo. Em alguns casos, o quadro reacional evolui com neurite, orquite, epididimite, irite, iridociclite, artrite, mão e pé reacionais, linfadenite, proteinúria e dano hepático. Edema de membros inferiores, pré-tibialgia e febre acompanham esta reação. Às vezes, a febre alta e prolongada domina o quadro clínico. As reações do tipo 2 repetem-se e evoluem indefinidamente em surtos subentrantes9.
DIAGNÓSTICO DIFERENCIAL
No diagnóstico diferencial da hanseníase deve-se levar em conta as manifestações dermatológicas, neurológicas, as doenças deformantes e doenças sistêmicas nos períodos reacionais. Os quadros abaixo ilustram algumas destas situações (Tabelas 2 e 3).
Reação e recidiva: considera-se recidiva o quadro observado em paciente que completa com êxito o tratamento, mas que posteriormente desenvolve novos sinais e sintomas da doença. As recidivas são raras e, geralmente, ocorrem nos casos que receberam poliquimioterapia inadequada para a sua forma clínica. Na maioria, os bacilos são sensíveis aos medicamentos e os pacientes podem ser retratados com os regimes originais. É de grande importância a diferenciação entre um quadro reacional tipo I e uma recidiva. Clinicamente, os quadros podem ser muito semelhantes. A Tabela 4 aponta as principais diferenças entre reação reversa e recidiva. A reação do tipo 2, quando ocorre em paciente que terminou tratamento há mais de três anos e não apresentava surtos reacionais anteriores, também deve levantar a suspeita de recidiva e deve ser cuidadosamente avaliada6.
TRATAMENTO
O tratamento da hanseníase compreende: quimioterapia específica, supressão dos surtos reacionais, prevenção de incapacidades físicas, reabilitação física e psicossocial. Este conjunto de medidas deve ser desenvolvido em serviços de saúde da rede pública ou particular, mediante notificação de casos à autoridade sanitária competente. As ações de controle são realizadas em níveis progressivos de complexidade, dispondo-se de centros de referência locais, regionais e nacionais para o apoio da rede básica. O Ministério da Saúde (MS) regulamenta o assunto através da portaria de número 1073/GM publicada em 28/09/2000 no Diário Oficial da União, disponível no site www.saude.gov.br.
Na indicação do esquema terapêutico deve-se levar em conta toda a história clínica do paciente, com especial atenção para alergias a medicamentos, interação de drogas, e doenças associadas. A definição do esquema depende da classificação final do caso. No Brasil adota-se a classificação de Madri e o Ministério da Saúde sugere classificação operacional com os seguintes critérios: paucibacilares (PB) - casos com até cinco lesões de pele e ou apenas um tronco nervoso comprometido e multibacilares (MB) - casos com mais de cinco lesões de pele e ou mais de um tronco nervoso acometido. A baciloscopia positiva classifica o caso como multibacilar, independentemente do número de lesões.
As drogas usadas nos esquemas padronizados pela OMS e MS são a rifampicina (única bactericida dos esquemas padrão), dapsona e clofazimina.
Os esquemas poliquimioterápicos têm como princípio a associação de drogas. O fornecimento da medicação é gratuito em todo o país. A Tabela 5 mostra os esquemas padronizados. Os casos multibacilares avançados, com infiltração exuberante da pele e que apresentem pouca melhora com as 12 doses, deverão receber 24 doses em até 36 meses (Tabela 6)6.
Existem tratamentos alternativos, disponíveis nos centros de referência, para pacientes com impossibilidade de usar os esquemas padronizados, incluindo o esquema ROM (rifampicina, ofloxacina e minociclina) para tratamento de lesão única de pele em pacientes paucibacilares.
TRATAMENTO DAS REAÇÕES
O diagnóstico correto e o tratamento adequado e precoce das reações são de grande valor para a prevenção de incapacidades, principalmente para evitar o dano neural. A busca de fatores desencadeantes deve ser rotineira, especialmente para infecções intercorrentes. A reação do tipo 1 ou reversa pode ser tratada com analgésicos ou anti-inflamatórios não hormonais (AINES), quando o quadro clínico for discreto e sem neurites. Os pacientes que apresentam neurite, placas reacionais extensas sobre trajeto nervoso ou com risco para ulceração devem receber prednisona na dose de 1 a 2mg/kg/dia até a regressão do quadro, quando então se inicia a redução progressiva do corticóide. Dose de manutenção deve ser feita por período mínimo de 2 meses. A imobilização do membro afetado pela neurite e fisioterapia na fase de recuperação são medidas complementares necessárias para alguns casos. Neurites refratárias aos corticóides poderão necessitar de tratamento cirúrgico3 7 9. As manifestações clínicas da reação do tipo 2 ou eritema nodoso mostram-se polimorfas e muitas vezes se arrastam por meses ou anos. As drogas usadas são analgésicos e AINES, talidomida, clofazimina, pentoxifilina e prednisona. A Tabela 7 mostra suas principais indicações, esquemas sugeridos e efeitos colaterais2 3 6 9.
PROFILAXIA
Pelas normas atuais do MS a prevenção consiste no diagnóstico precoce de casos e na utilização do BCG. Para tal recomenda-se o exame dermato-neurológico de todos os contatos intra-domiciliares do caso diagnosticado. Considera-se os conviventes do domicílio nos últimos cinco anos. Depois do exame clínico o contato será encaminhado para a aplicação da BCG por via intradérmica. Os contatos sem cicatrizes prévias receberão duas doses de BCG, com intervalo de seis meses entre elas. Aqueles com uma cicatriz irão receber uma dose da BCG6.
Recebido para publicação em 24/4/2003
Aceito em 28/5/2003
- 1. Barros RPC, Oliveira MLWR. Detecção de anticorpos específicos para o antígeno glicolípide fenólico-1 do M. leprae (anti PGL-1 IGM): aplicações e limitações. Anais Brasileiros de Dermatologia 75: 745-753, 2000.
- 2. Foss NT. Hanseníase: aspectos clínicos, imunológicos e terapêuticos. Anais Brasileiros de Dermatolologia 74:113-119,1999
- 3. Hastings RC. Leprosy. Churchill Livingstone, Singapore, 1994.
-
4Ministério da Saúde. Portaria Nº 354 de 15 de agosto de 1997 Publicada no D.O.U.- p.17844 - 17847 - Seção 1 de 18 de agosto, 1997.
-
5Ministério da Saúde. Secretaria de Políticas de Saúde. Departamento de Gestão de Políticas Estratégicas. Relatório de atividades da área técnica de dermatologia sanitária ano de 1999. Brasília, 1999.
-
6Ministério da Saúde. Portaria Nº 1073/GM de 26 de setembro de 2000. Publicada no D.O.U. - 188-E -pg 18 -Seção 1 - 28 de setembro, 2000.
- 7. Naafs B. Treatment of reactions and nerve damage. International Journal of Leprosy 64: S21-S28, 1996.
- 8. Nery JA, Vieira LMM, Matos HJ, Gallo MEN, Sarno EN. Reactional states in multibacillary Hansen disease patients during multidrug therapy. Revista do Instituto de Medicina Tropical de São Paulo 40: 363-70,1999.
- 9. Talhari S, Neves RG. Dermatologia tropical Hanseníase. Gráfica Tropical, Manaus,1997.
- 10. Van Beers SM, De Wit MYL, Klaster PR. MiniReview: The epidemiology of Mycobacterium leprae : Recent insight. FEMS Microbiology Letters 136:221-230, 1996.
- 11. Visschedijk J, van de Broek J, Eggens H, Lever P, van Beers S, Klaster P. Mycobacterium leprae millennium resistant! Leprosy control on the threshold of a new era. Tropical Medicine and International Health 5:388-399, 2000.
- 12. World Health Organization. Leprosy-Global Situation. Weekly epidemiological Record [on line], Disponível na Internet: <http://www.who.int/wer> 77: 1-8, 2002.
Datas de Publicação
-
Publicação nesta coleção
31 Jul 2003 -
Data do Fascículo
Jun 2003
Histórico
-
Recebido
24 Abr 2003 -
Aceito
28 Maio 2003