Resumos
O objetivo deste estudo foi definir a prevalência dos vírus linfotrópico de células T humana tipo 1 e 2 em pacientes positivos para o vírus da imunodeficiência humana tipo 1 no Estado de São Paulo, Brasil. Avaliamos 319 indivíduos atendidos em clínicas de Ribeirão Preto e Capital. Os pacientes foram entrevistados e testados sorologicamente. Foram seqüenciadas as regiões tax e long terminal repeat para diferenciação e determinação do subtipo. A soroprevalência geral foi de 7,5% (24/319) e esteve associada somente com uso de drogas injetáveis e ao vírus da hepatite tipo C (p<0, 001). O genoma viral foi detectado em 13 das 24 amostras, sendo 12 caracterizadas como HTLV-2 subtipo 2c e uma como 1a. Nossos dados mostraram que o uso de drogas injetáveis é um importante fator de risco para a transmissão de HTLV-2 em populações infectadas pelo vírus da imunodeficiência humana tipo 1.
Vírus linfotrópico de células T humana tipo 1; Vírus linfotrópico de células T humana tipo 2; Prevalência; Fatores de risco; Vírus da imunodeficiência humana tipo 1
The aim of this study was to define the prevalence of human T cell lymphotropic virus types 1 and 2 in patients who were positive for human immunodeficiency virus type 1 in the State of São Paulo, Brazil. We evaluated 319 individuals infected with HIV type 1 who were attended at specialized clinics in two cities (Ribeirão Preto and São Paulo). The patients were interviewed and tested for antibodies against HTLV types 1 and 2 (Orthoâ HTLV-1/HTLV-2 Ab-Capture enzyme immunoassay). Direct DNA sequencing of polymerase chain reaction products from the tax region of HTLV type 2 and the long terminal repeat region of HTLV types 1 and 2 were performed to differentiate and determine the subtypes. The overall prevalence of anti-HTLV type 1 and 2 antibodies was 7.5% (24/319; 95% CI: 5.2-11.5). HTLV type 1 and 2 infection was associated with a history of injected drug use and with antibodies for hepatitis C virus (p < 0.001), but not with age (p = 0.2), sex (p = 0.9), sexual behavior or serological markers for sexually transmitted diseases (anti-Treponema pallidum, anti-human herpesvirus type 8 or anti-hepatitis B virus antibodies) (p > 0.05). HTLV DNA was detected in 13 out of 24 samples, of which 12 were characterized as HTLV subtype 2c and one as HTLV subtype 1a. Among the 12 HTLV type 2 samples, seven were from injected drug users, thus indicating that this route is an important risk factor for HTLV type 2 transmission among our population infected with HIV type 1.
Human T cell lymphotropic virus type 1; Human T cell lymphotropic virus type 2; Prevalence; Risk factors; Human immunodeficiency virus type 1
ARTIGO ARTICLE
Prevalência, fatores de risco e caracterização genética dos vírus linfotrópico de células T humana tipo 1 e 2 em pacientes infectados pelo vírus da imunodeficiência humana tipo 1 nas Cidades de Ribeirão Preto e São Paulo
Prevalence, risk factors and genetic characterization of human T-cell lymphotropic virus types 1 and 2 in patients infected with human immunodeficiency virus type 1 in the cities of Ribeirão Preto and São Paulo
Walter Kleine NetoI; Sabri Saeed SanabaniI,II; Leda Fátima JamalIII; Ester Cerdeira SabinoI
IFundação Pró Sangue, Hemocentro de São Paulo, São Paulo, SP
IIDepartamento de Doenças Infecciosas e Parasitárias. Escola Paulista de Medicina, Universidade Federal de São Paulo. Laboratório de Retrovirologia, São Paulo, SP
IIICentro de Referência e Treinamento em DST/Aids. Coordenadoria de Controle de Doenças Sexualmente Transmissíveis. Secretaria de Estado da Saúde de São Paulo, São Paulo, SP
Endereço para correspondência Endereço para correspondência: Dra. Ester Cerdeira Sabino Fundação Pró-Sangue/Hemocentro de São Paulo Av. Dr. Enéas Carvalho de Aguiar 155, 1º andar Bloco B 05403-000 São Paulo, SP Tel: 55 11 3061-5544 Ramal 399, Fax: 55 11 3088-8317 e-mail: sabinoec@uol.com.br
RESUMO
O objetivo deste estudo foi definir a prevalência dos vírus linfotrópico de células T humana tipo 1 e 2 em pacientes positivos para o vírus da imunodeficiência humana tipo 1 no Estado de São Paulo, Brasil. Avaliamos 319 indivíduos atendidos em clínicas de Ribeirão Preto e Capital. Os pacientes foram entrevistados e testados sorologicamente. Foram seqüenciadas as regiões tax e long terminal repeat para diferenciação e determinação do subtipo. A soroprevalência geral foi de 7,5% (24/319) e esteve associada somente com uso de drogas injetáveis e ao vírus da hepatite tipo C (p<0, 001). O genoma viral foi detectado em 13 das 24 amostras, sendo 12 caracterizadas como HTLV-2 subtipo 2c e uma como 1a. Nossos dados mostraram que o uso de drogas injetáveis é um importante fator de risco para a transmissão de HTLV-2 em populações infectadas pelo vírus da imunodeficiência humana tipo 1.
Palavras-chaves: Vírus linfotrópico de células T humana tipo 1. Vírus linfotrópico de células T humana tipo 2. Prevalência. Fatores de risco. Vírus da imunodeficiência humana tipo 1.
ABSTRACT
The aim of this study was to define the prevalence of human T cell lymphotropic virus types 1 and 2 in patients who were positive for human immunodeficiency virus type 1 in the State of São Paulo, Brazil. We evaluated 319 individuals infected with HIV type 1 who were attended at specialized clinics in two cities (Ribeirão Preto and São Paulo). The patients were interviewed and tested for antibodies against HTLV types 1 and 2 (Orthoâ HTLV-1/HTLV-2 Ab-Capture enzyme immunoassay). Direct DNA sequencing of polymerase chain reaction products from the tax region of HTLV type 2 and the long terminal repeat region of HTLV types 1 and 2 were performed to differentiate and determine the subtypes. The overall prevalence of anti-HTLV type 1 and 2 antibodies was 7.5% (24/319; 95% CI: 5.2-11.5). HTLV type 1 and 2 infection was associated with a history of injected drug use and with antibodies for hepatitis C virus (p < 0.001), but not with age (p = 0.2), sex (p = 0.9), sexual behavior or serological markers for sexually transmitted diseases (anti-Treponema pallidum, anti-human herpesvirus type 8 or anti-hepatitis B virus antibodies) (p > 0.05). HTLV DNA was detected in 13 out of 24 samples, of which 12 were characterized as HTLV subtype 2c and one as HTLV subtype 1a. Among the 12 HTLV type 2 samples, seven were from injected drug users, thus indicating that this route is an important risk factor for HTLV type 2 transmission among our population infected with HIV type 1.
Key-words: Human T cell lymphotropic virus type 1. Human T cell lymphotropic virus type 2. Prevalence. Risk factors. Human immunodeficiency virus type 1.
Em 1980, Poiesz e cols21 isolaram o primeiro retrovírus humano, posteriormente denominado vírus linfotrópico de células T humana tipo 1 (HTLV-1). Dois anos depois, o tipo 2 seria identificado em uma linhagem de células de paciente com tricoleucemia16. Além da leucemia/linfoma de células T do adulto, o HTLV-1 também é causador de uma doença neurológica degenerativa denominada mielopatia associada ao HTLV-1/paraparesia espástica tropical (HAM/TSP)13 25. Existem vários indícios de acometimento múltiplo de órgãos sugerindo um amplo espectro de morbidades ligadas ao HTLV-12 4 8.
Ao contrário do HTLV-1, o tipo 2 não apresenta associação definida com nenhuma doença linfoproliferativa. Alguns estudos têm sugerido que ele possa também estar associado à HAM/TSP, além de outras síndromes neurológicas, bem como no aumento da incidência de pneumonia, bronquite e algumas condições inflamatórias como artrite26.
O vírus linfotrópico de células T humanas tipo 2 (HTLV-2) pode ser classificado em dois subtipos principais: HTLV-2a e HTLV-2b9 27. Análises filogenéticas de seqüências de long terminal repeat (LTR) e envelope de amostras brasileiras mostraram que os vírus isolados pertencem ao subtipo 2a29. Porém, na região tax eles são semelhantes ao subtipo 2b com uma proteína mais extensa composta por 25 aminoácidos adicionais devido à perda de um stop codon10. Por este motivo, estas cepas estão sendo classificadas como HTLV-2c e têm sido detectadas tanto em amostras urbanas quanto em populações indígenas do Brasil31.
Com o intuito de confirmar e fortalecer os dados de estudos anteriores, determinamos a soroprevalência de HTLV-1/2 em duas populações de pacientes positivos para o vírus da imunodeficiência tipo 1 (HIV-1) geograficamente separadas no Estado de São Paulo, avaliando conjuntamente os fatores de risco associados.
MATERIAL E MÉTODOS
Amostras clínicas. Este estudo de corte transversal incluiu 319 indivíduos infectados com HIV-1, sendo 212 homens e 107 mulheres com faixas etárias acima de 18 anos, atendidos em ambulatórios das cidades de Ribeirão Preto e São Paulo entre março e maio de 2001. As amostras foram colhidas de forma seqüencial no momento da realização do teste de carga viral para HIV-1 e contagem de células T CD4+. Após o consentimento informado, os pacientes foram submetidos a um questionário focando os potenciais fatores de risco para aquisição do HIV, incluindo características sócio-demográficas, histórico sexual e exposição parenteral.
O trabalho foi aprovado pela Comissão de Ética para Análise de Projetos de Pesquisa (CAPPesq), da Diretoria Clínica do Hospital das Clínicas e da Faculdade de Medicina da Universidade de São Paulo (Protocolo nº 111/04).
Ensaios sorológicos. As amostras foram submetidas ao teste ortho HTLV-1/HTLV-2 Ab Capture ELISA Test System (Ortho-Clinical Diagnostic Inc, Raritan, EUA). As amostras positivas foram submetidas ao teste de Western blot (WB) com o kit HTLV blot 2.4 GeneLabs Diagnostic (Cambridge, Singapure). As amostras foram consideradas positivas não tipadas quando apresentavam reatividade para as proteínas gag (p24 ou p19) e env (GD21). Amostras reativas para rgp46I e rgp46II foram consideradas HTLV-1, e HTLV-2, respectivamente. A ausência de bandas caracterizou o WB como negativo. Presença de bandas isoladas foram classificadas como WB indeterminado.
Foram também realizadas a detecção de anticorpos anticore do vírus da hepatite B (anti-HBc), antissuperfície do vírus da hepatite B (anti-HBs), antígeno de superfície do vírus da hepatite B (ag-HBs) pelo kit Hepanostika enzyme linked immunosorbent assay (ELISA) (Organon Teknika B.V., Boxtel, Holland), anticorpos contra o vírus da hepatite tipo C (anti-HCV) (Embrabio, Brazil), HCV confirmatório (InnoLia HCV Ab III Innogenetics, Belgium) e Treponema pallidum (Enzygnostâ Syphilis, Dade Behring, Marburg Germany) de acordo com as intruções de cada fabricante. Para detecção de anticorpos contra o herpes vírus humano tipo 8 (anti-HHV-8) utilizou-se a técnica de imunofluorescência indireta com visualização por microscopia dos antígenos de latência ou replicação viral conforme previamente publicado12.
Extração de ácido desoxirribonucléico. Todas as amostras positivas no teste de ELISA para HTLV foram submetidas à reação em cadeia da polimerase (PCR). O ácido desoxirribonucléico (DNA) foi extraído usando-se o Kit QIAamp Blood Extration (Qiagen, Chatsworth, CA, USA), de acordo com instruções do fabricante.
Todo DNA genômico extraído foi submetido à amplificação do gene da β-globina humana com os primers GH20 e PC0418 para avaliar a integridade do DNA e excluir a presença de inibidores de PCR.
Amplificação da região long terminal repeat do virus linfotrópico de células T humanas tipo 2. Para amplificação e sequenciamento da região long terminal repeat (LTR) do HTLV-2, foi aplicada a técnica de nested PCR, nas condições previamente descritas10 com os primers 194 (5'-CCTTACCCACTTCCCCTAGCGCTGA-3') e 831 (5'-GGGAAAGCCCGTGGATTTGCCCCAT-3') para a 1º amplificação e 290 (5'-AAAAGCGCAAGGACAGTTCAGGAGG-3') e 783 (5'-ATCCCGGACGAGCCCCCACTTGTTT-3') na segunda amplificação, gerando um fragmento de 493 pares de bases.
Amplificação da região tax do vírus linfotrópico de células T humanas tipo 2. Para se diferenciar os subtipos 2a e 2c, a região tax foi sequenciada. Um fragmento de aproximadamente 200pb, que contem a região do stop códon presente apenas no subtipo 2a, foi amplificado por PCR semi-nested com os primers pX105 (5'-GCTTTCCCCACCCATGACATG-3') e pX106 (5'-GGGCCGTGGTTTCAGTTCCTA-3') na 1º amplificação; e os primers pX106 e LS1 (5'-GAATACACCAACATCCCTGTC-3') na 2º amplificação sob as condições previamente descritas10.
Amplificação da região long terminal repeat do vírus linfotrópico de células T humanas tipo 1. Os produtos correspondentes a região LTR de HTLV-1 foram obtidos através da técnica de PCR semi-nested17, gerando um fragmento de 467pb, amplificado pelos primers 8255 (5'-TTGAAGAATACACCAACATCCC-3') e LTRU5E (5'-CGCAGTTCAGGAGGCACCAC-3') antisense, onde 2mL do produto de PCR inicial foram usados para a segunda amplificação, gerando um fragmento de 433pb com os primers 8255 e 420LTR (5'-GAACGCGACTCAACCGGCCGTGGAT-3').
Seqüenciamento de ácido desoxirribonucleico. Os produtos amplificados foram preparados para seqüenciamento de DNA a partir dos oligonucleotídeos da segunda amplificação sendo posteriormente purificados removendo-se o excesso de primers e dNTPs com o Kit QIAquick PCR purification (Qiagen Inc, Valência, CA, USA).
O sequenciamento foi realizado usando-se o kit BigDye Terminator (Versão 2.0; Applied Biosystems), no sistema de eletroforese em capilar ABI PRISM 3100 (Applied Biosystems).
Os dados dos fragmentos seqüenciados foram editados pelo programa Sequencher (Gene Code Corp., Ann Arbor, Mich.). Todas as seqüências foram checadas para contaminação através da procura pelo BLAST contra o banco de dados de seqüências de HTLV-1/2 e entre elas mesmas.
Método estatístico. As análises estatísticas foram feitas utilizando-se o pacote de programas Epi-info (version 6.04). Análises univariadas dos fatores de risco suspeitos para aquisição do HTLV foram feitas entre todos os indivíduos pelo teste do qui-quadrado com correção de Yate's ou com o teste de exatidão de Fisher, quando apropriado. Exatos intervalos de confiança (IC) binomiais para índices e exatos IC para odds ratios (ORs) foram usados para acessar a prevalência da infecção por HTLV e sua associação com os fatores de risco para HIV. As taxas de prevalência por grupos (como idade do grupo, número de parceiros sexuais) foram comparadas usando-se o teste do qui-quadrado Mantel-Haenszel para tendência linear. Para demonstrar a associação de fatores de risco individuais com a infecção por HTLV-1/2 utilizou-se o programa Epi-Info MVAWIN logistic regression (version 6.50). Variáveis com valor de P menor que 0.05 foram consideradas estatisticamente significativas.
Análises filogenéticas. As seqüências deste estudo foram alinhadas utilizando-se o programa Clustal W30 e editadas manualmente através do software BioEdit Sequence Alignment Editor (http://www.mbio.ncsu.edu/BioEdit/BioEdit.html).
Um total de 55 sequências de HTLV-1 correspondendo as posições 8325 a 8661 da cepa ATK, incluindo a sequência de um indivíduo envolvido neste estudo e várias sequências dos subtipos de HTLV-1 retiradas do GeneBank, correspondentes a região LTR, foram alinhadas e analisadas. Selecionou-se um modelo apropriado para estas sequências usando-se o teste de razão de verosimilhança como implementado no Modeltest v3.622. Os parâmetros do modelo escolhido (TrN+G) foram os seguintes: freqüência de equilíbrio nucleotídico, A = 0.2839, C = 0.2965, G = 0.2357, T = 0.1839; proporção de sítios invariáveis = 0.0; configuração da distribuição do parâmetro (γ) refletindo a taxa de variabilidade sítio a sítio de regiões variáveis = 0.4743; e valores da matriz R, R A C = 1.805, RA
C = 1.805, RA G = 11.7464 RA
G = 11.7464 RA T = RC
T = RC G = RG
G = RG T =1.0, e RC
T =1.0, e RC T = 6.1174. Uma matriz de distância foi calculada baseada neste modelo e usada na construção de uma árvore de máxima verosimilhança na versão 4.0b10 do programa phylogenetic analysis using parsimony (PAUP)24. Após a construção da árvore inicial obtida pelo método neighbor joining, uma procura heurística para verossimilhança foi realizada pelo algoritmo subtree pruning and regrafting (SPR) de ramo permutado.
T = 6.1174. Uma matriz de distância foi calculada baseada neste modelo e usada na construção de uma árvore de máxima verosimilhança na versão 4.0b10 do programa phylogenetic analysis using parsimony (PAUP)24. Após a construção da árvore inicial obtida pelo método neighbor joining, uma procura heurística para verossimilhança foi realizada pelo algoritmo subtree pruning and regrafting (SPR) de ramo permutado.
O parentesco de nossas seqüências de HTLV-2, em relação a diferentes seqüências referência de subtipos de HTLV-2, foi examinado.
O modelo apropriado Hasegawa, Kishino e Yano (HKY), para estas 40 sequências, incluindo nossos isolados de HTLV-2, foi selecionado usando-se o teste de razão de verossimilhança.
Os parâmetros para este modelo foram os seguintes: A = 0.1468, C = 0.3586, G = 0.2413, T = 0.2534. Entre os sítios a taxa de variação foi igual para todos.
RESULTADOS
Das 319 amostras, 24 (7,5%) foram positivas no teste de ELISA, dessas, 13 (54,2%) foram confirmadas como HTLV-2, duas (8,3%) como HTLV-1 por WB ou PCR, sete (29,2%) foram indeterminadas no WB, com PCR negativa, e duas (8,3%) amostras foram negativas em ambos os testes. Tendo em vista que a sensibilidade da PCR e WB são baixas para o HTLV-2, já que a amplificação do próvirus é bastante limitada em amostras de PBMC com baixo número de cópias32, e os testes de WB podem apresentar resultados duvidosos devido a inúmeros fatores tais como infecção com agente defectivo, mutações em segmentos de DNA que contêm epitopos imunodominantes7, bem como ao fato de se tratarem de pacientes imunodeprimidos, optamos por usar como critério de positividade na análise estatística os resultados obtidos pelo teste de ELISA que possui uma alta sensibilidade e especificidade. Todas as leituras de densidade ótica (DO) foram ao menos cinco vezes maiores que os valores de cut off (CO) estabelecidos pelo kit, com resultados de DO/CO variando de 5,1 a 11,9. Além disso, trata-se de um grupo de pacientes com alto risco e alta taxa de prevalência, sendo o valor preditivo positivo do teste de ELISA maior nesta situação.
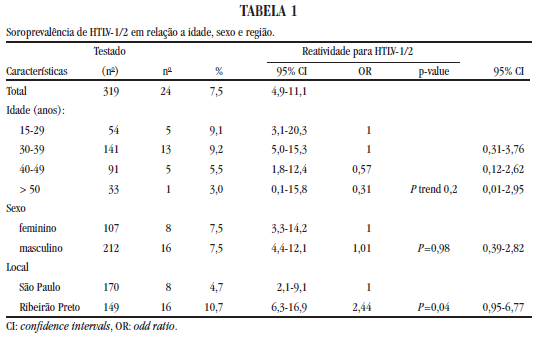
Na análise univariada, observamos que a prevalência de anti HTLV-1/2 não esteve ligada a idade (p = 0,2) ou sexo (p = 0,9), mas sim ao local de residência, com um índice de positividade de 10,7% na Cidade de Ribeirão Preto contra 4,7% na capital (p = 0,04: IC 95%) (Tabela 1).
A infecção por HTLV-1/2 foi fortemente associada com histórico de uso de drogas injetáveis (OR 10,92) e anticorpos para o vírus da hepatite C (OR 22,89) (p<0,001) (Tabelas 2 e 3). Não foi encontrada associação entre a presença de anticorpos anti-HTLV e fatores sexuais ou marcadores sorológicos de doenças sexualmente transmissíveis como anti Treponema pallidum, anti-HHV8 ou anticorpos anti-HBV (Tabela 3).
As análises estatísticas indicaram que o uso de drogas injetáveis é um importante fator de risco para a transmissão do HTLV-2 (OR 15,8: IC 95%: 6,2 - 40,7), mas não para o HTLV-1 entre nossa população de infectados por HIV-1, e que o subtipo HTLV-2c é um marcador útil para transmissão via uso de drogas injetáveis (p < 0,001).
Se utilizássemos como critério de positividade a reatividade para Western Blot e/ou PCR, a prevalência de HTLV-1 e HTLV-2 seria de 0,6% e 4,1%, respectivamente. Em nossa casuística, não foi encontrado nenhum caso de co-infecção com HTLV-1 e HTLV-2.
O sequenciamento das amostras positivas para PCR permitiu a subtipagem das mesmas. A amostra 244, única amplificada para HTLV tipo 1, foi classificada como pertencente ao genótipo 1a, o mais comum no Brasil28, também conhecido como subtipo Cosmopolita, suportado por um valor de bootstrap superior a 80% (Fígura 1 ).

Todas as 12 amostras HTLV tipo 2 foram classificadas como subtipo 2c. Além da análise filogenética da região LTR (Figura 2), também sequenciamos a região tax para verificação da perda do stop codon, pela substituição T por C na posição 8.203, que confere o ganho de 25 aminoácidos à cadeia polipeptídica do subtipo 2c em comparação ao subtipo 2a. O alinhamento e análise dos aminoácidos da região tax amplificada e sequenciada revelaram que em todas as amostras o stop códon estava ausente, confirmando o resultado da subtipagem fornecida pela análise da região LTR de HTLV-2.
DISCUSSÃO
Nos últimos 10 anos, a coinfecção HIV-1/HTLV vem emergindo como um problema de saúde pública mundial. O número de co-infectados na América do Sul e África está aumentando, bem como a co-infecção HIV-1/HTLV-2 nos Estados Unidos e Europa, frequentemente entre pessoas com histórico de uso de drogas injetáveis. Inúmeros estudos experimentais e epidemiológicos sobre a influência da infecção por HTLV na progressão da síndrome da imunodeficiência humana (AIDS) tem sugerido que a co-infecção pode promover o aumento da replicação do HIV-1 e acelerar o desenvolvimento da doença1 3. Entretanto, outros trabalhos não confirmaram esta hipótese e tal associação no tocante a progressão para a síndrome permanece pouco compreendida5.
No Brasil, a soroprevalência para HTLV-1/2 em indivíduos co-infectados por HIV-1 é em média 6,3%6, sendo no Rio de Janeiro registrada uma prevalência de 8,6% em usuários de drogas HIV positivos14, valores que não diferem significativamente daquele encontrado na casuística geral deste trabalho (7,5%), indicando boa consistência com os dados publicados na literatura. Entretanto, quando as prevalências sorológicas nas duas cidades estudadas foram analisadas individualmente, pode-se constatar uma taxa maior de infecção em Ribeirão Preto (10,7%) em relação a São Paulo, Capital (4,7%). Acreditamos que estes resultados relacionem-se ao fato de que na amostragem oriunda de Ribeirão Preto exista um número maior de indivíduos usuários de drogas intravenosa (UDIV), em comparação àqueles atendidos na Capital (p = 0,04). Estes dados são também condizentes com os já descritos em outros estudos, associando um índice elevado de infecção por HTLV-1/2 em UDIV portadores do HIV-111.
Com relação aos genótipos de HTLV-2, até então apenas o subtipo c havia sido descrito na população brasileira (incluindo índios da região amazônica, doadores de sangue, e usuários de drogas intravenosas de áreas urbanas), dado este também concordante com o encontrado neste trabalho onde pudemos constatar apenas a presença do subtipo c de HTLV-2. Entretanto, análises filogenéticas da região LTR de HTLV-2 de 12 doadores de sangue de Porto Alegre demonstraram que sete isolados segregaram com cepas HTLV-2b de índios Americanos, e cinco destes isolados segregaram com o subgrupo Brasileiro HTLV-2c. Tanto o HTLV-2c como 2b foram considerados endêmicos na região, e podem ter sido inseridos através de processos migratórios ancestrais humanos pela Costa do Pacífico ou via bacia Amazônica, sendo este o primeiro relato demonstrando a presença do HTLV-2b entre a população urbana do Brasil23.
Mais recentemente outro trabalho comprovou a presença do subtipo 2b também entre pacientes atendidos em clínicas da Cidade de São Paulo testados por ELISA e Western Blot para HTLV-1/220.
As informações sobre comportamento sexual e marcadores sorológicos para doenças sexualmente transmissíveis não apresentaram correlação com uma maior susceptibilidade a infecção por HTLV-1/2 ou pelo subtipo 2c, estando estes resultados em concordância com os previamente publicados11.
Através dos nossos dados, pudemos associar seguramente a infecção por HTLV-2 subtipo c ao uso de drogas injetáveis, com elevados índices de positividade para anticorpos anti HCV fortalecendo esta hipótese15 19, mostrando que este genótipo pode ser usado como um importante marcador para este fator de risco.
Recebido para publicação em 10/12/2008
Aceito em 29/04/2009
- 1. Beilke MA, Theall KP, O'Brien M, Clayton JL, Benjamin SM, Winsor EL, Kissinger PJ. Clinical outcomes and disease progression among patients coinfected with HIV and HTLV types 1 and 2. Clinical Infectious Diseases 39: 256-263, 2004.
- 2. Blank A, Yamaguchi K, Blattner W, Kiyokawa H, Seiki M, Watanabe T, Hino S, Takatsuki K. Report of the Fifth International Conference on Human Retrovirology: Human T-cell Lymphotropic Virus. Japanese Journal of Clinical Oncology 23: 134-142, 1993.
- 3. Brites C, Gusmão RA, Pedroso C, Netto EM, Pedral-Sampaio DB, Badaro R. Coinfection with HTLV-1 is associated with a shorter survival time for HIV-1-infected patients in Bahia, Brazil. Aids 15: 2053-2055, 2001.
- 4. Buggage RR. Ocular manifestations of human T-cell lymphotropic virus type 1 infection. Current Opinion in Ophthalmology 14: 420-425, 2003.
- 5. Casoli C, Pilotti E, Bertazzoni U. Molecular and cellular interactions of HIV-1/HTLV coinfection and impact on AIDS progression. AIDS Reviews 9: 140-149, 2007.
- 6. Catalan-Soares BC, Proietti FA, Carneiro-Proietti ABF. Os vírus linfotrópicos de células T humanos (HTLV) na última década (1990-2000): Aspectos epidemiológicos. Revista Brasileira de Epidemiologia 4: 81-95, 2001.
- 7. Costa JM, Segurado AC. Molecular evidence of human T-cell lymphotropic virus types 1 and 2 (HTLV-1 and HTLV-2) infections in HTLV seroindeterminate individuals from São Paulo, Brazil. Journal of Clinical Virology 44: 185-189, 2009.
- 8. Dennis G, Chitkara P. A case of human T lymphotropic virus type I-associated synovial swelling. Nature Clinical Practice Rheumatology 3: 675-680, 2007.
- 9. Dube DK, Sherman MP, Saksena NK, Bryz-Gornia V, Mendelson J, Love J, Arnold CB, Spicer T, Dube S, Glaser JB, Williams AE, Nishimura M, Jacobsen S, Ferrer JF, Del Pino N, Hiuruelas S, Poiesz BJ. Genetic heterogeneity in human T-cell leukemia/lymphoma virus type II. The Journal of Virology 67: 1175-1184, 1993.
- 10. Eiraku N, Novoa P, Ferreira MC, Monken C, Ishak R, Costa Ferreira O, Zhu SW, Lorenco R, Ishak M, Azvedo V, Guerreiro J, Oliveira MP, Loureiro P, Hammerschlak N, Ijichi S, Hall WM. Identification and characterization of a new and distinct molecular subtype of human T-cell lymphotropic virus type 2. The Journal of Virology 70: 1481-1492, 1996.
- 11. Etzel A, Shibata GY, Rozman M, Jorge ML, Damas CD, Segurado AA. HTLV-1 and HTLV-2 infections in HIV-infected individuals from Santos, Brazil: seroprevalence and risk factors. Journal of Acquired Immune Deficiency Syndromes 26: 185-190, 2001.
- 12. Ferreira S, Sanabani S, Reis AD, Chamone DF, Sabino EC. Human herpesvirus type 8 among Brazilian blood donors. Transfusion 43: 1764-1765, 2003.
- 13. Gonçalves DU, Proietti FA, Barbosa-Stancioli EF, Martins ML, Ribas JG, Martins-Filho OA, Teixeira-Carvalho A, Peruhype-Magalhaes V, Carneiro-Proietti AB. HTLV-1-associated myelopathy/tropical spastic paraparesis (HAM/TSP) inflammatory network. Inflamm Allergy Drug Targets 7: 98-107, 2008.
- 14. Guimaraes ML, Bastos FI, Telles PR, Galvão-Castro B, Diaz RS, Bongertz V, Morgado MG. Retrovirus infections in a sample of injecting drug users in Rio de Janeiro City, Brazil: prevalence of HIV-1 subtypes, and co-infection with HTLV-I/II. Journal of clinical virology 21: 143-151, 2001.
- 15. Hisada M, Chatterjee N, Zhang M, Battjes RJ, Goedert JJ. Increased hepatitis C virus load among injection drug users infected with human immunodeficiency virus and human T lymphotropic virus type II. The Journal of Infectious Diseases 188: 891-897, 2003.
- 16. Kalyanaraman VS, Sarngadharan MG, Robert-Guroff M, Miyoshi I, Golde D, Gallo RC. A new subtype of human T-cell leukemia virus (HTLV-II) associated with a T-cell variant of hairy cell leukemia. Science 218: 571-573, 1982.
- 17. Mahieux R, Ibrahim F, Mauclere P, Herve V, Michel P, Tekaia F, Chappey C, Garin B, Van Der Ryst E, Guillemain B, Ledru E, Delaporte E, de The G, Gessain A. Molecular epidemiology of 58 new African human T-cell leukemia virus type 1 (HTLV-1) strains: identification of a new and distinct HTLV-1 molecular subtype in Central Africa and in Pygmies. The Journal of Virology 71: 1317-1333, 1997.
- 18. Marchioli CC, Love JL, Abbott LZ, Huang YQ, Remick SC, Surtento-Reodica N, Hutchison RE, Mildvan D, Friedman-Kien AE, Poiesz BJ. Prevalence of human herpesvirus 8 DNA sequences in several patient populations. Journal of Clinical Microbiology 34: 2635-2638, 1996.
- 19. Morimoto HK, Caterino-De-Araujo A, Morimoto AA, Reiche EM, Ueda LT, Matsuo T, Stegmann JW, Reiche FV. Seroprevalence and risk factors for human T cell lymphotropic virus type 1 and 2 infection in human immunodeficiency virus-infected patients attending AIDS referral center health units in Londrina and other communities in Parana, Brazil. AIDS Research and Human Retroviruses 21: 256-262, 2005.
- 20. Novoa P, Oliveira ACP, Vergara MPP, Duarte AJS, Casseb J. Molecular characterization of human T-cell lymphotropic virus type 2 (HTLV-II) from people living in urban areas of Sao Paulo city: evidence of multiple subtypes circulation. Journal of Medical Virology 79: 182-187, 2007.
- 21. Poiesz BJ, Ruscetti FW, Gazdar AF, Bunn PA, Minna JD, Gallo RC. Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proceedings of the National Academy of Sciences 77: 7415-7419, 1980.
- 22. Posada D, Crandall KA. MODELTEST: testing the model of DNA substitution. Bioinformatics 14: 817-818, 1998.
- 23. Renner JD, Laurino JP, Menna-Barreto M, Schmitt VM. Molecular evidence of HTLV-II subtype B among an urban population living in South Brazil. AIDS Research and Human Retroviruses 22: 301-306, 2006.
- 24. Rogers JS, Swofford DL. A fast method for approximating maximum likelihoods of phylogenetic trees from nucleotide sequences. Molecular Systems Biology 47: 77-89, 1998.
- 25. Roman GC, Osame M. Identity of HTLV-I-associated tropical spastic paraparesis and HTLV-I-associated myelopathy. Lancet 1: 651, 1988.
- 26. Roucoux DF, Murphy EL. The epidemiology and disease outcomes of human T-lymphotropic virus type II. AIDS Reviews 6: 144-154, 2004.
- 27. Salemi M, Vandamme AM, Guano F, Gradozzi C, Cattaneo E, Casoli C, Bertazzoni U. Complete nucleotide sequence of the Italian human T-cell lymphotropic virus type II isolate Gu and phylogenetic identification of a possible origin of South European epidemics. Journal of General Virology 77: 1193-1201, 1996.
- 28. Segurado AA, Biasutti C, Zeigler R, Rodrigues C, Damas CD, Jorge ML, Marchiori PE. Identification of human T-lymphotropic virus type I (HTLV-I) subtypes using restricted fragment length polymorphism in a cohort of asymptomatic carriers and patients with HTLV-I-associated myelopathy/tropical spastic paraparesis from Sao Paulo, Brazil. Memórias do Instituto Oswaldo Cruz 97: 329-333, 2002.
- 29. Switzer WM, Black FL, Pieniazek D, Biggar RJ, Lal RB, Heneine W. Endemicity and phylogeny of the human T cell lymphotropic virus type II subtype A from the Kayapo Indians of Brazil: evidence for limited regional dissemination. AIDS Research and Human Retroviruses 12: 635-640, 1996.
- 30. Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG. The Clustal_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research 25: 4876-4882, 1997.
- 31. Vallinoto AC, Ishak MO, Azevedo VN, Vicente AC, Otsuki K, Hall WW, Ishak R. Molecular epidemiology of human T-lymphotropic virus type II infection in Amerindian and urban populations of the Amazon region of Brazil. Human Biology 74: 633-644, 2002.
- 32. Yao K, Hisada M, Maloney E, Yamano Y, Hanchard B, Wilks R, Rios M, Jacobson S. Human T lymphotropic virus types I and II western blot seroindeterminate status and its association with exposure to prototype HTLV-I. The Journal of Infectious Diseases 193: 427-437, 2006.
Datas de Publicação
-
Publicação nesta coleção
10 Ago 2009 -
Data do Fascículo
Jun 2009
Histórico
-
Aceito
29 Abr 2009 -
Recebido
10 Dez 2008