Resumos
Alguns isolados de rizóbio, além de fixarem o N2, são capazes de solubilizar fosfatos pouco solúveis, disponibilizando o P para as plantas e para si mesmos. No entanto, o Al e a acidez dos solos da Amazônia podem diminuir a população desses microrganismos. O presente trabalho avaliou a capacidade nodulífera, a tolerância à acidez e ao Al tóxico, bem como a capacidade de solubilizar fosfatos de Ca e de Al de 88 isolados de rizóbio de solos agrícolas, do município de Presidente Figueiredo, AM. Amostras de solo sob cultivos agrícolas foram coletadas e utilizadas como fontes de inóculo para plantas de feijão caupi. As amostras de solo continham isolados de rizóbio capazes de induzir a nodulação e incrementar a biomassa aérea do feijão caupi em condição ácida (pH 4,5) e álica (2cmol c Al. L-1). Os isolados de rizóbio presentes nas amostras de solo identificadas como INPA-PF2, INPA-PF3, INPA-PF4, INPA-PF5, INPA-PF13, INPA-PF15, INPA-PF22 e INPA-PF24 promoveram rendimentos de biomassa aérea superiores à testemunha. A tolerância à acidez foi apresentada por 25% dos isolados e apenas 23% apresentaram tolerância ao Al. O fosfato de Ca foi solubilizado por 39% dos isolados. No entanto, apenas um isolado apresentou alto índice de solubilização. A capacidade de solubilização de fosfato de Al foi identificada em 67% dos isolados. A maioria dos isolados de rizóbio que solubilizou fosfato de Ca (76,5% dos isolados) também solubilizou o fosfato de Al.
Leguminosa; nitrogênio; acidez; alumínio tóxico e solubilização de fosfato
Some isolated rhizobias, besides fixing N2, are also able to solubilize low soluble phosphates, making the P available both for plants and for themselves. Some factors like toxic Al and acidity, as in some Amazonian soils, may decrease the population of these microorganisms. The present study evaluated the nodulation ability, tolerance to acidity and toxic aluminum, as well as the ability to solubilize Ca and Al phosphates of rhizobia isolated from agricultural soils the municipality of from Presidente Figueiredo, AM. Samples of soil under agricultural cultivation were collected and used as a source of inoculum for the cowpea bean. Some rhizobia isolates were tested for tolerance to acidity and toxic Al, as well as to verify their abilities to solubilize phosphates. The soil samples contained rhizobia populations capable of inducing the nodulation and improving the aerial biomass of cowpea bean under acidity (pH 4,5) and alic (2 cmol c Al.L-1) conditions. The rhizobia population from the soil samples idnetified as INPA-PF2, INPA-PF3, INPA-PF4, INPA-PF5, INPA-PF13, INPA-PF15, INPA-PF22 and INPA-PF24 promoted increases of aerial biomass when compared to the control tratment (absence of inoculum). Twenty-five percent of the isolates were tolerant to acidity and 23% to Al. The Ca phosphate was solubilized by 39% of the isolated rhizobia. However, just one isolate presented high solubilization index. The Al phosphate solubilization ability was identified in 67% of the isolates. The majority of the isolates that solubilized Ca phosphate (76.5% of the lineages) also solubilized the Al phosphate.
Leguminosae; nitrogen; acidity; aluminum and phophate solubilization
AGRONOMIA
Características fisiológicas e ecológicas de isolados de rizóbios oriundos de solos ácidos e álicos de Presidente Figueiredo, Amazonas* * Pesquisa financiada pelo BASA S.ª e INPA/MCT/PPI 2 3870.
Physiological and ecological characteristics of rhizobio isolated deriving of acid and alic soils of Presidente Figueiredo, Amazonas State
Francisco Adilson dos Santos HaraI; Luiz Antonio de OliveiraII
I Professor Adjunto I, DEAS/ FCA/UFAM
II Pesquisador CPCA/INPA, bolsista do CNPA, prof. UFAM e UEA
RESUMO
Alguns isolados de rizóbio, além de fixarem o N2, são capazes de solubilizar fosfatos pouco solúveis, disponibilizando o P para as plantas e para si mesmos. No entanto, o Al e a acidez dos solos da Amazônia podem diminuir a população desses microrganismos. O presente trabalho avaliou a capacidade nodulífera, a tolerância à acidez e ao Al tóxico, bem como a capacidade de solubilizar fosfatos de Ca e de Al de 88 isolados de rizóbio de solos agrícolas, do município de Presidente Figueiredo, AM. Amostras de solo sob cultivos agrícolas foram coletadas e utilizadas como fontes de inóculo para plantas de feijão caupi. As amostras de solo continham isolados de rizóbio capazes de induzir a nodulação e incrementar a biomassa aérea do feijão caupi em condição ácida (pH 4,5) e álica (2cmolc Al. L-1). Os isolados de rizóbio presentes nas amostras de solo identificadas como INPA-PF2, INPA-PF3, INPA-PF4, INPA-PF5, INPA-PF13, INPA-PF15, INPA-PF22 e INPA-PF24 promoveram rendimentos de biomassa aérea superiores à testemunha. A tolerância à acidez foi apresentada por 25% dos isolados e apenas 23% apresentaram tolerância ao Al. O fosfato de Ca foi solubilizado por 39% dos isolados. No entanto, apenas um isolado apresentou alto índice de solubilização. A capacidade de solubilização de fosfato de Al foi identificada em 67% dos isolados. A maioria dos isolados de rizóbio que solubilizou fosfato de Ca (76,5% dos isolados) também solubilizou o fosfato de Al.
Palavras-chave: Leguminosa, nitrogênio, acidez, alumínio tóxico e solubilização de fosfato.
ABSTRACT
Some isolated rhizobias, besides fixing N2, are also able to solubilize low soluble phosphates, making the P available both for plants and for themselves. Some factors like toxic Al and acidity, as in some Amazonian soils, may decrease the population of these microorganisms. The present study evaluated the nodulation ability, tolerance to acidity and toxic aluminum, as well as the ability to solubilize Ca and Al phosphates of rhizobia isolated from agricultural soils the municipality of from Presidente Figueiredo, AM. Samples of soil under agricultural cultivation were collected and used as a source of inoculum for the cowpea bean. Some rhizobia isolates were tested for tolerance to acidity and toxic Al, as well as to verify their abilities to solubilize phosphates. The soil samples contained rhizobia populations capable of inducing the nodulation and improving the aerial biomass of cowpea bean under acidity (pH 4,5) and alic (2 cmolc Al.L-1) conditions. The rhizobia population from the soil samples idnetified as INPA-PF2, INPA-PF3, INPA-PF4, INPA-PF5, INPA-PF13, INPA-PF15, INPA-PF22 and INPA-PF24 promoted increases of aerial biomass when compared to the control tratment (absence of inoculum). Twenty-five percent of the isolates were tolerant to acidity and 23% to Al. The Ca phosphate was solubilized by 39% of the isolated rhizobia. However, just one isolate presented high solubilization index. The Al phosphate solubilization ability was identified in 67% of the isolates. The majority of the isolates that solubilized Ca phosphate (76.5% of the lineages) also solubilized the Al phosphate.
KeyWords: Leguminosae, nitrogen, acidity, aluminum and phophate solubilization.
INTRODUÇÃO
Os solos de terra firme da Amazônia possuem alta acidez e concentração de alumínio tóxico, e ainda são deficientes em nitrogênio e fósforo (Sanchez et al., 1982), sendo assim, torna-se necessária a aplicação de grandes quantidades de corretivos e adubos químicos para melhorar a condição do solo para a agricultura. No entanto, a calagem e a adubação química na Amazônia são bastante onerosas para os agricultores locais, geralmente pouco capitalizados (Noda, 1998), em função dos custos dos produtos, importados de outras regiões do país. Essas dificuldades para o desenvolvimento da agricultura na Amazônia justificam o desenvolvimento de sistemas agrícolas alternativos que possam garantir, ao mesmo tempo, a sustentabilidade da população regional e a preservação do meio ambiente.
A utilização da simbiose leguminosa-rizóbio é uma das alternativas mais promissoras para a agricultura de baixos insumos nas regiões tropicais e subtropicais. Além da capacidade de fixar nitrogênio, contribuindo para o balanço desse nutriente nos ecossistemas, alguns isolados de rizóbio são capazes de solubilizar fosfatos pouco solúveis, disponibilizando o fósforo para as plantas e para si mesmos (Chabot et al., 1998). O rizóbio, e algumas espécies de bactérias do gênero Pseudomonas e Bacillus, estão entre os microrganismos mais eficientes em solubilizar fosfatos inorgânicos pouco solúveis, presentes no solo (Rodriguez & Fraga, 1999).
Embora a pesquisa tenha mostrado que os rizóbios podem tornar as plantas menos dependentes da aplicação de fertilizantes nitrogenados e fosfatados, fatores do solo predominantes na Amazônia, como pH ácido (Bonetti et al., 1984) e alta concentração de alumínio tóxico (Sanchez et al., 1982) podem diminuir a população desses microrganismos no solo (Wood, 1995). No entanto, alguns isolados apresentam mecanismos de tolerância a esses fatores (Watkin et al., 2000).
Apesar da importância prática e econômica do uso da associação leguminosa-rizóbio, poucos estudos foram realizados, principalmente quanto aos fatores químicos dos solos regionais que afetam a bactéria, a planta e a simbiose entre ambos. Devido à diversidade de espécies, microrganismos e condições regionais, esses estudos devem ser intensificados para que se compreenda melhor esta associação, a fim de favorecer o aumento da eficiência e da viabilidade ecológica e econômica de sistemas agrícolas e agroflorestais implantados na Amazônia.
A seleção de isolados de rizóbio que possuam alta capacidade fixadora de nitrogênio, resistência à acidez e ao alumínio tóxico, e que sejam capazes de solubilizar fosfatos, é fundamental para a produção e utilização de inoculantes pelos agricultores para o incremento na produção de leguminosas na região.
O presente trabalho teve como objetivo avaliar a capacidade nodulífera e fixadora de nitrogênio de isolados de rizóbio, avaliar a tolerância à acidez e ao alumínio tóxico, e a capacidade de solubilizar fosfatos de cálcio e de alumínio de isolados de rizóbio oriundos de solos agrícolas ácidos do município de Presidente Figueiredo, Amazonas.
MATERIAL E MÉTODOS
Avaliação de isolados de rizóbio em amostras de solos
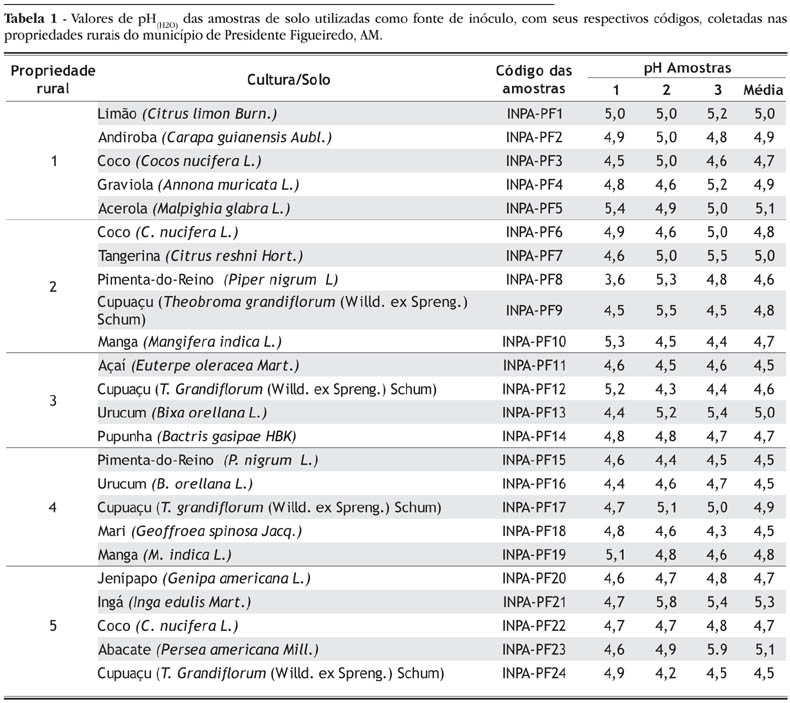
Em cinco propriedades rurais do município de Presidente Figueiredo, Estado do Amazonas (longitude 60º W de Greenwich e latitude 2º Sul), quatro a cinco áreas com diferentes cultivos agrícolas foram selecionadas e, de cada uma delas, retiraram-se três amostras superficiais (0 20 cm) de solos, obtendo-se um total de 72 amostras. Em todas as propriedades, o solo foi classificado como Latossolo amarelo. Os valores de pH(H2O) das amostras de solo são apresentados na Tabela 1.
Foram retiradas subamostras de 60 gramas de solo de cada amostra, para serem usadas como fonte de inóculo para plantas de caupi (Vigna unguiculata L. Walp., cultivar IPEAN V69) e para a avaliação da população de rizóbio em um experimento conduzido em casa-de-vegetação, na Coordenação de Pesquisa em Ciências Agronômicas do INPA, em Manaus.
As subamostras de solo foram colocadas sobre e no centro da areia estéril (autoclavada a 120ºC por duas horas) em vasos esterilizados com capacidade para 3 kg, e sobre elas foram semeadas oito sementes de caupi por vaso, para que, ao germinarem, as raízes das plantas entrassem em contato com isolados de rizóbio presentes no solo. No sétimo dia após a germinação, fez-se um desbaste deixando-se três plantas por vaso. A irrigação foi feita de acordo com a necessidade, usando uma solução nutritiva ácida e álica (pH 4,5 + 2 cmolc Al.L-1) modificada (Specht et al., 1956; Smith et al., 1983), segundo Oliveira (1988), para representar as condições encontradas na maioria dos solos da Amazônia, em relação a esses aspectos.
No período da floração, as plantas foram seccionadas na base do caule, e levadas para secar a 60ºC até peso constante para determinação da matéria seca da parte aérea (MSPA). As raízes foram coletadas para determinação do número de nódulos (NN). O peso dos nódulos secos (PNS) foi obtido após secagem do material, da mesma forma que para a parte aérea.
O delineamento experimental utilizado foi o de blocos ao acaso com 25 tratamentos, sendo 24 referentes as diferentes áreas de coleta de solo consideradas como fontes de inóculos, mais um tratamento testemunha, com os vasos contendo areia estéril sem amostra de solo. Foram utilizadas três repetições por tratamento, perfazendo um total de 75 parcelas experimentais (vasos). Para verificar a significância dos tratamentos, foi realizada a análise de variância pelo teste F-Snedecor (5 e 1%) e, para as características que tiveram efeitos significativos, foi realizado o teste de Tukey (5%) para se verificar a diferença entre tais tratamentos. Os dados referentes ao número de nódulos foram transformados em raiz quadrada (X + 0,5) para a análise estatística.
Isolamento de rizóbio e teste de tolerância à acidez e ao alumínio tóxico
Das raízes das plantas do experimento anterior, foram selecionados três a cinco maiores nódulos com coloração intensa avermelhada, indicando presença de leghemoglobina e nitrogenase, para os isolamentos de rizóbio, segundo a metodologia de Somasegaran & Hoben (1985). De cada nódulo foi obtido um isolado, que foi repicado para o meio extrato de levedura, manitol e ágar (YMA) (Vincent, 1970), com pH 6,5 em placa de Petri. Os isolados foram purificados e armazenados em tubos de ensaio contendo YMA à temperatura de 28ºC.
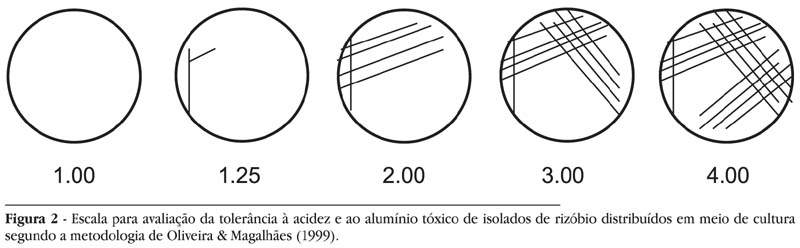
Para a avaliação da tolerância à acidez e ao alumínio tóxico, os isolados foram transferidos para o meio YMA, com pH 4,5, com pH 4,5 + 2,0 cmolc Al.L--1 e com pH 6,5. O alumínio foi adicionado na forma de AlCl3. Foram utilizadas quatro repetições para cada meio utilizando-se o método de riscagem proposto por Oliveira & Magalhães (1999) (Figura 1), sendo que cada placa foi marcada ao meio, e cada metade da placa continha uma repetição, estabelecendo-se então, duas repetições por placa de Petri. Com o objetivo de verificar a alteração do pH do meio pelas bactérias, foram acrescentados os indicadores bromocresol verde (20 ml.l-1) nos meios com pH 4,5 e pH 4,5 + Al e azul de bromotimol (5 ml.l-1) no meio com pH 6,5.
As avaliações foram feitas a cada três dias, durante um período de 18 dias, no qual as bactérias foram mantidas em laboratório a uma temperatura de 23 - 28ºC. De acordo com o desenvolvimento das colônias nas quatro zonas da placa (Figura 1), foram dados valores para o crescimento para cada isolado variando de 1 (sem crescimento visível na placa) a 4 (máximo crescimento em todas as zonas), segundo a escala apresentada na Figura 2. Com base no crescimento em placas de Petri, os isolados foram classificados como sensíveis, medianamente tolerantes ou tolerantes (Tabela 2).
Teste de solubilização de fosfatos de cálcio e de alumínio
Foram instalados dois experimentos, sendo um para verificar a capacidade dos isolados de solubilizar fosfato de cálcio e outro para a solubilização de fosfato de alumínio. No primeiro experimento foi utilizado o meio desenvolvido por Sylvester-Bradley et al. (1982), contendo 10 g de glicose, 2 g de extrato de levedura e 18 g de ágar por litro de meio. Foram acrescentadas as soluções A, contendo 5 g de K2HPO4 em 50 mL de água e B, contendo 10g de CaCl2 em 100 mL de água, para a formação do fosfato de cálcio precipitado. Em seguida, ajustou-se o pH para 6,5. No segundo experimento foi utilizado um meio, com pH 4,5, para verificar a solubilização de fosfato de alumínio, contendo 10 g de manitol, 2 g de extrato de levedura, 6 g de K2HPO4 e 18 g de ágar por litro de meio, acrescido de 5,34 g de AlCl3, para formar o precipitado de fosfato de alumínio. O AlCl3 foi autoclavado separadamente antes da sua adição ao meio.
Os isolados de rizóbio, crescidos em meio YMA (pH 6,5) foram repicados para os dois meios de solubilização com o auxílio de uma alça de platina, retirando-se uma porção do isolado armazenado em tubo de ensaio, realizando-se um leve toque no meio de cultura para cada colônia. Foram estabelecidas cinco colônias por placa, e duas placas por isolado.
O diâmetro do halo de solubilização, percebido como uma área translúcida em torno da colônia, foi medido a cada três dias, utilizando-se um paquímetro digital por um período de 18 dias. A partir dessas medidas, foram obtidos os Índices de Solubilização (IS) para cada isolado através da fórmula: IS = f Halo (mm)/ f Colônia (mm) (Berraquero et al., 1976).
Com base nos índices de solubilização, os isolados foram classificados como isolados com baixa (IS<2), média (2 £ IS < 4) e alta (IS>4) capacidade de solubilização. De acordo com o início da solubilização, os isolados foram classificados como precoces, quando o início da solubilização se deu até o terceiro dia, tardios, com início da solubilização a partir do terceiro dia e não solubilizadores, aqueles que não apresentaram solubilização visível até o décimo oitavo dia de avaliação.
RESULTADOS E DISCUSSÃO
Infectividade e eficiência dos isolados de rizóbio dos solos
Os isolados de rizóbio presentes nas amostras de solo identificadas como INPA-PF2, INPA-PF3, INPA-PF4, INPA-PF5, INPA-PF13, INPA-PF15, INPA-PF22 e INPA-PF24 promoveram rendimentos de biomassa do caupi estatisticamente superiores ao obtido no tratamento testemunha (Tabela 3). A deficiência de N na testemunha foi detectada visualmente, com as plantas apresentando clorose generalizada e menor crescimento vegetativo.
Todas as fontes de inoculo superaram estatisticamente a ausência de inoculação em relação a nodulação. As plantas inoculadas com os isolados de rizóbio INPA-PF1, INPA-PF5, INPA-PF7, INPA-PF10, INPA-PF15, INPA-PF17, INPA-PF18, INPA-PF19, INPA-PF20, INPA-PF22 apresentaram os maiores números de nódulos (Tabela 3).
O ganho da matéria seca do caupi ocasionado pelos isolados de rizóbio das amostras de solo identificadas como INPA-PF2, INPA-PF3, INPA-PF4, INPA-PF5, INPA-PF13, INPA-PF15, INPA-PF22 e INPA-PF24, mesmo na presença de uma nodulação fraca, pode ser devido a uma maior eficiência de alguns dos isolados presentes nos nódulos das plantas em relação às suas porcentagens de ocorrência (Singleton & Stockinger, 1983).
A fonte de inóculo INPA-PF19 foi a que proporcionou maior peso dos nódulos secos, embora tenha diferido estatisticamente apenas das fontes de inóculo INPA-PF9, INPA-PF10, INPA-PF11 e INPA-PF12 (Tabela 3). Nem todas as plantas que apresentaram os maiores números e peso dos nódulos secos tiveram os maiores rendimentos de matéria seca, indicando diferenças entre os isolados de rizóbia na capacidade fixadora de nitrogênio (Tabela 3). Essa afirmativa é comprovada pelos baixos valores de correlação obtidos entre a produção de matéria seca das plantas e número de nódulos (r=0,46) e peso dos nódulos (r=0,43), resultado semelhante ao obtido por Brose (1994) com o trevo.
Tolerância à acidez e ao alumínio tóxico
As tabelas dos resultados foram apresentadas apenas com o 3º, 6º e 18º dia de crescimento para facilitar a visualização dos dados. Entre os 88 isolados oriundos dos nódulos coletados do experimento de infectividade e com base na escala de valores da Tabela 2, 45,5% (40 isolados) apresentaram alto crescimento, 21,5% baixo e 33% crescimento médio, no pH 6,5 (Tabela 4). Os isolados que apresentaram baixo crescimento no pH 6,5 também se comportaram desta maneira no pH 4,5 e no pH 4,5 + AL (Tabela 2).
A acidez do meio de cultura afetou o crescimento dos isolados e as respostas variaram entre os mesmos (Tabela 4), da mesma forma como foi observado por Brockwell et al. (1995) e Oliveira & Magalhães (1999). Foi verificado que 25% dos isolados (22) apresentaram escore de crescimento acima de três (Tabela 4), o que permite inferir que são tolerantes à acidez, com base na escala de valores da Tabela 2. Essa tolerância ao pH ácido em rizóbio depende da habilidade em manter o pH intracelular entre 7,2 e 7,5 quando o pH externo é ácido (Graham et al., 1994). A proporção de rizóbio oriundos de solos ácidos, tolerantes à acidez, foi baixa nesse trabalho (Tabela 4), quando comparada ao encontrado por Ramos et al. (1987), que foi de 75% de isolados tolerantes ao pH 4,6, e por Hara & Oliveira (dados não publicados), que encontraram 92% de isolados tolerantes ao pH 4,5 entre 36 extraídos de solos ácidos do município de Rio Preto da Eva-AM.
Entre os isolados tolerantes à acidez, onze apresentaram máximo crescimento a partir do sexto dia (Tabela 4). O critério tempo de crescimento pode também ser usado para a seleção em relação à tolerância à acidez, tendo em vista que os isolados que apresentaram maior escore de crescimento em menor período de tempo, podem ser considerados como mais tolerantes a esse fator. Resultado semelhante foi obtido por Oliveira & Magalhães (1999) analisando os isolados INPA 048, 078 e 671, que apresentaram estabilização de crescimento máximo no nono dia de avaliação (Oliveira & Magalhães, 1999).
Foi detectado que 24% dos isolados apresentaram tolerância média e 51% dos isolados, apresentaram sensibilidade à acidez (Tabela 4). A exposição de isolados de rizóbio à acidez diminui o crescimento, sugerindo que alguns processos citoplasmáticos da bactéria são sensíveis à esse fator (Hungria & Vargas, 2000). Em meio ácido há uma diminuição da síntese de proteínas pelas bactérias, o que também pode afetar o crescimento bacteriano (Aarons & Graham, 1991).
O alumínio foi mais limitante para o crescimento bacteriano que a acidez (Tabela 4), corroborando com as observações de Lesueur et al. (1993). Do total de 88 isolados, apenas 20 (23%) apresentaram escores de crescimento maiores que três no 18º dia de crescimento, sendo consideradas como tolerantes ao alumínio (Tabela 4).
O meio com pH 6,5 foi acidificado por 59 isolados (66%) (Tabela 5). Entre esses, 38 apresentaram escore de crescimento abaixo de 3 (Tabela 3), indicando que a diminuição do pH pode estar afetando o crescimento dessas bactérias, embora as mesmas sejam oriundas de solos ácidos (Tabela 1).
Entre os isolados tolerantes à acidez, cinco (INPA-PF5a, INPA-PF15a, INPA-PF19b, INPA-PF19c e INPA-PF22d) foram capazes de alcalinizar o meio ácido (Tabela 5), o que pode ser considerado como um mecanismo de adaptação a essa condição de estresse. A elevação do pH do meio é decorrente do metabolismo da bactéria que, ao atuar sobre o substrato em busca de energia, libera substâncias básicas que aumentam o pH externo (O'hara et al., 1989). Os demais isolados (14), que foram capazes de apresentar escore superior a três e que não alcalinizaram o meio, apresentaram alguma outra adaptação ecoquímica à acidez, uma delas podendo ser a manutenção do pH interno elevado da própria bactéria.
O meio com pH 4,5 + Al foi alcalinizado por 16 isolados, entre eles, INPA-PF5a, INPA-PF5b, INPA-PF5e, INPA-PF19c e INPA-PF22d (Tabela 5), os quais apresentaram tolerância a esses fatores, com escores de crescimento maiores que 3. Entre os isolados que alcalinizaram o meio pH 4,5 + Al, sete apresentaram escores entre 2,06 a 3,00 (Tabelas 4 e 5), o que permite caracterizá-los como de tolerância média segundo a escala de avaliação (Tabela 2). A diminuição do pH desse meio foi verificada com 21 isolados (Tabela 5), sendo, que entre esses, INPA-PF3a, INPA-PF15c, INPA-PF24a apresentaram tolerância tanto à acidez como ao alumínio (Tabela 4).
Os isolados tolerantes ao alumínio que aumentaram o pH do meio, provavelmente causaram complexação do alumínio, transformando-o numa forma não tóxica para as células. Já os isolados que acidificaram o meio, provavelmente desenvolveram um mecanismo de tolerância parecido com o que foi observado por Kawai et al (2000), no qual a diminuição da concentração de monômeros de alumínio (Al3+), que é a forma mais prejudicial deste elemento, diminui com a diminuição do pH, reduzindo o seu efeito tóxico. No entanto, esse efeito não foi observado para os isolados desse trabalho, que acidificaram o meio na presença do alumínio tóxico, mas não se comportaram como tolerantes a esse elemento. Os isolados tolerantes ao alumino apresentaram acentuada produção de goma, indicando a liberação de exopolissacarídeos que podem neutralizar o alumínio tóxico.
Outros mecanismos de tolerância ao alumínio, encontrados em isolados de rizóbios são citados na literatura, tais como a) diminuição da quantidade de cargas negativas na superfície celular diminuindo a ligação com o alumínio (Bushby, 1990); b) elevação do pH interno da célula (O'hara et al.,1989); c) complexação do alumínio por polissacarídeos (Appana, 1988; Flis et al., 1993); d) acumulação de fosfato inorgânico no interior da célula (Mukherjee & Asanuma, 1999) neutralizando o efeito do alumínio pela formação de complexo insolúvel biologicamente não tóxico (Blamey et al ,1983). Van Veen et al. (1994), por outro lado, observaram que Acinetobacter johsonii utiliza um sistema de fluxo de complexos Al-P para fora da célula, como mecanismo de tolerância ao alumínio.
O efeito tóxico do alumínio causou inibição do crescimento em 77% dos isolados, sendo que 27% apresentaram crescimento médio (escore 2,06 - 3,00) e 50% crescimento baixo (sensíveis) (Tabela 4). A proporção de bactérias tolerantes ao efeito conjunto da acidez + alumínio (20 isolados) não foi tão diferente da proporção de bactérias tolerantes somente à acidez (22 isolados) (Tabela 4). É importante destacar que nem todas os isolados tolerantes à acidez foram tolerantes ao pH 4,5 + Al. Resultados semelhantes foram obtidos por Marriel (1984) e Rosalem & Lindstron (1997). Entre as tolerantes à acidez, 14 foram tolerantes também ao alumínio (Tabela 4).
Usando-se uma seleção mais rigorosa, observou-se que onze isolados entre os tolerantes ao pH 4,5 + Al tiveram seu crescimento estabilizado no sexto dia (Tabela 4), o que permite confirmar as suas indicações para serem testadas em outras etapas da seleção, inclusive nos solos ácidos e álicos regionais.
Geralmente, os isolados obtidos de solos mais ácidos são mais tolerantes à acidez (Cline & Senwo, 1994). Ramos et al. (1987) observaram que apenas 17% dos isolados de solos que sofreram calagem apresentaram tolerância à acidez. Isso reforça as observações de Van Rossum et al. (1994) de que a seleção de isolados para uma nodulação eficiente em condições adversas do solo é melhor realizada entre isolados que foram naturalmente expostos a esses estresses, como é caso dos isolados utilizados neste trabalho.
Solubilização de fosfato de cálcio e alumínio
Na Tabela 6 observa-se que 34 isolados (39%) solubilizaram o fosfato de cálcio, sendo que apenas o isolado INPAPF7a apresentou alto índice de solubilização. Dentre esses, 28 se comportaram como precoces e seis como tardios. Piex et al. (2001) encontraram isolados de rizóbios efetivos na solubilização de fosfato de cálcio em laboratório, mas a eficiência de solubilização variou entre os isolados.
A capacidade dos isolados de rizóbio solubilizarem o fosfato de cálcio está relacionada com a diminuição do pH do meio pelos ácidos orgânicos (Mikanova & Kubat, 1999; Mikanova, 2000). Este resultado, obtido em laboratório indica a possibilidade de se utilizarem os isolados de rizóbio, capazes de solubilizar fosfatos para incrementar a concentração de fósforo solúvel na rizosfera e disponibilizá-lo para as plantas. O ácido 2-cetoglucâmico, envolvido na solubilização do fosfato de cálcio, é produzido por alguns isolados de rizóbio (Halder et al. 1990). Alguns trabalhos têm mostrado o efeito positivo da inoculação de plantas com bactérias solubilizadoras de fosfato sobre cultivos agrícolas. Chabot et al. (1988) observaram um incremento no rendimento da matéria seca do milho, assim como Mikanova & Kubát (1999) e Piex et al. (2001) verificaram aumento na produtividade de ervilha, soja e feijão, respectivamente, quando inoculados com rizóbios solubilizadores de fosfato de cálcio.
Entre os 88 isolados avaliados, 67% (59) apresentaram capacidade de solubilização de fosfato de alumínio (Tabela 7). Esta predominância de isolados solubilizadores de fosfato de alumínio, em relação aos solubilizadores de fosfato de cálcio, pode estar relacionada ao fato do alumínio e do fosfato ligado a ele predominam nos solos de onde os isolados foram extraídos. Entre esses isolados solubilizadores, 15 comportaram-se como tardios, solubilizando o fosfato depois do sexto dia e 44 como precoces (Tabela 7). Todos os isolados que apresentaram capacidade de solubilizar fosfato de alumínio, no entanto, apresentaram baixa solubilização (Tabela 7), com I.S. pouco acima de 1.
Os dados das Tabelas 6 e 7 evidenciam que 76,5% dos isolados que solubilizaram o fosfato de cálcio também solubilizaram o fosfato de alumínio. Este resultado diverge dos encontrados por Toro et al. (1996) e Silva Filho & Vidor (2000), que identificaram uma baixa ocorrência de isolados que solubilizassem fosfato de cálcio e o de alumínio. Silva Filho & Vidor (2000) citam que a baixa frequência de solubilizadoras de fosfato de alumínio se deve ao fato de inicialmente os isolados serem obtidos em meios contendo o fosfato de cálcio para, depois, eles serem avaliados na presença de fosfato de alumínio. Essa seqüência no processo de isolamento poderia levar à maior seletividade de microrganismos capazes de solubilizar fosfato de cálcio em detrimento de fosfato de alumínio. Essa grande presença de solubilizadores de fosfato de alumínio encontrada nesse trabalho, pode estar relacionada ao fato de que essa forma de fosfato é a predominante nos solos tropicais (Raij, 1991).
Ilmer & Schinner (1995) citam que a produção de ácidos orgânicos por microrganismos, bem como a liberação de íons de H+, são importantes mecanismos para solubilizar o AlPO4. O citrato é o principal ácido orgânico envolvido na complexação do alumínio (Fulton et al., 1989). Até onde se sabe, os trabalhos envolvendo a solubilização de fosfato de alumínio são escassos e nenhum, até o momento, foi realizado para investigar o papel da população de rizóbio neste processo, embora nas condições tropicais e subtropicais, sejam as formas predominantes de fosfato (Vieira, 1988).
Após a solubilização, o alumínio é liberado para o meio na forma monomérica (Al3+), o que poderia causar toxicidade aos isolados. No entanto, o fósforo oriundo da solubilização do AlPO4 é suficiente para suprimir um incremento no efeito tóxico do alumínio decorrente da solubilização (Ilmer et al., 1995).
Entre os isolados tolerantes à acidez (n=21), sete foram capazes de solubilizar o fosfato de cálcio (Tabelas 4 e 6) e 15 solubilizaram o fosfato de alumínio (Tabelas 4 e 7). Dentre esses, seis solubilizaram as duas formas de fosfato. Entre os isolados que foram tolerantes ao alumínio (n=19) (Tabela 4), seis solubilizaram o fosfato de cálcio (Tabela 6) e 14 solubilizaram o fosfato de alumínio (Tabela 7), sendo que cinco solubilizaram as duas formas de fosfato. Estes resultados mostram uma tendência de haver uma relação entre a capacidade dos isolados em crescerem em meio ácido e álico com a capacidade de solubilizar o fosfato de alumínio.
A capacidade de solubilizar fosfatos e de promover o crescimento das plantas evidencia o quanto é promissora a utilização dessas bactérias como inoculantes em cultivos agrícolas, tanto para leguminosas, como para não-leguminosas. Há a necessidade de se aprofundar o estudo do uso de rizóbio como inoculante, enfocando os mecanismos de sobrevivência nos solos da região, para que se possam selecionar isolados não só capazes de tolerar a acidez e o alumínio tóxico, mas que também possam solubilizar o P indisponível, além, evidentemente, de fixar o N2 atmosférico.
CONCLUSÕES
a) As amostras de solo continham isolados de rizóbio capazes de induzir a nodulação e incrementar a biomassa aérea do feijão caupi em condições de acidez e teores de alumínio elevados;
b) O alumínio foi mais limitante que a acidez para o crescimento do isolados de rizóbio;
c) Os isolados apresentaram diferenças metabólicas de adaptação à acidez mais o alumínio. Do total de 88 isolados, cinco alcalinizaram e três acidificaram o meio de cultura ao consumir o manitol como fonte de carbono;
d) O fosfato de cálcio foi solubilizado por 39% dos isolados (34), mas apenas um apresentou alto índice de solubilização;
e) A capacidade de solubilização de fosfato de alumínio foi identificada em 67% dos isolados (59), sendo que todos apresentaram baixa capacidade de solubilização;
f) Entre os 20 isolados que foram tolerantes ao alumínio, 15 foram capazes de solubilizar o fosfato de alumínio;
g) A maioria dos isolados de rizóbio que solubilizou fosfato de cálcio (76,5%) também solubilizou o fosfato de alumínio.
BIBLIOGRAFIA CITADA
Recebido em 23/06/03
Aceito em 13/07/04
- Aarons, S.R.; Graham, P.H. 1991. Response of Rhizobium leguminosarum bv phaseoli to acidity. Pl. Soil, 13(4/1): 145-151.
- Appana, V.D. 1988. A comparative study of exopolysaccharide synthesis in Rhizobium meliloti JJ-I exposed to aluminum and iron. Microbios, 55: 33-39.
- Berraquero, F.R.; Baya, A.M.; Cormenzana, A.R. 1976. Establecimiento de indices para el estudio de la solubilizacion de fosfatos por bacterias del suelo. Ars Pharmaceutica, 17(4): 399-406.
- Blamy, F.P.C.; Edwards, D.G.; Asher, C.J. 1983. Effects of aluminum, OH:Al and P:Al molar rations and ionic strength on soybean root elongation in solution culture. Soil Science, 136: 197-207.
- Bonetti, R.; Oliveira, L.A.; Magalhães, F.M.M. 1984. Rhizobium spp. populations, and mycorrhizal associations in some plantations of forest tree species. Pesq. Agrop. Bras., 19: 137-142.
- Brockwell, J.; Bottomley, P.J.; Thies, J.E. 1995. Manipulation of rhizobia microflora for improving legume productivity and soil fertility: a critical assessment. Plant Soil, 174: 143-180.
- Brose, E. 1994. Rhizobia selection for white clover in acid soil. Pesq. Agrop. Bras, 29(2): 281-285.
- Bushby, H.V.A. 1990. The role of bacterial surface charge in the ecology of root nodule bacteria: a hypothesis. Soil Biol. Biochem, 22(1): 1-9.
- Chabot, R.; Beauchamp, C.J.; Kloepper, J.W.; Auton, H. 1998. Effect of phosphorus on root colonization and growth promotion of maize by bioluminescent mutants of phosphate-solubilizing Rhizobium leguminosarum bv phaseoli Soil Biol. Biochem, 30: 1615-1618.
- Cline, G.R.; Senwo, Z.N. 1994. Tolerance of lespedeza Bradyrhizobium to acidity, aluminum, and manganese in culture media containing glutamate or ammonium. Soil Biol. Biochem, 26(8): 1067-1072.
- Flis, S.E. Glen, A.R.; Dilworth, M.J. 1993. The interaction between aluminium and root nodule bacteria. Soil Biol. Biochem, 25(4): 403-417.
- Fulton, B.; Iam, S.; Jeffery, E. 1989 Bioavaibility of aluminum from drinking water. Fundamental and Applied Toxicology, 12(1): 144-150.
- Graham, P.H.; Draeger, K.J.; Ferrey, M.L.; Conray, M.J.; Hammer, B.E.; Martinez, E.; Aarons, S.R.; Quintino, C. 1994. Acid pH tolerance in strains of Rhizobium and initial studies on the basis for acid tolerance of Rhizobium tropici UMR 1899. Can. J. Microbiol., 40: 198-207.
- Halder, A.K.; Mishra, A.K.; Bhattacharya, P.; Chakrabarty, P.K. 1990. Solubilization of rock phosphate by Rhizobium and Bradyrhizobium J. Gen. Appl. Microbiol, 36: 81-92.
- Hungria, M.; Vargas, M.T.A. 2000. Environmental factors affecting grain legumes in the tropics, with emphasis on Brazil. Field Crops Research, 65: 151-164.
- llmer, P.; Barbato, A.; Schinner, F. 1995. Solubilization of hardly-soluble AlPO4 with P-solubilizing microrganisms. Soil Biol. Biochem., 27(3): 265-270.
- Ilmer, P.; Schinner, F. 1995. Solubilization of inorganic calcium phosphates - solubilization mechanisms. Soil Biol. Biochem, 27(3): 257-263.
- Kawai, F.; Zhang, D.; Sugimoto, M. 2000. Isolation and characterization of acid and Al-tolerant microrganisms. FEMS Microbiology Letters, 189: 143-147.
- Lesueur, D.; Diem, H.G.; Dianda, M.; Lesoux, C. 1993. Selection of Bradyrhizobium strains and provenances of Acacia mangium and Faiderbhia albida - Relationship with their tolerance to acidity and aluminum. Pl. Soil, 149 (2): 1559-166.
- Marriel, I.E. 1984. Efeitos de fatores limitantes sobre o crescimento de Rhizobium japonicum (Kirchner) buchana e de soja (Glicine max (L.) Merril). Dissertação de Mestrado, Universidade Federal de Viçosa. Viçosa, Minas Gerais. 114 p.
- Mikanova, O. 2000. Study of the P-solubilizing microorganisms and their utilization for improving plant nutrition. Disertation Thesis, Czech Univerzity of Agriculture Prague/Faculty of Agronomy, Prague. p.1-13.
- Mikanova, O.; Kúbat, J. 1999. Practical use of P-solubilization a activity of Rhizobium species strains. Rostlinná Vyroba, 45(9): 407-409.
- Mukherjee, K.; Asanuma, S. 1998. Possible role of cellular phosphate pool and subsequent accumulation of inorganic phosphate on the aluminum tolerance in Bradyrhizobium japonicum Soil Biol. Biochem., 30(12): 1511-1516.
- Noda, H. 1998. Pequena Produção de Terra Firme no Estado do Amazonas Manaus, INPA. 80p. (Série documentos, nº 5).
- O'hara, G.W.; Goss, T.J. ; Dilworth, M.J.; Glenn, R. 1989. Maintenance of intracelular pH and acid tolerance Rhizobium meliloti Appl. Enviro. Microbiol., 55: 1870-1876.
- Oliveira, L.A. de 1988. Competitive ability of Rhizobiun leguminosarum bv. phaseoli strains Ph D. Thesis, Univerty of Minnesota, Minnesota, United State of American. 125 p.
- Oliveira, L.A. de; Magalhães, H.P. de 1999. Quantitative evaluation of acidity tolerance of root nodule bacteria. Rev. Microbiol., 30: 203- 208.
- Piex, A.; Rivas-Boyero, A.A.; Mateos, P.F.; Rodriguez-Barrueco, C.; Martinez-Molina-E.; Velazquez, E. 2001. Growth promotion of chickpea and barley by a phosphate solubilizing strain of Mesorhizobium mediterraneum under growth chamber conditions. Soil Biol. Biochem., 33(1): 103-110.
- Raij, B.V. 1991 Fertilidade do Solo e Adubação São Paulo, Agronômica Ceres, 347p.
- Ramos, M.L.G.; Magalhães, M.F.M.; Boddey, R.M. 1987. Native and inoculated rhizobia isolated from field grown Phaseolus vulgaris: effects of liming and acid soil on antibiotic resistance. Soil Biol. Biochem, 19(2): 179-185.
- Rodriguez, H.; Fraga, R. 1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnology Advances, 17: 319-339.
- Rosalem, L.A.; Lindstron, K. 1997. Stability of short and long O-chain lipopolysacharides types in Rhizobium galegae and their correlation with symbiotic properties and growth conditions, tolerance of low pH, aluminum and salt in the growth medium. FEMS Microbiology Letters, 155: 17-22.
- Sanchez, P.A.; Bandy, D.E.; Villachica, J.H.; Nicholaides, J.J. 1982. Amazon basin soils: management for continuos crop production. Science, 216: 821-827.
- Silva Filho, G.N. ; Vidor, C. 2000. Solubilização de fosfato por microrganismos na presença de fontes de carbono. R. bras. Ci. Solo, 24: 311-319.
- Singleton, P.W.; Stockinger, K.R. 1983. Compensation against infective nodulation in soybean. Crops Science, 23: 69-72.
- Smith, G.S.; Jonhson, C.M.; Cornforth, I.S. 1983. Comparison of nutrient solutions for growth of plants in sand culture. New Phytol, 94: 537-548.
- Somasegaran, P.; Hoben, H.J. 1985. Methods in legume-Rhizobium Technology. NifTAL Project and MIRCEN, Paia, Hawai-USA, 365p.
- Specht, A.W.; Erdman, L.W.; Means, V.M.; Rernicky, J.W. 1956. Effect of nutrition on Trifolium hirtum inoculated with Rhizobium trifolii Soil Sci. Soc. Am. Proc. 29: 489-495.
- Sylvester-Bradley, R.; Asakawa, N.; La Torraca, S.; Magalhães, F.M.M.; Oliveira, L.A.; Pereira, R.M. 1982. Levantamento quantitativo de microorganismos solubilizadores de fosfato na rizosfera de gramíneas e leguminosas forrageiras na Amazônia. Acta Amazonica, 12(1): 15-22.
- Toro, M.; Azcón, R. ; Herrera, R. 1996. Effects on yeld and nutrition of mycorrhizal and nodulated Pueraria phaseoloides exerted by P-solubilizing rhizobacteria. Biol. Fertil. Soils, (21): 23-29.
- Van Rossum, P.; Muijotech, A.; Hopo, B.M.; Van Verseveld, H.W.; Stouthomer, A.H.; Boogered, F. C. 1994. Soil acidity in relation to groundnut Bradyrhizobium symbiotic performance. Pl. Soil, 163: 165-175.
- Van Veen, H.W.; Abee, T.; Kortstee, G.I.J.; Konings, W.N. ; Zehnder, A.B.J. 1994. Generation of proton motive force by the excretion of metal phosphate in the phosphate-accumulating Acinetobacter johnsonii strain 210ª. Journal of Biological Chemistry, 269: 29509-29514.
- Vieira, L.S. 1988. Manual de ciência do solo: com ênfase dos solo tropicais São Paulo, Agronômica Ceres. 464p.
- Vincent, J.M. 1970. A manual for practical study of root nodule bacteria. IBP Handbook n. 15. Blackwell Scient. Oxford, 140p.
- Watkin, E.L.J.; O'Hara, G.W.; Howieson, J.G.; Glenn, A.R. 2000. Identification of tolerance to soil acidity in inoculant strains of Rhizobium leguminosarum bv. trifolii. Soil Biol. Biochem., 32: 1393-1403.
- Wood, M. 1995. A mechanism of aluminium toxicity to soil bacteria and possible ecological implications. Pl. Soil, 171: 63-69.
Datas de Publicação
-
Publicação nesta coleção
30 Nov 2004 -
Data do Fascículo
Set 2004
Histórico
-
Recebido
23 Jun 2003 -
Aceito
13 Jul 2004