Resumos
Estudos com comunidades de morcegos são escassos no Brasil, não sendo encontrado nenhum no Maranhão. Este estudo teve como objetivo investigar a composição de espécies da comunidade de morcegos do Parque Estadual do Bacanga (PEB), São Luís - MA, além de contribuir para o levantamento da fauna de morcegos do estado. Os morcegos foram capturados com três redes neblina de maio a agosto de 2004 em quatro diferentes hábitats (mata de capoeira, mata de terra firme, mata de várzea e mangue). A diversidade e similaridade entre hábitats foram calculadas, bem como a amplitude e sobreposição dos nichos das espécies consideradas comuns na área. Foram registradas 24 espécies de morcegos, sendo a maior diversidade encontrada na mata de várzea. A baixa similaridade constatada entre o hábitat de mangue e os demais hábitats indica a existência de dois conjuntos de espécies de morcegos distintos, o que é reforçado pelas sobreposições de nicho espacial das espécies mais comuns.
Floresta Amazônica; Morcegos; Comunidade; Maranhão
There are few studies about bat communities in Brazil and none for the Maranhão state there is none. The present study aimed to analyze the bat community of the Bacanga State Park (PEB), São Luís - MA, and to contribute with bat data for the Maranhão state. The bats were sampled in four different habitats (capoeira forest, terra firme forest, riparian forest, and mangrove), using three mist nets from May to August 2004. Diversity and similarity were calculated, as well as the spatial niches width and overlap of the commonest species in PEB. Twenty four species of bats were recorded in PEB and the riparian habitat forest presented the highest diversity index. The low similarity found between mangrove and the remaining habitats seemed to identify two well-defined assemblages of bats in the sampled area, which is enforced by the spatial niche overlaps of the most commonness species.
Amazonian forest; Bats; Community; Maranhão
Comunidades de morcegos em hábitats de uma Mata Amazônica remanescente na Ilha de São Luís, Maranhão
Bat communities of an Amazonian remnant forest of São Luís Island, Maranhão
Leonardo Dominici CruzI; Carlos MartínezII; Fernanda Rodrigues FernandesI,III
IPrograma de Pós-graduação em Ecologia, Universidade Estadual de Campinas, Instituto de Biologia, Departamento de Parasitologia, Caixa Postal 6109, Campinas, São Paulo, 13083-970, Brasil. e-mail: leodominici@yahoo.com.br IIUniversidade Federal do Maranhão, Departamento de Ciências Biológicas, Av. dos Portugueses, S/N, Campus Universitário do Bacanga, São Luís, Maranhão, 65080-040, Brasil. e-mail: nyctic@yahoo.com IIIe-mail: nandafernandes@gmail.com
RESUMO
Estudos com comunidades de morcegos são escassos no Brasil, não sendo encontrado nenhum no Maranhão. Este estudo teve como objetivo investigar a composição de espécies da comunidade de morcegos do Parque Estadual do Bacanga (PEB), São Luís - MA, além de contribuir para o levantamento da fauna de morcegos do estado. Os morcegos foram capturados com três redes neblina de maio a agosto de 2004 em quatro diferentes hábitats (mata de capoeira, mata de terra firme, mata de várzea e mangue). A diversidade e similaridade entre hábitats foram calculadas, bem como a amplitude e sobreposição dos nichos das espécies consideradas comuns na área. Foram registradas 24 espécies de morcegos, sendo a maior diversidade encontrada na mata de várzea. A baixa similaridade constatada entre o hábitat de mangue e os demais hábitats indica a existência de dois conjuntos de espécies de morcegos distintos, o que é reforçado pelas sobreposições de nicho espacial das espécies mais comuns.
Palavras-chave: Floresta Amazônica, Morcegos, Comunidade, Maranhão.
ABSTRACT
There are few studies about bat communities in Brazil and none for the Maranhão state there is none. The present study aimed to analyze the bat community of the Bacanga State Park (PEB), São Luís - MA, and to contribute with bat data for the Maranhão state. The bats were sampled in four different habitats (capoeira forest, terra firme forest, riparian forest, and mangrove), using three mist nets from May to August 2004. Diversity and similarity were calculated, as well as the spatial niches width and overlap of the commonest species in PEB. Twenty four species of bats were recorded in PEB and the riparian habitat forest presented the highest diversity index. The low similarity found between mangrove and the remaining habitats seemed to identify two well-defined assemblages of bats in the sampled area, which is enforced by the spatial niche overlaps of the most commonness species.
Keywords: Amazonian forest, Bats, Community, Maranhão.
INTRODUÇÃO
Os morcegos, ou Chiroptera, constituem a segunda maior ordem de mamíferos em número de espécies (Nowak, 1991; Emmons & Feer, 1997), contribuindo de forma notável com a riqueza e diversidade da mastofauna de vários ecossistemas neotropicais (Mares et al., 1981; Schneider, 2000; Marinho-Filho & Gastal, 2001; Silva et al., 2001), além de desempenharem papéis fundamentais tanto na predação de artrópodes e vertebrados (Humphrey et al., 1983; Medellín, 1988), quanto na dispersão de sementes e pólen (Fleming & Heithaus, 1981; Palmerim et al., 1989; Kalko et al., 1996; Sazima et al., 1999).
No Brasil, 165 espécies de morcegos são registradas até o momento (Peracchi et al., 2006) e apesar de existirem vários estudos realizados com este grupo de animais no país (e.g. levantamentos: Pedro & Taddei, 1998; Bernard & Fenton, 2002; Miretzk, 2003 - estudos de aspectos reprodutivos: Marques, 1986; Mello & Fernandez, 2000; Zortea, 2003 - alimentação: Bernard, 2002; Mikich, 2002; Nogueira & Peracchi, 2002), estudos ecológicos de comunidades de morcegos são escassos (Marinho-Filho & Sazima, 1998; Aguiar & Marinho-Filho, 2004).
No Maranhão, os únicos trabalhos encontrados com morcegos são relacionados a agressões de Desmodus rotundus, Geoffroy 1810, em seres humanos (Schneider et al., 1996; 2001), porém não há informação a respeito das comunidades de morcegos existentes no estado. Dessa forma, o presente estudo teve como objetivo investigar a comunidade de morcegos de uma área de preservação na Ilha de São Luís, o Parque Estadual do Bacanga, assim como contribuir para melhorar os dados referentes à ocorrência de espécies de morcegos do estado do Maranhão.
MATERIAL E MÉTODOS
O Parque Estadual do Bacanga (PEB) (2° 33' S e 44° 14' W) localiza-se na parte centro-oeste da Ilha de São Luís (Figura 1) e compreende atualmente uma área de aproximadamente 2.634,06 ha com um alto grau de ocupação humana. A área é formada por fragmentos de floresta amazônica, com hábitats de várzea e de mata de terra firme, separados por uma matriz de mata secundária e de campos abandonados (Muniz et al., 1994), além de formações de manguezais nas áreas de influência marinha no Rio Bacanga.
Foram realizados dois dias de capturas semanais no PEB no período de maio a agosto de 2004, sendo amostrados quatro hábitats: mata de capoeira, com a presença de árvores frutíferas cultivadas e vegetação secundária; mata de várzea, em grande parte primária; mata de terra firme, compreendendo um mosaico de vegetação primária e secundária; e uma mata de mangue. Todos os hábitats foram amostrados por 6 h30 min com a utilização de três redes neblina de 12 x 2,5 m cada (malha 36 mm) armadas à altura do solo, totalizando um esforço de captura de 175 h 30 min por hábitat e de 702 h no PEB. Os morcegos foram capturados das 17 h 30 min às 24 h, sendo identificados ao nível de espécie, marcados por perfuração no patágio (Bonaccorso & Smythe, 1972; Trajano, 1985), registrado o hábitat de captura e soltos logo em seguida.
A diversidade de espécies de morcegos em todos os hábitats foi calculada por meio do índice de Shannon-Wiener (Krebs, 1999). Para o cálculo de similaridade entre os hábitats foi utilizado o índice de Morisita (Krebs, 1999). A amplitude do nicho espacial foi calculada por meio do índice de Levins (1968), considerando-se os tipos de hábitats amostrados como categorias de recursos, e a sobreposição do nicho foi obtida por meio do índice de Morisita simplificado (Horn, 1966; Krebs, 1999). Foram consideradas para as análises de amplitude e sobreposição do nicho espacial, as espécies com o número de indivíduos capturados (n) maior ou igual a 25, sendo consideradas as espécies mais comuns da área de estudo.
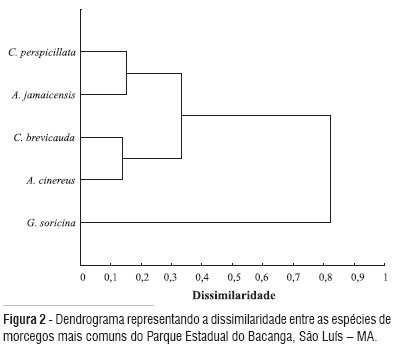
Uma análise de agrupamento das freqüências relativas das espécies consideradas mais comuns do PEB por hábitat foi realizada adicionalmente, utilizando-se o método UPMGA, evitando-se, dessa forma, os extremos introduzidos pelos agrupamentos de ligação simples e completa (Krebs, 1999). A distância euclidiana foi adotada como medida de dissimilaridade entre as espécies mais comuns.
RESULTADOS
No PEB, foram registradas 24 espécies pertencentes a cinco famílias. A família Phyllostomidae foi a mais comum, sendo representada por 18 espécies, seguida das famílias Emballonuridae e Vespertilionidae com duas espécies cada (Tabela 1).
A diversidade de espécies de morcegos atingiu valor máximo na mata de várzea, com cinco espécies (Rhinophylla pumilio, Peters 1865; Tonatia brasiliensis, Peters 1866; Uroderma bilobatum, Peters 1866; Vampyressa bidens, Dobson 1878 e Lonchophylla mordax, Thomas 1903) ocorrendo somente neste hábitat; e valor mínimo no mangue (Tabela 2). A mata de capoeira, mata de várzea e mata de terra firme apresentaram altos níveis de similaridade entre si, ao passo que o mangue apresentou baixa similaridade em relação aos demais hábitats (Tabela 3).
As espécies consideradas nas análises sobre estrutura do nicho espacial foram: Artibeus cinereus, Gervais 1856, (n = 33), A. jamaicensis, Leach 1821, (n = 119), Carollia brevicauda, Schinz 1821, (n = 43), C. perspicillata, Linnaeus 1758, (n = 209) e Glossophaga soricina, Pallas 1766, (n = 182). Os morcegos C. perspicillata, C. brevicauda e A. cinereus apresentaram os nichos espaciais mais amplos, ao passo que A. jamaicensis apresentou uma amplitude de nicho ligeiramente menor.
As diferenças mais importantes, no entanto, ocorreram com G. soricina que apresentou um nicho espacial com uma amplitude muito menor do que as demais espécies (Tabela 4). As sobreposições do nicho espacial entre G. soricina e as outras quatro espécies foram em geral muito menores do que entre qualquer outro par de espécies. Entre as espécies de Carollia e Artibeus, as sobreposições intragenéricas foram menores do que as intergenéricas, com a única exceção de C. perspicillata e A. cinereus (Tabela 5).
A análise de agrupamento mostrou um padrão de similaridade entre as freqüências relativas dessas cinco espécies, onde G. soricina apresentou uma dissimilaridade muito maior em relação às espécies C. perspicillata, C. brevicauda, A. jamaicensis e A. cinereus (Figura 2).
DISCUSSÃO
Segundo Simmons (2005), cerca de 70 espécies de morcegos possuem provável ocorrência para a região norte do Maranhão. O número de espécies registradas no PEB representa 34% das espécies de ocorrência esperada para esta região e indica uma elevada riqueza local, além de corresponder ao esperado num estudo de curta duração baseado em captura com redes. No entanto, a falta de estudos faunísticos anteriores deste grupo em outras localidades da região, associada ao pouco conhecimento da distribuição geográfica de grande parte das espécies de morcegos neotropicais (Marinho-Filho & Sazima, 1998; Bernard, 2002), torna difícil uma estimativa mais precisa da riqueza de espécies de morcegos existentes no norte do estado. No geral, são necessárias amostragens mais completas, além da amostragem de hábitats marginais presentes na região norte do Maranhão para entender melhor a riqueza de morcegos regional.
A predominância de espécies da família Phyllostomidae é um resultado encontrado habitualmente no Neotrópico (Brosset & Charles-Dominique, 1990; Reis & Muller, 1995; Emmons & Feer, 1997; Bernard, 2001), sendo que as espécies mais comuns variam entre as regiões estudadas (Marques, 1985; Reis et al., 2000). Isto pode ser reflexo dos diferentes tamanhos das populações locais destas espécies e da amplitude de suas distribuições regionais. Entretanto, outros fatores como o viés de amostragem associado ao uso de redes de espera, mais eficiente em capturar filostomídeos stenodermatíneos, geralmente frugívoros de sub-bosque, e filostomíneos que capturam invertebrados e mesmo pequenos vertebrados, também na folhagem do estrato arbustivo, ou ainda preferências de determinadas espécies de morcegos filostomídeos por algumas espécies vegetais que apresentam distribuição espaço-temporal heterogêneas (Fleming, 1982), também podem influenciar estes resultados.
Os morcegos filostomídeos são associados principalmente com áreas de florestas no Brasil (Marinho-Filho & Sazima, 1998). Mesmo em formações abertas (e.g. cerrados), as matas de galeria desempenham um papel crucial na manutenção de populações de morcegos (Marinho-Filho & Gastal, 2001). Um padrão semelhante foi observado no PEB, onde os hábitats de mata amazônica apresentaram uma maior diversidade de morcegos. Isto pode ser explicado pela maior heterogeneidade espacial e maior diversidade vegetal e entomofaunística destes hábitats quando comparados com o mangue, fornecendo uma maior variedade de recursos às diferentes espécies de morcegos. O mangue apresenta uma estrutura espacial mais homogênea, composta principalmente por árvores de Rhizophora mangle, refletindo-se na menor diversidade de espécies de morcegos neste hábitat. A presença de um maior número de espécies encontradas somente na várzea indica que este hábitat tem grande importância para a manutenção da comunidade de morcegos existente no PEB.
Esta relação entre morcegos e os diferentes hábitats de um ambiente heterogêneo pode ocasionar a formação de diferentes conjuntos de espécies locais. Bernard et al. (2001), comparando os fragmentos de floresta de Santarém com as áreas de floresta contínua desta mesma localidade, encontraram conjuntos de espécies de morcegos distintos nos fragmentos, formados por um subgrupo das espécies encontradas na floresta contínua, o que demonstra um uso restrito dos fragmentos pelas espécies de morcegos desta região. No PEB, os menores valores de similaridade observados entre o hábitat de mangue e os outros três de mata, assim como as maiores similaridades de espécies de morcegos entre estes últimos, apontam para a existência de dois conjuntos de espécies de morcegos parcialmente diferenciados no PEB: a) o conjunto de espécies de mangue e b) o conjunto de espécies de mata, formado pelos hábitats capoeira, várzea e mata de terra firme, originados da vegetação amazônica primária da região. No entanto, pode ocorrer um fluxo de indivíduos entre estes dois conjuntos de espécies, devido à proximidade existente entre os hábitats.
No PEB, a maior parte das espécies encontradas no hábitat de mangue também foi encontrada nos hábitats de mata, porém a maior abundância de algumas espécies como, por exemplo, G. soricina, em relação às outras, pode indicar um uso diferenciado do mangue pelas espécies de morcegos presentes na área de estudo, configurando um conjunto de espécies diferente do encontrado nos outros hábitats. A espécie G. soricina esteve freqüentemente associada ao hábitat de mangue apresentando um nicho espacial estreito e baixos valores de sobreposição de nicho com as outras quatro espécies mais comuns, o que corresponde com duas possibilidades: que esta espécie pode ser especialista neste tipo de hábitat na área estudada, apesar de outros trabalhos verificarem a ocorrência desta espécie em hábitats de mata primitiva (e.g. Reis et al., 2000; Bernard et al., 2001), ou simplesmente que utilize oportunisticamente o mangue em função de disponibilidades sazonais de recursos.
As outras quatro espécies apresentaram nichos espaciais bem mais amplos do que G. soricina e foram mais estreitamente associadas aos hábitats originados da mata amazônica. Todavia, os baixos valores de sobreposição do nicho espacial entre algumas espécies, como por exemplo, o observado entre Carollia perspicillata e C. brevicauda, indicam uma possível segregação espacial entre espécies congenéricas de tamanho semelhante. Estas espécies apresentam um alto grau de similaridade morfológica e na dieta (Owen et al., 1984; Cloutier & Thomas, 1992; Lim & Engstrom, 1998; Giannini & Kalko, 2004), sendo C. perspicillata apenas um pouco maior que C. brevicauda e, apesar desta pequena diferença, elas apresentaram uma segregação de hábitat, com C. brevicauda sendo mais freqüente nos hábitats de capoeira e de várzea, ao passo que C. perspicillata foi mais freqüente em todos os hábitats, apresentando um comportamento generalista. Por outro lado, Artibeus jamaicensis e A. cinereus são congenéricos de notável diferença de tamanho, com A. jamaicensis sendo muito maior que A. cinereus (Emmons & Feer, 1997; Eisenberg & Redford, 1999; Ortega & Castro-Arellano, 2001) e estas sobrepuseram mais a utilização dos hábitats que as espécies de Carollia.
Vários estudos têm revelado que espécies simpátricas similarmente morfológicas forrageiam em hábitats diferentes (e.g. Saunders & Barclay, 1992; Arletttaz, 1999; Nicholls & Racey; Bumrungsri et al., 2007). O grau de segregação de hábitat revelado nestas espécies, as quais apresentam uma considerável sobreposição nos caracteres de ecolocalização e morfologia funcional utilizados para separar espécies de morcegos em guildas amplas de forrageio (Schnitzler & Kalko, 1998), sugere que estas características podem não predizer segregações ecológicas em escalas mais finas. Considerando-se os frugívoros de sub-bosque de tamanho semelhante, como as duas espécies de Carollia e A. cinereus, observa-se a mesma tendência à segregação entre C. perspicillata e A. cinereus que a apresentada entre as espécies de Carollia. Porém, ao considerar-se o índice de sobreposição entre A. cinereus e C. brevicauda, verifica-se entre elas um alto valor de sobreposição, sendo ambas mais freqüentes nos hábitats de capoeira e várzea, indicando que outros fatores, além de similaridades morfológicas, podem estar influenciando este padrão.
De fato, a maioria das espécies de morcegos filostomídeos que se alimentam de frutos ou néctar parece comportar-se como forrageadores oportunistas, utilizando seus principais itens alimentares do modo como são disponíveis no ambiente (Heithaus et al., 1975; Willig & Moulton, 1989). Portanto, o uso dos hábitats no PEB pelas espécies de morcegos também pode ter sido influenciado pelos padrões de fenologia de floração e frutificação das espécies vegetais de maior importância em suas dietas, assim como observado em outras localidades tropicais (e.g. Thies & Kalko, 2004; Thies et al., 2006; Bumrungsri et al., 2007). Entretanto estudos mais detalhados precisam ser desenvolvidos a respeito para determinar o alcance e as circunstâncias desse uso preferencial do mangue por G. soricina, assim como da utilização de hábitats na Ilha de São Luís pelas demais espécies de morcegos estudadas. De fato, a maioria dos estudos existentes na literatura sobre as faunas de morcegos no Neotrópico foi realizada em ecossistemas de mata interiorana (e.g. Reis et al., 2000; Bernard & Fenton, 2002; Estrada & Coates-Estrada, 2002), sendo que os ecossistemas costeiros, entre eles o mangue, permanecem quase que inteiramente desconhecidos. Menos ainda se conhece a respeito das interações existentes entre os hábitats costeiros e de terra firme com a fauna de morcegos.
AGRADECIMENTOS
Agradecemos à Maria Ivanilde Rodrigues e a Fernando Mendonça pelo apoio logístico, ao Dr. Antonio Augusto Rodrigues pela cessão de material, à Secretária de Meio Ambiente do Estado do Maranhão por conceder a autorização para realizar o trabalho na área, ao Batalhão Florestal pela segurança oferecida durante a realização do trabalho, a Samir Feres, Luiza Santos e João Carlos Costa pela ajuda no trabalho de campo.
BIBLIOGRAFIA CITADA
Recebido em 14/02/2007
Aceito em 10/09/2007
- Aguiar, L.M.S.; Marinho-Filho, J.S. 2004. Activity patterns of nine phyllostomid bat species in a fragment of the Atlantic Forest in southeastern Brazil. Revista Brasileira de Zoologia, 21(2):385-390.
- Arlettaz, R. 1999. Habitat selection as a major resource partitioning mechanism between the two sympatric sibling bat species Myotis myotis and Myotis blythii.Journal of Animal Ecology, 68(3): 460-471.
- Bernard, E. 2001. Vertical stratification of bat communities in primary forest of Central Amazon, Brazil. Journal of Tropical Ecology, 17(1): 115-126.
- Bernard, E. 2002. Diet, activity and reproduction of bats species (Mammalia, Chiroptera) in Central Amazonia, Brazil. Revista Brasileira de Zoologia, 19(1): 173-188.
- Bernard, E.; Albernaz, A.L.K.M.; Magnusson, W.E. 2001. Bat species composition in three localities in the Amazon Basin. Studies on Neotropical Fauna and Environment 36 (3): 177-184.
- Bernard, E.; Fenton, M.B. 2002. Species diversity of bats (Mammalia: Chiroptera) in forest fragments, primary forests and savannas in central Amazonia, Brazil. Canadian Journal of Zoology, 80(6): 1124-1140.
- Bonaccorso, F.J.; Smythe, N. 1972. Punch-marking bats: an alternative to banding. Journal of Mammology, 53(2): 389-390.
- Brosset, A.; Charles-Dominique, P. 1990. The bats of French Guiana: a taxonomic, faunistic and ecological approach. Mammalia, 54(4): 509-560.
- Bumrungsri, S.; Leelapaibul, W.; Racey, P.A. 2007. Resource partitioning in sympatric Cynopterus bats in lowland tropical rain forest, Thailand. Biotropica, 39(2): 241-248.
- Cloutier, D.; Thomas, D.W. 1992. Carollia perspicillata.Mammalia Species, 417: 1-9.
- Eisenberg, J.F.; Redford, K.H. 1999. Mammals of the Neotropics Vol. 3. University of Chicago Press, Chicago, USA. 609pp.
- Emmons, L.H.; Feer, F. 1997. Neotropical Rainforest Mammals 2 ed. University of Chicago Press, Chicago, USA. 380pp.
- Estrada, A.; Coates-Estrada, R. 2002. Bats in continuous forest, forest fragments and in an agricultural mosaic habitat-island at Los Tuxtlas, Mexico. Biological Conservation, 103(2): 237-245.
- Fleming, T.H. 1982. Foraging strategies of plant visiting bats. In: Kunz, T.H. (Ed). Ecology of Bats Plenum Press, New York, USA. p. 287-326.
- Fleming, T.H.; Heithaus, E.R. 1981. Frugivorous bats, seed shadows, and the structure of tropical forests. Biotropica, 13(2): 45-53.
- Giannini, N.P.; Kalko, E.K.V. 2004. Trophic structure in a large assemblage of phyllostomid bats in Panama. Oikos, 105(2): 209-220.
- Heithaus, E.R.; Fleming, T.H.; Opler, P.A. 1975. Foraging patterns and resource utilization in seven species of bats in a seasonal tropical forest. Ecology, 56(4): 841-854.
- Horn, H. S. 1966. Measurement of "overlap" in comparative ecological studies. American Naturalist, 100(114): 419-424.
- Humphrey, S.R.; Bonaccorso, F.J.; Zinn, T.L. 1983. Guild structure of surface-gleaning bats in Panama. Ecology, 64(2): 284-294.
- Kalko, E.K.V.; Herre, E.A.; JR Handley, C.O. 1996. Relation of fig fruit characteristics to fruit-eating bats in the New and Old World tropics. Journal of Biogeography, 23(4): 565-576.
- Krebs, C.J. 1999. Ecological Methodology 2 thed. Benjamin Cummings, California. USA. 620pp.
- Levins, R. 1968. Evolution in chanching environments: some theoretical explorations Pricenton University Press, New Jersey, USA. 120pp.
- Lim, B.K.; Engstrom, M.D. 1998. Phylogeny of neotropical short-tailed fruit bats, Carollia sp. Phylogenetic analysis of restriction site variation in mtDNA. In : Kunz, T.H.; Racey, P.A. (Eds). Bat Biology and Conservation. Smithsonian Institution Press, Washington, USA. p. 43-58.
- Mares, M.A.; Willig, M.R.; Streilein, K.E.; Lacher, T.E. 1981. The mammals of northeastern Brazil: a preliminary assessments. Annals of the Carnegie Museum of Natural History, 50(4): 81-110.
- Marinho-Filho, J. ;Sazima, I. 1998. Brazilian bats and conservation biology a first survey. In: Kunz, T.H.; Racey, P.A. (Eds). Bat Biology and Conservation. Smithsonian Institution Press, Washington, USA. p. 282-294.
- Marinho-Filho, J.; Gastal, M.L. 2001. Mamíferos das Matas Ciliares dos Cerrados do Brasil Central. In: Rodrigues R.R.; Leitão-Filho H.F. (Eds). Matas Ciliares: Conservação e Recuperação 2Şed. EDUSP, São Paulo, p. 209-221.
- Marques, S.A. 1985. Novos registros de morcegos do Parque Nacional da Amazônia (Tapajós), com observação do período de atividade noturna e reprodução. Boletim do Museu Paraense Emílio Goeldi - Zoologia, 2(1): 71-83.
- Marques, S.A. 1986. Activity cycle, feeding and reproduction of Molossus ater (Chiroptera: Molossidae) in Brazil. Boletim do Museu Paraense Emilio Goeldi - Zoologia 2 (2): 159-179.
- Medellín, R.A. 1988. Prey of Chrotopterus auritus, with notes on feeding behavior. Journal of Mammalogy, 69(4): 841-844.
- Mello, M.A.R.; Fernandez, F.A.S. 2000. Reproductive ecology of the bat Carollia perspicillata (Chiroptera: Phyllostomidae) in a fragment of the Brazilian Atlantic coastal forest. Mammalian Biology, 65(5): 340-349.
- Mikich, S.B. 2002. A dieta dos morcegos frugívoros (Mammalia, Chiroptera, Phyllostomidae) de um pequeno remanescente de Floresta Estacional Semidecidual do sul do Brasil. Revista Brasileira de Zoologia, 19(1): 239-249.
- Miretzki, M. 2003. Morcegos do estado do Paraná, Brasil (Mammalia, Chiroptera): riqueza de espécies, distribuição e síntese do conhecimento atual. Papéis Avulsos de Zoologia 43(6): 101-138.
- Muniz, F.H; Cesar, O.; Monteiro, R. 1994. Fitossociologia da vegetação arbórea da Reserva Florestal do Sacavém-São Luís, MA (Brasil). Acta Amazônica, 24(3/4): 219-236.
- Nicholls, B.; Racey, P.A. 2006. Habitat selection as a mechanism of resource partitioning in two cryptic bat species Pipistrellus pipistrellus and Pipistrellus pyygmaeus.Ecography, 29(5): 697-708.
- Nogueira, M.R.; Peracchi, A.L. 2002. The feeding specialization in Chiroderma doriae (Phyllostomidae, Stenodermatinae) with comments on its conservation implications. Chiroptera Neotropical, 8(2): 143-148.
- Nowak, R.M. 1991. Walker's Mammals of the World.Vol. 1 Johns Hopkins University Press, London, USA., 5 thed. 642pp.
- Ortega, J.; Castro-Arellano, I. 2001. Artibeus jamaicensis.Mammalian Species, 662: 1-9.
- Owen, J.G.; Schmidly, D.J.; Davis, W.B. 1984. A morphometric analysis of three species of Carollia from Middle America. Mammalia, 48(1): 85-93.
- Palmerim, J.M.; Gorchov, D.L.; Stoleson, S. 1989. Trophic structure of a neotropical frugivore community: is there competition between birds and bats? Oecologia, 79(3): 403-411.
- Pedro, W.A.; Taddei, V.A. 1998. Bats from Southwestern Minas Gerais, Brazil (Mammalia: Chiroptera). Chiroptera Neotropical, 4(2): 85-90.
- Peracchi, A.L.; Lima, I.P.; Reis, N.R.; Nogueira, M.R.; Ortêncio Filho, H. 2006. Ordem Chiroptera. In: Reis, N.R.; Peracchi, A.L.; Pedro, W.A.; Lima, I.P. (Eds). Mamíferos do Brasil Londrina, Paraná. p. 153-230.
- Reis, N.R.; Muller, M.F. 1995. Bat diversity of forests and open areas in a subtropical region of south Brazil. Ecologia Austral, 5(1): 31-36.
- Reis, N.R.; Peracchi, A.L.; Sekiama, M.L.; Lima, I.P. 2000. Diversidade de morcegos (Chiroptera, Mammalia) em fragmentos florestais do estado do Paraná, Brasil. Revista Brasileira de Zoologia, 17(3): 697-704.
- Sazima, M.; Buzato, S.; Sazima, I. 1999. Bat-pollinated flower assemblages and bat visitors at two Atlantic Forest sites in Brazil. Annals of Botany, 83(6): 705-712.
- Schneider, M. 2000. Mastofauna: Os mamíferos e suas associações com as fitofisionomias do cerrado. Uma abordagem de ecologia da paisagem para avaliação da perda de habitats. In: Alho, C.J.R. (Org). Fauna silvestre da região do rio Manso, MT Edições IBAMA e ELETRONORTE, p. 217-267.
- Schneider, M.C.; Santos-Burgoa, C.; Aron, J.; Munoz, B.; Ruiz-Velazco, S.; Uieda, W. 2001. Potential force of infection of human rabies transmitted by vampire bats in the Amazonian region of Brazil. American Journal of Tropical Medicine and Hygiene, 55(6): 680-684.
- Schneider, M.C.; Aron, J.; Santos-Burgoa, C.; Uieda, W.; Ruiz-Velazco, S. 2001. Common vampire bat attacks on humans in a village of the Amazon region of Brazil. Cadernos de Saúde Pública, 17(6): 1531-1536.
- Schnitzler, H.A.; Kalko, E.K.V. 1998. How echolocating bats search and find food. In: Kunz, T.H.; Racey, P.A. (Eds). Bat Biology and Conservation. Smithsonian Institution Press, Washington, USA. p. 183-196.
- Silva, M.N.F.; Rylands, A.B.; Patton, J.L. 2001. Biogeografia e Conservação da Mastofauna na Floresta Amazônica Brasileira. In: Capobianco, J.P.R. (Org). Biodiversidade na Amazônia Brasileira, avaliação e ações prioritárias para a conservação, uso sustentável e repartição de benefícios. Estação Liberdade - Instituto Socioambiental, São Paulo, p. 110-131.
- Simmons, N.B. 2005. Order Chiroptera. In: Wilson, D.E.; Reeder, D.M. (Eds). Mammals species of the world: a taxonomic and geographic reference 3 thed. Johns Hopkins University Press, Baltimore, USA. p. 312-529.
- Trajano, E. 1985. Ecologia de populações de morcegos cavernícolas em uma região cárstica do Sudeste do Brasil. Revista Brasileira de Zoologia, 2(5): 255-320.
- Thies, W.; Kalko, E.K.V. 2004. Phenology of neotropical pepper plants (Piperaceae) and their association with their main dispersers, two short-tailed fruit bats, Carollia perspicillata and C. castanea (Phyllostomidae). Oikos, 104(2): 362-376.
- Thies, W.; Kalko, E.K.V.; Schnitzler, H.A. 2006. Influence of environment and resource availability on activity patterns of Carollia castanea (Phyllostomidae) in Panama. Journal of Mammalogy, 87(2): 331-338.
- Willig, M.R.; Moulton, M.P. 1989. The role of stochastic and deterministic process in structuring Neotropical bat communities. Journal of Mammalogy, 70(2): 323-329.
- Zortéa, M. 2003. Reproductive patterns and feeding habits of three nectarivorous bats (Phyllostomidae: Glossophaginae) from the Brazilian Cerrado. Brazilian Journal of Biology, 63(1): 159-168.
Datas de Publicação
-
Publicação nesta coleção
03 Mar 2008 -
Data do Fascículo
2007
Histórico
-
Aceito
10 Set 2007 -
Recebido
14 Fev 2007