Resumos
O objetivo deste trabalho foi avaliar a eficácia da formalina e sulfato de cobre no controle de monogenéticos em juvenis de Hemigrammus sp e seu efeito na contagem diferencial de leucócitos. Utilizou-se um delineamento inteiramente casualizado com 5 tratamentos e 3 repetições. Todos os tratamentos tiveram duração de três dias e corresponderam a: T1, controle; T2 e T3 banho por imersão de uma hora em formalina, em duas concentrações uma de 0,25 ml e outra 0,1 ml formalina L-1; o T4, banho de 24 horas com 0,025 ml de formalina L-1; e o T5, banho de 24 horas com sulfato de cobre (0,3 mg L-1). Após o período experimental observou-se que em T2 ocorreu 100% de mortalidade. O T3 e T5 proporcionaram eficácia de 100%, porém os peixes apresentaram intoxicação e mortalidades de 66 e 80%, respectivamente. T4 apresentou eficácia de 77,7% e diminuição dos índices parasitológicos: número total de parasitos de 11,3± 9, intensidade média de infecção de 3,2± 2 e prevalência de 47,1%. Quanto aos leucócitos observou-se que no T3, T4 e T5 ocorreram diferenças na proporção de linfócitos, monócitos e neutrófilos em relação ao controle. O CuSO4 e a formalina reduzem a carga parasitária, mas apresentaram-se tóxicos nas maiores concentrações.
CuSO4; formol; monogênias; tratamento
The objective of this study was to evaluate the effectiveness of formalin and copper sulphate to controlm onogeneans injuvenile Hemigrammus spand its effect on leukocyte count. We used acompletely randomized design with five treatments and three replications. All treatments lasted for three days and consisted of: T1, control; T2 and T3 immersion bath for one hour in formalin, an of two concentrations of 0.25ml formalin and the other 0.1mlL-1; the T4 bath for 24 hours with 0,025 ml of formalin-L -1; and T5, bath 24 hours with copper sulphate (0.3 mgL-1). After the experimental period was observed that T2, 100% mortality. The T3 and T5 provided 100% efficiency, however, fish presented mortalities and intoxication of the 66 and 80% respectively. T4 showed an efficacy of 77.7% and decrease in parasitological indices: total number of parasites of 11, 3 ± 9, mean infection intensity of 3.2 ± 2 and a prevalence of 47.1%. As the leukocytes was observed that at T3, T4 and T5 occurred differences in the proportionof lymphocytes, monocytes and neutrophilsas compared to control. The CuSO4 and formalin reduce the parasite load, but presented to be toxicat higher concentrations.
control; CuSO4; formalin; monogenea
ZOOTECNIA
Efeitos do tratamento com formalina e sulfato de cobre sobre os parâmetros hematológicos e parasitos monogenéticos em juvenis de Hemigrammus sp. (Osteichthyes: Characidae)
Evaluation of formalin and copper sulfate on monogenetic parasite (Urocleidoides sp.) of Hemigrammus sp. (Osteichthyes: Characidae) juveniles
Luciana Farias PaixãoI,IV; Rudã Fernandes Brandão SantosIII,V; Fabricio Menezes RamosI,VI; Rodrigo Yudi FujimotoII,VII
IUniversidade Federal do Pará, Campus de Bragança. Alameda Leandro Ribeiro, s/n bairro aldeia, Bragança Pará Cep 68600-000 PA-BR
IIEMBRAPA, Tabuleiros Costeiros Av. Beira Mar, 3250 - Jardins Caixa Postal 44 - Aracaju, SE - Brasil -, Cep 49025-040
IIIUniversidade Estadual Paulista, Júlio de Mesquita Filho. Via de Acesso Prof. Paulo Donato Castellane, s/n - Jaboticabal, SP - Brasil - Cep 14884-900
IVFormada em Ciências biológicas pela Universidade Federal do Pará
VMestrando pelo programa de Pós Graduação em Aquicultura pela UNESP, CAUNESP
VIDoutorando pelo programa de Pós Graduação em Ciência Animal pela Universidade Federal do Pará
VIIPesquisador EMBRAPA Tabuleiros Costeiros
RESUMO
O objetivo deste trabalho foi avaliar a eficácia da formalina e sulfato de cobre no controle de monogenéticos em juvenis de Hemigrammus sp e seu efeito na contagem diferencial de leucócitos. Utilizou-se um delineamento inteiramente casualizado com 5 tratamentos e 3 repetições. Todos os tratamentos tiveram duração de três dias e corresponderam a: T1, controle; T2 e T3 banho por imersão de uma hora em formalina, em duas concentrações uma de 0,25 ml e outra 0,1 ml formalina L-1; o T4, banho de 24 horas com 0,025 ml de formalina L-1; e o T5, banho de 24 horas com sulfato de cobre (0,3 mg L-1). Após o período experimental observou-se que em T2 ocorreu 100% de mortalidade. O T3 e T5 proporcionaram eficácia de 100%, porém os peixes apresentaram intoxicação e mortalidades de 66 e 80%, respectivamente. T4 apresentou eficácia de 77,7% e diminuição dos índices parasitológicos: número total de parasitos de 11,3± 9, intensidade média de infecção de 3,2± 2 e prevalência de 47,1%. Quanto aos leucócitos observou-se que no T3, T4 e T5 ocorreram diferenças na proporção de linfócitos, monócitos e neutrófilos em relação ao controle. O CuSO4 e a formalina reduzem a carga parasitária, mas apresentaram-se tóxicos nas maiores concentrações.
Palavras chave: CuSO4, formol, monogênias, tratamento
ABSTRACT
The objective of this study was to evaluate the effectiveness of formalin and copper sulphate to controlm onogeneans injuvenile Hemigrammus spand its effect on leukocyte count. We used acompletely randomized design with five treatments and three replications. All treatments lasted for three days and consisted of: T1, control; T2 and T3 immersion bath for one hour in formalin, an of two concentrations of 0.25ml formalin and the other 0.1mlL-1; the T4 bath for 24 hours with 0,025 ml of formalin-L -1; and T5, bath 24 hours with copper sulphate (0.3 mgL-1). After the experimental period was observed that T2, 100% mortality. The T3 and T5 provided 100% efficiency, however, fish presented mortalities and intoxication of the 66 and 80% respectively. T4 showed an efficacy of 77.7% and decrease in parasitological indices: total number of parasites of 11, 3 ± 9, mean infection intensity of 3.2 ± 2 and a prevalence of 47.1%. As the leukocytes was observed that at T3, T4 and T5 occurred differences in the proportionof lymphocytes, monocytes and neutrophilsas compared to control. The CuSO4 and formalin reduce the parasite load, but presented to be toxicat higher concentrations.
Keywords: control, CuSO4, formalin, monogenea
INTRODUÇÃO
O gênero Hemigrammus é amplamente distribuído no Brasil, sendo encontrado geralmente em riachos e apresentando habito alimentar onívoro (Casatti et al. 2003; Brandão-Gonsalvez et al. 2010). Na Amazônia diversas espécies desse gênero tem importância econômica como o H. armstrongi, H. bleheri, H. erithrozonus, H. ocellifer, H. ulreyi devido suas características propicias para serem utilizados na aquariofilia.
A cadeia de comercialização dessas espécies apresenta alguns gargalos, iniciando na fase de captura em que os peixes são mantidos em basquetas plásticas nos barcos de pescadores sem trocas de água e com alimentação inadequada, após esse período os peixes sofrem problemas relacionados com transporte e qualidade de água nesses recipientes e posteriormente já nos entrepostos comerciais onde comumente são estocados antes da exportação são armazenados em densidades elevadas e recebem tratamentos preventivos inadequados (Torres etal. 2008).
Como esses manejos geram estresse nos peixes e consequente diminuição da resistência, muitas vezes ocorre o aparecimento de surtos de doenças e parasitoses resultando no desequilíbrio da tríade parasito-hospedeiro. Assim, infestações por parasitas monogenéticos caracterizados por serem monoxêmicos (Garcia et al. 2003) e apresentar infestações que resultam em lesões que são portas de entrada para bactérias e fungos tem potencial para gerar grandes perdas econômicas. Todavia, pouco se sabe sobre as relações entre os helmintos monogenóides e peixes ornamentais (Garcia et al. 2003).
Quando se considera os principais produtos químicos utilizados no controle e prevenção da reprodução desses parasitos merece destaque a formalina e o sulfato de cobre (Martins 2004; Tavares-Dias et al. 2002). Podendo ser aplicado nas formas de banho, de longa ou de curta duração. Porém, para peixes tropicais a informação da duração destes banhos ainda é escassa podendo ser citado Araujo et al. (2004).
Estudos demonstraram efeitos tóxicos do formol em peixes, como agressão do epitélio branquial (Martins 2004), também há relatos que a toxicidade aumenta com a elevação da temperatura da água (Carraschi et al. 2011) sendo esta afirmação muito importante para a realização de tratamentos em peixes tropicais. Para o sulfato de cobre é reportado que o mesmo é tóxico em água com baixa dureza e seu uso prolongado pode deixar os peixes debilitados (Bassleer 2011) além de que no ambiente natural já ocorrem problemas relacionados com o aumento da sua concentração nos corpos de água ocasionando efeitos tóxicos nos organismos aquáticos (Mazon et al. 2002).
Diante desse quadro, a utilização de uma ferramenta que possibilite diagnosticar a higidez dos peixes durante a realização dos tratamentos preventivos com essas substâncias é importante para avaliar o uso adequado destes produtos. Assim, o monitoramento das respostas hematológicas se apresenta como uma alternativa, pois, Jung et al. (2003) afirmaram que os valores sanguíneos demostram a toxicidade de um produto químico. Porém, não existe uma padronização, para os peixes tropicais, do quadro hematológico o que dificulta a interpretação de resultados.
O objetivo deste trabalho foi avaliar a infestação parasitária de monogenéticos branquiais e contagem diferencial de leucócitos do peixe ornamental Hemigrammus sp. submetidos a diferentes tratamentos com formalina (37%) e sulfato de cobre pentahidratado (CuSO4 5H20) como subsídio para manejo de exportação de peixes ornamentais.
MATERIAL E MÉTODOS
O Experimento foi realizado na Universidade Federal do Pará no campus de Bragança, no Laboratório de Ictioparasitologia e Piscicultura da UFPA. Foram coletados 200 peixes jovens Hemigrammus sp, provenientes do Rio Chumucuí, Bragança, Pará, Brasil (01º05'50''S e 46º47'33''W) transportados até o laboratório (6 km do local de coleta) e distribuídos em duas caixas de 500 litros, onde permaneceram em aclimatação durante 10 dias. Nas caixas havia aeração constante e a troca de 30% da água foi realizada todos os dias. Os peixes foram alimentados com ração comercial extrusada Poytara com pellets de 2mm (28 PB) todos os dias de manha e a tarde.
Após o período de aclimatação os peixes foram distribuídos em 15 recipientes contendo 3 litros de água, na densidade de 5 peixes por recipiente (peso vivo médio de 0,4 g), com aeração constante. O experimento foi conduzido em um sistema estático. Durante o experimento os peixes não foram alimentados e foram registradas as mortalidades, sendo realizada no fim do experimento a determinação da taxa de mortalidade. Os parâmetros de água como o pH, temperatura (YSI 60) e oxigênio dissolvido (YSI 550A) foram monitorados diariamente).
O delineamento utilizado foi inteiramente casualizado com 5 tratamentos e três repetições. Os tratamentos foram denominados de: T1, tratamento controle; T2, banho com duração de uma hora na concentração de 0,25 ml de formalina L-1 de água, repetido diariamente, por três dias; T3, banhos com duração de uma hora na concentração de 0,1 ml de formalina L-1, repetido diariamente, por 3 dias; T4, banhos de 24 horas na concentração de 0,025 ml de formalina L-1 de água por 3 dias e T5, banho de 24 horas com solução de sulfato de cobre na concentração de 0,3 mg L-1 por 3 dias. A cada término de banho, a água era retirada e renovada com água sem produtos, sendo que no controle o mesmo procedimento foi realizado Apresentar a composição e fórmula química da formalina (37%, H2CO) e sulfato de cobre pentahidratado (CuSO4 5H2O).
Após o término do experimento, uma amostra de 33% dos peixes de cada tratamento foi submetida a contagem de parasitos e a obtenção do sangue. Os peixes foram sacrificados por comoção cerebral e o sangue, devido ao pequeno tamanho dos peixes, foi coletado por corte da nadadeira caudal para confecção da extensão sanguínea seguido de coloração com Rosenfeld para a contagem diferencial de leucócitos, contudo, devido ao pequeno tamanho dos peixes e à quantidade insuficiente de sangue colhido, somente foi possível avaliar a proporção percentual dos diferentes tipos de leucócitos circulantes pelo método indireto em extensão sanguínea .
Para a análise parasitológica após essa etapa as brânquias foram retiradas, separou-se os arcos para observá-los entre lâmina-lâmina e então contar os monogenéticos in loco e posteriormente preservá-los em formol 10%.
Após a obtenção do número de parasitos por peixe, foram calculados a eficácia dos produtos testados [(número de parasitos no tratamento/número de parasitos no controle) x 100] e os índices parasitológicos de prevalência [(número de peixes infectados/número de peixes examinados) x 100)] e intensidade média (número total de parasitos/ número de peixes parasitados), segundo Bush et al. (1997).
De posse dos dados estes foram submetidos a analise de variância (ANOVA), sendo F significativo foi realizado o teste de Tukey (5% de probabilidade) para comparação das médias.
RESULTADOS E DISCUSSÃO
Durante o experimento foram monitorados os parâmetros doce água, pH: 7,22 ± 0, 16, oxigênio dissolvido: 6,87 ± 0,56 mg L-1 e temperatura: 29,3 ◦C ± 0,58. Não sendo esses valores prejudiciais aos peixes (Baldisseroto 2002).
No final do experimento observou-se que o T2 foi tóxico para os peixes ocasionando mortalidade de 100% do lote. De maneira geral, o manejo de troca de água pode ter provocado elevado estresse, pois nota-se mortalidade relativamente elevada, inclusive no controle. Contudo, esse é o manejo realizado comumente pelos envolvidos na comercialização de peixes ornamentais quando se realiza banhos terapêuticos. No T4 observou-se a menor mortalidade (33%).
Os peixes do controle (T1) apresentaram os maiores índices parasitológicos (p<0,05): que associada ao estresse de manejo, ocasionou mortalidades de até 40%. Os tratamentos T3 e T5 proporcionaram eficácia de 100% contra os parasitos, porém também foram tóxicos com mortalidades de 66,6% e 80% respectivamente. Em T4 foram obtidos resultados intermediários com eficácia de 77,7%, redução do numero total de parasitas (11,3± 9) e da prevalência (47,1%) e como citado anteriormente menor mortalidade. (Figura 1).
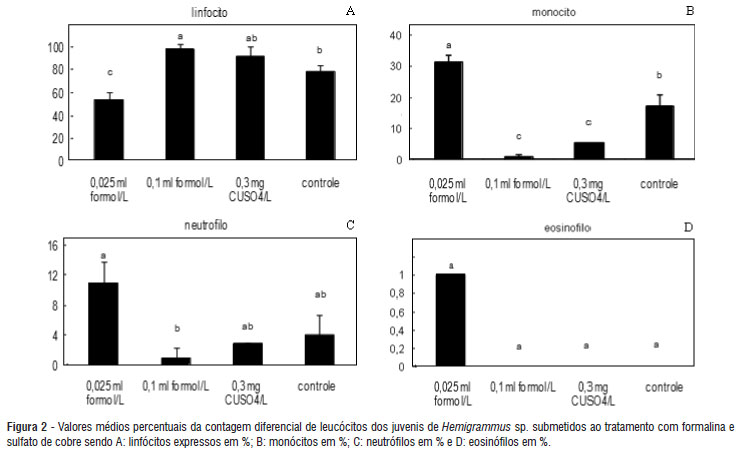
O T2 com 0,25 ml de formalina L-1 foi tóxico para os peixes ocasionando mortalidade de 100%, impedindo a análise da contagem diferencial de leucócitos neste tratamento. Nos demais tratamentos, após a contagem de leucócitos verificou-se a ausência de basófilos e que as quantidades de leucócitos granulares PAS positivos não se alteraram em relação ao controle. Porém, pôde-se observar que houve linfocitopenia, monocitose e neutrofilia no T4 (0,025 ml de formol L-1) em relação ao controle (p<0,05), causado pela presença da formalina na água durante 24 horas. Inversamente no T5 (0,3mg sulfato de cobre L-1) e no T3 (0,1 ml de formol L-1) houve linfocitose e monocitopenia em relação ao controle. (Figura 2).
A sobrevivência no controle e no T4 foi de 40% e 33%, o que indica que os peixes selvagens capturados foram sensíveis ao manejo utilizado, indicando que outras práticas de manejo devem ser adotadas pelos produtores e/ou pesquisadores que realizam tratamento nessa espécie, uma vez que o manejo por si só contribui para elevadas taxas de mortalidade.
Segundo Gandara et al. (2002) o uso da formalina é amplamente discutido na literatura e sua toxicidade varia de espécie para espécie mesmo em condições ambientais ideais de cultivo, e que podem ocorrer riscos de mortalidades quando este produto é utilizado mesmo em doses terapêuticas. Além disso, a condição sanitária e nutricional a qual o peixe está anteriormente ao tratamento é importante para a reposta ao tratamento, pois, peixes parasitados ou peixes desnutridos podem ser mais sensíveis ao tratamento com quimioterápicos e ao manejo. Além disso, em peixes pertencentes a populações naturais podem apresentar comportamentos fisiológicos distintos aos peixes oriundos de regiões impactadas ou mantidos em confinamento (Santos e Tavares Dias 2010).
No peixe marinho Seriola dumerili, por exemplo, a concentração de 300mg L-1 de formalina não causou mortalidades e, segundo esses mesmos autores não é restritivo o uso da formalina de forma profilática ou terapêutica para essa espécie. No presente trabalho, utilizando concentrações semelhantes, pôde-se observar que a formalina estressou os peixes, apresentando-se tóxico, provocando mortalidades elevadas (100% e 66%) em banhos de curta duração como em T2 (0,25 ml L-1) e T3 (0,1 ml L-1) respectivamente.
No caso de banhos de longa duração (T4, 0,025ml formol L-1) há indícios de que os peixes exibiam um quadro decorrente de estresse em função do aumento de neutrófilos e diminuição de linfócitos, resposta hematológica típico de agentes estressores (Tavares-Dias et al. 2001), apesar desse tratamento não apresentar mortalidade superior ao controle (33%).
O estresse de manejo, associado a presença dos parasitos e a presença do quimioterápico possivelmente tenham desencadeado a síndrome geral de adaptação que segundo Rotlland e Tort (1997) pode ser divididas em três etapas, sendo a ultima a fase de exaustão onde o organismo perde a homeostase e sucumbe ao agente estressor podendo levar a surtos de doenças e até mesmo a morte, o que provavelmente ocorreu pronunciadamente com os peixes submetidos aos tratamentos que receberam as maiores concentrações dos quimioterápicos testados (Figura. 1).
Jung et al. (2003) não observaram alterações no quadro leucocitário do linguado (Paralichthys olivaceus) quando este foi submetido a banhos de uma hora com diferentes concentrações de formalina (0,1, 0,2 e 0,3 ml L-1), porém observou que o formol pode causar inibição na transferência de oxigênio do sangue e danos no fígado e rim quando estes foram submetidos a banhos de curta duração. Para larvas de trairão (Hoplias lacerdae) a formalina foi considerada moderadamente tóxica com concentração letal (CL50) em 96 horas de 0,2 ml L-1 e em concentrações de 0,1 a 0,2 ml L-1. O fígado destes peixes apresentaram desarranjo cordonal, fusão celular e congestão dos sinusoides (Cruz et al., 2005). Assim, pode-se inferir que além de estressor o formol pode ter causado alterações graves em órgãos dos Hemigrammus sp., comprometendo a sanidade dos peixes do presente trabalho, causando as mortalidades.
Segundo Martins (2004), o formaldeído a 37% pode ser utilizado na forma de banho de curta duração (até 60 min) na concentração de 0,15 a 0,25 ml L-1 e em banhos de longa duração (24 h) na concentração de 0,010 a 0,015 ml L-1. Porém para a espécie Hemigrammus sp capturados na natureza, o banho com formalina durante 60 min na mesma concentração, citada pelo autor, mostrou-se tóxica em função da mortalidade de 100%. Isso pode ter ocorrido pelo fato dos peixes selvagens serem mais susceptíveis ao estresse e menos rústicos do que os de cultivo.
Segundo Rotlland et al. (1997) o Pagrus pagrus capturado na natureza apresentou aumento no nível de cortisol plasmático quando mantidos em alta densidade de estocagem. Dessa forma cuidados maiores devem ser realizados na estocagem e no tratamento de peixes nativos selvagens para exportação, pois, a resposta ao estresse se torna mais acentuada e a adaptação a nova condição fica comprometida.
Segundo Cruz et al. (2005) testes preliminares são essenciais anteriormente ao tratamento definitivo com a formalina devido a sua toxicidade. Isso ocorre devido a variação muito grande em relação à concentração recomendada por diversos autores, já que há uma variação em relação a CL50 e também à uma variação da toxicidade em relação ao grau de parasitismo em que os peixes se encontram.
Quanto ao banho empregado de sulfato de cobre houve um pequeno aumento significativo nos valores de linfócitos e uma redução nos valores de neutrófilos e monócitos de Hemigrammus sp (Figura 1). Segundo Tavares-Dias et al. (2002) consiste em resposta à alta atividade migratória e fagocíticas destas células até os locais que foram afetados pelo cobre como, brânquias, fígado e rim. Além do que a adição de metais na água pode reduzir as respostas imunes dos peixes devido ao seu efeito estressante, atuando sobre a liberação de corticosteróide e catecolaminas, tornando os peixes mais susceptíveis a infecções.
Tavares-Dias et al. (2001) afirmaram que diversos autores demonstraram neutrofilia, em peixes estressados, acompanhando a linfocitopenia. Mazon et al. (2002) em exposição aguda ao sulfato de cobre não encontrou diminuição no número de linfócitos em Prochilodus scrofa exposto ao cobre, mas observaram aumento no de neutrófilos quando os peixes foram expostos a 96 horas em solução com 20-29 µg de Cu L-1. Além disso, não observou alterações nos valores de monócitos corroborando com Fujimoto et al. (2009). Esses autores não verificaram diferença nos valores de monócito em peixes parasitados e não parasitados, contrariamente ao observado no presente estudo.
Essas variações podem ocorrer devido a concentração testada e o grau de dano que o cobre causa aos órgãos, pois, a alteração nos valores de leucócitos varia de acordo com a migração das células do vaso para o tecido lesado, além disso uma lesão em órgãos hematopoéticos também pode alterar esse quadro (Mazon et al., 2002; Tavares-Dias et al., 2002).
Tavares-Dias et al. (2002) estudaram a hematologia de pacus (Piaractus mesopotamicus) submetidos a banhos de sulfato de cobre por 24 horas em duas aplicações intermitentes e observaram que 24 horas depois do último banho houve diminuição do número de neutrófilos, quando expostos a concentração de 0,5 mg L-1, porém os autores relataram diminuição no número de linfócitos aos 8 dias após a exposição ao produto.
CONCLUSÕES
O sulfato de cobre e a formalina, reduzem a carga parasitária, mas foram tóxicos nas maiores concentrações. Banhos de 24 horas com formalina seriam mais indicados, porém outras concentrações devem ser testadas para peixes nativos e selvagens como o Hemmigramus sp. A duração dos banhos influenciou na proporção dos leucócitos sendo que mesmo em dosagens baixas recomendadas a formalina parece ter comprometido a saúde dos peixes.
AGRADECIMENTOS
A Poytara pelo fornecimento da ração para a realização do experimento e a CAPES pela concessão da bolsa de doutorado ao terceiro autor.
BIBLIOGRAFIA CITADA
Recebido em: 13/10/2011
Aceito em: 04/05/2012
- Araújo, L.D.; Chagas, E.C.; Gomes; Brandão, F.R. 2004. Efeito de banhos terapêuticos com formalina sobre indicadores de estresse em tambaqui. Pesquisa Agropecuária Brasileira, 39:217-221.
- Baldisserotto, B. 2002. Fisiologia de Peixes Aplicada à Piscicultura Ed. UFSM, Santa Maria. 212 pp.
- Bassleer, G. 2009. The new illustrated guide tofish diseasesBassleer Biofish, Westmeerbeek, Belgium. 232 pp.
- Goulding, M. 1980. The fishes and the forest. Explorations in Amazonian natural history University of California Press, Berkeley, CA, USA. 280 pp.
- Brandão-Gonçalves, L.; Oliveira, S.A.; Lima-Junior, S.E. 2010. Hábitos alimentares da ictiofauna do córrego Franco, Mato Grosso do Sul, Brasil. Biota Neotropica, 10:21-30.
- Bush, A.O.; Lafferty, K.D.; Lotz, J.M.; Shostak, A.W. 2009. Parasitology meets ecology on its own terms: Margolis et al revisited. Journal of Parasitology, 83:575-583.
- Carraschi, S.P.; Cubo, P.; Schiavetti, B.L.; Shiogiri, N.S.; Cruz, C. Pitelli, R.A. 2011. Efeitos tóxicos de surfactantes fitossanitários para o peixe mato grosso (Hyphessobrycon eques). Acta Scientiarum. Biological Sciences, 33:191-196.
- Casatti, L.; Mendes, H.F.; Ferreira, K.M. 2003. Aquatic macrophytes as feeding site for small ishes in the Rosana reservoir, Paranapanema river, southeastern Brazil. Brazilian Journalof Biology 63:213-222.
- Cruz, C.; Fujimoto, R.Y.; Luz, R.K.; Portella, M.C.; Martins, M.L. 2005. Toxicidade aguda e histopatologia do fígado de larvas de trairão (Hoplias lacerdae) expostas à solução aquosa de formaldeído a 10%. Pesticidas: Revista de Ecotoxicologia e Meio Ambiente 15:21-28.
- Fujimoto, R.Y.; Santana, C.A.; Carvalho, W.L.C.; Diniz, D,G.; Barros, Z.M.N.; Varella, J. E. A.; Guimarães, M. D. F. 2009. Hematologia e parasitas metazoários de camurim (Centropomus Undecimalis, bloch, 1792) na região Bragantina, Bragança-Pará. Boletim do Instituto de Pesca 35:441-450.
- Gándara, F.; Jover, M.; García-Gómez, A. (2002). Efecto del tratamiento con formol sobre el consumo de oxígeno de juveniles de seriola mediterránea Seriola dumerili (Risso, 1810). Bol. Inst. Esp. Oceanogr 377-383
- Garcia, F; Fujimoto, R.Y.; Martins, M. L.; Moraes, F. R. 2003. Parasitismo de Xiphophorus spp. por Urocleidoides sp. e sua relação com os parâmetros hídricos, Boletim do Instituto de Pesca 29:123-131.
- Jung, S.H.; Sim, D.S.; Park, M.; Jo, Q.; Kim, Y. 2003. Effects of formalin on haematological and blood chemistry in olive flounder, Paralichthys olivaceus (Temminck et Schlegel). Aquaculture Research 34:1269-1275.
- Martins, M.L., 2004. Cuidados básicos e alternativas no tratamento de enfermidades de peixes na aqüicultura brasileira, p.357-70. In: RANZANI-PAIVA, M.J., TAKEMOTO, R.M., LIZAMA, M.A.P. Sanidade de Organismos Aquáticos São Paulo: Editora Varela.
- Mazon, A. F.; Monteiro, E. A. S.; Pinheiro, G. H. D.; Fernandes, M. N. 2002. Hematological and physiological changes induced by short-term exposure to copper in the freshwater fish, Prochilodus scrofa. Brazilian Journalof Biology 62:621-631.
- Rotlland, J.; Pavlidis, M.; Kentouri, M.; Abad, M.E.; Tort, L. 1997. Non-specific immune reponses in the red progy pagrus pagrus after crowding stress. Aquaculture 156:279-90.
- Rotlland, J.; Tort, L. 1997. Cortisol and glucose response after acute stress by net handling in the sparid red porgy previously to subject crowding stress. Journal Fish Biology 51:21-28.
- Santos, R. B. S.; Tavares-Dias, M. 2010. Células sanguíneas e resposta hematológica de Oxydoras niger (pisces, doradidae) oriundos da bacia do médio rio solimőes, Boletim do Instituto de Pesca 36:283-292.
- Tavares-Dias, M.; Sandrim, E.F.S.; Moraes, F.R.; Carneiro, P.C.F. 2001. Physiological responses of "tambaqui" Colossoma macropomum (CHARACIDAE) to acute stress. Boletim do Instituto de Pesca 27:43-48.
- Tavares-Dias, M.; Martins, M. L.; Schalch, S. H. C.; Onaka, E. M.; Quintana, C. I. F.; Moraes, J. R.E.; Moraes F. R. 2002. Alterações hematológicas e histopatológicas em pacu, Piaractus mesopotamicus Holmberg, (1887) (Osteichthyes, Characidae), tratado com sulfato de cobre (CuSO4). Acta Scientiarum Animal Science. 24:547-554.
- Torres, M.F.; Giarizzo, T.; Carvalho, J.R.Jr. Diagnóstico, Tendência, Análise e Políticas Públicas para o Desenvolvimento da Pesca Ornamental no Estado do Pará Belém: SEPAq, 2008. 41p.
- Vargas, L. 2004. Efeito da Vitamina C, da Vitamina E, do Cloreto de Sódio e da Formalina na Ocorrência de Ectoparasitas em Tilápias do Nilo (Oreochromis niloticus). p. 371-382. In: Ranzani-Paiva, M.J.; Takemoto, R.M.; Lizama, M.A.P. Sanidade de Organismos Aquáticos São Paulo: Editora Varela.
Datas de Publicação
-
Publicação nesta coleção
27 Fev 2013 -
Data do Fascículo
Jun 2013
Histórico
-
Recebido
13 Out 2011 -
Aceito
04 Maio 2012