Diretriz de fibrilação atrial
Editor
Martino Martinelli Filho (SP)
Editores Associados
Dalmo A. Ribeiro Moreira (SP)
Adalberto M. Lorga (SP)
Eduardo Sosa (SP)
Jacob Atié (RJ)
João Pimenta (SP)
José Carlos S. de Andrade (SP)
Márcio Luis A. Fagundes (RJ)
Ricardo Ryoshim Kuniyoshi (ES)
Membros
Adalberto Lorga Filho (SP)
Adalberto Menezes Lorga (SP)
Alberto Nicodemus G. Lopes (PE)
Ângelo A. V. de Paola (SP)
Álvaro Barros da Costa (RN)
Ayrton Klier Péres (DF)
César J. Grupi (SP)
Cídio Halperin (RS)
Dalmo A. Ribeiro Moreira (SP)
Eduardo A. Sousa (SP)
Eduardo Sternick (MG)
Fernando Eugênio S. Cruz (RJ)
Francisco Carlos C. Darrieux (SP)
Gustavo Glotz Lima (RS)
Jacob Atié (RJ)
José Carlos Moura Jorge (PR)
José Carlos S. de Andrade (SP)
José Carlos Pachón Mateos (SP)
João Pimenta (SP)
Júlio Cesar de Oliveira (SP)
Leandro I. Zimerman (RS)
Márcio Luis A. Fagundes (RJ)
Martino Martinelli Filho (SP)
Maurício I. Scanavacca (SP)
Paulo de Tarso J. Medeiros (SP)
Reynaldo Castro Miranda (MG)
Roberto Costa (SP)
Ricardo Ryoshim Kunyioshi (ES)
Sérgio Gabriel Rassi (GO)
Silas S. Galvão Filho (SP)
Tamer N. Seixas (DF)
Thiago da Rocha Rodrigues (MG)
Coordenador
Jorge Ilha Guimarães (RS)
História da Fibrilação Atrial
A mais antiga referência à fibrilação atrial (FA) é creditada a um imperador chinês, que viveu entre 1696 a 1598 AC, o médico Huang Ti Nei Ching Su Wen3. Muito mais tarde, no século XV, a FA passou a ter conotação mais científica, sendo conhecida como "palpitações revoltosas", depois delirium cordis ou pulsus irregularis perpetuus. Parece que a primeira citação médica foi de William Harvey que, em 1628, em seu livro De Motu Cordis, ao descrever que os batimentos cardíacos "originavam-se na aurícula direita", mencionou que os animais, antes de morrerem, apresentavam "batimentos irregulares e ineficazes nas aurículas". O francês Jean Baptiste De Sénac, em 1749, descreveu as palpitações duradouras (pulsus irregularis perpetuus), atualmente conhecidas como FA paroxística. Esse autor também apresentou as relações entre estenose mitral e FA. Laënnec, em 1819, relatou que apenas a palpação do pulso era insuficiente para diagnosticar FA e que a ausculta cardíaca era necessária porque a "intermissão nos batimentos cardíacos", poderia manifestar-se sem o correspondente pulso3.
As antigas documentações gráficas de FA surgiram com o desenvolvimento do esfigmógrafo que, adaptado a um polígrafo, registrava as "movimentações das veias". Assim, parece que os primeiros registros de pulsos em humanos com FA, através desse instrumento, foram obtidos por Marey em 1863, em pacientes com estenose mitral. Vulpian, em 1874, deu o nome de mouvement fibrillaire às características oscilações do ritmo de FA documentadas em cães.
Em humanos, os primeiros registros simultâneos de pulsos arteriais, venosos e de batimentos cardíacos são atribuídos a James Mackenzie, em 1894, que demonstrou pulso irregular em casos de estenose mitral grave sem qualquer sinal de atividade atrial, auricular paralysis, nos registros venosos.
Em 1906, Einthoven publicou o traçado eletrocardiográfico de um caso de pulsus inaequalis et irregularis, em que complexos QRS com morfologia normal ocorriam irregularmente, "sob interferência", e não permitia a identificação de atividade elétrica 4. Esse traçado foi obtido por meio de um galvanômetro, desenvolvido por Einthoven, que pesava 270kg e utilizava 1,5km de fiação, o que motivou a denominação de télécardiogramme. Em 1909, Sir Thomas Lewis5 provou que ondas eletrocardiográficas irregulares, observadas na diástole, ocorriam somente na presença de "fibrilação das aurículas".
Essas descrições originais embasaram o estágio atual de conhecimentos acerca dos aspectos clínicos e eletrocardiográficos que envolvem a FA e, por isso, merecem ser enaltecidas continuamente por sua contribuição pioneira.
Aspectos Epidemiológicos. Tipos e Classificação
A FA é a arritmia sustentada mais freqüente na prática clínica, responsável por aproximadamente um terço das hospitalizações por distúrbios do ritmo cardíaco. A prevalência da FA é de 0,4% na população geral; aumenta com o avanço da idade e, a partir dos 50 anos, duplica a cada década. Em aproximadamente 30% dos casos, a FA pode ocorrer na ausência de cardiopatia (FA solitária), ou sem nenhuma doença (FA idiopática)6 Sabe-se, também, que a FA é muito mais freqüente na presença de doença do nó sinusal (síndrome bradi-taqui), síndrome de Wolff-Parkinson-White e de taquicardias por reentrada nodal atrioventrentricular (AV).
A real incidência de FA no Brasil ainda não é conhecida. Entretanto, estima-se que seja mais freqüente em homens do que em mulheres, na proporção de 2:1.
Por outro lado, o flutter atrial é bem menos comum do que a FA, especialmente como apresentação crônica. Neste caso, quase sempre está associado à cardiopatia estrutural e/ou doença pulmonar obstrutiva crônica grave. Os episódios de flutter atrial agudo são geralmente transitórios e, com freqüência, revertem para FA ou ritmo sinusal. A forma crônica do flutter atrial é incomum, e sua prevalência não é referida porque invariavelmente é descrita em associação com a FA.
As situações que mais freqüentemente se associam ao flutter atrial são: doença pulmonar obstrutiva crônica, e o pós-operatório (imediato e tardio) de fechamento de comunicação interatrial e correção de anomalia de Ebstein.
O prognóstico atual do flutter atrial é bom porque o tratamento através da ablação por radiofreqüência tem demonstrado alta eficácia. Alguns estudos7,8 sugerem risco aumentado de fenômeno tromboembólico, semelhante ao da FA crônica, especialmente quando o flutter atrial está associado à cardiopatia estrutural, com disfunção sistólica. Não se sabe, na verdade, se este risco aumentado deve-se exclusivamente ao flutter atrial ou à coexistência de FA.
Os critérios classificatórios relativos às apresentações da fibrilação e do flutter atrial são absolutamente distintos. Assim, serão separadamente abordados:
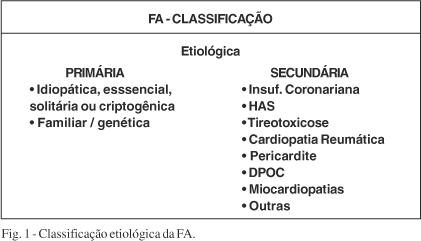
Fibrilação atrial - Durante os últimos anos, inúmeros tipos de classificação foram sugeridos: etiológica (primária ou secundária); cuja importância se deve, especificamente, às clássicas apresentações "idiopática" e "reumática" (fig. 1); sintomatológica (sintomática ou silenciosa); - de acordo com a resposta ventricular (alta, adequada ou baixa); aspecto eletrocardiográfico (fina ou grosseira); eletrofisiológica (Ex. Konings®tipo I, II e III); conforme o modo de início (adrenérgica ou vagal-dependente); de acordo com a resposta à ablação por RF; e pelo padrão temporal (aguda, paroxística ou crônica). Esta última parece ser a mais adequada porque tem implicações terapêuticas muito claras.
A versão atual foi proposta por Camm (fig. 2), que excluiu o subgrupo "aguda" e estabeleceu os seguintes critérios: a) FA inicial - Primeira detecção, sintomática ou não, da arritmia, desde que a duração seja superior a 30s (forma sustentada). Neste critério incluem-se, ainda, casos de FA com início desconhecido e história clínica de primeiro episódio; b) FA crônica - em que se documenta a recorrência da arritmia, podendo se apresentar de 3 formas distintas:
1) paroxística: episódios com duração de até 7 dias. Geralmente são autolimitados e freqüentemente revertem espontaneamente a ritmo sinusal; 2) persistente: episódios com duração superior a 7 dias. Neste caso, a interrupção da FA geralmente exige cardioversão elétrica e/ou farmacológica. O limite de 7 dias, embora arbitrário, define um período no qual a reversão espontânea é pouco provável e a reversão farmacológica raramente ocorre. É importante salientar que essa pode ser a primeira apresentação clínica da arritmia ou pode ser precedida por episódios recorrentes, tornando difícil, muitas vezes, o diagnóstico diferencial com a FA inicial; 3) permanente: casos em que a arritmia está documentada há algum tempo e que a cardioversão, farmacológica ou elétrica, é ineficaz na reversão a ritmo sinusal. Incluem-se também, nessa apresentação: I- casos de recorrência de FA até 24h pós-cardioversão elétrica (CVE) otimizada; II-FA de longa duração, em que a CVE está contra-indicada ou não é aceita pelo paciente, o que alguns preferem denominar FA permanente "decidida".
Flutter atrial - A tradicional classificação do flutter atrial leva em consideração o aspecto eletrocardiográfico das ondas "f". Assim, o flutter atrial é dito comum ou típico quando a freqüência atrial média é de 300 bpm, as ondas são predominantemente negativas nas derivações DII, DIII e aVF e o aspecto morfológico é de um serrilhado. O flutter atrial incomum ou atípico, por outro lado, geralmente apresenta freqüência atrial mais rápida, as ondas atriais são menos uniformes, positivas em DII, DIII e aVF e nem sempre pode ser reconhecido ao ECG. Esta classificação tem merecido críticas, especialmente de eletrofisiologistas, porque os dois tipos podem ter o mesmo mecanismo eletrofisiológico: uma macro-reentrada cujo substrato anatômico envolve o istmo cavo-tricuspídeo (ICT). Assim, recentemente foi proposta uma nova classificação para flutter atrial, que inclui 5 apresentações: 1) flutter atrial típico (ECG típico, com rotação anti-horária pelo ICT); 2) flutter atrial típico reverso (ECG atípico, com rotação horária pelo ICT); 3) flutter atrial tipo "lower loop" (em torno da veia cava inferior); 4) flutter atrial incisional (ao redor de cicatrizes, ex.: CIA operada) e 5) taquicardia macrorreentrante atrial esquerda (flutter de átrio esquerdo). Esses três últimos tipos são ditos incomuns ou atípicos. Esta classificação é limitada, uma vez que os achados clínicos e eletrocardiográficos não permitem 100% de acurácia diagnóstica. Assim, na prática, ainda é mais simples classificar o flutter atrial apenas pelo aspecto eletrocardiográfico.
Bases Anatômicas e Mecanismo Eletrofisiológico da FA
1- Patologia e remodelamento atrial
Wijffels e cols10, em estudo experimental realizado em corações de cabras, demonstraram os efeitos da indução laboratorial da FA através de estimulação atrial rápida. Os autores observaram que, quanto maior o número de reinduções da FA, maior o tempo de duração da arritmia. A FA de duração cada vez mais longa está associada ao encurtamento progressivo do período refratário efetivo atrial, possivelmente relacionado à redução dos canais de íons cálcio do tipo L. Este fenômeno foi denominado de remodelamento eletrofisiológico e alguns estudos sugerem que pode ser inibido pelo uso de bloqueadores de cálcio.
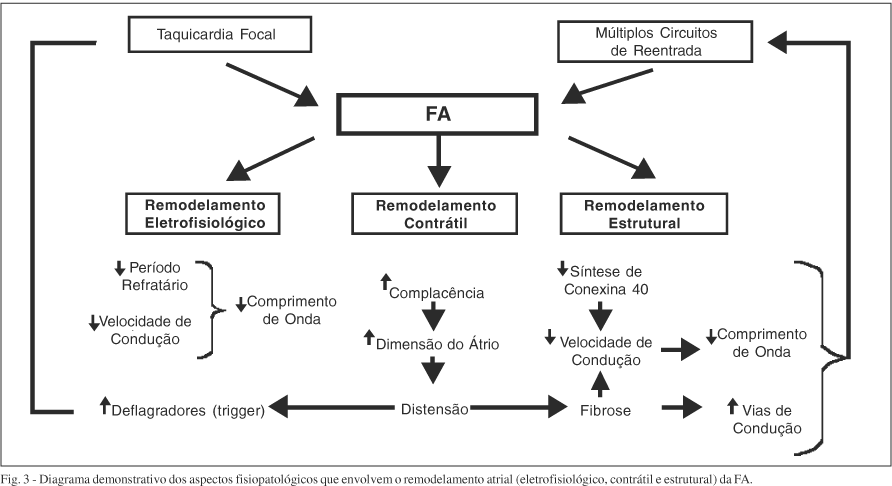
Ao lado desse remodelamento eletrofisiológico, sugere-se que a FA seja responsável por remodelamento contrátil e estrutural, os quais envolvem respectivamente modificações da complacência atrial e redução da conexina 40 (fig.3). O substrato anatomopatológico dessas alterações é constituído por: hipertrofia das fibras musculares (achado principal); justaposição de tecido normal com fibras doentes, o que poderia explicar a característica heterogeneidade do período refratário atrial; alterações compatíveis com miocardite (FA isolada), sugerindo provável componente inflamatório na patogênese da arritmia; e fibrose intersticial extensa, o que pode explicar a ocorrência freqüente de FA sustentada em casos de insuficiência cardíaca.
Por outro lado, na ausência de cardiopatia, níveis séricos de anticorpos antimiosina de cadeias pesadas foram detectados na FA paroxística, sugerindo o papel de mecanismos auto-imunes na gênese da arritmia.
2 - Mecanismos eletrofisiológicos da FA
Duas teorias são aceitas, atualmente, para explicar os mecanismos eletrofisiológicos envolvidos na FA: a da ativação focal e a das múltiplas ondas de reentrada.
A teoria da ativação focal surgiu com os estudos de Scherf e cols11, que demonstraram que a aplicação tópica de aconitina no átrio originava taquicardia atrial rápida, que por sua vez, induzia a FA. Recentemente, Haissaguere e cols12 demonstraram que a presença de extensões do tecido endomiocárdico do átrio esquerdo nos óstios das veias pulmonares favorece o surgimento de focos ectópicos rápidos capazes de deflagrar a FA. Também foi demonstrado que, além das veias pulmonares, os focos ectópicos indutores da FA podem ser encontrados no ligamento de Marshall, veias cavas e crista terminalis.
A teoria das múltiplas ondas de reentrada, proposta por Moe e cols13 sugere que vários circuitos de reentrada atrial são responsáveis pela ocorrência da FA. Os autores observaram também que, para a sustentação da arritmia, é preciso que uma área mínima de tecido atrial esteja envolvida, a qual é denominada massa crítica, o que explicaria a maior ocorrência da FA em doenças que provocam a distensão ou hipertrofia do tecido atrial.
Maiores conhecimentos foram recentemente agregados através das publicações de Allessie e cols14, que analisaram a seqüência de ativação na FA com o uso de mapeamento de múltiplos eletrodos e demonstraram que estímulos prematuros com bloqueio unidirecional ocorrem pela presença de condução anisotrópica atrial ou pelas próprias características heterogêneas da refratariedade atrial.
Sabe-se também que as características do circuito reentrante dependem dos valores do período refratário e da velocidade de condução do impulso, e que o produto desses valores define o comprimento de onda. Assim, a ativação atrial com um grande comprimento de onda pode gerar um único circuito macro-reentrante (ex.: flutter atrial), enquanto que a presença de comprimento de onda mais curto favorece a ocorrência de vários e pequenos circuitos de reentrada, caso típico da FA.
Sumariamente, a análise crítica dos achados de Scherf e Moe11,13 sugere que as duas teorias se completam. A presença de focos ectópicos, únicos ou múltiplos, ocasiona, em condições especiais, alterações da refratariedade e da velocidade de condução do tecido atrial e favorecem a gênese dos circuitos reentrantes.
Investigação do Paciente com FA
O diagnóstico de FA é muito fácil; exige apenas a documentação eletrocardiográfica. Está comumente associada à cardiopatia oro-valvar (principalmente mitral), isquêmica ou hipertensiva, sobretudo na presença de hipertrofia ventricular esquerda.
As condições mórbidas não-cardiovasculares que mais freqüentemente se associam à FA são: ingestão excessiva de álcool ou cafeína, hipertireoidismo, embolia pulmonar e doença pulmonar crônica. A abordagem diagnóstica da FA envolve:
1 - Investigação basal (mínima)
Inclui os procedimentos mínimos necessários para o diagnóstico.
Avaliação clínica - Aproximadamente 60% dos casos de FA são diagnosticados por meio da história clínica e do exame físico. A anamnese dirigida, em geral, permite distinguir as apresentações clínicas, sobretudo as paroxísticas das permanentes.
As manifestações clínicas são muito variáveis. FA isolada, em geral, é assintomática, o que impossibilita a caracterização clínica do episódio como inicial ou crônico. Por outro lado, situações graves como edema agudo dos pulmões podem ocorrer na presença de estenose mitral e morte súbita, apesar de rara, pode acometer pacientes com síndrome de Wolff-Parkinson-White. Os casos crônicos se caracterizam, na sua grande maioria, pela história de episódios paroxísticos recorrentes e pela presença de cardiopatia estrutural. Os achados cardiovasculares associados mais comuns são: hipertensão arterial sistêmica, valvopatias reumáticas, cardiopatia isquêmica e insuficiência cardíaca congestiva. Estes, em geral, pioram a qualidade de vida e aumentam as taxas de internações.
Os exames que conduzem ao diagnóstico de FA são:
Eletrocardiograma de repouso(ECG) - É o exame essencial para o diagnóstico da FA. Pacientes com a forma paroxística ou persistente, freqüentemente apresentam durante ritmo sinusal, ao ECG, onda P com aspecto bimodal, caracterizando aumento da duração ou amplitude da despolarização atrial. Em alguns casos, durante ritmo de FA, distingue-se atividade atrial com variação de forma, amplitude e polaridade. A origem dessas atividades pode ser a região atrial direita (crista terminalis, adjacências da veia cava inferior e seio coronariano), ou esquerda (veias pulmonares). Por vezes, é possível documentar o início do episódio através da despolarização precoce atrial ou da taquicardia atrial. O ECG pode, às vezes, manifestar apenas uma linha de base com inúmeras ondas f sem qualquer atividade elétrica normal dos átrios, caracterizando a "FA fina". A alternância de ciclos ou aumento abrupto da FC durante a instalação da FA pode provocar complexos QRS com aberrância de condução. Diferentes graus de QRS aberrante e freqüência cardíaca muito elevada em pacientes jovens, sempre devem levantar suspeitas de síndrome de Wolff-Parkinson-White.
Radiografia do tórax - O estudo radiológico do tórax é particularmente importante para a avaliação da circulação pulmonar e as dimensões do átrio esquerdo, caracterizando a importância clínica das doenças valvares.
Ecocardiograma transtorácico (ETT) - É considerado exame obrigatório na investigação clínica de qualquer paciente com história de FA. É capaz de avaliar a estrutura anatômica e funcional dos átrios e septo interatrial, a anatomia e função das valvas cardíacas, em particular a mitral e a função sistólica do ventrículo esquerdo. A sensibilidade do ETT para a avaliação de trombos intracavitários em pacientes com FA é estimada entre 33 e 72%15-17 exames clínico - laboratoriais.
Essa avaliação é útil para a determinação de distúrbios hidroeletrolíticos, principalmente nos pacientes em uso crônico de diuréticos, sendo rotineira a determinação dos níveis dos íons sódio, potássio e magnésio. A avaliação da função tireoidiana deve ser sempre realizada, devido à freqüente associação, sobretudo da FA recorrente com doenças da tireóide.
2 - Investigação complementar
Inclui os procedimentos necessários para complementação diagnóstica em situações específicas.
Holter 24h - O ECG contínuo de 24h pode contribuir muito na avaliação dos sintomas e na documentação do início e término dos episódios de FA. Também permite a análise da frequência ventricular média, que tem importância terapêutica (taquicardiomiopatia) e o diagnóstico da síndrome bradi-taqui.
Ecocardiograma transesofágico (ETE) - O ETE tem demonstrado muitas vantagens sobre o ETT, na avaliação de pacientes com FA. A sensibilidade estimada do ETE, para a documentação de trombos intracavitários, tem sido estimada entre 97 a 100% enquanto que a especificidade varia entre 98 e 100%18-20.
Eletrocardiograma de alta resolução (ECGAR) - A medida da duração total da onda P, por meio do registro do ECGAR, apresenta importância diagnóstica do grau de distensão da câmara atrial, com sensibilidade de 80%, especificidade de 93% e valor preditivo de 92% 21.
Estudo eletrofisiológico (EEF) - É útil no esclarecimento diagnóstico de pacientes com relato de palpitações não-documentadas, podendo, ainda, afastar a presença de outras arritmias, comprovar a presença de síndrome de WPW ou de taquicardia supraventricular, que facilmente degenera para FA.
Prognóstico de Pacientes com FA-Tromboembolismo e Fatores de Risco
A taxa de mortalidade em pacientes com FA está associada à presença de cardiopatia estrutural. Os achados de ensaios que incluíram pacientes com insuficiência cardíaca (IC) avançada e FA revelam taxas de mortalidade controversas: o estudo SOLVD22 demonstrou índice de mortalidade estimado em 34% nos pacientes com FA vs 24%, com ritmo sinusal, enquanto o estudo V-Heft23 não revelou diferenças entre esses subgrupos. Por outro lado, em pacientes com IC classe funcional I ou II, a presença de FA não é determinante de maior mortalidade.
O prognóstico da FA está intimamente relacionado a marcadores de risco, cujo reconhecimento implica na orientação terapêutica profilática das complicações, aumentando a sobrevida e melhorando a qualidade de vida dos pacientes.
Os eventos tromboembólicos são responsáveis por taxas de mortalidade de 50% a 100% mais elevadas em pacientes com FA, em relação a indivíduos normais24.
A FA é considerada a condição clínica isolada de maior risco relativo para a ocorrência de acidente vascular cerebral (AVC). Comparada a outros fatores, no estudo de Framingham25 foi demonstrado que a ocorrência de AVC aumenta 2 vezes na presença de doença aterosclerótica coronariana, 3 vezes na de hipertensão arterial, 4 vezes na de IC e quase 5 vezes, na presença de FA. A combinação desses fatores, assim como o avanço da idade, torna esses riscos ainda maiores. Na faixa etária de 50 a 59 anos, é de 1,5% ao ano; na faixa de 80 a 89 anos, é de 23,5%.
Numa análise multivariada, que incluiu vários estudos multicêntricos em portadores de FA26, foram considerados fatores de risco preditores de AVC: idade, história de hipertensão arterial, diabetes e evento tromboembólico prévio. Pacientes com menos de 65 anos e sem esses fatores apresentam incidência de AVC de apenas 1% / ano.
O estudo SPAF- Stroke Prevention of Atrial Fibrillation27,28 demonstrou que o risco de AVC está associado à coexistência dos seguintes fatores de risco: pressão arterial sistólica > 160 mmHg, insuficiência cardíaca recente, idade > 75 anos, evento tromboembólico prévio, fração de encurtamento sistólico do VE < 25% e átrio esquerdo com diâmetro > 2,5 cm/ m2 (± 4,5cm). Também foram considerados marcadores: contraste espontâneo ou trombo no átrio esquerdo e placas ateroscleróticas complexas na aorta torácica, ao ECO transesofágico. Esse exame, entretanto, não tem valor preditivo para risco de AVC estabelecido, por falta de maiores evidências científicas.
Com relação ao flutter atrial, pouco se conhece sobre a incidência de tromboembolismo. Seidl e cols29 concluíram que a taxa de eventos tromboembólicos em pacientes referidos para tratamento de flutter atrial é de 1,8% ao ano. A análise univariada revelou que: cardiopatia isquêmica, função ventricular esquerda deprimida, hipertensão arterial sistêmica e diabetes mellitus são fatores de risco para a ocorrência de flutter atrial. Entretanto, por análise multivariada, foi demonstrado que a hipertensão arterial sistêmica é o único fator independente preditor de risco de tromboembolismo. Vários estudos têm demonstrado risco de 10 a 20 % para a instalação de FA após ablação com sucesso do istmo cavo-tricuspídeo para tratamento do flutter atrial. Avaliando dados do Medicare, dentre 749.988 pacientes seguidos por oito anos, Biblo e cols8 demonstraram que o flutter atrial aumenta o risco de AVC e, a concomitância de episódios de FA torna esse risco ainda maior.
O impacto da anticoagulação sobre o prognóstico de pacientes com FA e flutter atrial será discutido adiante.
Terapêutica da FA
A terapêutica da FA deve ser discutida levando em consideração o tipo de intervenção. A terapêutica não-invasiva inclui restauração do ritmo sinusal, controle de freqüência, prevenção das recorrências e anticoagulação. A terapêutica invasiva discutirá o papel da ablação por cateter, do tratamento cirúrgico e da estimulação cardíaca artificial.
1 - Terapêutica não-invasiva
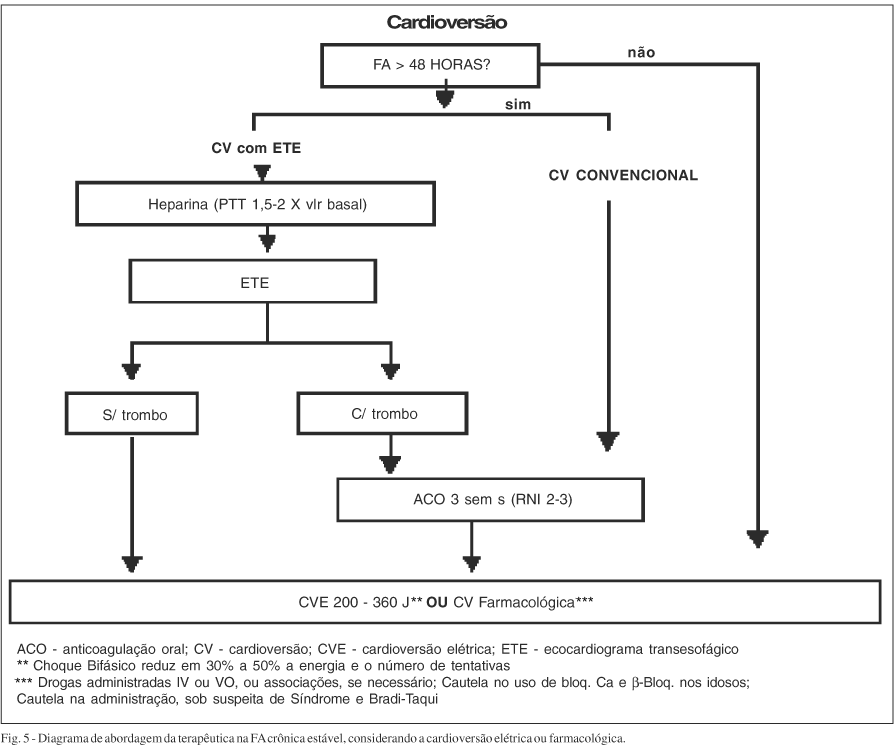
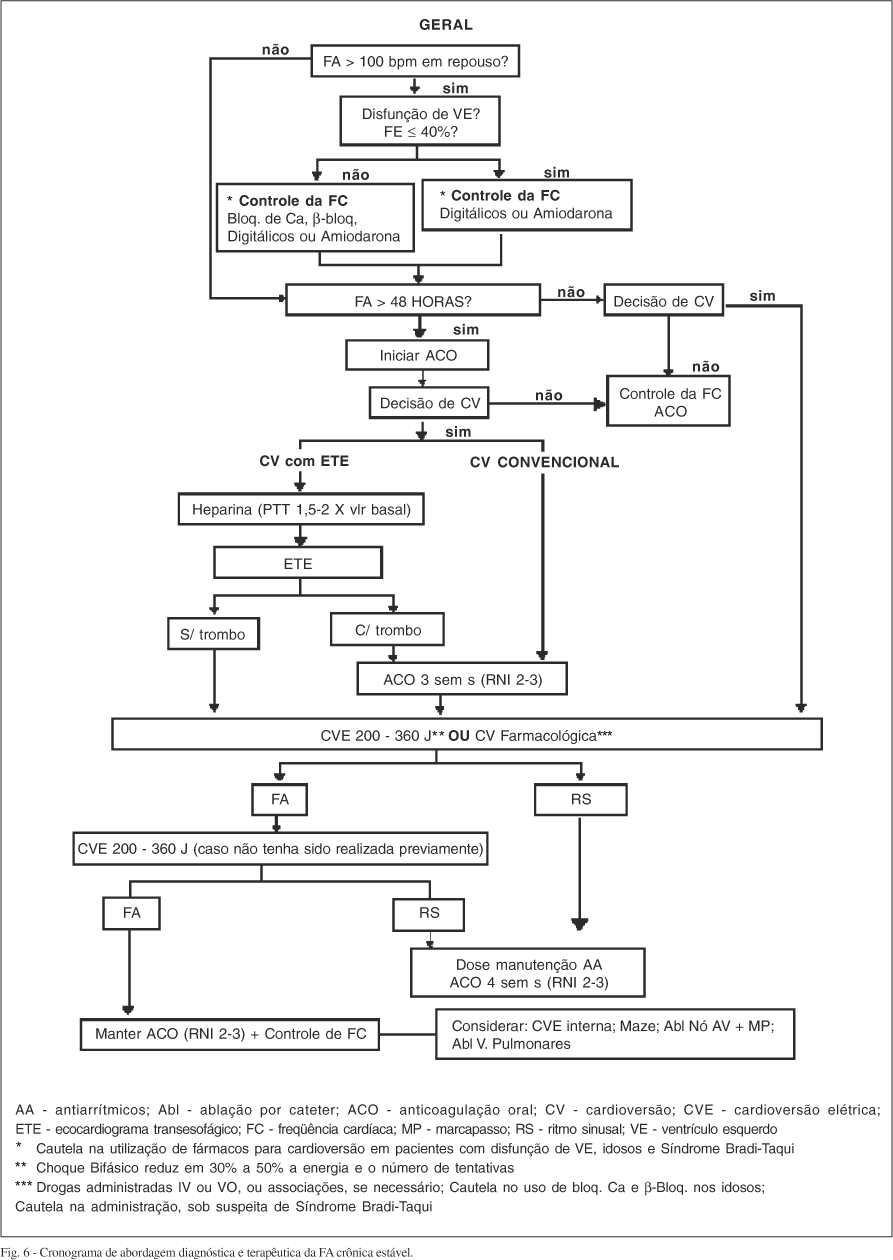
Para facilitar o acompanhamento dos procedimentos discutidos a seguir, as figuras 4, 5 e 6 incluem os diagramas de condutas terapêuticas, conforme a apresentação clínica da FA.
A - Restauração do ritmo sinusal
Durante as primeiras 12, 24 e 48h de hospitalização, os índices de reversão espontânea para RS são respectivamente estimados em: 34 a 45%, 55 a 87% e 76 a 92%. Por outro lado, nos episódios de FA com mais de 7 dias de duração, a reversão espontânea é pouco freqüente. Os fatores clínicos de predição para a reversão espontânea da FA são a ausência de doença cardíaca estrutural, idade < 60 anos e duração do episódio inferior a 24h30,31.
Os procedimentos terapêuticos realizados na reversão da FA para ritmo sinusal são:
Cardioversão farmacológica - A cardioversão farmacológica é mais eficaz na FA inicial com duração inferior a 7 dias ou crônica paroxística e, apesar de ser menos eficiente que a cardioversão elétrica, é mais simples, principalmente porque evita o inconveniente da anestesia geral.Os estudos demonstram que ao final das primeiras 48h do tratamento da FA paroxística, as drogas antiarrítmicas apresentam pouca superioridade em relação ao placebo, devido ao alto índice de reversão espontânea. A vantagem, entretanto, é que alguns fármacos são capazes de abreviar o tempo de reversão da FA, em relação ao placebo.
Recente estudo metanalítico32 avaliou 91 ensaios randomizados controlados (8.563 pacientes) e demonstrou que antiarrítmicos de classe IA, IC e III são significantivamente mais eficazes, em relação ao placebo, na reversão de FA. Não houve, entretanto, diferenças com relação à mortalidade e não foi possível analisar os efeitos adversos comparativos das drogas antiarrítmicas, por falta de informações consistentes.
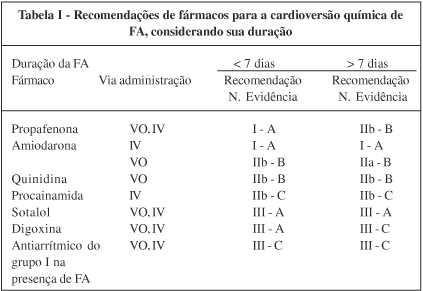
Os fármacos de primeira escolha para reversão da FA inicial ou paroxística são a propafenona e a amiodarona. Outras drogas, com menor grau de recomendação, são a quinidina e a procainamida. (tab. I). Os fármacos das classes IA e IC devem ser evitados nos pacientes com disfunção ventricular e, nesses casos; a droga de escolha é a amiodarona, em função do satisfatório índice de reversão e segurança33,34. Também para os casos de FA persistente, a droga de escolha para a reversão é a amiodarona. A propafenona, a quinidina e a procainamida, são alternativas com menor grau de recomendação. A digoxina e o sotalol não devem ser utilizados (tab. I).
A importância dos principais fármacos na cardioversão da FA, assim como suas propriedades específicas serão apresentadas a seguir.
Amiodarona - O papel da amiodarona na reversão da FA com duração inferior a 7 dias foi avaliado por 2 metanálises recentemente publicadas33,34, que demonstraram maior eficácia da droga em relação ao placebo. Comparada aos antiarrítmicos da classe IC, a amiodarona mostrou-se menos eficaz nas primeiras 8h do início do tratamento, mas igualou-se a essas drogas ao final de 24h.
A via de administração mais usual da amiodarona, na reversão de FA, é a intravenosa. Recomenda-se uma infusão inicial de 5 a 7 mg/kg em 30 a 60min e, em seguida, 1,2 a 1,8 g/dia em infusão contínua até o total de 10g. Por via oral, sob monitorização em ambiente hospitalar, deve-se utilizar entre 1,2 e 1,8 g/dia, até o total de 10g e, sob administração ambulatorial, a dose recomendada é de 600 a 800 mg/dia, até atingir 10g. A utilização da amiodarona em administração de ataque (única), mostrou eficácia apenas na dose de 30 mg/kg.
Os efeitos adversos imediatos da amiodarona mais comuns são: bradicardia, hipotensão, distúrbio visual, náuseas, constipação intestinal e flebite (administração IV).
Diversos estudos demonstraram que a amiodarona também é uma droga segura quando administrada em pacientes com cardiopatia estrutural e disfunção ventricular importante.
Propafenona - A propafenona é muito eficaz na reversão de FA inicial ou paroxística tanto por via oral (450 ou 600 mg) quanto por IV (2mg/Kg), mas tem eficácia reduzida nos casos de FA persistente. Achados documentados, recentemente, através de uma metanálise35 e um estudo de revisão31. Esses estudos indicaram ainda que a propafenona deve ser utilizada apenas em pacientes sem cardiopatia estrutural e que não é recomendável nas seguintes situações: idade > 80 anos, IC classe funcional (NYHA) > II, fração de ejeção de VE < 40%, pressão arterial sistólica < 95 mmHg, FA com resposta ventricular espontânea < 70 bpm, duração do QRS > 0,11s, evidências de BAV avançado, disfunção do nó sinusal, hipocalemia e associação com outros antiarrítmicos31.
A taxa de efeitos adversos da propafenona é baixa, a saber: transformação da FA em flutter atrial com condução atrioventricular 1:1 mal tolerada (risco grave - 0,3%); hipotensão arterial transitória (2,5%), bradiarritmias transitórias (1%), óbito (0,1%) e flutter atrial com condução AV > 2:1. (4, 5, 17, 28-41).
Quinidina - A quinidina é um fármaco comprovadamente eficaz na reversão da FA e ritmo sinusal. Alguns estudos demonstraram que sua eficácia é semelhante à da amiodarona e superior à da propafenona na FA crônica persistente e sotalol. Particularmente na reversão da FA inicial ou paroxística, a eficácia da quinidina é inferior à da propafenona oral. Seu uso, entretanto, tem sido desestimulado pelo risco de pró-arritmia (torsades de pointes), que geralmente ocorre na primeira semana pós-início da administração e em pacientes com cardiopatia estrutural.
Procainamida - Poucos estudos testaram a eficácia da procainamida na reversão da FA e seus achados não foram convincentes no sentido de recomendar sua administração rotineira.
Sotalol - Uma revisão sistemática36 de estudos que testaram o uso do sotalol na reversão da FA não demonstrou eficácia superior ao placebo e à quinidina. O índice de reversão para RS variou de 4% a 49% e, portanto, não há evidências científicas para recomendar sua administração.
Cardioversão elétrica (CVE) - É considerado o método de escolha na reversão de FA para ritmo sinusal nos idosos e/ou nas seguintes situações específicas: instabilidade hemodinâmica, disfunção ventricular grave e FA de longa duração. Isto porque, além de ser mais eficiente que a cardioversão química, nessas situações a administração de fármacos para a reversão a ritmo sinusal é acompanhada de maiores riscos de complicações. O sucesso da CVE para reversão de FA é estimado entre 70% e 90% e depende das características clínicas das casuísticas, assim como dos critérios de sucesso terapêutico estabelecidos em cada estudo37.
Vários fatores, como a cardiopatia de base, idade, duração da FA, conformação torácica, entre outros, podem interferir no sucesso do procedimento. Em análise multivariada, os únicos fatores independentes de predição de sucesso foram a presença de flutter atrial, o tempo de duração da FA e pacientes jovens. Preditores independentes de insucesso foram átrio esquerdo aumentado, presença de cardiopatia estrutural e cardiomegalia37.
A CVE pode ser realizada por meio de choque externo (CVE transtorácica) ou interno (CVE interna), com o paciente em jejum e sob anestesia geral. O choque deve ser sincronizado com o QRS, para evitar a ocorrência de fibrilação ventricular. A energia inicial preconizada para reversão da FA é de 200J (no flutter atrial, recomenda-se iniciar com 50J). Caso não se obtenha sucesso, a energia deve ser aumentada de 100 em 100 J até atingir 360J.
Estudos recentes demonstraram que a taxa de sucesso de reversão para ritmo sinusal, na CVE transtorácica, é influenciada pelos seguintes fatores: 1) posicionamento ântero-posterior das pás do cardioversor sobre o tórax, superior ao o ântero-lateral; 2) choque de onda bifásica, superior ao de onda monofásica, exigindo menor número de tentativas e da quantidade de energia; 3) administração de antiarrítmicos, como amiodarona e propafenona, prévia ao procedimento, que também reduz as taxas de recorrências precoces pós-CVE.
A CVE interna é opção eficaz, com taxas de sucesso próximos a 100%, em pacientes refratários à CVE externa. Entretanto, trata-se de procedimento invasivo e complexo, que exige treinamento específico e, portanto, pouco indicado.
Recomendações para CVE e farmacológica da FA.
Classe I- 1) CVE imediata nos casos de FA com alta resposta ventricular, associados a IAM e angina ou com instabilidade hemodinâmica importante (edema agudo de pulmão, choque, IC descompensada, hipotensão grave), que não respondam prontamente a manobras farmacológicas (NE=D); 2) CVE em pacientes com FA sem instabilidade hemodinâmica, porém altamente sintomáticos (NE=C).
Classe II a - 1) Cardioversão, elétrica ou farmacológica, para abreviar a restauração do ritmo sinusal em pacientes com primeiro episódio de FA (NE=C); 2) CVE em pacientes com FA persistente, com poucas chances de recorrência (NE=C); 3) CVE repetidas, em pacientes com FA recorrente que não tenham recebido antiarrítmicos após cardioversão com sucesso. (NE=C); 4) cardioversão farmacológica ambulatorial com administração de amiodarona ou propafenona, para reversão de FA paroxística ou persistente, quando houver segurança para utilização da droga (NE=C).
Classe IIb - Cardioversão química em pacientes com FA persistente, com pouca possibilidade de recorrência. (NE=C).
Classe III - 1) CVE em pacientes com alternância de ritmo sinusal e FA em curtos períodos de tempo. (NE=C); 2) CVE em pacientes com recorrência precoce da FA pós-reversão para ritmo sinusal, apesar de terapêutica adequada para prevenção de recorrência. (NE=C).
Anticoagulação para restauração do ritmo sinusal - A ocorrência de tromboembolismo em pacientes com FA submetidos à cardioversão, sem anticoagulação prévia, é estimada entre 1% a 7%38. As taxas se reduzem a menos de 1% sob anticoagulação, com RNI entre 2 e 3, durante 3 semanas pré-cardioversão e 4 semanas após, uma vez que os mecanismos trombogênicos pré e pós-cardioversão da FA são distintos. Após 48h em FA, a estase sanguínea intra-atrial, conseqüente à ausência de contração efetiva, favorece à formação de trombos. Nesse caso a anticoagulação oral, antes do procedimento, por 3 semanas, com RNI entre 2 e 3, estabiliza o trombo na cavidade e impede a formação de novos trombos. Por outro lado, a própria cardioversão (farmacológica ou elétrica) provoca "atordoamento" atrial por 4 semanas e conseqüentemente estase atrial, responsável por formação de novos trombos. Daí a necessidade de se manter, sempre, a anticoagulação (RNI entre 2 e 3)durante esse período pós-cardioversão, independente do resultado do ECO transesofágico, e do tipo de cardioversão.
A duração da anticoagulação pré-cardioversão entretanto, pode ser abreviada, na ausência de trombo intracavitário, ao ECO transesofágico. Isto porque foi comprovado que a heparinização plena, até atingir TTPA 2 vezes o basal, em geral obtido em menos de 24h, permite a imediata cardioversão39. A anticoagulação oral por 4 semanas deve sempre ser mantida, com RNI entre 2 e 3.
Na cardioversão do flutter atrial, deve-se seguir as mesmas recomendações para a FA, pois, apesar do menor risco de tromboembolismo, fatores trombogênicos semelhantes aos da FA e a ocorrência de fenômenos tromboembólicos pós cardioversão têm sido descritos40.
As discussões acima deixam claro que a indicação de anticoagulação na FA de duração superior a 48h está bem estabelecida. Entretanto, nos casos de FA estáveis com menos de 48h de duração, a necessidade de anticoagulação para cardioversão ainda não está bem estudada e a decisão deve ser individualizada, conforme a presença de fatores de risco para tromboembolismo. Quando o quadro for de alto risco, recomenda-se a administração prévia de heparina e, se necessária, a introdução do anticoagulante oral, no momento da cardioversão. Nos casos de FA com instabilidade hemodinâmica, IAM ou angina de peito, recomenda-se a heparinização imediata e posterior avaliação da necessidade de manutenção do anticoagulante oral.
Recomendações para prevenção de tromboembolismo em pacientes com FA submetidos a cardioversão.
Classe I - 1) Introdução de anticoagulação, independente do método de cardioversão, elétrico ou farmacológico (NE=B); 2) anticoagulação oral por 4 semanas, com RNI entre 2 e 3, pré-cardioversão de FA com duração superior a 48h ou desconhecida. (NE=B); 3) dispensa de anticoagulação oral prévia em casos de CVE por FA de início recente, associada a IAM e angina ou com instabilidade hemodinâmica (choque ou edema agudo de pulmão), com introdução imediata de heparina IV em bolus, seguida da infusão contínua com ajuste da dose, até atingir valor de 2 vezes o TTPA basal. (NE=C). Concomitantemente, anticoagulação oral, com RNI entre 2 e 3, por 4 semanas pós-cardioversão (NE=C). A heparina de baixo peso molecular tem valor incerto (NE=C); 4) realização de ECO transesofágico, como alternativa à anticoagulação pré-cardioversão. Conforme resultado, considerar:
Ausência de trombos - usar heparina IV em bolus, seguida de infusão contínua com ajuste da dose até atingir valor de 2 vezes o TTPA basal (NE=B). Em seguida, iniciar anticoagulação oral por 4 semanas, suspendendo infusão de heparina apenas ao atingir RNI entre 2 e 3 (NE= B). Heparina de baixo peso molecular não é alternativa duvidosa (NE=B).
Presença de trombos - anticoagulação oral, com RNI entre 2 e 3, por 3 a 4 semanas pré-cardioversão(NE=B); 5) anticoagulação de pacientes com flutter atrial deve obedecer aos mesmos critérios estabelecidos para pacientes com FA (NE=C). Classe IIb - 1) realização de ECO transesofágico para cardioversão de FA com duração inferior a 48 h (NE= C); 2) anticoagulação em FA com duração inferior a 48h (NE=C). Classe III - Cardioversão farmacológica ou elétrica, em pacientes com FA estável e com duração superior a 48 h, sem anticoagulação prévia (NE=B).
B - Manutenção do ritmo sinusal pós-cardioversão da FA (Prevenção das recorrências)
O ritmo sinusal pós-reversão da FA pode ser mantido com o uso de fármacos que provocam prolongamento da duração do período refratário efetivo ou aumento do limiar de FA41.
O tempo de instalação da FA é um fator importante a ser considerado no comportamento clínico de pacientes pós-reversão a ritmo sinusal. Assim, nos casos em que a duração da FA é superior a 1 ano, a probabilidade de recorrência é muito maior que nos pacientes em que o tempo de instalação da FA é inferior a 3 meses. Esse comportamento sugere que o prolongamento da duração da arritmia incrementa as chances de modificações anatômicas atriais, favorecendo o substrato eletrofisiológico da FA. Tecidos de átrios dilatados, que apresentam padrões do tipo resposta lenta (baixa amplitude do potencial de ação), sofrem mais efeitos do verapamil do que dos fármacos do grupo I, particularmente a procainamida. Estes achados indicam que as características do potencial de ação do miócito atrial representam fator importante de influência na resposta ao tratamento antiarrítmico da FA.
A presença de cardiopatia aumenta a probabilidade de recorrências da FA pós-reversão e, embora as dimensões isoladas do AE não representem fator de influência, seu aumento progressivo também incrementa a chance de recorrências. Por isso, a prevenção deve sempre incluir o tratamento da cardiopatia de base.
De maneira geral, a maioria dos medicamentos falha na prevenção das recorrências em pacientes com FA crônica com duração superior a um ano, mas, certamente, a taxa de recorrências é maior quando nenhum antiarrítmico é administrado pós-reversão a ritmo sinusal. O sucesso terapêutico deve ser determinado pela redução da taxa de recorrências e não pela abolição das crises. Para assegurar a manutenção do ritmo sinusal, os antiarrítmicos devem ser administrados na dose terapêutica máxima tolerada. A indicação desses fármacos deve obedecer a rigorosos critérios clínicos, levando em consideração os riscos dos efeitos adversos, sobretudo na presença de disfunção ventricular, isquemia miocárdica, intervalo QT longo e arritmia ventricular complexa (tab. II).
No caso da FA inicial sem qualquer fator desencadeante identificado, não há necessidade de medicação a longo prazo. Em pacientes sem fatores de risco, o uso do antiarrítmico pode estar indicado no mínimo, por 30 dias. A determinação deste período é empírica, mas corresponde ao tempo de maiores taxas de recorrências. Na presença de síncope, edema agudo de pulmão, estenose mitral, insuficiência cardíaca, extra-sístololia atrial freqüente e outros, deve-se administrar antiarrítmicos a longo prazo. Os fármacos mais utilizados são propafenona, sotalol, disopiramida, quinidina ou amiodarona.
A propafenona, único fármaco do grupo IC disponível no Brasil, deve ser evitado em pacientes com disfunção ventricular ou insuficência cardíaca. Sua eficácia é dose-dependente; comparável a do sotalol e à disopiramida, porém superior à quinidina.
O uso da quinidina está associado ao maior risco de efeitos adversos, sobretudo pró-arritmia. Estudo metanalítico demonstrou que,embora seja mais eficaz que o placebo, a mortalidade dos pacientes em uso de quinidina é significativamente maior (2,9% vs 0,8%)42. A eficácia da quinidina na presença de recorrência de FA parece ser inferior ao da propafenona, mas similar ao sotalol.
A disopiramida é um fármaco eficaz para prevenção de recorrências tanto quanto a propafenona. Seu uso é limitado pelos efeitos colaterais e está contra-indicada em pacientes com insuficiência cardíaca ou hipertrofia prostática.
O sotalol é eficaz e seguro para a prevenção de recorrências de FA, nas doses de 80 a 160 mg, duas vezes ao dia. É tão eficaz quanto a propafenona na manutenção do ritmo sinusal, e também deve ser evitado em pacientes com insuficiência cardíaca e insuficiência renal.
A amiodarona parece ser o agente antiarrítmico mais eficaz para prevenção de recorrências de FA. A avaliação de um subgrupo de casos do estudo CTAF43, distribuiu aleatoriamente 403 pacientes para comparar a eficácia da amiodarona (grupo I) e propafenona ou sotalol (grupo II), na manutenção do ritmo sinusal. Após seguimento médio de 16 meses, a amiodarona foi superior aos outros agentes, demonstrando recorrência de 35% no grupo I vs 63% no grupo II.
O estudo de Gold e cols44.incluiu 68 pacientes com FA persistente ou paroxística e demonstrou, em seguimento médio de 21 meses, eficácia de até 79% da amiodarona na prevenção de recorrências. O menor índice de sucesso (57%) foi observado em pacientes com FA com duração superior a 1 ano.
Entretanto, o uso crônico da amiodarona está associado aos efeitos adversos, que estão estimados em até 35% dos casos, e obrigam a suspensão em até 10%. Por isso, a amiodarona deve ser reservada aos casos de falha de outros antiarrítmicos.
O digital está associado ao aumento do risco de recorrências de FA, devido ao seu efeito colinérgico, redução da duração do período refratário efetivo atrial e, conseqüentemente, do comprimento de onda do impulso atrial.
O verapamil e o diltiazem diminuem o acúmulo de cálcio intracelular, fator importante na genêse do remodelamento eletrofisiológico atrial, que tende a perpetuar a FA. Estudos clínicos45 recentes têm superado os resultados de estudos experimentais, sugerindo que verapamil e diltiazem devam ser cada vez mais incorporados ao esquema de prevenção das recorrências de FA.
As tabelas III e IV incluem os efeitos adversos e os tipos de pró-arritmias que envolvem todos os fármacos acima referidos.
Recomendações para manutenção do ritmo sinusal
Classe I - 1) terapêutica farmacológica para manutenção do ritmo sinusal de pacientes muito sintomáticos, considerando essencialmente a segurança proporcionada pelo fármaco (NE=B); 2) terapêutica dos precipitantes e reversíveis antes de iniciar o tratamento antiarrítmico (NE=C).
Classe II a - 1) terapêutica farmacológica para manutenção do ritmo sinusal para prevenir taquicardiomiopatia relacionada a FA (NE=C); 2) terapêutica antiarrítmica, acompanhada de episódios raros e bem tolerados de FA, não indicam, necessariamente, insucesso terapêutico (NE=C); 3) terapêutica farmacológica ambulatorial pode ser realizada em pacientes selecionados (NE=C).
Classe II b - 1) terapêutica farmacológica para manter ritmo sinusal em pacientes assintomáticos, para prevenção do remodelamento atrial (NE=C); 2) terapêutica farmacológica para manutenção do ritmo sinusal, para prevenção de tromboembolismo ou IC em pacientes selecionados (NE=C); 3) terapêutica farmacológica combinada de antiarrítmicos para manutenção de ritmo sinusal, em casos de falha da monoterapia (NE=C); 4) associação de antagonista de cálcio ao antiarrítmico, para reduzir risco de recorrência e impedir remodelamento eletrofisiológico atrial (NE=B); 5) terapêutica farmacológica por 30 dias, para manutenção do ritmo sinusal após primeiro episódio sintomático de FA; (NE=D); 6) Terapêutica farmacológica crônica, após o primeiro episódio de FA revertida a ritmo sinusal, em pacientes com alto risco de recorrências, tais como estenose mitral, hipertireoidismo, miocardiopatia e hipertensão arterial (NE=D).
Classe III - 1) terapêutica farmacológica, para manutenção de ritmo sinusal em pacientes com predisposição especifica à pró-arritmia (NE=A); 2) terapêutica farmacológica para manutenção do ritmo sinusal em pacientes com doença sinusal ou do nódulo atrioventricular, na ausência de marcapasso definitivo (NE=C); 3) terapêutica com antiarrítmicoantiarrítmico de classe I, para manter ritmo sinusal em pacientes com disfunção ventricular ou infarto prévio.
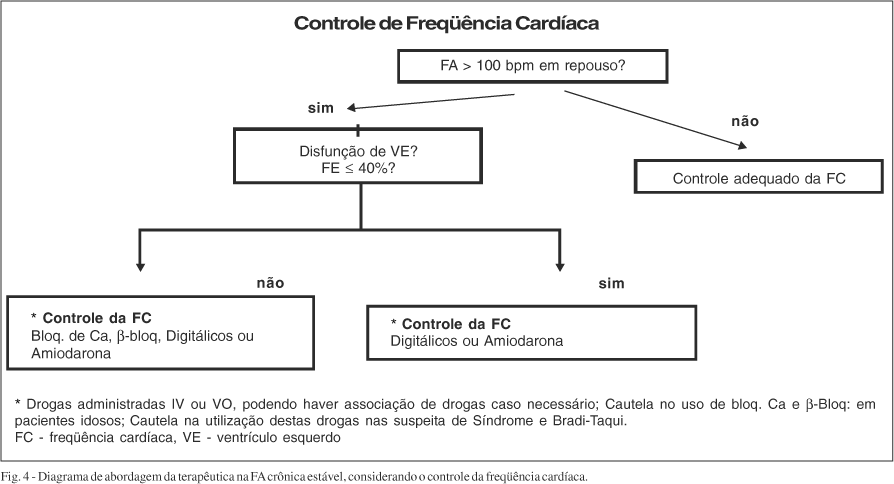
C - Controle da freqüência cardíaca na FA e no flutter atrial
De um modo geral, a estratégia de controle da freqüência cardíaca em pacientes com FA deve ser sempre considerada, porque vários estudos demonstraram que, independente da sintomatologia, a tendência ao desenvolvimento da taquicardiomiopatia é considerável. Entretanto, sua indicação é imperiosa quando a cardioversão (elétrica ou farmacológica) não é bem sucedida ou é contra-indicada. A opção por controle da freqüência pode também ocorrer por decisão médica, considerando-se as características clínicas de cada caso. Nesse sentido, para pacientes com mais de 60 anos, as evidências científicas atuais são de que as estratégias de controle de freqüência ou reversão para ritmo sinusal, em seguimento a longo prazo, não diferem com relação às taxas de eventos clínicos.
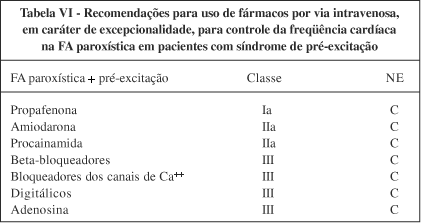
Para o controle da FC, deve-se utilizar fármacos com ações específicas sobre o NAV, como betabloqueador e inibidor dos canais de cálcio (verapamil e diltiazem), bem como digitálicos e amiodarona, levando sempre em consideração a presença ou não de ICC. É importante ressaltar que, em pacientes com síndrome de WPW que desenvolvem FA, quando a cardioversão não é possível ou está indisponível, deve-se utilizar fármacos com ação depressora específicas sobre a condução da via anômala, como propafenona, amiodarona ou procainamida. Devido à gravidade desta situação, deve-se preferir adminstrar essas drogas por via intravenosa. Nesses casos, está contra-indicado o uso de depressores da condução AV como adenosina, betabloqueadores, inibidores dos canais de cálcio e digitálicos.
Nos casos de refratariedade ao uso de drogas para controle da FA, está indicada a modificação ou ablação por cateter do NAV com radiofreqüência, seguida de implante de marcapasso definitivo46.
As recomendações para o uso de fármacos no controle da FA, conforme a apresentação clínica, encontram-se nas tabelas V, VI e VII.
D - Anticoagulação na FA
De um modo geral, as evidências atuais são de que o tratamento anticoagulante em pacientes com FA, independente da apresentação clínica, reduzem em cerca de 65% a 80% a incidência de AVC (tab. VIII) Os principais estudos a esse respeito47,49 demonstraram especificamente que: 1) o risco anual de AVC é de 4,5 % nos grupos controles (placebo) e de 1,4% nos grupos com warfarin; 2) warfarin reduz em 84% o risco de AVC nas mulheres e em 60% nos homens; o ácido acetil salicílico (AAS), na dose de 325 mg/dia, reduz em 44% nos pacientes com idade < 75 anos; 3) warfarin reduz em 33% a mortalidade total (P=0,01) e em 48% os eventos combinados AVC, embolia sistêmica e óbitos (P<0,001), sendo que o AAS, na dose de 75 mg, não demonstra diferenças; 4) o risco anual de hemorragias maiores é de 1,0% para o grupo controle, 1,0% para o AAS e 1,3% para o warfarin.
A prevenção antitrombótica primária em pacientes com FA não-valvar foi avaliada no estudo metanalítico de Hart e cols39, que reuniu os 6 principais ensaios randomizados, comparando warfarin com o placebo. A redução de risco de AVC foi de 68%, mas provocou aumento da taxa de quadros hemorrágicos (fig. 7).
Com relação aos pacientes com FA e AVC prévio (prevenção secundária), o estudo European Atrial Fibrillation Trial50 comparando o uso de AAS (330 mg / dia), placebo e warfarin, demonstrou que: 1) a taxa anual de eventos é de 8% no grupo warfarin versus 17% do grupo placebo; 2) a redução de risco de eventos embólicos no grupo warfarin versus AAS é de 40%; 3) a redução de risco de AVC isolado no grupo warfarin versus placebo é de 33%.
É importante destacar que a idade média da casuística desses estudos foi 69 anos. Os pacientes muito idosos foram excluídos devido ao risco maior de hemorragias.
O estudo SPAF II28, entretanto, fixou-se especificamente na população > de 75 anos, comparando AAS e warfarin. A incidência de eventos hemorrágicos maiores foi de 4,2% com warfarin (RNI médio 2,6) vs 1,6% com AAS (P=0,02). Por outro lado, nessa faixa etária, valores de RNI<2,0 reduzem a taxa de eventos hemorrágicos, mas não são eficazes na prevenção de eventos embólicos51 e por isso recomenda-se que pacientes sem contra-indicação para anticoagulante oral devam manter RNI entre 2,0 e 2,5.
Esquemas terapêuticos, isolados ou combinados com baixas doses de warfarin não demonstraram eficácia. O estudo SPAF III52, comparando warfarin, ajustado para RNI entre 2.0 e 3.0, com: AAS (300 mg/dia) isolado, warfarin (1,25 mg) isolado e warfarin (1,25 mg) + AAS (300 mg/dia), observou as respectivas taxas anuais de eventos embólicos: 2,8%; 3.6%; 5,8% e 7,2%, A interrupção da terapêutica e o RNI abaixo de 2,0 associaram-se à maior incidência de eventos embólicos. Hylek e cols.51 também observaram que a incidência de infarto cerebral aumenta com RNI abaixo de 2,0. Esses achados permitiram concluir, definitivamente, que, para obter o melhor resultado da anticoagulação, deve-se manter o RNI entre 2,0 e 3,0.
Pacientes com FA paroxística parecem estar sob o mesmo risco de eventos tromboembólicos que formas persistentes. A análise de subgrupos do SPAF53 comparou a incidência de AVC em 460 pacientes com FA intermitente vs 1552 com FA persistente, tratados com AAS (325 mg) e foi observada incidência anual de eventos semelhante (3,2% x 3,3%). Na FA paroxística, a incidência de AVC foi de 7,8% ao ano, na presença de pelo menos 1 dos seguintes fatores de risco independentes: idade avançada (RR= 2,1 por década, P<0,001), hipertensão (RR=3,4, P=0,003) e AVC prévio (RR=4,1, P=0,01). Esses achados foram semelhantes aos de pacientes com FA persistente, considerando-se os mesmos fatores de risco, e por isso, recomendando que os esquemas de anticoagulação fossem idênticos.
É importante destacar também que a manutenção da anticoagulação, sobretudo em pacientes com fatores de risco associados, deve ser feita por tempo indefinido, independentemente da escolha da estratégia. Isto por que o estudo AFFIRM54, que comparou as estratégias terapêuticas de controle do ritmo vs o controle da freqüência cardíaca em pacientes idosos (m=69a), demonstrou que, em ambos os grupos, a maioria dos eventos embólicos ocorre por interrupção do warfarin ou na presença de RNI abaixo da faixa terapêutica. Ademais, mesmo no grupo de pacientes considerado sob controle de ritmo, ocorreram episódios assintomáticos de FA paroxística.
Pacientes com crises tireotóxicas e FA também apresentam incidência elevada de fenômenos tromboembólicos, por isso recomenda-se o uso de anticoagulante oral (RNI 2,0 a 3,0) até que o hipertiroidismo seja tratado. Se a FA persistir após controle, devem ser aplicados os critérios para anticoagulação anteriormente mencionados.
Com relação ao flutter atrial, estudos mais recentes têm demonstrado ocorrência de eventos tromboembólicos, tanto durante a arritmia, quanto pós-reversão a ritmo sinusal Irani e cols40 demonstraram que, dentre 47 pacientes com flutter atrial não submetidos à anticoagulação, 34 % apresentavam contraste espontâneo ou trombo ao ETE realizado pré-cardioversão e, dentre os que reverteram a ritmo sinusal, 28% não apresentavam atividade mecânica atrial. Assim, para pacientes com flutter atrial recomenda-se anticoagulação, utilizando-se os mesmos critérios indicados para FA.
Para se obter os efeitos desejados com a anticoagulação, é extremamente importante uma monitorização rigorosa, periódica e confiável do RNI. No início, este exame deve ser realizado semanalmente e, após a estabilização dos resultados, a cada 30 dias. Entretanto, é importante salientar que os estudos que revelam os efeitos benéficos do warfarin foram realizados em países desenvolvidos, onde a avaliação laboratorial é bastante confiável. Sabe-se que, em nosso meio, muitas vezes as condições são desfavoráveis e, assim, quando a monitorização do RNI não for factível por motivos técnicos, sociais, econômicos ou psíquicos, deve-se dar preferência ao uso de AAS, na dose de 325 mg / dia.
Os inconvenientes que envolvem os atuais anticoagulantes têm estimulado a pesquisa clínica para o uso de opções que não provoquem os riscos elevados de sangramento e a necessidade de monitoração plasmática freqüente atribuídos ao warfarin, mas que produzam efeitos antitrombóticos pelo menos semelhantes aos dessa droga. Nesse sentido, o uso dos agentes antiplaquetários ticlopidina e clopidogrel não demonstrou evidências clínicas suficientes para substituir a anticoagulação com warfarin. Por outro lado, as perspectivas para o uso de agente antitrombínico de ação direta por via oral, ximelagatran, são extremamente auspiciosas, no sentido de reproduzir os efeitos satisfatórios do warfarin e reduzir efeitos adversos, sobretudo eventos hemorrágicos.
A série de estudos SPORTIF (III e V)55 já recrutou cerca de 7000 pacientes com FA não-valvar, comparando aleatoriamente warfarin com ximelagatran. Os resultados preliminares, apresentados no Congresso do American College of Cardiology (maio de 2003) demonstraram redução de risco de AVC embólico e hemorrágico para o grupo ximelagatran em relação ao warfarin.
As recomendações para anticoagulação na FA, conforme apresentação clínica, estão incluídas nas tabelas IX, X e XI.
2 - Terapêutica invasiva da FA
A - Ablação por cateter
Durante muitos anos e até há pouco tempo, a principal indicação da ablação por cateter na FA envolvia apenas pacientes com resposta ventricular rápida refratária ao tratamento clínico, submetidos à ablação do nódulo AV seguida de implante de marcapasso definitivo. Com esse procedimento, apesar de melhora sintomática e da função ventricular, a FA permanecia, e com ela todas as co-morbidades relacionadas à sua persistência. Por isso, a ablação do nódulo AV, analisada criticamente nos últimos anos, tem sido postergada para os casos de falha da ablação da FA propriamente dita, ou quando a presença de co-morbidades contra-indica o procedimento.
Por outro lado, nos casos em que a FA é secundária a outras arritmias cardíacas, como às taquicardias da síndrome de Wolff-Parkinson-White, à taquicardia por reentrada nodal, ao flutter atrial ou alguns tipos de taquicardia atrial automática, a ablação do circuito primário costuma ser o tratamento definitivo. Estes casos são excepcionais, porém sempre devem ser considerados.
Estima-se, atualmente, que a grande maioria dos pacientes com FA tem o mecanismo originado por focos ectópicos localizados nos prolongamentos musculares que penetram nas veias pulmonares. Com essa prerrogativa, Haissaguerre e cols.12 propuseram, inicialmente, a ablação do foco ectópico no interior das veias pulmonares, mas, apesar dos resultados iniciais animadores, observou-se que a técnica não permitia localizar todos os focos responsáveis pela FA, além de provocar índices de estenose das veias pulmonares que variavam de 2 a 28%58, uma vez que a junção entre as veias pulmonares e o átrio esquerdo é mais complexa do que se pensava, do ponto de vista anatômico-funcional, sugerindo que os sítios envolvidos no mecanismo da FA incluem também áreas de fibroses e desarranjo muscular que podem causar condução lenta e facilitar as condições para o mecanismo reentrante. Nesta região também estão localizadas células do tipo nodais com propriedades automáticas e abundante inervação autonômica que podem contribuir para o início e perpetuação da FA.
Em vista disso, a estratégia atual para ablação da FA é o isolamento elétrico das veias pulmonares em relação ao átrio esquerdo. Nesse sentido, duas técnicas estão em uso clínico: 1) técnica proposta por Haissaguerre e col59, que utiliza o registro eletrofisiológico convencional, por meio de duas punções transeptais, introduz-se um cateter circular multipolar, no interior da veia pulmonar a ser isolada, que dirige aplicações de RF nos segmentos de entrada das fibras atriais aderidas à veia. Por esse motivo o procedimento também é denominado ablação segmentar54; 2) técnica proposta por Pappone e cols.60, que usa o sistema eletro-anatômico com reconstrução tridimensional do átrio esquerdo e dos óstios das veias pulmonares. O procedimento é realizado com múltiplas aplicações de radiofreqüência ao redor das quatro veias pulmonares e é denominado ablação circunferencial das veias pulmonares. A estratégia é realizar o isolamento das veias pulmonares utilizando-se as referências anatômicas fornecidas pelo Sistema Carto, que exige apenas uma punção transeptal e reduz a exposição à radiografia, tanto para a equipe médica como para o paciente. Ademais, recentemente, foi demonstrado que esta técnica proporciona redução da mortalidade, morbidade e melhora da qualidade de vida, em relação aos pacientes em uso de antiarrítmicos.
A taxa de controle clínico de pacientes com FA paroxística, proporcionada pela aplicação destas duas técnicas, varia de 70 a 85%, sendo que em 10% a 50% dos casos a administração de antiarrítmicos é mantida. O risco de estenose de veias pulmonares é inferior a 1%.
É importante destacar que esses resultados têm melhorado progressivamente, graças ao incremento de novos procedimentos, dentre os quais destacam-se: 1) uso da angiografia de veias pulmonares, do ecocardiograma transesofágico e intracardíaco, com o intuito de melhor avaliar a anatomia das veias pulmonares para isolamento; 2) aplicação de lesões lineares e isolamento de áreas mais extensas do átrio esquerdo, por meio de sistemas de navegação tri-dimensional. Estes são capazes de mapear as regiões com cicatrizes, com baixa voltagem, identificar rotas de propagação elétrica de múltiplos circuitos, assim como marcar os pontos de aplicação prévia de RF, identificando eventuais falhas de ablação anterior. Procedimentos que proporcionam redução das taxas de recorrências, sobretudo em pacientes com FA de duração prolongada e átrio esquerdo dilatado.
Recomendações de ablação para pacientes com FA
FA deflagrada por outra taquicardia - Ablação dos circuitos primários de pacientes com síndrome de WPW, taquicardia por reentrada nodal, flutter atrial e taquicardia atrial focal (I - NE:B).
Isolamento das veias pulmonares - 1) FA paroxística assintomática sem cardiopatia estrutural ou disfunção sinusal, com resposta ventricular rápida não-responsiva a, pelo menos, duas drogas antiarrítmicas (incluindo amiodarona): (IIa-NE=C); 2) FA paroxística ou persistente sem cardiopatia estrutural, assintomática, de difícil controle clínico, evoluindo com disfunção ventricular esquerda secundária à arritmia: (II a - NE=D); 3) FA persistente ou permanente sintomática sem cardiopatia estrutural ou disfunção sinusal não-responsiva a pelo menos duas drogas antiarrítmicas (incluindo amiodarona): (II b - NE=C); 4) FA controlada com drogas antiarrítmicas: (III - NE=D).
Ablação do nó AV e implante de marcapasso definitivo - 1) FA paroxística, persistente ou permanente com resposta ventricular rápida não controlada com tratamento farmacológico e não-farmacológico: (I - NE=A); 2) em pacientes idosos ou com co-morbidades (I-NE=B);
Ablação do circuito do flutter atrial - 1) Flutter atrial comum (relacionado ao istmo veia cava inferior - anel da valva tricúspide). Técnica convencional: (I - NE=B); Técnica com mapeamento eletroanatômico (I - NE=B). 1) Flutter atrial atípico (não-relacionado ao istmo veia cava inferior - anel da valva tricúspide). Técnica convencional: (IIb - NE=C); Técnica com mapeamento eletroanatômico (I -NE=B).
Ablação do nó AV e implante de marcapasso em pacientes com flutter atrial - 1) Flutter atrial com resposta ventricular rápida ou com baixo débito, não controlado com drogas anti-arriítmicas ou com tratamento não farmacológico (I - NE=A); 2) Flutter atrial controlado com drogas antiarrítmicas ou com possibilidade de ablação curativa da arritmia (III - NE=D).
B - Tratamento cirúrgico da FA
A abordagem cirúrgica da FA iniciou-se em 1991 com a proposta de Cox e cols61 que, com base em mapeamento da arritmia em animais e humanos, desenvolveram um procedimento denominado "cirurgia do labirinto", Maze, na língua inglesa, com o objetivo de eliminar a arritmia, manter a função sinusal e a condução AV, assim como de restaurar a contração atrial. A técnica consiste em realizar diversas incisões cirúrgicas em ambos os átrios de modo a constituir um verdadeiro labirinto, além de extirpar os apêndices atriais e isolar, eletricamente, as veias pulmonares. As incisões formam barreiras elétricas que impedem a propagação das frentes de onda reentrantes da FA e compartimentalizam o miocárdio atrial, impedindo a perpetuação da arritmia. As incisões, ainda, direcionam o impulso sinusal para todas as partes do miocárdio atrial, incluindo o nó AV, de modo a manter sua função contrátil. O isolamento das veias pulmonares tem a finalidade de prevenir o inicio da FA, discriminando focos arritmogênicos potenciais, dentro ou próximo às veias pulmonares, em relação ao tecido atrial restante e as regiões com período refratário mais curto.
As publicações mais recentes de Cox e cols.61, incluíndo modificações da técnica inicialmente proposta (Cox-Maze III), demonstraram controle da FA em cerca de 90% dos casos.
A associação de valvulopatia mitral e FA foi documentada há várias décadas e estima-se que, atualmente, mais de 50% dos pacientes com disfunção valvar grave apresentam FA. Brodell e cols62 corroboraram esses achados, demonstrando que a prevalência de FA crônica em pacientes submetidos à abordagem cirúrgica valvar mitral é de cerca de 50%. Também foi observado que, aproximadamente 75% dos portadores de FA crônica no momento da abordagem cirúrgica da valva mitral, permanecem com a arritmia no pós- operatório.
A associação de correção de valvopatia mitral com cirurgia de Cox praticamente não compromete os resultados da "cirurgia do labirinto" isolada. As séries recentes demonstram taxas de sucesso variando entre 70% e 90% com índice de mortalidade entre 1% e 2%. As complicações mais comuns são inerentes às próprias condições cirúrgicas e incluem retenção hídrica, disfunção do nó sinusal e perda da contração atrial transitória ou permanente.
A "cirurgia do labirinto" é demorada e requer um padrão de incisões atriais complexo, extensas suturas, provoca perda sangüínea significativa e tempo de circulação extracorpórea prolongado. Porém, até o momento, é considerada a abordagem cirúrgica para FA melhor avaliada, com relatos da experiência, a longo prazo, de diversos Centros. Entretanto, procedimentos modificados estão sendo desenvolvidos com o objetivo de diminuir o tempo cirúrgico e as complicações pós-operatórias.
As propostas de diferentes grupos envolvem, invariavelmente, a simplificação da técnica e, recentemente, Sueda e cols.63 desenvolveram uma técnica de abordagem especifica da região posterior do AE para o tratamento de pacientes com valvulopatia mitral e FA crônica. Após 6 meses de seguimento, 78% dos casos não apresentavam FA, sendo que 61% tinham recuperado a contratilidade atrial esquerda. Os resultados, a longo prazo, demonstraram uma proporção atuarial de eliminação de FA de 74%, em 3 anos.
Gaita e cols.64, Williams e cols.65, Tuinenburg e cols.66 e Kalil e cols67 também desenvolveram cirurgias direcionadas à região posterior do AE, isolando as veias pulmonares com crioablação, com radiofreqüência ou com incisões cirúrgicas, obtendo manutenção de ritmo sinusal, a médio prazo, em 70% a 90% dos pacientes.
Os achados acima referidos e as perspectivas emergentes de aperfeiçoamento das técnicas sugerem que, a exemplo do sucesso dos procedimentos cirúrgicos para FA crônica valvar em portadores de cardiopatia isquêmica ou congênita, com FA sintomática no momento do tratamento cirúrgico, também deve-se considerar a abordagem concomitante da arritmia.
Recomendações para tratamento cirúrgico da FA
Classe I - Nenhuma;
Classe IIa - Pacientes com valvulopatia mitral e FA que têm indicação de correção cirúrgica da valvulopatia (NE= B);
Classe IIb - Pacientes com FA que necessitam cirurgia cardíaca por outra causa (NE= B);
Classe IIb - Pacientes com FA sintomática refratários ao tratamento clínico ou ablação por cateter (NE= B);
Classe III - Pacientes com FA assintomática ou oligossintomática sem indicação de cirurgia cardíaca (NE=B).
C - Estimulação cardíaca artificial
O papel da estimulação cardíaca artificial na terapêutica e prevenção da FA está relacionado à regularização do ritmo e ao controle da freqüência cardíaca. Na FA permanente com baixa freqüência ventricular adquirida ou induzida (por fármacos ou ablação), a estimulação ventricular convencional ou multissítio (insuficiência cardíaca refratária) provoca regularização do intervalo R-R e da freqüência cardíaca46.
Na FA recorrente (paroxística ou persistente), associada ou não à disfunção do nó sinusal, a estimulação atrial convencional ou multissítio tem demonstrando evidências de redução de recorrência e da instalação da forma clínica permanente68. Além disso, serve de suporte para o uso de antiarrítmicos com maior segurança, por correção da bradicardia. Também foram desenvolvidos algoritmos específicos para a prevenção da FA recorrente como: overpace, que possibilita a estimulação atrial constante, elevando a freqüência sempre que for detectada uma ativação atrial espontânea, overdrive, que permite inibir taquiarritmias atriais por estimulação em alta freqüência e a regulação da freqüência ventricular, que ajusta o intervalo de estimulação ventricular de acordo com o ciclo espontâneo pregresso, eliminando variações rápidas do intervalo RR.
Ademais, vários recursos diagnósticos incorporados aos marcapassos convencionais ou com a finalidade específica de otimizar o diagnóstico e a terapêutica dos pacientes com FA podem ser utilizados como alternativas de programação. Assim, podem ser disponibilizados: 1) sensores para adaptação de freqüência de estimulação, que corrigem a insuficiência cronotrópica; 2) mudança automática de modo, que permite a identificação automática da FA; 3) mudança automática para modo VVI e rate smoothing, que impede as oscilações bruscas de freqüência ocasionadas pelas arritmias atriais transitórias; 4) registro e armazenamento do eletrocardiograma intracavitário, ou histogramas de freqüência cardíaca atrial; 5) transmissão remota de eventos por telefonia celular, que podem auxiliar no controle das recorrências e na otimização de antiarrítimicos.
Por outro lado, estudos recentes têm demonstrado resultados ainda não convincentes sobre o papel dos cardio-desfibriladores atriais.
Recomendações para o uso de marcapasso cardíaco artificial permanente
Classe I - 1)FA permanente com resposta ventricular elevada, em pacientes submetidos à ablação da junção AV- tipo de estimulação: MP VVI-R (NE=A); 2) FA paroxística refratária, com resposta ventricular elevada, em pacientes submetidos à ablação da junção AV- tipo de estimulação: MP DDD-R com mudança automática de modo (NE=A); 3) FA permanente com bradiarritmia persistente ou intermitente, que agrava ou pode ser reconhecida como causa de insuficiência cardíaca - tipo de estimulação: VVI-R ou VVI-R com ressincronização (NE=B);
Classe II a - 1)FA paroxística, associada à disfunção sinusal adquirida ou induzida por drogas necessárias e insubstituíveis - tipo de estimulação: MP DDD-R com mudança automática de modo e overpace (NE=B); 2) FA permanente com BAV em pacientes com cardiomiopatia dilatada e ICC classe III e IV NYHA refratária ao tratamento clínico, BRE (QRS > 130ms); DDFVE > 55mm e FE < 35% - tipo de estimulação: MP VVI-R com ressincronização ventricular (NE=B); 3) FA recorrente (paroxística e persistente) com BAV, em pacientes com cardiomiopatia dilatada e ICC classe III e IV NYHA refratária ao tratamento clínico, BRE (QRS > 130ms), DDFVE > 55mm e FE < 35% - tipo de estimulação: MP DDD-R com ressincronização ventricular e mudança automática de modo (NE=B).
Classe II b - 1) FA paroxística refratária a tratamento clínico, sem outra alternativa terapêutica, com relação direta e documentada de bradicardia precedendo os episódios de arritmia - tipo de estimulação: com condução AV normal: MP AAI-R com overpace. Com condução AV comprometida: MP DDD-R com mudança automática de modo e overpace (NE=C); 2)FA paroxística em pacientes com distúrbios da condução interatrial ou intra-atrial - tipo de estimulação: MP DDD-R com ressincronização atrial: biatrial ou bifocal atrial direita (NE=C).
FA Pós-Cirurgia Cardíaca
A prevalência da FA pós-cirurgia cardíaca é estimada entre 11% e 40% para pacientes submetidos à revascularização do miocárdio, 40% e 50% para correções valvares e em até 60% para associações desses dois procedimentos69. Ocorre mais freqüentemente entre o 1o e o 5o pós-operatório, com pico de incidência no 2o dia. Na maioria dos pacientes, a FA pós operatória é bem tolerada e autolimitada, e, em cerca de 98% dos casos, ocorre reversão a ritmo sinusal em até oito semanas pós-cirurgia. Pode ocorrer, entretanto, instabilidade hemodinâmica, particularmente quando há disfunção diastólica do ventrículo esquerdo. Está associada a risco duas vezes maior de AVC69, assim como ao aumento da morbidade e do custo do tratamento, graças ao maior tempo de hospitalização e às complicações associadas. O tempo de permanência de pacientes que desenvolvem FA aumenta, em média, de dois a quatro dias em relação aos que permanecem em ritmo sinusal. A FA é a principal causa de readmissão hospitalar pós-alta de cirurgia cardíaca70.
Os achados clínicos mais comumente associados ao risco de ocorrência de FA pós-operatória estão na tabela XII69,71-73.
Vários achados clínicos foram descritos na patogênese da FA pós-operatória (tab. XIII), entretanto não existem dados consensuais a esse respeito.
A fisiopatologia da FA no pós-operatório de cirurgia cardíaca envolve múltiplos fatores como: idade do paciente, alterações cardíacas degenerativas pré-existentes, dispersão da refratariedade atrial, alterações da velocidade de condução atrial e do potencial transmembrana atrial, assim como a hipocalemia ao prolongar a fase 3 da despolarização, aumentar o automatismo e diminuir a velocidade de condução.
Por outro lado, Aranki e cols.71 descreveram os fatores independentes preditivos de ocorrência de FA no pós-operatório: idade avançada; sexo masculino; hipertensão arterial sistêmica; pneumonia no pós-operatório; ventilação mecânica prolongada (>24h); uso de balão intra-aórtico e retorno ao ambiente de terapia intensiva.
Com relação ao tratamento da FA instalada no pós-operatório de cirurgia cardíaca, as regras básicas são similares aos casos não-cirúrgicos. Assim, em termos gerais, recomenda-se: 1) na presença de instabilidade hemodinâmica, imediata cardioversão elétrica; 2) - nas outras condições, controle da freqüência ou cardioversão farmacológica, que devem-se basear na susceptibilidade do paciente aos efeitos colaterais pró-arrítmicos; 3) - anticoagulação sempre que possível, considerando as circunstâncias momentâneas e as co-morbidades que aumentam as chances de complicações hemorrágicas.
Com relação à prevenção de FA pós-operatória, o uso de betabloqueadores, sotalol e amiodarona tem sido muito estudado, principalmente na revascularização do miocárdio em pacientes com fração de ejeção do ventrículo esquerdo entre 43% a 68%. Um estudo meta-análitico74 de 27 ensaios, que avaliaram o papel do betabloqueador no pós-operatório de cirurgia cardíaca, incluiu 3840 pacientes e demonstrou que a incidência de FA foi de 33% no grupo betabloqueador vs 19% no grupo controle (OR = 0,39; intervalo de confiança de 95%: 0,28 a 0,52). A análise de estudos que avaliaram o uso do sotalol na prevenção da FA, incluindo 1294 pacientes, demonstrou taxa de ocorrência de FA de 17% no grupo sotalol vs 37% no grupo controle (OR = 0,35; intervalo de confiança de 95%: 0,26 a 0.49). O uso de amiodarona foi avaliado através de 9 estudos que incluíram 1384 pacientes. A amiodarona reduziu a taxa de ocorrência de FA, em relação ao controle, de 37% para 22,5% (OR = 0,48; intervalo de confiança de 95%: 0,37 a 0,61). Sotalol e outros betabloqueadores foram comparados diretamente em quatro estudos que incluíram 900 pacientes. A taxa de ocorrência de FA foi de 22% no grupo dos betabloqueadores vs 12% no grupo sotalol (OR = 0,50; intervalo de confiança de 95%: 0,34 a 0,74).
Por outro lado, a estimulação cardíaca temporária para prevenção de FA pós-operatória, também tem sido avaliada. Dez estudos analisaram os efeitos do marcapasso, utilizando eletrodos temporários epimiocárdicos no pós-operatório de cirurgia cardíaca, na maioria revascularização miocárdica. Foram comparadas as técnicas de estimulação do átrio direito, átrio esquerdo e ambos (simultaneamente) com o grupo controle (convencional com FE:35-40). As três técnicas avaliadas diminuíram a incidência de FA em relação ao controle: biatrial - N:744, OR = 0,46 (IC-95%: 0,30 a 0,71); átrio direito _ n: 581, OR = 0,68 (IC-95%: 0,39 a 1,19); e átrio esquerdo- N:148, OR = 0,57 (IC- 95%: 0,28 a 1,16).
Recomendações para pacientes com FA no pós-operatório de cirurgia cardíaca
Classe I - 1) Administração de betabloqueador oral, com início entre 3 a 5 dias antes de cirurgia de revascularização do miocárdio ou cirurgia valvar, associada ou não, para prevenção de FA, a menos que ocorra contra-indicação. (NE=A); 2) administração de bloqueadores do nó A-V para controle de FC, em pacientes que desenvolvem FA pós-operatória. (NE=B).
Classe IIa - 1) administração de sotalol ou amiodarona profilática para pacientes com risco aumentado de ocorrência de FA pós-operatória. (NE=B); 2) cardioversão farmacológica ou cardioversão elétrica, em pacientes com FA pós-operatória, como recomendado para casos não-cirúrgicos. (NE=B); 3) administração de antiarrítmicos para pacientes com FA pós-operatória recorrente ou refratária, para manutenção do ritmo sinusal, como recomendado para casos não-cirúrgicos. (NE=B); 4) prevenção do tromboembolismo para pacientes com FA pós-operatória (completadas 48 h), como recomendado para casos não-cirúrgicos. (NE=B).
FA em Situações Específicas
Algumas condições especificas, relacionadas à idade, cardiopatia de base, tipo nosológico ou característica clínica de pacientes com FA merecem abordagem à parte, a saber:
Crianças e adultos jovens - Em crianças e jovens com coração normal, a FA é muito rara. A prevalência de arritmias cardíacas significativas é de 22,5 para cada 100.000 consultas de pacientes com idade <18 anos, em Emergência e, dentre esses, a FA representa menos de 5%75. A presença de taquiarritmias atriais é mais comum, apenas, entre crianças com cardiopatia congênita, em seguimento tardio de cirurgia de Fontan.
Com relação ao mecanismo desencadeante, a maioria dos casos de FA em crianças e jovens com coração normal parece ser secundária a outras arritmias, como taquiarritmias por feixe anômalo (mesmo oculto), flutter atrial istmo-dependente ou focos extrasistólicos em veias pulmonares76. O prognóstico desses pacientes é bom, com baixo risco de eventos tromboembólicos. Com relação à terapêutica, a amiodarona é muito eficaz na cardioversão, mas é dose-dependente e provoca muitos efeitos adversos; a propafenona e a flecainida são as drogas mais utilizada na manutenção do ritmo sinusal e a ablação por RF proporciona resultados muito bons.
Atletas - A FA é considerada a causa mais comum de palpitações prolongadas em atletas; cuja incidência é comprovadamente superior em relação a não-atletas da mesma idade77,78. Cerca de 0,2% dos atletas de elite apresentam FA paroxística, entretanto, ela parece ser causa de 25 a 40% dos episódios de palpitação de longa duração. Pode ocorrer durante treino, competição, recuperação ou mesmo repouso e, eventualmente, levar à interrupção da carreira.
O mecanismo fisiopatológico parece estar relacionado à desregulação neuro-humoral com incremento do tônus vagal ou ao uso de esteróides anabolizantes e costuma ser facilmente reproduzida por estimulação atrial.
O prognóstico destes casos costuma ser muito favorável; a arritmia freqüentemente desaparece após-a interrupção de atividade física por tempo determinado.
A abordagem diagnóstica segue os mesmos critérios gerais anteriormente descritos, com maior ênfase para o teste ergométrico, que pode revelar os limites máximos de atividade física desencadeadores da FA78.
Com relação à terapêutica, como algumas modalidades esportivas impedem o uso de betabloqueador e o digitálico, apresenta importante redução de ação sobre a condução AV durante atividade esportiva, o controle da freqüência pode ser difícil. As drogas mais comumente utilizadas para manutenção do ritmo são propafenona e flecainida. Por outro lado, na presença de doença cardíaca estrutural ou fatores de risco para eventos embólicos, pode ser necessária a anticoagulação plena, o que desqualifica o atleta para participação em esportes de contato físico.
Como alternativa terapêutica, a ablação por radiofreqüência pode curar uma série de taquiarritmias atriais desencadeadoras de FA, incluindo as formas focais. Após sua realização com sucesso, a retomada das atividades esportivas pode ocorrer após 3 a 6 meses de seguimento sem sintomas78,79.
Idosos - Sabe-se que a incidência de FA dobra a cada década de vida, depois dos 60 anos de idade. A prevalência é de aproximadamente 2,3% > 40 anos, 5,9% > 65 anos e 10% > 80 anos de idade. Aproximadamente 1/3 dos pacientes apresentam FA paroxística, e 2/3 FA permanente 80. Foi demonstrado, também, que: a presença de FA em idosos está francamente associada ao risco aumentado de síncopes e AVC***; a gravidade do quadro está relacionada à presença de outras doenças e, nos idosos, cerca de 60% dos casos estão associados às seguintes morbidades: valvulopatias (8%), hipertensâo arterial sistêmica (16%) e cardiopatia isquêmica (12%); o hipertireoidismo se associa à presença de FA em até 24% dos casos. Freqüentemente manifesta sintomas inespecíficos, como depressão, perda de apetite, cansaço, emagrecimento e diarréia e, por isso, recomenda-se sistematicamente a dosagem de TSH em idosos com FA.
A abordagem terapêutica do idoso com FA segue, em linhas gerais, as mesmas regras estabelecidas para adultos jovens, com a ressalva de que o uso dos antiarrítmicos em idosos deve ser muito mais criterioso, pois porque esses, freqüentemente, apresentam: doenças associadas, alterações cognitivas e propensão a disfunções renais ou hepáticas81. Antiarrítmicos da classe I manifestam taxas mais elevadas de efeitos pro-arrítmicos em idosos e a cardioversão elétrica para ritmo sinusal, demonstra resultados imediatos e a curto prazo iguais aos observados em adultos jovens.
Recomendações gerais para abordagem do idoso com FA devem incluir também ressalvas especificas à anticoagulação, relacionadas à própria idade: idade >60 anos sem fatores de risco-AAS 325mg/d; idade> 60anos com fatores de risco- anticoagulação plena (RNI:2-3); opcional: associar AAS 81 -162mg/d; idade> 70 anos: anticoagulação plena (RNI: 2)
Cardiomiopatia hipertrófica - A incidência de FA em CMH é estimada entre 10 a 25%, e os fatores que mais influenciam a sua ocorrência são: idade, dimensões do átrio esquerdo e presença de insuficiência cardíaca. Esta disfunção miocárdica, cuja principal característica fisiopatológica é a redução da complacência do VE, na presença de FA paroxística, em geral, manifesta importantes alterações hemodinâmicas e sintomas muito limitantes. É importante destacar que não existem ensaios clínicos bem delineados ou randomizados a respeito da terapêutica da FA em CMH, como farmacológica, estimulação artificial (marcapasso atrial e desfibrilador implantável) e ablação por cateter (focal e da junção AV). Assim, as recomendações para abordagem da FA na CMH seguem as regras gerais descritas para outras cardiopatias, com algumas inclusões específicas.
Recomendações para reversão da FA paroxística na CMH
Classe I - pacientes com instabilidade hemodinâmica ou refratários à medicação antiarrítmica devem ser submetidos à cardioversão elétrica (NE= C); 2) pacientes com estabilidade hemodinâmica devem ser submetidos à administração de: amiodarona, disopiramida, propafenona, quinidina, procainamida ou sotalol (NE= C) e à anticoagulação com manutenção do RNI entre 2 e 3 (NE= B).
Classe IIb - Implante de desfibrilador atrial (NE= D).
Classe III - Nenhuma
Recomendações para controle da freqüência cardíaca em pacientes com CMH e FA Permanente:
Classe I - 1) administração de beta-bloqueador, verapamil, diltiazem, amiodarona ou sotalol. (NE= C); 2) ablação do nódulo AV, em casos de refratariedade a drogas
Classe IIa - ablação do nódulo AV e implante de marcapasso definitivo (NE=C).
Classe III - administração de digitálicos NE=C).
Recomendações para manutenção do ritmo sinusal em pacientes com CMH e FA paroxística:
Classe I - Nenhuma
Classe IIa - 1) administração de propafenona, disopiramida e amiodarona (NE=C); 2) implante de marcapasso, na presença de FA claramente relacionada à bradicardia documentada. (NE=C).
Classe IIb - 1) implante de desfibrilador atrial. (NE=D); 2) ressincronização atrial, na presença de distúrbios da condução interatrial (NE=D); 3) ablação de veias pulmonares ou cirurgia de Cox (NE=D).
Síndrome de Wolff-Parkinson-White (SWPW) - FA paroxística é uma arritmia comum nos pacientes com síndrome de SWPW e pode ser observada em até 1/3 deles82. Sugere-se que, nesses casos, a ocorrência de FA deve-se ao aumento da vulnerabilidade atrial, acompanhada por alterações hemodinâmicas durante os episódios de taquicardia por reentrada atrioventricular ou por anormalidade atrial intrínseca. Na vigência da FA, os impulsos atriais são conduzidos de forma rápida pela via anômala, podendo induzir fibrilação ventricular (FV) e morte súbita, cuja ocorrência, entretanto, é baixa (0,6% ao ano)83. Os pacientes com SWPW considerados de risco para essas complicações são os que apresentam: período refratário curto da via anômala (<250ms), intervalo R-R curto durante FA com complexos QRS pré-excitados ou múltiplas vias.
É importante destacar que o tratamento ablativo da SWPW reduz sensivelmente a recorrência de FA a longo prazo, sugerindo a participação importante da via anômala na gênese dessa arritmia. Por isso, a ablação por cateter é considerada alternativa terapêutica primária para esses pacientes, sobretudo na presença de síncope ou FA.
Assim, fica claro que as recomendações para a abordagem de pacientes com síndrome de WPW e FA devem se basear na gravidade da doença e na apresentação clínica da arritmia:
Recomendações para pacientes com síndrome de WPW e FA paroxística:
Classe I - 1) cardioversão elétrica imediata (prevenção de FV) nos casos de FC rápida e instabilidade hemodinâmica. (NE=B); 2) ablação por cateter da via anômala em pacientes com FC elevada e síncopes ou período refratário efetivo da via anômala curto (=270ms) (NE=B); 3) administração de propafenona, procainamida ou amiodarona intravenosa para restaurar o ritmo sinusal, nos casos de complexo QRS largo(=120ms), na ausência de instabilidade hemodinâmica. (N=C); 4) excepcionalmente, administração de medicação intravenosa (propafenona, amiodarona, procainamida), nos casos de FA com complexos QRS pré-excitados e instabilidade hemodinâmica, quando a cardioversão elétrica é indisponível (NE=D).
Classe IIb - 1) procainamida, disopiramida ou amiodarona endovenosa em pacientes hemodinamicamente estáveis, com FA com complexos QRS pré-excitados. (NE=B).
Classe III - 1) administração de adenosina, beta-bloqueador, digitálico, diltiazem ou verapamil (NE=B).
Considerações Finais e Direções Futuras
Conforme expresso no inicio desta Diretriz, a FA não é somente a arritmia mais freqüente em clínica, mas também a de mais fácil diagnóstico e a de mais difícil tratamento, devido a mecanismos, substratos e apresentação clínica heterogênea. O cardiologista clínico e o clínico geral podem encontrar dificuldades em definir escolhas terapêuticas apropriadas e modernas, apenas por não poder acompanhar a grande quantidade de dados oferecidos pela mídia científica. Assim, este documento, resultado não apenas da síntese da literatura disponível, mas também de uma ampla discussão e adaptação à realidade brasileira realizada por especialistas, pretende auxiliar os colegas que lidam com FA a tratar melhor seus pacientes, fazendo escolhas terapêuticas mais apropriadas. Estas diretrizes não pretendem indicar a decisão a ser tomada, mas oferecer ao clínico o espectro de decisões possíveis e as evidências atuais que, considerando as características clínicas dos pacientes, assim como seus valores e expectativas, servirão de base para sua própria decisão.
Além disso, as recomendações expressas neste documento podem facilitar o relacionamento com os diferentes organismos de Saúde Pública.
A quantidade de situações clínicas em que a FA se apresenta como desafio terapêutico, bem como a diversidade de opções terapêuticas, é, em parte, uma prova de que ainda estamos longe do tratamento ideal: eficiente, seguro e de baixo custo para a maioria dos casos, a fim de permitir que um contingente cada vez maior de médicos possa aplicá-los aos seus pacientes.
A partir da posição atual, podemos antecipar, com ponderada convicção, possíveis caminhos: alguns imediatos e outros mais distantes. A julgar pelo interesse da comunidade de especialistas, as técnicas de ablação estão entre os primeiros e deverão receber um número considerável de propostas que envolve cateteres e fontes de energia mais apropriadas. Propostas que, certamente, tornar-se-ão de mais fácil manuseio e, provavelmente, poderão oferecer a cura para os casos bem selecionados. Ademais, o desenvolvimento tecnológico aumentará o interesse por estas técnicas e o número de eletrofisiologistas dedicados ao procedimento de ablação de FA.
Por outro lado, a industria farmacêutica poderá também nos surpreender com a introdução de novo medicamento, capaz de atuar sobre o remodelamento atrial e interferir, eficazmente, na ocorrência e sustentação da FA. Entretanto, até o momento, não temos conhecimento, de qualquer produto em desenvolvimento com tais características. Ainda com relação aos fármacos, nossas expectativas imediatas se concentram na aprovação para uso clínico da droga ximelagatran, um inibidor direto da trombina, de uso oral, que, segundo este documento, parece ser tão efetivo como o cumadin, na prevenção do tromboembolismo, a mais grave comorbidade da FA, sem os inconvenientes conhecidos desse medicamento.
Finalmente, para um futuro não tão próximo, talvez a engenharia genética ofereça-nos outra opção terapêutica. Pesquisadores franceses e chineses identificaram um gene (KCNQ1) que controla os movimentos de potássio através da membrana celular, que poderia explicar a ocorrência de FA em algumas famílias estudadas. Este novo conhecimento das bases moleculares da FA poderá nos conduzir ao diagnóstico pré-sintomático dessa arritmia e ao desenvolvimento de novas e auspiciosas terapêuticas.
Referências
1. Diretrizes para Avaliação e Tratamento de Pacientes com Arritmias Cardíacas. Arq Bras Cardiol 2002; 80-Suppl V:1-50.
2. www.cardiol.br/diretrizes/procedimentos.asp
3. Pimenta J, Moreira JM. A história da fibrilação atrial. In Moreira DAR. Fibrilação Atrial, Lemos Editorial, São Paulo, 2003, 11-29.
4. Einthoven W. Le télécardiogramme. Arch Internat Physiol 1906; 4: 132-64.
5. Lewis T. Evidences of auricular fibrillation, treated historically. Br Med J 1912; 13: 56-60.
6. Lévy S, Maarek M, Counmel P, et al. Characterization of differents subsets of atrial fibrillation in general practice in France. The Alpha Study. Circulation 1999; 99: 3028-35.
7. Sparks PB, Kalman JM. Is atrial flutter a risk for stroke? J Am Coll Cardiol 2001; 38: 785-8.
8. Biblo LA, Yuan Z, Quan KJ, Mackall JÁ, Rimm AA. Risk of stroke in patients with atrial fibrillation. Am J Cardiol 2001; 87: 346-9.
9. Camm AJ, Levy S, Saksena S, Wyse DG. Don't you agree or not what part of the problem don't you understand? J Intervent Card Electrophisiol 2000; 4: 559-60.
10. Wijffels MCEF, Kirchhof CJHJ, Boersma LVA, Dorland R, Alessie MA. Atrial fibrillation begets atrial fibrillation. In: Alessie M, Campbel R, Olsson B. Atrial Fibrillation: Mechanisms and Therapeutic Strategies. Armonk, NY: Futura Publishing co; 1994.
11. Scherf D. Studies on auricular tachycardia caused by aconitine administration. Proc Exp Biol Med 1947; 64: 233-9.
12. Haisseguere M, Jais P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339:659-66.
13. Moe GK. Evidence for reentry as a mechanism of cardiac arrhytmias. Rev Physiol Biochem Pharmacol 1975; 72: 55-81.
14. Alessie MA, Konings KT, Kirchhof CJ. Mapping of atrial fibrillation. In: Olsson SB, Alessie MA, Campbell RW. In: Atrial Fibrillation Mechanisms and Therapeutic Strategies. Armonk, NY: Futura Publishing 1994: 37-49.
15. Ewy GA, Appleton CPP, De Maria AN et al. ACC/AHA - Guidelines of the clinical application of echocardiography. Circulation 1990; 82; 2323-46.
16. Mugge A, Kuhn H, Daniel WG. The role transesophageal echocardiography in the detection left atrial thrombi. Echocardiography 1993; 10: 405-17.
17. Carerj S, Micari A, Di Rosa S, Pugliatti P, Cerrito M, Zito C, Coglito S, Luzza F, Arigo F. Thrombo-embolic risk evaluation in patients with atrial fibrillation. Role of echocardiography. Minerva Cardioangiol 2003; 51: 287-93.
18. Koca V, Bozat T, Akkaya V, Sarikamis C, Turk T, Vural H, Ozdemir A. Left atrial thrombus detection with multiplane transesophageal echocardiography: an echocardiographic study with surgical verification. J Heart Valve Dis 1999; 8: 63-6.
19. Manning WJ, Weintraub RM, Waksmonski CA et al. Accuracy of transesophageal echocardiography for identifying left atrial thrombi. A prospective, intraoperative study. Ann Intern Med 1995; 123: 817-22.
20. Goswami KC, Narang R, Bahl VK, Talwar KK, Manchanda SC. Comparative evaluation of transthoracic and transesophageal echocardiography in detection of left atrial thrombus before percutaneous transvenous mitral commissurotomy. Do all patients need transesophageal examination? Int J Cardiol 1997; 62: 237-49.
21. Guidera SA, Steinberg JS. The signal-averaged P wave duration: a rapid and noninvasive marker of risk of atrial fibrillation. J Am Coll Cardiol 1993; 21/7: 1645-51.
22. The SOLVD Investigators Studies of Left Ventricular Dysfunction Effect of enalapril on mortality and the development of heart failure in assymptomatic patients with reduced left ventricular ejection fractions. N Engl J Med 1992; 327: 685-91.
23. Carson PE, Johson GR, Dunkkman WB, Fletcher RD, Farrell L, Cohn JN for the V-Heft VA Cooperative Studies Group. The influence of atrial fibrillation on prognosis in mild to moderate heart failure The V-HeFT Studies. Circulation 1993: 87- Suppl.VI: 102-10.
24. Flaker GC, Blackshear JR, McBride R, et al. Antiarrhythmic drug therapy and cardiac mortality in atrial fibrillation. The Stroke Prevention in Atrial Fibrillation Investigators. J Am Coll Cardiol 1992; 20: 527-32.
25. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: The Framingham Study. Stroke 1991; 22: 983-8.
26. Laupacis A, Boysen G, Connolly S et al. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med 1994; 154: 1449-57.
27. Stroke Prevention in Atrial Fibbrilation Investigators: (SPAF) Predictors of thromboembolism in atrial fibbrilation. Clinical features of patients at risks. Ann Intern Med.1992, 116: 1-5.
28. Stroke Prevention in Atrial Fibrillation Investigators: Predictors of thromboembolism in atrial fibbrilation. (SPAF II): Echocardiography features of patients at risks. Ann Intern Med.1992; 116: 6-12.
29. Seidl K, Hauer B, Schwick NG, Zellner D, Zahn R, Senges J. Risk of thrombembolic events in patientes with atrial flutter. Am J Cardiol 1998, 82: 5, 580-3.
30. Danias PG, Caulfield TA, Weigner MJ et al. Likelihood of spontaneous conversion of atrial fibrillation to sinus rhythm. J Am Coll Cardiol 1998; 31: 588-92.
31. Boriani G, Martignani C, Biffi M et al. Oral loading with propafenone for conversion of recent-onset atrial fibrillation. A review on in-hospital treatment. Drugs 2002; 62: 415-23.
32. Nichol G, McAlister F, Pham B et al. Meta-analysis of randomized controlled trials of the effectiveness of antiarrhythmic agents at promoting sinus rhythm in patients with atrial fibrillation. Heart 2002; 87: 535-43.
33. Hilleman DE, Spinler AS. Conversion of recent-onset atrial fibrillation with intravenous amiodarone: A meta-analysis of randomized controlled trials. Pharmacotherapy 2002; 22: 66-74.
34. Chevalier P, Durand-Dubief A, Burri H et al. Amiodarone versus placebo and class Ic drugs for cardioversion of recent-onset atrial fibrillation: A meta-analysis. J Am Coll Cardiol 2003; 41: 255-62.
35. Reimold SC, Maisel WH, Antman EM. Propafenone for the treatment of supraventricular tachycardia and atrial fibrillation: A meta-analysis. Am J Cardiol 1998; 82: 66N-71N.
36. Ferreira E, Sunderji R, Gin K. Is oral sotalol effective in converting atrial fibrillation to sinus rhythm? Pharmacotherapy 1997; 17: 1233-7.
37. Van Gelder IC, Crijns HJ, Van Gilst WH, Verwer R, Lie KI. Prediction of uneventful cardioversion and maintenance of sinus rhythm from direct-current electrical cardioversion of chronic atrial fibrillation and flutter. Am J Cardiol 1991; 68: 41- 6.
38. Arnold AZ, Mick MJ, Mazurek RP, Loop FD, Trohman RG. Role of prophylactic anticoagulation for direct current cardioversion in patients with atrial fibrillation or atrial flutter. J Am Coll Cardiol 1992; 19: 851-5.
39. Ewy GA. The optimal technique for electrical cardioversion of atrial fibrillation. Clin Cardiol 1994; 17: 79-84.
40. Irani WN, Grayburn PA, Afridi I. Prevalence of thrombus, spontaneous echo contrast, and atrial stunning in patients undergoing cardioversion of atrial flutter: a prospective study using transesophageal echocardiography. Circulation 1997; 95: 962- 6.
41. Fuster V, Rydén LE, Asinger RW, et al. ACC/AHA/ESC Guidelines for the management of patients with atrial fibrillation. A report of American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Deveolp Guidelines for the Management of Patients with Atrial Fibrillation. J Am Coll Cardiol 2001; 38: 1231-65.
42. Jull-Moller S, Edwardsson N, Rehnqvist-Ahlberg N. Sotalol versus quinidine for the maintenance of sinus rhythm after direct current conversion of atrial fibrillation. Circulation 1990; 82: 1932-9.
43. Roy D, Taljic M, Dorian P et al. for the Canadian Trial of Atrial Fibrillation Investigators. Amiodarone to prevent recurrence of atrial fibrillation. N Eng J Med 2000; 342: 913-20.
44. Gold RL, Haffajee CI, Charos G, Sloan K, Baker S, Alpert JS. Amiodarone for refractory atrial fibrillation. Am J Cardiol 1986; 57: 124-7.
45. Daoud EG, Knight BP, Weiss R, Bahu M, Paladino W, Goyal R, Man C, Stricberger AS, Morady F. Effect of verapamil and procainamide on atrial fibrillation-induced electrical remodeling in humans. Circulation 1997; 96: 1542-50.
46. Wood MA, Brown-Mahoney C, Kay GN, Ellenbogen KA. Clinical outcomes after ablation and pacing therapy for atrial fibrillation: a metanalysis. Circulation 2000; 101: 1138-44.
47. Connolly SJ, Laupacis A, Gent M et al. Canadian atrial fibrillation anticoagulation (CAFA) study. J Am Coll Cardiol 1991; 18: 349-55.
48. Pettersen P, Godtfredsen J, Boysen G et al. The Copenhagen AFASAK Study. Placebo-controlled, randomised trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation. Lancet 1989; 28: 175-9.
49. EAFT - Gorter JW, for the Stroke Prevention in Reversible Ischemia Trial (ESPIRIT) and European Atrial Fibrillation Trial (EAFT) study groups. Major bleeding during anticoagulation after cerebral ischemia: patterns and risk factors. Neurology 1999, 53: 1319-27.
50. Koudstaal PJ, on behalf of the EAFT (European Atrial Fibrillation trial) Study Group. Secondary prevention in non-rheumatic atrial fibrillation after transient ischaemic attack or minor stroke. Lancet 1993; 342: 1255-62.
51. Hylek EM, Skates SJ, Sheehan MA, Singer DE. An analysis of the lowest effective intensity of prophylatic anticoagulation for patients with nonrheumatic atrial fibrillation. N Engl J Med 1996; 335: 540-6.
52. Gullov AL, Koefoed BG, Petersen P et al. Fixed minidose warfarin and aspirin alone and in combination versus adjusted-dose warfarin for stroke prevention in atrial fibrillation. Second Copenhagen atrial fibrillation, aspirin and anticoagulation study. Arch Intern Med 1998; 158: 1513-21.
53. Hart RG, Pearce LA, Rothbart RM et al. for the Stroke Prevention in Atrial Fibrillation Investigators. Stroke with intermitent atrial fibrillation: incidence and predictors during aspirin therapy. J Am Coll Cardiol 2000; 35: 183-7.
54. A comparison of rate control and rhythm control in patients with atrial fibrillation. The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators. N Eng J Med 2002; 347: 1825-33.
55. Halperin JL. Ximelagatran compared with warfarin for prevention of thromboembolism in patients with nonvalvular atrial fibrillation: Rationale, objectives, and design of a pair of clinical studies and baseline patient characteristics (SPORTIF III and V). Am Heart J 2003; 146: 431-8.
56. BAATAF - Boston Area Anticoagulant Trial for Atrial Fibrillation. N Eng J Med 1990; 323: 1505-11.
57. SPINAF - Ezekowitz MD, Bridgers SL, James KE et al. for the Veterans Affairs Stroke Prevention in Nonrheumatic Atrial Fibrillation Investigators. Warfarin in the prevention of stroke associated wih nonrheumatic atrial fibrillation (published erratum appears in N Engl J Med 1993; 328:148). N Engl J Med 1992: 327-1406-12.
58. Arents T, Jander N, Rosenthal JV et al. Incidence of pulmonary vein stenosis 2 years after radiofrequency catheter ablation of refractory atrial fibrillation. Eur Heart Journal 2003; 24: 963-9.
59. Haissaguerre M, Shah D, Jais P et al. Electrophysiological breakthroughs from the left atrium to the pulmonary veins. Circulation 2000; 102: 2463-5.
60. Pappone C, Oreto G, Lamberti F, et al. Catheter ablation of paroxysmal atrial fibrillation using a 3D mapping system. Circulation 1999; 100: 1203-8.
61. Cox JL, Schuessler RB, D'Agostino HJ Jr et al. The surgical treatment of atrial fibrillation, III: development of a definitive surgical procedure. J Thorac Cardiovasc Surg 1991; 101: 569-83.
62. Brodell GK, Cosgrove D, Schiavone W, Underwood DA, Loop FD. Cardiac rhythm and conduction disturbances in patients undergoing mitral valve surgery. Cleve Clin J Med 1991; 58: 397-9.
63. Sueda T, Nagata H, Shikata H et al. Simple left atrial procedure for chronic atrial fibrillation associated with mitral valve disease. Ann Thorac Surg 1996; 62: 1796-800.
64. Gaita F, Gallotti R, Calo L, et al. Limited posterior left atrial cryoablation in patients with chronic atrial fibrillation undergoing valvular heart sugery. J Am Coll Cardiol 2000; 36: 159-66.
65. Williams MR, Stewart JR, Bolling SF et al. Surgical treatment of atrial fibrillation using radiofrequency energy. Ann Thorac Surg 2001; 71: 1939-44.
66. Tuinenburg AE, Van Gelder IC, Tieleman RG et al. Mini-maze suffices as adjunct to mitral valve surgery in patients with preoperative atrial fibrillation. J Cardiovasc Electrophysiol 2000; 11: 960-7.
67. Kalil RAK, Lima GG, Leiria TL et al. Simple surgical isolation of pulmonary veins for the treatment of secondary atrial fibrillation in mitral valve disease. Ann Thorac Surg, 2002, 73: 1169-73.
68. Default P, Saksena S, Prakash A et al _ Long-term outcome of patients with drug refractory atrial flutter an fibrillation after single an dual-site right atrial pacing for arrhytmia prevention. J Am Coll Cardiol 1998; 32: 1900-8.
69. Creswell LL, Schuessler RB, Rosenbloom M, Cox JL. Hazards of postoperative atrial arrhythmias. Ann Thorac Surg 1993; 56: 539-49.
70. Lahey SJ, Campos CT, Jennings B et al. Hospital readmission after cardiac surgery: Does "fast-track" cardiac surgery result in cost saving or cost shifting? Circulation 1998; II35-II40.
71. Aranki SF, Shaw DP, Adams DH, et al. Predictors of atrial fibrillation after coronary artery surgery: Current trends and impact on hospital resources. Circulation 1996; 94: 390-7.
72. Leitch JW, Thomson D, Baird DK, Harris PJ. The importance of age as a predictor of atrial fibrillation and flutter after coronary artery bypass grafting. J Thorac Cardiovasc Surg 1990; 100: 338-42.
73. Dixon FE, Genton E, Vacek JL, Moore CB, Landry J. Factors predisposing to supraventricular tachyarrhythmias after coronary artery bypass grafting. Am J Cardiol 1986; 58: 476-8.
74. Crystal E, Connolly SJ, Sleik K, Ginger TJ, Yusuf S. Interventions on prevention of postoperative atrial fibrillation in patients undergoing heart surgery. A meta-analysis. Circulation 2002; 106: 75-80.
75. Sacchetti A, Moyer V, Baricella R, Cameron J, Moakes M. Primary cardiac arrhythmias in children. Pediatric Emerg Care 1999; 15: 95-8.
76. Nanthakumar K, Lau Y, Veenhuyzen G, Sanchez J, Kay NK. Atrial fibrillation in children with structurally normal hearts. PACE 2003; 26: 1061 [Abstract].
77. Furlanello F, Bertoldi A, Dallago M et al. Atrial fibrillation in elite athletes. J Cardiovasc Electrophysiol 1998; 9: S63-S68.
78. Estes III M, Link M, Cannom D et al. Report of NASPE Policy Conference of arrhythmias in athletes. J Cardiovasc Electrophysiol 2001; 12: 1208-19.
79. Link M, Wang P, Estes III M. Cardiac arrhythmias and electrophysiologic observations in the athlete. In Williams R. The Athlete and Heart Disease. Lippincott Williams & Wilkins, Philadelphia 1998; 197-216.
80. Manolio T, Furberg C, Rautaharju P et al. Cardiac arrhythmias on 24-hour ambulatory electrocardiography in older women and men. The Cardiovascular Health Study. J Am Coll Cardiol 1994; 35: 458-62.
81. Berman N. Antiarrhythmoc therapy in the eldery: pacemakers and drugs. Geriatrics 1986; 41: 61-72.
82. Hamada T, Hiraki T, Ikeda H et al. Mechanisms for atrial fibrillation in patients with Wolff-Parkinson-White Syndrome. J Cardiovasc Electrophysiol 2002; 13: 223-9.
83. Soria R, Guize L, Chretien JM et al. The natural history of 270 cases of Wolff-Parkinson-White syndrome in a survey of the general population. Arch Mal Coeur 1989; 82: 331-6.
Datas de Publicação
-
Publicação nesta coleção
02 Jun 2004 -
Data do Fascículo
Nov 2003