ATUALIZAÇÃO
O papel da ecocardiografia no tratamento percutâneo dos defeitos septais
Simone Rolim F. Fontes Pedra; Sérgio Cunha Pontes Jr; Renata de Sá Cassar; Carlos Augusto Cardoso Pedra; Sérgio Luiz Navarro Braga; César Augusto Esteves; Maria Virgínia Tavares Santana; Valmir Fernandes Fontes
Instituto Dante Pazzanese de Cardiologia - São Paulo, SP
Correspondência Correspondência Simone Rolim F. Fontes Pedra Av. Dr. Dante Pazzanese, 500 14º 04012-180 - São Paulo, SP E-mail: sfpedra@uol.com.br
Nos últimos anos, o tratamento percutâneo dos defeitos septais atriais e ventriculares, evoluiu significativamente, estabelecendo-se como modalidade terapêutica factível, segura e eficaz. A ecocardiografia possui papel fundamental neste cenário, identificando os candidatos adequados para o procedimento, monitorando o implante da prótese e avaliando a taxa de oclusão no seguimento. Os dispositivos disponíveis para a oclusão percutânea dos defeitos septais sofreram modificações e aperfeiçoamento ao longo do tempo. Da mesma forma, grandes avanços tecnológicos ocorreram também na área da ecocardiografia, tais como o advento da ecocardiografia transesofágica multiplanar de alta resolução, da ecocardiografia tridimensional on e off-line e da ecocardiografia intracardíaca. Esta última tornou-se, em alguns centros, a técnica de escolha para a monitoração da oclusão percutânea da comunicação intertatrial em adultos, por dispensar anestesia geral, tornando o procedimento ainda mais simples. Neste artigo de revisão, discutiremos o papel da ecocardiografia para avaliação dos pacientes antes, durante e após os procedimentos intervencionistas para oclusão dos defeitos septais, incluindo a comunicação interatrial, tipo ostium secundum, as comunicações interventriculares perimembranosa e muscular e o forame oval patente, baseado na experiência do grupo neste tipo de abordagem.
Nos últimos 35 anos, os equipamentos de ultra-som sofreram grande aprimoramento tecnológico, o que fez com que a ecocardiografia se tornasse um instrumento indispensável para o diagnóstico das cardiopatias congênitas. Na área da cardiologia intervencionista pediátrica, a ecocardiografia vem tendo papel primordial na identificação e seleção dos pacientes candidatos aos procedimentos percutâneos, na monitoração e no seguimento tardio daqueles assim tratados. Dentre os procedimentos intervencionistas, aqueles que mais necessitam do apoio da ecocardiografia são a oclusão dos defeitos dos septos atrial e ventricular. Neste capítulo, estaremos discutindo o papel da ecocardiografia no tratamento percutâneo da comunicação interatrial, do forame oval patente e da comunicação interventricular.
Oclusão percutânea da comunicação interatrial
As comunicações interatriais correspondem a, aproximadamente, 7% de todas as cardiopatias congênitas, atingindo, predominantemente, o sexo feminino, na proporção de 2:11. O tipo anatômico mais freqüente é aquele localizado na região da fossa oval (75% dos casos), também denominado comunicação interatrial do tipo ostium secundum, e ocorre devido à deficiência, perfuração ou ausência da lâmina da fossa oval2. As demais comunicações ocorrem devido à deficiência de prega entre as paredes dos átrios e entre as suas veias tributárias, sendo elas as comunicações do tipo ostium primum, do tipo seio venoso e do tipo seio coronariano. Considerando-se estas características anatômicas, a única comunicação interatrial passível de tratamento com implante de próteses é aquela do tipo fossa oval2.
Seleção dos pacientes
Aqueles pacientes com suspeita clínica de comunicação interatrial são inicialmente submetidos ao estudo ecocardiográfico transtorácico. Além da identificação do defeito, são avaliados o retorno venoso pulmonar, o grau de repercussão hemodinâmica, os sinais de hipertensão pulmonar e a presença de defeitos associados que necessitem abordagem terapêutica3. As informações mais específicas referentes às características dos defeitos, como número de orifícios, dimensões dos mesmos, localização no septo e características das bordas que os circundam, são mais bem avaliadas pela ecocardiografia transesofágica, que pode ser realizada ambulatorialmente ou imediatamente antes do implante, já na sala de hemodinâmica3-5. Na nossa experiência, a realização do estudo transesofágico antes do paciente entrar na sala de cateterismo traz vantagens quanto à programação do procedimento, seleção do dispositivo que será empregado e aconselhamento familiar.
Critérios de indicação
O tratamento percutâneo da comunicação interatrial está indicado nas seguintes condições: a) comunicação interatrial do tipo ostium secundum; b) diâmetro do defeito variando de 4 a 35 mm; c) fluxo pelo defeito predominantemente direcionado do átrio esquerdo para o direito; d) presença de sinais de sobrecarga volumétrica das câmaras direitas (aumento do diâmetro diastólico do ventrículo direito e presença de movimentação paradoxal do septo interventricular); e) distância das margens do defeito das estruturas contíguas (seio coronariano, valvas atrioventriculares, veias pulmonares e veias cavas) de pelo menos 4 mm; f) presença de bordas com pelo menos 5 mm ao redor de, no mínimo, 75% do contorno do defeito; g) ausência de hipertensão pulmonar fixa; h) ausência de defeitos associados que necessitem abordagem cirúrgica.
Todos estes critérios se aplicam quando se pretende utilizar as próteses da linha Amplatzer, as mais freqüentemente utilizadas no mercado atualmente. Em se tratando do implante da prótese Helex, a segunda mais comumente empregada, o diâmetro da comunicação interatrial não deve exceder 15 mm. Esta linha de dispositivo está disponível nos diâmetros de 15, 20, 25, 30 e 35 mm. Como a escolha do seu tamanho se baseia em uma relação de 1,7 a 2 para 1 com o diâmetro estirado (diâmetro da comunicação interatrial obtido na sala de hemodinâmica em que se coloca um balão complacente através do orifício, distendendo-o de modo que o mesmo adquira uma configuração circular), é possível a oclusão de orifícios distendidos de, no máximo, 20 mm6.
Graças à crescente experiência mundial no tratamento percutâneo do defeito do septo interatrial, ao aprimoramento dos dispositivos oclusores e à melhoria da qualidade das imagens ecocardiográficas, incluindo ecocardiografia transesofágica de alta resolução, reconstrução tridimensional e ecocardiografia intracardíaca, as indicações, que antes eram restritas a casos inquestionavelmente favoráveis, foram ampliadas para casos denominados complexos, em que se sabe que o implante é factível e efetivo, porém, com taxas de sucesso discretamente menores e tempo de procedimento mais prolongado7. Considera-se comunicação interatrial de anatomia complexa aquela que apresenta as seguintes características: diâmetro estirado acima de 26 mm; bordas deficientes, medindo menos que 4 mm na região anterior, posterior ou inferior do septo; dois orifícios distantes entre si; septo interatrial multifenestrado e aneurisma do septo interatrial (septo interatrial redundante e móvel com excursão maior que 10 mm)7. A figura 1 ilustra uma comunicação interatrial de anatomia complexa.
Independentemente do tipo da sonda empregada (biplanar ou multiplanar), o estudo transesofágico deve seguir uma metodologia de estudo padronizada, a fim de se obter todas as informações necessárias. Preferimos iniciar pelos cortes no plano transverso (0º na sonda multiplanar), deslocando lenta e progressivamente a sonda, a partir do plano que evidencia a veia cava superior e a raiz aórtica até atingir o nível do assoalho do átrio direito, identificado pela presença do seio coronariano e da valva de Eustáquio. A seguir, passamos para o plano longitudinal (90º), com o corte que contém o apêndice atrial esquerdo e a valva mitral, imprimindo à sonda rotação lenta no sentido anti-horário, a fim de se obter uma varredura do septo atrial da porção anterior para a posterior. Esta padronização permite ao examinador reconstruir mentalmente o defeito em três dimensões, bem como definir com bastante exatidão as características dos defeitos complexos5,8.
A ecocardiografia durante o procedimento
O procedimento de oclusão da comunicação interatrial é continuamente monitorado pela ecocardiografia transesofágica ou intracardíaca. Quando isto é feito por via transesofágica, mesmo que o paciente seja adulto, há necessidade do emprego da anestesia geral. Os principais passos da ecocardiografia durante o implante são:
1. Medida do diâmetro estirado - Além da medida, deve-se verificar se o balão está obstruindo totalmente o defeito e se não aparecem defeitos adicionais com a oclusão do defeito principal. A escolha do tamanho da prótese Amplatzer depende das dimensões do orifício distendido pelo cateter-balão (diâmetro estirado). O estiramento com o cateter-balão afasta por compressão as bordas finas, formadas pelo septum primum, ocupando o orifício delimitado pelas bordas rígidas, constituídas pelo septum secundum, que servirão de apoio à prótese. O cateter-balão, ao ser insuflado e sofrer resistência do septo, passa a exibir nítida cintura ao redor do defeito. Importante lembrar que o balão deve ser insuflado somente o suficiente para que ocorra abolição do fluxo pelo defeito, evitando-se superestiramento do septo e, conseqüente, superdimensionamento do dispositivo a ser selecionado. As medidas do diâmetro da cintura na imagem bidimensional do ecocardiograma e na angiografia digital são semelhantes, desde que sejam adequadamente realizadas. A correta determinação do diâmetro estirado do orifício é essencial para que se faça a escolha adequada do dispositivo. Embora a prótese Amplatzer possa ser facilmente recolhida e substituída por outra, a escolha de um dispositivo de dimensões inadequadas acarreta um custo mais elevado ao procedimento.
2. Orientar o hemodinamicista quanto à localização do disco do átrio esquerdo, previamente à abertura dos demais componentes do dispositivo, para que ele esteja próximo do septo interatrial, sem protruir através do defeito.
3.Demonstrar o posicionamento do dispositivo após a abertura de todos os seus componentes. A prótese só deverá ser liberada quando for demonstrada a presença de tecido do septo interatrial entre seus dois discos e se não houver qualquer comprometimento funcional de estruturas venosas e valvares do coração.
4. Rastreamento de possível fluxo residual, graduando-o quando presente. No período que se segue à liberação, é possível identificar pequeno fluxo central de baixa velocidade através das malhas da prótese, que normalmente desaparece no dia seguinte ao implante5.
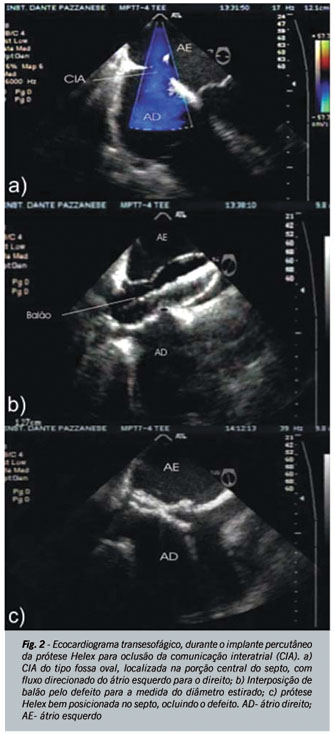
Em situações especiais, como de comunicações interatriais amplas em crianças pequenas ou com dimensões superiores a 35 mm, em adultos, alguns autores têm abandonado a realização do diâmetro estirado para a seleção do dispositivo. Nestes casos, faz-se a medida do comprimento superior-inferior do septo interatrial em posição de quatro câmaras (a zero grau pela ecocardiografia transesofágica). O dispositivo é escolhido de modo que o diâmetro do disco esquerdo não exceda o comprimento total do septo (Dr. Zahid Amin, comunicação pessoal). Esta nova tática, além de viabilizar o procedimento percutâneo, evita o superdimensionamento da prótese, que pode, raramente, resultar em erosão da parede da aorta para o átrio direito ou esquerdo, fístulas aorto-camerais ou derrame pericárdico com tamponamento cardíaco9. Seguindo as indicações previamente descritas, só é possível ocluir estes defeitos percutaneamente se as bordas ao redor do orifício medirem pelo menos 5 mm, exceção feita àquela junto à aorta, que pode estar ausente, não contra-indicando o procedimento. A figura 2 ilustra uma comunicação do tipo fossa oval com características morfológicas ideais para tratamento percutâneo, a medida do diâmetro estirado com interposição do balão medidor e o resultado final após a liberação de um dispositivo Helex.
A ecocardiografia na evolução pós-oclusão percutânea da comunicação interatrial (CIA)
O seguimento dos pacientes submetidos ao implante de prótese para comunicação interatrial é feito por avaliações clínicas seriadas e ecocardiograma transtorácico no dia seguinte ao implante, depois de um, três, 12 meses e, posteriormente, a cada ano. Os principais parâmetros avaliados pela ecocardiografia são o adequado posicionamento do dispositivo, a presença de fluxo residual e a medida das dimensões das cavidades cardíacas direitas3. Avaliando-se o diâmetro diastólico do ventrículo direito no eixo paraesternal longitudinal pré-implante e durante o seguimento tardio, temos observado que o ventrículo direto retorna às suas dimensões normais dentro do primeiro ano pós-procedimento4.
No começo da nossa experiência, repetíamos rotineiramente o ecocardiograma transesofágico após o terceiro mês de implante. Diante dos excelentes resultados tardios, observados no nosso serviço, e na experiência mundial com relação à baixa taxa de complicações tardias, ao desaparecimento dos pequenos fluxos residuais e à redução do perfil do dispositivo, temos acompanhado os pacientes com ecocardiograma transtorácico apenas, reservando o estudo transesofágico àqueles com suspeita de complicação. Embora complicações como fístulas da aorta para os átrios direito ou esquerdo, derrame pericárdico secundário à perfuração atrial, e formação de trombo ou vegetação no dispositivo tenham sido raramente descritas na literatura, nenhuma destas anormalidades foram observadas na nossa experiência que já consta de 144 casos, incluindo os pacientes tratados com as próteses Amplatzer e Helex. Tampouco foi observado comprometimento da função das valvas atrioventriculares e do deságüe das veias pulmonares ou sistêmicas.
Oclusão percutânea do forame oval patente
Aproximadamente 25% da população geral são portadores de forame oval patente10. Na quase totalidade destes casos, o forame oval não tem implicações patológicas, sendo apenas uma variação anatômica da normalidade, casualmente observada durante o exame ecocardiográfico de rotina. Entretanto, em pacientes jovens (< 55 anos) com acidente vascular de causa indeterminada após investigação extensa (incluindo causas neurológicas, cardíacas, vasculares, hematológicas e reumatológicas), o forame oval patente é encontrado em até 60% dos casos. Baseado nesta diferença epidemiológica, postulou-se que o forame oval patente, funcionando como válvula, pode permitir uma inversão de fluxo no plano atrial (da direita para a esquerda) em situações de aumento da pressão no átrio direito, associando-se a processos embólicos para a circulação sistêmica (embolia paradoxal)11. Por este motivo, é obrigatória a investigação de inversão de fluxo no plano atrial pelo forame oval em indivíduos que apresentaram manifestações de isquemia cerebral sem outras causas aparentes. Esta pesquisa é realizada por meio da ecocardiografia transesofágica. Além da visualização anatômica do orifício na fossa oval, é necessária a documentação da passagem de fluxo do átrio direito para o átrio esquerdo, empregando-se contraste. Com o objetivo de se obter um contraste rico em microbolhas, utiliza-se a solução salina fisiológica agitada na proporção de 9 para cada 1 ml de ar injetado rapidamente em veia periférica. Neste momento, para que haja aumento das pressões no lado direito do coração, solicita-se ao paciente que realize a manobra de Valsalva. É confirmada a presença de fluxo invertido pelo forame oval quando o contraste, após encher toda a cavidade atrial direita, é encontrado na quantidade de pelo menos cinco microbolhas no interior do átrio esquerdo, dentro dos três primeiros ciclos cardíacos após a injeção5.
Nestes pacientes, a oclusão percutânea do forame oval tem sido realizada com segurança e eficácia, com o objetivo de prevenir recorrências dos fenômenos tromboembólicos12. Apesar de ainda não haver estudos prospectivos e randomizados comparando a terapêutica medicamentosa (com antiplaquetários ou anticoagulantes) com a percutânea, os estudos longitudinais observacionais já publicados demonstram que a oclusão com dispositivos é, no mínimo, tão eficaz quanto a terapêutica clínica, sendo mais efetiva em alguns sub-grupos de pacientes, tais como aqueles que apresentam mais de um episódio de acidente vascular cerebral anterior ou recorrência em vigência de tratamento farmacológico13. Alguns aspectos anatômicos do septo interatrial têm particular importância na correta seleção do diâmetro e do formato do dispositivo para a oclusão percutânea e devem ser adequadamente observados durante o estudo ecocardiográfico. São eles: a) presença ou não de aneurisma do septo interatrial (definido por excursão > que 10 mm do septo)7, b) o forame oval em túnel, e c) a presença de outros orifícios no septo interatrial. A investigação ecocardiográfica do septo interatrial também é obrigatória em mergulhadores profissionais, já que os portadores de forame oval patente apresentam risco cinco vezes maior de sofrerem doença descompressiva em relação àqueles que têm o septo interatrial íntegro14. Recentemente, o forame oval tem sido associado a casos de enxaqueca com aura e sua oclusão associada à melhora da intensidade e freqüência dos episódios15.
O procedimento de oclusão percutânea do forame oval é, de modo geral, bastante rápido e simples e pode ou não ser realizado sob monitorização ecocardiográfica, ficando esta escolha a critério do hemodinamicista. A figura 3 ilustra a visão ecocardiográfica do forame oval patente e o estudo com microbolhas para detecção de fluxo direito-esquerdo.
A profilaxia medicamentosa com aspirina é mantida por seis a 12 meses após o tratamento intervencionista. Só é possível interromper o uso da medicação quando um novo estudo transesofágico com microbolhas não demonstrar a passagem de contraste para o átrio esquerdo. Este exame é normalmente realizado seis meses após o procedimento.
Oclusão percutânea da comunicação interatrial (CIA) e do forame oval guiada pela ecocardiografia intracardíaca
Atualmente disponível no mercado brasileiro, o AcuNav vem revolucionando o cateterismo intervencionista, principalmente nas áreas de eletrofisiologia e do tratamento percutâneo de defeitos septais. O AcuNav é um transdutor de ultra-som, destinado ao sistema venoso, que promove imagens de alta resolução e penetração de até 12 cm no coração. O cateter atualmente comercializado é 10 French, com 90 cm de comprimento, introduzido no sistema venoso por uma bainha 11 French. Ele é dotado de um transdutor, acoplado à sua extremidade distal, que permite aquisição de imagens setoriais de 90º. A sua ponta pode ser mobilizada nos sentidos ântero-posterior e lateral (esquerdo-direito), no interior das câmaras cardíacas, gerando imagens bidimensionais e permitindo, também, a utilização dos recursos de Doppler (pulsátil, contínuo e mapeamento de fluxo em cores). O cateter é compatível com a linha de equipamentos Sequoia™, Aspen™ e Cypress™ (Acuson Corporation, Mountain View, CA), já tendo sido liberado para uso intracardíaco e intraluminal pelo Food and Drug Administration.
As principais vantagens do ecocardiograma intracardíaco, para o tratamento percutâneo das comunicações interatriais e do forame oval, são a obtenção de imagens de melhor qualidade, já que o transdutor encontra-se dentro do átrio direito, a melhor visibilização da porção póstero-inferior do septo interatrial (a borda mais dificilmente visibilizada na ecocardiografia transesofágica), menor exposição à radiação por redução do tempo de procedimento, necessidade de apenas um operador (o próprio hemodinamicista obtém as imagens ecocardiográficas), e tornar desnecessário o uso da anestesia geral em adolescentes e adultos, por dispensar a ecocardiografia transesofágica16-20.
Estudos recentes comprovam que todas as medidas realizadas pela ecocardiografia intracardíaca têm ótima correlação com aquelas obtidas pelo estudo transesofágico, e que as imagens demonstrando a posição de guias, cateteres e discos dos dispositivos são de qualidade superior21,22. Por estas vantagens, o monitoramento da oclusão percutânea da comunicação interatrial e do forame oval patente pela ecocardiografia intracardíaca tem se tornado a prática de escolha na faixa etária de adolescentes e adultos nos países da América do Norte e da Europa. Esta prática vem se difundindo mais lentamente nos países em desenvolvimento, principalmente devido ao alto custo do transdutor, que teoricamente deve ser utilizado apenas uma vez. Na prática, entretanto, o equipamento pode ser reesterilizado e reutilizado por cerca de 10 vezes, dependendo do cuidado com o qual é manuseado (Carlos Zabal, comunicação pessoal). A figura 4 ilustra algumas imagens obtidas durante a experiência inicial com a ecocardiografia intracardíaca no instituto Dante Pazzanese de Cardiologia e no Hospital do Coração.
Oclusão percutânea da comunicação interventricular (CIV)
A comunicação interventricular é o defeito congênito mais freqüente, correspondendo a cerca de 20% de todas as cardiopatias congênitas23. Em aproximadamente 80% dos casos, ela é localizada na área membranosa do septo, com extensões variáveis para as porções da via de entrada e de saída ventricular, sendo por isso denominada perimembranosa23. Com o desenvolvimento do dispositivo da família Amplatzer, apropriado para essa região do septo, o tratamento percutâneo, que anteriormente restringia-se aos defeitos localizados na região muscular, estendeu-se também para defeitos localizados na região membranosa24,25. Embora, virtualmente, todas as comunicações interventriculares perimembranosas possam ser ocluídas por via percutânea, alguns aspectos importantes devem ser cuidadosamente analisados pela ecocardiografia. Diferente da comunicação interatrial, a avaliação pré-procedimento, na maior parte dos candidatos ao implante, é realizada pela ecocardiografia transtorácica. Na nossa prática clínica, temos realizado ecocardiograma transesofágico apenas em pacientes adultos, com janelas ecocardiográficas muito desfavoráveis, em que a adequada avaliação anatômica do defeito está comprometida.
Seleção dos pacientes
Como mencionado anteriormente, alguns aspectos anatômicos e funcionais devem ser avaliados previamente à indicação do tratamento percutâneo da comunicação interventricular: A) Localização: sendo esta perimembranosa, é importante ressaltar se está mais situada na região de entrada ou de saída ventricular. B) Distância da borda da comunicação para os folhetos da valva aórtica. Embora a ausência de tecido separando os folhetos valvares aórticos do orifício não seja uma contra-indicação absoluta para o procedimento, sabe-se que nesta situação ele é mais trabalhoso e requer mais cuidado. De modo geral, é preferível que o defeito tenha uma distância de pelo menos 2 mm da valva aórtica. C) Presença de tecido acessório em torno do defeito: por vezes existe uma pequena quantidade de tecido frouxo em torno do orifício, que não reduz significativamente o fluxo através do mesmo. Nestes casos, a prótese deverá ficar ancorada no próprio septo muscular. Por outro lado, existem defeitos que apresentam quantidade abundante de tecido ao seu redor, formando um verdadeiro aneurisma, que reduz significativamente o orifício original de fluxo. Estes defeitos podem ser ocluídos com próteses menores que os anteriores, que são posicionadas no interior do saco aneurismático e não comprometem o funcionamento das valvas aórtica e tricúspide. D) Presença de prolapso de folheto valvar aórtico. Sabe-se que de 2 a 7% das comunicações interventriculares podem associar-se a prolapso do folheto coronariano direito da valva aórtica, levando ou não a diferentes graus de insuficiência aórtica. Apesar deste achado ser uma contra-indicação ao procedimento percutâneo nos protocolos de estudo nos Estados Unidos, o implante de dispositivos nestas situações tem sido realizado com segurança e ótimos resultados em médio prazo. Na nossa experiência de 29 casos, três pacientes apresentavam tal complicação e, em todos, a prótese foi implantada com sucesso. Dois persistiram sem insuficiência aórtica e um apresentou mínima progressão da insuficiência previamente existente, caracterizada como discreta. A monitoração destes pacientes com ecocardiogramas seriados é obrigatória. E) Presença de defeitos associados, como membrana subvalvar aórtica e banda muscular anômala do ventrículo direito, que necessitem abordagem terapêutica cirúrgica. Lesões, como estenose valvar pulmonar ou aórtica, canal arterial persistente e coartação da aorta, podem também ser tratadas percutaneamente, dependendo de suas particularidades anatômicas. F) Presença de sinais de repercussão hemodinâmica, como a dilatação das câmaras cardíacas esquerdas, que justifiquem a intervenção. G) Ausência de hipertensão arterial pulmonar fixa.
A comunicação interventricular muscular também pode ser tratada por via percutânea, esteja ela localizada na região trabecular do septo ou nas porções apicais. Embora existam menos variações anatômicas, é comum a presença de múltiplos orifícios, particularmente no ápex ventricular. Quando o orifício é único, a prótese Amplatzer para comunicação interventricular muscular é a melhor opção, pois apresenta discos de retenção pequenos, que ocupam pouca extensão do septo interventricular. Em casos de comunicações interventriculares múltiplas, próteses da linha CardioSEAL podem ser mais adequadas, devendo ser implantadas no orifício mais central. Recentemente, tem-se adotado a abordagem híbrida para o manejo de pacientes de baixa faixa etária (< 6 meses) e com defeitos musculares amplos. Estes pacientes são levados ao centro cirúrgico, onde são submetidos à toracotomia para exposição do coração. Por meio de punção da parede livre do ventrículo direito, um fio-guia é avançado através da comunicação interventricular para o ventrículo esquerdo, utilizando-se a ecocardiografia transesofágica para monitoração destes passos. Uma bainha curta é avançada até o ventrículo esquerdo sobre o guia, possibilitando o implante de próteses por via perventricular. Esta abordagem inovadora e revolucionária, na qual o intervencionista, o ecocardiografista e o cirurgião trabalham em conjunto, evita os efeitos deletérios da circulação extracorpórea, proporcionando taxas de oclusão acima de 90%26.
A ecocardiografia durante a oclusão percutânea da comunicação interventricular (CIV)
O ideal é utilizar sondas multiplanares, pois planos intermediários entre 0 e 180º podem facilitar a visibilização da comunicação interventricular e da posição do dispositivo, dependendo da localização do defeito do septo. De maneira semelhante ao implante da prótese para comunicação interatrial, a ecocardiografia auxilia na medida do orifício e na escolha do número do dispositivo a ser empregado, monitora o posicionamento de guias, cateteres e bainhas no interior do coração e determina a disposição dos discos da prótese, antes e após a sua liberação24. Também se constitue em função primordial da ecocardiografia, a análise cuidadosa da função das valvas aórtica e tricúspide e a detecção e graduação de possível fluxo residual. Embora as imagens ecocardiográficas tragam um grande auxílio ao procedimento, a fluoroscopia e a angiografia são indispensáveis no decorrer da intervenção.
A ecocardiografia no seguimento de pacientes submetidos à oclusão percutânea da CIV
O seguimento dos pacientes submetidos ao implante percutâneo da comunicação interventricular é realizado por consultas clínicas e ecocardiogramas transtorácicos seriados, quando devemos nos deter em avaliar os seguintes parâmetros: a) dimensões das cavidades cardíacas esquerdas (normalmente após o primeiro ano de tratamento, estas já retornaram às dimensões normais24); b) posicionamento do dispositivo do septo interventricular; c) presença de fluxo residual; d) avaliação e medida do gradiente de fluxo na via de saída do ventrículo esquerdo; e e) função das valvas aórtica e tricúspide.
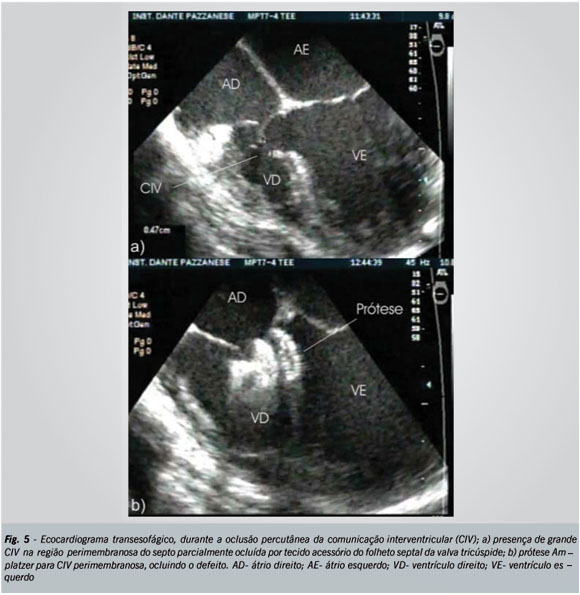
A nossa experiência atual consta de 29 casos tratados com prótese para comunicações interventriculares perimembranosas e um, com a prótese para comunicações musculares. Independentemente das características morfológicas do defeito, todos os procedimentos foram realizados com sucesso. Notou-se a presença de fluxo residual imediato em 25% dos casos. Em um período de seguimento médio de 10 ± 8,5 meses, apenas dois pacientes persistem com discreto fluxo residual, dentre os quais um com menos de um mês de seguimento. Em dois outros casos, observamos gradientes na via de saída do ventrículo esquerdo variando de 17 a 25 mmHg, no dia seguinte após o procedimento, que desapareceram durante a evolução, possivelmente devido à redução espontânea do perfil do dispositivo e ao processo de epitelização, que ocorre dentro dos primeiros seis meses após o implante24,27. A figura 5 ilustra uma comunicação interventricular antes e após o implante da prótese Amplatzer.
A ecocardiografia tridimensional na oclusão percutânea dos defeitos septais
Em meados dos anos 90, vários estudos surgiram demonstrando a viabilidade e a acurácia da ecocardiografia tridimensional na avaliação do coração28. Nesta mesma época, o cateterismo terapêutico se consagrava como técnica eficaz e segura para o tratamento das comunicações interatriais. Com isso, vários estudos foram publicados demonstrando a avaliação tridimensional do septo interatrial e de seus defeitos, e as relações do dispositivo implantado com as estruturas cardíacas contíguas29-33. A reconstrução tridimensional era feita a partir de imagens obtidas pela ecocardiografia transesofágica, visibilizando as margens do defeito por meio de uma varredura automática do septo interatrial, entre zero e 180º, obtidas a cada dois ou três graus, sincronizados ao ciclo cardíaco e respiratório do paciente. Pela necessidade de total imobilidade do paciente, a maioria dos estudos era realizada na própria sala de hemodinâmica sob anestesia geral32,33. Utilizando-se a linha de equipamentos Hewlett-Packard Sonos (Philips, Bothel, WA, EUA) e Echo-Scan, TomTec Imaging Systems Inc., (Boulder, CO, EUA), o tempo necessário para a obtenção das imagens variava de 3 a 10 minutos, dependendo da freqüência cardíaca do paciente. O tempo necessário para a reconstrução variava de 3 a 5 minutos, podendo se prolongar para até 40 minutos para a reconstrução de um conjunto de imagens29,32.
As principais vantagens da ecocardiografia tridimensional para a avaliação das comunicações interatriais são as de demonstrar claramente as características do septo intertatrial e de seus defeitos, com especial visibilização da extensão da borda ântero-superior, estabelecer o formato do defeito e permitir obtenção de todas as dimensões do orifício28,29,34. Nesta modalidade de imagem, é possível fazer uma apreciação en face da comunicação, mimetizando a visão do cirurgião, com vantagem desta ser dinâmica durante o ciclo cardíaco. Após o implante da prótese, a reconstrução tridimensional pode auxiliar na identificação do posicionamento do dispositivo, demonstrando e localizando os braços ou discos protruídos para o átrio direito33. A avaliação e a medida de defeitos residuais também podem ser realizadas por este método29.
Recentemente, tornou-se disponível no mercado um sistema de reconstrução tridimensional on-line. Até o momento, estão disponíveis apenas transdutores transtorácicos, o que dificulta a ideal apreciação dos defeitos do septo interatrial em crianças maiores e adultos. A figura 6 ilustra a apreciação bidimensional, por via transesofágica, e tridimensional transtorácica de uma mesma comunicação interatrial.
Já existe relato de emprego deste equipamento para monitoração de oclusão percutânea da comunicação interatrial em uma criança de seis anos e 22 kg, com imagens obtidas pela via subcostal35. O posicionamento dos cateteres, guias e do balão medidor, e a abertura dos discos do dispositivo Amplatzer foram orientados pela ecocardiografia tridimensional on-line, que permitiu a demonstração adequada de tecido do septo interatrial entre os mesmos e demonstrou, mais precisamente, a borda póstero-inferior. Os benefícios, observados com este tipo de monitoração neste relato, foram redução do tempo de fluoroscopia, melhor delineamento da forma do defeito, eliminação da intubação esofágica e maior confiança no posicionamento do dispositivo35. Com o desenvolvimento do transdutor transesofágico para imagens tridimensionais on-line, o método também poderá ser aplicado para a monitoração da oclusão percutânea das comunicações interatriais e interventriculares em crianças maiores e adultos.
CONCLUSÕES
Como pudemos observar, existem várias técnicas percutâneas para a abordagem dos defeitos septais. Avanços tecnológicos vêm tornando estes procedimentos factíveis, efetivos e seguros. A ecocardiografia exerce papel fundamental para a identificação dos pacientes que podem se beneficiar destes procedimentos, para a monitoração do implante dos dispositivos e para o acompanhamento imediato e tardio pós-oclusão. Da mesma forma que os dispositivos e as técnicas percutâneas vêm se tornando cada vez mais elaborados e adequados para estas abordagens terapêuticas, a ecocardiografia vem acompanhando esta evolução, trazendo informações mais completas e precisas para o hemodinamicista, auxiliando a intervenção e tornando-a ainda mais simples e segura.
REFERÊNCIAS
1. Sobrinho JHM, Fontes VF, Pontes Jr SC. Defeitos isolados do septo atrial. In: Sobrinho JHM, Fontes VF, Pontes Jr SC, editors. Cardiopatias Congênitas. São Paulo: Sarvier, 1990: 295-314.
2. Ferreira Martins JD, Anderson RH. The anatomy of interatrial communications--what does the interventionist need to know? Cardiol Young 2000; 10: 464-73.
3. Pedra SR, Pedra CA, Assef JE et al. Percutaneous closure of atrial septal defects. The role of transesophageal echocardiography. Arq Bras Cardiol 1999; 72: 59-69.
4. Fontes VF, Pedra SRFF, Braga SLNB, Pedra CAC. Fechamento Percutâneo da Comunicação Interatrial. Rev Soc Cardiol Estado de São Paulo 2002; 12: 293-305.
5. Pontes Jr SC. Importância da ecocardiografia transesofágica na avaliação morfológica dos defeitos septais atriais. Rev Bras de Ecocard 1999; 31: 25-37.
6. Pedra CA, Pedra SF, Esteves CA et al. Initial experience in Brazil with the Helex septal occluder for percutaneous occlusion of atrial septal defects. Arq Bras Cardiol 2003; 81: 435-52.
7. Pedra CA, Pedra SR, Esteves CA et al. Transcatheter closure of secundum atrial septal defects with complex anatomy. J Invasive Cardiol 2004; 16: 117-22.
8. Pontes Jr SC. Avaliação morfológica dos defeitos septais atriais. In: Assef JE, Belém M, Castro-Lima A, Torreão JAM, editors. Ecocardiografia Transesofágica. Rio de Janeiro: Livraria e Editora Revinter Ltda, 2000: 164-76.
9. Chun DS, Turrentine MW, Moustapha A, Hoyer MH. Development of aorta-to-right atrial fistula following closure of secundum atrial septal defect using the Amplatzer septal occluder. Catheter Cardiovasc Interv 2003; 58: 246-51.
10. Varma C, Benson LN, Warr MR et al. Clinical outcomes of patent foramen ovale closure for paradoxical emboli without echocardiographic guidance. Catheter Cardiovasc Interv 2004; 62: 519-525.
11. Yahia AM, Shaukat A, Kirmani JF, Qureshi AI. Age Is Not a Predictor of Patent Foramen Ovale with Right-to-Left Shunt in Patients with Cerebral Ischemic Events. Echocardiography 2004; 21: 517-522.
12. Wahl A, Krumsdorf U, Meier B et al. Transcatheter treatment of atrial septal aneurysm associated with patent foramen ovale for prevention of recurrent paradoxical embolism in high-risk patients. J Am Coll Cardiol 2005; 45: 377-80.
13. Windecker S, Wahl A, Nedeltchev K et al. Comparison of medical treatment with percutaneos closure of patent foramen ovale in patients with criptogenic stroke. J Am Coll Cardiol 2004; 44: 750-8.
14. Cartoni D, De Castro S, Valente G et al. Identification of professional scuba divers with patent foramen ovale at risk for decompression illness. Am J Cardiol 2004; 94: 270-3.
15. Morandi E, Anzola GP, Angeli S, Melzi G, Onorato E. Transcatheter closure of patent forâmen ovale: a new migraine treatment? J Interv Cardiol 2003; 16: 39-42.
16. Hijazi Z, Wang Z, Cao Q, Koenig P, Waight D, Lang R. Transcatheter closure of atrial septal defects and patent foramen ovale under intracardiac echocardiographic guidance: feasibility and comparison with transesophageal echocardiography. Catheter Cardiovasc Interv 2001; 52: 194-9.
17. Koenig PR, Abdulla RI, Cao QL, Hijazi ZM. Use of intracardiac echocardiography to guide catheter closure of atrial communications. Echocardiography 2003; 20:781-7.
18. Zanchetta M. On-line intracardiac echocardiography alone for Amplatzer Septal Occluder selection and device deployment in adult patients with atrial septal defect. Int J Cardiol 2004; 95: 61-8.
19. Zanchetta M, Onorato E, Rigatelli G et al. Intracardiac echocardiography-guided transcatheter closure of secundum atrial septal defect: a new efficient device selection method. J Am Coll Cardiol 2003; 42: 1677-82.
20. Zanchetta M, Rigatelli G, Pedon L et al. Transcatheter atrial septal defect closure assisted by intracardiac echocardiography: 3-year follow-up. J Interv Cardiol 2004; 17: 95-8.
21. Boccalandro F, Muench A, Salloum J et al. Interatrial defect sizing by intracardiac and transesophageal echocardiography compared with fluoroscopic measurements in patients undergoing percutaneous transcatheter closure. Catheter Cardiovasc Interv 2004; 62: 415-20.
22. Boccalandro F, Baptista E, Muench A, Carter C, Smalling RW. Comparison of intracardiac echocardiography versus transesophageal echocardiography guidance for percutaneous transcatheter closure of atrial septal defect. Am J Cardiol 2004; 93: 437-40.
23. Tynan M, Anderson RH. Ventricular Septal Defect. In: Anderson RH, Baker EJ, McCartney FJ, Rigby ML, Shinebourne EA, editors. Paediatric Cardiology. New York: Churchill, Livingstone, 2002: 983-1014.
24. Pedra CA, Pedra SR, Esteves CA et al. Percutaneous closure of perimembranous ventricular septal defects with the Amplatzer device: technical and morphological considerations. Catheter Cardiovasc Interv 2004; 61: 403-10.
25. Pedra CA, Pedra SR, Esteves CA, Chamie F, Christiani LA, Fontes VF. Transcatheter closure of perimembranous ventricular septal defects. Expert Rev Cardiovasc Ther 2004; 2: 253-64.
26. Bacha EA, Cao QL, Starr JP, Waight D, Ebeid MR, Hijazi ZM. Perventricular device closure of muscular ventricular septal defects on the beating heart: technique and results. J Thorac Cardiovasc Surg. 2003; 126: 1718-23.
27. Cao QL, Du ZD, Joseph A et al. Immediate and six-month results of the profile of the Amplatzer septal occluder as assessed by transesophageal echocardiography. Am J Cardiol 2001; 88: 754-9.
28. Marx GR, Fulton DR, Pandian NG et al. Delineation of site, relative size and dynamic geometry of atrial septal defects by real-time three-dimensional echocardiography. J Am Coll Cardiol 1995; 25: 482-90.
29. Acar P. Three-dimensional echocardiography in transcatheter closure of atrial septal defects. Cardiol Young 2000; 10: 484-92.
30. Acar P, Dulac Y, Roux D, Rouge P, Duterque D, Aggoun Y. Comparison of transthoracic and transesophageal three-dimensional echocardiography for assessment of atrial septal defect diameter in children. Am J Cardiol 2003; 91: 500-502.
31. Acar P, Roux D, Dulac Y, Rouge P, Aggoun Y. Transthoracic three-dimensional echocardiography prior to closure of atrial septal defects in children. Cardiol Young 2003; 13: 58-63.
32. Maeno YV, Benson LN, McLaughlin PR, Boutin C. Dynamic morphology of the secundum atrial septal defect evaluated by three dimensional transoesophageal echocardiography. Heart 2000; 83: 673-7.
33. Maeno YV, Benson LN, Boutin C. Impact of dynamic 3D transoesophageal echocardiography in the assessment of atrial septal defects and occlusion by the double-umbrella device (CardioSEAL). Cardiol Young 1998; 8: 368-78.
34. Marx GR, Sherwood MC, Fleishman C, Van Praagh R. Three-dimensional echocardiography of the atrial septum. Echocardiography 2001; 18: 433-43.
35. Roman KS, Nii M, Golding F, Benson LN, Smallhorn JF. Images in cardiovascular medicine. Real-time subcostal 3-dimensional echocardiography for guided percutaneous atrial septal defect closure. Circulation 2004; 109(24): e320-e321.
Recebido em 08/10/04
Aceito em 30/03/05
Correspondência
Datas de Publicação
-
Publicação nesta coleção
20 Fev 2006 -
Data do Fascículo
Fev 2006