Resumos
OBJETIVO: Determinar numa população de recém-nascidos de uma cidade do sul do Brasil as concentrações de lípides séricos e apolipoproteína B (apo-B) em neonatos normais a termo e pré-termo, analisando-se a influência da idade gestacional e do peso ao nascimento. MÉTODOS: Foram estudados 212 neonatos de ambos os sexos, deles, 142 a termo (>37 semanas de gestação) e 70 neonatos pré-termo (<37 semanas). Os neonatos a termo e pré-termo foram classificados pelo peso de nascimento em pequeno para a idade gestacional ou adequado para a idade gestacional. Utilizou-se o sangue do cordão umbilical para as análises bioquímicas. RESULTADOS: Os valores de colesterol total, LDL-C, HDL-C e de apo-B foram maiores nos neonatos pré-termo (79±34, 26±6, 45±15 e 36±14 mg/dL, respectivamente) do que nos neonatos a termo (58±19, 20±10, 31±14 e 28±7 mg/dL, respectivamente; p < 0,0001). Inversamente, os valores de triglicérides foram menores nos neonatos pré-termo (36±14 mg/dL) do que nos neonatos a termo (43±25 mg/dL; p < 0,0018). O sexo e o fato de o neonato ser pequeno ou adequado para a idade gestacional não influenciaram os valores de colesterol total e frações, de triglicérides e apo-B. CONCLUSÃO: As concentrações de lípides plasmáticos e de apo-B dos neonatos da população estudada são semelhantes às dos neonatos de outros países de continentes diversos reportados na literatura e, como esperado, é acentuadamente menor do que os valores referidos na literatura para as de crianças acima de dois anos. A maturidade fetal influencia a concentração de lípides dos neonatos, mas o peso de nascimento não tem efeito nesses parâmetros.
Recém-nascidos; colesterol; triglicérides; lipoproteína de alta densidade; lipoproteína de baixa densidade
OBJECTIVE: To determine the concentrations of serum lipids and apolipoprotein B (apo-B) in a population of normal full-term and preterm newborns in a city in Southern Brazil, and assess the impact of gestational age and birth weight on these values. METHODS: Two hundred and twelve newborns of both genders were studied, 142 of whom were full-term (>37 weeks of gestation) and 70 preterm (<37 weeks of gestation). According to their birth weights, the full-term and preterm newborns were classified as small for gestational age or appropriate for gestational age. Umbilical cord blood was collected for biochemical analysis. RESULTS: The total cholesterol, LDL-C, HDL-C and apo-B values were higher in preterm newborns (79±34, 26±6, 45±15 and 36±14 mg/dL, respectively ) than in full-term newborns (58±19, 20±10, 31±14 and 28±7 mg/dL, respectively; p < 0.0001). Inversely, triglyceride values were lower in preterm newborns (36±14 mg/dL) than in full-term newborns (43±25 mg/dL; p < 0.0018). Gender and size at birth did not have any impact on the values of total cholesterol and fractions, triglycerides, and apo-B. CONCLUSION: Plasma concentrations of lipids and apo-B in the population of newborns studied are similar to those in newborns from other countries and continents reported in medical literature and, as expected, are markedly lower than the values mentioned in literature for infants over two years of age. Fetal maturity has an impact on the concentration of lipids in newborns, but birth weight does not have any effect on these parameters.
Newborns; cholesterol; triglycerides; high-density lipoprotein; low-density lipoprotein
ARTIGOS ORIGINAIS
ATEROSCLEROSE
Concentração sérica de lípides e apolipoproteína B em recém-nascidos
Sirlei Donegá; Jane Oba; Raul C. Maranhão
Instituto do Coração do Hospital das Clínicas de São Paulo, FMUSP, Universidade de São Paulo e Universidade Federal de Londrina - São Paulo, SP - Londrina, PR
Correspondência Correspondência: Jane Oba Rua João Lourenço 763/192 04508-031 São Paulo, SP E-mail: jane.oba@incor.usp.br
RESUMO
OBJETIVO: Determinar numa população de recém-nascidos de uma cidade do sul do Brasil as concentrações de lípides séricos e apolipoproteína B (apo-B) em neonatos normais a termo e pré-termo, analisando-se a influência da idade gestacional e do peso ao nascimento.
MÉTODOS: Foram estudados 212 neonatos de ambos os sexos, deles, 142 a termo (>37 semanas de gestação) e 70 neonatos pré-termo (<37 semanas). Os neonatos a termo e pré-termo foram classificados pelo peso de nascimento em pequeno para a idade gestacional ou adequado para a idade gestacional. Utilizou-se o sangue do cordão umbilical para as análises bioquímicas.
RESULTADOS: Os valores de colesterol total, LDL-C, HDL-C e de apo-B foram maiores nos neonatos pré-termo (79±34, 26±6, 45±15 e 36±14 mg/dL, respectivamente) do que nos neonatos a termo (58±19, 20±10, 31±14 e 28±7 mg/dL, respectivamente; p < 0,0001). Inversamente, os valores de triglicérides foram menores nos neonatos pré-termo (36±14 mg/dL) do que nos neonatos a termo (43±25 mg/dL; p < 0,0018). O sexo e o fato de o neonato ser pequeno ou adequado para a idade gestacional não influenciaram os valores de colesterol total e frações, de triglicérides e apo-B.
CONCLUSÃO: As concentrações de lípides plasmáticos e de apo-B dos neonatos da população estudada são semelhantes às dos neonatos de outros países de continentes diversos reportados na literatura e, como esperado, é acentuadamente menor do que os valores referidos na literatura para as de crianças acima de dois anos. A maturidade fetal influencia a concentração de lípides dos neonatos, mas o peso de nascimento não tem efeito nesses parâmetros.
Palavras-chave: Recém-nascidos, colesterol, triglicérides, lipoproteína de alta densidade, lipoproteína de baixa densidade.
A doença arterial coronariana é a principal causa de morbi-mortalidade na população adulta no Ocidente1. No Brasil, as doenças cardiovasculares e outras manifestações da aterosclerose constituem a terça parte das causas de mortalidade no adulto2 e a dislipidemia, que é um dos principais fatores de risco da aterosclerose, pode ter sua origem na infância3. As seqüelas clínicas da aterosclerose geralmente ocorrem na idade adulta, mas vários estudos experimentais e clínicos mostraram que essas lesões podem iniciar na infância. As importantes observações de McGill e McMaham em estudo multicêntrico PDAY (Pathobiological Determinants of Atherosclerosis in Youth) mostraram a progressão das estrias gordurosas, as lesões iniciais da aterosclerose, em aorta de crianças e coronárias de adolescentes. Nesta pesquisa, a transição de estrias gordurosas para placas ateroscleróticas, observadas em jovens a partir dos 25 anos de idade, foi associada com o aumento nas concentrações séricas de LDL-C (low-density lipoprotein cholesterol) e VLDL-C (very-low-density lipoprotein cholesterol) e diminuição de HDL-C (high-density lipoprotein cholesterol)3. Na última década, houve muito interesse em descobrir se as alterações lipídicas observadas no período fetal poderiam resultar em mudanças permanentes nas estruturas e funções dos órgãos, que se refletiriam na vida adulta. Alguns estudos experimentais e clínicos demonstraram estrias gordurosas na aorta durante o período de desenvolvimento fetal4-6, enquanto outras pesquisas epidemiológicas tentaram associar peso e alterações lipídicas ao nascimento com a doença arterial coronariana do adulto, mas os resultados ainda não são conclusivos7-12.
Diversas condições clínicas podem influenciar as concentrações dos lípides séricos nos neonatos. A idade gestacional tem importante efeito sobre a concentração dos lípides séricos e de apoliproteínas, pois, com o aumento da maturidade fetal, as concentrações de colesterol total diminuem, enquanto as de triglicérides aumentam13,14. Baixo peso ao nascer, associado à prematuridade e a alterações no crescimento intrauterino, independente da idade gestacional, podem estar associados a concentrações séricas aumentadas de colesterol total e de apolipoproteína B (apo-B)8,15. Outras alterações, como infecções perinatais e malformações congênitas também podem influenciar o perfil lipídico dos neonatos16. No que se refere ao efeito da concentração sérica de colesterol materno sobre a concentração de colesterol fetal, as conclusões são controversas. Alguns autores concluíram que esse fenômeno poderia ser potencializado pela hipercolesterolemia materna5, enquanto outros não encontraram correlação, inclusive quando a mãe tem hipercolesterolemia17.
O perfil lipídico dos neonatos no nosso meio é desconhecido, mas isso não ocorre em outros países. Conhecer os valores de referência do perfíl lipídico no início da vida pode ampliar a compreensão das dislipidemias, das suas associações com a aterosclerose e auxiliar no planejamento preventivo em fases mais precoces. Nosso objetivo foi o de determinar as concentrações de lípides séricos e da apo-B no sangue de cordão de uma população de neonatos normais a termo e pré-termo, de uma cidade do sul do Brasil, e analisar as influências da idade gestacional e do peso ao nascimento sobre os parâmetros lipídicos.
MÉTODOS
Foram estudados consecutivamente 212 neonatos, dos quais 107 eram do sexo feminino e 105 do masculino, da maternidade do Hospital Universitário Regional Norte do Paraná da Universidade Estadual de Londrina (HURNP-UEL), de um total de 496 nascimentos registrados no período.
Critérios de inclusão: Na população estudada foram inclusos somente neonatos a termo (³37 semanas de gestação) e pré-termo (<37 semanas), de ambos os sexos, de parto normal e cesáreo, sem malformações evidentes e sem complicações perinatais.
Critérios de exclusão: Foram exclusos os neonatos pós-termo (>41 semanas de gestação), de mães diabéticas, em eclâmpsia e os que sofreram estresse fetal, como infecções no período perinatal, desconforto respiratório, condições essas que podem alterar a concentração lipídica15.
A idade gestacional foi calculada pela data da última menstruação. Após o nascimento, todos neonatos foram pesados e distribuídos de acordo com a idade gestacional em termo e pré-termo. Posteriormente os neonatos foram classificados em dois subgrupos, com base no peso ao nascer: pequenos para a idade gestacional (PIG), quando o peso foi menor que o percentil 10, ajustado para a idade gestacional e adequado para a idade gestacional (AIG), quando o peso permaneceu entre os percentis 10 e 90, segundo os critérios de Alexander e cols.18.
Na tabela 1 mostram-se os dados da idade gestacional e o peso dos neonatos estudados. Do total da população de 212 neonatos, 77% eram a termo e 33% pré-termo; quanto à adequação do peso para a idade gestacional 85% eram AIG e 15% eram PIG.
O estudo foi aprovado pelo Comitê de Ética do HURNP-UEL. As mães eram esclarecidas quanto à participação na pesquisa e, após autorização dos procedimentos, assinavam o termo de consentimento livre e esclarecido.
Determinações bioquímicas: A coleta das amostras de sangue dos neonatos foi realizada por meio de punção da veia do cordão umbilical com retirada de 6 ml de sangue, na extremidade proximal aos neonatos, imediatamente após o clampeamento do cordão, para evitar possível contaminação com sangue materno19.
As concentrações de colesterol total, de LDL-C, de HDL-C e de triglicérides (TG) foram determinadas no soro das amostras. Em 130 neonatos foi determinada também a concentração sérica da apoliproteína B (apo-B).
As análises foram feitas num sistema auto-analisado Dimension AR® (Dade Behring, Newark, USA) utilizando-se kits de reagentes e protocolos do fabricante. As determinações séricas de colesterol total e triglicérides foram realizadas por meio de ensaios colorimétricos de ponto final, e para o HDL-C utilizou-se um método de precipitação com fosfotungstato de sódio+magnésio. As concentrações de LDL-C foram calculadas pela equação de Friedewald20, também utilizadas em neonatos21,22. Por sua vez, o ensaio para apo-B foi realizado por nefelometria em um equipamento Behring Nephelometer 100 Analiser? (Dade Behring, Newark, USA).
Análise estatística: Os dados foram transferidos para planilha eletrônica (Excel, versão 2000) e posteriormente analisados com os softwares SAS e SPSS, versão 8.0 e 10 respectivamente. As concentrações séricas das lipoproteínas foram expressas em médias e desvios-padrão.
As diferenças entre os grupos neonatos a termo e pré-termo, e os subgrupos AIG e PIG foram calculadas utilizando-se análise de variância para cada valor de concentração sérica, considerando distribuição gama (não normal), McCullagh & Nelder, 198923. O nível de significância estatística estabelecido foi p < 0,05.
RESULTADOS
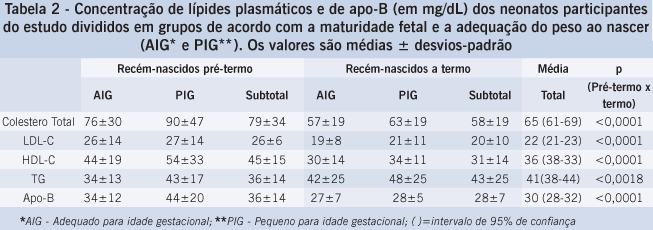
A tabela 2 mostra as concentrações séricas de colesterol total e frações, triglicérides e apo-B dos neonatos a termo e pré-termo, também ilustrados na Figura 1. Os valores de CT, LDL-C, HDL-C e apo-B foram maiores nos neonatos pré-termo do que nos neonatos a termo (p<0,0001). Inversamente, os valores de triglicérides foram menores nos neonatos pré-termo do que nos neonatos a termo (p < 0,0018).
Quanto às concentrações séricas de colesterol não houve diferenças quanto ao sexo, tanto entre os neonatos a termo (sexo masculino 70±28; sexo feminino 66±28, p>0,05) quanto entre os neonatos pré-termo (sexo masculino 80±43; sexo feminino 78±40, p>0,05).
A tabela 2 mostra os valores de lípides plasmáticos e apo-B em neonatos com peso adequado para a idade gestacional e pequeno para idade gestacional, nos grupos pré-termo e termo. O peso ao nascer não influenciou os valores de colesterol total, colesterol de LDL e HDL, de triglicérides e de apo-B, tanto entre os neonatos a termo quanto entre os neonatos pré-termo.
DISCUSSÃO
Neste estudo documentou-se o perfil lipídico e a concentração sérica de apo-B em sangue de cordão de neonatos de uma cidade do sul do Brasil.
Os valores de colesterol total, de LDL-C e de HDL-C encontrados foram semelhantes aos descritos por outros pesquisadores em diferentes populações de neonatos, do Chile24, Europa25,26, América do Norte e Canadá27-29, África30 e Japão31. Entretanto, Juarez e cols.21 descreveram valores de lipoproteínas em neonatos mexicanos mais elevados do que aqueles mostrados nesse estudo, bem como dos daqueles citados, constituindo-se uma exceção. Essa discrepância pode ser devido a uma particularidade da população deste país, já que os nossos valores estão de acordo com a maioria dos outros estudos descritos. Os valores de triglicérides obtidos, que refletem principalmente a concentração sérica das partículas de VLDL (very low density lipoprotein), também foram semelhantes aos encontrados por outros autores14,26. É importante mencionar que a composição lipídica do sangue do cordão umbilical, colhido imediatamente após o nascimento, corresponde exatamente à do sangue colhido de veia periférica19. Esse procedimento evita o traumatismo da punção venosa nos neonatos.
As concentrações séricas de colesterol total e frações e triglicérides, obtidas nos neonatos deste estudo, foram acentuadamente baixas, quando comparadas aos valores de referência para crianças na idade escolar32 e adotados no Brasil pela Sociedade Brasileira de Cardiologia. É descrito na literatura que os níveis séricos do perfil lipídico aumentam drasticamente durante a primeira semana de vida, quando se inicia o aleitamento, até os 6 meses de idade14. Dessa forma, os valores médios de colesterol total aumentam de 70 mg/dL para 150 mg/dL, os de LDL-C de 30 mg/dL para 100 mg/dL e os de triglicérides de 32 mg/dL para 58 mg/dL26. Após o primeiro ano de vida, esses valores aumentam lentamente e, por volta dos dois anos de idade, alcançam valores próximos aos observados em adolescentes e adultos33. Por esse motivo, os neonatos apresentam um perfil lipídico peculiar, quando comparados com lactentes, crianças ou adolescentes.
Neste estudo também mostrou-se que a proporção de LDL-C para HDL-C nos neonatos a termo foi de 0,6, idêntica à dos neonatos pré-termo (0,6). Dessa forma, do colesterol total dos neonatos, apenas 34% correspondem à fração LDL-C e mais da metade (56%) corresponde ao colesterol presente na fração HDL-C. É interessante observar, pelos valores de referência internacionais32 para crianças maiores de dois anos de idade e adolescentes, que a razão LDL-C/HDL-C é 1,7, muito diferente dos neonatos, bem como o colesterol da fração LDL-C, que é aproximadamente o dobro (70%)33. No Brasil, nos dois estudos com crianças a partir de 6 anos de idade a razão LDL-C/HDL-C foi mais elevada 1,8 em Bento Gonçalves (RS) e 2,1 em Campinas (SP), assim como a freqüência de valores indesajáveis de colesterol total (>180mg/dL) 30% e 35% respectivamente34,35. Com esses resultados observamos que a partir dos dois anos de idade ocorre uma inversão das frações de colesterol séricos LDL-C e HDL-C, em relação ao período neonatal, destacando ainda mais este período dos demais. Essa inversão parece ser mais acentuada nas crianças brasileiras, provavelmente porque os eventos aterogênicos dessa população iniciam na infância.
A dosagem de apo-B em neonatos a termo e pré-termo, também foi muito baixa, quando comparada com valores de referência para crianças maiores de dois anos. A tendência de sua concentração ser mais baixa na população estudada acompanhou os baixos níveis da fração LDL-C na circulação e a relação LDL-C/apo-B nos neonatos a termo e pré termo foi 0,7, semelhantes com as descrições da literatura28,29,36. Isso ocorreu possivelmente porque a concentração sérica de apo-B está relacionada principalmente com a concentração de partículas de LDL, apesar de essa determinação incluir também outras classes de lipoproteínas que contêm apo-B, como as VLDL, as IDL (intermediate-density lipoprotein), e Lp(a) (lipoprotein a).
Neste estudo não separamos os neonatos quanto ao sexo, porque não encontramos diferenças nos valores de colesterol total e frações e de triglicérides entre os grupos masculino e feminino, resultados que estão em conformidade com os achados da literatura30. Tampouco não separamos os neonatos quanto à raça, porque não só, de acordo com Glueck e cols.27, esse fator não influencia o perfil lipídico mas também pela notória miscigenação racial, característica da população brasileira.
Outro aspecto importante deste estudo refere-se ao perfil lipídico dos neonatos quanto à maturidade fetal. O colesterol total foi maior nos neonatos pré-termo em relação ao do a termo. Inversamente, os valores de triglicérides foram maiores nos a termo em relação aos pré-termo, observando-se uma tendência divergente nos valores de colesterol total e frações e triglicérides. Esta variação também foi registrada em outros trabalhos da literatura15,37 e é atribuída ao consumo de nutrientes, especialmente gordura, para a aceleração do crescimento fetal próximo ao nascimento17.
O fato de o neonato ser pequeno ou adequado para a idade gestacional não influenciou o perfil lipídico nesses resultados. Essa característica é polêmica na literatura, porque alguns trabalhos correlacionam a prematuridade e baixo peso ao nascer à maior incidência de doença arterial coronária nos adultos que, por sua vez, pode ter relação com o perfil lipídico ao nascimento38-40. Entretanto são hipóteses que necessitam de estudos mais controlados.
Esse estudo determinou as concentrações de lípides plasmáticos e de apo-B de neonatos de uma cidade do sul do Brasil e a influência da maturidade fetal e do peso ao nascer sobre esses parâmetros. Os valores de colesterol total, LDL-C, HDL-C, triglicérides e apo-B foram semelhantes aos de populações de neonatos de outros países; a maturidade fetal influenciou esses valores, mas o peso ao nascer não teve efeito nesses parâmetros. Apesar de escassos, os dados nacionais mostraram, em estudos anteriores, que a freqüência de colesterol indesejável nas crianças a partir dos 6 anos de idade é elevada. Dessa forma, conhecer os valores do perfíl lipídico no período neonatal adquire valor intrínseco do ponto de vista epidemiológico e fisiopatológico, amplia a compreensão de suas relações com as doenças cardiovasculares, bem como pode auxiliar no planejamento preventivo em fases mais precoces da vida.
Potencial Conflito de Interesses
Declaro não haver conflitos de interesses pertinentes.
Recebido em 10/03/05
Aceito em 24/03/06
- 1. Diet, Nutrition and prevention of chronic diseases, Geneva, World Health Organization/ FAO 2002.
-
22. Fundação Nacional da Saúde. Ministério da Saúde. www.funasa.gov.br e www.saude.gov.br
- 3. McGill H, McMahan A. Determinants of atherosclerosis in the young. Am J Cardiol. 1998; 82: 30-6.
- 4. Napoli C, Witzum JL, Calara F, et al. Maternal hypercholesterolemia enhances atherogenesis in normocholesterolemic rabbits, which is inhibited by antioxidant or lipid-lowering intervention during pregnancy. Circ Res. 2000; 87: 946-52.
- 5. Napoli C, Armiento FP, Mancini FP, et al. Fatty streak formation occurs in human fetal aortas and is greatly enhanced by maternal hypercholesterolemia. J Clin Invest. 1997; 100: 2680-90.
- 6. Palinski W, Napoli C. Fetal origin of atherosclerosis: maternal hypercholesterolemia, and cholesterol-lowering or antioxidant treatment during pregnancy influence in utero programming and postnatal susceptibility to atherogenesis. Faseb J. 2002; 16: 1348-60.
- 7. Barker DJP, Gluckman PD, Godfrey KM, et al. Fetal nutrition and cardiovascular disease in adult life. Lancet. 1993; 341: 938-41.
- 8. Barker DJP, Martyn CN, Osmond C. Growth in utero and serum cholesterol concentrations in adult life. BMJ. 1993; 307: 1524-7.
- 9. Curhan GC, Willet W, Rimm EB, et al. Prevention of cardiovascular disease: birth weight and adult hypertension, diabetes mellitus, and obesity in US men. Circulation. 1996; 94: 3246-50.
- 10. Ericksson JG, Forsen T, Tuomilehto J, et al. Early growth, adult income, and risk of stroke. Stroke. 2000; 31: 869-74.
- 11. Barker DJP, Forsen T, Uutela A, et al. Size at birth and resilience to effects of poor living conditions in adult life: longitudinal study. BMJ. 2001; 323: 1-5.
- 12. Barker DJP. Coronary heart disease: a disorder of growth. Horm Res. 2003; 59S1: 35-41.
- 13. Parker CRJ, Carr BR, Simpson ER, et al. Decline in the concentration of low-density lipoprotein-cholesterol in human fetal plasma near term. Metabolism. 1983; 32: 919-23.
- 14. Zee P. Lipid metabolism in the newborn. Pediatrics. 1968; 41: 640-5.
- 15. Lane DM, Mcconathy WJ. Factors affecting the lipid and apolipoprotein levels of cord sera. Pediatr Res. 1983; 17: 83-91.
- 16. Viikari JSA, Raitakari OT, Simell O. Nutritional influences on lipids and future atherosclerosis beginning prenatally and during childhood. Curr Opin Lipidol. 2002; 13: 11-8.
- 17. Herrera E. Lipid metabolism in pregnancy and its consequences in the fetus and newborn. Endocrine. 2002; 19: 43-55.
- 18. Alexander GR, Himes JH, Kaufman RB, et al. A United States national reference for fetal growth. Obstet Gyneco.l 1996; 87: 163-8.
- 19. Merzouk H, Bouchenak M M, Korso N, et al. Low birth weight at term impairs cord serum lipoprotein compositions and concentrations. Eur J Pediatr. 1998; 157: 321-6.
- 20. Friedewald WT, Levy RF, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem. 1972; 18: 499-502.
- 21. Juarez I E, Silva RG, Arangure JMM, et al. Perfil de lípidos en recién nacidos sanos y su correlación con los niveles de lípidos maternos. Salud Publica Mex. 1999; 41: 405-9.
- 22. Diaz M, Leal C, Ramon J, et al. Cord blood lipoprotein cholesterol: relationship birth weight and gestational age of newborns. Metabolism. 1989; 38: 435-8.
- 23. McCullagh P, Nelder JA. Generalized linear models. 2Ş ed. New York: Chapman and Hall. p.511.
- 24. Casanueva V, Cid X, Chiang MT, Molina S, et al. Serum lipids, lipoprotein and apolipoprotein levels in normal chilean newborns. Rev Med Chile. 1998; 126: 1073-8.
- 25. Biervliet JPV, Vercaemst R, Keersgieter W, et al. Evolution of lipoprotein patterns in newborns. Acta Paediatr Scand. 1980; 69: 593-6.
- 26. Ginsburg BE, Zetterstrom R. Serum cholesterol concentration in newborn infants with gestational ages of 28-42 weeks. Acta Paediatr Scand. 1980; 69: 587-92.
- 27. Glueck CJ, Heckman F, Schoenfeld M, et al. Neonatal familial type II hyperlipoproteinemia: cord blood cholesterol in 1800 birth. Metabolism. 1971; 20: 597-608.
- 28. Dolphin PJ, Breckenridge WC, Dolphin MA, Tan MH. The lipoprotein of human umbilical cord blood apolipoprotein and lipid levels. Atherosclerosis. 1984; 51: 109-22.
- 29. McConathy W, Lane DM. Studies on the apolipoproteins and liproteins of cord serum. Pediatr Res. 1980; 14: 757-61.
- 30. Boersma ER. Serum lipids in maternal/cord blood pairs from normal and low birthweight infants in Dar Es Salaam, Tanzania. Acta Pediatr Scand. 1980; 69: 747-51.
- 31. Nagasaka H, Chiba H, Kikuta H, et al. Unique character and metabolism of high density lipoprotein HDL in fetus. Atherosclerosis. 2002; 161: 215-23.
- 32. American Academy of Pediatrics National cholesterol education program: Report of the expert panel on blood cholesterol levels in children and adolescents. Pediatrics. 1992; 89: S495-584.
- 33. Brotons C, Ribera A, Perich RM, et al. Worldwide distribution of blood lipids and lipoproteins in childhood and adolescence. Atherosclerosis. 1998, 139: 1-9.
- 34. Gerber ZRS, Zielinsky P. Fatores de risco de aterosclerose na infância. Um estudo epidemiológico. Arq Bras Cardiol. 1997; 69: 231-36.
- 35. Moura EC, Castro CM, Mellin AS, Figueiredo DB. Perfíl lipídico em escolares de Campinas. Rev Saúde Pública. 2000; 34: 499-505.
- 36. Muniz SFJ, Batisda S, Perea S, et al. Low density lipoprotein in neonates with high cord serum cholesterol levels. Acta Paediatr. 1997; 86: 414-8.
- 37. Radunovic N, Kuczynski E, Rosen T, et al. Plasma apolipoprotein A-I and B concentrations in growth retarded fetuses: a link between low birth weight and adult atherosclerosis. J Clin Endocrinol Metab. 2000; 85:85-8.
- 38. Leeson CPM, Kattenhorn M, Morley R, et al. Impact of low birth weight and cardiovascular risk factor on endothelial function in early adult life. Circulation. 2001; 103:1264-8.
- 39. Norman M, Martin K. Preterm birth attenuates association between low birth weight and endothelial dysfunction. Circulation. 2003; 108: 996-1001.
- 40. Jones JN, Taylor CG, Taylor DD. Altered cord serum lipid levels associated with small for gestational age infants. Obstet Gynecol. 1999; 93: 527-31.
Datas de Publicação
-
Publicação nesta coleção
26 Jun 2006 -
Data do Fascículo
Jun 2006
Histórico
-
Recebido
10 Mar 2005 -
Aceito
24 Mar 2006