Resumos
FUNDAMENTO: Pacientes com síndrome metabólica (SM) têm alto risco coronariano e a disfunção da célula beta ou resistência à insulina pode prever um risco adicional de eventos cardiovasculares precoces. OBJETIVO: Avaliar as alterações glicometabólicas precoces em pacientes com SM, mas sem diagnóstico de diabete tipo 2, após síndrome coronariana aguda. MÉTODOS: Um total de 114 pacientes foi submetido ao teste oral de tolerância à glicose (TOTG), 1-3 dias da alta hospitalar, após infarto agudo do miocárdio ou angina instável. Baseado no TOTG, definimos três grupos de pacientes: tolerância normal à glicose (TNG; n=26), tolerância alterada à glicose (TAG; n=39) ou diabetes mellitus (DM; n=49). O Modelo de Avaliação da Homeostase (HOMA-IR) foi usado para estimar a resistência à insulina; a responsividade da célula beta foi avaliada através do índice insulinogênico de 30 minutos (ΔI30/ΔG30). RESULTADOS: Baseado no HOMA-IR, os pacientes com DM eram mais insulino-resistentes do que aqueles com TNG ou TAG (p<0,001). De acordo com o índice insulinogênico, a responsividade da célula beta também estava alterada em indivíduos com DM (p<0,001 vs TNG ou TAG). CONCLUSÃO: Altas taxas de alterações glicometabólicas foram encontradas após síndrome coronariana aguda em pacientes com SM. Como essas anormalidades acentuadamente aumentam o risco de desfechos adversos, o TOTG precoce pode ser utilizado em pacientes com SM para identificar aqueles que apresentam maior risco coronariano.
Resistência à insulina; síndrome metabólica; síndrome coronariana aguda; diabetes mellitus tipo 2; células secretoras de insulina
FUNDAMENTO: Pacientes con síndrome metabólico (SM) tienen alto riesgo coronario y la disfunción de la célula beta o la resistencia a la insulina puede prever un riesgo adicional de eventos cardiovasculares precoces. OBJETIVO: Evaluar las alteraciones glucometabólicas precoces en pacientes con SM, pero sin diagnóstico de diabetes tipo 2, tras el síndrome coronario agudo. MÉTODOS: Un total de 114 pacientes fue sometido a la prueba oral de tolerancia a la glucosa (POTG), de un a tres días tras el alta hospitalaria, y luego de infarto agudo de miocardio o angina inestable. Basado en el POTG, definimos tres grupos de pacientes: tolerancia normal a la glucosa (TNG; n=26), tolerancia alterada a la glucosa (TAG; n=39) o diabetes mellitus (DM; n=49). Se utilizó el Modelo de Evaluación de la Homeostasis (HOMA-IR) para estimarse la resistencia a la insulina; se evaluó la responsividad de la célula beta a través del índice insulinogénico de 30 minutos (ΔI30/ΔG30). RESULTADOS: Basado en el HOMA-IR, los pacientes con DM se mostraban más insulinoresistentes que los individuos con TNG o TAG (p<0,001). De acuerdo con el índice insulinogénico, la responsividad de la célula beta también estaba alterada en individuos con DM (p<0,001 vs. TNG o TAG). CONCLUSIONES: Se encontraron altas tasas de alteraciones glucometabólicas tras el síndrome coronario agudo en pacientes con SM. Como esas anormalidades incrementan acentuadamente el riesgo de desenlaces adversos, el POTG precoz se puede utilizar en pacientes con SM para identificar a los que presentan mayor riesgo coronario.
Resistencia a la insulina; síndrome metabólico; síndrome coronario agudo; diabetes mellitus tipo 2; células secretoras de insulina
BACKGROUND: Patients with metabolic syndrome (MetS) are at high coronary risk and beta-cell dysfunction or insulin resistance might predict an additional risk for early cardiovascular events. OBJECTIVE: This study aimed to evaluate early glucometabolic alterations in patients with MetS, but without previously known type 2 diabetes, after acute coronary syndrome. METHODS: A total of 114 patients were submitted to an oral glucose tolerance test (OGTT) 1-3 days after hospital discharge due to myocardial infarction or unstable angina. Based on the OGTT, we defined three groups of patients: normal glucose tolerance (NGT; n=26), impaired glucose tolerance (IGT; n=39), or diabetes (DM; n=49). The homeostasis model assessment (HOMA-IR) was used to measure insulin resistance; beta-cell responsiveness was assessed by the insulinogenic index at 30 min (ΔI30/ΔG30). RESULTS: Based on the HOMA-IR, patients with DM were more insulin-resistant than those with NGT or IGT (p<0.001). According to the insulinogenic index, the beta-cell responsiveness was also impaired in subjects with DM (p<0.001 vs NGT or IGT). CONCLUSION: High rates of glucometabolic alterations were found after acute coronary syndrome in patients with MetS. As these abnormalities markedly increase the risk for adverse outcomes, early OGTT among MetS patients might be used to identify those at the highest coronary risk.
Insulin resistance; metabolic syndrome; acute coronary syndrome; diabetes mellitus, type 2; insulin-secreting cells
ARTIGO ORIGINAL
CORONARIOPATIA AGUDA
Perfil glicometabólico inicial em pacientes com síndrome coronariana aguda e síndrome metabólica
Carlos M. C. Monteiro; Luciene Oliveira; Maria C. O. Izar; Tatiana Helfenstein; Andreza O. Santos; Simone M. Fischer; Sahana W. Barros; Luiz F. M. Pinheiro; Antonio C. C. Carvalho; Francisco A. H. Fonseca
Universidade Federal de São Paulo, São Paulo, SP - Brasil
Correspondência Correspondência: Francisco Antônio Helfenstein Fonseca Rua Pedro de Toledo, 276 - V. Clementino 04039-001 - São Paulo, SP - Brasil E-mail: fahfonseca@terra.com.br, ffonseca@cardiol.br
RESUMO
FUNDAMENTO: Pacientes com síndrome metabólica (SM) têm alto risco coronariano e a disfunção da célula beta ou resistência à insulina pode prever um risco adicional de eventos cardiovasculares precoces.
OBJETIVO: Avaliar as alterações glicometabólicas precoces em pacientes com SM, mas sem diagnóstico de diabete tipo 2, após síndrome coronariana aguda.
MÉTODOS: Um total de 114 pacientes foi submetido ao teste oral de tolerância à glicose (TOTG), 1-3 dias da alta hospitalar, após infarto agudo do miocárdio ou angina instável. Baseado no TOTG, definimos três grupos de pacientes: tolerância normal à glicose (TNG; n=26), tolerância alterada à glicose (TAG; n=39) ou diabetes mellitus (DM; n=49). O Modelo de Avaliação da Homeostase (HOMA-IR) foi usado para estimar a resistência à insulina; a responsividade da célula beta foi avaliada através do índice insulinogênico de 30 minutos (ΔI30/ΔG30).
RESULTADOS: Baseado no HOMA-IR, os pacientes com DM eram mais insulino-resistentes do que aqueles com TNG ou TAG (p<0,001). De acordo com o índice insulinogênico, a responsividade da célula beta também estava alterada em indivíduos com DM (p<0,001 vs TNG ou TAG).
CONCLUSÃO: Altas taxas de alterações glicometabólicas foram encontradas após síndrome coronariana aguda em pacientes com SM. Como essas anormalidades acentuadamente aumentam o risco de desfechos adversos, o TOTG precoce pode ser utilizado em pacientes com SM para identificar aqueles que apresentam maior risco coronariano.
Palavras-chave: Resistência à insulina, síndrome metabólica, síndrome coronariana aguda, diabetes mellitus tipo 2, células secretoras de insulina.
Introdução
Recentemente, têm se estabelecido relações entre anormalidades glicometabólicas e doença arterial coronariana1,2. Anormalidades da glicose observadas durante a fase aguda das síndromes coronarianas (SCA) aumentam o risco de desfechos adversos3,4. Além disso, os pacientes com diagnóstico de diabetes mellitus (DM) e infarto do miocárdio prévio apresentam o maior risco de mortalidade cardiovascular5.
Vários estudos têm reconhecido que a síndrome metabólica (SM) é um fator de risco adicional para eventos cardiovasculares, especialmente entre os pacientes com diagnóstico de DM6-8. Todos esses aspectos sugerem a necessidade de uma identificação precoce de pacientes com diabetes oculta ou aqueles com anormalidades glicometabólicas. De fato, para esses pacientes, um tratamento mais agressivo, incluindo mudanças no estilo de vida e a aquisição precoce de alvos lipídicos e pressóricos podem contribuir para desfechos mais favoráveis9,10.
Dessa forma, o objetivo desse estudo é comparar o perfil glicometabólico, baseado nas respostas iniciais ao TOTG, em pacientes com SM e síndrome coronariana aguda (SCA) recente.
Métodos
A seleção dos pacientes da Universidade Federal de São Paulo foi realizada segundo os seguintes critérios de inclusão: hospitalização recente devido a SCA (infarto agudo do miocárdio ou angina instável), sem diagnóstico prévio de diabetes mellitus, idade entre 30-75 anos, SM diagnosticada de acordo com as diretrizes revisadas do National Cholesterol Education Program/Adult Treatment Panel (NCEP/ATP III)11, e condições hemodinâmicas estáveis nos primeiros 1-3 dias após a alta hospitalar. Os critérios de exclusão foram: pacientes em uso de terapia hipolipidêmica nos últimos 30 dias ou que apresentavam LDL-C > 130 mg/dl na admissão hospitalar. Um total de 114 participantes de ambos os sexos foram selecionados e o termo de consentimento informado foi obtido de todos os pacientes. Este estudo foi aprovado pelo Comitê de Ética da nossa instituição.
Níveis plasmáticos de lípides foram obtidos em jejum (colesterol, HDL-C, triglicérides) e determinados através de um kit padrão; o LDL-C foi estimado através da fórmula de Friedewald, e apolipoproteínas A1 e B foram determinadas através de nefelometria. O teste oral de tolerância à glicose (TOTG, 75 g de glicose em 200 ml de água) foi aplicado 1-3 dias após a alta hospitalar, após três dias de aconselhamento nutricional baseado nas diretrizes do NCEP/ATP III e consumo apropriado e não-restritivo de carboidratos. O modelo de avaliação da homeostase da resistência à insulina (HOMA-IR) foi calculado como insulina (mU/l) X (glicose [mg/dl] X 0,055)/22,512. Para este cálculo, utilizamos a média de três amostras consecutivas de insulina de jejum. O índice insulinogênico foi calculado como a diferença entre os valores de insulina plasmática no TOTG nos tempos 30' e 0', dividida pela diferença entre os valores de glicose plasmática correspondentes (ΔI30/ΔG30). A área sob a curva (AUC) para a glicose e a insulina foi determinada com base nas amostras de sangue obtidas antes (t=0) e 30, 60, 90, e 120 minutos após a carga oral de glicose. A adiponectina foi medida através do método ELISA (enzyme-linked immunosorbent assay) utilizando-se um kit comercial (Human Adiponectin/Acrp30 Immunoassay - Quantiquine, R&D Systems). A hemoglobina glicada (HbA1c) foi medida através de cromatografia líquida de alta resolução.
A gravidade da aterosclerose coronariana foi avaliada através do escore de Gensini, o qual depende do grau de estreitamento do lúmen e a importância do local da estenose coronariana13. O escore avalia a gravidade e os efeitos de múltiplas obstruções, qualidade das artérias coronarianas e a influência dos vasos colaterais.
Para determinar as diferenças entre os três grupos formados após o TOTG (TNG, TAG e DM), as variáveis contínuas foram comparadas através de análise de variância (ANOVA). Quando necessário, os valores foram log-transformados. As variáveis categóricas foram comparadas através de Testes Qui-quadrado. Todos os testes foram bicaudais e um valor de p <0,05 foi definido como sendo estatisticamente significante. A análise estatística foi feita utilizando-se o programa SPSS 11.5 para Windows.
Resultados
As principais características da população estudada são mostradas na Tabela 1. Um a três dias após a alta hospitalar, apenas 23% (n=26) dos pacientes apresentava TNG, enquanto 34% (n=39) apresentavam TAG e 43% (n=49) foram classificados como tendo DM. O tratamento médico e os procedimentos intra-hospitalares foram similares entre os grupos. Os indivíduos com TNG, TAG e DM foram também comparados em relação à distribuição de idade e sexo, mas valores mais altos de índice de massa corpórea (IMC) foram encontrados entre indivíduos com DM (p=0,036 vs TNG), sem diferenças em relação à circunferência da cintura. A extensão e gravidade da doença arterial coronariana, avaliadas pelo escore de Gensini, não apresentaram diferenças entre os grupos. Os valores de lípides e apolipoproteínas foram similares entre os grupos. Os níveis plasmáticos de glicose em jejum foram mais altos nos indivíduos com DM, bem como os níveis 120 minutos após a carga oral de glicose (p<0,001 vs TNG e TAG). Os níveis plasmáticos de insulina de jejum também foram mais altos em indivíduos com DM (p<0,001 vs TNG e p<0,004 vs TAG).
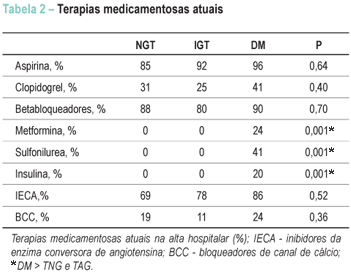
As terapias medicamentosas na alta hospitalar são mostradas na Tabela 2. As únicas diferenças foram as taxas mais altas de medicamentos hipoglicemiantes em indivíduos com DM.
O HOMA-IR foi mais alto em indivíduos com DM (p<0,001 vs TAG e TNG), bem como o índice insulinogênico (p<0,001 vs TNG e TAG) [Figura 1]. Os níveis de adiponectina plasmática não diferiram entre os grupos.
A figura 2 mostra a AUC para glicose e insulina. Os pacientes com DM apresentaram valores mais altos de glicose AUC (p<0,001 vs TNG e TAG). Os valores de insulina AUC também foram mais altos em indivíduos com DM (p<0,017 vs TNG, p<0,001 vs TAG).
Discussão
Em anos recentes, a síndrome metabólica (SM) tem sido relatada em pacientes com síndrome coronariana aguda (SCA)6,14. Este estudo mostra, pela primeira vez, as grandes anormalidades glicometabólicas em pacientes com SM, mas sem diagnóstico de diabete tipo 2, na fase aguda das síndromes coronarianas.
Baseado nas respostas ao TOTG aplicado 1-3 dias após a alta hospitalar, nós observamos altas taxas de TAG (34%) e DM (43%). Com base no HOMA-IR, os pacientes com DM foram mais insulino-resistentes do que aqueles com TNG ou TAG. Além disso, de acordo com o índice insulinogênico (ΔI30/ΔG30), a responsividade das células beta também estava alterada em indivíduos com DM, quando comparados com indivíduos TNG ou TAG.
Mesmo considerando que a SCA é uma situação de estresse que pode explicar a alta taxa de alterações glicometabólicas em indivíduos com SM, essas anormalidades estão associadas com desfechos adversos. Feinberg e cols.5 relatou, em 1.060 pacientes consecutivos sem diagnóstico prévio de diabetes mellitus, que a SM é um preditor independente de mortalidade de 30 dias e de 1 ano. Entretanto, esses autores também observaram que, entre esses pacientes, aqueles que apresentavam glicemia > 140 mg/dl também apresentavam o risco mais alto de mortalidade.
Em nosso estudo, observamos que a resistência à insulina era mais freqüente em pacientes sem diagnóstico prévio de DM. A associação independente de resistência à insulina e doença coronariana ainda é controversa. Tenenbaum e cols.15 avaliaram o valor preditivo de HOMA-IR para novos eventos cardiovasculares maiores em 2.938 indivíduos com doença coronariana pré-existente. Após análise multivariada, eles concluíram que a resistência à insulina é um fator de risco independente para eventos cardiovasculares e diabetes de início recente15. No Estudo Multiétnico de Aterosclerose (MESA)2, a aterosclerose subclínica foi avaliada em 5.810 participantes sem diabete, e o HOMA-IR foi associado com a aterosclerose subclínica, embora a associação não tenha sido independente após o ajuste para componentes não-glicosídeos da SM.
Foi também observado em nosso estudo que os indivíduos com DM apresentavam menor responsividade das células beta. Utilizamos o índice insulinogênico para estimar a função das células beta. Em estudos comparativos para avaliação da secreção insulínica, este índice foi considerado intimamente relacionado com a secreção de insulina16. Além disso, como parte de nossos pacientes com DM estivessem utilizando medicamentos hipoglicemiantes na alta hospitalar, este método parece ser mais sensível, já que ele realmente avalia a resposta precoce da insulina ao estímulo da administração oral de glicose.
A deficiência de insulina e a resistência à insulina podem ser associadas com disfunção endotelial, já que as vias de sinalização da insulina incluem a produção de óxido nítrico (NO) e a secreção de endotelina-1. Em pacientes com SM, os estímulos inflamatórios podem ocasionar um desequilíbrio adicional entre a produção de NO e a secreção de endotelina-1, levando a uma redução do fluxo sanguíneo e alteração na captação de glicose no músculo periférico17. Além disso, a disfunção endotelial também tem sido relacionada ao desenvolvimento de aterosclerose e eventos cardiovasculares18,19.
Em nosso estudo, os procedimentos intra-hospitalares (revascularização do miocárdio, intervenção percutânea) e a extensão da doença coronariana avaliada pelo escore de Gensini foram similares entre os grupos estudados. Entretanto, nosso estudo não tinha o poder de detectar diferenças significantes referentes ao impacto da aterosclerose ou eventos cardíacos. Entretanto, Boulon e cols.20, avaliando o impacto da SM durante o acompanhamento de 480 pacientes consecutivos com SCA, relatou um aumento na mortalidade total no grupo com SM, quando comparado com o grupo sem SM20. No estudo de Avaliação da Síndrome de Isquemia em Mulheres (WISE), a angiografia coronariana foi obtida em 755 mulheres devido a suspeita de isquemia miocárdica. Comparadas a mulheres com estado metabólico normal, as que apresentavam SM tinham uma taxa de sobrevivência de 4 anos mais baixa e de sobrevivência livre de eventos (morte, infarto do miocárdio não-fatal, AVC ou insuficiência cardíaca congestiva) e quando estratificadas pela presença de doença coronariana significante na angiografia, as mulheres com SM também apresentavam maior risco de eventos cardiovasculares21.
Recentemente, estudos que objetivaram a avaliação de prognóstico a longo prazo de TAG ou DM de diagnóstico recente após infarto do miocárdio identificaram essas anormalidades glicometabólicas após o TOTG como os mais importantes preditores de morte e eventos cardiovasculares maiores22-24.
Além disso, o Euro Heart Survey mostrou que 20-30% dos pacientes com síndrome coronariana aguda ou doença arterial coronariana crônica apresentavam intolerância à glicose ou diabetes de diagnóstico recente e o TOTG foi considerado o método mais apropriado para a avaliação clínica do estado glicometabólico nesses pacientes25. Finalmente, o Munich Myocardial Infarction Registry mostrou a relevância do diagnóstico intra-hospitalar do diabetes mellitus a fim de estabelecer precocemente estratégias para reduzir a mortalidade cardiovascular26, o que é endossado pelos American College of Cardiology/American Heart Association e pelo American Diabetes Association/American College of Endocrinology para o controle glicêmico em pacientes com síndrome coronariana aguda como uma recomendação de Classe IIa27.
Em conclusão, esse estudo descreve altas taxas de alterações do metabolismo glicêmico, incluindo resistência à insulina e disfunção das células beta em indivíduos com SM na fase aguda de síndromes coronarianas. O estudo consolida a idéia de que um TOTG precoce pode identificar os indivíduos com DM ou TAG, dando a oportunidade para um tratamento mais apropriado e a obtenção dos objetivos em termos de níveis lipídicos, pressão arterial e metabolismo glicêmico, a fim de melhorar os resultados nessa população de alto risco.
Agradecimentos
Esse estudo recebeu apoio financeiro da FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo). Dr. Monteiro é bolsista do CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico).
Potencial Conflito de Interesses
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo foi financiado por FAPESP e CAPES.
Vinculação Acadêmica
Este artigo é parte de tese de Doutorado de Carlos Manoel de Castro Monteiro pela UNIFESP.
Artigo recebido em 20/02/08; revisado recebido em 10/03/08; aceito em 17/03/08.
- 1. Coutinho M, Gerstein HC, Wang Y, Yusuf S. The relationship between glucose and incident cardiovascular events: a meta-regression analysis of published data from 20 studies of 95,783 individuals followed for 12.4 years. Diabetes Care. 1999; 22: 233-40.
- 2. Bertoni AG, Wong ND, Shea S, Ma S, Liu K, Preethi S, et al. Insulin resistance, metabolic syndrome, and subclinical atherosclerosis: the multi-ethnic study of atherosclerosis (MESA). Diabetes Care. 2007; 30: 2951-6.
- 3. Hashimoto K, Ikewaki K, Yagi H, Nagasawa H, Imamoto S, Shibata T. Glucose intolerance is common in japanese patients with acute coronary syndrome who were not previously diagnosed with diabetes. Diabetes Care. 2005; 28: 1182-6.
- 4. Wallander M, Bartnik M, Efendic S, Hamsten A, Malmberg K, Ohrvik J, et al. Beta cell dysfunction in patients with acute myocardial infarction but without previously known type 2 diabetes: a report from the GAMI study. Diabetologia. 2005; 48: 2229-35.
- 5. Feinberg MS, Schwartz R, Tanne D, Fisman EZ, Hod H, Zahger D, et al. Impact of the metabolic syndrome on the clinical outcomes of non-clinically diagnosed diabetic patients with acute coronary syndrome. Am J Cardiol. 2007; 99: 667-72.
- 6. Zeller M, Steg PG, Ravisy J, Laurent Y, Janin-Manificat L, L'Huillier I, et al. Prevalence and impact of MS on hospital outcomes in acute myocardial infarction. Arch Intern Med. 2005; 165: 1192-8.
- 7. Levantesi G, Macchia A, Marfisi RM, Franzoni MG, Maggioni AP, Nicolosi L, et al. Metabolic syndrome and risk of cardiovascular events after myocardial infarction. J Am Coll Cardiol. 2005; 46: 277-83.
- 8. Shaw JE, Hodge AM, de Courten M, Chitson P, Zimmet PZ. Isolated post-challenge hyperglycaemia confirmed as risk factor for mortality. Diabetologia. 1999; 42: 1050-4.
- 9. Shepherd J, Barter P, Carmena R, Deedwania P, Fruchart JC, Hoffner S, et al. Effect of lowering LDL cholesterol substantially below currently recommended levels in patients with coronary heart disease and diabetes: the Treating to New Targets (TNT) study. Diabetes Care. 2006; 29: 1220-6.
- 10. Julius S, Kjeldsen SE, Weber M, Brunner HR, Ekman S, Hanson L, et al. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet. 2004; 363: 2022-31.
- 11. Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute scientific statement. Circulation. 2005; 112: 2735-52.
- 12. Matthews DR, Hosker JP, Rudenski AS, Burnett MA, Darling P, Bown EG, et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985; 28: 412-9.
- 13. Gensini GG. A more meaningful scoring system for determining the severity of coronary heart disease. Am J Cardiol. 1983; 51: 606.
- 14. Clavijo LC, Pinto TL, Kuchulakanti PK, Tenenbaum H, Fisman EZ, Tanne D, et al. Metabolic syndrome in patients with acute myocardial infarction is associated with increased infarct size and in-hospital complications. Cardiovasc Revasc Med. 2006; 7: 7-11.
- 15. Tenenbaum A, Adler Y, Boyko V, Sakai M, Nagata I, Doi K, et al. Insulin resistance is associated with increased risk of major cardiovascular events in patients with preexisting coronary artery disease. Am Heart J. 2007; 153: 559-65.
- 16. Taniguchi A, Nagasaka S, Fukushima M, Sakai M, Nagata I, Doi K, et al. Assessment of insulin sensitivity and insulin secretion from the oral glucose tolerance test in nonobese Japanese type 2 diabetic patients: comparison with minimal-model approach. Diabetes Care. 2000; 23: 1439-40.
- 17. Kim JA, Montagnani M, Koh KK, Quon MJ. Reciprocal relationships between insulin resistance and endothelial dysfunction: molecular and pathophysiological mechanisms. Circulation. 2006; 113: 1888-904.
- 18. Gokce N, Keaney JF Jr, Hunter LM, Watkins MT, Nedeljkovic ZC, Menzoiam JO, et al. Predictive value of noninvasively determined endothelial dysfunction for long-term cardiovascular events in patients with peripheral vascular disease. J Am Coll Cardiol. 2003; 41: 1769-75.
- 19. Huang PH, Chen JW, Lu TM, Yu-An Ding P, Lin SJ. Combined use of endothelial function assessed by brachial ultrasound and high-sensitive C-reactive protein in predicting cardiovascular events. Clin Cardiol. 2007; 30: 135-40.
- 20. Boulon C, Lafitte M, Richeboeuf V, Paviot B, Pradeou V, Coste P, et al. Prevalence of metabolic syndrome after acute coronary syndrome and its prognostic significance. Am J Cardiol. 2006; 98: 1429-34.
- 21. Marroquin OC, Kip KE, Kelley DE, Johnson BD, Shaw LJ, Bairey Merz CN, et al. Metabolic syndrome modifies the cardiovascular risk associated with angiographic coronary artery disease in women. A report from the Women's Ischemia Syndrome Evaluation. Circulation. 2004; 109: 714-21.
- 22. Bartnik M, Malmberg K, Norhammar A, Tenerz A, Ohrvik J, Rydén L. Newly detected abnormal glucose tolerance: an important predictor of long-term outcome after myocardial infarction. Eur Heart J. 2004; 25: 1990-7.
- 23. Tamita K, Katayama M, Takagi T, Akasaka I, Yamamura A, Kajis S, et al. Impact of newly diagnosed abnormal glucose tolerance on long-term prognosis in patients with acute myocardial infarction. Circ J. 2007; 71: 834-41.
- 24. Barr ELM, Zimmet PZ, Welborn TA, Jolley D, Magliano DJ, Dunstan DW, et al. Risk of cardiovascular and all-cause mortality in individuals with diabetes mellitus, impaired fasting glucose, and impaired glucose tolerance. The Australian Diabetes, Obesity, and Lifestyle Study (AusDiab). Circulation. 2007; 116: 151-7.
- 25. Bartinik M, Rydén L, Maimberg K, Ohrvik J, Pyöralä K, Standl E, et al. Oral glucose tolerance test is needed for appropriate classification of glucose regulation in patients with coronary artery disease: a report from the Euro Heart Survey on Diabetes and the Heart. Heart. 2007; 93: 72-7.
- 26. Schnell O. The links between diabetes and cardiovascular disease. J Intervent Cardiol. 2005; 18: 413-6.
- 27. Nesto RW, Lago RM. Glucose: a biomarker in acute myocardial infarction ready for prime time? Circulation. 2008; 117: 990-2.
Datas de Publicação
-
Publicação nesta coleção
06 Abr 2009 -
Data do Fascículo
Fev 2009
Histórico
-
Aceito
17 Mar 2008 -
Revisado
10 Mar 2008 -
Recebido
20 Fev 2008