Resumos
FUNDAMENTO: A embolia pulmonar apresenta alta mortalidade em pacientes com hipotensão arterial ou choque circulatório. Entretanto, em pacientes hemodinamicamente estáveis, a associação de algumas variáveis clínicas com a mortalidade ainda não está claramente estabelecida. OBJETIVOS: Derivar um modelo de estratificação do risco de mortalidade intra-hospitalar em pacientes com embolia pulmonar hemodinamicamente estáveis. MÉTODOS: Estudo de coorte multicêntrico prospectivo de 582 pacientes consecutivos que foram admitidos em unidades de emergência ou de terapia intensiva, com suspeita clínica de embolia pulmonar, e que tiveram o diagnóstico confirmado por meio de um ou mais dos seguintes exames: arteriografia pulmonar, angiotomografia computadorizada helicoidal, angioressonância magnética, ecodopplercardiograma, cintilografia pulmonar ou duplex-scan venoso. Os dados sobre características demográficas, comorbidades e manifestações clínicas foram coletados e incluídos em uma análise de regressão logística para compor o modelo de predição. RESULTADOS: A mortalidade global foi de 14,1%. Foram identificadas como variáveis independentes de risco de óbito: idade > 65 anos; repouso no leito > 72h; cor pulmonale crônico; taquicardia sinusal e taquipnéia. Após a estratificação por faixas de risco, observaram-se mortalidades de 5,4%, 17,8% e 31,3%, respectivamente nos subgrupos de baixo, moderado e alto riscos. O modelo mostrou sensibilidade de 65,5% e especificidade de 80%, com uma área sob a curva de 0,77. CONCLUSÃO: Em pacientes hemodinamicamente estáveis com embolia pulmonar, a idade > 65 anos, o repouso no leito > 72h, o cor pulmonale crônico, a taquicardia sinusal e a taquipnéia foram preditores independentes da mortalidade intra-hospitalar. Entretanto o modelo de predição necessita ser validado em outras populações para sua incorporação à prática clínica.
Mortalidade hospitalar; embolia pulmonar; doença cardiopulmonar; taquicardia sinusal
BACKGROUND: Pulmonary embolism is associated with high mortality in patients with hypotension or circulatory shock. However, the association between some clinical variables and mortality is still unclear in hemodynamically stable patients. OBJECTIVES: To derive an in-hospital mortality risk stratification model in hemodynamically stable patients with pulmonary embolism. METHODS: This is a prospective multicenter cohort study of 582 consecutive patients admitted in emergency units or intensive care units with clinically suspected pulmonary embolism and whose diagnosis was confirmed by one or more of the following tests: pulmonary arteriography, spiral CT angiography, magnetic resonance angiography, Doppler echocardiography, pulmonary scintigraphy, or venous duplex scan. Data on demographics, comorbidities and clinical manifestations were collected and included in a logistic regression analysis so as to build the prediction model. RESULTS: Overall mortality was 14.1%. The following parameters were identified as independent death risk variables: age > 65 years, bed rest > 72h, chronic cor pulmonale, sinus tachycardia, and tachypnea. After risk stratification, mortalities of 5.4%, 17.8%, and 31.3% were found in the low, moderate and high-risk subgroups, respectively. The model showed 65.5% sensitivity and 80% specificity, with a 0.77 area under the curve. CONCLUSION: In hemodynamically stable patients with pulmonary embolism, age > 65 years, bed rest > 72h, chronic cor pulmonale, sinus tachycardia and tachypnea were independent predictors of in-hospital mortality. However, further validation of the prediction model in other populations is required so that it can be incorporated into the clinical practice.
Hospital mortality; pulmonary embolism; pulmonary heart disease; tachycardia; sinus
FUNDAMENTO: La embolia pulmonar presenta alta mortalidad en pacientes con hipotensisn arterial o shock circulatorio. Sin embargo, en pacientes hemodinamicamente estables, la asociacisn de algunas variables clmnicas con la mortalidad todavma no esta claramente establecida. OBJETIVO: Derivar un modelo de estratificacisn del riesgo de mortalidad intrahospitalaria en pacientes con embolia pulmonar hemodinamicamente estables. MITODOS: Estudio de cohorte multicintrico prospectivo de 582 pacientes consecutivos que ingresaron en unidades de emergencia o de terapia intensiva, con sospecha clmnica de embolia pulmonar, y que tuvieron el diagnsstico confirmado por medio de uno o mas de los examenes: arteriografma pulmonar, angiotomografma computadorizada helicoidal, angiorresonancia magnitica, ecocardiografma doppler, centellografma pulmonar o duplex scan venoso. Los datos sobre caractermsticas demograficas, comorbilidades y manifestaciones clmnicas se recolectaron e se incluyeron en un analisis de regresisn logmstica para componer el modelo de prediccisn. RESULTADOS: La mortalidad global fue del 14,1%. Se identificaron como variables independientes de riesgo de sbito: edad > 65 aqos; reposo en la cama > 72h; cor pulmonale crsnico; taquicardia sinusal y taquipnea. Tras la estratificacisn por franjas de riesgo, se observaron mortalidades del 5,4%, el 17,8% y el 31,3%, respectivamente en los subgrupos de bajo, moderado y alto riesgos. El modelo revels sensibilidad del 65,5% y especificidad del 80%, con un area bajo la curva de 0,77. CONCLUSISN: En pacientes hemodinamicamente estables con embolia pulmonar, la edad > 65 aqos, el reposo en la cama > 72h, el cor pulmonale crsnico, la taquicardia sinusal y la taquipnea fueron predictores independientes de la mortalidad intrahospitalaria. Sin embargo, el modelo de prediccisn necesita validarse en otras poblaciones para su incorporacisn a la practica clmnica. (Arq Bras Cardiol 2009; 93(2) : 132-137)
Mortalidad hospitalaria; embolia pulmonar; enfermedad cardiopulmonar; taquicardia sinusal
ARTIGO ORIGINAL
EMBOLIA PULMONAR
Preditores de mortalidade hospitalar em pacientes com embolia pulmonar estáveis hemodinamicamente
André VolschanI; Denilson AlbuquerqueII; Bernardo Rangel TuraII; Marcos KnibelVIII; José Péricles EstevesIII; Luiz Carlos BodaneseV; Francisco SilveiraIX; João PantojaIV; Paulo Cesar Pereira da Silva e SouzaVII; João MansurVI; Evandro Tinoco MesquitaI,* * Em nome dos investigadores do EMEP (Estudo Multicêntrico de Embolia Pulmonar)
IHospital Pró-Cardíaco
IIUniversidade do Estado do Rio de Janeiro Rio de Janeiro, RJ
IIIHospital Português, Salvador, BA
IVHospital Copa D'Or, Rio de Janeiro, RJ
VHospital São Lucas, Porto Alegre, RS
VIHospital Samaritano, Rio de Janeiro, RJ
VIIHospital de Clínicas de Niterói, Niterói, RJ
VIIIHospital CardioTrauma, Rio de Janeiro, RJ
IXHospital Prontocor, Belo Horizonte, MG - Brasil
Correspondência Correspondência: André Volschan Rua Baronesa De Pocone, 137/201 - Lagoa 22471-270 - Rio de Janeiro, RJ - Brasil E-mail: volschan@cardiol.br, volschan@uol.com.br
RESUMO
FUNDAMENTO: A embolia pulmonar apresenta alta mortalidade em pacientes com hipotensão arterial ou choque circulatório. Entretanto, em pacientes hemodinamicamente estáveis, a associação de algumas variáveis clínicas com a mortalidade ainda não está claramente estabelecida.
OBJETIVOS: Derivar um modelo de estratificação do risco de mortalidade intra-hospitalar em pacientes com embolia pulmonar hemodinamicamente estáveis.
MÉTODOS: Estudo de coorte multicêntrico prospectivo de 582 pacientes consecutivos que foram admitidos em unidades de emergência ou de terapia intensiva, com suspeita clínica de embolia pulmonar, e que tiveram o diagnóstico confirmado por meio de um ou mais dos seguintes exames: arteriografia pulmonar, angiotomografia computadorizada helicoidal, angioressonância magnética, ecodopplercardiograma, cintilografia pulmonar ou duplex-scan venoso. Os dados sobre características demográficas, comorbidades e manifestações clínicas foram coletados e incluídos em uma análise de regressão logística para compor o modelo de predição.
RESULTADOS: A mortalidade global foi de 14,1%. Foram identificadas como variáveis independentes de risco de óbito: idade > 65 anos; repouso no leito > 72h; cor pulmonale crônico; taquicardia sinusal e taquipnéia. Após a estratificação por faixas de risco, observaram-se mortalidades de 5,4%, 17,8% e 31,3%, respectivamente nos subgrupos de baixo, moderado e alto riscos. O modelo mostrou sensibilidade de 65,5% e especificidade de 80%, com uma área sob a curva de 0,77.
CONCLUSÃO: Em pacientes hemodinamicamente estáveis com embolia pulmonar, a idade > 65 anos, o repouso no leito > 72h, o cor pulmonale crônico, a taquicardia sinusal e a taquipnéia foram preditores independentes da mortalidade intra-hospitalar. Entretanto o modelo de predição necessita ser validado em outras populações para sua incorporação à prática clínica.
Palavras-chave: Mortalidade hospitalar, embolia pulmonar, doença cardiopulmonar, taquicardia sinusal.
Introdução
A embolia pulmonar (EP) é a terceira causa cardiovascular de admissão hospitalar1, depois da síndrome coronariana aguda e do acidente vascular cerebral, e possui um amplo espectro de manifestações clínicas, principalmente quando associada a descompensações de insuficiência cardíaca2 e doença pulmonar obstrutiva crônica. A EP maciça caracterizada pela instabilidade hemodinâmica define o subgrupo de pacientes de maior gravidade em que observamos a alta taxa de mortalidade3,4, os quais podem se beneficiar de uma abordagem terapêutica mais agressiva. Por outro lado, pacientes estáveis clinicamente e considerados de baixo risco exigem um menor tempo de permanência hospitalar e, em alguns casos, podem ser tratados ambulatorialmente com heparina de baixo peso molecular5,6. Dessa forma a avaliação do prognóstico torna-se útil para guiar a estratégia terapêutica e orientar melhor os demais cuidados.
Se a hipotensão arterial caracteriza os pacientes com EP com maior risco de morte, nos pacientes estáveis hemodinamicamente, o ecocardiograma, a troponina e o peptídeo natriurético cerebral ajudam a identificar pacientes de pior prognóstico. Desde o início da década de 90, a presença de disfunção do ventrículo direito demonstrada pelo ecocardiograma em pacientes normotensos, classificados como EP submaciça, tem sido relacionada à maior mortalidade7,8. Apesar de sua capacidade de estratificar pacientes de maior risco, o ecocardiograma nem sempre está disponível 24 horas diárias, o que limita sua utilização.
A troponina e o peptídeo natriurético cerebral são métodos que indiretamente expressam o comprometimento ventrícular9,10 e ajudam a selecionar pacientes de maior gravidade11,12. Esses exames, apesar de cada vez mais difundidos, ainda são pouco utilizados em centros de menor complexidade que também admitem pacientes com EP.
Marcadores prognósticos clínicos em pacientes estáveis que possam contribuir para uma estratificação de risco de mortalidade dos pacientes com EP têm sido pouco estudados13-15.Dados demográficos, fatores de risco, sinais e sintomas constituem um grupo de variáveis de baixa complexidade que podem ser avaliadas em qualquer ambiente hospitalar, independentemente de exames complementares, o que torna a estratégia possível de ser universalmente utilizada.
Objetivos
O objetivo deste estudo foi elaborar um modelo baseado em indicadores clínicos de estratificação do risco de mortalidade intra-hospitalar em pacientes com EP hemodinamicamente estáveis.
Métodos
O estudo de coorte multicêntrico prospectivo foi realizado em 24 centros investigadores de 20 hospitais terciários brasileiros, no período de janeiro de 1998 a maio de 2003. A partir de uma base inicial de 727 pacientes consecutivos com suspeita de EP, foram excluídos os que apresentaram instabilidade hemodinâmica, sendo analisada uma amostra de 582 pacientes consecutivos (42,1% homens, mediana de idade de 73 anos, variando de 18 a 102), admitidos em unidades de emergência ou de terapia intensiva. A suspeita clínica foi definida pelo médico que avaliou o paciente, baseado nos fatores de risco, sinais e sintomas de EP. A pressão arterial sistolica > 90 mmHg foi considerada critério para estabilidade hemodinâmica. Além da suspeita clínica, era necessária a documentação de EP por um dos métodos complementares abaixo relacionados:
1) Arteriografia pulmonar com visualização do trombo em artéria pulmonar.
2) Angiotomografia helicoidal com visualização do trombo em artéria pulmonar.
3) Angioressonância com visualização do trombo em artéria pulmonar.
4) Ecocardiograma com visualização do trombo em artéria pulmonar.
5) Cintilografia pulmonar de ventilação/perfusão com alta probabilidade de EP.
6) Duplex-scan com visualização do trombo e redução da compressibilidade no sistema venoso profundo.
Foram considerados para análise univariada: idade; gênero; história prévia de tromboembolismo venoso; fratura de bacia ou de membros inferiores nos últimos 90 dias; cirurgia abdominal ou pélvica nos últimos 30 dias; neoplasia; repouso no leito > 72h; cor pulmonale crônico; tabagismo; insuficiência cardíaca; acidente vascular cerebral; dor torácica; taquicardia sinusal ( frequência cardíaca > 100 bpm); síncope; dispnéia; taquipnéia ( frequência respiratória > 20 irpm); febre (temperatura axilar > 37˚ C); tosse; cianose e hemoptise ou hemoptóicos.
As informações coletadas foram incluídas pelos investigadores de cada centro em um formulário padronizado e, posteriormente, foram encaminhadas ao investigador principal para serem colocadas em um banco de dados de formato CSV e exportadas para o pacote estatístico R versão 2.6.0, em que as análises foram realizadas16.
Análise estatística
O modelo utilizou variáveis demográficas, comorbidades e manifestações clínicas que pudessem ser facilmente coletadas durante o primeiro atendimento dos pacientes com EP.
Os dados foram descritos por meio de porcentagem, médias e desvio-padrão ou mediana e desvio-interquartílico, de acordo com o tipo de variável (categórica, normal e não-paramétrica). A dicotomização de variáveis contínuas foi realizada por meio do uso de curva ROC (Receive Operatoring Characteristic). Para medir a associação de variáveis clínicas com o desfecho, foram utilizados teste T de Student, Mann-Witney, qui-quadrado ou teste exato de Fisher. Como critério de seleção para inclusão no modelo multivariado, foi considerado um valor de p < 0,20 ou a existência de forte associação clínica com mortalidade17.
O modelo multivariado foi ajustado por meio de uma regressão logística com a seleção das variáveis guiada pela razão de verossimilhança, utilizando o menor número de variáveis possíveis sem perda da capacidade de predição, e sua acurácia avaliada pela estatística C. Após a criação do modelo, foi elaborado um escore de cada variável, baseado no valor do odds ratio, aproximado para a unidade. O escore de risco foi analisado por meio do qui-quadrado da tendência linear, e, posteriormente, foi avaliado o risco óbito em cada estrato.
Foi realizada uma análise de sobrevida dos três subgrupos, usando o estimador de Kaplan-Meyer.
Resultados
Neste estudo, a mortalidade global foi de 14,1%, e as características demográficas e clínicas estão descritas na tabela 1.
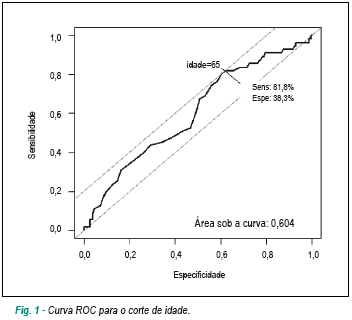
A mediana de idade foi de 73 anos, variando de 18 a 102 anos. Por meio da curva ROC16, foi determinada como melhor ponto de corte a idade de 65 anos, com área sob a curva de 0,60 (figura 1), sensibilidade de 81,8%, especificidade de 88,3%, razão de verossimilhança positiva de 6,99 e negativa de 0,21. O modelo identificou, além da idade > 65 anos, repouso no leito, cor pulmonale crônico, taquicardia sinusal e taquipnéia como variáveis capazes de predizer de forma independente, por meio da regressão logística, o risco de óbito (tabela 2).
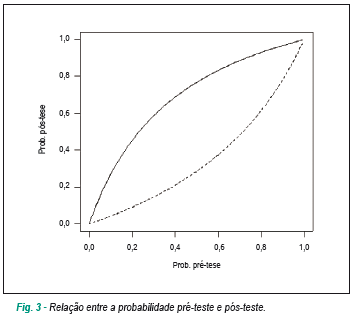
A partir do modelo de predição, foi calculado o risco esperado de óbito para cada paciente, e foi construída uma curva ROC18 (figura 2).A área sob a curva - também chamada estatística C - foi de 0,77, o que corresponde à acurácia do modelo e às características operacionais com sensibilidade de 65,5%, especificidade de 80,0%, razão de verossimilhança positiva de 3,3 e razão de verossimilhança negativa de 0,4. A figura 3 mostra a relação entre a probabilidade pré-teste (14,1%), que corresponde à mortalidade global do estudo, e a probabilidade pós-teste de morte, no caso do teste positivo (35,1%) e do teste negativo (6,2%). A comparação das curvas de mortalidade (figura 4) mostrou diferença entre os grupos de risco com valor de p = 0,000004.
Baseado no poder de predição de cada variável, guiado pelo respectivo odds ratio, o modelo mostrou associação linear para a predição do óbito (p > 0,001).
Para o cálculo do escore de pontos de cada paciente, foram utilizados os valores descritos na tabela 3, e a estratificação do risco mostrou 5,4% de óbito entre os pacientes considerados de baixo risco e 17,8% e 33,1%, no grupo de moderado e alto riscos, respectivamente, conforme demonstrado na tabela 4.
Discussão
Os estudos sobre prognóstico com EP utilizam, na sua maioria, dados ecocardiográficos de disfunção do ventrículo direito19,20 ou laboratoriais, como a elevação da troponina21,22 e do peptídeo natriurético cerebral23-25,para quantificar o risco de pior evolução dos pacientes. Apesar de sua boa acurácia prognóstica, esses exames não estão amplamente disponíveis.
Nesta primeira análise de nosso estudo, optamos pela utilização de um modelo composto puramente por variáveis clínicas, seguindo as recomendações de que, a partir de uma regra de predição mais simples, sua aplicação seja mais abrangente26. Foram excluídos os pacientes com instabilidade hemodinâmica, para que pudéssemos avaliar um subgrupo mais homogêneo e com menor risco de óbito. Apesar da menor gravidade dessa população, quando comparados aos pacientes com hipotensão arterial, a mortalidade global de 14,1% foi superior em relação às outras publicações sobre o tema.
Wicki e cols.27, em um estudo com 296 pacientes consecutivos, construíram um modelo de predição, o escore prognóstico de Geneva, e observaram 10.1% de eventos adversos, sendo a mortalidade global de 8,4%. Esse modelo utilizou como preditores de eventos adversos câncer, hipotensão arterial, hipoxemia, insuficiência cardíaca e história prévia ou documentação de trombose venosa profunda no duplex scan.
Aujesky e cols., no estudo PESI28, derivaram um modelo de estratificação de risco em um total de 10.534 pacientes distribuídos em cinco subgrupos, utilizando 11 variáveis clínicas, e observaram mortalidade global de 9,2%, variando de 1,1% (classe I, muito baixo risco) a 24,5% (classe V, muito alto risco).
Esses dois modelos foram posteriormente comparados quanto à sua capacidade de selecionar pacientes a serem tratados ambulatorialmente e demonstraram uma diferença significativa para a predição de mortalidade em 30 dias (PESI, 0.9%; 95% CI, 0.3 a 2.2; vs Geneva, 5.6%; 95% CI, 3.6 a 7.6, p < 0.0001)5.
A maior mortalidade em nossa casuística sugere que, apesar da estabilidade hemodinâmica, a população estudada composta por pacientes admitidos em unidades de terapia intensiva possa ter maior risco de complicações. Por esse mesmo motivo, é possível compreender o maior risco de óbito em cada estrato avaliado e comparado com os estudos citados27,28.
A identificação de um subgrupo cujo tratamento possa ser realizado ambulatorialmente não foi possível nesta análise, uma vez que o risco de mortalidade de 5,4%, atribuído ao estrato baixo risco, é muito alto para assumir essa conduta. Por outro lado, a mortalidade de 31,3% no subgrupo de alto risco indica a necessidade de maior complexidade nas intervenções e na vigilância desses pacientes.
A derivação de um modelo de predição é o início de uma estratégia para se conseguir uma regra de decisão clínica, assim sendo etapas de validação interna e externa são fundamentais para que o modelo possa ser universalmente aplicado26. Bases de dados semelhantes estão sendo coletadas em outros centros investigadores, de maneira que possamos validar o modelo em outras populações.
Conclusão
Em pacientes com EP hemodinamicamente estáveis, a idade > 65 anos, o repouso no leito, o cor pulmonale crônico, a taquicardia sinusal e a taquipnéia foram capazes de predizer de forma independente, por meio da regressão logística, o risco de óbito.
Agradecimentos
Agradecemos a participação dos seguintes investigadores do EMEP (Estudo Multicêntrico de Embolia Pulmonar) pela coleta de dados do estudo: Evandro Tinoco Mesquita (Hospital Pró-Cardíaco, Rio de Janeiro, RJ); João Mansur Filho e José Kezen Camillo Jorge (Hospital Samaritano, Rio de Janeiro, RJ); Gustavo Nobre (Hospital Rio Mar, Rio de Janeiro, RJ); Marcos Baptista, Nelson Arthur, Marcos Knibel e Marcelo Lugarinho (Hospital São Lucas, Rio de Janeiro, RJ); Gláucia Maria e Ricardo Eiras (Hospital Prontocor, Rio de Janeiro, RJ); Gustavo Gouvêa, Alexandre Drummond, Eduardo Eiras e Emanuel Salgueiro (Casa de Saúde São José, Rio de Janeiro, RJ); Mônica Callafiori (Hospital CardioTrauma, Rio de Janeiro, RJ); Paulo César Pereira da Silva e Souza e Marcelo Magalhães (Hospital de Clínicas de Niterói, Niterói, RJ); Ana Paula Lacerda (Hospital Barra D'Or, Rio de Janeiro, RJ); Fernando Pacheco (Hospital Copa D'Or, Rio de Janeiro, RJ); Marcelo Vieira Gomes e Luis Felipe Camille (Clínica São Vicente, Rio de Janeiro, RJ); Guilherme Aguiar (Hospital São Vicente de Paulo, Rio de Janeiro, RJ); Maria Luiza Toscano e Roberto Caetano (Instituto Nacional do Câncer, Rio de Janeiro, RJ); José Péricles Esteves e Carolina Barbosa (Hospital Português, Salvador, BA); Francisco Silveira (Hospital Prontocor, Belo Horizonte, MG); Alex Macedo (Hospital Santa Casa, Santos, SP); Luis Carlos Bodanese (Hospital São Lucas, Porto Alegre, RS).
Potencial Conflito de Interesses
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo foi parcialmente financiado pela Sanofi-Aventis.
Vinculação Acadêmica
Este artigo é parte de tese de Doutorado de Andre Volschan pela Universidade do Estado do Rio de Janeiro.
Artigo recebido em 12/08/08; revisado recebido em 12/09/08; aceito em 19/09/08.
- 1. Giuntini C, Di Ricco G, Marini C, Melillo E, Palla A. Pulmonary embolism: epidemiology. Chest. 1995; 107: 3S-9S.
- 2. Terzi CB, Lage SG, Dragosavac D, Terzi RGG. Insuficiência cardíaca grave em unidade de terapia intensiva: existe um índice prognóstico ideal? Arq Bras Cardiol. 2006; 87: 344-51.
- 3. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry. Lancet. 1999; 353: 1386-9.
- 4. Kurkciyan I, Meron G, Sterz F, Janata K, Domanovits H, Holzer M, et al. Pulmonary embolism as a cause of cardiac arrest: presentation and outcome. Arch Intern Med. 2000; 160: 1529-35.
- 5. Jiménez D, Yusen RD, Otero R, Uresandi F, Nauffal D, Laserna E, et al. Prognostic models for selecting patients with acute pulmonary embolism for initial outpatient therapy. Chest. 2007; 132 (1): 7-8.
- 6. Wells PS. Outpatient treatment of patients with deep-vein thrombosis or pulmonary embolism. Curr Opin Pulm Med. 2001; 7: 360-4.
- 7. Ribeiro A, Lindmarker P, Juhlin-Dannfelt A, Johnsson H, Jorfeldt L. Echocardiography Doppler in pulmonary embolism: right ventricular dysfunction as a predictor of mortality rate. Am Heart J. 1997; 134: 479-87.
- 8. Grifoni S, Olivotto I, Cecchini P, Pieralli F, Camaiti A, Santoro G, et al. Short-term clinical outcome of patients with pulmonary embolism, normal blood pressure, and echocardiographic right ventricular dysfunction. Circulation. 2000; 101: 2817-22.
- 9. Meyer T, Binder L, Hruska N, Luthe H, Buchwald AB. Cardiac troponin I elevation in acute pulmonary embolism is associated with right ventricular dysfunction. J Am Coll Cardiol. 2000; 36: 1632-6.
- 10. Tulevski II, ten Wolde M, van Veldhuisen DJ, Mulder JW, van der Wall EE, Buller HR, et al. Combined utility of brain natriuretic peptide and cardiac troponin T may improve rapid triage and risk stratification in normotensive patients with pulmonary embolism. Int J Cardiol. 2007; 116: 161-6.
- 11. Becattini C, Vedovati MC, Agnelli G. Prognostic value of troponins in acute pulmonary embolism: a meta-analysis. Circulation. 2007; 116: 427-33.
- 12. Douketis JD, Leeuwenkamp O, Grobara P, Johnston M, Sohne M, Tem Wolde M, et al. The incidence and prognostic significance of elevated cardiac troponins in patients with submassive pulmonary embolism. J Thromb Haemost. 2005; 3: 508-13.
- 13. Aujesky D, Roy PM, Le Manach CP, Verschuren F, Meyer G, Obrosky DS, et al. Validation of a model to predict adverse outcomes in patients with pulmonary embolism. Eur Heart J. 2006; 27: 476-81.
- 14. Aujesky D, Obrosky DS, Stone RA, Auble TE, Perrier A, Cornuz J, et al. A prediction rule to identify low-risk patients with pulmonary embolism. Arch Intern Med. 2006; 166 (2): 169-75.
- 15. Jiménez D, Díaz G, Valle M, Martí D, Escobar C, Vidal R, et al. Prognostic value of syncope in the presentation of pulmonary embolism. Arch Bronconeumol. 2005; 41 (7): 385-8.
- 16. R Development Core Team (2007) R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria; 2007.
- 17. Greeland, S. Modeling and variable selection in epidemiology analysis. Am J Public Health. 1989; 79 (3): 340-9.
- 18. Hanley JA, McNeil BJ. The meaning and use of the area under the receiver operating characteristic (ROC) curve. Radiology. 1982; 143: 29-36.
- 19. Grifoni S, Vanni S, Magazzini S, Olivotto I, Conti A, Zanobetti M, et al. Association of persistent right ventricular dysfunction at hospital discharge after acute pulmonary embolism with recurrent thromboembolic events.. Arch Intern Med. 2006; 166: 2151-6.
- 20. Sociedade Brasileira de Cardiologia. Diretriz de embolia pulmonar. Arq Bras Cardiol. 2004; 83 (supl 1): 1-8.
- 21. Konstantinides S, Geibel A, Olschewski M, Kasper W, Hruska N, Jäckle S, et al. Importance of cardiac troponins I and T in risk stratification of patients with acute pulmonary embolism. Circulation. 2002; 106: 1263-8.
- 22. Giannitsis E, Muller-Bardorff M, Kurowski V, Weidtmann B, Wiegand U, Kampmann M, et al. Independent prognostic value of cardiac troponin T in patients with confirmed pulmonary embolism. Circulation. 2000; 102 (2): 211-7.
- 23. Pruszczyk P, Kostrubiec M, Bochowicz A, Styczynski G, Szulc M, Kurzyna M, et al. N-terminal pro-brain natriuretic peptide in patients with acute pulmonary embolism. Eur Respir J. 2003; 22: 649-53.
- 24. Binder L, Pieske B, Olschewski M, Geibel A, Klostermann B, Reiner C, et al. N-terminal pro-brain natriuretic peptide or troponin testing followed by echocardiography for risk stratification of acute pulmonary embolism. Circulation. 2005; 112: 1573-9.
- 25. Sanchez O, Trinquart L, Colombet I, Durieux P, Huisman MV, Chatellier G, et al. Prognostic value of right ventricular dysfunction in patients with haemodynamically stable pulmonary embolism: a systematic review. Eur Heart J. 2008; 29 (12): 1569-77.
- 26. Thomas G, McGinn TG, Guyatt GH, Wyer PC, Naylor CD, Stiell IG, et al. for the Evidence-Based Medicine Working Group. Users' Guides to the Medical Literature XXII: How to Use Articles About Clinical Decision Rules. JAMA. 2000; 284: 79-84.
- 27. Wicki J, Perrier A, Perneger TV, Bounameaux H, Junod AF. Predicting adverse outcome in patients with acute pulmonary embolism: a risk score. Thromb Haemost. 2000; 84 (4): 548-52.
- 28. Aujesky D, Obrosky DS, Stone RA, Auble TE, Perrier A, Cornuz J, et al. Derivation and validation of a prognostic model for pulmonary embolism. Am J Resp Crit Care Med. 2005; 172: 1041-6.
Datas de Publicação
-
Publicação nesta coleção
13 Out 2009 -
Data do Fascículo
Ago 2009
Histórico
-
Revisado
12 Set 2008 -
Recebido
12 Ago 2008 -
Aceito
19 Set 2008