Resúmenes
FUNDAMENTO: El ejercicio físico promueve estrés hemodinámico. OBJETIVO: Probar si programas de entrenamiento con carreras voluntaria y forzada inducen niveles distintos de expresión de Hsp72 en el miocardio de ratas hembra Wistar. MÉTODOS: Ratas hembra Wistar fueron distribuidas en tres grupos (n = 6, cada uno): entrenadas con carrera voluntaria (ECV), entrenadas con carrera forzada (ECF) y grupo control (C). Los animales del ECV tuvieron libre acceso a la rueda de carrera voluntaria, mientras que los del ECF fueron sometidos a carrera forzada en cinta sin fin (18 m/min, 0% inclinación, 60 m/min, 5 días/sem) durante ocho semanas. Fragmentos de los ventrículos izquierdo (VI) y derecho (VD) se recolectaron para análisis de los niveles de Hsp72. RESULTADOS: Las ratas del grupo ECV corrieron, en promedio 4,87 km, y las del ECF, 4,88 km por semana. Los animales de los grupos ECV y ECF ganaron menos peso (p<0,05) que los del grupo C (81,67 ± 11,95 g vs. 81,17 ± 10,18 g vs. 111,50 ± 2,26 g, respectivamente). El peso relativo del corazón no fue diferente (p>0,05) entre los grupos ECV, ECF y C (4,54 ± 0,79 mg/g vs. 4,94 ± 0,89 mg/g vs. 4,34 ± 0,87 mg/g, respectivamente). Las ratas entrenadas con carrera presentaron niveles de Hsp72 mayores (p<0,05) que las que corrieron voluntariamente, en el VI (287,45 ± 35,86% vs. 135,59 ± 5,10%, respectivamente) y en el VD (241,31 ± 25,83% vs. 137,91 ± 45,20%, respectivamente). CONCLUSIÓN: Los programas de entrenamiento con carreras voluntaria y forzada inducen niveles distintos de expresión de Hsp72 en el miocardio de ratas Wistar.
Actividad física; carrera; ratones; estrés; miocardio
FUNDAMENTO: O exercício físico promove estresse hemodinâmico. OBJETIVO: Testar se programas de treinamento com corridas voluntária e forçada induzem níveis distintos de expressão de Hsp72 no miocárdio de ratas Wistar. MÉTODOS: Ratas Wistar foram alocadas em três grupos (n = 6, cada): treinadas com corrida voluntária (TCV), treinadas com corrida forçada (TCF) e grupo controle (C). Os animais do TCV tiveram livre acesso à roda de corrida voluntária, enquanto os do TCF foram submetidos à corrida forçada em esteira (18 m/min, 0% inclinação, 60 m/min, 5 dias/sem) durante oito semanas. Fragmentos dos ventrículos esquerdo (VE) e direito (VD) foram coletados para análise dos níveis de Hsp72. RESULTADOS: As ratas do grupo TCV correram, em média, 4,87 km, e as do TCF, 4,88 km por semana. Os animais dos grupos TCV e TCF ganharam menos peso (p < 0,05) que os do grupo C (81,67 ± 11,95 g vs 81,17 ± 10,18 g vs 111,50 ± 2,26 g, respectivamente). O peso relativo do coração não foi diferente (p > 0,05) entre os grupos TCV, TCF e C (4,54 ± 0,79 mg/g vs 4,94 ± 0,89 mg/g vs 4,34 ± 0,87 mg/g, respectivamente). Ratas treinadas com corrida forçada apresentaram níveis de Hsp72 maiores (p < 0,05) que as que correram voluntariamente, no VE (287,45 ± 35,86% vs 135,59 ± 5,10%, respectivamente) e no VD (241,31 ± 25,83% vs 137,91 ± 45,20%, respectivamente). CONCLUSÃO: Os programas de treinamento com corrida voluntária e forçada induziram níveis distintos de expressão de Hsp72 no miocárdio de ratas Wistar.
Atividade física; corrida; ratos; estresse; miocárdio
BACKGROUND: Physical exercise induces hemodynamic stress. OBJECTIVE: To evaluate if voluntary running and forced running induced different levels of stress protein (Hsp72) in the myocardium of female Wistar rats. METHODS: Female rats were randomly assigned to the following groups: forced treadmill running group (FR; n= 6), voluntary running group (VR; n=6) and control group (C; n=6). VR group animals had free access to running wheels, and those from FR group underwent a running program on a treadmill (18 m/min, 60 min/day, 5 days/wk) for 8 weeks. Left ventricle (LV) and right ventricle (RV) fragments were collected at sacrifice, and the relative immunoblot contents of stress protein (Hsp72) were determined. RESULTS: VR animals ran on average 4.87 km/wk, and FR rats ran 4.88 km/wk. Animals from VR and FR groups had less body weight gain (p<0.05) than those from C group (81.67 ± 11.95g vs 81.17 ± 10.18g vs 111.50 ± 2.26g, respectively). Heart weight/body weight ratio was not significantly different (p>0.05) among VR, FR and C groups (4.54 ± 0.79 mg/g vs 4.94 ± 0.89 mg/g vs 4.34 ± 0.87 mg/g, respectively). FR group animals had levels of Hsp72 (p<0.05) higher than those from VR, both in LV (287.45 ± 35.86 % vs 135.59 ± 5.10 %, respectively) and RV (241.31 ± 25.83 % vs 137.91 ± 45.20 %, respectively). CONCLUSION: Voluntary running and forced running induced different levels of Hsp72 in the myocardium of female Wistar rats.
Physical activity; running; rats; stress; myocardium
ARTÍCULO ORIGINAL
Niveles distintos de Hsp72 en el miocardio de ratas en respuesta a los ejercicios voluntario y forzado
Stéphano Freitas Soares Melo; Wellington Lunz; Elizabeth Pacheco Batista Fontes; Cristina Maria Ganns Chaves Dias; Miguel Araujo Carneiro Júnior; Anselmo Gomes de Moura; Ricardo Junqueira Del Carlo; Antonio Jose Natal
Universidade Federal de Viçosa (UFV), Viçosa, MG - Brasil
Correspondencia
RESUMEN
FUNDAMENTO: El ejercicio físico promueve estrés hemodinámico.
OBJETIVO: Probar si programas de entrenamiento con carreras voluntaria y forzada inducen niveles distintos de expresión de Hsp72 en el miocardio de ratas hembra Wistar.
MÉTODOS: Ratas hembra Wistar fueron distribuidas en tres grupos (n = 6, cada uno): entrenadas con carrera voluntaria (ECV), entrenadas con carrera forzada (ECF) y grupo control (C). Los animales del ECV tuvieron libre acceso a la rueda de carrera voluntaria, mientras que los del ECF fueron sometidos a carrera forzada en cinta sin fin (18 m/min, 0% inclinación, 60 m/min, 5 días/sem) durante ocho semanas. Fragmentos de los ventrículos izquierdo (VI) y derecho (VD) se recolectaron para análisis de los niveles de Hsp72.
RESULTADOS: Las ratas del grupo ECV corrieron, en promedio 4,87 km, y las del ECF, 4,88 km por semana. Los animales de los grupos ECV y ECF ganaron menos peso (p<0,05) que los del grupo C (81,67 ± 11,95 g vs. 81,17 ± 10,18 g vs. 111,50 ± 2,26 g, respectivamente). El peso relativo del corazón no fue diferente (p>0,05) entre los grupos ECV, ECF y C (4,54 ± 0,79 mg/g vs. 4,94 ± 0,89 mg/g vs. 4,34 ± 0,87 mg/g, respectivamente). Las ratas entrenadas con carrera presentaron niveles de Hsp72 mayores (p<0,05) que las que corrieron voluntariamente, en el VI (287,45 ± 35,86% vs. 135,59 ± 5,10%, respectivamente) y en el VD (241,31 ± 25,83% vs. 137,91 ± 45,20%, respectivamente).
CONCLUSIÓN: Los programas de entrenamiento con carreras voluntaria y forzada inducen niveles distintos de expresión de Hsp72 en el miocardio de ratas Wistar.
Palabras clave: Actividad física, carrera, ratones, estrés, miocardio.
Introducción
La exposición de células a diferentes situaciones de estrés induce la expresión de proteínas de choque térmico (HSP), también conocidas como proteínas de estrés. Tales proteínas le otorgan a las células tolerancia a varios agentes estresantes, ejercen protección del organismo contra la desnaturalización proteica y auxilian en la eliminación de proteínas dañadas1,2.
El ejercicio físico, tanto agudo como crónico, es uno de esos agentes estresantes que pueden inducir la expresión de Hsp72, forma inducible de la familia de las Hsp de peso molecular 70kDa (Hsp70), en varios tejidos, entre los cuales se encuentran los músculos esquelético y cardíaco3-10. Hay evidencias de que la expresión de Hsp72 en el miocardio, inducida por ejercicio, está asociada a la protección cardíaca contra eventos de estrés cardiovascular7,11-14, a pesar de algunos resultados en contrario15. No obstante, la inducción de la expresión de Hsp72 en respuesta al ejercicio parece ser dependiente del género del animal16-18 y de la intensidad del ejercicio6.
Considerando que los modelos de ejercicio forzado para animales provocan alteraciones en las respuestas neuroendócrinas e inmunológicas comúnmente asociadas al estrés19-21, la inducción de la expresión de Hsp72 por el ejercicio forzado puede sufrir interferencia de factores estresantes adversos al ejercicio. Al contrario, la carrera voluntaria, modelo en que los animales tiene libre acceso al equipamiento a partir de la jaula y corren voluntariamente22, provoca niveles más bajos de estrés a los animales, en comparación con la carrera forzada y la natación4,23.
Así, este estudio tuvo como objetivo probar si programas de entrenamiento con carreras voluntaria y forzada inducen niveles distintos de expresión de Hsp72 en el miocardio de ratas Wistar.
Métodos
Animales de experimento y tratamiento
Se usaron dieciocho ratas Wistar jóvenes (siete semanas de edad). Se formaron tres grupos en tiempos diferentes, a saber: entrenadas con carrera voluntaria (ECV), entrenadas con carrera forzada (ECF) y grupo control (C). Todos los animales se manejaron de forma idéntica, sin embargo, el grupo C no realizó ejercicio. Los animales se alojaron en jaulas individuales de acero inoxidable (25 x 20 x 18 cm), recibieron agua y ración propia ad libitum, se mantuvieron en ambiente con temperatura promedio de 22ºC y se sometieron a un régimen de luminosidad de 12 horas de oscuridad por 12 horas de claridad durante el período del experimento.
Los animales fueron proporcionados por el Bioterio Central del Centro de Ciencias Biológicas y de la Salud, de la Universidad Federal de Viçosa, y se siguieron las normas establecidas en el Guide for the Care and Use of Laboratory Animals (Institute of Laboratory Animal Resources, National Academy of Sciences, Washington, D.C., 1996) y en los 'Principios éticos en experimentación animal', del Colegio Brasileño de Experimentación Animal (COBEA).
Programa de entrenamiento con carrera voluntaria
El primer grupo en ejercitarse fue el ECV, cuyas ratas tuvieron libre acceso a la rueda de carrera voluntaria, acoplada a sus respectivas jaulas de acero inoxidable (25 x 20 x 18 cm), por ocho semanas.
Esta rueda de carrera voluntaria tiene una circunferencia interna de 1,53 m y el número de vueltas se registró con un contador de vueltas mecánico. De esta forma, la distancia recorrida por los animales se calculó por el número de vueltas realizadas.
Se observa que los roedores son animales de hábitos nocturnos y por lo tanto, se ejercitan normalmente durante la fase de oscuridad del ciclo de luminosidad.
Programa de entrenamiento con carrera forzada
Conocidos los metrajes promedio semanales y totales recorridos por las ratas del grupo ECV, se elaboró el protocolo de entrenamiento para el otro grupo de ratas (ECF), de forma que los metrajes no fueron diferentes entre los dos grupos.
Así, las ratas del grupo ECF se sometieron a un régimen de carrera forzada en cinta sin fin motorizada (Insight Instrumentos Científicos, Ribeirão Preto, SP, Brasil) por ocho semanas (adaptado de Samelman)5. Los animales iniciaron el programa de ejercicio corriendo a velocidad de 15 m/min, 0% inclinación, por 15 minutos el primer día, cinco días por semana. Esta duración se aumento en cinco minutos por día, de forma que, el último día de la segunda semana, los animales corrieron durante 60 minutos. A partir del primer día de la tercera semana, la velocidad pasó para 17 m/min. De la cuarta a la octava semana, la sesión de ejercicio se mantuvo con la duración de 60 minutos por día, 18 m/min, 0% de inclinación, cinco días por semana.
Este programa de carrera en cinta se aplicó durante la fase de oscuridad del ciclo de luminosidad para no diferir del grupo ECV. Los animales eran motivados a correr con leves toques en el dorso. Debe observarse que estos animales se alojaron en jaulas individuales de acero inoxidable (25 x 20 x 18 cm), al igual que los animales de los grupos ECV y C. Así, se considera que el movimiento (voluntario) de los animales en esas jaulas, fuera del período de entrenamiento, no es suficiente para provocar adaptaciones que puedan confundir aquellas probadas por las carreras voluntaria y forzada.
Por lo tanto, en ninguno de los tres grupos es necesario contabilizar el movimiento de los animales en sus respectivas jaulas, por considerarse que es similar para todos los animales.
Recolección de las muestras
Para evitar la respuesta aguda del ejercicio y preservar la respuesta crónica, la eutanasia de los animales se realizó 48 horas después de la última sesión de ejercicio. Se recolectaron fragmentos de los ventrículos izquierdo y derecho, que fueron envueltos en papel aluminio, identificados, inmediatamente congelados en nitrógeno líquido y almacenados a -80ºC para posterior análisis.
Extracción de las proteínas
Se retiraron fragmentos de las muestras del freezer y, después de pesados, se maceraron para la obtención de un extracto tisular, al cual se le agregó el respectivo tampón (composición 15 mM Tris HCL; 600 mM de NaCl; 1 mM PMSF, pH 7,5). A 60 mg del extracto se agregaron 1200 µl de tampón de extracción (proporción de 1: 20). A seguir, las muestras se colocaron en eppendorfs, los cuales se identificaron y se mantuvieron en hielo por aproximadamente, cinco minutos.
Tras ese período de incubación, los restos celulares se descartaron por centrifugación a 14.000 g, a 4ºC, durante 20 minutos, y el sobrenadante se almacenó a - 20ºC. Los extractos de proteínas totales se cuantificaron de acuerdo con el método de Bradford24, utilizando las tres réplicas preconizadas.
Electroforesis SDS-PAGE
Se realizó electroforesis en geles de poliacrilamida (PAGE) con detergente dodecil sulfato de sodio (SDS), esencialmente, como la describe Laemmli25. El extracto de proteína se incubó por cinco minutos, a 100º C, en tampón de la muestra [glicerol 10% (v/v), SDS 2,3%, azul de bromofenol 0,25%, 2-mercaptoetanol 5% (v/v) y Tris-HCl 0,0625 mol/L, pH 6,8], antes de ser aplicado en el gel. La electroforesis se condujo por, aproximadamente, 16 horas, a 48 V, en el tampón de corrida [Tris-HCl 0,025 mol/L, glicina 0,2 mol/L, EDTA 1 mmol/L y SDS 3,5 mmol/L].
Este procedimiento se realizó para obtención de tres geles. Uno de ellos se coloreó con solución colorante [metanol 40% (v/v), CH3COOH 7,5% (v/v) y coomassie brilhant blue R-250 0,01%] por, aproximadamente, 12 horas y se decoloró con solución decolorante [metanol 10% (v/v) y ácido acético 7,5% (v/v)]. Los otros dos geles se sometieron a la técnica de imunoblotting, para verificar si el anticuerpo Monoclonal Anti-Heat Shock Protein 70 contra Hsp72 de animales era capaz de reconocer la proteína de interés.
Imunoblotting
Las proteínas se transfirieron para la membrana de nitrocelulosa, usando el sistema de transferencia de BIORAD (EEUU), de acuerdo con las instrucciones del fabricante. Después de la transferencia (en aproximadamente una hora, a 0,70 Amperios constantes), la membrana de nitrocelulosa fue sumergida en solución de bloqueo (caseína Non-fat Dry Milk, BIORAD) por una hora.
A seguir, se realizaron cuatro lavados, de 15 minutos cada uno, a temperatura ambiente, con TBS-T [Tris-HCl 0,01 mol/L, NaCl 1,5 mmol/L, Tween-20 0,1% (v/v), pH 7,6]. La membrana se incubó con el anticuerpo Monoclonal Anti-Heat Shock Protein 70 (SIGMA), en una dilución de 1: 5. 000 por tres horas en agitación.
Después de ese período de incubación, la membrana se lavó con TBS-T cuatro veces, 15 minutos cada una, y a seguir se incubó con el anticuerpo Anti-Mouse IgG [fosfatasa alcalina Sigma], en una dilución de 1:10.000 por, aproximadamente, dos horas. La membrana fue lavada extensivamente con TBS-T, nuevamente cuatro veces, de 15 minutos cada una. A continuación, se incubó con tampón de la enzima [Tris-HCl 0,1 mol/L, pH 9,8, NaCl 0,1 mol/L, MgCl2 0,5 mol/L] por diez minutos.
La actividad de la fosfatasa alcalina fue detectada usando los sustratos NBT [azul de nitrotetrazolio, GIBCO/BRL] y BCIP [5-bromo-4-cloro-3-indolil-fosfato, GIBCO/BRL]. Las bandas de los imunoblottings se cuantificaron por medio de densitometría computarizada, utilizándose el personal densitometer, equipado con el programa Image Quant, versión 5.2 (Molecular Dinamics EEUU).
Tratamiento estadístico
Las comparaciones de los promedios de peso corporal, ganancia de peso y del peso relativo del corazón se realizaron utilizando ANOVA one-way, seguida del test post hoc de Tukey. Las comparaciones de los niveles de Hsp72 se realizaron con el test de Mann-Whitney, pues los datos no presentaron distribución normal (Kolmogorov-Smirnov, p<0,05). Los análisis se realizaron en el programa Sigma Stat (versión 3. 0 Richmond CA), y se utilizó el nivel de significancia de hasta el 5%.
Este trabajo fue financiado por la Fundación de Amparo a la Investigación del Estado de Minas Gerais (FAPEMIG CDS nº 947/2002).
Resultados
Los animales del grupo ECV recorrieron, voluntariamente, distancias diferentes, de acuerdo con la capacidad individual, mientras que en el grupo ECF todos los animales fueron forzados a recorrer la misma distancia. De esta forma, la distancia recorrida por los animales del grupo ECV será presentada como promedio (promedio ± SEM), y la de los animales del grupo ECF, como valor absoluto para el grupo.
Los animales del grupo ECV recorrieron 4,87 ± 0,55 km/semana y un total de 38,96 ± 3,55 km, mientras que los del grupo ECF recorrieron, en el mismo período, 4,88 km/semana y un total de 39,03 km. No hubo, por lo tanto, diferencia entre las distancias recorridas en los dos modelos.
Al final de las ocho semanas de entrenamiento, los animales de los grupos ECV y ECF exhibieron una ganancia de peso significativamente menor que los animales del grupo control (tabla 1). El peso relativo del corazón, índice usado para indicar hipertrofia cardíaca, no presentó diferencia estadística significativa entre los grupos (tabla 1).
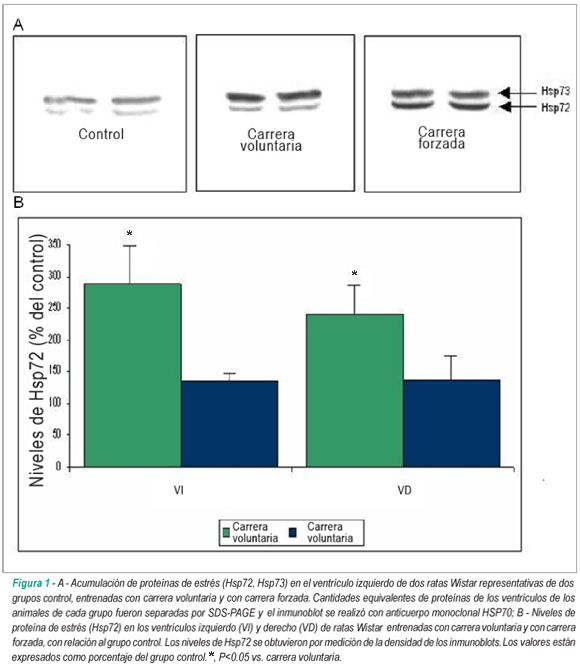
La figura 1 es una representación de la acumulación de Hsp72 y Hsp73 en el VI de dos ratas Wistar de cada uno de los grupos experimentales. La expresión de Hsp73, un miembro constituyente de la familia de las Hsp70, fue similar en los tres grupos (p>0,05), no siendo afectada por los programas de ejercicio usados.
Se observó, con todo, que hubo inducción de la expresión de Hsp72 en respuesta a los programas de ejercicios voluntarios y forzado, pero en niveles diferentes. El VI y el VD de los animales del grupo control mostraron expresión de pequeña cantidad de Hsp72, presentada como unidad arbitraria (282,19 ± 20,02 vs. 287 ± 32,05, respectivamente), probablemente en función de algún estrés ambiental.
Estos valores se usaron como baseline para comparación de los efectos de los dos protocolos de ejercicio, en porcentajes. Las ratas sometidas a carrera forzada en cinta sin fin presentaron niveles de Hsp72 mayores (p<0,05) que las que corrieron voluntariamente, en el VI (287,45 ± 35,86% vs. 135,59 ± 5,10%, respectivamente) y en el VD (241,31 ± 25,83% vs. 137,91 ± 45,20%, respectivamente). No obstante, no hubo diferencia significativa en la expresión de Hsp72 entre el VI y el VD (fig. 1B).
Se observó que las ratas presentaron una variación interindividual en la distancia total recorrida de, aproximadamente, 3,5 km, pero no hubo correlación significativa (p=0,22) entre la distancia total recorrida y la inducción de la expresión de Hsp72 (fig. 2).
Discusión
Investigamos si programas de entrenamiento con carreras voluntaria y forzada inducen niveles distintos de expresión de Hsp72 en el miocardio de ratas Wistar. Los datos demostraron que los protocolos de ejercicio usados fueron capaces de inducir la expresión de Hsp72 en el miocardio de las ratas en forma diferente, tanto en el VI como en el VD, siendo mayor en la carrera forzada en cinta sin fin que en la carrera voluntaria.
Los animales de los grupos ejercitados, ECV y ECF, recorrieron distancias similares. No obstante, debe destacarse que la forma de ejecución de la carrera es diferente entre los dos modelos. La carrera en la cinta es realizada por los animales de forma continua, pues la velocidad de la estera permanece constante durante la sesión de entrenamiento. Sin embargo, en la rueda de carrera voluntaria, los animales se ejercitan de forma intermitente, pues corren períodos cortos (60 a 90 s), por aproximadamente cinco minutos, con períodos intercalados de descanso26. Así, es posible calcular el trabajo realizado por las ratas sólo en la carrera forzada, pues éste está dado por la relación de la masa corporal del animal con el tiempo de ejecución de la carrera, la velocidad de la carrera y la inclinación de la cinta27.
Aunque el peso corporal, las distancias recorridas y la inclinación hayan sido similares en los dos modelos, la velocidad y el tiempo de ejecución de la carrera fueron diferentes. Consideramos esta falta de precisión en la equivalencia del trabajo realizado entre los animales de los grupos ECV y ECF una limitación del presente estudio. Con todo, los programas de ejercicio utilizados redujeron la ganancia de peso de los animales, al compararla a la de los animales sedentarios del grupo de control.
Esto indica una interferencia de los programas de carrera en el organismo de las ratas, pues la reducción de peso corporal puede reflejar el aumento de la tasa de metabolismo y del gasto energético28. Fisiológicamente, se sabe que peso corporal similar no significa, necesariamente, composición corporal y metabolismo energético equivalentes. No obstante, estudios previos demuestran que entrenamientos con ejercicio aeróbico de diferentes intensidades resultaron en diferentes alteraciones en el peso corporal de las ratas29, pero también que diferentes modelos de ejercicio provocaron reducciones similares en la ganancia de peso de ratas, en comparación con las sedentarias (carrera en cinta vs. natación30, carrera en cinta vs. carrera voluntaria)4,31. Por lo tanto, es razonable especular que nuestros protocolos de carreras voluntaria y forzada resultaron en tasas metabólicas similares, lo que nos permite hacer comparaciones entre los dos grupos.
El peso relativo del corazón no fue diferente entre los tres grupos experimentales. Ello sugiere que los protocolos de ejercicio usados en el presente estudio no fueron suficientes para promover hipertrofia cardíaca. Sin embargo, adaptaciones del músculo cardíaco al ejercicio crónico, inclusive la inducción de la expresión de Hsp72, fueron observadas en animales con y sin hipertrofia cardíaca12,31.
El principal hallazgo del presente estudio tiene relación con los protocolos de ejercicio usados, que fueron capaces de inducir la expresión de Hsp72 en el miocardio de las ratas en forma diferente, en el VI y en el VD, siendo significativamente mayor en la carrera forzada en cinta sin fin que en la carrera voluntaria. Estos niveles de Hsp72 aumentados reflejan el mayor nivel de estrés intracelular generado por el programa de carrera forzada, en comparación al de carrera voluntaria.
A pesar de que nuestros datos no permitieron especificar los mecanismos responsables por el aumento de la expresión de Hsp72 observado, durante el ejercicio, varios eventos fisiológicos y metabólicos ocurren a nivel celular (por ejemplo, aumento de la temperatura, hipoxia, estrés oxidativo, aumento de la concentración de calcio y reducción de pH) y pueden, aisladamente o en conjunto, inducir la expresión de Hsp7210,32.
Algunos estudios han atribuido altos niveles de expresión de Hsp72, en respuesta a la carrera en la cinta, a la intensidad del ejercicio31. De hecho, Milne y Noble6 demostraron que la inducción de la expresión de Hsp72 en músculos esquelético y cardíaco es dependiente de la intensidad del ejercicio, presentando las velocidades superiores a 24 m/min como las más eficientes en la inducción de la expresión de Hsp72.
Sin embargo, sabiendo que, en el presente estudio, la velocidad durante la carrera en cinta fue 18 m/min, que la distancia recorrida en los dos protocolos fue similar y que los animales pueden correr a velocidades superiores a 40 m/min33 en la carrera voluntaria, la mayor expresión de Hsp72 observada en los animales del grupo ECF parece haber sido provocada por otros factores además de la carga de ejercicio.
Uno de esos factores podría ser el nivel de estrés proporcionado al animal por el modelo de ejercicio. Existen evidencias de que, en la carrera voluntaria, el nivel de estrés sufrido por el animal es menor al compararlo con la carrera en cinta4,23. En el presente estudio no usamos choque eléctrico para forzar los animales a correr en la cinta, lo que aumenta la expresión de Hsp7234, pero los animales fueron estimulados con toques en el dorso.
Además de ello, el ejercicio forzado crónico puede causar estrés mental al animal35 y otras adaptaciones negativas indicadoras de estrés crónico (por ejemplo, reducción de globulinas ligantes de corticosteroides séricas, hipertrofia adrenal, involución del timo, supresión de la proliferación de linfocitos y de IgM antígeno específico)20. En la carrera voluntaria, al contrario, los animales no fueron forzados a correr. Hay relatos de que el entrenamiento con carrera voluntaria redujo los niveles de daños oxidativos al ADN4 y redujo la depresión comportamental inducida por estrés en ratas36.
Además, observamos que las ratas presentaron una variación interindividual de, aproximadamente, 3,5 km en la distancia total recorrida. Con todo, la distancia recorrida no presentó correlación significativa con la inducción de la expresión de Hsp72 (fig. 2). Esto puede ser un indicador de que, en el modelo de carrera voluntaria, la intensidad del ejercicio expone los animales a menor estrés.
De hecho, se ha reportado que la carrera voluntaria puede neutralizar la supresión de la función inmune inducida por estrés, así como los impactos negativos del estrés en el comportamiento y en la función inmune adquirida de ratas36,37. Recientemente, Hill et al. 38 demostraron que la carrera voluntaria crónica fue capaz de aumentar la capacidad de síntesis de GABA en el cerebro de ratas, lo que puede implicar alteraciones en la sensibilidad al estrés durante el ejercicio.
Observamos que no hubo distinción regional significativa (VI vs. VD) en la inducción de la expresión de Hsp72. Esta observación confirma resultados reportados en estudios previos5,31. A pesar de las adaptaciones del músculo cardíaco al ejercicio ser más pronunciadas en el ventrículo izquierdo, reflejando el estrés intracelular distinto impuesto por la carga mecánica sobre la cual las fibras trabajan durante el ejercicio, todas las fibras del miocardio son reclutadas en cada latido, y el trabajo del corazón crece linealmente en función del aumento de la contractilidad y de la frecuencia cardíaca en ambos ventrículos.
Nuestros resultados evidencias que ratas también responden al estrés provocado por el ejercicio, aumentando la inducción de la expresión de Hsp72 en el miocardio. Se ha observado que la inducción de la expresión de Hsp72 en respuesta al ejercicio es mayor en ratas macho, lo que sugiere que la presencia de estrógeno en las ratas es suficiente para inhibir la expresión de Hsp7216-18. No obstante, el miocardio de las ratas hembra Sprague-Dawley mostró dos veces más Hsp72 que el de las ratas macho39, y el músculo cardíaco de ratos macho no mostró dimorfismo sexual en la expresión de Hsp72 en respuesta al choque eléctrico35.
Finalmente, a pesar de no haber evaluado los efectos de los protocolos de ejercicio en la protección cardíaca, el aumento de la expresión de Hsp72 observado aquí puede tener impactos fisiológicamente importantes en la protección del miocardio contra eventos de estrés (por ejemplo, isquemia o reperfusión). A pesar de que estudios16,18 han reportado que la respuesta de la Hsp70 al ejercicio físico agudo y crónico (carrera en cinta), mediada por hormonas específicas de sexo, resultó en cardioprotección, preferentemente en ratas macho, Chicco et al. 40 demostraron que ratas que corrieron voluntariamente por ocho semanas presentaron niveles elevados de Hsp72, los cuales estaban asociados a una mejora de la disfunción cardíaca inducida por la doxorubicina.
Conclusión
Concluimos que los programas de entrenamiento con carreras voluntaria y forzada adoptados en el presente estudio indujeron niveles distintos de expresión de Hsp72 en el miocardio de ratas Wistar.
Potencial Conflicto de Intereses
Declaro no haber conflicto de intereses pertinentes.
Fuentes de Financiación
El presente estudio fue financiado por FAPEMIG.
Vinculación Académica
No hay vinculación de este estudio a programas de postgrado.
Referencias
- 1. Li GC, Li LG, Liu YK, Mak JY, Chen LL, Lee WM. Thermal response of rat fibroblasts stably transfected with the human 70-kDa heat shock protein-encoding gene. Proc Natl Acad Sci USA. 1991; 88 (5): 1681-5.
- 2. Welch WJ. Mammalian stress response: cell physiology, structure/function of stress proteins, and implications for medicine and disease. Physiol Rev. 1992; 72 (4): 1063-81.
- 3. Locke M, Noble EG, Atkinson BG. Exercising mammals synthesize stress proteins. Am J Physiol. 1990; 258 (4 Pt 1): C723-9.
- 4. Asami S, Hirano T, Yamaguchi R, Tsurudome Y, Itoh H, Kasai H. Effects of forced and spontaneous exercise on 8-hydroxydeoxyguanosine levels in rat organs. Biochem Biophys Res Commun. 1998; 243 (3): 678-82.
- 5. Samelman TR. Heat shock protein expression is increased in cardiac and skeletal muscles of Fischer 344 rats after endurance training. Exp Physiol. 2000; 85 (1): 92-102.
- 6. Milne KJ, Noble EG. Exercise-induced elevation of HSP70 is intensity dependent. J Appl Physiol. 2002; 93 (2): 561-8.
- 7. Campisi J, Leem TH, Greenwood BN, Hansen MK, Moraska A, Higgins K, et al. Habitual physical activity facilitates stress-induced HSP72 induction in brain, peripheral, and immune tissues. Am J Physiol Regul Integr Comp Physiol. 2003; 284 (2): R520-30.
- 8. Atalay M, Oksala NK, Laaksonen DE, Khanna S, Nakao C, Lappalainen J, et al. Exercise training modulates heat shock protein response in diabetic rats. J Appl Physiol. 2004; 97 (2): 605-11.
- 9. Lunz W, Oliveira EC, Neves MT, Fontes EP, Dias CM, Natali AJ. Anabolic steroid- and exercise-induced cardiac stress protein (HSP72) in the rat. Braz J Med Biol Res. 2006; 39 (7): 889-93.
- 10. Whitham M, Fortes MB. Heat shock protein 72: release and biological significance during exercise. Front Biosci. 2008; 13: 1328-39.
- 11. Locke M, Tanguay RM, Klabunde RE, Ianuzzo CD. Enhanced postischemic myocardial recovery following exercise induction of HSP 72. Am J Physiol. 1995; 269 (1 Pt 2): H320-5.
- 12. Powers SK, Demirel HA, Vincent HK, Coombes JS, Naito H, Hamilton KL, et al. Exercise training improves myocardial tolerance to in vivo ischemia-reperfusion in the rat. Am J Physiol. 1998; 275 (5 Pt 2): R1468-77.
- 13. Demirel HA, Powers SK, Zergeroglu MA, Shanely RA, Hamilton K, Coombes J, et al. Short-term exercise improves myocardial tolerance to in vivo ischemia-reperfusion in the rat. J Appl Physiol. 2001; 91 (5): 2205-12.
- 14. Melling CW, Thorp DB, Milne KJ, Krause MP, Noble EG. Exercise-mediated regulation of Hsp70 expression following aerobic exercise training. Am J Physiol Heart Circ Physiol. 2007; 293(6):H3692-8.
- 15. Taylor RP, Harris MB, Starnes JW. Acute exercise can improve cardioprotection without increasing heat shock protein content. Am J Physiol. 1999; 276(3 Pt 2):H1098-102.
- 16. Paroo Z, Haist JV, Karmazyn M, Noble EG. Exercise improves postischemic cardiac function in males but not females: consequences of a novel sex-specific heat shock protein 70 response. Circ Res. 2002; 90(8):911-7.
- 17. Brown DA, Johnson MS, Armstrong CJ, Lynch JM, Caruso NM, Ehlers LB, et al. Short-term treadmill running in the rat: what kind of stressor is it? J Appl Physiol. 2007; 103(6):1979-85.
- 18. Thorp DB, Haist JV, Leppard J, Milne KJ, Karmazyn M, Noble EG. Exercise training improves myocardial tolerance to ischemia in male but not in female rats. Am J Physiol Regul Integr Comp Physiol. 2007; 293(1):R363-71.
- 19 Harri M, Kuusela P. Is swimming exercise or cold exposure for rats? Acta Physiol Scand. 1986; 126(2):189-97.
- 20. Moraska A, Deak T, Spencer RL, Roth D, Fleshner M. Treadmill running produces both positive and negative physiological adaptations in Sprague-Dawley rats. Am J Physiol Regul Integr Comp Physiol. 2000; 279(4):R1321-9.
- 21. Linthorst AC, Penalva RG, Flachskamm C, Holsboer F, Reul JM. Forced swim stress activates rat hippocampal serotonergic neurotransmission involving a corticotropin-releasing hormone receptor-dependent mechanism. Eur J Neurosci. 2002; 16(12):2441-52.
- 22. Shyu BC, Andersson SA, Thoren P. Spontaneous running in wheels: a microprocessor assisted method for measuring physiological parameters during exercise in rodents. Acta Physiol Scand. 1984; 121(2):103-9.
- 23. Rupp H. Differential effect of physical exercise routines on ventricular myosin and peripheral catecholamine stores in normotensive and spontaneously hypertensive rats. Circ Res. 1989; 65(2):370-7.
- 24. Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976; 72:248-54.
- 25. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227: 680-5.
- 26. Eikelboom R, Mills R. A microanalysis of wheel running in male and female rats. Physiol Behav. 1988; 43(5):625-30.
- 27. Brooks GA, White TP. Determination of metabolic and heart rate responses of rats to treadmill exercise. J Appl Physiol. 1978; 45(6):1009-15.
- 28. Brooks GA, Fahey TD. Exercise physiology: human bioenergetics and its applications. New York: Macmillan; 1984.
- 29 Chang FL, Huang TH, Hsieh SS, Yang RS, Lin CC. The effects of different endurance training intensity on systematic and peripheral citrate synthase activity. Med Sci Sports Exerc. 2001; S33:295.
- 30 Huang TH, Lin SC, Chang FL, Hsieh SS, Liu SH, Yang RS. Effects of different exercise modes on mineralization, structure, and biomechanical properties of growing bone. J Appl Physiol. 2003; 95(1):300-7.
- 31. Noble EG, Moraska A, Mazzeo RS, Roth DA, Olsson MC, Moore RL, et al. Differential expression of stress proteins in rat myocardium after free wheel or treadmill run training. J Appl Physiol. 1999; 86(5):1696-701.
- 32. Noble EG. Heat shock proteins and their induction with exercise. In: Locke M, Noble EG, editors. Exercise and stress response: the role of stress proteins. Barcelona: Boca Raton; 2002. p. 43-78.
- 33. Rodnick KJ, Reaven GM, Haskell WL, Sims CR, Mondon CE. Variations in running activity and enzymatic adaptations in voluntary running rats. J Appl Physiol. 1989; 66(3):1250-7.
- 34. Nickerson M, Kennedy SL, Johnson JD, Fleshner M. Sexual dimorphism of the intracellular heat shock protein 72 response. J Appl Physiol. 2006; 101(2):566-75.
- 35. Maier SF. Learned helplessness and animal models of depression. Prog Neuropsychopharmacol Biol Psychiatry. 1984; 8(3):435-46.
- 36. Moraska A, Fleshner M. Voluntary physical activity prevents stress-induced behavioral depression and anti-KLH antibody suppression. Am J Physiol Regul Integr Comp Physiol. 2001; 281(2):R484-9.
- 37. Dishman RK, Warren JM, Youngstedt SD, Yoo H, Bunnell BN, Mougey EH, et al. Activity-wheel running attenuates suppression of natural killer cell activity after footshock. J Appl Physiol. 1995; 78(4):1547-54.
- 38. Hill LE, Droste SK, Nutt DJ, Linthorst AC, Reul JM. Voluntary exercise alters GABAA receptor subunit and glutamic acid decarboxylase-67 gene expression in the rat forebrain. J Psychopharmacol. 2008; 00(00):1-12
- 39. Voss MR, Stallone JN, Li M, Cornelussen RN, Knuefermann P, Knowlton AA. Gender differences in the expression of heat shock proteins: the effect of estrogen. Am J Physiol Heart Circ Physiol. 2003; 285(2):H687-92.
- 40. Chicco AJ, Schneider CM, Hayward R. Voluntary exercise protects against acute doxorubicin cardiotoxicity in the isolated perfused rat heart. Am J Physiol Regul Integr Comp Physiol. 2005; 289(2):R424-R31.
Fechas de Publicación
-
Publicación en esta colección
06 Ene 2010 -
Fecha del número
Nov 2009
Histórico
-
Acepto
02 Dic 2008 -
Recibido
26 Set 2008 -
Revisado
03 Nov 2008