HIPERTENSÃO ARTERIAL NA GESTAÇÃO
17. Hipertensão arterial na gestação
Cláudia Maria Vilas Freire; Citânia Lúcia Tedoldi
17.1 - introdução
A hipertensão arterial (HA) é uma doença considerada problema de saúde pública pelo seu elevado custo médicosocial. A prevalência varia conforme a faixa etária, sexo, raça, obesidade e presença de patologias associadas, como diabetes e doença renal. Nas mulheres em idade procriativa a prevalência vai de 0,6 a 2,0%, na faixa etária de 18 a 29 anos, e de 4,6 a 22,3%, na faixa etária de 30 a 39 anos1,2. Diferente dos países desenvolvidos, a HA na gestação permanece a primeira causa de morte materna direta no Brasil (37%), sendo a proporção maior nas regiões Norte e Nordeste em relação ao Sudeste, Sul e Centro-Oeste3.
17.2 - Classificação
A classificação das doenças hipertensivas na gestação mais aceita em nosso meio é a adotada pelo Grupo de Estudo da Hipertensão Arterial na Gravidez do Programa Nacional de Hipertensão Arterial (EUA) e pela Federação Brasileira de Ginecologia e Obstetrícia - FEBRASGO (BR). Além de utilizada como uma base de acesso à grávida hipertensa, também guia o planejamento de seus cuidados4,5,6.
1) Hipertensão crônica (HC).
2) Pré-eclâmpsia (PE)/Eclâmpsia (E).
3) Pré-eclâmpsia superposta à hipertensão crônica.
4) Hipertensão gestacional (HG).
17.2.1 - Hipertensão crônica
É a hipertensão que está presente antes da gravidez ou diagnosticada antes de 20 semanas de gestação. É considerada hipertensão quando a pressão arterial sistólica (PAS) é > 140 mmHg e/ou a pressão arterial diastólica (PAD) > 90 mmHg, medidas em duas ocasiões com 4 horas de intervalo. Tal diagnóstico é mais difícil de ser realizado em mulheres hipertensas sem diagnóstico prévio, pela presença do descenso fisiológico da pressão arterial (PA), que ocorre na primeira metade da gestação.
Também é considerada HC aquela diagnosticada pela primeira vez durante a gravidez e que não normaliza no pósparto. A definição dos níveis de 140/90 mmHg como ponto de corte para hipertensão deve ser avaliada com cuidado em pacientes jovens abaixo de 18 anos, onde os valores podem ser menores4,5.
Diagnóstico - O diagnóstico de hipertensão é baseado na medida adequada da PA > 140/90 mmHg, definida arbitrariamente. O Grupo de Estudos de Hipertensão na Gravidez recomenda considerar a fase V de Korotkoff (desaparecimento dos sons) para diagnóstico da PA diastólica. No entanto, na mulher grávida, devido à vasodilatação sistêmica fisiológica, muitas vezes a PA diastólica pode chegar a zero6,7.
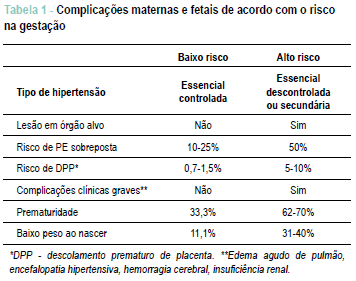
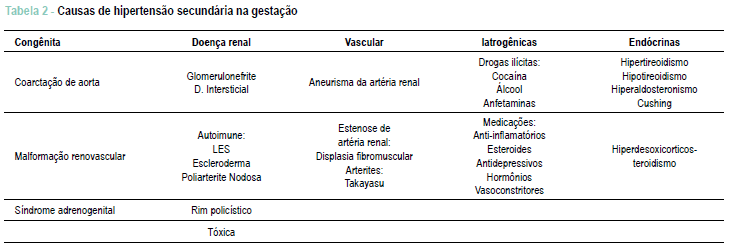
Classificação - É classificada em hipertensão essencial ou primária (na maioria das vezes), ou em secundaria (em 10% dos casos), considerando a etiologia e, de acordo com os níveis tensionais, em leve e grave (PA > 160/110 mmHg)5,6,7. Tal classificação é importante pois vai identificar a paciente de maior ou menor risco durante a gestação, além de orientar na conduta (vide Tabela 1).
A paciente pode ser classificada como de baixo risco no início da gestação e evoluir para alto risco se apresentar PE sobreposta ou hipertensão descontrolada5. As causas de hipertensão secundária são descritas na Tabela 2.
A duração da hipertensão > 4 anos e a história prévia de PE aumentam o risco de PE sobreposta, e a presença de insuficiência renal ou disfunção ventricular aumentam o risco de complicações clínicas graves, com piora do prognóstico materno e fetal5.
A PE sobreposta deve ser suspeitada quando a paciente sem proteinúria antes das 20 semanas de idade gestacional (IG) passa a apresentar proteinúria > 0,3 g/24h, ou aquela com proteinúria patológica prévia que após as 20 semanas apresenta aumento importante da PA (mesmo que previamente controlada com medicações), associada a sintomas tipo cefaleia, visão borrada, dor epigástrica e/ou alterações laboratoriais, como aumento de enzimas hepáticas e trombocitopenia. As complicações perinatais são maiores em pacientes com hipertensão crônica do que na população obstétrica em geral (a mortalidade perinatal aumenta em 3-4 vezes) e são agravadas com o desenvolvimento de PE sobreposta4,5.
Exames complementares maternos recomendados antes da gestação 4,5,6
1) Exames laboratoriais que avaliem a função dos órgãos que costumam ser comprometidos com a hipertensão crônica, a fim de servirem de parâmetro basal. Devem incluir EQU, urocultura, proteinúria de 24 horas, hemograma completo, função renal com eletrólitos e teste de tolerância à glicose.
2) ECG e ecocardiograma naquelas com HC por vários anos, para avaliação de hipertrofia ventricular esquerda e análise da função sistodiastólica ventricular.
3) Exames específicos na investigação de hipertensão secundária, como feocromocitoma (crises paroxísticas de hipertensão, hiperglicemia e sudorese), hiperaldosteronismo primário (hipertensão e hipocalemia) ou estenose de artéria renal. Além de exames bioquímicos, podem ser necessários exames de imagem, como tomografia computadorizada ou ressonância nuclear magnética.
Avaliação laboratorial após a metade da gestação (20 semanas)
Hematócrito e hemoglobina - O surgimento de hemoconcentração sinaliza para o diagnóstico de PE sobreposta (Ht > 36%), além de ser um indicador de gravidade. Valores diminuídos podem significar hemólise associada;
Plaquetas: Trombocitopenia sugere PE grave;
Proteinúria de 24 horas - Surgimento de proteinúria sugere PE sobreposta;
Ácido úrico - Quando aumentado, sugere PE sobreposta (> 4,5 mg/dl);
Creatinina sérica - Quando aumentada, e principalmente se associada à oligúria, sugere PE grave;
Transaminases - Aumentadas sugerem comprometimento hepático da PE;
Desidrogenase lática - Aumenta na presença de hemólise associada à PE;
Provas da coagulação - Alteram quando ocorre coagulopatia de consumo.
Avaliação do desenvolvimento e bem-estar fetal
Ultrassonografia - Deve sempre ser realizada com o objetivo de avaliar a biometria e o crescimento fetal em IG entre 16 e 20 semanas e repetida entre 28 e 32 semanas (conforme a gravidade materna), assim como após cada 3-4 semanas até o termo5. Quando é diagnosticada PE sobreposta, aumenta em 30% o risco de insuficiência placentária e consequente crescimento intrauterino restrito (CIUR), que é geralmente assimétrico. Além do crescimento fetal comprometido, o método permite avaliar a redução do líquido amniótico8.
Dopplervelocimetria - Exame que avalia a circulação uteroplacentária por meio da análise das curvas ao Doppler de artérias uterinas e cerebrais no segundo trimestre. Apesar de não ter sido validado como teste preditor de risco de PE, pode estar indicado nos casos de risco muito elevado para esta complicação e que poderiam se beneficiar de alguma medida terapêutica preventiva efetiva9. A confirmação de fluxo reverso na artéria umbilical identifica gestações que se beneficiam de monitorização fetal mais freqüente, que é feita por meio dos testes tradicionais de avaliação do bem-estar fetal (cardiotocografia e o perfil biofísico fetal).
Cardiotocografia - Monitoriza a frequência cardíaca fetal e as contrações uterinas. Apesar de poder sofrer interferência de vários fatores, pode evidenciar hipóxia e acidose fetal. Os resultados são mais fidedignos quando o exame é realizado a partir da 32ª semana de IG, e com frequência até diária nos casos mais graves. Não fornece informações preditivas10.
Perfil biofísico fetal - Baseado em 4 parâmetros de bemestar fetal (movimento, tônus, respiração e líquido amniótico), complementa a cardiotocografia e auxilia na decisão do melhor momento do parto. Em casos estáveis, é realizado uma vez por semana e nos graves pode ser necessário até diariamente10.
Objetivos do tratamento - O principal objetivo do tratamento é reduzir os riscos maternos e conseguir um bom resultado perinatal. Em não gestantes com HA crônica, o controle adequado da PA a longo prazo reduz a morbimortalidade cardiovascular. Na gestação, como a duração do tratamento é por período menor, é preferivel manter níveis de PA um pouco acima dos preconizados para uma adequada proteção materna a longo prazo e garantir o bem-estar fetal, evitando hipotensão e hipoperfusão placentária5.
Como avaliar a PA - Com as pacientes em repouso e sentadas em ângulo de 45º, a PA deve ser aferida sempre no mesmo braço, com manguito apropriado à circunferência braquial e na altura do coração. Considerar como PA diastólica a fase V de Korotkoff 8 (IA).
A maioria das hipertensas de baixo risco não necessita de medicação anti-hipertensiva durante a primeira metade da gestação devido à redução fisiológica da PA neste período11. O tratamento deve ser iniciado quando ocorrer aumento pressórico que possa provocar complicações maternas, como AVC, insuficiência cárdica ou insufuciência renal. O objetivo do tratamento é manter a PAS entre 140-150 mmHg e a PAD entre 90-100 mmHg. Entretanto, aquelas pacientes que apresentam lesão de órgão-alvo (insuficiência renal, diabetes com comprometimento vascular, disfunção ventricular esquerda) e níveis pressóricos nem tão elevados, podem ter um agravamento dos órgãos afetados durante a gestação. Devem ser orientadas antes da concepção sobre a possibilidade de que haja insuficiência cardíaca, piora da função renal (necessitando de diálise) e até evolução para óbito durante a gestação. Nessas pacientes, o controle pressórico deve ser mais rigoroso, sendo recomendada manutenção da PAS em 140 mmHg e da PAD em 90 mmHg. Na maioria das vezes, necessitam de acompanhamento multidisciplinar, além de unidades especializadas e atendimento terciário por ocasião do parto5.
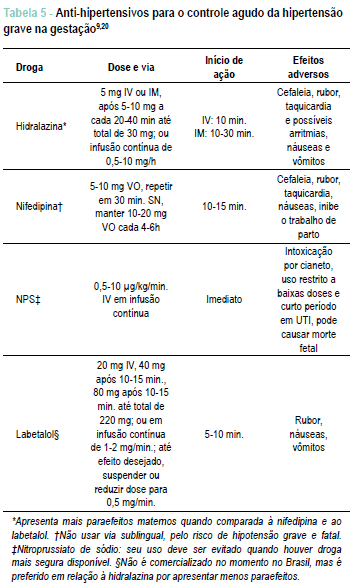
Drogas anti-hipertensivas - A falta de estudos randomizados que possam avaliar os riscos e benefícios dos anti-hipertensivos na gestação faz com que a escolha se baseie mais na experiência pessoal e no consenso de especialistas. Não existe uniformidade de conduta nas sociedades nacionais, nem nas internacionais5. As drogas mais utilizadas e comercializadas no Brasil estão detalhadas no capítulo 6 e algumas delas apresentadas na Tabela 3. Apesar do labetalol (betabloqueador não seletivo com ação vascular também α1 bloqueadora) não estar mais sendo comercializado no Brasil, será citado neste capítulo por ter sua eficácia e segurança comparadas às da metildopa para uso crônico, e para uso uso IV agudo ser preferido em relação à hidralazina, por apresentar menos efeitos colaterais14.
Os inibidores da ECA (IECA) e os bloqueadores dos receptores da angiotensina II (BRA) devem ser suspensos antes da concepção pelo efeito deletério fetal, mas podem ser reiniciados após o parto. O atenolol, quando utilizado desde os dois primeiros trimestres, se associa à redução do peso fetal, complicação que não tem sido observada com o pindolol e o metoprolol, apesar de serem escassas as publicações5. Os diuréticos tiazídicos não são prejudiciais ao feto, mas por reduzirem o volume plasmático materno podem agravar a hemoconcentração quando a HC complica com PE sobreposta. Além disso, podem provocar hiperuricemia e prejudicar a valorização de um dos exames laboratoriais que altera mais precocemente na PE, o de ácido úrico, e cujo aumento costuma se relacionar com a gravidade da doença. No entanto, o uso de tiazídico em baixa dosagem (hidroclorotiazida 12,5 a 25 mg/dia) pode ser útil quando associado a outro anti-hipertensivo, como a metildopa, naquelas que não controlam a PA com monoterapia12,13,14.
A metildopa é a droga mais utilizada na gestação, seguida pela nifedipina e o labetalol. Entre os betabloqueadores, o pindolol parece ser o mais seguro para o feto15; no entanto, a ação simpaticomimética intrínseca, característica desta medicação, faz com que não seja tão efetivo no controle da FC, da angina e de arritmias maternas16. Tal ação deve ser levada em consideração no tratamento de hipertensas com cardiopatia isquêmica e/ou arritmia associada, situação em que seria benéfico o uso do metoprolol. A associação de drogas é necessária em casos mais graves e deve se ter o cuidado de optar por anti-hipertensivos que tenham mecanismos de ação diferentes13.
Em hipertensas crônicas, o uso de anti-hipertensivos e a manutenção da PA dentro dos níveis adequados colaboram para se evitar complicações cardiovasculares, mas não modificam o risco de PE sobreposta14. Além disso, apesar dos vários estudos que tentaram identificar marcadores a fim de predizer ou detectar a PE, nenhum ainda é isoladamente específico ou preditivo para ser utilizado na prática clínica17.
Prevenção da pré-eclâmpsia - Nos últimos anos, houve tentativas no uso de aspirina em baixas doses, cálcio e vitaminas C+E, a fim de prevenir ou reduzir a incidência ou gravidade da PE em pacientes de risco. Uma metanálise de estudos com uso de aspirina evidenciou uma redução muito pequena de casos de PE e o NNT ("number needed to treat" ou "número necessário para tratar") dependia mais das características basais de risco da população estudada para redução de um caso. Nos casos de hipertensas crônicas, o uso de aspirina não comprovou redução de risco. A conclusão é que a indicação de seu uso profilático deva ser individualizada. A suplementação de cálcio também não comprovou ser eficaz, em revisão conduzida pela FDA nos Estados Unidos. E estudos multicêntricos, randomizados com suplementação vitamínica, além de também não comprovarem redução da incidência de PE, se associaram a aumento de eventos adversos maternos e fetais17.
Resumo das orientações
1) Pacientes com HA leve e sem comprometimento de órgão alvo geralmente não necessitam de medicação anti-hipertensiva na primeira metade da gestação (IC).
2) O uso de anti-hipertensivos está recomendado quando a PAS estiver > 150 mmHg e a PAD em 90-100 mmHg (IC).
3) A escolha do anti-hipertensivo é individualizada (IC).
4) São contraindicados para uso em qualquer período da gestação os inibidores da ECA e os antagonistas dos receptores da angiotensina (IIIA).
5) Pacientes com HA e comprometimento de órgão-alvo necessitam de controle mais rigoroso da PA (mantendo em 140/90 mmHg) e apresentam maior risco de complicações maternas e fetais (IB).
6) Como é alta a incidência de PE sobreposta (25%-50%), as pacientes devem ser adequadamente monitoradas a partir das 20 semanas de IG para a detecção precoce desta complicação (IB).
7) Ainda não existe um marcador validado que seja específico e preditivo de PE (IIIA).
8) Hipertensas crônicas não têm redução de PE sobreposta com o uso de aspirina em baixas doses (IIIA).
17.2.2 - Pré-eclâmpsia (PE)/Eclâmpsia (E)
A PE é uma síndrome caracterizada por comprometimento clínico generalizado heterogêneo e alterações laboratoriais. Os achados clínicos podem se manifestar tanto como uma síndrome materna (hipertensão, proteinúria e/ou sintomas variados) quanto como uma síndrome fetal (CIUR), ou ainda ambos17. Ela ocorre em 5% a 8% das gestações e é a principal causa de morte materna e perinatal nos países em desenvolvimento, sendo que os resultados gestacionais dependem dos seguintes fatores9:
1) IG em que a doença é diagnosticada;
2) Gravidade da doença;
3) Qualidade do atendimento;
4) Presença de outras doenças pré-existentes.
Classificação - É classificada em leve e grave de acordo com os achados clínicos e laboratoriais.
A) PE leve
PA > 140/90 mmHg após 20 semans de IG em paciente normotensa antes da gestação;
Proteinúria de 1+ em fita (duas amostras de urina com 4-6 horas de intervalo que se correlaciona a 30mg/dl em amostra de urina, quando excluída presença de infecção urinária), mas confirmada com > 0,3 g em urina de 24 horas6;
Sintomas cerebrais (cefaleia, tonturas, visão borrada, escotomas), ou digestivos (dor epigástrica ou no quadrante superior D, náuseas ou vômitos), ou trombocitopenia e alteração de enzimas hepáticas, mesmo na ausência de proteinúria9.
B) PE grave, se constatado > 1 dos seguintes critérios 4,6,9
PA > 160/110 mmHg, em duas aferições com 6 horas de intervalo e com a paciente em repouso;
Proteinúria de 24h > 5 g ou > 3+ em fita, em duas amostras coletadas com intervalo de 4 horas;
Oligúria, com volume urinário < 500 ml/24h;
Insuficiência renal (creatinina sérica > 1,2 mg/dl em paciente com função renal normal prévia);
Distúrbios visuais ou cerebrais (cefaleia, visão borrada, cegueira, alteração do estado mental) persistentes;
Edema pulmonar ou cianose;
Dor epigástrica ou no quadrante superior direito persistente;
Insuficiência hepática (SGOT ou SGPT > 70 UI//L);
Trombocitopenia (plaquetas < 100.000/µL) e/ou evidência de anemia hemolítica microangiopática);
Síndrome HELLP;
Restrição de crescimento fetal.
C) Eclâmpsia
É o surgimento de convulsões em pacientes com PE ou HG. Está associada ao aumento da mortalidade materna e frequentemente se acompanha de hemorragia cerebral6. Em estudo desenvolvido em 6 capitais brasileiras, onde foram avaliadas 4.892 mulheres, foi observado uma frequência total de distúrbios hipertensivos na gravidez de 7,5%, sendo 2,3% classificadas como PE/E; 4,0% como HC; 0,5% como PE sobreposta à HC; e 0,7% como HG17. A PE foi mais frequente em nulíparas, enquanto a HC prevaleceu em mulheres não brancas, obesas e com idade > 35 anos18. Acredita-se que a patogênese da PE seja diferente quando são comparadas nulíparas e portadoras de doença vascular (diabetes, PE prévia, gestação multifetal etc.)9. E apesar de extensa linha de pesquisa na área, sua causa permanece desconhecida15.
As complicações maternas e neonatais mais frequentes são9:
Maternas:
1) DPP (1-4%);
2) Coagulopatia/Síndrome HELLP (10-20%);
3) Edema pulmonar/aspiração (2-5%);
4) Insuficiência renal aguda (1-5%);
5) Eclâmpsia (< 1%)*;
6) Insuficiência hepática ou hemorragia (< 1%);
7) AVC;
8) Morte;
9) Morbidade cardiovascular a longo prazo.
* No Brasil ainda é grande a mortalidade materna por eclâmpsia, atribuída à falta de assistência pré-natal. Em uma maternidade de referência, em Fortaleza, foi constatado que, do total de óbitos maternos, 41,2% foram secundários à hipertensão, entre os quais 64,1% por eclâmpsia. A maioria ocorreu nas primeiras horas após a chegada ao hospital19.
Neonatais:
1) Prematuridade (15-67%);
2) Restrição de crescimento fetal (10-25%);
3) Hipóxia com lesão neurológica (< 1%);
4) Morte perinatal (1-2%);
5) Morbidade cardiovascular a longo prazo associada ao baixo peso ao nascer (P < 2.500 g).
Tratamento - O especialista que conduz os casos de PE é o obstetra, e o cardiologista colabora no manejo dos antihipertensivos e no tratamento das complicações cardiológicas, pois o tratamento definitivo da doença é a interrupção da gestação. Quando é confirmado o diagnóstico, é necessário considerar a IG, o estado clínico materno e o bem-estar fetal - a decisão do momento adequado para o parto vai se basear nestes três parâmetros4.
PE leve com gestação a termo (> 38 semanas de IG)  promover o parto.
promover o parto.
PE leve e com IG < 38 semanas  acompanhamento ambulatorial ou em ambiente hospitalar (preferível), com monitoração clínica e laboratorial materna e avaliação do bem-estar fetal periódicas. A PE leve pode progredir rapidamente para a forma grave ou para eclâmpsia e, em vista disto, a paciente deve ser orientada a comunicar sempre que apresentar sintomas cerebrais ou digestivos, redução do volume urinário ou redução dos movimentos fetais. É recomendado repouso relativo, adoção do decúbito lateral esquerdo (para aumentar retorno venoso) e, apesar de geralmente as pacientes apresentarem edema generalizado, não é recomendada restrição de sal, nem uso de diuréticos4. Na PE, o volume plasmático está reduzido e existe uma tendência à hemoconcentração, que poderia se agravar com o uso de diurético, estimulando o sistema renina-angiotensina e aumentando a PA20. Evoluindo para PE grave, é imperativa a internação hospitalar 4,13.
acompanhamento ambulatorial ou em ambiente hospitalar (preferível), com monitoração clínica e laboratorial materna e avaliação do bem-estar fetal periódicas. A PE leve pode progredir rapidamente para a forma grave ou para eclâmpsia e, em vista disto, a paciente deve ser orientada a comunicar sempre que apresentar sintomas cerebrais ou digestivos, redução do volume urinário ou redução dos movimentos fetais. É recomendado repouso relativo, adoção do decúbito lateral esquerdo (para aumentar retorno venoso) e, apesar de geralmente as pacientes apresentarem edema generalizado, não é recomendada restrição de sal, nem uso de diuréticos4. Na PE, o volume plasmático está reduzido e existe uma tendência à hemoconcentração, que poderia se agravar com o uso de diurético, estimulando o sistema renina-angiotensina e aumentando a PA20. Evoluindo para PE grave, é imperativa a internação hospitalar 4,13.
PE grave em IG < 23 semanas  interromper a gestação9.
interromper a gestação9.
PE grave entre 23 e 34 semanas de IG, indicado controle da PA (anti-hipertensivos se PA > 160 mmHg/110 mmHg ou PAM > 125 mmHg), corticoide para acelerar a maturidade pulmonar fetal (vide capítulo 5), sulfato de magnésio para evitar convulsões e monitoração materna e fetal diárias, na tentativa de prolongar a gestação até IG de 34 semanas. Os exames necessários e a frequência com que serão repetidos dependerá da gravidade e da(s) complicação(ões) apresentada(s). O objetivo de prolongar a gestação seria melhorar os resultados perinatais, mas com o surgimento de algum sinal ou sintoma de gravidade, a gestação deve ser interrompida. As indicações para interrupção da gestação estão relacionadas na Tabela 321.
PE grave e com IG > 34 semanas  estabilizar paciente e interromper a gestação9,21.
estabilizar paciente e interromper a gestação9,21.
Eclâmpsia - É definida como o surgimento de convulsão em portadora de HG ou PE9. A maioria das convulsões eclâmpticas ocorrem antes do parto (67%) e, entre as que ocorrem após o parto, cerca de 79% surgem depois de 48 horas (3-14 dias). É fundamental que as pacientes com PE sejam orientadas sobre a possibilidade desta complicação tardia na alta hospitalar. Elas devem ter a capacidade de reconhecer os sinais premonitórios (se presentes) e procurar recurso especializado com a maior brevidade possível22.
Sulfato de magnésio - É a droga de escolha tanto para o tratamento como para prevenção da convulsão eclâmptica: (IA) uma dose de ataque de 4-6 g IV em infusão por 2030 minutos, seguida por infusão IV contínua de 1-2 g/h e mantida até 24 horas após a convulsão ou parto. Convulsões recorrentes são tratadas com novo bolus de 2 g IV ou o aumento da infusão para 1,5-2 g/h (se a dosagem estiver em 1 g/h). Enquanto for utilizado, a paciente deve ser monitorada em relação ao débito urinário, reflexos patelares, frequência respiratória e saturação de oxigênio8,23. O magnésio plasmático deve ser mantido entre 4-7 mEq/l e dosado na presença de insuficiência renal. Na suspeita de intoxicação por sulfato de magnésio, deve ser utilizado gluconato de cálcio 1 g IV (10 ml de solução a 10%) em dois minutos24.
O risco de convulsão na PE leve, mesmo sem profilaxia, é muito baixo (1/200), não sendo indicado o uso rotineiro do sulfato de magnésio. Na PE grave, o uso profilático reduz o risco de eclâmpsia em 60% dos casos (RR 0,39, IC 95%, 0,28-0,55) e as pacientes que mais se beneficiam são aquelas com sintomas de eminência de eclâmpsia (cefaleia intensa, visão borrada ou dor epigástrica), onde o NNT é de 1/36. A prevenção da convulsão evita as suas complicações (trauma materno, aspiração, insuficiência respiratória, peneumonia), mas não as complicações da doença, como edema pulmonar, AVC, insuficiência hepática e/ou renal.
Para uso na hora do parto, a infusão deve ser iniciada no início do trabalho de parto, ou uma hora antes da cesárea, e mantida até 24 horas após o procedimento23.
Indicações de avaliação cerebral complementar por método de imagem - Método de imagem (ressonância nuclear magnética ou angioressonância) está indicado naquelas pacientes que fazem comprometimento neurológico focal ou coma prolongado, ou naquelas com convulsão de apresentação atípica (antes das 20 semanas de IG ou > 48 horas após o parto, ou convulsão refratária à terapia adequada com sulfato de magnésio), a fim de excluir complicação neurológica associada25.
17.2.2 -Pré-eclâmpsia superposta à hipertensão crônica
É o surgimento de proteinúria (> 0,3 g/24h) após a IG de 20 semanas em portadora de HC, ou um aumento adicional da proteinúria em quem já apresentava aumento prévio, ou ainda um aumento súbito da PA em quem apresentava níveis controlados previamente, ou alteração clínica ou laboratorial característica de PE4. O manejo segue o da PE descrito anteriormente.
17.2.3 - Hipertensão gestacional
É o aumento da PA que surge após as 20 semanas de IG e sem proteinúria. Pode representar uma PE que não teve tempo de desenvolver proteinúria, ou uma hipertensão transitória se a PA retornar ao normal após 12 semanas do parto, ou ainda uma HC se a PA persistir elevada4.
Implicações clínicas da classificação - Tanto a apresentação como a evolução da PE é muito variável. A maioria das pacientes pode apresentar a forma leve e não progredir para a grave. No entanto, em alguns casos, a progressão para a forma grave pode ser acelerada, evoluindo em dias ou até horas. Como a grande importância do tratamento é evitar a morbimortalidade materna e perinatal, principalmente até o momento do parto, mesmo quando diagnosticadas como portadoras da forma leve, as pacientes devem ser monitoradas continuamente4.
Importância da relação entre a hipertensão na gravidez e o risco cardiovascular futuro materno e fetal
Risco materno - A hipertensão na gravidez pode induzir alterações metabólicas e vasculares a longo prazo, associadas ao aumento do risco cardiovascular. Mulheres com PE têm 4 vezes mais chances de desenvolver HA crônica e quase duas vezes maior risco de doença arterial coronariana, AVC e tromboembolismo venoso num intervalo de tempo de até 14 anos após a gestação considerada. As pacientes que fazem PE precoce são as de maior risco. Tal relação reflete a possibilidade de uma causa comum ou um efeito a longo prazo do desenvolvimento da doença. Portanto, mulheres que desenvolvem PE devem ter seu perfil de risco cardiovascular avaliado depois de 6 meses do parto e iniciar com medidas preventivas eficazes com a maior precocidade possível26.
Risco fetal -A restrição de crescimento intrauterino é reconhecida como grande fator de risco de desenvolvimento de aterosclerose precoce. E a síndrome da resistência à insulina parece ser a ligação de um ambiente intrauterino adverso, como o que ocorre na PE grave e compromete o crescimento fetal, com o comprometimento da saúde dessas crianças na vida adulta9. Em vista disso, neonatos com baixo peso também devem ser avaliados precocemente e orientados a manter um estilo de vida saudável desde a infância.
- 1. Debert-Ribeiro MB, Ribeiro AB, Stabile Neto C. Hypertension and economic activities in São Paulo, Brazil. Hypertension. 1981; 6 (Suppl. II): 233-7.
- 2. Lolio CM. Prevalência de hipertensão arterial no município de Araraquara, SP, Brasil, em 1987. [Tese]. São Paulo: Faculdade de Medicina da USP; 1988.
- 3. Laurenti R, Jorge MHPM, Gotlieb SLD. A mortalidade materna nas capitais brasileiras. Rev Bras Epidemiol. 2004; 7 (4): 449-60.
- 4. Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Am J Obstet Gynecol. 2000; 183: S1-S22.
- 5. Sibai BM. Chronic hypertension in pregnancy. Obstet Gynecol. 2002; 100: 369-77.
- 6. ACOG. Practice Bulletin. Diagnosis and management of preeclampsia and eclampsia. Obstet Gynecol. 2002; 99 (1): 159-67.
- 7. Sociedade Brasileira de Cardiologia. IV Diretrizes brasileiras de hipertensão arterial. Arq. Bras. Cardiol. 2004; 82 (supl. 4): 1-14.
-
8Royal College of Obstetricians and Gynaecologists. Guideline n. 10 (A) 2006. The management of severe pre-eclampsia/eclampsia. London: RCOG; 2006.
- 9. Sibai B, Dekker G, Kupferminc M. Preeclampsia. Lancet. 2005; 365: 785-99.
- 10. Spong CY. Antepartum fetal monitoring. In: Queenan JT. (editor). Management of high-risk pregnancy. 4th ed. Malden: Blackwell Science; 1999. p. 158-66.
- 11. James PR, Nelson-Pierce C. Management of hypertension before, during and after pregnancy. Heart. 2004; 90: 1499-504.
- 12. Briggs GG, Freeman RK, Yaffe SJ. (editors). Drugs in pregnancy and lactation. 6th ed. Philadelphia: Lippincot Williams & Wilkins; 2002.
- 13. Kahhale S, Zugaib M. (editors). Síndromes hipertensivas na gravidez. Rio de Janeiro: Atheneu; 1995.
- 14. Podymow T, August P. Update on the use of antihypertensive drugs in pregnancy. Hypertension. 2008; 51: 960-9.
- 15. Rasanen J, Jouppila P. Uterine and fetal hemodynamics and fetal cardiac function after atenolol and pindolol infusion: a randomized study. Eur J Obstet Gynecol Reprod Biol. 1995; 62: 195-201.
- 16. Libby P, Bonow RO, Mann DL, Zipes DP. (editors). Braunwald's heart disease: a textbook of cardiovascular medicine. 8th ed. Philadelphia: Elsevier; 2007.
- 17. Sibai BM. Hypertensive disorders of pregnancy: the United States perspective. Curr Opin Obstet Gynecol. 2008; 20: 102-6.
- 18. Gaio DS, Schmidt MI, Duncan BB, Nucci LB, Matos MC, Branchtein L. Hypertensive disorders in pregnancy: frequency and associated factors in a cohort ob Brazilian women. Hypertens Pregnancy. 2001; 20: 269-81.
- 19. Bezerra EHM, Alencar Junior CA, Feitosa RFG, Carvalho AFA. Mortalidade materna por hipertensão: índice e análise de suas características em uma maternidade-escola. Rev Bras Ginecol Obstet. 2005; 27 (9): 548-53.
- 20. Frishman WH, Schlocker SJ, Awad K, Tejani N. Pathophysiology and medical management of systemic hypertension in pregnancy. Cardiol Rev. 2005; 13 (6): 274-84.
- 21. Sibai BM, Barton JR. Expectant management of severe preeclampsia remote from term: patient selection, treatment and delivery indications. Am J Obstet Gynecol. 2007; 196: 514.e1-514.e9.
- 22. Chames MC, Livingston JC, Ivester TS, Barton JR, Sibai BM. Late postpartum eclampsia: a preventable disease? Am J Obstet Gynecol. 2002; 186: 1174-7.
- 23. Sibai BM. Magnesium sulfate prophylaxis in preeclampsia: lessons learned from recent trials. Am J Obstet Gynecol. 2004; 190: 1520-6.
- 24. Clark SL, Cotton DB, Hankins GDV, Phelan JP. (editors). Critical care obstetrics. 3rd ed. Malden: Blackwell Scientific Publications; 1997. p.251-89.
- 25. Sibai BM. Diagnosis, prevention and management of eclampsia. Obstet Gynecol. 2005; 105: 402-10.
- 26. Chandiramani M, Shennan A. Hypertensive disorders of pregnancy: a UK-based perspective. Curr Opin Obstet Gynecol. 2008; 20: 96-101.
Datas de Publicação
-
Publicação nesta coleção
02 Ago 2010 -
Data do Fascículo
Dez 2009