DIRETRIZES
III Diretriz Brasileira de Insuficiência Cardíaca Crônica
COORDENADOR DE NORMATIZAÇÕES E DIRETRIZES DA SBC
Jadelson Pinheiro de Andrade
AUTORES
Edimar Alcides BocchiI, 1 1 Coordenador geral da III Diretriz de IC crônica ; Fabiana Goulart Marcondes BragaI, 2 2 Comissão de Redação e planejamento ; Silvia Moreira Ayub FerreiraI, 2 2 Comissão de Redação e planejamento ; Luis Eduardo Paim RohdeII, 3 3 Coordenadores de grupos. ; Wilson Alves de OliveiraIII, 3 3 Coordenadores de grupos. ; Dirceu Rodrigues de AlmeidaIV, 3 3 Coordenadores de grupos. ; Maria da Consolação Vieira MoreiraV, 3 3 Coordenadores de grupos. ; Reinaldo Bulgarelli BestettiVI, 3 3 Coordenadores de grupos. ; Solange BordignonVII, 3 3 Coordenadores de grupos. ; Clério AzevedoVIII; Evandro Mesquita TinocoIX; Ricardo Mourilhe RochaX; Victor Sarli IssaI; Almir FerrazXI; Fátima das Dores CruzI; Guilherme Veiga GuimarãesI; Vanessa dos Santos Pereira MonteraXII; Denilson Campos AlbuquerqueX; Fernando BacalI; Germano Emilio Conceição SouzaI; João Manoel Rossi NetoXI; Nadine Oliveira ClausellII; Silvia Marinho MartinsXIII; Alexandre SicilianoXIV; João David de Souza NetoXV; Luis Felipe MoreiraI; Ricardo Alkmim TeixeiraI; Lídia Zytynski MouraXVI; Luís Beck-da-SilvaII; Salvador RassiXVII; Estela AzekaI; Estela HorowitzVII; Felix RamiresI; Marcus Vinicius SimõesXVIII; Renato Barroso Pereira de CastroXVIII; Vera Maria Cury SalemiI; Humberto Villacorta JuniorIX; José Henrique VilaXIX; Ricardo SimõesXX; Francisco AlbanesiX; Marcelo Westerlund MonteraXII, XIV, 3 3 Coordenadores de grupos.
INSTITUIÇÕES
IInstituto do Coração do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo
IIHospital de Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul
IIIFaculdade de Ciências Médicas de Pernambuco, Universidade de Pernambuco
IVEscola Paulista de Medicina, Universidade Federal de São Paulo
VFaculdade de Medicina, Universidade Federal de Minas Gerais
VIFaculdade de Medicina de São José do Rio Preto
VIIInstituto de Cardiologia, Fundação Universitária de Cardiologia do Rio Grande do Sul
VIIIRede Labs D'Or, Rio de Janeiro
IXUniversidade Federal Fluminense, Rio de Janeiro
XFaculdade de Ciencias Médicas, Universidade do Estado do Rio de Janeiro
XIInstituto Dante Pazzanese de Cardiologia, São Paulo
XIISanta Casa de Misericórdia, Rio de Janeiro
XIIIPronto Socorro Cardiológico de Pernambuco, Universidade de Pernambuco
XIVHospital Pró Cardíaco, Rio de Janeiro
XVHospital de Messejana, Ceará
XVIPontifícia Universidade Católica do Paraná
XVIIFaculdade de Medicina, Universidade Federal de Goiás
XVIIIFaculdade de Medicina de Ribeirão Preto, Universidade de São Paulo
XIXReal e Benemerita Sociedade de Beneficência Portuguesa, São Paulo
XXFaculdade de Ciências Médicas de Minas Gerais
Esta diretriz deverá ser citada como: Bocchi EA, Marcondes-Braga FG, Ayub-Ferreira SM, Rohde LE, Oliveira WA, Almeida DR, e cols. Sociedade Brasileira de Cardiologia. III Diretriz Brasileira de Insuficiência Cardíaca Crônica. Arq Bras Cardiol 2009;93(1 supl.1):1-71
Correspondência Correspondência: Edimar Alcides Bocchi Rua Melo Alves, 690 - 4º andar - Cerqueira Cesar São Paulo - 01417-010 dcledimar@incor.usp.br
Clique para ampliar

I. Introdução
O objetivo desta Diretriz é servir de apoio e auxiliar os médicos nas decisões referentes aos seus pacientes, elaborando orientações que podem ser úteis na prática médica. A adoção das recomendações das Diretrizes é uma ferramenta de grande valor para uma atividade médica de melhor qualidade. Entretanto, nenhuma Diretriz deve substituir a habilidade, a experiência, e o julgamento clínico de profissionais especializados que são soberanos nas suas decisões, frente a cada paciente individualmente.
Este documento inclui orientações advindas de novos avanços no manejo da insuficiência, conseqüência de resultados de estudos clínicos observacionais e randomizados, da aplicabilidade dos mesmos na prática médica diária e da experiência clínica de cada participante. Os membros desta Diretriz são integrantes do Grupo de Estudos de Insuficiência Cardíaca, cuja oportunidade de participação baseou-se no fato de serem considerados especialistas na área, e/ou terem contribuído cientificamente de maneira importante para o manejo desta síndrome no cenário brasileiro, diversidade altamente recomendável. Como a maioria dos grandes ensaios clínicos para o tratamento da Insuficiência Cardíaca não foram desenvolvidos ou idealizados no nosso meio, acreditamos que os componentes desta Diretriz terão uma visão adequada para a redação deste documento sem grau de conflito de interesses que possa influenciar as decisões.
Diretrizes são mais complexas do que a simples adoção de resultados observados em estudos clínicos randomizados ("trials"). Estes estudos traduzem as melhores evidências incorporadas pelas Diretrizes, e as Diretrizes são as arenas onde a importância clínica dos "trials" é determinada1. Apesar de algumas limitações como alto custo, organização complexa, tempo de seguimento muitas vezes curto, intervenção única, critérios de inclusão restritos (superseleção), difícil reprodução no mundo real, e impossibilidade de generalização para a população global, os ensaios clínicos representam a principal ferramenta na construção de evidências científicas para a prática clínica. Dentre suas potenciais vantagens merecem destaque a alta credibilidade, comparabilidade dos grupos testados, controle de vieses, padronização de coleta e análise de dados, interpretação simples dos resultados, e possibilidade de investigação simultânea de vários desfechos.
A Diretriz é um processo científico e social que envolve julgamento e interpretação acurados das evidências. Na determinação das indicações as relações de custo-efetividade também devem ser consideradas principlamente para tratamentos de alto custo, tomando-se por base a política de saúde pública de cada país, os recursos disponíveis, e as prioridades2. Mas uma Diretriz também tem limitações como o fato de que muitos podem advogar sob um ponto de vista particular, o que deve ser evitado. Adicionalmente segundo Miguel Unamuno (1898, De Mi Pais - Madri - España) "La unanimidad es uma inseguridad relativa e incierta", principalmente na ausência de evidência robustas3.
Esta diretriz inova e se diferencia de outras pela incorporação da necessidade da análise dos estudos utilizando as recomendações conhecidas com o CONSORT (Consolidated Standards of Reporting Trials)4, que utiliza uma lista de checagem (check list) e um fluxograma compreendendo os quatro estágios fundamentais de um estudo clínico randomizado: recrutamento, alocação, seguimento dos pacientes e análise de dados. Nível de evidência A contemplará preferencialmente estudos randomizados que estejam de acordo com as recomendações do CONSORT. Meta-análises só serão consideradas nível de evidência A se os trabalhos seguirem esta mesma orientação. Estudos de qualidade duvidosa geram meta-análise duvidosa. Recentemente, resultados de algumas meta-análises têm gerado muita polêmica. Os desfechos primários também serão considerados para evidência A. Quanto à análise de subgrupos, serão valorizadas a especificação clara de poucas hipóteses em subgrupos importantes e plausíveis a priori, a utilização de testes de interação e/ou correção para multiplicidade de comparações estatísticas, e a interpretação dos resultados no contexto de dados similares de outros estudos. Estudos envolvendo tratamento não farmacológico (dispositivos implantáveis, cirurgia, etc) também serão analisados segundo o CONSORT, ressaltando-se a possibilidade de efeito placebo5. Em geral, classe de recomendação I deve estar apoiada por nível de evidência A. Abaixo as classes de recomendação e nível de evidência utilizados.
Classe de Recomendação
Classe I - consenso sobre a indicação do procedimento ou tratamento;
Classe IIa - evidências favorecem a indicação do procedimento ou tratamento;
Classe IIb - evidências não favorecem a indicação do procedimento ou tratamento;
Classe III - não indicado o procedimento ou tratamento.
Níveis de Evidência
A) Dados obtidos a partir de estudos randomizados de boa qualidade que seguem as orientacões do CONSORT ou metanálises de grandes estudos randomizados que seguem as orientacões do CONSORT (Consolidated Standards of Reporting Trials);
B) Dados obtidos de um único ensaio clínico randomizado de boa qualidade que seguem a orientacào do CONSORT ou vários estudos não-randomizados;
C) Dados obtidos de estudos que incluíram série de casos e dados obtidos do consenso e opiniões de especialistas.
II. Epidemiologia
a) Considerações gerais
A insuficiência cardíaca (IC) é a via final comum da maioria das doenças que acometem o coração, sendo um dos mais importantes desafios clínicos atuais na área da saúde. Trata-se de um problema epidêmico em progressão6.
b) No Brasil
O Brasil é o maior país da América Latina, com população estimada pelo IBGE em 2007 de 183.987.291 habitantes. Aproximadamente 50,8% do sexo feminino, habitando a maioria (81,2%) áreas urbanas, e tendo a expectativa de vida ao nascer aumentado de 69 anos em 2000 para 71,8 anos em 20077.
A maioria da população brasileira (80%) é atendida pelo Sistema Único de Saúde (SUS), do Ministério da Saúde. Ocorreram no ano de 2007, 111.309.325 internações, sendo 67.933.328 (60,07%) do sexo feminino, o que consumiu o montante total de R$ 7.607.591.178,43, sendo empregados 38,68% na região sudeste (4.373.947 internações), que além de ser a mais populosa, é a que tem maior número de habitantes cobertos por seguro saúde não-estatal. O restante da população é atendida por planos de saúde e cooperativas7.
No ano de 2007, as doenças cardiovasculares representaram a terceira causa de internações no SUS, com 1.156.136 hospitalizações. A IC é a causa mais freqüente de internação por doença cardiovascular.
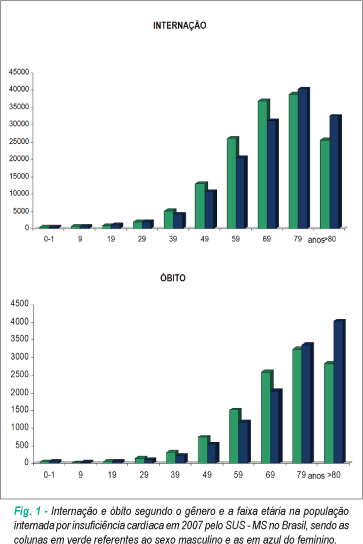
Na tabela 1 temos as internações pelo SUS e os óbitos hospitalares ocorridos devido à IC entre 2000 e 2007, além de seus percentuais em relação ao total das hospitalizações. É mais encontrada na faixa etária acima de 60 anos, onde mais de 2/3 (69,8%) das hospitalizações foram realizadas. Esta disposição, similar a dos países do primeiro mundo, pode ser vista na figura 1. A taxa de mortalidade intra-hospitalar varia com a faixa etária, sendo maior nos idosos e nos menores de 20 anos (tabela 2).
No período de 2000 a 2007, identificou-se redução do número de hospitalizações por IC (tabela 3) com diminuição proporcional entre todas as regiões geográficas do país. Os gastos decorrentes de hospitalizações por IC no SUS no período 2000-2007 tiveram aumento de 11,3% e de 64,7% nos gastos unitários por internação (tabela 4).
Em 2006 a IC e cardiopatias associadas à IC foram responsáveis por 6,3% dos óbitos no Estado de São Paulo, estado mais populoso do Brasil com 41.654.020 habitantes8. Em 2007 a IC foi responsável por 2,6% das hospitalizações e por 6% dos óbitos registrados pelo SUS-MS no Brasil, consumindo 3% do total de recursos utilizados para atender todas as internações realizadas pelo sistema. O serviço de saúde suplementar no Brasil vem se expandindo e hoje 1 em cada 5 brasileiros é por ele atendido. Os dados sobre atendimentos ambulatoriais e hospitalares por IC neste cenário não estão disponíveis.
No Brasil, a principal etiologia da IC é a cardiopatia isquêmica crônica associada à hipertensão arterial. Em determinadas regiões geográficas do país e em áreas de baixas condições sócio-econômicas, ainda existem formas de IC associadas à doença de Chagas, endomiocardiofibrose e a cardiopatia valvular reumática crônica, que são situações especiais de IC em nosso meio.
I. Insuficiência cardíaca associada à cardiopatia reumática crônica
A cardiomiopatia valvular reumática crônica ainda é uma causa freqüente de IC no Brasil, embora tenha sido observada uma marcada redução de novos casos de febre reumática aguda nas últimas 3 décadas no Brasil, e redução de mortalidade devido a doença reumatica8. Em todo mundo existem mais de 15 milhões de indivíduos portadores de cardiopatia reumática, em países em desenvolvimento 470.000. Novos casos são diagnosticados e 200.000 pessoas morrem a cada ano, principalmente na África e no sudeste asiático. Também se observa cerca de 3 milhões de hospitalizações por IC associada à cardiopatia reumática em todo o mundo. Na África a cardiopatia reumática, em indivíduos jovens, é responsável por 22% dos casos de IC9,10.
O gradiente sócio-econômico é o principal responsável pela chance de desenvolver doença reumática e também está relacionada à qualidade do cuidado cardiovascular oferecido a população. É estimado que um número importante de pacientes não tem diagnóstico de febre reumática11. A cardiopatia reumática é uma causa prevenível de IC, sendo o tratamento precoce com penicilina, nos casos suspeitos de amigdalite estreptocócica, a forma mais adequada para prevenir a doença. Cerca de 30% das cirurgias cardíacas no Brasil (DATASUS 2003) são devido a seqüelas da febre reumática12.
II. Insuficiência cardíaca associada à Doença de Chagas
A Doença de Chagas representa a 3ª maior doença parasitária no mundo, após malária e esquistossomose. A cardiomiopatia chagásica crônica é forma comum da cardiomiopatia dilatada e causa importante de morbimortalidade na América Latina13. Estima-se que 10 a 12 milhões de pessoas estão infectadas e 21% a 31% delas irão desenvolver a cardiomiopatia. A doença de Chagas contribui com 15.000 mortes anuais, e aproximadamente 200.000 novos casos por ano14. No Estado de São Paulo em 2006 a etiologia chagásica foi responsável por 0,49% dos óbitos devido a IC8.
A Doença de Chagas é causada pelo Tripanossoma cruzi, transmitido para humanos pelo inseto triatomídeo, transfusão de sangue, contaminação oral ou congenitamente. A Doença de Chagas apresenta 2 fases clínicas: aguda e crônica. A infecção aguda é freqüentemente um quadro autolimitado, com duração de 4 a 8 semanas, com mortalidade inferior a 5%, sendo os casos fatais associados a miocardite, e a meningoencefalite. A fase crônica aparece após um longo período de latência (forma indeterminada). Em cerca de 1/3 dos casos de indivíduos cronicamente infectados ocorrem complicações cardíacas ou digestivas após 10 a 30 anos do quadro agudo. O acometimento cardíaco na forma crônica - cardiomiopatia chagásica crônica, tipicamente produz arritmias ventriculares, bloqueios intracardíacos, anormalidades contráteis regionais e IC, fenômenos tromboembólicos pulmonares e ou sistêmicos, e morte súbita. A mortalidade anual de pacientes ambulatoriais tem sido estimada em cerca de 4%. A morte súbita ocorre entre 55 a 65% dos casos. A IC progressiva é responsável por 25 a 30% e fenômenos tromboembólicos por 10 a 15%15,16. O prognóstico da miocardiopatia chagásica é pior que de miocardiopatias de outras etiologias17.
Embora tenha sido observada uma importante diminuição de incidência da Doença de Chagas na última década, em muitos países da América Latina a Doença de Chagas é ainda um problema maior de saúde pública13. O problema da Doença de Chagas não está apenas confinado a América Latina, devido ao fenômeno da migração internacional de indivíduos contaminados, inúmeros casos têm sido observados nos Estados Unidos e na Europa. Cerca de 100 milhões de pessoas vivem em áreas de risco.
A cardiomiopatia chagásica crônica é causa líder de IC sistólica crônica em áreas onde há a forma endêmica da doença. A IC crônica de etiologia chagásica, no Brasil, acomete 4 a 8% dos pacientes ambulatoriais, 10% dos pacientes internados e até 76% dos pacientes internados em áreas endêmicas. A incidência de IC descompensada de internados no Brasil pode ser responsável por até 3% das internações anuais. Casos agudos de transmissão vetorial se tornaram excepcionais nas últimas 3 décadas, porém, a mortalidade anual por doença de Chagas é de aproximadamente 5.500 casos14.
III. Endomiocardiofibrose
A endomiocardiofibrose é uma forma de cardiomiopatia restritiva endêmica na África equatorial, sudeste asiático (Índia), Colômbia, e também descrito na região do nordeste do Brasil. A endomiocardiofibrose ocorre principalmente em áreas tropicais e sub-tropicais e a sintomatologia surge na idade jovem. O envolvimento do coração é típico com a presença de fibrose na região de via de entrada dos ventrículos e acomete o aparelho sub-valvular mitral e/ou tricúspide18.
Os achados clínicos dependem do estágio da doença e do envolvimento anatômico do coração. Vários fatores ambientais (geográficos, pobreza, infestações) e individuais (dieta, etnicidade, fatores genéticos) têm sido implicados com a patogênese da endomiocardiofibrose, porém ainda permanece não determinado. Com progressão para fase sintomática o prognóstico é reservado com sobrevida estimada em 2 anos, em 50% dos pacientes19. O transplante cardíaco tem sido realizado com sucesso na endomiocardiofibrose20.
III. Caracterização da insuficiência cardíaca como síndrome clínica
a) Definição de insuficiência cardíaca
É uma síndrome clínica complexa de caráter sistêmico, definida como disfunção cardíaca que ocasiona inadequado suprimento sanguíneo para atender necessidades metabólicas tissulares, na presença de retorno venoso normal, ou fazê-lo somente com elevadas pressões de enchimento.
As alterações hemodinâmicas comumente encontradas na IC envolvem resposta inadequada do débito cardíaco e elevação das pressões pulmonar e venosa sistêmica. Na maioria das formas de IC, a redução do débito cardíaco é responsável pela inapropriada perfusão tecidual (IC com débito cardíaco reduzido). De início este comprometimento do débito cardíaco se manifesta durante o exercício, e com a progressão da doença ele diminui no esforço até ser observado sua redução no repouso.
Existem condições nas quais o débito cardíaco poderá ser normal ou até elevado, como em condições de pós-carga diminuída ou hipermetabolismo, porém inadequado à demanda metabólica tecidual, caracterizando a IC com débito cardíaco elevado (IC alto débito).
O mecanismo responsável pelos sintomas e sinais clínicos pode ser decorrente da disfunção sistólica, diastólica ou de ambas, acometendo um ou ambos os ventrículos. Nos adultos, em aproximadamente 60% dos casos está associada à disfunção ventricular esquerda sistólica e nos restantes 40% à disfunção diastólica, devendo ser realçado que esta última vem sendo mais observada com o aumento da expectativa de vida da população.
b) Classificação da insuficiência cardíaca baseada em sintomas
A IC crônica tem sido classicamente categorizada com base na intensidade de sintomas em 4 classes propostas pela New York Heart Association (tabela 5). Estas classes estratificam o grau de limitação imposto pela doença para atividades cotidianas do indivíduo; vale dizer, portanto, que esta classificação além de possuir caráter funcional, é também uma maneira de avaliar a qualidade de vida do paciente frente a sua doença. As quatro classes propostas são:
Classe I - ausência de sintomas (dispnéia) durante atividades cotidianas. A limitação para esforços é semelhante à esperada em indivíduos normais;
Classe II - sintomas desencadeados por atividades cotidianas;
Classe III - sintomas desencadeados em atividades menos intensas que as cotidianas ou pequenos esforços;
Classe IV - sintomas em repouso.
Vale notar que esta categorização tem como base de referência para sua gradação as atividades cotidianas, que são variáveis de um indivíduo para outro, o que confere subjetividade a esta medida. Em que pese a estratificação de sintomas pela classe funcional possuir boa correlação com o prognóstico e qualidade de vida, não é boa a sua relação com a fração de ejeção. Além do valor prognóstico da classe funcional aferida em avaliação inicial de pacientes, sua determinação serve para avaliar resposta terapêutica e contribuir para a determinação do melhor momento para intervenções.
c) Classificação da insuficiência cardíaca baseada na progressão da doença
A estratificação de pacientes com IC é medida simples, baseada em dados de história, e que permite ao profissional de saúde avaliar o momento evolutivo da doença em que o paciente se encontra, avaliar qualidade de vida e prognóstico e estabelecer prioridades e linhas terapêuticas. Esta forma de categorização permite uma compreensão evolutiva da doença e, ainda, serve de base para a identificação de pacientes com indicação de intervenções predominantemente preventivas (estágios A e B), terapêuticas (estágios C) ou seleção de pacientes para procedimentos especializados e cuidados paliativos (estágio D) (tabela 5).
Estágio A - Inclui pacientes sob risco de desenvolver insuficiência cardíaca, mas ainda sem doença estrutural perceptível e sem sintomas atribuíveis à insuficiência cardíaca.
Estágio B - Pacientes que adquiriram lesão estrutural cardíaca, mas ainda sem sintomas atribuíveis à insuficiência cardíaca.
Estágio C - Pacientes com lesão estrutural cardíaca e sintomas atuais ou pregressos de insuficiência cardíaca.
Estágio D - Pacientes com sintomas refratários ao tratamento convencional, e que requerem intervenções especializadas ou cuidados paliativos.
IV. Abordagem do paciente com IC
a) Avaliação inicial
A avaliação inicial do paciente com IC tem como objetivos: confirmar o diagnóstico, identificar a etiologia e possíveis fatores precipitantes, definir modelo fisiopatológico (disfunção sistólica versus função sistólica preservada), definir modelo hemodinâmico, estimar prognóstico e identificar pacientes que possam se beneficiar de intervenções terapêuticas específicas (como dispositivos e procedimentos cirúrgicos) (figura 2).
A definição da etiologia (tabela 6) é etapa fundamental da avaliação dos pacientes com IC, contribui para a avaliação do prognóstico e pode influenciar a terapia. Dados obtidos por história, exame físico, eletrocardiograma, e exames laboratoriais são capazes de, na maior parte dos casos, sugerir a etiologia da IC. São dados que apontam para a etiologia isquêmica a presença de angina de peito, antecedente de infarto do miocárdio, fatores de risco para aterosclerose, área inativa em eletrocardiograma e presença de disfunção segmentar ao ecocardiograma. Na Doença de Chagas podem-se encontrar dados epidemiológicos sugestivos (origem ou passagem por zona endêmica, familiares com doença, exposição a alimentos potencialmente contaminados, possibilidade de transmissão materno-fetal, transfusão sanguínea) associados à insuficiência cardíaca de predomínio direito, bloqueio de ramo direito e bloqueio divisional ântero-superior (BDAS) no eletrocardiograma, e achado no ecocardiograma de disfunção segmentar da parede inferior, aneurisma de ponta do ventrículo esquerdo e trombo apical. Finalmente, a presença de história de hipertensão arterial, etilismo ou de familiares com cardiomiopatia podem indicar a existência de causas específicas para a IC. Em casos selecionados, métodos diagnósticos adicionais podem ser utilizados como a ressonância magnética, cinecoronariografia e biópsia endomiocárdica. As seções seguintes tratam dos instrumentos utilizados na avaliação inicial.
I. História clínica e exame físico
Os sinais e sintomas são de grande importância para a suspeita clínica de IC, mas isoladamente apresentam limitações de sensibilidade e/ou especificidade para o diagnóstico21 (tabela 7). Os sinais mais específicos e de maior valor prognóstico (pressão venosa elevada e B3) são pouco sensíveis e de reprodutibilidade inter-observador limitada, principalmente entre não especialistas. A organização dos sinais e sintomas de forma integrada e hierarquizada, através de sistema de pontos (Boston) ou critérios maiores e menores (Framingham), com adição de informação radiológica, melhora a acurácia do diagnóstico clínico22. Além das limitações para o diagnóstico, os sinais e sintomas não permitem diferenciar o modelo fisiopatológico da IC23 e têm acurácia limitada na definição do modelo hemodinâmico dos pacientes com IC aguda ou agudizada24. A avaliação clínica deve incluir ainda a busca dos fatores de risco e possíveis causas e fatores precipitantes de descompensação da IC (tabela 8). Embora a diferenciação clínica de IC com disfunção sistólica versus IC com fração de ejeção preservada seja tarefa difícil, alguns dados clínicos podem auxiliar nesta avaliação (tabela 9).
II. Eletrocardiograma
O eletrocardiograma pode fornecer úteis informações para o diagnóstico, etiologia, prognóstico e tratamento da IC (tabela 10). Eletrocardiograma normal tem um valor preditivo negativo superior a 90% para excluir disfunção sistólica e torna o diagnóstico de IC improvável25. Fibrilação atrial e sobrecarga atrial e/ou ventricular esquerda são achados eletrocardiográficos comuns em pacientes com IC. Bloqueio de ramo esquerdo e zona inativa em parede anterior, por outro lado, são bons preditores de disfunção sistólica. O eletrocardiograma é fundamental para o diagnóstico de bradiarritmias e taquiarritmias (principalmente fibrilação ou flutter atrial), que podem ser a causa ou fator precipitante de IC. Etiologia isquêmica pode ser suspeitada pela presença de zonas inativas, enquanto que bloqueio de ramo direito, isolado ou associado a bloqueio divisional ântero-superior esquerdo, sugere fortemente o diagnóstico de cardiopatia chagásica em pacientes com epidemiologia positiva. A largura do QRS é um importante fator prognóstico independente e ajuda a identificar candidatos à terapêutica de ressincronização. Arritmia ventricular complexa e dispersão de QT aumentada podem estar associadas à maior risco de morte súbita, embora o seu valor prognóstico independente seja considerado controverso.
III. Radiografia de tórax
Cardiomegalia (índice cardio-torácico > 0,5) associada a sinais de congestão pulmonar (redistribuição vascular para os ápices, edema intersticial e/ou alveolar e derrame pleural) são úteis marcadores de disfunção ventricular e/ou elevação das pressões de enchimentos26. No entanto, IC pode ocorrer sem cardiomegalia, principalmente em pacientes com IC aguda ou com função sistólica preservada. A relação entre as alterações radiológicas e os dados hemodinâmicos depende não só da gravidade da disfunção cardíaca, mas também da sua duração. Em pacientes com IC crônica os sinais de congestão venosa podem estar ausentes, mesmo na presença de pressões de enchimento elevadas. Por outro lado os sinais radiológicos de congestão podem persistir mesmo quando as alterações hemodinâmicas já foram otimizadas com o tratamento (tabela 11). Etiologia da IC pode ser sugerida pela análise da forma da silhueta cardíaca ou pela presença de calcificação em topografia valvar ou de pericárdio. Radiografia de tórax pode ainda identificar presença de doença pulmonar, responsável pelos sintomas.
IV. Avaliação laboratorial
Anemia, hiponatremia e alteração da função renal são preditores prognósticos adversos na IC27. Anemia pode ser causa, fator precipitante ou conseqüência da IC. Alteração da função renal pode ocorrer por vários motivos: co-morbidades (diabetes mellitus, hipertensão arterial sistêmica), débito cardíaco reduzido pela cardiopatia ou efeito do tratamento (uso de diuréticos, inibidores da enzima conversora de angiotensina II e bloqueadores dos receptores da angiotensina). Hipocalemia é um efeito adverso comum do tratamento com diuréticos e pode causar arritmias fatais e aumentar o risco de intoxicação digitálica. Por outro lado, hipercalemia pode complicar o tratamento com inibidores da enzima conversora de angiotensina II e bloqueadores dos receptores da angiotensina, β-bloqueadores e espironolactona e requerer ajuste terapêutico. Elevação de enzimas hepáticas pode ocorrer em decorrência de congestão e/ou hipoperfusão hepática.
Na busca etiológica da IC e de acordo com a suspeita clínica, exames laboratoriais específicos, voltados para as causas descritas na tabela 12, devem ser realizados.
V. BNP
O peptídeo natriurético do tipo B (BNP) é um polipeptídeo liberado pelos miócitos ventriculares em resposta à sobrecarga de volume, sobrecarga de pressão e aumento da tensão parietal. Tanto a sua forma fisiologicamente ativa, o BNP, quanto o seu bioproduto inativo, o N-terminal pró-BNP podem ser confiavelmente dosados. Diversos estudos têm demonstrado a sua grande utilidade na avaliação de pacientes com suspeita diagnóstica de IC na sala de emergência28 e em nível ambulatorial29. Nestes cenários, o BNP é particularmente útil em afastar o diagnóstico de IC, pelo seu elevado valor preditivo negativo. É importante ressaltar, no entanto, que o BNP não substitui o exame clínico e deve sempre ser considerado dentro de contexto adequado e com conhecimento de suas limitações e peculiaridades (tabela 13).
O BNP sofre a influência de diversos fatores (idade, IMC, função renal) que podem interferir na sua acurácia diagnóstica e requerer pontos de corte específicos30. Além disso, o BNP pode estar elevado na ausência de IC em condições como hipertensão arterial sistêmica (HAS), valvulopatias, isquemia miocárdica, hipertrofia ventricular esquerda (HVE) e embolia pulmonar. A utilização de dois pontos de corte, um para "excluir" (valor preditivo negativo alto), outro para "confirmar" (valor preditivo positivo alto) e uma faixa intermediária, na qual outros diagnósticos deveriam ser considerados, tem sido recomendado e pode facilitar seu uso clínico.
Diversos estudos têm demonstrado a correlação entre os níveis de BNP e a gravidade da IC bem como o valor prognóstico independente destes bio-marcadores para mortalidade total, mortalidade cardiovascular e hospitalização tanto na IC aguda quanto na IC crônica31. Na miocardiopatia chagásica também se demonstrou a importância prognóstica do BNP32,33. Há também evidências recentes que o uso de BNP para guiar terapêutica pode estar associado à melhor evolução clínica34 e redução de custos35.
VI. Ecodopplercardiograma
A ecodopplercardiografia (EDC) é um método rápido, seguro e largamente disponível que fornece diversas informações funcionais e anatômicas de grande importância. É útil na confirmação diagnóstica, avaliação da etiologia, do modelo fisiopatológico, do modelo hemodinâmico, do prognóstico e para indicar possíveis alternativas terapêuticas (tabela 14).
Diversas causas de IC podem ser identificadas ou sugeridas pelo aspecto ecocardiográfico típico. Outras informações que podem ser obtidas pela ecocardiografia são descritas na tabela 15. O parâmetro mais importante para quantificação da função sistólica de VE é a fração de ejeção, fundamental para diferenciar a IC diastólica da IC sistólica e para definir tratamento. Deve ser obtida preferencialmente pelo método de Simpson, que apresenta melhor correlação com a ressonância magnética cardíaca (RMC), principalmente em ventrículos esféricos ou com doença segmentar.
Análise da função diastólica do VE, realizada através do fluxo mitral, fluxo de veia pulmonar e doppler tecidual do anel mitral pode ser de grande utilidade na confirmação diagnóstica de IC diastólica, fornece importante informação prognóstica e ajuda a diferenciar cardiomiopatia restritiva de pericardite constritiva. Em especial, o doppler tissular é um método recente que avalia a velocidade de movimentação miocárdica tanto na sístole como na diástole em qualquer segmento do miocárdio. A sua avaliação no anel mitral é um excelente método para estudar a função diastólica do ventrículo esquerdo. Permite ainda estimar a pressão atrial esquerda (PAE), quando avaliado conjuntamente com o fluxo valvar transmitral não tissular (relação E/E').
Outras informações hemodinâmicas que apresentam correlação satisfatória com dados invasivos incluem a medida do débito cardíaco, da pressão venosa sistêmica, das pressões sistólica, diastólica e média de artéria pulmonar e da resistência vascular pulmonar e sistêmica. Estudo recente sugere que terapêutica guiada por informações hemodinâmicas derivadas do ecocardiograma pode resultar em melhor evolução clínica36.
Diversas técnicas ecocardiográficas têm sido investigadas para avaliação, quantificação e localização de dissincronismo inter e intraventricular, bem como para orientação e otimização da terapêutica de ressincronização, com objetivo de reduzir taxa de não respondedores. O papel exato da ecocardiografia para esta indicação, no entanto, ainda não se encontra estabelecido. Recentemente, os investigadores do estudo Prospect (Predictors of Response to Cardiac Resynchronization Therapy) concluíram que nenhuma medida ecocardiográfica isolada pode ser recomendada para melhorar a seleção de pacientes candidatos à terapia de ressincronização cardíaca37.
O ecocardiograma transesofágico deve ser indicado para pacientes com janela acústica transtorácica limitada e em pacientes em que o exame convencional deixa dúvidas diagnósticas. Em particular, pode ser recomendado para avaliação de próteses valvulares, de cardiopatias congênitas e da presença de trombos dentro do átrio esquerdo.
VII. Cineangiocoronariogragia
A indicação de cineangiocoronariografia na avaliação etiológica de pacientes com IC é motivo de intenso debate. Entretanto, em pacientes que se apresentam com quadro clínico de angina pectoris e disfunção ventricular sistólica a realização de angiocoronariografia é consensual, uma vez que a presença de isquemia e viabilidade miocárdica são marcadores de potencial indicação de revascularização e reversibilidade da disfunção contrátil. A mesma linha de raciocínio se aplica a pacientes sem angina típica, porém com perfil de fatores de risco indicativo de doença arterial coronariana ou para pacientes com história prévia sugestiva de IAM (tabela 16). Avaliação da anatomia coronariana também se justifica em pacientes com indicação cirúrgica para correção de valvulopatias primárias ou secundárias em pacientes com IC com risco de doença coronariana.
VIII. Outros métodos de imagem na avaliação e investigação da IC
Em pacientes nos quais a ecocardiografia em repouso não tenha fornecido informações suficientes, exames adicionais devem ser realizados: ecocardiografia de estresse, imagem por medicina nuclear (SPECT e PET), ressonância magnética cardíaca (RMC) e tomografia computadorizada cardíaca (TCC)38.
Em particular, nos pacientes portadores de IC crônica secundária à cardiopatia isquêmica, os métodos de imagem apresentam papel importante não apenas na avaliação da anatomia coronariana, mas também na avaliação de isquemia e viabilidade miocárdica (tabela 16). Já foi demonstrado que a disfunção ventricular esquerda de etiologia isquêmica pode ser melhorada ou normalizada caso os pacientes sejam adequadamente revascularizados39. Portanto, a avaliação da anatomia coronariana quanto à presença e gravidade de lesões obstrutivas por angiocoronariografia invasiva ou não-invasiva é fundamental. A avaliação não-invasiva quanto à presença e extensão de isquemia miocárdica pela ecocardiografia de estresse, medicina nuclear ou RMC também apresenta importância e pode substituir ou, mais freqüentemente, complementar a avaliação anatômica.
Um aspecto importante a ser ressaltado na investigação diagnóstica desses pacientes diz respeito à viabilidade miocárdica. Diversos estudos observacionais sugerem que pacientes com disfunção ventricular esquerda de etiologia isquêmica, com anatomia coronariana passível de revascularização e com predomínio de viabilidade miocárdica nos exames de avaliação não-invasiva, apresentam benefício clínico quando adequadamente revascularizados. Em contrapartida, quando esses mesmos pacientes não apresentam viabilidade miocárdica significativa, não existe benefício dos procedimentos de revascularização em reduzir a mortalidade39.
IX. Ecocardiograma de estresse
O ecocardiograma de estresse pode ser utilizado para avaliar a presença e a extensão da isquemia miocárdica em pacientes com IC crônica e disfunção ventricular de etiologia isquêmica40. Utilizando o estresse físico ou farmacológico, apresenta acurácia comparável aos demais métodos de avaliação não-invasiva (SPECT e RMC)41. É importante ressaltar que sua acurácia diagnóstica especificamente em pacientes com IC ainda não está bem estabelecida, podendo apresentar menor sensibilidade e especificidade devido à dilatação ventricular e bloqueios de ramo, quando presentes.
A ecocardiografia com baixas doses de dobutamina também pode ser útil na avaliação da viabilidade miocárdica. A recuperação inicial da contratilidade regional, seguida por piora da função segmentar com doses progressivas de dobutamina (resposta bifásica) identifica miocárdio viável e é o preditor mais específico de recuperação da contratilidade após revascularização, ainda que apresente menor sensibilidade40.
X. Imagem por medicina nuclear - SPECT e PET
A medicina nuclear com técnicas de SPECT (single photon emission tomography) pode contribuir na IC fundamentalmente de duas maneiras distintas: avaliação da perfusão miocárdica e da função ventricular42,43. Na avaliação da função ventricular, as opções mais utilizadas são o SPECT sincronizado com o ECG (gated-SPECT) e a ventriculografia radioisotópica, esta última reconhecidamente precisa e um dos padrões de referência para avaliação da função do VE e VD. Cintilografia miocárdica de perfusão é mais freqüentemente utilizada no contexto de diagnóstico de doença arterial coronária (DAC), fornecendo informações de isquemia e viabilidade miocárdica, assim como valiosas informações prognósticas44.
A tomografia por emissão de pósitrons (positron emission tomography, PET), é mais freqüentemente indicada na situação de avaliação da viabilidade miocárdica, com a utilização de 18FDG, sendo considerada uma das técnicas de referência nesta utilização43. A avaliação de isquemia miocárdica utilizando rubídio (82Rb) ou amônia(13N) durante estresse farmacológico também tem demonstrado alta sensibilidade. A disponibilidade do método ainda é limitada no nosso meio.
XI. Ressonância magnética cardíaca
A ressonância magnética cardíaca (RMC) já foi validada para quantificar os volumes, a massa e a função tanto do VE como do VD. Dada a sua alta resolução espacial e temporal, e devido a sua natureza tridimensional, que a torna independente de premissas geométricas, a RMC apresenta excelente acurácia e reprodutibilidade, características especialmente úteis ao acompanhamento longitudinal dos pacientes portadores de IC crônica45,46.
Existem diversas técnicas de RMC que permitem a determinação da viabilidade miocárdica, dentre as quais a avaliação da contratilidade segmentar com dobutamina em baixas doses, técnicas de imagem do sódio ("sodium imaging") e a análise do perfil metabólico/energético miocárdico pela espectroscopia. Entretanto, a principal delas é a técnica de realce tardio. A avaliação da transmuralidade das regiões de necrose e/ou fibrose do miocárdio permite predizer com excelente acurácia a probabilidade de recuperação da função regional após a revascularização, seja ela cirúrgica ou percutânea47. A avaliação da viabilidade miocárdica através da RMC com técnica do realce tardio apresenta ainda as vantagens de não exigir o emprego de estresse farmacológico e não envolver o uso de material radioativo.
Uma das principais questões a ser respondida durante a avaliação inicial de pacientes portadores de miocardiopatia dilatada é se a disfunção ventricular esquerda é de etiologia isquêmica ou não-isquêmica. A RMC com técnica de realce tardio pode proporcionar delimitação das regiões de infarto do miocárdio. Adicionalmente, a RMC com estresse farmacológico permite determinar se existe ou não isquemia miocárdica associada48. Dessa forma, as informações morfológicas e funcionais proporcionadas pela RMC complementam aquelas obtidas pela angiografia coronariana, permitindo determinar se a etiologia da miocardiopatia é isquêmica ou não-isquêmica.
XII. Tomografia computadorizada cardíaca
Na disfunção ventricular de etiologia desconhecida a exclusão de DAC como causa da disfunção é desejável. A tomografia computadorizada cardíaca, com o seu reconhecido alto valor preditivo negativo49, pode atuar neste cenário como método alternativo ao cateterismo cardíaco para afastar doença coronariana. Ainda em situações de IC crônica com suspeita clínica ou laboratorial de DAC, a tomografia computadorizada cardíaca pode auxiliar na busca de presença ou ausência de doença obstrutiva significativa e, portanto, ajudar a orientar o manejo terapêutico46.
XIII. Investigação de IC de etiologia indeterminada
Mesmo após excluir as causas mais prevalentes de IC crônica, dentre as quais a etiologia isquêmica, hipertensiva, alcoólica e valvar, uma parte significativa dos pacientes permanece sem diagnóstico etiológico para seu quadro. Ademais, muitos deles apresentam IC grave e/ou rapidamente progressiva. Fica clara, portanto, a necessidade de se prosseguir com a investigação, especialmente porque muitas das diversas etiologias possíveis apresentam evoluções bastante distintas e tratamentos específicos efetivos (tabela 17).
Neste cenário, a RMC representa uma modalidade diagnóstica útil, particularmente devido a sua capacidade de proporcionar caracterização tecidual. Constitui-se, portanto, em ferramenta na avaliação do diagnóstico etiológico das mais diversas cardiomiopatias não-isquêmicas potencialmente causadoras de IC crônica, dentre as quais a cardiomiopatia hipertrófica, as miocardiopatias restritivas, infiltrativas ou de depósito, as miocardites, a miocardiopatia não-compactada, a miocardiopatia siderótica, a cardiomiopatia arritmogênica do VD e a cardiomiopatia chagásica45.
A biópsia endomiocádica também pode ser útil na avaliação de diversas miocardiopatias específicas. É importante ressaltar, entretanto, que seu uso não deve ser indiscriminado. Publicação recente reavaliou as indicações específicas para a realização da biópsia endomiocádica50. No contexto da IC crônica, ela está indicada na avaliação de pacientes com piora inesperada do seu quadro clínico caracterizada pelo surgimento de arritmias ventriculares novas e/ou bloqueios AV de 20-30 graus e que não apresentem resposta ao tratamento usual. Também está indicada na avaliação de pacientes com suspeita clínica de doenças infiltrativas, alérgicas ou restritivas de causa desconhecida50.
XIV. Holter
A utilização de Holter é útil na avaliação de pacientes com suspeita de cardiomiopatia secundária à taquiarritmias. Na análise de indivíduos com palpitações e ou síncopes, pode identificar a presença de arritmias supraventriculares e/ou ventriculares. Além disso, pode ser considerado como método para documentação de arritmias ventriculares em candidatos a estudo eletrofisiológico (tabela 18).
XV. Estudo eletrofisiológico
O estudo eletrofisiológico (EEF) não é realizado de rotina na avaliação de pacientes com IC. Em algumas situações, na presença de eletrocardiograma com suspeita de bloqueio trifascicular, na presença de taquiarritmia supraventricular sustentada que pode ser gênese do mecanismo da IC (taquicardiomiopatias), ou na suspeita de taquicardia ventricular ramo a ramo, o estudo pode ser recomendado.
O EEF também pode ser indicado em pacientes pós-infarto do miocárdio com disfunção sistólica grave do ventrículo esquerdo e com presença de arritmias ventriculares freqüentes, que sejam considerados candidatos ao implante de cardiodesfibriladores, estratégia sugerida pelo estudo MADIT.
b) Seguimento clínico
I. Periodicidade das consultas
O seguimento clínico meticuloso dos pacientes é tarefa essencial para monitorar a evolução do quadro clínico, a resposta ao tratamento instituído e a estratificação prognóstica da IC (tabela 19). A periodicidade das consultas não é aspecto definido em estudos clínicos prospectivos, porém evidências indiretas de estudos de gerenciamento de pacientes sugerem que acompanhamento intensivo por médicos ou enfermeiras pode reduzir a morbidade da síndrome51. Deve ser considerado na decisão da periodicidade de consultas o estágio da IC (A-D), o estado funcional das últimas avaliações, a data da última internação, as co-morbidades clínicas e a presença de equipe multidisciplinar para o atendimento dos pacientes. Em particular, o agendamento de consulta no período imediato de pós-alta (nos primeiros 30 dias) é marcador internacionalmente aceito de qualidade assistencial52.
II. Avaliar habilidades para atividades diárias (mudança de classe funcional)
Os profissionais de saúde que acompanham pacientes com IC devem a cada consulta investigar sobre os sintomas que ocorrem durante as atividades do dia-a-dia. A anamnese deve questionar especificamente quais atividades que causam desconforto e limitam a capacidade funcional, como subir lombas e lances de escada, caminhar no plano, realizar atividades domésticas, vestir-se sozinho, tomar banho, alimentar-se e dormir sem restrição de decúbito. Em alguns casos, a avaliação subjetiva da capacidade funcional pode ser acrescida da avaliação direta do paciente durante a consulta, como andar em um corredor ou subir um lance de escadas. Diversas escalas são disponíveis para auxiliar na avaliação seqüencial das mudanças funcionais, sendo a mais difundida a classificação da New York Heart Association. Esta, entretanto, tem grande variabilidade inter-observador, particularmente nas categorias intermediárias. A classificação da Specif Activity Scale incorpora a realização de perguntas específicas sobre atividades do dia a dia, e permite avaliação mais objetiva do estado funcional do paciente.
III. Avaliar peso e volemia
A avaliação seriada do estado volêmico é tarefa crucial dos profissionais de saúde que lidam com pacientes com IC. Neste sentido, o exame clínico tem sido tradicionalmente considerado o instrumento fundamental na identificação da retenção de fluidos e sódio. O bom senso recomenda que a cada consulta, o médico ou enfermeira devam mensurar o peso, identificar a presença de hipotensão postural e realizar exame físico focado para sinais clínicos de congestão pulmonar e periférica. A valorização destes sinais como indício de estado hipervolêmico é controvertida, uma vez que isoladamente a maioria destes achados apresenta sensibilidade e especificidade limitadas para o diagnóstico de congestão24. Nesse sentido, diversos estudos demonstram que a elevação de pressões de capilar pulmonar ou de átrio direito não implica necessariamente na presença de congestão clínica. Dentre os diversos sinais e sintomas da IC, a presença de turgência jugular, refluxo hepato-jugular ou ortopnéia são aqueles sinais de maior acurácia para predizer o estado congestivo e o risco de eventos cardiovasculares futuros53,54. Adicionalmente, a ausência de todos os sinais e sintomas tradicionais de IC revela cenário clínico de baixa probabilidade de aumento das pressões de enchimento intra-cardíacas55.
O monitoramento do peso a cada consulta deve ser realizado, pois é medida simples que pode auxiliar na aferição do estado nutricional e volêmico de pacientes com IC crônica. A variação de peso pode ser um bom parâmetro de piora do estado volêmico quando ocorre em intervalos curtos de tempo (dias ou poucas semanas). Em ambiente ambulatorial de longo prazo, entretanto, muitas vezes é difícil diferenciar ganho de peso por incremento de massa muscular e gordura corpórea daquele relacionado com aumento de volemia. Adicionalmente, pacientes podem manter peso à custa de retenção hídrica e perda de massa muscular.
IV. Avaliar aderência ao tratamento farmacológico e não-farmacológico (restrição hidro-salina)
A sobrecarga hidro-salina é freqüentemente referida como causa comum de descompensação da IC. Na era do tratamento farmacológico otimizado e agressivo, entretanto, estas estratégias de tratamento têm papel controvertido no manejo da IC crônica. Não existem estudos prospectivos bem delineados que demonstrem que restrição hídrica e salina, isoladas ou em conjunto, são estratégias efetivas para reduzir a morbidade da IC em nível ambulatorial, particularmente para aqueles estáveis e pouco limitados do ponto de vista funcional. Apesar disto, existe consenso geral de que avaliar a adesão do paciente a medidas de restrição hidro-salina é marcador de qualidade assistencial, sendo parte importante das iniciativas das clinicas de IC.
V. Otimizar tratamento farmacológico a partir de dados clínicos exames do seguimento (bioquímica, BNP e ECO)
O monitoramento de eletrólitos séricos e de parâmetros de função renal deve ser realizado de forma seriada em pacientes com IC crônica. Em particular, alterações dos níveis de potássio sérico têm implicações clínicas importantes, aumentando o risco de arritmias ventriculares complexas. Piora de função renal pode indicar necessidade de redução da intensidade de uso de diuréticos e readequação de fármacos que inibem o sistema renina-angiotensina-aldosterona.
O tratamento da IC guiado pelos níveis de peptídeos natriuréticos no cenário ambulatorial vem sendo testado por diversos grupos de investigadores56. Um estudo pequeno prospectivo usando terapia guiada por BNP demonstrou redução na taxa de eventos cardiovasculares futuros57. Recentemente o estudo multicêntrico STARS-BNP avaliou a terapia guiada por BNP em 220 pacientes com IC ambulatorial sintomática. Apesar de apenas 33% dos pacientes alocados para o manejo por BNP terem alcançado os valores almejados - BNP < 100 g/ml - houve melhora significativa da sobrevida livre de eventos (morte ou internação por IC) naqueles alocados para terapia guiada por BNP34. Outros estudos recentes, entretanto, questionam a capacidade do BNP de avaliar a capacidade funcional e as alterações hemodinâmicas em pacientes ambulatoriais com IC58,59. Um ensaio clínico randomizado de pequeno porte falhou em demonstrar benefícios clínicos com a titulação de fármacos β-bloqueadores guiada pela mensuração de BNP em pacientes ambulatoriais60. Outra limitação potencial para o monitoramento de BNP é sua grande variabilidade intra-individual. Um estudo em ambiente extra-hospitalar demonstrou que tanto pacientes sintomáticos como assintomáticos com IC crônica podem se apresentar com grande variação dos níveis de plasmáticos de BNP61.
A avaliação seriada e rotineira de parâmetros ecocardiográficos de função sistólica, como fração de ejeção de ventrículo esquerdo, não é recomendada para pacientes ambulatoriais e estáveis. Re-avaliação ecocardiográfica da fração de ejeção pode ser útil em pacientes que apresentam alterações importantes no seu estado clínico, uma vez que melhora ou piora deste marcador pode ter implicações terapêuticas substanciais. O estudo ecocardiográfico, por outro lado, permite avaliação não invasiva segura e confiável de diversos parâmetros hemodinâmicos relevantes ao manejo de paciente com IC em nível ambulatorial62. Um ensaio clínico de pequeno porte que realizou avaliações seriadas de parâmetros hemodinâmicos guiados por ecocardiografia demonstrou redução significativa de morbidade relacionada com IC em pacientes ambulatoriais aparentemente estáveis36.
V. Estágios e avaliação prognóstica
Um importante instrumento incorporado à avaliação dos pacientes com insuficiência cardíaca (IC) é a classificação desta síndrome em estágios. A insuficiência cardíaca pode ser classificada em quatro estágios principais (A, B, C e D), que podem estar direta ou indiretamente associados a diferentes mecanismos etiológicos, além de ter implicações terapêuticas63,64,65. De A à D mais grave se torna a IC, mas a sobrevida pode ser melhor estimada a partir de marcadores de prognóstico. O importante a ser observado neste estadiamento é se tratarmos de forma intensa e preventiva os pacientes nos estágios iniciais poderemos reduzir o número de pacientes com lesão estrutural e subseqüentemente, a presença de sinais e sintomas de IC.
Uma vez instalada, a disfunção ventricular sistólica usualmente progride, muitas vezes de maneira imprevisível. A mortalidade nos pacientes com IC ocorre de forma súbita, por progressiva falência de bomba e por outras formas, incluindo infarto agudo do miocárdio (IAM), acidente vascular encefálico, infecções, etc. No estudo de Framingham somente 25% dos homens e 38% das mulheres sobreviveram 5 anos após o diagnóstico de IC. Essa mortalidade foi quatro a oito vezes maior do que a da população geral da mesma idade66.
A avaliação prognóstica é importante não só para o paciente se programar para o seu futuro e de seus familiares, quanto para seu médico, que deve estar atento ao melhor momento para a indicação de terapias de maior custo como ressincronizadores, desfibriladores, dispositivos mecânicos e transplante cardíaco63,67,68.
Análises multivariadas identificaram diversos marcadores prognósticos de sobrevida, e alguns modelos prognósticos têm sido descritos e validados, tanto na avaliação de transplante cardíaco, como de estabelecer pior sobrevida em pacientes crônicos63,67,68.
Os principais marcadores prognósticos identificados na IC crônica estão descritos na tabela 20, mas nenhum modelo utiliza todos eles de maneira sistemática para estimar a sobrevida51. Alguns deles como os neuro-hormônios (norepinefrina ou endotelina) não são usados de rotina, pois suas mensurações são complexas, caras e não adicionam nenhuma intervenção adicional na terapêutica. Outro marcador largamente utilizado é o peptídeo natriurético do tipo B (BNP) que quando permanece elevado durante uma hospitalização é um preditor de pior prognóstico, podendo predizer re-hospitalização e/ou morte do indivíduo63,67,68. Recentemente, o tempo de exercício tem sido documentado como marcador de prognóstico em crianças com insuficiência cardíaca69,70. Pacientes que recebem alta hospitalar após terem sido internados com IC descompensada têm prognóstico reservado tanto para re-hospitalização quanto para óbito71,72.
Dois modelos têm sido utilizados mais frequentemente para cálculo de previsão de sobrevida em pacientes com IC crônica: O "Heart Failure Survival Score" (HFSS) e o Seattle Heart Failure Model que derivou do estudo PRAISE 1 e foi validado em cinco estudos prospectivos em IC (ELITE 2, Val-HeFT, UW, RENAISSANCE e IN-CHF)73,74. O HFSS é definido pela seguinte equação: [(0,0216x freqüência cardíaca em repouso) + (-0,0255 x pressão arterial sistêmcia média) + (-0,0464 x fração de ejeção de ventrículo esquerdo) + (-0,047 x sódio sérico) + (-0,546 x consumo de oxigênio durante exercício máximo) + (0,6931 x presença de doença coronariana)]. O risco foi considerado baixo quando >8,10, médio de 7,2 a 8,09, e alto risco <7,19. Entretanto este modelo não considera os procedimentos terapêuticos. O Seattle Heart Failure Model permite estimativa de benefício de medicações e procedimentos terapêuticos. Considera no seu cálculo características clínicas (idade, sexo, classe funcional, peso, fração de ejeção de ventrículo esquerdo, pressão sistólica sistêmica), medicações (inibidores da enzima de conversão da angiotensina - IECA, beta-bloqueador - BB, bloqueadores dos receptores de angiotensina - BRA, estatina, alupurinol, antagonista da aldosterona, diuréticos com detalhamento dos tipos), laboratório (hemoglobina, linfócitos, ácido úrico, colesterol total, sódio sérico), ressincronização e/ou cardiodesfibrilador. A sobrevida prevista do paciente na situação basal e pós-intervenção pode ser obtida no www. SeattleHeartFailureModel.org. A função renal não foi um preditor independente neste modelo que incluiu pacientes sob cuidados ambulatoriais. Este escore de sobrevida tem também outras limitações, pois foi desenvolvido e validado em pacientes de estudos clínicos, observacionais e em registros, não podendo ser generalizado para pacientes hospitalizados e com outras co-morbidades, como insuficiência renal, cirrose hepática, câncer, demência, etc. Além disso, toda vez que o status clínico ou as medicações são modificados, o escore tem que ser recalculado. Portanto, sua utilização deve ser pontual, mas pode ajudar a estimar a sobrevida dos pacientes com IC e o impacto de cada medicamento adicionado a prescrição. A introdução do BNP neste modelo parece melhorar o seu valor preditivo75.
VI. Tratamento não farmacológico
A quebra de paradigma na abordagem da IC tem demonstrado que o tratamento não farmacológico deixa de ser um simples complemento da farmacoterapia, tornando-se parte integrante e indispensável da terapêutica desta complexa síndrome. A não adoção destas medidas coloca em risco a eficácia do tratamento.
a) Dieta na IC crônica
A orientação nutricional tem fundamental importância no tratamento de pacientes com IC, contribuindo para maior equilíbrio da doença, melhorando a capacidade funcional e a qualidade de vida com impacto positivo na morbimortalidade76,77.
A intervenção nutricional deve ser realizada em duas etapas distintas: diagnóstico nutricional e planejamento alimentar de forma clara e simples. A anamnese alimentar propicia o conhecimento da qualidade e da quantidade alimentar do paciente, possibilitando identificar suas preferências e aversões, além das limitações de ordem cultural e econômica que possam interferir na orientação dietética (tabela 21).
Recomendações
Composição da dieta
O excesso de substratos energéticos obtidos via dietas hipercalóricas ou nutricionalmente desequilibradas pode contribuir em certas situações para o desenvolvimento e progressão da IC, através de mecanismos relacionados à glicotoxicidade e lipotoxicidade77. Desta forma como orientação geral indica-se: 28kcal/kg de peso para pacientes com estado nutricional adequado e 32kcal/kg de peso para pacientes nutricionalmente depletados, considera-se o peso do paciente sem edemas76. Quanto à composição recomenda-se:
1) Carboidratos - De 50 a 55% da ingestão energética, priorizando os carboidratos integrais com baixa carga glicêmica, evitando os refinados (açúcar), por agravar a resistência à insulina77,78.
2) Lipídeos - De 30 a 35%, com ênfase às gorduras mono e polinssaturadas, em especial aos ácidos graxos da série ômega-3, e níveis reduzidos de gorduras saturadas e trans77,79,80.
3) Proteínas - De 15 a 20% do valor calórico total da dieta, priorizando as proteínas de alto valor biológico.
4) Sódio - De 2 a 3g/dia, principalmente nos estágios mais avançados da doença e na ausência de hiponatremia ou na dificuldade para alimentação com baixo teor de sódio. Composições alternativas tais como sais de cloreto de potássio, amônia ou cálcio, podem contribuir para a redução da ingestão sódica, contudo, com risco de elevação do potássio sérico particularmente na disfunção renal concomitante e em uso de alguns fármacos poupadores de potássio (tabela 22).
5) Líquido - A restrição deve ser de acordo com a condição clínica do paciente e deve ser considerada a dose de diuréticos. Em média a ingestão de líquidos sugerida é de 1.000 a 1.500 ml em pacientes sintomáticos com risco de hipervolemia.
6) Álcool - Há a necessidade de completa abstinência do álcool principalmente para pacientes com miocardiopatia alcoólica, por causar depressão miocárdica e precipitar arritmias81. Entretanto, quantidades limitadas diárias (20-30ml de álcool em vinho tinto) em pacientes estáveis, classes I-II, poderiam ser de benefício na presença de doença coronariana.
7) Suplemento nutricional - Indicado nos pacientes com baixa ingestão alimentar, má absorção de nutrientes, uso de medicamentos que alteram a síntese ou que aumentam a excreção de nutrientes, e em estado de hipercatabolismo76,82,83. Nos casos de anorexia, refeições pequenas e freqüentes ou até a nutrição enteral provisória, podem contribuir para a meta calórica diária. Pacientes em uso de anticoagulação oral com dicumarínicos devem evitar a variabilidade de ingestão alimentos ricos em vitamina K, a exemplo de folhosos (alface, brócolis, couve, dentre outros).
8) Monitoramento do peso corporal - O paciente deverá ser instruído a verificar diariamente o seu peso. Redução acima de 6% em 6 meses, não planejada, pode ser indicativa de caquexia cardíaca84, assim como, o aumento repentino e inesperado de dois ou mais kilos em curto período (3 dias), pode indicar retenção hídrica. Embora recentemente dois relatos apontem a obesidade como fator de proteção na IC, ainda há a necessidade de novas investigações para respaldar tal afirmação85,86.
b) Prevenção de fatores agravantes
I. Vacinação
A presença de IC é uma condição de alto risco para infecções do trato respiratório, podendo levar à descompensação clínica, tendo como conseqüência o aumento da morbimortalidade. Diante da necessidade preventiva, os pacientes devem receber vacina contra Influenza (anualmente) e Pneumococcus (a cada cinco anos e a cada três anos em pacientes com IC avançada), sobretudo nas localidades de grandes modificações climáticas entre as estações do ano (inverno mais rigoroso)87,88 (tabela 23).
II. Tabagismo
O tabagismo aumenta o risco de doença cardiovascular total, assim como de infecção pulmonar. Portanto, os pacientes com IC devem ser estimulados a suprimir o uso do tabaco - passivo e ativo - por meio de abordagem breve/mínima ou PAAP (perguntar, avaliar, aconselhar e preparar), terapia cognitiva comportamental e suporte medicamentoso se necessário89 (tabela 23).
III. Antiinflamatórios não esteroidais (AINE)
Os AINES clássicos (ibupropufeno, diclofenaco e naproxeno), assim como os inibidores da Cox-2 (celocoxib, rofecoxib, valdecoxib) provocam retenção hidrossalina e elevação da pressão arterial. Os inibidores da Cox-2 possuem também efeito pró-trombótico. Portanto, os AINES de forma geral devem ser evitados nos portadores de IC. Quando o seu uso for imprescindível, há necessidade de maior vigilância no peso corporal, edema e função renal90. Quando a indicação destes agentes for inevitável, parece que o naproxeno apresenta maior segurança cardiovascular do que os inibidores da Cox-2, e os outros AINES como o ibuprofeno e os diclofenacos91 (tabela 23).
IV. Drogas ilícitas
Deve ser recomendada abstinência total sem exceções. A cocaína, por exemplo, compromete diretamente a função ventricular podendo induzir arritmias potencialmente fatais92,93 (tabela 23).
V. Orientações para viagens
Pacientes com IC classe funcional IV devem evitar viagens aéreas ou dirigir veículos. Deve ser recomendada a profilaxia para trombose venosa profunda em pacientes com IC independentemente da classe funcional. Orienta-se uso de meia-elástica de média compressão para viagens prolongadas, devendo-se avaliar o uso de heparina fracionada subcutânea profilática quando duração maior do que 4 horas (tabela 24).
c) Clínicas de IC
I. Definição
O paciente com IC apresenta múltiplos fatores envolvidos tanto em sua gênese, como em sua evolução. A elevada morbimortalidade encontrada em pacientes portadores de IC, requer freqüentes internações e re-internações, exigindo, portanto, abordagem multidisciplinar contínua. Essa complexidade supõe um importante desafio para o sistema de saúde uma vez que existem numerosas lacunas e ineficiências no manuseio desses pacientes quando acompanhados em clínicas não especializadas94.
Dentro desse contexto e objetivando um melhor seguimento dos pacientes portadores de IC torna-se imperativo a criação de clínicas especificas, com corpo multidisciplinar, capaz de fornecer assistência integral ao paciente, levando em consideração o conjunto de determinantes: biológico, psicológico e social95. As evidências têm demonstrado que o acompanhamento dos pacientes nas clínicas de IC melhora a adesão ao tratamento farmacológico e não farmacológico, determina melhor otimização da terapêutica, diminui o número de hospitalizações relacionadas diretamente à doença, com conseqüências diretas na qualidade de vida e redução dos custos hospitalares96. Quanto à mortalidade total, os dados ainda são menos consistentes97,98,99 (tabela 25).
II. Atribuições das clínicas de IC
1. Realizar o diagnóstico diferencial, estabelecer o prognóstico, propor tratamento efetivo e monitorar continuamente o paciente, otimizando a relação custo-efetividade.
2. Estimular a adesão ao tratamento farmacológico e não-farmacológico.
3. Orientar medidas de autocontrole para detecção precoce dos sinais e sintomas de descompensação, por meio de ações educativas ao paciente e seus familiares.
4. Identificar e tratar as co-morbidades.
5. Capacitar e reciclar profissionais com enfoque específico na atenção integral ao paciente, estimulando ensino e pesquisa.
6. Apoiar a criação de associações de pacientes com IC, visando melhor integração de seus participantes e, conseqüentemente, fortalecimento para suas reivindicações.
7. Criar mecanismo de rapidez na assistência frente às primeiras manifestações de descompensação da doença.
8. Fornecer orientação adequada com relação aos aspectos médico-trabalhistas e previdenciário.
As clínicas de IC são classificadas segundo o grau de tratamento disponível, recursos humanos, equipe multidisciplinar, monitoramento, educação e estruturação física (tabela 26).
III. Profissionais integrantes
A base profissional da clínica de IC é constituída por médico cardiologista e enfermeira. A enfermeira coordena a rápida resposta às múltiplas solicitações e serviços para os outros membros da equipe tais como orientação psicológica, nutricional, social, farmacológica, assim como a educação do paciente/família e monitorização contínua destas ações100,101,102 (Figura 3).
IV. Plano de acompanhamento
A monitorização da aderência, complicações e sinais e sintomas de piora da IC são realizados pela enfermeira por meio de contatos telefônicos e visitas domiciliares. É também responsabilidade da enfermeira orientar sobre a necessidade de ajuste da dose de diuréticos51,103.
d) Suporte psicológico do paciente e da família
O diagnóstico de uma doença grave e progressiva pode gerar frustrações e desestruturação psicológica para o paciente e sua família, pois é o primeiro grupo na sua relação. A adaptação à restrição funcional é sempre difícil; produzindo sensação de perda que reflete sua nova situação de vida104. Mudar o estilo de vida implica em uma ameaça quase sempre cercada de ansiedade, angústia, medos, questionamentos e dúvidas.
Por outro lado, considerando que a família convive com o paciente e sua doença, a mesma deve ser acompanhada e orientada, compartilhando perdas, limitações e cuidados. Vale ressaltar que o envolvimento familiar e a motivação do paciente, são imprescindíveis para a adesão às mudanças de estilo de vida105 (tabela 27).
e) Planejamento familiar e medidas anti-estresse
Mulheres com IC em classe funcional III e IV devem ser desaconselhadas a engravidar. Pacientes com IC devem receber orientação sobre o planejamento familiar. A orientação sobre os métodos contraceptivos deve ser individualizada de acordo com a etiologia da cardiomiopatia, classe funcional e biótipo da paciente (tabela 28).
Apesar da recomendação de combate ao estresse, entre as medidas não farmacológicas no tratamento da IC, sua aplicação na prática tem sido pouco implementada. Meditação pode reduzir a atividade simpática e melhorar a qualidade de vida de pacientes com IC106.
A utilização de intervenções comportamentais tais como aprender a relaxar, a meditar e o biofeedback no tratamento de pacientes com falência cardíaca tem recebido pouca atenção até o momento. No entanto, a própria natureza dessa síndrome que envolve ativação neuro-hormonal, sugere um papel potencial dessas técnicas. O estímulo à adoção de medidas anti-estresse, quer em sessões individuais, ou em grupo, deve fazer parte das orientações não farmacológicas (tabela 28).
f) Reabilitação cardíaca
I. Conceito
A alta morbidade e mortalidade assim como a persistente intolerância ao esforço físico que ocorre nos pacientes com IC crônica apesar da terapêutica farmacológica otimizada, levanta a necessidade de pesquisar novas estratégias de tratamento como o treinamento físico regular e contínuo.
Atualmente existem evidências de que a redução do nível de atividade física (secundária à progressão dos sintomas da IC) leva ao descondicionamento físico, que contribui para aumentar ainda mais os sintomas e a intolerância ao exercício. A limitação de atividade física reduz progressivamente a capacidade funcional produzindo efeitos psicológicos negativos107 e comprometimento da resposta vasodilatadora periférica108 configurando a disfunção endotelial109. Estudos randomizados documentaram os benefícios do treinamento físico na capacidade funcional máxima e submáxima, na qualidade de vida, na miopatia esquelética respiratória e de membros, no balanço autonômico, no perfil neurohumoral e na redução de re-hospitalizações110,111,112,113,114,115,116 . Estudo multicêntrico (HF-Action) cujos resultados foram apresentados recentemente não demonstrou benefício quanto à mortalidade ou hospitalização na IC117.
Revisões sistemáticas sugerem que o procedimento é seguro, com efeitos positivos na sobrevida e raros efeitos adversos relacionados ao exercício118. Não há dados disponíveis sobre os pacientes com sintomas avançados (classe IV NYHA), pois geralmente são excluídos dos programas de exercício.
II. Indicação e contra-indicação
Programas de exercícios físicos ativos em associação com o tratamento farmacológico otimizado têm sido recomendados para melhorar a condição clínica e a capacidade funcional de pacientes estáveis em classe funcional (NYHA) II - III sendo considerado custo efetivo119 (tabela 29). Vários estudos randomizados têm demonstrado que o treinamento físico pode reduzir sintomas e aumentar a capacidade funcional120,121,122. Entretanto exercícios competitivos, extenuantes e puramente isométricos devem ser desencorajados.
III. Qualidade de vida
Os estudos que abordaram análise de qualidade de vida utilizam ferramentas diferentes, contudo o instrumento mais utilizado é o questionário "Minnesota Living with Heart Failure"123 com questões de como o paciente percebe os efeitos da doença e do seu tratamento na sua vida diária. As perguntas enfocam sintomas como dispnéia e fadiga, assim como o estado psicológico e laborativo. Alguns estudos mostraram ganhos significativos e correlacionados com aumento de capacidade funcional, mas outros não112,124,125.
IV. Atividade sexual
A orientação sobre a atividade sexual deve fazer parte da rotina de abordagem médica, embora haja consenso estabelecido sobre o aconselhamento dessa atividade (tabela 30). As recomendações e esclarecimentos são dados para assegurar a não progressão dos sintomas. O desempenho tem dependência direta com os temores do paciente e do parceiro. Pouco se sabe sobre os efeitos do tratamento da IC na função sexual, contudo há dados farmacocinéticos sobre alguns medicamentos e seus efeitos adversos126,127 (tabela 31). Estimativas sugerem que 40% dos pacientes homens em classe funcional III referem disfunção sexual128. Alguns fármacos como os inibidores orais da fosfodiesterase 5 (PDE5) têm sido estudados em pacientes com disfunção erétil e portadores de IC. Não há evidências de que o uso de PDE5 aumente o risco de infarto do miocárdio ou estimulem progressão da IC, exceto naqueles pacientes que fazem uso de nitratos, por qualquer via, em que o seu uso tem contra indicação formal, pois poderá acarretar hipotensão arterial severa.
Bocchi e col em estudo clínico controlado e randomizado utilizando o sildenafil em pacientes com IC foi o primeiro a demonstrar que a medicação foi bem tolerada e eficaz para a disfunção erétil neste grupo129.
As informações a respeito da atividade sexual deverão partir do médico assistente, durante a consulta médica.
V. Atividade laborativa
O aumento da capacidade funcional tem sido o objetivo de todos os estudos randomizados para manter a capacidade de trabalho. Nos trabalhadores com tarefas laborativas de força, a troca de função deve ser avaliada de modo individual e periódico e somente após otimização do tratamento farmacológico e não farmacológico. A individualização de cada paciente dentro de seu contexto deve ser levada em consideração na tomada de decisão (tabela 30). A complexidade dos aspectos médicos-trabalhistas relacionados aos pacientes com IC e a falta de estudos abrangentes sobre o tema, devem ser considerados como fatores limitantes para orientação de decisões.
A realocação deve ser sempre uma meta a considerar, contudo depende de vários fatores relacionados ao paciente, como por exemplo, o nível educacional. No entanto, duas situações devem ser avaliadas: a) quando a atividade profissional não interferir na progressão, nos sintomas e na gravidade da doença, a realocação não é necessária; b) quando a atividade laborativa impactar diretamente na gravidade da doença, a realocação deverá ser avaliada.
VI. Teste ergoespirométrico
Os mecanismos fisiopatológicos da limitação da capacidade funcional na IC não estão totalmente esclarecidos, pois não existe correlação entre capacidade física e parâmetros hemodinâmicos de repouso. As limitações periféricas secundárias a anormalidades funcionais e estruturais da musculatura esquelética com predominância de fibras musculares do tipo II têm sido identificadas na IC como potencial fator de intolerância ao exercício130. O teste de esforço cardiopulmonar é uma técnica bem estabelecida para avaliação da tolerância ao exercício e do diagnóstico na IC. O consumo de oxigênio de pico (VO2 pico) medido no teste é um marcador prognóstico e um importante critério na seleção de candidatos para transplante de coração. A Sociedade Internacional de Transplante de Coração e Pulmão recomenda que pacientes com VO2 pico < 14 ml.kg-1.min-1 e razão da troca repiratória > 1.05 (RER) podem ser aceitos em lista de transplante. Pacientes que fazem uso de BB requerem reavaliação desses valores uma vez que um menor valor de VO2 pico parece ser mais apropriado. Assim, na presença de terapêutica com BB o ponto de corte do VO2 pico < 12 ml.kg-1.min-1 poderá ser usado como parâmetro no seguimento clínico de pacientes com IC131.Outras variáveis do teste ergoespirométrico também têm demonstrado valor prognóstico na IC, como a respiração periódica, a relação entre a ventilação pulmonar (VE, em l.min-1) e a produção de dióxido de carbono (VCO2, em l.min-1) expressa como inclinação VE/VCO2; valores > 35 têm mostrado prognóstico desfavorável na IC, embora seu valor ainda não esteja completamente definido131,132,133. Além disso, o teste poderá ajudar no diagnóstico diferencial de dispnéia, avaliar a resposta a intervenções terapêuticas e auxiliar na prescrição de exercício (tabela 32). O teste ergoespirométrico de caminhada de 6 minutos, introduzido por Guimarães e Bocchi, também pode ser uma ferramenta na avaliação funcional de pacientes com insuficiência cardíaca, pois reflete o exercício das atividades habituias134,135.
VII. Prescrição do exercício
O exercício físico tem sido indicado em algumas estratégias recentes de análise de custos para internações hospitalares por IC, como recurso promissor para a redução de custos. Além de ser seguro e não aumentar a mortalidade, melhora a qualidade de vida, e o desempenho funcional. Poucos estudos têm demonstrado o efeito do exercício em longo prazo ou definem protocolos de exercícios. Tradicionalmente o método utilizado para prescrição de exercício aeróbico é a caminhada ou o cicloergômetro, mas recentemente, a atividade física intervalada tem sido demonstrada como método efetivo, seguro e bem tolerado em pacientes com IC. A carga de trabalho é realizada em blocos de menor e maior intensidade, variando de 50 a 80% da freqüência cardíaca máxima136.
Programa de treinamento físico domiciliar137, hidroterapia138, yoga139, meditação106 e tai chi chuan140 também têm sido proposto alternativamente para pacientes com IC. Assim como o programa de atividade física formal, esses programas parecem ser seguros e efetivos em diminuir sintomas e melhorar a qualidade de vida de pacientes com IC.
O condicionamento físico deveria ser estimulado para todos pacientes com IC estável que sejam capazes de participar de programa de treinamento físico (tabela 33). Assim como a terapêutica clínica cuida de manter a função de compensação dos órgãos, a atividade física promoveria adaptações fisiológicas favoráveis, melhorando a qualidade de vida nesses pacientes.
VII. Tratamento farmacológico
A figura 4 esquematiza a estratégia de tratamento para uso de fármacos e dispositivos em pacientes com IC sintomática e disfunção sistólica.
a) Inibidores da enzima conversora de angiotensina II (IECA)
I. Mecanismos de ação
Os mecanismos de ação dos inibidores da enzima de conversão da angiotensina (IECA) são complexos. As ações que mais imediatamente se associam aos seus efeitos cardiovasculares resultam da diminuição da formação de angiotensina II e do acúmulo de bradicinina. As conseqüências diretas da diminuição da angiotensina II incluem a redução do efeito vasoconstritor, do efeito retentor de sódio (via aldosterona), e do efeito trófico na musculatura lisa de vasos, nas células miocárdicas e fibroblastos. Outros efeitos potencialmente benéficos resultam da diminuição da ativação simpática, restauração de barorreflexos pela ativação parassimpática, normalização da função do endotélio, redução do inibidor do ativador do plasminogênio, diminuição da endotelina e da arginina-vasopressina. O acúmulo de bradicininas, possivelmente, se relaciona à síntese de prostaglandinas vasodilatadoras e à maior geração de óxido nítrico141.
II. Benefícios clínicos
Os IECA constituem um grupo de fármacos com comprovados benefícios na evolução de pacientes com IC, tanto em relação à morbidade, como à mortalidade. Esta afirmação baseia-se em numerosos ensaios randomizados, placebo-controlados ou comparativos, que atestaram os benefícios dos IECA nos diferentes estágios evolutivos da IC, e de disfunção ventricular sistólica, inclusive na assintomática142,143,144,145.
O uso de IECA está fundamentado nas diferentes etiologias de IC bem como em pacientes com disfunção ventricular esquerda pós-infarto do miocárdio146,147 (tabela 34).
III. Ajuste terapêutico
A prescrição de IECA deve ser iniciada em todos os pacientes, salvo contra-indicações, em doses inicialmente baixas e progressivamente aumentadas até atingirem a dose-alvo (tabela 35). Os níveis de creatinina e potássio devem ser monitorados.
IV. Contra-indicações
São contra-indicações para o uso de IECA: potássio sérico > 5,5 mEq/l, estenose de artéria renal bilateral, história de angioedema documentado com uso prévio de IECA, hipotensão arterial sistêmica sintomática, estenose aórtica grave. Precauções devem ser tomadas ao iniciar IECA em pacientes com nível de creatinina sérica > 3 mg/dl ou hipotensão arterial sistêmica sistólica persistente inferior a 80 mmHg141.
V. Efeitos adversos
Os efeitos adversos mais comumente observados são tosse, hipotensão arterial, angioedema e insuficiência renal. No caso de tosse, a substituição pelos bloqueadores de angiotensina II está indicada. A combinação hidralazina-isossorbida é preferencialmente indicada nos casos de insuficiência renal, uma vez que apresenta benefício comprovado em pacientes com IC sistólica148. Embora a hipotensão arterial venha a ser um efeito adverso relativamente comum, somente em caso de estar associada a sintomas ou piora da função renal é que se torna uma indicação de redução ou suspensão.
b) Beta-bloqueadores (BB)
I. Mecanismo de ação
Os BB apresentam diversas atuações na fisiologia e metabolismo do cardiomiócito de pacientes com IC em decorrência de sua ação no antagonismo da atividade simpática, que cronicamente apresenta efeitos deletérios à função e geometria ventricular. Os benefícios da redução do antagonismo da atividade simpática se traduzem pela melhora clínica e da função ventricular com aumento da sobrevida dos pacientes com IC149.
Os BB com eficácia clínica comprovada no tratamento da IC são: carvedilol, bisoprolol e succinato de metoprolol. Recentemente, o nebivolol teve a sua eficácia demonstrada em idosos.
II. Propriedades farmacológicas
Os BB apresentam diferentes propriedades farmacológicas na β1-seletividade. O bisoprolol150 e o nebivolol151 têm maior seletividade, seguidos pelo succinato de metoprolol152. No que se refere à atuação lipofílica, o BB que apresenta esta atividade é o carvedilol e, portanto, maior atuação sobre o sistema nervoso central e maior metabolismo hepático, com conseqüente menor meia-vida. O bisoprolol, o nebivolol e o succinato de metoprolol apresentam uma atuação lipofílica menor, com conseqüente reduzida ação central e menor metabolismo hepático, o que os confere a propriedade de posologia uma vez ao dia. Outros aspectos são as atuações de α-bloqueio do carvedilol, ocasionando atividade vasodilatadora moderada e propriedades anti-oxidantes em nível endotelial 149,153 e o nebivolol apresenta propriedades vasodilatadoras secundárias ao seu efeito modulador sobre o óxido nítrico. O carvedilol pode determinar um remodelamento reverso da função simpática nervosa cardíaca154.
III. Benefícios clínicos
Os BB apresentam benefícios clínicos comprovados de melhora da classe funcional, redução da progressão dos sintomas de IC e redução de internação hospitalar, em pacientes com IC com disfunção sistólica, classe funcional I a IV da NYHA150,155,156,157,158,159 (tabela 36). Não se observou melhora na capacidade ao exercício, em decorrência ao seu efeito cronotrópico negativo160. Os benefícios terapêuticos dos BB foram observados de forma consistente em pacientes com miocardiopatia dilatada de origem isquêmica ou não, sem influência da raça, sexo, idade e do ritmo sinusal ou fibrilação atrial. Os BB foram testados em populações brasileiras com sucesso154,161,162.
Quando associados aos IECA ou BRA, aumentam sobrevida por redução na mortalidade global e cardiovascular. A redução da mortalidade cardiovascular deve-se a uma redução de cerca de 20% na morte por progressão do IC e de 36% a 44% na morte súbita. Estes benefícios foram demonstrados de forma semelhante com os três tipos de BB150,152,156.
Nos pacientes assintomáticos, somente no grupo com disfunção ventricular pós-infarto do miocárdio, é que se tem comprovado o benefício dos BB na redução da mortalidade total e cardiovascular157.
Nos pacientes idosos (> 70 anos) a utilização de nebivolol demonstrou benefício na redução de eventos combinados de mortalidade e internação hospitalar por IC151.
A utilização dos BB como monoterapia, assim como o seu ajuste até a dose tolerada antes do ajuste do IECA, demonstraram benefícios clínicos semelhantes ao uso isolado da IECA, e resultados superiores na redução da remodelagem e melhora da função ventricular em longo prazo163,164. Não foi observado aumento de efeitos adversos como hipotensão arterial e bradicardia, ou agravamento da IC.
O estudo CIBIS III demonstrou a possibilidade do início da terapia com bisoprolol anterior ao do maleato de enalapril com redução significativa de morte súbita e reinternação hospitalar sem agravamento do quadro clínico de congestão pulmonar ou sistêmica165.
Os BB apresentam ação (três a seis meses) de remodelamento reverso e melhora da função ventricular quando comparados com IECA e BRA157,159,163,164.
IV. Ajuste terapêutico e posologia
Os BB devem ser iniciados em pacientes em classe funcional de I a IV da NYHA, com disfunção sistólica, em ritmo sinusal ou fibrilação atrial, sem hipotensão sintomática. (tabela 36).
Os BB podem ser iniciados em associação com IECA ou BRA, ou como monoterapia. No uso associado com IECA ou BRA, pode-se iniciar ambos os medicamentos em conjunto. A posologia inicial dos BB deve ser com baixas doses, sendo ajuste gradual com intervalo de 7 a 14 dias, tendo como alvo as doses máximas preconizadas para cada BB (tabela 37). Antes de cada ajuste, deve-se avaliar a tolerância do paciente através do exame clínico e realização do eletrocardiograma, quando possível. Nestes casos, deve-se verificar o agravamento ou desenvolvimento de: a) sintomas e sinais de piora do quadro congestivo ou de baixo débito; b) hipotensão arterial sintomática ou redução da pressão arterial sistólica abaixo de 85 mmHg; c) alargamento do espaço P-R (>0,28 seg); d) bradicardia sinusal (FC< 60 ppm); e e) bloqueio sino-atrial ou atrio-ventricular avançado.
V. Suspensão ou contra-indicação
Tartarato de metoprolol, propranolol e atenolol não foram testados em grandes estudos randomizados, na melhora da sobrevida e função ventricular, portanto não devem ser utilizados no tratamento da IC quando na disponibilidade de medicamentos com eficácia comprovada.
Na fase inicial da introdução dos BB, cerca de 15% dos pacientes poderão apresentar algum grau de piora do quadro clínico. No desenvolvimento de hipotensão arterial, o excesso de diurético ou doses elevadas de vasodilatadores, IECA ou BRA, podem ser os responsáveis. Nestas situações, a prioridade é a manutenção ou aumento da dose do BB, devendo-se modificar a dose de outros medicamentos. O desenvolvimento ou agravamento da dispnéia e/ou edema, usualmente são contornados com o aumento da dose do diurético. Em outras situações não toleráveis ou que determinem risco (bradicardia importante, alargamento do P-R com bloqueio A-V, hipotensão arterial importante) devemos reduzir a dose do BB para a posologia anterior ou avaliar a sua suspensão.
Em pacientes internados por IC descompensada, não se deve suspender os BB de uso prévio, exceto na presença de choque cardiogênico, bloqueio átrio-ventricular ou sino-atrial avançados ou de bradicardia sintomática. Em pacientes com pressão arterial sistólica inferior a 85 mmHg ou com sinais de hipoperfusão periférica devemos reduzir inicialmente a posologia dos BB em 50% e reavaliar a resposta.
c) Bloqueadores dos receptores de angiotensina II (BRA)
I. Mecanismo de Ação
A angiotensina II provoca efeitos adversos no coração, sistema arterial, glomérulo renal e na coagulação. Os BRA atuam de forma seletiva no bloqueio dos receptores do subtipo AT1 da angiotensina II, liberando a ação da AT-2, promovendo redução dos níveis de aldosterona e catecolaminas, vasodilatação arterial com consequente diminuição da resistência vascular periférica. Apresentam ainda, atividade antiproliferativa, com pouco efeito no cronotropismo e inotropismo. Não interferem na degradação da bradicinina, reduzindo a incidência de tosse.
Estudos atuais vêm demonstrando que os IECA não inibem por completo o sistema renina angiotensina-aldosterona, e que o seu uso continuado pode gerar "escape" da conversão de angiotensina II e da ativação da aldosterona. Portanto, um bloqueio na via final do sistema renina-angiotensina-aldosterona (SRAA) poderia proporcionar um bloqueio mais efetivo do sistema.
II. Benefícios clínicos
De forma geral, os BRA têm sua principal indicação em pacientes portadores de IC crônica com fração de ejeção (FE) reduzida intolerantes aos IECA, reduzindo morbi-mortalidade166,167.
Em portadores de disfunção ventricular assintomática, não foi testado adequadamente, ficando ainda reservado aos que não toleram os IECA.
Na IC com FE preservada, foi apropriadamente avaliado em estudo recente, surgindo como opção eficaz na redução de internações hospitais, sem evidências na redução da mortalidade168.
O uso associado com IECA em pacientes que permaneçam sintomáticos, a despeito do tratamento otimizado, reduz a combinação de mortalidade ou reinternação. Neste caso, a associação com antagonistas da aldosterona deve ser utilizada com cautela, com freqüente monitorização dos níveis séricos de potássio.
III. Ajuste terapêutico
Os BRA podem ser utilizados como primeira opção no tratamento de pacientes com IC sistólica, em casos selecionados. (tabela 38).
O medicamento deve ser iniciado com doses baixas, sendo aumentada progressivamente, até atingir a dose alvo (tabela 39) ou a máxima tolerada. A avaliação clínica deve ser periodicamente realizada acrescida de avaliação laboratorial (creatinina e potássio séricos).
IV. Efeitos adversos
Os efeitos adversos mais freqüentes são hipotensão arterial, piora da função renal e hiperpotassemia. O angioedema e a tosse também são observados com uma freqüência menor que os IECA.
V. Contra-indicações
As contra-indicações são semelhantes às dos IECA.
d) Antagonista de Aldosterona
I. Mecanismos de ação
Níveis elevados de aldosterona estimulam a produção de fibroblastos e aumentam o teor da fibrose miocárdica, perivascular e perimiocítica, provocando rigidez muscular e disfunção. Além disso, a aldosterona provoca dano vascular por diminuição da complacência arterial, modula o equilíbrio da fibrinólise por aumentar o PAI-1(inibidor do ativador do plasminogênio), predispondo a eventos isquêmicos. Pode ocasionar disfunção de barorreceptores, ativação simpática, agravar a disfunção miocárdica e, por conseqüência, fazer progredir a IC. Por outro lado, acarreta retenção de Na+ e água, determinando perda de K+ e Mg++, aumentando a liberação de neuro-hormônio adrenérgico e o risco para arritmias cardíacas e morte súbita. Assim, seu bloqueio pode reduzir a síntese e o depósito do colágeno, melhorando a função miocárdica63.
II. Benefícios clínicos
Neste grupo de medicamentos, temos a espironolactona (com maior tempo de uso e com estudos que comprovaram sua eficácia) e o eplerenone (recentemente comercializado, porém ainda não disponível no Brasil), e ambos antagonizando a ação da aldosterona.
A espironolactona tem eficácia comprovada na redução de mortalidade em pacientes com classe funcional III-IV e FEVE<35%169. Em pacientes assintomáticos pós IAM com FEVE<40%, o eplerenone reduziu mortalidade geral e cardiovascular, hospitalização e morte súbita170 (tabela 40).
III. Ajuste terapêutico
Pode-se iniciar o tratamento com espironolactona na dose de 12.5 - 25 mg/dia e o eplerenone na dose de 25mg, podendo ser aumentada até 50 mg/dia em pacientes com persistência dos sinais e sintomas de congestão.
O paciente deve ter os seus níveis séricos de potássio monitorados com freqüência (semanal) no 1º mês do tratamento. Recomenda-se a redução da dose para 12.5 mg/dia ou mesmo em dias alternados de acordo com os níveis séricos do potássio (>5 mEq./l). A suspensão está indicado caso potássio >5.5 mEq/l.
IV. Efeitos adversos
Hiperpotassemia, ginecomastia e mastodínia (ginecomastia dolorosa) são efeitos adversos encontrados principalmente com espironolactona.
V. Contra-indicações
Não está recomendado em pacientes com creatinina >2,5 mg/dl ou potássio sérico > 5,0 mEq./l.
e) Diuréticos
I. Mecanismo de ação
Promovem natriurese, contribuindo para a manutenção e melhor controle do estado volêmico171.
Tiazídicos
Seu mecanismo de ação se faz no começo do túbulo distal, ao bloquear o co-transporte de Na+-Cl-. A ação natriurética dos tiazídicos é modesta em relação a outros diuréticos e perdem sua efetividade em pacientes com função renal comprometida (clearance de creatinina < 30 ml/min). Os principais representantes são a hidroclorotiazida e a clortalidona172.
Diuréticos de alça
Esses diuréticos determinam aumento da excreção da carga de sódio e mantém sua eficácia, a não ser que a função renal esteja gravemente comprometida. Os principais representantes dessa classe são a furosemida e a bumetamida. Esses agentes aumentam o fluxo sangüíneo renal sem aumentar a taxa de filtração, especialmente após administração intravenosa173,174,175.
II. Benefícios clínicos
Na IC os diuréticos são raramente utilizados como monoterapia, sendo de preferência associados com IECA e BB. Os diuréticos de alça são freqüentemente utilizados nos pacientes com classes funcionais mais avançadas (III/IV), em decorrência das suas ações: 1) maior excreção de água para o mesmo nível de natriurese; 2) manutenção da sua eficácia, a despeito da disfunção renal que freqüentemente se observa na IC; 3) ação diurética diretamente relacionada à dose utilizada.
Por outro lado, os diuréticos tiazídicos têm sido utilizados nas formas brandas de IC (classe funcional II), com boa eficácia na melhora clínica dos pacientes.
Alguns estudos clínicos demonstraram melhora dos sintomas de congestão, aumento da capacidade ao exercício, e redução do risco de descompensação. Os seus efeitos sobre a mortalidade não estão bem definidos, em função da ausência de ensaios clínicos com esta finalidade172,176,177.
A utilização de doses elevadas dos diuréticos não poupadores de potássio está associada a aumento da mortalidade em longo prazo178.
Devido à falta de evidências clínicas, os diuréticos devem ser evitados em pacientes com classe funcional I (tabela 41).
III. Ajuste terapêutico
O início da terapia com diuréticos deve obedecer a um racional de aumento progressivo de doses conforme o estado congestivo; ou seja, naqueles pacientes pouco congestos doses menores devem ser utilizadas. Nos pacientes em que há perda progressiva do efeito diurético com furosemida (resistência a diuréticos), a associação com tiazídicos, promovendo bloqueio seqüencial do néfron, pode levar a aumento do efeito diurético (tabela 42).
IV. Efeitos adversos
De maneira geral, sabe-se que o uso de diuréticos de alça promove ativação adicional do eixo renina-angiotensina, agravando efeitos neuro-humorais deletérios. Distúrbios eletrolíticos (hipocalemia, hipomagnesemia, hiponatremia) e metabólicos (hiperglicemia, hiperlipidemia, hiperuricemia), hipovolemia e ototoxidade, este último menos freqüente na forma oral, são também observados na terapia diurética (tabela 43).
Nos pacientes com disfunção renal subjacente e/ou hipovolemia, o uso de diurético poderá agravar a função renal.
f) Hidralazina e Nitrato
I. Mecanismos de ação
Os nitratos induzem vasodilatação ao regenerar o radical NO livre ou um congênere de NO, S-nitrosotiol (SNO). Os efeitos globais na musculatura lisa são a redução da concentração de cálcio no citosol e redução na fosforilação da miosina de cadeia leve, o que leva à vasodilatação179,180. Doses baixas de dinitrato de isosorbida (30 mg três vezes ao dia) dilatam preferencialmente o sistema venoso. Vasodilatação arterial é tipicamente associada a doses maiores181,182.
Hidralazina é um dilatador seletivo da musculatura arterial. Embora o exato mecanismo mediando a vasodilatação arterial ainda seja motivo de dúvidas, tem sido demonstrado que a hidralazina está mais provavelmente envolvida com a liberação de catecolaminas intravesiculares, dentro de neurônios183,184. A hidralazina tem sido também descrita como capaz de reparar a atividade da ALDH-2 vascular, o que pode prevenir a tolerância ao nitrato185.
II. Benefícios clínicos
O estudo V-HEFT I demonstrou uma redução de 34% na mortalidade após 2 anos de tratamento com a combinação de hidralazina e nitrato quando comparado com placebo, ou o antagonista de receptores alfa-1, prazozin148. A mortalidade total ao final do estudo foi reduzida em 28%, o que foi de significância limítrofe (p=0.05), sendo atribuído ao pequeno tamanho amostral. Com base nos resultados do VHEFT-I, foi desenhado o VHEFT-II, para comparar os efeitos do inibidor da ECA, enalapril, com a associação nitrato/hidralazina em pacientes com IC CF II/III NYHA142. Aos dois anos, enalapril foi associado à redução de mortalidade de 28% e de 11% ao final do acompanhamento. A redução de mortalidade foi devido principalmente à redução de morte súbita. Isso foi observado a despeito de maiores incrementos de fração de ejeção e capacidade funcional observados com a combinação hidralazina e nitrato. As doses médias de nitrato/hidralazina foram aproximadamente 25% menores do que as alcançadas no VHEFT-I.
Uma análise subseqüente do VHEFT I e II revelou que em ambos os estudos havia diferenças nos desfechos entre brancos e negros. A mortalidade anual no VHEFT-I não foi diferente entre brancos e negros recebendo placebo. Entretanto, pacientes negros em uso de hidralazina/nitrato comparados com aqueles recebendo placebo tiveram uma redução significativa na mortalidade anual, enquanto nenhuma diferença foi vista entre os brancos. De forma semelhante, pacientes brancos em uso de enalapril no VHEFT II tiveram mortalidade anual significativamente menor, quando comparado com aqueles em uso de hidralazina e nitrato, enquanto que não houve diferença entre os negros em uso de enalapril comparado com hidralazina e nitrato186.
O estudo African-American Heart Failure Trial (A-HeFT) investigou o uso da associação hidralazina e nitrato adicionada ao tratamento padrão numa população que se autodenominava como negra187. O estudo foi interrompido precocemente devido à redução de mortalidade no grupo tratamento. Nesse estudo também foi observada redução de hospitalizações e melhora da qualidade de vida (tabela 44).
g) Digoxina
A digoxina está indicada em pacientes com IC com disfunção sistólica, associado à freqüência ventricular elevada na fibrilação atrial, com sintomas atuais ou prévios188. Em pacientes com ritmo sinusal e disfunção sistólica, principalmente se sintomáticos, os resultados do estudo DIG TRIAL mostraram que o emprego da digoxina se associa à redução de hospitalizações, sem impacto na mortalidade (tabela 45). A suspensão do digital em pacientes com IC com fração de ejeção reduzida pode levar a piora sintomática e aumento nas hospitalizações189,190. Os digitálicos não estão indicados para o tratamento da IC com fração de ejeção preservada (FEVE > 45%) e ritmo sinusal191 (tabela 45).
I. Contra-indicações
O uso da digoxina está contra-indicado em pacientes que apresentem bloqueio AV de segundo grau Mobitz II e terceiro grau; doença do nó sinusal sem proteção de marcapasso e em síndromes de pré-excitação192. Deve ser administrado com precaução em idosos, portadores de disfunção renal e pacientes com baixo peso. Cuidado adicional deve ser tomado em relação a interações medicamentosas (amiodarona, quinidina, verapamil, diltiazem, quinolônicos) que podem elevar os níveis séricos da digoxina.
II. Doses empregadas
A digoxina é comumente prescrita na dose de 0,125mg ou 0,25mg via oral por dia. Não há evidência que suporte o uso de doses de ataque ou doses adicionais. A maior parte dos pacientes deve receber 0,125mg por dia. Em idosos, portadores de insuficiência renal e pacientes com peso baixo, especialmente mulheres, a dose de digoxina pode ser ainda menor (0,125mg em dias alternados).
III. Intoxicação digitálica
Pacientes em uso de digoxina que apresentem distúrbios gastrointestinais (anorexia, náuseas e vômitos), neurológicos (confusão mental, xantopsia) ou cardiovasculares (bloqueios átrio-ventriculares, extra-sístoles ventriculares polimórficas freqüentes ou, mais especificamente, taquicardia atrial com BAV variável) devem ter o digital suspenso, pelo menos temporariamente. Nestes casos, o nível sérico de digoxina pode ajudar a confirmar o diagnóstico, porém a conduta de suspender o medicamento não deve ser retardada por este motivo. Mesmo indivíduos com nível sérico baixo podem ter intoxicação digitálica, principalmente se houver hipocalemia ou hipomagnesemia concomitante.
O reconhecimento precoce destes sinais e sintomas, bem como ajuste eletrolítico associado à suspensão da digoxina, normalmente são suficientes para a reversão do quadro. Em caso de intoxicação potencialmente letal e/ou refratária, caso esteja disponível, pode-se utilizar anticorpo anti-Fab.
IV. Evidências clínicas
Diversos estudos documentaram a eficácia da digoxina em reduzir desfechos clinicamente relevantes em pacientes com IC188,189,190,193. Estes estudos evidenciaram melhora sintomática, da capacidade aeróbica e da qualidade de vida na IC sintomática (classe funcional II-IV). Tais benefícios ocorreram independentemente do ritmo de base ou da etiologia da IC. Vale ressaltar que estes estudos foram executados na era anterior à utilização de BB no tratamento da IC sistólica.
Por outro lado, um braço do estudo DIG avaliou o efeito da digoxina versus placebo em pacientes com fração de ejeção preservada. O uso de digoxina não teve qualquer efeito em mortalidade ou em hospitalização por causa cardiovascular. Houve tendência à redução de hospitalização por piora da IC, porém também houve aumento da tendência de aumento de hospitalizações por angina instável191.
Mais recentemente, documentou-se que níveis séricos de digoxina acima de 1,0 ng/dl estão associados à maior chance de morte, em análise retrospectiva dos estudos SOLVD e DIG. O subgrupo que manteve níveis entre 0,3 e 0,9 ng/ml teve o maior benefício, incluindo menor mortalidade entre homens194,195,196. A partir destes achados, passou-se a recomendar doses mais baixas de digoxina no intuito de tentar obter estes níveis séricos. Ainda permanece em debate se utilização de níveis séricos como guias terapêuticos trariam algum benefício adicional.
Os estudos PROVED e RADIANCE revelaram a necessidade em manter-se a digoxina em pacientes com IC sintomática, sob pena de piora da classe funcional e aumento de chance hospitalização189,190.
h) Anticoagulantes e antiagregantes plaquetários
I. Racional fisiopatológico
A IC é fator de risco para fenômenos tromboembólicos. O racional para esta maior incidência está na estase sanguínea nas câmaras cardíacas e nos vasos sanguíneos periféricos inerentes aos estados de baixo débito, eventualmente associada à lesão endotelial ou estados pro-trombóticos. A conjunção destes fatores pode induzir a geração de trombina com conseqüentes trombos intracavitários ou periféricos.
II. Evidências clínicas
Os estudos em IC têm mostrado incidência de acidente vascular encefálico isquêmico ao redor de 2% ao ano, mesmo em pacientes com disfunção sistólica muito grave ou com trombos intracavitários. Isto justifica o fato de não ter sido documentado benefício ao anticoagular-se com varfarina pacientes com IC sistólica, sem maiores estratificações de risco tromboembólico197,198,199.
Desta forma, uma vez que a disfunção sistólica, por si só, não justifica o uso de drogas antiagregantes plaquetárias ou anticoagulantes, fez-se necessário buscar subgrupos de pacientes com IC que sejam potenciais alvos para estas estratégias terapêuticas. Assim, identificou-se algumas situações clínicas em que fenômenos tromboembólicos são mais freqüentes, dentre eles a presença de fibrilação atrial paroxística, persistente ou permanente200,201, a presença de trombos cavitários com características emboligênicas, (móveis, pediculados), além daqueles com história de fenômenos tromboembólicos prévios198. Existem, também, algumas etiologias de IC que cursam com maior chance de fenômenos tromboembólicos, como o miocárdio não-compactado associado à FEVE < 40%, amiloidose cardíaca e cardiomiopatia dilatada familiar com história de fenômenos tromboembólicos em parentes de primeiro grau.
Um escore (CHADS2) em portadores de FA propõe uma estratificação de risco de fenômenos tromboembólicos baseado em características clínicas, quais sejam: IC sintomática ou FEVE <35%, hipertensão arterial sistêmica, idade >75 anos, diabetes mellitus ou acidente vascular encefálico isquêmico. Caso o paciente apresente, além da IC, pelo menos um fator de risco adicional, recomenda-se o uso de varfarina na prevenção de fenômenos tromboembólicos. Em pacientes sem fatores de risco adicionais, pode-se optar por aspirina ou varfarina202.
Nestes pacientes, justifica-se anticoagulação com cumarínicos. Pode-se utilizar a varfarina ou a femprocumona 3mg com alvo terapêutico de INR entre 2,0 e 3,0. Na maioria destes subgrupos, o uso de antiagregantes plaquetários como a aspirina não apresenta a mesma eficácia, embora possa conferir alguma proteção em portadores de FA202 (tabela 46).
O uso rotineiro de antiplaquetários não está indicado na IC203. A aspirina é largamente empregada nos casos de doença coronária concomitante. Nestes casos, é recomendável utilizar-se as menores doses possíveis de aspirina (75-100mg). Entretanto, não há evidências que justifiquem o uso da aspirina em longo prazo em portadores de miocardiopatia isquêmica com IC sintomática. Críticos ao uso desta droga neste contexto advogam que, além de não haver benefício claro, existe potencial interação negativa da aspirina com os IECA reduzindo o efeito deste medicamento de comprovada eficácia na IC. Desta forma, em pacientes com cardiomiopatia isquêmica sem evidência de isquemia recente e disfunção sistólica sintomática, o uso de antiagregantes plaquetários é controverso e a aspirina deve ser evitada em pacientes com recorrentes hospitalizações por piora da IC197 (tabela 46).
Não há estudos controlados que evidenciem benefício de outros antiagregantes plaquetários na IC. Um estudo randomizado comparando desfechos de pacientes com IC sistólica com FEVE < 35%, sem FA ou próteses mecânicas, tratados com varfarina (INR entre 2,5 a 3,0) ou aspirina (325mg) está em andamento e deverá prover novas evidências para tentar elucidar esta questão204.
III. Profilaxia de fenômenos tromboembólicos durante hospitalização
Pacientes acamados apresentam, reconhecidamente, maior risco de tromboembolismo venoso. Na IC, a estase venosa crônica acentua a chance desta doença e, neste contexto, o uso profilático de heparinas subcutâneas é eficaz na sua prevenção. Desta forma, deve-se indicá-las para todos os pacientes com IC hospitalizados e impossibilitados de deambular, exceto se houver contra-indicação. A eficácia desta profilaxia foi documentada na IC205. Não há diferença de eficácia entre os diversos tipos de heparina disponíveis no mercado (tabela 47).
i) Antiarrítmicos
Arritmias ventriculares e morte súbita são comuns em pacientes com IC aguda e crônica e disfunção ventricular sistólica. Fibrilação atrial pode ocorrer em até 15 a 30% dos pacientes com IC, e é frequentemente causa de descompensação cardíaca206.
Com o avanço no tratamento da IC, os antiarrítmicos perderam relevância, não sendo indicados como rotina para prevenção de morte súbita (exceto os BB) e ficando reservados para situações específicas.
Os BB fazem parte da terapia padrão da IC com impacto na redução da mortalidade total e da morte súbita arrítmica150,152,207. Estes medicamentos têm também indicação na terapia adjuvante ao cardiodesfibrilador implantável (CDI) para suprimir taquiarritmias ventriculares sintomáticas, prevenindo disparos de terapias208. Assim, os BB têm efeitos antiarrítmicos e são opções medicamentosas da terapia antiarrítmica.
A amiodarona é um agente antiarrítmico de classe III cujo uso como terapia primária era controverso até a publicação do estudo SCD-HeFT209. Este estudo estabeleceu que não há benefício com uso de amiodarona na prevenção primária quando comparado ao placebo, independente da etiologia da IC. Só deveria ser usada nesta situação quando o paciente recusar o uso de CDI. Por outro lado, é recomendada como terapia adjunta com BB em pacientes com disfunção de VE com CDI que tem episódios repetitivos de taquicardia ventricular ou choques apropriados210,211.
Sendo também efetiva contra a maioria das arritmias supraventriculares, inclusive a fibrilação atrial, a amiodarona é a droga de escolha para a restauração e manutenção do rítmo sinusal em pacientes com IC, se não houver indicação de cardioversão elétrica.
A administração crônica de amiodarona está associada a interações medicamentosas complexas envolvendo pulmões, fígado, tireóide e pele, que são menos freqüentes com doses menores (100-200 mg/dia). Os efeitos colaterais incluem microdepósitos na córnea (>90%), neurite/neuropatia ótica (1-2%), descoloração acinzentada da pele (4-9%), fotossensibilidade (25-75%), hipotiroidismo (6%), hipertiroidismo (0,9-2%), toxicidade pulmonar (1-17%, mais frequente com doses > 400 mg/d) e hepatotoxicidade (elevação enzimática 15-30%, hepatite e cirrose < 3%)212. A toxicidade pulmonar determinando dispnéia deve ser diferenciada da sintomatologia da IC213. Como regra geral, quanto maior o tempo de utilização e a dose, maior a probabilidade de aparecimento de efeitos colaterais que podem exigir a suspensão deste medicamento. Pode interagir com muitos medicamentos como potencializando os efeitos da warfarina.
Não há indicação para uso de rotina de antiarrítmicos do grupo I e IV na IC, sendo que aquelas do grupo IA e IC aumentam o risco de morte.
Em resumo, os BB devem ser usados como terapia primária para o tratamento de arritmias ventriculares e prevenção de morte súbita em pacientes com IC. A eficácia dos demais antiarrítmicos é questionável e cada medicamento tem risco potencial de efeitos adversos, incluindo a pró-arritmia (tabela 48).
j) Bloqueadores dos canal de cálcio
Em relação aos bloqueadores dos canais de cálcio, aqueles de 1ª geração, representados pelo verapamil, diltiazem, nifedipina e nicardipina apresentam acentuados efeitos cronotrópicos e inotrópicos negativos. Alguns estudos demonstraram efeitos deletérios destes medicamentos quando comparados ao placebo ou dinitrato de isossorbida no tratamento da IC214,215.
Anlodipina e felodipina, bloqueadores de 2ª geração, têm elevada especificidade no sítio ativo dos complexos canais de cálcio com longa duração de ação e pouco ou nenhum efeito inotrópico negativo nas doses usuais. Tornam-se, assim, melhor tolerados do que os outros bloqueadores de canal de cálcio em pacientes com IC. Porém estudos não mostraram benefício ou malefício quando usados em pacientes em classe funcional II ou III216,217,218. A anlodipina reduziu eventos fatais e não fatais em pacientes com miocardiopatia não isquêmica no estudo PRAISE. O uso de anlodipina foi associado a maior frequência de edema pulmonar e periférico, e menor incidência de hipertensão arterial e angina219. Parecem seguros em pacientes selecionados com IC com angina e hipertensão como terapia adjuvante aos IECA e BB. (tabela 49).
Não há muitos estudos que possam orientar quanto ao uso dos bloqueadores de canal de cálcio em pacientes com IC e fração de ejeção preservada. Estas drogas são muitas vezes usadas na presença de co-morbidades (p.ex. fibrilação atrial, hipertensão arterial e doença arterial coronária) e as diretrizes específicas devem ser empregadas220.
VIII. Tratamento cirúrgico
O tratamento cirúrgico da IC é uma área de grande desenvolvimento no cenário brasileiro, e sua indicação deve ser considerada na presença de doenças cirurgicamente corrigíveis e principalmente na presença de sintomas de IC. Em geral, influenciam os resultados do tratamento cirúrgico fatores que devem ser considerados na sua indicação: adequada seleção dos pacientes, condição e características pré-operatórias, co-morbidades, experiência e capacidade técnica da equipe cirúrgica no procedimento escolhido, estrutura de assistência durante e após a cirurgia, tempo de manutenção do benefício esperado, idade, prognóstico, possibilidade de seguimento adequado, e risco de morte súbita221,222,223,224,225,226,227 . Alguns procedimentos são reservados para a IC descompensada228,229.
a) Revascularização do miocárdio
I. Doença arterial coronariana e IC
Em pacientes que apresentem ambos os sintomas de IC e angina pectoris ou que possuam doença arterial coronariana subjacente sem angina deve-se considerar a possibilidade de revascularização do miocárdio, seja ela percutânea ou cirúrgica. A revascularização do miocárdio pode reduzir os sintomas associados à isquemia e a cirurgia de revascularização do miocárdio tem demonstrado ser capaz de reduzir angina e risco de morte em pacientes com doença coronariana obstrutiva multiarterial, disfunção ventricular esquerda e angina estável230,231,232,233 (tabela 50).
b) Cirurgia da valva mitral
A cirurgia da válvula mitral (troca valvar ou plastia) em pacientes com disfunção ventricular esquerda e grave insuficiência valvar mitral pode aliviar os sintomas de IC em pacientes selecionados (tabela 51). Entretanto, nenhum estudo controlado avaliou os efeitos dessa terapia na função ventricular e seu impacto em qualidade de vida e sobrevida. Um estudo de centro único, que avaliou uma série não randomizada de pacientes considerados elegíveis para a terapia cirúrgica conservadora no plano valvar mitral, não foi capaz de demonstrar benefício de sobrevida234,235. A correção da insuficiência mitral também pode ter influenciado os resultados funcionais da ventriculectomia236,237.
c) Remodelamento cirúrgico do ventrículo esquerdo
Os procedimentos de remodelamento cirúrgico do ventrículo esquerdo têm como objetivo proporcionar auxílio à contração, evitar a progressão da dilatação e corrigir os efeitos adversos do remodelamento ventricular. Entre esses procedimentos a correção dos aneurismas do ventrículo esquerdo com a reconstrução ventricular na cardiomiopatia isquêmica, reúne experiência clínica relevante e resultados tardios consistentes. Outros procedimentos, como a ventriculectomia parcial esquerda e a cardiomioplastia dinâmica demonstraram resultados controversos e não se estabeleceram como procedimentos de abrangência e de fácil aceitação no tratamento da insuficiência cardiaca. Por último a prótese de contenção ventricular esquerda foi avaliada em um único estudo randomizado e com resultados preliminares promissores.
A cirurgia de ressecção dos aneurismas de ventrículo esquerdo é indicada isoladamente ou associada à revascularização do miocárdio em pacientes com sintomas de IC refratária, arritmias ventriculares incontroláveis ou sinais de tromboembolismo sistêmico. Este procedimento é responsável pela queda da mortalidade e melhora da qualidade de vida dos pacientes, apresentando índices de sobrevivência acima de 80% em cinco anos de pós-operatório238. A correção dos aneurismas de ventrículo esquerdo pode ser realizada de maneira linear ou geométrica, não existindo evidências definitivas de resultados superiores com nenhuma dessas técnicas239 (tabela 52).
Os pacientes com cardiomiopatia isquêmica, dilatação ventricular e grandes áreas de acinesia podem ser indicados para cirurgia de reconstrução ventricular, quando tiverem indicação concomitante de revascularização do miocárdio. Nesta situação, também é comum a necessidade de correção da insuficiência funcional da valva mitral. A reconstrução ventricular na presença de áreas de acinesia não tem sido indicada como um procedimento isolado. A sua realização concomitante a cirurgia de revascularização do miocárdio leva a um melhor remodelamento ventricular, com melhora da função sistólica do ventrículo esquerdo240,241. No entanto, o estudo multicêntrico randomizado "STICH" não mostrou melhora marcante melhora dos sintomas ou da tolerância ao exercício nem redução na taxa óbito ou hospitalização por causas cardíacas242.
O remodelamento cirúrgico do ventrículo esquerdo foi proposto em pacientes com cardiomiopatia dilatada idiopática através da técnica da ventriculectomia parcial243. Apesar de este procedimento resultar em queda do estresse sistólico e em melhora da função ventricular esquerda, ele foi realizado com elevada mortalidade imediata, tendo também apresentado sobrevivência tardia limitada pela possibilidade de redilatação daquela câmara244. Fatores como necrose miocárdica pela ressecção, diâmetro da fibra miocárdica e apoptose influenciaram o seu resultado245,246,247,248.
A cardiomioplastia foi amplamente avaliada na literatura internacional, sendo demonstrada sua efetividade na melhora da função sistólica e distólica do ventrículo esquerdo, na hemodinâmica, na capacidade de exercício, e na qualidade de vida dos pacientes249,250,251,252,253,254,255,256,257,258 . No entanto, ela está praticamente abandonada pela falta de disponibilidade de dispositivos eletrônicos para estimulação muscular, por sua alta complexidade, pela lesão e degeneração do músculo com estimulação habitual, e pela persistência de risco de morte súbita259,260,261,262,263,264. Por outro lado, o uso de prótese de contenção passiva, fixada ao redor das câmaras ventriculares, tem sido indicado com o objetivo de prevenir a dilatação e melhorar a função ventricular. Resultados de um grande estudo multicêntrico randomizado demonstram que o implante da prótese de contenção passiva é responsável pelo remodelamento ventricular e pela melhora da função sistólica do ventrículo esquerdo, com conseqüente melhora da qualidade de vida dos pacientes265. Entretanto, este procedimento não parece influenciar a sobrevivência tardia, devendo ser indicado apenas como terapêutica associada a outras intervenções cirúrgicas.
IX. Transplante cardíaco
a) Indicações
Apesar dos avanços no tratamento clínico da IC, o transplante cardíaco continua sendo reconhecido como a melhor modalidade de tratamento cirúrgico para a IC terminal, a despeito do procedimento não ter sido testado em estudos randomizado-controlados63,266.
Avanços importantes na seleção do receptor, manutenção do doador, novas drogas imunossupressoras, avanços no diagnóstico de rejeição, e experiência no manuseio pós-transplante, se tornaram os pilares principais para a melhoria do sucesso deste procedimento terapêutico63,266,267,268,269,270,271,272,273,274 . Na prática, o transplante determina um grande impacto no tratamento do paciente com IC refratária ou terminal e os benefícios incluem melhor qualidade de vida, de exercício e maior sobrevida a médio e longo prazos63,266,275,276,277,278.
Resultados do transplante cardíaco foram publicados quando ainda receptores selecionados não utilizavam BB, terapia de ressincronização ventricular, e cardiodesfibrilador266,275,276,277 que exercem impacto positivo na redução de morbidade e mortalidade de pacientes com IC. Este fato poderia possibilitar discussão a respeito do critério de seleção atual para transplante em subgrupos de pacientes menos graves ou em graves não otimizados. No entanto, atualmente a maioria dos pacientes submetidos a transplante encontram-se otimizados do tratamento clínico ou hospitalizados, dependentes de drogas inotrópicas endovenosas ou de dispositivos de assistência circulatória. A sobrevida em curto prazo após transplante cardíaco é influenciada pela rejeição e infecção, e em longo prazo pela incidência de neoplasia e doença vascular do enxerto279,280,281,282,283,284,285,286,287,288,289,290,291,292 .
Como co-morbidades a hipertensão arterial, a insuficiência renal, arritmias, infecções, aumento do índice de massa corpóreo, e dislipidemias293,294,295,296,297,298,299,300,301,302 .
Os pacientes candidatos a transplante são aqueles com doença avançada, classe funcional IV permanente, ou III intermitente com IV, com sintomas severos e incapacitantes, sem alternativa de tratamento e com alta mortalidade em 1 ano63,131. O tratamento clínico deve ter otimização farmacológica e não farmacológica como: cuidados com ingestão de sal e líquido e uso de diuréticos, IECA, antagonistas da aldosterona, BB, digital, e hidralazina e nitrato especialmente para afro-brasileiros119. Deve-se ter atenção à remoção de fatores reversíveis ou precipitantes, entre eles, doença coronária passível de tratamento cirúrgico; insuficiência mitral de correção com remodelamento ventricular; correção de defeitos congênitos; como também obedecer aos critérios para implante de CDI e terapia de ressincronização ventricular119.
Alguns critérios de indicações e contra-indicações têm sido modificados nos últimos anos principalmente com relação à idade, consumo de oxigênio no teste cardiopulmonar, resistência vascular pulmonar, obesidade, câncer, diabetes mellitus, insuficiência renal, doença vascular periférica, e dependência de drogas131,303.
As indicações para transplante cardiaco estão resumidas na tabela 53. Avaliações da resistência vascular pulmonar, pressões na artéria pulmonar, e gradiente transpulmonar devem ser realizadas em todos os potenciais receptores. O teste de vasoreatividade pulmonar com o emprego de drogas vasodilatadoras (nitroprussiato, óxido nítrico, prostaglandinas, inibidores da fosfodiesterase 5) deve ser realizado em pacientes com resistência vascular pulmonar acima de 4,5 woods. Deve-se ter cautela com óxido nítrico, pois pode desencadear edema pulmonar304,305,306. O consumo de oxigênio (VO2) obtido no teste cardiopulmonar com o paciente alcançando o limiar anaeróbico máximo é um marcador prognóstico e tem se mostrado útil como estratificador de risco e de grande valia como método auxiliar na indicação de transplante cardíaco em pacientes ambulatoriais. Na ausência de uso de BB, VO2 inferior a 14 ml/kg/min é indicativo de prognóstico limitado. Cabe ressaltar que o tratamento com BB influencia o VO2 no teste cardiopulmonar e o ponto de corte do pico de VO2< 12 ml/Kg/min nos pacientes em uso de BB. Na presença de um teste cardiopulmonar submáximo, o equivalente de ventilação do dióxido de carbono (VE/VCO2) >35 pode auxiliar na indicação de transplante131,307.
b) Contra-indicações
No tocante a potenciais contra-indicações (tabela 54), devemos analisar cuidadosamente e individualmente cada caso. Portadores de neoplasia que têm baixo grau de malignidade podem ser considerados dependendo do critério de cura e da chance de recorrência. Quando a recorrência for baseada em tipo de tumor com resposta adequada à terapêutica e ausência de metástase, a decisão de listar para o procedimento deve ser avaliada juntamente com o oncologista131.
Em relação à obesidade, sabe-se que pacientes obesos têm grande morbi-mortalidade após cirurgia cardíaca, relacionada a fatores como cicatrização, aumento do risco de infecção, tromboembolismo e complicações pulmonares. Por este motivo, devemos recomendar perda de peso para alcançar IMC < 30 Kg/m2 131,307,308.
O diabetes mellitus de difícil controle glicêmico pode se tornar um grande problema após transplante devido à grande probabilidade de descompensação e complicações relacionadas a efeitos adversos da imunossupressão. Considera-se contra-indicação absoluta a inclusão de pacientes portadores de diabetes com complicações vasculares graves ou com lesões de órgãos-alvo (retinopatia, neuropatia, nefropatia)131,307,308.
A função renal deve ser avaliada usando-se o clearence da creatinina ou a creatinina sérica como parâmetros de seleção; uma depuração permanentemente <30 mg/dl é considerada contra-indicação relativa. Neste caso pode se considerar o transplante combinado rim/coração. Doença cerebrovascular e vascular periférica graves sem possibilidade de revascularização são contra-indicações formais309.
O tabagismo ativo com menos de seis meses de suspensão é uma contra-indicação relativa devendo ser desencorajado. Paciente usuário de drogas tem contra-indicação absoluta devendo ter abstinência superior a seis meses e monitoração constante da equipe multidisciplinar.
A recomendação na doença de Chagas deixou de ser uma controvérsia devido aos bons resultados de grupos brasileiros a curto e longo prazo, com sobrevida superior às outras etiologias como miocardiopatia isquêmica e idiopática310,311,312. A imunossupressão pode desencadear reativação da infecção crônica por T.cruzi, porém sua incidência pode ser reduzida com o uso de doses menores de imunossupressores ou com a modificação da imunossupressão313,314,315,316.
Há consenso entre os especialistas de que o transplante cardíaco deve ser reservado para aqueles pacientes que melhor se beneficiam em termos de qualidade de vida e sobrevida. Devido à diversidade sócio-econômica da nossa população, uma criteriosa avaliação deve ser realizada buscando-se identificar aceitabilidade; condições sociais; o padrão educacional e a dinâmica familiar. Vale salientar a importância do acompanhamento do assistente social no pré e pós-transplante. A avaliação psicológica deve identificar condições patológicas que possam comprometer a compreensão e a adesão ao tratamento. Avaliação criteriosa de outros componentes da equipe multidisciplinar como enfermeiros, nutricionistas, odontólogos e fisioterapeutas devem compor o protocolo63,131,276.
X. Dispositivos de estimulação cardíaca artificial
a) Marcapasso
A utilização de marcapasso convencional atrioventricular, na ausência de bradiarritmias sintomáticas em pacientes com IC se reserva a situações infreqüentes como nos casos de sintomas conseqüentes ao acoplamento AV anormal resultante de bloqueio atrioventricular de 1º grau ou de 2º grau do tipo I extremos, ou para suporte terapêutico para o uso de BB.
b) Terapia de ressincronização cardíaca
Pacientes com disfunção ventricular grave, estágios de IC avançados, refratários ao tratamento medicamentoso convencional podem se beneficiar da terapia de ressincronização cardíaca (tabela 55).
Esta modalidade da estimulação cardíaca tem o propósito de corrigir disfunções eletromecânicas em pacientes com IC avançada. Essa alternativa terapêutica surgiu a partir da observação inicial de que a presença de bloqueio do ramo esquerdo estaria associada à dissincronismo intra e interventricular e, conseqüentemente, comprometimento funcional do miocárdio317. Estima-se, além disso, que mesmo em pacientes sem distúrbios da condução intraventricular, mas com IC, a prevalência de dissincronia intraventricular seja elevada (27 a 53%)318,319.
A base fisiopatológica para a terapia de ressincronização cardíaca está relacionada a melhora da dissincronia que poderá determinar remodelamento reverso da cavidade ventricular, e redução da insuficiência mitral.
Os primeiros ensaios clínicos avaliando os efeitos da ressincronização demonstraram melhora significativa na classe funcional, na qualidade de vida (QoL), assim como incremento da distância percorrida em 6 min e do VO2 pico. Entretanto, somente dois estudos randomizados, COMPANION320 e CARE-HF321, cujos desfechos foram mortalidade total e taxa de hospitalização, demonstraram aumento de sobrevida. O estudo COMPANION foi um estudo de três braços que demostrou benefício da ressincronização somente quando associada ao implante de cardiodesfibrilador, portando é extremamente limitado para avaliação do impacto da ressincronização. Assim, o único estudo de impacto é o CARE-HF, que incluiu 97% dos pacientes em classe funcional III e utilizou como critérios de inclusão QRS com duração > 150 ms ou de 120 a 150 ms associado à presença de dissincronia no ecocardiograma. Em um estudo metanalítico322 com 3380 pacientes a ressincronização proporcionou redução de mortalidade (OR: 0.72, 95% e IC 0.59 a 0.88), da taxa de hospitalizações por IC (OR: 0.55, 95%, IC 0.44 a 0.68) e melhora da qualidade de vida (3 a 6 meses). O NNT foi estimado em 11 em 2,5 anos.
Publicações recentes de pequenas casuísticas demonstraram também que a terapia de ressincronização pode ser útil para pacientes com IC CF III ou IV e bloqueio atrioventricular avançado com indicação de marcapasso323,324. Para usuários crônicos de marcapasso convencional que evoluem com IC avançada, a conversão para ressincronização pode ser benéfica325,326. Com casuística específica de portadores de fibrilação atrial de baixa resposta, alguns ensaios clínicos pequenos também demonstraram benefícios da ressincronização ventricular327,328.
A análise de custo-efetividade desse procedimento foi publicada por Feldman e cols329 em 2005, mostrando uma taxa de custo-efetividade adicional de US$19,600.00 ao longo de sete anos de seguimento quando comparado com terapêutica medicamentosa otimizada para o tratamento da IC, estando muito abaixo do valor de US$50,000.00 considerado aceitável nos EUA. Porém, quando se analisa o custo-efetividade da associação do cardiodesfibrilador à ressincronização ventricular foi demonstrado que apesar do benefício em redução da mortalidade, a associação resultou em um incremento muito elevado na taxa de custo-efetividade, US$160,000.00 em sete anos de seguimento. Assim, as evidências científicas sobre prevenção primária de morte súbita cardíaca em candidatos à terapia de ressincronização ventricular são ainda insuficientes para definir essa questão, assim, na maioria dos casos, a indicação de ressincronização não deve estar condicionada à indicação de cardiodesfibrilador e vice-versa.
c) Cardioversor desfibrilador implantável (CDI)
Prevenção de Morte Súbita na IC
A morte súbita é responsável por 30 a 50% dos óbitos dos portadores de IC e cerca de 80% das mortes súbitas são decorrentes de arritmias ventriculares como taquicardia ventricular ou fibrilação ventricular330. Os maiores preditores de risco para morte súbita são a morte súbita recuperada, documentação de um episódio de taquicardia ventricular sustentada e a presença de disfunção ventricular com fração de ejeção < 35% e o paciente se encontra sintomático331. É importante ressaltar que o tratamento atual da IC com os antagonistas neuro-hormonais exerce efeitos significativos na redução de morte por progressão da IC e também de morte súbita332.
Os IECA ou BRA possuem efeitos antiarrítmicos, anti-isquêmicos, antitrombóticos e propriedades eletrofisiológicas benéficas, pois interferem favoravelmente nos processos de remodelação ventricular, com redução de hipertorfia, fibrose e de substrato arritmogênico, aumento de sensibilidade barorreflexa, redução da modulação simpática e aumento da atividade vagal; evita a hipopotassemia e tem ações em canais de cálcio e potássio. Uma metanálise de 15 estudos randomizados e controlados com placebo os IECA determinou redução significativa no risco de mortalidade total, morte cardiovascular e morte súbita (OR. 0,80; 95% CI. 0,70-0,92)332.
Os antagonistas dos receptores de aldosterona previnem a hipertrofia, reduzem a formação de fibrose, melhoram a função endotelial, reduzem a atividade simpática, restabelecem a variabilidade da freqüência cardíaca, reduzem a dispersão do intervalo QT e prolongam o período refratário da repolarização ventricular e previnem a hipopotassemia, todos estes efeitos conferem alto potencial para estas drogas atuarem favoravelmente na redução da morte súbita por arritmia ventricular. No estudo RALES169, a espironolactona conferiu uma redução significativa de 29% no risco de morte súbita (RR, 0.71; 95% IC, P=0,02). No estudo EPHESUS170, a associação de eplerenone ao inibidor da ECA e ao BB, em pacientes com disfunção ventricular após infarto no miocárdio conferiu uma redução significativa da mortalidade global, mortalidade cardiovascular e morte súbita cardíaca (RR, 0.79; IC 95% p= 0,03)333. Dados clínicos e experimentais enfatizam a forte influência da ativação adrenérgica nos mecanismos arritmogênicos que resultam em morte súbita. É consenso que a disfunção autonômica é característica de paciente de alto risco para morte súbita e existem inúmeros efeitos pró-arritímicos decorrentes da excessiva estimulação adrenérgica, como a necrose, a apoptose, fibrose, hipertrofia, isquemia, alterações de canais iônicos, com hipopotassemia e aumento do cálcio intracelular334.
A terapêutica com os BB antagonizam os efeitos deletérios das catecolaminas sobre a função e estrutura cardiovascular incluindo os efeitos de redução do consumo de oxigênio, redução de isquemia e efeitos biológicos sobre a remodelação estrutural do coração através da expressão gênica que determinam redução da proliferação celular, de apoptose, redução de fibrose, modulação de canais iônicos e estabilização de membranas, redução de arritmias ventriculares e aumento do limiar para fibrilação ventricular. Todos estes efeitos têm impacto na redução de morte súbita. Vários estudos multicêntricos randomizados, incluindo pacientes com IC, de diferentes etiologias e em todas as classes funcionais, documentaram os efeitos dos BB na redução do risco de morte súbita, com redução de risco relativo variando de 34 a 55% nos diferentes estudos334.
I. CDI na prevenção secundária de morte súbita
Vários estudos multicêntricos e randomizados documentaram a efetividade do CDI em reduzir o risco de morte súbita em pacientes de alto risco (prevenção secundária) quando comparados às drogas antiarrítmicas. Estes estudos de prevenção secundária contemplaram na sua maioria pacientes portadores de cardiomiopatia isquêmica, que foram recuperados de morte súbita ou que apresentaram taquicardia ventricular sustentada, ou arritmia ventricular complexa induzida por estimulação ventricular no estudo eleletrofisiológico.
A compilação dos quatro principais estudos de prevenção secundária, totalizando aproximadamente 2.500 pacientes demonstrou uma redução de risco relativo médio de morte de 36% (p=0,09)335. A despeito de várias limitações, estes estudos suportam a evidência de que a terapia com CDI está plenamente indicada na prevenção secundária de morte súbita e com custo efetividade aceitável. Portanto existe indicação formal de CDI para pacientes com disfunção ventricular que foram recuperados de morte súbita por fibrilação ventricular, ou taquicardia ventricular sustentada de causa não reversível. Também deve ser indicado para paciente com documentação de taquicardia ventricular sustentada estável ou instável e para pacientes com síncope recorrente de relevância clinica e que apresentem taquicardia ventricular sustentada instável ou fibrilação ventricular no estudo eletrofisiológico invasivo. Nestas indicações, devemos excluir os pacientes muito idosos, com importantes co-morbidades e com reduzida expectativa de vida em um ano devido a outras doenças e pacientes com isquemia tratável por revascularização, pacientes com tempestade elétrica ou com indicação de transplante cardíaco iminente (tabela 56).
II. CDI na prevenção primária de morte súbita
A maioria dos pacientes com disfunção ventricular não preenchem critérios para prevenção secundária de morte súbita com implante de CDI e, portanto, são potenciais candidatos para prevenção primária de morte súbita (tabela 57). Vários estudos randomizados foram conduzidos com intuito de avaliar o impacto do CDI na prevenção primária de morte súbita em pacientes com IC. O estudo MADIT II336 randomizou 1232 pacientes com cardiomiopatia isquêmica, com fração de ejeção < 35% em um período tardio após o infarto do miocárdio, no seguimento médio de 20 meses, 105 (14,9%) pacientes que receberam CDI morreram, comparado com 97 (19,8%) no grupo de tratamento clínico, com uma redução de risco relativo de morte de 31% e absoluto de 6% em favor do CDI (OR=0,69; p=0,016). Análises subseqüentes e de subgrupos deste estudo demonstraram que os pacientes foram selecionados em um período em que a terapia de reperfusão não estava amplamente empregada, tratamento com estatina, aspirina e BB não estava otimizada, pacientes com menos de 6 meses após infarto não se beneficiaram do implante do dispositivo e pacientes com co-morbidades também não tiveram benefícios337. Outro estudo importante que avaliou o impacto do CDI na prevenção primária foi o SCD-HeFT209. Neste estudo, foram randomizados 2521 pacientes, com IC sintomática, em classes funcionais II (70%) e III (30%), fração de ejeção < 35% e com cardiomiopatia isquêmica (52%) e não isquêmica (48%). Os pacientes foram randomizados para manutenção do tratamento convencional (847 pacientes), associação de amiodarona (845 pacientes) e implante de CDI associado ao tratamento convencional (829 pacientes). O objetivo primário do estudo foi morte por qualquer causa. Num segmento médio de 45 meses ocorreram 244 (29%) mortes no grupo placebo, 240 (28%) no grupo com amiodarona e 182 (22%) no grupo que recebeu CDI. Os grupos placebo e amiodarona não se mostram diferentes na evolução (p=0,53). Entretanto, quando comparado com os grupos placebo e amiodarona, a terapia com CDI promoveu uma redução do risco relativo de morte na ordem de 23% (OR: 0,77; p= 0,007) e redução de risco absoluto de 7,2%. Os resultados foram semelhantes para ambas as etiologias e não se observou redução de mortalidade com o implante do CDI nos pacientes em classe funcional III. Cabe ressaltar que quatro estudos com implante de CDI na prevenção primária tiveram resultados negativos338. O estudo CABG-Patch demonstrou que a inserção rotineira de CDI não reduz mortalidade em pacientes com miocardiopatia isquêmica, fração de ejeção < 35% e ECGAR positivo quando são submetidos à cirurgia de revascularização miocárdica339. O estudo DINAMIT demonstrou que o implante muito precoce de CDI após o infarto do miocárdio não reduziu mortalidade340. Em cardiomiopatia dilatada não isquêmica os estudos AMIOVIRT e DEFINITE não demonstraram benefícios do CDI na prevenção primária de morte súbita341,342.
Merece atenção a análise de custo efetividade do CDI na prevenção primária de morte súbita343. A análise de custo-efetividade dos estudos MADIT II e SCDHeFT são extremamente criticáveis por assumir que o CDI confere a mesma proteção ao longo da evolução da doença, quando na realidade, com a progressão da doença predomina a morte por progressão da IC. Em várias análises realizadas em países desenvolvidos, atesta-se que o CDI não tem custo-efetividade comprovada e a despeito das recomendações das diretrizes internacionais muitos destes países não adotaram a prática de implante de CDI na prevenção primária de morte súbita na IC343,344. Em nosso país, ficam evidentes as limitações de incorporação de recomendações para indicação de CDI na prevenção primária pelo seu custo elevado num cenário da medicina pública brasileira. A despeito da rápida expansão da utilização do cardiodesfibrilador na prevenção da morte súbita cardíaca e forte influência dos estudos na elaboração das diretrizes, fica claro que não houve uma avaliação criteriosa e crítica dos estudos disponíveis, em que os benefícios clínicos talvez tenham sido superestimados. Análises posteriores e atuais apontam para várias limitações das evidências disponíveis e o implante deste dispositivo tem vários incovenientes ou limitações que devem ser considerados na decisão de sua utilização345. A despeito do risco mínimo do implante, a colocação CDI pode acarretar várias complicações que merecem atenção. Infecção ocorre em 2 a 4% dos casos e geralmente é necessária a retirada do dispositivo e dos eletrodos. O implante do CDI está associado a uma piora na qualidade de vida devido à presença de múltiplas visitas hospitalares, presença de choques apropriados, inapropriados e, principalmente, por alterações psicológicas importantes como ansiedade, depressão e pânico345,346. Defeitos de fabricação nos dispositivos têm sido verificados, o que implica na necessidade de vigilância e checagem constantes dos parâmetros programados por profissionais especializados e experientes347.
XI. Abordagem por estágios
As recomendações de tratamento não farmacológico e farmacológico em cada estágio da IC estão resumidas na figura 5.
a) Estágio A
O estágio A inclui os pacientes com alto risco de desenvolver IC, porém sem doença cardíaca estrutural ou sintomas de IC. Entre outras condições podemos citar os portadores de hipertensão arterial, doença aterosclerótica, diabetes mellitus, obesidade, síndrome metabólica, ou pacientes submetidos à terapia antineoplásica com drogas de potencial cardiotoxicidade. Estes pacientes devem ser avaliados quanto à presença dos diferentes fatores de risco que levam lesão estrutural e posterior eclosão desta síndrome, bem como avaliação do seu histórico pessoal tais como ocorrência prévia de febre reumática, história familiar de cardiomiopatia, etc. A tabela 58 retirada do Framingham Offspring and Cohort Study exemplifica muito bem a importancia da identificação deste elevado risco348.
Dentro das recomendações estabelecidas para estes pacientes, todos os esforços preventivos devem ser utilizados dentro das medidas não farmacológicas como a cessação do fumo, redução do consumo de álcool, prática regular de atividade física, etc. Por outro lado, devemos também entre as medidas farmacológicas exercer a prática clínica referendada nas diferentes diretrizes para as patologias co-existentes. Assim as recomendações para o tratamento da hipertensão arterial, diabetes, dislipidemias, etc, devem ser plenamente utilizadas (tabela 59)349.
Nas recomendações do estágio A, o desenvolvimento de IC pode ser retardado ou prevenido pelo manuseio precoce destes pacientes de alto risco.
Alguns estudos randomizados indicam que a intervenção precoce com IECA ou BRA reduz significativamente a ocorrência de IC em pacientes com doença cardiovascular prévia, diabetes isolada ou com nefropatia e hipertensão arterial350,351,352,353,354,355. Em uma população de alto risco, igualmente estatina e antiplaquetários podem mostrar uma redução do desenvolvimento de IC.
b) Estágio B
Pacientes que apresentam disfunção ventricular esquerda, porém sem sintomas da doença. O grande exemplo deste estágio é o de pacientes que sofrem infarto agudo do miocárdio (IAM), normalmente de parede anterior, que evoluem com disfunção ventricular. Muitas vezes o sintoma só manifestar-se-á meses após o evento. Portanto, abordagens precoces são fundamentais, na tentativa de evitar a progressão da doença. Neste estágio, têm se discutido a introdução precoce de drogas anti-remodelamento, já que poderão interferir na progressão da doença para suas fases mais avançadas, bem como reduzir a mortalidade, mesmo nesta fase mais inicial. Estudos pós IAM, confirmam que introdução precoce de IECA ou BRA (intolerantes ao IECA), BB e antagonistas de aldosterona, reduziram a mortalidade neste grupo de pacientes. Outro aspecto que se discute hoje é a prevenção de morte súbita em pacientes com disfunção ventricular esquerda, principalmente na etiologia isquêmica. As diretrizes têm abordado este tema, na tentativa de uniformizar as indicações para prevenção primária (sem eventos prévios)153,157,356,357.
c) Estágio C
Pacientes que apresentam disfunção ventricular esquerda, e já estiveram em fase de descompensação da doença. Nesta fase, indicam-se diuréticos na retenção hídrica e controle da hipervolemia; uso de IECA, se não houver contra-indicação; uso de BB, também em não havendo contra-indicações, digitais para controle dos sintomas de descompensação, e espironolactona em pacientes com função renal preservada e níveis de potássio séricos adequados. Devemos sempre estar atentos para situações que podem agravar os sintomas, tais como uso de antiinflamatórios não-esteroidais, uso de alguns anti-arrítmicos e bloqueadores de canais de cálcio. Portanto, neste estágio, todas as medidas adotadas no estágio B, devem ser incorporadas. Porém devemos discutir ainda novas abordagens terapêuticas para pacientes que permanecem descompensados, a despeito da máxima otimização medicamentosa. O principal exemplo desta indicação é a terapia de ressincronização, que deve ser avaliada com critérios pelos especialistas em IC, com a finalidade de tornar este procedimento mais custo-efetivo para os pacientes358.
d) Estágio D
Nesta fase encontramos os pacientes com IC refratária, com indicação de transplante cardíaco, freqüentemente cursando com baixo débito, portanto, muitos deles candidatos à assistência circulatória. A abordagem neste estágio deve levar em consideração a elevada mortalidade dos pacientes, associado ao fato de apresentarem freqüentes internações hospitalares e dificuldade de manutenção de doses efetivas de IECA, e BB, devido à hipotensão e sinais de baixo débito. O transplante cardíaco é o tratamento de eleição para pacientes nesta fase, porém ainda nos deparamos com dificuldades, tais como escassez de órgãos para doação e poucos centros realmente ativos no Brasil, aptos a realizar o procedimento. Outros procedimentos que devem ser adotados neste estágio incluem131: controle da retenção hídrica; encaminhamento de pacientes para centros de referência em transplante cardíaco ou clínicas de IC; discussão de opções para cuidados de fim de vida; informação sobre ineficácia de indicação de CDI nestes pacientes (dependentes de drogas vasoativas, freqüentes internações em CF IV, com risco elevado de óbito por progressão de doença e sem perspectiva de transplante); e assistência circulatória em pacientes selecionados.
XII. Insuficiência cardíaca com fração de ejeção preservada (ICFEP)
A figura 6 esquematiza uma estratégia para diagnóstico e tratamento da IC com fração de ejeção preservada (ICFEP).
a) Investigação etiológica e critérios diagnósticos
A ICFEP representa 50% dos casos de IC. É mais prevalente entre as mulheres, idosos, portadores de HAS, HVE, diabetes, obesidade, doença coronária e fibrilação atrial (FA). É possível que o envelhecimento tenha impacto maior no enchimento ventricular do que na FEVE. A fibrose que ocorre com o envelhecimento ocasiona redução nas propriedades elásticas e complacência359,360,361. Várias doenças podem ter apresentação clínica semelhante e devem ser incluídas no diagnóstico diferencial, as quais estão descritas na tabela 60.
O diagnóstico de ICFEP requer a presença simultânea de três condições: sinais ou sintomas de IC congestiva; FEVE normal ou discretamente reduzida e evidências objetivas de disfunção diastólica do VE: relaxamento e enchimento anormal do VE, distensibilidade diastólica anormal ou rigidez diastólica. Estas evidências de disfunção diastólica podem ser obtidas a partir de dados hemodinâmicos, níveis de peptídeos natriuréticos, dados ecocardiográficos e do doppler tecidual362 (figura 6).
Há controvérsia sobre qual FEVE deveria ser adotada como ponto de corte entre fração de ejeção preservada e disfunção sistólica. Nesse documento será considerada FEVE > 50% e índice de volume diastólico final do VE < 97ml/m2363.
Três padrões de disfunção diastólica são definidos através da ecodopplercardiografia: relaxamento diastólico anormal (grau I), padrão pseudonormal (grau II) e padrão restritivo (grau III).
Em pacientes com sintomas de dispnéia e sem evidência de congestão o diagnóstico de ICFEP ou com disfunção sistólica é difícil. Uma estratégia proposta tem sido a utilização de peptídeos natriuréticos. Níveis de NT-pró BNP < 120 pg/ml ou BNP < 100 pg/ml, associados aos dados da ecodopplercardiografia excluem o diagnóstico de IC359.
b) Princípios do tratamento
A ICFEP continua sendo pouco valorizada e seu tratamento ainda empírico. Embora alguns estudos tenham sido conduzidos para avaliar fármacos no tratamento da ICFEP, a maioria deles incluiu um pequeno número de pacientes ou produziu resultados inconclusivos. Todavia, muitos dos pacientes com ICFEP são tratados com esses fármacos devido a condições co-mórbidas: HAS, diabete, FA e doença coronária.
O primeiro grande ensaio clínico multicêntrico, aleatorizado com o intuito de avaliar o benefício de uma droga, nesse caso o candesartan, no tratamento de pacientes com ICFEP foi o CHARM - Preserved Trial. A conclusão foi que o candesartan empregado em pacientes com ICFEP (FEVE >40%), não influenciou na mortalidade por causas cardiovasculares, em seguimento de 3,5 anos, porém reduziu em 22% o índice de hospitalizações168. Outro grande ensaio (I-PRESERVE Trial) avaliou os efeitos da irbesartana na mortalidade de pacientes com ICFEP (FEVE > 45%)364. A irbesartana não modificou a evolução de pacientes com IC e fração de ejeção preservada neste estudo em que o desfecho principal analisado foi combinado de morte por qualquer causa ou hospitalização por doença cardiovascular365. O ensaio prospectivo (PEP-CHF) avaliou os benefícios do perindopril em idosos com ICFEP cujos resultados preliminares foram inconclusivos366. Os IECA, à semelhança de outros agentes anti-hipertensivos têm efeitos na HVE podendo melhorar o enchimento diastólico.
O tratamento com BB pode ser útil de várias formas: regressão da HVE, controle da freqüência cardíaca com subseqüente melhora do enchimento ventricular, controle da HAS e melhora das propriedades diastólicas na presença de isquemia miocárdica. O estudo SENIORS testou os efeitos do nebivolol, em termos de mortalidade ou hospitalização em pacientes idosos com IC. Os efeitos foram semelhantes nos pacientes com FEVE acima e abaixo de 35%151.
Existem evidências de que a aldosterona desempenha papel importante na produção de fibrose e HVE. Antagonistas da aldosterona podem melhorar a função diastólica. Um grande ensaio prospectivo (TOPCAT) está sendo conduzido para avaliar o papel da espironolactona na ICFEP.
Os bloqueadores dos canais de cálcio podem ser benéficos no controle da FC, HAS, HVE e tratamento da isquemia.
Na ausência de estudos clínicos aleatorizados com resultados positivos o tratamento é baseado no controle dos fatores influenciado a síndrome e suas manifestações: pressão arterial, freqüência cardíaca, volemia e isquemia miocárdica, os quais são conhecidos por exercer efeitos importantes no relaxamento ventricular. Clinicamente, é bastante razoável o tratamento com alvo nos sintomas, principalmente objetivando a redução das pressões de enchimento ventricular no repouso e exercício. A HAS exerce efeito deletério na função ventricular causando alterações funcionais e estruturais, as quais alteram o relaxamento ventricular e as propriedades passivas da câmara, portanto, deve ser efetivamente tratada de acordo com as recomendações das diretrizes. A isquemia miocárdica pode prejudicar o relaxamento ventricular e a revascularização miocárdica deve ser considerada, quando indicada. A taquicardia encurta o tempo de enchimento (diástole) e reduz a perfusão coronária. Drogas tais como BB e alguns bloqueadores de cálcio podem ser úteis no alívio de sintomas. A conversão da FA para ritmo sinusal ainda é controversa desde que a resposta ventricular esteja controlada. O uso de diuréticos pode aliviar os sintomas de dispnéia ou congestão. A tabela 61 sumariza as recomendações para o tratamento da ICFEP.
XIII. Insuficiência cardíaca e co-morbidades
a) Insuficiência renal crônica
I. Síndrome cardio-renal
O termo síndrome cardio-renal tem sido aplicado para a associação de IC e insuficiência renal, porém esta síndrome não está claramente definida nem tampouco o seu tratamento367,368. Este estado avançado de perda da regulação cardio-renal pode se manifestar por um de três padrões: IC e concomitante insuficiência renal (falência cardio-renal), piora da função renal (durante o tratamento da IC aguda descompensada) e resistência aos diuréticos369.
II. Índice prognóstico
Sessenta por cento dos pacientes com IC tem algum grau de comprometimento da função renal. A TFG (taxa de filtração glomerular) é um dos principais preditores de mortalidade nos pacientes hospitalizados com IC370. Em pacientes em regime ambulatorial ou intra-hospitalar, a presença de algum grau de comprometimento da função renal (TFG < 90 ml/min/1,73m2) representa aumento de 50% do risco relativo de morte em um ano. Comprometimento moderado a importante da função renal (TFG < 50 ml/min/1,73m2) eleva o risco em 100%371. A redução de 1 ml/min na TFG provoca aumento de 1% na mortalidade geral de pacientes com IC372. Entretanto, em uma sub-análise do REMADHE trial realizado em população brasileira, insuficiência renal não foi um marcador independente de prognóstico em população de etiologia não isquêmica em cuidado ambulatorial27.
III. Tratamento farmacológico em vigência de insuficiência renal
O tratamento da IC na presença de insuficiência renal não está plenamente representado nos estudos clínicos randomizados, pois estes incluíram pequena proporção de indivíduos com creatinina sérica acima de 2,0 mg/dl373.
A introdução de IECA ou BRA, principalmente em pacientes com IR, provoca elevação transitória nos níveis da creatinina sérica (20 a 30% dos níveis basais). Esta elevação é mais acentuada nas duas primeiras semanas e gradual até a quarta semana374. A persistência na deteriorização da função renal (> 30% do valor inicial) com uso de IECA ou BRA implica na busca de causas secundárias como uso excessivo de diuréticos; hipotensão arterial; uso de contraste ou drogas nefrotóxicas e presença de doença renovascular (tabela 62).
Entre os estudos clínicos com IECA na IC, o CONSENSUS foi o que incluiu o maior número de pacientes com insuficiência renal (TFG média de 45 ml/min/1,73m2) e foi o único que fez análise no subgrupo com insuficiência renal, no qual obteve o mesmo benefício de sobrevida que no subgrupo sem insuficiência renal375. Entre os estudos clínicos com BRA na IC, a maioria não incluiu pacientes com creatinina > 2,5 mg/dl e não há dados sobre análise no subgrupo de pacientes com insuficiência renal (tabela 62).
Nos estudos clínicos randomizados de antagonistas da aldosterona na IC também foram excluídos pacientes com creatinina sérica > 2,5 mg/dl. No EPHESUS houve aumento do risco de hipercalemia para pacientes com TFG < 50 ml/min170. Não existe prevenção ou tratamento especifico para insuficiência renal a não ser evitar a hipovolemia e hipoperfusão renal. Em pacientes hospitalizados investiga-se o papel de antagonistas da adenosina e solução hipertônica376.
b) Anemia
Anemia tem sido reconhecida como co-morbidade na IC com uma prevalência entre 4-61% (média 18%) e associada principalmente à doença renal, diabete, idade avançada, doença severamente sintomática e uso de diuréticos377.
I. Tipo de anemia
A característica multifatorial e associação com outras co-morbidades sugerem uma apresentação variada. Usualmente, anemia na IC tem sido caracterizada como "doença crônica ou normocrômica/normocítica", "microcítica/por deficiência de ferro"378 e "macrocítica/deficiência de vitamina B"379.
Dos mecanismos implicados, têm sido extensivamente descritos: hemodiluição; deficiência de ferro, ácido fólico e vitamina B12 por baixa ingesta, má-absorção ou perda crônica; alteração no metabolismo do ferro; associação de doença renal crônica e/ou modificações na síntese e metabolismo de eritropoetina; atividade inflamatória aumentada entre outros377.
II. Anemia como índice prognóstico para IC
A grande maioria dos estudos tem relatado a anemia como preditor independente de mortalidade380. Em uma sub-análise do REMADHE trial realizado em população brasileira, anemia foi marcador independente de prognóstico em população sob cuidado ambulatorial27. Anemia associa-se a aumento de mortalidade nos pacientes com IC de ambos o sexos, forma crônica ou descompensada, com fração de ejeção de VE reduzida ou preservada, com descrições de aumento do risco relativo de morte de até 50% em três anos (disfunção sistólica)379,381. Freqüentemente a prevalência e gravidade aumentam com a progressão da classe funcional (NYHA) e seu surgimento em qualquer momento no curso da doença implica, por si só, em aumento da morbi-mortalidade382.
No entanto, a relação causa-efeito entre anemia e pior prognóstico em pacientes com IC não está estabelecida.
III. Manejo clínico
Ainda que atraente a idéia da correção de uma co-morbidade que exacerba IC, não há dados convincentes para consenso no que diz respeito aos níveis alvo de hemoglobina (Hb), eficácia, modalidade e segurança do tratamento380.
A observação do metabolismo de agentes estimulantes da eritropoiese na IC tornou-os uma potencial proposição terapêutica. No entanto, o maior ensaio clínico disponível neste contexto resultou em melhora dos níveis de hemoglobina, porém sem evidências de benefício sobre o seu desfecho principal: tempo de exercício. Outros desfechos clínicos relevantes também não foram diferentes entre darbepoetina e placebo383.
As observações relacionadas ao metabolismo do ferro têm estimulado pesquisas sobre seu uso isolado. Apesar de pequenos, os estudos têm demonstrado melhora dos níveis de Hb e redução nos níveis de BNP384,385. Novos estudos em curso deverão trazer importantes esclarecimentos sobre o uso do ferro (oral ou IV) em pacientes com anemia e IC386. Com base nas evidências disponíveis, não há suficiente embasamento para recomendar o tratamento sistemático da anemia em pacientes com IC (tabela 63).
c) Diabetes mellitus
Pacientes com diabetes mellitus (DM) apresentam maior risco de morte precoce por doença cardiovascular. Aqueles que sobrevivem ao primeiro evento ainda apresentam maior risco de morte, nos meses ou anos subseqüentes, quando comparados com os pacientes não diabéticos. A glicemia de jejum é um preditor independente de hospitalização por IC em pacientes de risco, na presença ou na ausência de diagnóstico prévio de DM387.
Os BB são drogas de 1ª linha no tratamento da IC. Estão indicados nos pacientes com IC diabéticos ou não-diabéticos com mesmo grau de recomendação. No entanto, a redução da mortalidade é mais evidente entre os não-diabéticos, quando comparado aos diabéticos388,389. Provavelmente, isso se deve ao fato de que os BB podem prejudicar o metabolismo da glicose.
As drogas hipoglicemiantes orais utilizadas para o tratamento do DM 2 podem ter efeitos deletérios em pacientes com IC. Em pacientes com IC estável e em classe funcional I/II, a rosiglitazona promoveu retenção de líquidos sem afetar a fração de ejeção, mas exigiu o aumento da medicação para compensação da IC390. Portanto, essa classe de droga deve ser utilizada com cautela em pacientes em classes funcionais I ou II e estão contra-indicadas naqueles em classes funcionais III ou IV.
São poucos os estudos que avaliaram a segurança da metformina em pacientes com IC. Dois estudos retrospectivos incluindo grande número de indivíduos não observaram risco aumentado de acidose lática em pacientes com IC. Um ensaio clínico prospectivo pequeno descreveu redução da mortalidade em pacientes com IC classe funcional III e IV e em uso de metformina391.
Exercício físico moderado está associado à melhora da resistência à insulina, mas esse efeito não foi observado na ausência de perda de peso392 (tabela 64).
d) DPOC
A prevalência de DPOC varia de 20% a 30% em pacientes com IC. O diagnóstico de IC em pacientes com DPOC muitas vezes não é suspeitado, porque é atribuída, ao DPOC, a piora da dispnéia393,394.
Pacientes com IC ou DPOC desenvolvem alterações dos músculos esqueléticos que são muito semelhantes. A limitação funcional correlaciona-se com a severidade das alterações musculares esqueléticas e não com a gravidade do comprometimento cardíaco ou pulmonar na IC ou DPOC. A melhora na função cardíaca ou pulmonar não é traduzida em alívio da limitação funcional, a menos que as alterações na musculatura esquelética regridam concomitantemente. Os mecanismos responsáveis pelas alterações musculares esqueléticas são incompletamente conhecidos. A atrofia da musculatura esquelética resultaria do quadro inflamatório sistêmico, do pouco uso da musculatura esquelética e do aumento de estresse oxidativo que contribui para a redução da síntese e aceleração da degradação protéica.
O BNP é útil no diagnóstico diferencial entre exacerbação do DPOC e a descompensação da IC. Para investigação de IC em pacientes com DPOC estável, a avaliação da função ventricular pelo ecocardiograma ainda é preferível ao BNP395,396.
A presença de DPOC impacta no tratamento da IC, pois a DPOC é ainda vista como uma contra-indicação relativa ao uso dos BB. Portanto, a DPOC freqüentemente priva pacientes com IC da intervenção farmacológica mais benéfica ao seu tratamento. Evidências cumulativas dos ensaios clínicos indicam que pacientes com DPOC toleram bem BB seletivos, que não devem ser negados para pacientes com IC e DPOC concomitantes397 (tabela 65).
e) Tireoidopatias
Aproximadamente 30% dos pacientes com IC têm Síndrome de T3 baixo (redução do nível de T3 com níveis adequados de T4 e TSH). Esta síndrome resulta da redução na conversão hepática de T4 em T3 e está relacionada com a gravidade da IC398,399. O benefício da reposição de T3 nestes casos ainda encontra-se em estudo.
A taquicardia sinusal é o distúrbio do ritmo mais comum no hipertiroidismo. A fibrilação atrial é identificada em 2 a 20% dos casos de tireotoxicose. O aparecimento ou exarcebação de arritmias cardíacas, especialmente a fibrilação atrial, implica em reavaliação da função da tireóide400.
A amiodarona pode causar alterações na função tireoidiana e resultar em hipotiroidismo (5 a 25% dos casos) ou hipertiroidismo (2 a 10% dos casos). Os pacientes tratados com amiodarona devem ser submetidos à avaliação da função tireoidiana antes de iniciar seu uso e monitorar periodicamente401.
f) Distúrbios do sono
Em torno de 60% dos pacientes com IC encaminhados a polissonografia, recebem o diagnóstico de apnéia do sono, sendo 20% do tipo obstrutiva (SAOS) e 40% de origem central402. A SAOS é caracterizada por interrupções repetitivas da ventilação durante o sono secundárias ao colapso da via aérea faríngea. A prevalência é maior nos homens, cujo maior fator de risco é a obesidade enquanto nas mulheres é a idade avançada403,404. A apnéia de origem central é caracterizada por interrupções repetitivas da ventilação pela perda do estímulo respiratório central. É a causa de apnéia mais diretamente relacionada à IC405.
I. Implicações dos distúrbios do sono na IC
Estudos sugerem que a SAOS é um fator prognóstico independente para mortalidade, podendo ainda levar a progressão da IC ou refratariedade à terapêutica, principalmente por: 1) pressões intratorácicas extremamente negativas com aumento da pós-carga e redução da pré-carga do VE; 2) cardiomiotoxicidade da hipóxia e 3) aumento da ativação simpática e conseqüente aumento da resistência vascular periférica406,407.
II. Indicação de tratamento
Nos pacientes com SAOS moderada/grave (índice apnéia/hipopnéia > 15 por hora de sono), o tratamento com CPAP (pressão aérea pulmonar contínua) tem demonstrado melhora do índice apnéia/hipopnéia, índice de apnéia e despertares, saturação de O2, reduzindo ainda estresse oxidativo miocárdico, PA sistólica e freqüência cardíaca, com relatos sugerindo redução de internações e melhora da sobrevida408,409,410,411. O uso de CPAP no manejo de pacientes com apnéias centrais está menos estabelecido. Entretanto, resultados do estudo CANPAP prospectivo, randomizado, com grupo controle não demonstraram benefício na mortalidade livre de transplante cardíaco com modesta ação na fracão de ejeção de ventrículo esquerdo (aumento de 2,2%)412 (tabela 66).
g) Depressão
A depressão é freqüentemente observada em pacientes com IC, mas sua prevalência nessa população é difícil de estimar porque os sintomas de ambas as condições clínicas se sobrepõem. Foi descrita prevalência de Depressão Maior entre 15%413 a 36%414 nos pacientes internados por IC. A presença de depressão aumenta o risco de não aderência ao tratamento da IC e está associada a aumento de morbi-mortalidade.
O tratamento não farmacológico com programa de treinamento físico aeróbico pode melhorar o escore de depressão415. A prescrição de paroxetina melhorou os sinais de depressão e dos aspectos psicológicos dos escores de qualidade de vida, sem afetar os aspectos físicos416. Estudo randomizado, realizado na Itália, mostrou que pacientes idosos e com descompensação da IC apresentaram escores melhores de depressão e de qualidade de vida quando mantidos em tratamento domiciliar, em comparação com o tratamento hospitalar, após seis meses, sem diferença na mortalidadepa. No entanto, essa é uma realidade difícil de extrapolar para o cenário nacional. O rastreamento para depressão e instituição de terapia adequada deve ser considerado em pacientes com sintomas sugestivos (tabela 67).
h) Doenças reumatológicas
Os agentes antiinflamatórios não esteróides (AINES) e os inibidores seletivos da ciclooxigenase-2 (COX- 2) ou "coxibs", são usados em situações clínicas para alívio da dor e do processo inflamatório. Dados disponíveis na literatura sugerem que estes agentes têm efeitos pró-trombóticos sendo que a magnitude do risco varia com o agente individual91. Os AINES e os coxibs aumentam os níveis da pressão arterial, pioram o seu controle e podem precipitar e/ou descompensar IC, com diferenças importantes entre os diferentes fármacos. Estudos de base populacional demonstram alta incidência de hospitalização por IC descompensada em pacientes idosos que estavam em tratamento com rofecoxib ou AINES não seletivos418,419. O mesmo achado foi associado com o uso de indometacina, mas não foi associado com o uso de celecoxib420. Um painel sobre coxibs do FDA421 concluiu:
1) Os coxibs aumentam o risco de eventos cardiovasculares;
2) O risco parece diferir entre as classes das drogas;
3) O risco cardiovascular pode ser dependente da dose e duração do tratamento.
Baseado nessas evidências, esta diretriz recomenda que os coxibs devam ser evitados até que ensaios aleatorizados controlados com placebo sejam conduzidos para definir seu perfil de segurança nessa população de pacientes.
i) Cardiotoxicidade dos quimioterápicos
O emprego da quimioterapia no tratamento das doenças oncológicas é responsável pelo aumento da sobrevida destes pacientes. Entre os agentes anti-neoplásicos mais utilizados estão as antraciclinas, entre elas, a doxorrubicina (adriamicina), útil para tratamento de câncer de mama e ovário, sarcomas e linfomas, entre outros.
Entretanto, a utilização dessas drogas é limitada pela sua cardiotoxicidade, que é dose dependente e irreversível422. Pode acometer mais de 20% dos pacientes e manifestar-se tanto precocemente quanto anos após. Por esse motivo, os parâmetros clínicos isoladamente não são adequados para o seu diagnóstico precoce, o qual pode ser realizado pela ventriculografia radioisotópica ou pelo ecocardiograma423. O uso do BNP neste contexto parece promissor.
O risco de cardiotoxicidade é maior nos indivíduos idosos, com cardiopatia prévia e naqueles submetidos à irradiação do mediastino. Todos os pacientes, em uso destas medicações, devem ser acompanhados com realização de ecocardiogramas seriados, sendo o primeiro realizado antes do início da quimioterapia423.
Existem várias hipóteses para explicar o mecanismo da cardiotoxicidade induzida pelas antraciclinas, incluindo aceleração de apoptose, disfunção mitocondrial, ativação de metaloproteinase e principalmente aumento dos radicais livres de oxigênio424,425,426,427,428. Visando prevenir essas complicações, diferentes substâncias foram testadas, sendo mais recentemente os IECA429 e o carvedilol430, com aparente benefício cardioprotetor (tabela 68).
Como norma, os pacientes em quimioterapia devem ser monitorados, utilizando-se a menor dose possível de quimioterápicos e suspendendo seu uso caso ocorra depressão da função miocárdica. As drogas cardioprotetoras serão a próxima medida a ser implementada, porém necessitamos de mais evidências quanto a sua eficácia.
j) Fibrilação atrial
A fibrilação atrial (FA) é a arritmia mais freqüente em pacientes com IC. O início de FA em pacientes com IC pode determinar piora dos sintomas, risco aumentado de tromboembolismo e pior prognóstico global. A FA pode ser classificada como: primeiro episódio, paroxística, persistente ou permanente. Potenciais fatores precipitantes (alterações eletrolíticas, hipertireoidismo, consumo de bebidas alcoólicas, valvulopatia mitral, isquemia aguda, infecção, hipertensão não controlada) devem ser investigados e, se possível, corrigidos. O tratamento clínico da IC deve ser revisado e readequado.
O manejo da FA em pacientes com IC tem três objetivos principais: o controle da freqüência, a correção do distúrbio do ritmo e a prevenção de tromboembolismo. A reversão a ritmo sinusal em pacientes sintomáticos com primeiro episódio de FA é geralmente acompanhada de melhora sintomática. Não há evidência, no entanto, de que restaurar o ritmo sinusal por cardioversão elétrica ou farmacológica seja superior ao controle da freqüência cardíaca em reduzir morbi-mortalidade em pacientes com FA persistente e IC com disfunção sistólica431 ou com FE preservada432 (tabelas 69 e 70).
A cardioversão através de procedimentos invasivos baseados em cateteres com objetivos de reversão temporária ou definitiva da FA têm sido considerada em casos refratários. No entanto, não existem até o momento ensaios clínicos que embasem tal conduta em pacientes com FA e IC.
A terapia antitrombótica (antiplaquetários ou anticoagulantes) é indicada em todos os pacientes com FA e IC. Pacientes de maior risco de eventos tromboembólicos (presença de mais um fator de risco adicional à IC e FA) beneficiam-se de anticoagulação oral crônica com cumarínicos, enquanto em pacientes de baixo risco (sem fator de risco adicional à IC e FA) é razoável o uso de anti-plaquetários202.
XIV. Subgrupos especiais
a) IC na criança e no adolescente
A IC na criança decorre da multiplicidade de etiologias, dos aspectos evolutivos das cardiopatias, da idade e da associação com a terapêutica cirúrgica ou percutânea nos casos de defeitos cardíacos congênitos.
A incidência de cardiopatias congênitas estruturais é aproximadamente 8 - 10 por 1000 nascidos vivos sendo que cerca de 0.1 a 0.2% evoluem para IC.
A incidência de cardiomiopatia na criança varia de 1,13 a 1,24 casos / 100.000 crianças433,434,435.
I. Etiologia
A IC na população pediátrica pode ser dividida pela idade:
1) fetal;
2) neonatal;
3) lactentes;
4) crianças e adolescentes.
1) Feto
Caracteriza-se por edema generalizado ou hidropsia fetal. As alterações cardiovasculares que levam ao desenvolvimento de hidropsia fetal incluem arritmias, disfunção miocárdica associada às cardiomiopatias, regurgitação de valva atrioventricular, constrição ductal ou do forâmen oval e situações de alto débito como a síndrome de transfusão feto-fetal.
2) Recém-nascido
A IC do período pós-natal imediato resulta de elevação da pressão atrial esquerda e da pressão venosa pulmonar levando a congestão venosa pulmonar e edema. O débito cardíaco e o retorno venoso sistêmico estão reduzidos. Os sinais clínicos de baixo débito muitas vezes confundem-se com quadro de choque séptico. O quadro clínico caracteriza-se por taquipnéia, taquicardia, irritabilidade, má perfusão periférica e sinais clínicos de baixo débito. É importante a observação criteriosa dos pulsos arteriais.
As principais causas estruturais são:
lesões obstrutivas das vias de saída dos ventrículos (principalmente do ventrículo esquerdo (VE). Exemplos: estenose aórtica, coarctação aórtica, interrupção do arco aórtico e hipoplasia do VE. Estas cardiopatias apresentam circulação sistêmica dependente do canal arterial, que ao sofrer constrição fisiológica pós-natal limita o fluxo sistêmico resultando em choque;
regurgitação valvar (principalmente tricúspide)
As causas não estruturais mais freqüentes são:
distúrbios metabólicos como hipoglicemia e hipocalcemia;
síndrome hipoxêmica;
fístulas arteriovenosas;
taquiarritmias e bradiarritmias.
3) Lactentes
Nesta faixa etária, o quadro clínico inclui, além dos sinais e sintomas citados no recém-nascido, a hepatomegalia, a sudorese excessiva, a dificuldade de sucção, as infecções respiratórias de repetição e o baixo desenvolvimento pôndero-estatural. Corresponde ao momento de queda da resistência vascular pulmonar e as causas mais freqüentes de IC incluem cardiopatias congênitas com sobrecarga volumétrica ou pressórica.
cardiopatias com aumento do fluxo pulmonar, como comunicações interventriculares, defeito do septo atrioventricular, persistência do canal arterial e cardiopatias complexas;
cardiopatias com sobrecarga pressórica, principalmente com obstrução da via de saída ventricular esquerda (coarctação da aorta, síndrome de Shone, estenose aórtica valvar, subvalvar ou supravalvar);
cardiopatias com disfunção miocárdica como as miocardites, as cardiomiopatias e a origem anômala da coronária esquerda.
4) Crianças até a adolescência
A síndrome clínica da IC é semelhante à dos adultos.
As causas mais freqüentes são:
além das cardiopatias obstrutivas e daquelas com aumento do fluxo pulmonar, são freqüentes as associadas a lesões residuais após correção da cardiopatia (exemplo: pós-operatório de tetralogia de Fallot, valvuloplastia aórtica, defeito septal AV, comunicação interventricular);
cardiopatias com dilatação ventricular e disfunção miocárdica, como as miocardites, as cardiomiopatias, a doença de Kawasaki, a febre reumática, as síndromes anêmicas, a displasia arritmogênica de VD, as arritmias e outros distúrbios como Wolf Parkinson White e síndrome do QT longo;
hipertensão arterial sistêmica;
IC direita.
II. Métodos diagnósticos
O diagnóstico clínico de IC na criança baseia-se no quadro clínico avaliado pela classe funcional [classificação de Ross (tabela 71)436, por estágios pela classificação da ISHLT437 (International Society of Heart and Lung Transplantation) (tabela 72) e por métodos diagnósticos (tabela 73)438.
III. Tratamento
Pode-se dividir a terapêutica em medidas gerais (tabela 74), farmacológicas (tabela 75) e cirúrgicas.
Terapêutica medicamentosa
O tratamento farmacológico tem papel limitado nas cardiopatias estruturais, para os quais tratamento cirúrgico efetivo é disponível. Permite melhorar as condições clínicas antes da correção cirúrgica nas primeiras semanas ou meses de vida.
Beta-bloqueadores
Em crianças, o uso de BB em estudos não randomizados revelam melhora da função ventricular, da tolerância ao exercício e diminuição da necessidade de transplante cardíaco em pacientes com cardiomiopatia dilatada idiopática ou induzida por drogas. Um estudo duplo-cego e randomizado recrutando crianças portadoras de IC grave candidatas a transplante cardíaco demonstrou claro benefício do carvedilol, permitindo retirar pacientes da lista de transplantes439. Resultado de estudo randomizado, duplo-cego, prospectivo, que testou o efeito de carvedilol em crianças e adolescentes, não demonstrou benefício na IC440. Entretanto, este estudo devido ao número limitado de eventos e de pacientes tem sido questionado quanto ao seu poder estatístico, além da diferença morfológica entre crianças e adolescentes.
Tratamento cirúrgico
A escolha entre terapêutica cirúrgica ou percutânea depende do tipo de lesão, do grau de IC e das opções disponíveis. Nas cardiopatias por hiperfluxo, a correção cirúrgica está indicada especialmente quando ocorre má resposta à terapêutica medicamentosa e déficit do desenvolvimento pôndero-estatural. Sobre outras terapêuticas, como a ressincronização, ainda não há consenso sobre sua utilização em crianças.
IV. Indicação de transplante cardíaco
As indicações de transplante cardíaco em crianças seguem as mesmas orientações dos adultos, mas com peculiaridades inerentes a criança e as cardiopatias congênitas (tabela 76)441,442,443.
b) IC na Doenca de Chagas
Apesar da diminuição importante do número de casos novos de doença de Chagas no Brasil a partir dos anos 90, muitos casos crônicos de longa evolução ainda fazem parte da rotina de atendimento, principalmente no SUS, onde os pacientes de menor poder aquisitivo, e, portanto, com maiores chances de exposição ao triatomídeo na infância, são seguidos. A IC, forma grave da doença, ainda é responsável por número considerável de internações e mortes.
A evolução da terapêutica para tratamento da IC secundária à cardiomiopatia chagásica, a partir do melhor conhecimento da fisiopatologia da disfunção ventricular, não tem evidências de efeito na melhora da sobrevida e da qualidade de vida como nos grandes estudos randomizados para tipos de acometimento semelhantes, sendo os estudos limitados a casuísticas menores.
As primeiras medicações que se mostraram eficazes na melhora da sobrevida foram os IECA, porém nos grandes estudos publicados não se incluem pacientes com cardiomiopatia chagásica143. Estudos menores, não randomizados e duplo-cegos, com casuísticas mistas, mostraram melhora da classe funcional e da ativação neurohormonal, além de agir no remodelamento ventricular444. Em relação aos BRA não existem estudos.
Já o uso da espironolactona, útil no acometimento avançado, incluiu apenas um pequeno grupo de pacientes com cardiomiopatia chagásica, sendo o número insuficiente para observar sobrevida169,445.
O digital, útil na diminuição da internação e na melhora dos sintomas, mas não na sobrevida de pacientes com IC, nunca foi testado em casos de cardiomiopatia chagásica na forma de estudos randomizados188. Em vista, contudo, do desequilíbrio autonômico que existe nesse tipo de acometimento, seu uso exige cuidado, pela possibilidade de lentificação da condução do estímulo, principalmente quando usado junto com antiarrímicos ou BB.
Em relação aos BB, tanto o carvedilol, como metoprolol, bisoprolol e nebivolol já se mostraram úteis no tratamento da IC de várias etiologias, com melhora da classe funcional, da função ventricular, da morbidade e da mortalidade156. Porém, em nenhum grande estudo pacientes com cardiomiopatia chagásica foram incluídos. Casuísticas pequenas mostram boa tolerabilidade desse pacientes, mas os efeitos na função ventricular ainda são duvidosos e não há dados relativos à sobrevida160.
A preocupação em relação à interferência na condução do estímulo sempre deve estar presente.
Quanto à abordagem das arritmias ventriculares, o tratamento farmacológico inclui quase que exclusivamente a amiodarona, que foi testada em grandes estudos com pacientes com cardiomiopatias de outras etiologias, não havendo número suficiente para análise dos com doença de Chagas apenas446 (tabela 77).
c) IC na gestante
A maioria dos grandes estudos em IC incluiu uma porcentagem menor de mulheres e a totalidade deles excluiu pacientes em fase de gestação. Sabemos que durante a gestação ocorre uma série de alterações hemodinâmicas, entre elas um aumento de 30 a 50% do débito cardíaco e do volume sanguíneo. Portanto, o estado gravídico pode ser o fator de descompensação cardíaca em pacientes previamente doentes.
Diuréticos, em especial os de alça (furosemida), são de fundamental importância no controle do estado congestivo. Os riscos maternos de seu uso são semelhantes ao dos pacientes fora da gestação, entretanto, atenção especial deve ser dada ao controle volêmico materno, visto que uma contração importante do volume intravascular pode reduzir o fluxo placentário levando ao retardo de crescimento fetal e em alguns casos ao sofrimento fetal447. Portanto, a monitorização do crescimento e da viabilidade fetal deve ser periódica.
O uso de IECA ou BRA está contra-indicado em qualquer fase da gestação448. Nitrato e hidralazina podem ser usados durante o período gestacional promovendo um bom aporte hemodinâmico em substituição a outros vasodilatadores como IECA e BRA449. Cuidado mandatório é evitar quadros de hipotensão prevenindo assim hipofluxo placentário.
BB se mostraram seguros durante a gestação. Alteração do crescimento fetal, apnéia fetal, hipotensão, bradicardia e hipoglicemia neonatal eventualmente podem ocorrer, mas sem risco importante para o neonato. Em geral, fármacos β-1 seletivos são preferidos, pois parecem interferir menos com os receptores β-2 que modulam o relaxamento uterino e a vasodilatação periférica450.
Espironolactona durante o período gestacional não foi efetivamente estudada sendo que em animais provocou feminilização de fetos masculinos451.
Digital (digoxina) pode ser usado no período gestacional em especial na melhora de classe funcional em pacientes CFIII-IV e em pacientes com fibrilação atrial com alta resposta ventricular. Vale ressaltar que a digoxina ultrapassa a barreira placentária e a freqüência cardíaca fetal deve ser monitorada452 (tabela 78).
d) IC no idoso
A IC é caracteristicamente uma doença do idoso, correspondendo a até 20% das causas de internação hospitalar em pacientes acima de 65 anos. A IC com fração de ejeção preservada ganha especial participação etiológica, notadamente no gênero feminino. Seu reconhecimento é fundamental para o adequado manuseio terapêutico. Dada associação freqüente com outras morbidades que limitam a tolerância a esforços, o diagnóstico da IC no idoso pode ser dificultado; o uso de marcadores como o BNP é útil.
Embora os princípios terapêuticos sejam os mesmos, algumas peculiaridades devem ser salientadas. Menor depuração hepática e renal predispõe a maior toxicidade, requerendo ajuste posológico; maior incidência de co-morbidades facilita a interação indesejada de drogas.
Os diuréticos preservam papel fundamental no manejo da volemia e dos sintomas congestivos; a redução da função renal direciona para o uso de diuréticos de alça. Digitálicos tiveram seu beneficio confirmado no estudo DIG453. Quanto aos IECA e BRA, as evidências suportam seu uso em idosos168,454 sugere-se monitoração rigorosa, clínica e laboratorial, bem como cautela ao buscar doses plenas. Vasodilatadores diretos podem ser úteis, porém, a hipotensão postural freqüentemente compromete sua utilização. BB não devem ser contraindicados apenas pela idade avançada. Recentemente o estudo SENIORS revelou benefício na redução de eventos combinados de mortalidade e internação hospitalar por IC em pacientes > 70 anos tratados com Nebivolol151. Em estudo brasileiro com número limitado de pacientes a dose de carvedilol tolerada em pacientes idosos com IC foi 50% da dose dos não idosos455. A espironolactona pode ser utilizada, mas com doses iniciais menores e estrita vigilância sobre função renal e eletrólitos. A maior incidência de FA resulta em maior utilização de anticoagulantes orais; o controle laboratorial deve ser freqüente, mantendo-se o INR entre 2,0 e 3,0. A vacinação contra influenza e pneumococo reduz hospitalizações por IC no idoso.
Abordagem multidisciplinar, contactos telefônicos e interconsultas podem reduzir reinternações456,457. O uso de recursos não medicamentosos tais como cirurgias (revascularização, correções valvares) e dispositivos (desfibrilador e/ou ressincronizador) deve ser decidido levando-se em conta a real expectativa de vida e o impacto sobre a qualidade da mesma (tabela 79).
e) IC no paciente com SIDA
As complicações cardíacas ocorrem tardiamente na evolução da SIDA; sua prevalência tem aumentado paralelamente à melhora do tratamento e da sobrevida dos pacientes. Vários mecanismos são propostos para a cardiomiopatia da SIDA, dentre eles a infecção pelo HIV, infecções oportunistas, virais, autoimunidade, cardiotoxicidade pelas drogas antivirais, déficits nutricionais, etc. Hipertensão pulmonar pode agravar o quadro. Independente do mecanismo fisiopatológico, a disfunção de VE agrava significantemente o prognóstico do portador de SIDA.
I. Antiretrovirais
As drogas antiretrovirais, notadamente os inibidores da protease, predispõem à lipodistrofia, dislipidemia e à resistência insulínica, aumentando o risco aterosclerótico; dentre os mais utilizados, o ritonavir parece ser o principal implicado. Embora os dados sejam conflituosos, o maior estudo retrospectivo disponível sugere incidência de IAM aumentada com a exposição prolongada à terapêutica anti-retroviral458. A troca de medicação (diferentes inibidores da protease), associada a aumento de exercícios aeróbicos pode ter bom resultado na melhora do perfil lipídico459. Dados os inequívocos benefícios dessas medicações, resta ao médico permanecer atento ao surgimento da lipodistrofia (obesidade central e consumo periférico), providenciando o controle dos distúrbios metabólicos associados - elevação de triglicérides e de LDL bem como intolerância à glicose - minimizando assim o risco a médio e longo prazos.
Cardiotoxicidade direta pela zidovudina foi aventada, notadamente em crianças460, o provável mecanismo envolveria a agressão mitocondrial461,462.
II. Manejo clínico
Diversas condições clínicas associadas (notadamente respiratórias) podem dificultar o diagnóstico da IC; o ecocardiograma assume especial papel na detecção precoce da disfunção ventricular na SIDA. Os princípios terapêuticos são semelhantes, baseando-se em diuréticos, digitálicos, IECA, BRA, BB, antagonistas da aldosterona e outros vasodilatadores. É controverso o uso rotineiro da biópsia endomiocárdica na condução clínica da IC na SIDA; sua indicação frente à falência da terapêutica clínica - em geral após 2 a 3 semanas - parece mais razoável. O achado de agente etiológico tratável é raro e não há no presente momento evidência de que imunossupressores ou corticoterapia sejam superiores à terapia convencional. A pesquisa de agentes infecciosos, como toxoplasma, deve ser rotineira e o tratamento adequado realizado, em caso positivo. O uso de imunoglobulina EV foi relatado como benéfico sobre a função de VE em crianças portadoras de cardiomiopatia por HIV463. Distúrbios nutricionais, quando sugeridos clinicamente, devem ser pesquisados objetivamente e corrigidos.
f) IC direita
A causa mais freqüente de IC direita (ICD) é aquela secundária à disfunção sistólica do ventrículo esquerdo (VE). Outras causas de ICD são cor pulmonale, cardiopatias congênitas, valvulopatia mitral, doença isquêmica do VD, doença da válvula tricúspide, cardiomiopatias do VD e síndrome carcinóide464.
O quadro clínico é representado fundamentalmente pela congestão venosa sistêmica, ressaltando-se a estase jugular bilateral, o edema periférico, a hepatomegalia e a ascite. Fadiga e intolerância ao exercício físico podem ocorrer, secundários ao baixo débito cardíaco. Arritmias supraventriculares e ventriculares são comuns465.
O manejo da sintomatologia de congestão visa à otimização da volemia. Assim, os pacientes com franca congestão sistêmica beneficiam-se da restrição hídrica diária, da restrição de sal, e do uso controlado de diuréticos. Nos casos refratários, pode-se considerar o uso de ultrafiltração ou hemofiltração. Nas ocasiões em que pacientes apresentam congestão sistêmica, porém com pré-carga diminuída pode-se administrar, criteriosamente, solução salina por via endovenosa464.
O tratamento da ICD objetiva, além do controle da volemia, a redução da pós-carga e a melhora do desempenho do VD, e deve ser norteado pela etiologia subjacente. Nos casos de associação entre disfunção sistólica do VE e VD, deve-se otimizar o tratamento da primeira condição clínica. Os pacientes com insuficiência ventricular direita (IVD) secundária à hipertensão arterial pulmonar (HAP) primária podem ser tratados com prostanóides, inibidores da fosfodiesterase ou antagonistas dos receptores da endotelina (tabela 79)466,467,468,469. Aqueles com DPOC não se beneficiam de vasodilatadores pulmonares, devendo-se tratar a hipóxia secundária à doença pulmonar. Da mesma forma, ainda não há evidências conclusivas para o uso dessas medicações em pacientes com tromboembolismo pulmonar (TEP) crônico470. Em pacientes com ICD associada à instabilidade hemodinâmica, a dobutamina é a droga de escolha. Se a ICD for secundária à HAP, a associação de dobutamina com óxido nítrico é benéfica. Não existem evidências para o uso crônico de digoxina na ICD. O transplante coração/pulmão ou pulmão isolado é a terapêutica para os casos refratários ao tratamento convencional464.
g) Hipertensão pulmonar e IC
A hipertensão arterial pulmonar (HP) acomete aproximadamente 60% dos pacientes com IC471. HP importante acomete 40% dos pacientes com IC terminal candidatos a transplante cardíaco. A principal causa de HP na IC é o estado congestivo decorrente das cardiomiopatias, síndrome de alto débito cardíaco e lesões valvulares mitral e/ou aórtica472. O tromboembolismo pulmonar crônico é uma causa de IC e hipertensão pulmonar na IC e, embora não seja freqüente, incidência de 3,8% depois de 2 anos de embolia pulmonar, o seu reconhecimento é importante pois é potencialmente curável473.
A redução da pressão artéria pulmonar é obtida com a otimização do tratamento da IC com o uso de IECA agentes BB, diuréticos e digitálicos.Há evidências iniciais que a diminuição da pressão arterial pulmonar com o uso de sildenafil e bosentan possa ter efeito benéfico na IC474,475,476 (tabela 80). A diminuição dos níveis pressóricos arteriais pulmonares, com algumas intervenções, permite a realização do transplante cardíaco com maior sucesso477,478 (tabela 80). Na insuficiência cardíaca secundária a hipertensão pulmonar por tromboembolismo pulmonar crônico inoperável, obteve-se redução da resistência vascular pulmonar e aumento do débito cardíaco com bosentam, sem melhora da capacidade de exercício479. A endarterectomia pulmonar oferece benefício hemodinâmico e potencial cura para pacientes quando esta é possível de ser indicada: proximal, acessível cirurgicamente e sem co-morbidades que aumentem os riscos (90-50% dos pacientes)480.
h) Miocardite
A miocardite se caracteriza por inflamação do miocárdio e é causa de IC aguda e crônica. Além do T.cruzi , os vírus têm destaque na determinação da miocardite, a lembrar principalmente enteroviroses e adenoviroses além de parvoviroses cuja detecção em biópsias endomiocárdicas vem se demonstrando481. Outras causas como toxinas, fármacos e agentes físicos podem também promover processo inflamatório no miocárdio. Além da agressão direta e citotóxica dos quadros infecciosos virais ao miocárdio, faz parte da fisiopatologia da progressão da miocardite a resposta autoimune na progressão do processo inflamatório e lesão miocárdica482.
Apesar de mais de 90% dos pacientes com miocardite terem um predomínio significativo de infiltrado linfocítico, infiltrado eosinofilico ou de células gigantes também podem ocorrer. O diagnóstico se faz pela suspeita clínica, além de exames de rotina iniciais como o eletrocardiograma, o qual revela desde alterações inespecíficas de repolarização ventricular, arritmias supraventriculares e/ou ventriculares, alterações do segmento ST e bloqueios intraventriculares e/ou atrioventriculares. Enzimas como creatinofosfoquinase fração MB e/ou troponina podem estar elevadas na fase aguda483. Dentre os exames de imagem não invasivos, a cintilografia miocárdica com Gallium-67 tem sensibilidade de 87% e especificidade de 81%, o anticorpo antimiosina marcado com Indium-111 91 a 100% de sensibilidade e 31% a 58% de especifidade, e a ressonância magnética até 90 a 100% de sensibilidade e 90 a 100% de especificidade dependendo da técnica utilizada484,485. A dosagem sérica de auto-anticorpos anti-coração, principalmente anti-miosina, quando associada a outros dados, reforça o diagnóstico486. Na miocardite por doença de Chagas a ressonância magnética também se mostrou um método aplicável487,488.
Entretanto, a biópsia endomiocárdica do ventrículo direito ainda se mostra importante no diagnóstico e avaliação prognóstica nos quadros de miocardite. A análise histológica utilizando-se os critérios de Dallas, que avalia o infiltrado inflamatório e a perda de miócitos, apresenta uma baixa sensibilidade apesar de ainda ser importante no diagnóstico. A utilização de fragmentos de biópsia para detecção do genoma viral por PCR ou para detecção de antígenos de histocompatibilidade, HLA, e a marcação de células inflamatórias, principalmente linfócitos T, por imunohistoquímica aumentam a chance do diagnóstico489.
Quanto à evolução aproximadamente 60% dos pacientes após o evento agudo apresentarão remissão espontânea do quadro. Entretanto, quadros de miocardite fulminante podem estar presentes com alta mortalidade precoce. O tratamento básico da miocardite é suporte e tratamento otimizado da IC. O tratamento com imunossupressores com prednisona, azatioprina, ciclosporina, OKT3 e imunoglobulinas, isoladamente ou em combinação não apresentou resultados consistentes em estudos randomizados controlados quanto à melhora da sobrevida ou a melhora da evolução dos pacientes com miocardite já na fase crônica490,491 (tabela 81).
i) Miocárdio não compactado
O miocárdio não-compactado isolado (MNCI) é uma cardiomiopatia primária genética, com prevalência estimada em 0,05% da população geral. A anatomia miocárdica é representada por trabeculações numerosas e proeminentes, com recessos intratrabeculares que penetram profundamente no miocárdio e não estão em comunicação com os vasos coronários. Quando não está associado a outras alterações cardíacas, é considerado isolado.
A etiologia é desconhecida. O padrão de herança mais conhecido é autossômico dominante. A ocorrência é mais comum no ventrículo esquerdo, e a localização é predominantemente apical. Em adultos, pode evoluir desde a forma assintomática até três tipos de manifestações clínicas: 1) disfunção sistólica e/ ou diastólica, levando a IC; 2) trombos endocárdicos com embolização sistêmica e ou pulmonar; e 3) arritmias ventriculares.
O ecocardiograma é o método de escolha para o diagnóstico do MNCI, e os critérios diagnósticos são a relação não compactado/compactado (NC/C) > 2 no local de espessura máxima observada no final da sístole e o fluxo sangüíneo nos recessos intertrabeculares. A estratificação familiar por meio de ecocardiograma deve ser considerada em parentes de paciente com diagnóstico de MNCI. O critério diagnóstico pela ressonância magnética é relação NC/C maior de 2,3 na diástole.
No diagnóstico diferencial inclui-se endomiocardiofibrose, cardiomiopatias hipertrófica apical ou restritiva, trombos apicais, e displasia arritmogênica do VD.
Os pacientes com MNCI podem apresentar, em até 80% dos casos, doenças neuromusculares associadas às alterações cardíacas.
Não existem estudos sobre tratamento específicos para a IC devido a esta etiologia. Assim, o tratamento inclui as drogas convencionais utilizadas em pacientes com IC. Não existe estudo testando a efetividade de anti-coagulante nesta etiologia. Vários centros advogam anticoagulação oral nos casos de disfunção ventricular além das indicações usuais como fibrilação atrial ou episódios embólicos prévios492 (tabela 82).
j) Tromboembolismo pulmonar na IC
Vários estudos contemporâneos têm demonstrado a incidência de TEP em pacientes com IC. No estudo SCD-HeFT, envolvendo pacientes ambulatoriais moderadamente sintomáticos e sem FA, a incidência anual de tromboembolismo sistêmico ou pulmonar foi 1,7%493. Foi descrita incidência de 15% em pacientes com IC CF III-IV hospitalizados e com algum fator adicional de risco205,494. Outros fatores ligados à IC associam-se a risco aumentado de eventos tromboembólicos: a gravidade da disfunção miocárdica, presença de fibrilação atrial e detecção de trombose cardíaca intracavitária199.
Em 90% dos casos a suspeita de TEP é levantada por sintomas clínicos como taquidispnéia, dispnéia e dor torácica. Nos pacientes com IC pré-existente, a acentuação da dispnéia ou progressão de outros sintomas de IC pode ser o único sintoma indicativo de TEP, o que faz o diagnóstico mais difícil.
A combinação destas variáveis clínicas de maneira subjetiva pelo clínico ou seguindo-se regras de predição possibilita discriminar os pacientes suspeitos de TEP em categorias de probabilidade de risco correspondendo a um aumento da prevalência de TEP: baixo (10%), intermediário (30%) ou alto (65%). Esse é o passo chave em todos os algoritmos diagnósticos de TEP. Uma das mais usadas regras de predição de risco é o escore de Wells ou canadense495. Ainda que as recomendações atuais adotem o uso de um sistema de predição, o rendimento da sua aplicação em portadores de IC ainda não foi especificamente validado.
A partir do risco clínico, exames complementares (cintilografia pulmonar de ventilação/perfusão, angiografia pulmonar não invasiva com tomografia de múltiplos detectores, ultrassonografia de compressão venosa) podem ser usados para confirmar ou afastar o diagnóstico de TEP.
Tratamento agudo
I. TEP de alto risco (cursando com hipotensão prolongada ou choque)
A terapia inicia-se pela anticoagulação com heparina não fracionada endovenosa seguida de terapia trombolítica endovenosa (rtPA100 mg em 2 horas ou 0,6 mg/Kg em 15 min. - dose máxima de 50 mg ou Streptoquinase 250.000 UI como dose de ataque em 30 min, seguida por 100.000 UI/h por 12 a 24 horas ). Estudos clínicos randomizados têm demonstrado que a terapia trombolítica rapidamente resolve a obstrução tromboembólica e uma revisão sistemática aponta também para benefício em redução de mortalidade496,497,498. O maior benefício é observado quando o tratamento é iniciado dentro de 48 horas do início dos sintomas, mas a trombólise pode ainda ser útil em pacientes que tenham sintomas por 6 a 14 dias.
Naqueles pacientes com contra-indicação para trombólise e naqueles em que a trombólise não se mostrou efetiva, métodos alternativos como a embolectomia cirúrgica ou embolectomia/fragmentação de trombo via cateter devem ser consideradas ainda que a segurança e eficácia dessas intervenções ainda não tenham sido claramente demonstradas (tabela 83).
II. TEP de risco intermediário
Os pacientes apresentando-se hemodinamicamente estáveis, mas, exibindo disfunção ventricular direita e/ou marcadores de lesão miocárdica e pacientes com IC pré-existente devem ser classificados como de risco intermediário.
O uso de heparina não fracionada ou de baixo peso molecular deve ser o tratamento de rotina, uma vez que nesse subgrupo de pacientes o benefício do uso de trombolíticos ainda não foi claramente demonstrado (tabela 83).
III. Anticoagulação a longo prazo; e profilaxia secundária
Vários estudos observacionais demonstraram taxas elevadas de recorrência de eventos tromboembólicos nos primeiros meses após o evento inicial de TEP, com aumento da letalidade, na ausência de tratamento profilático com antagonistas da vitamina K ou heparina pelo período de 3 a 6 meses (INR entre 2 e 3). Naqueles casos de TEP recorrente, o tratamento deve ser considerado por tempo indeterminado. O uso de filtro de cava não é recomendado na população geral, só se justificando em casos de contra-indicação absoluta ao tratamento anticoagulante oral e alto risco de recorrência (tabela 83).
XV. Questões legais da insuficiência cardíaca
a) Aposentadoria por invalidez e isenção de IR
A IC é uma forma de cardiopatia grave que tem tratamento diferenciado na legislação de assistência social no Brasil, pois garante a aposentadoria integral, sem período de carência. É fundamental a atitude profissional do médico, investigando minuciosamente a síndrome de IC, com particular atenção às situações abaixo, com o objetivo de determinar o real comprometimento da situação funcional do paciente:
1) IC ou co-morbidades sem tratamento adequado ou sem adesão do paciente visando benefício da aposentadoria: um exemplo é a hipertensão arterial associada à IC, sem controle em medidas de consultório, que pode ser devido à suspensão pontual da medicação pelo paciente, devendo este tema ser amplamente abordado e documentado o fato. Neste caso, a realização de exames como MAPA, fundo de olho e outros mostra a diligência do médico, que deve anotar em prontuário, inclusive as recomendações de uso continuado da medicação.
2) IC diastólica, em que a limitação física pode ser acentuada, com parâmetros de função sistólica normais, as provas funcionais são importantes para documentar a real limitação do paciente.
3) IC de alto débito, como na doença de Paget, também de difícil controle e que pode exibir parâmetros de função sistólica normal ao ecocardiograma demandam, também, provas funcionais, com anotação criteriosa em prontuário das dúvidas e soluções.
4) Recusa do paciente em submeter-se a tratamento cirúrgico, que poderia ser a solução da limitação imposta pela cardiopatia do paciente, como nos casos de aneurisma de aorta e valvopatia reumatismal, que mesmo tendo o benefício negado pelos peritos, tiveram sua concessão definitiva proferida em esfera judicial federal (4ª apelação civil no. 98.02.45619-5 e recurso inominado No. 2005.33.00766809-5-BA). Nestes casos, o médico deve propor ao paciente a cirurgia, solicitando o preenchimento do consentimento informado, e constatada a negativa, informá-la ao médico perito a quem caberá a decisão final, guardando uma das vias do consentimento preenchido no prontuário.
5) Portador de cardiopatia grave que não quer abandonar profissão de risco coletivo ou individual. Deve-se comunicar ao médico perito por meio de relatório contendo minuciosa avaliação clínica e potenciais conseqüências.
b) Recomendações para afastamento do trabalho (tabela 84)
1) Cardiopatia crônica grave ou IC crônica grave: dano grave e permanente da função miocárdica sistólica e/ou diastólica, com resolução parcial do ponto de vista clínico e funcional com as medidas terapêuticas clínicas e cirúrgicas. Com freqüência o risco aumentado de morte súbita justifica licença de serviço para tratamento de saúde e eventual aposentadoria definitiva, uma vez cumpridos os prazos legais de afastamento. O paciente deve ser submetido a reavaliações periódicas e pode ser inscrito em programa de transplante cardíaco.
2) IC crônica compensada: presença de dano significativo da função miocárdica sistólica ou diastólica, com boa compensação com as medidas terapêuticas clínicas e cirúrgicas; ausência de sintomas ou ocorrência aos grandes esforços. O paciente pode permanecer trabalhando em atividades moderadas ou leves ou readaptado quando o programa for disponível na empresa.
3) IC de recente começo ou devido à descompensação de IC crônica: comprometimento agudo da função miocárdica, exigindo imediato afastamento da atividade laborativa. Pode haver regressão com o tratamento clínico, cirúrgico ou evolução para uma das formas crônicas acima.
4) IC secundária a cardiopatias estruturais passíveis de resolução clínica, cirúrgica ou eletrofisiológica, ainda sem dano miocárdico permanente: Os pacientes devem ser licenciados, até a realização do procedimento, procedendo a reavaliação posteriormente.
XVI. Opções diagnósticas e terapêuticas controversas
a) Monitorização hemodinâmica
A monitorização hemodinâmica invasiva foi proposta no passado como uma forma de monitorar e ajustar a dose de medicações em pacientes com IC grave499. No entanto, o estudo ESCAPE, importante ensaio clínico multicêntrico randomizado, não demonstrou superioridade dessa abordagem quando comparada à abordagem clínica convencional500. Desta forma, com exceção de pacientes candidatos a transplante cardíaco, para avaliação da resistência vascular pulmonar, a utilização da monitorização hemodinâmica invasiva não está indicada de forma rotineira no paciente com IC crônica. A monitorização hemodinâmica por dispositivos implantáveis não mostrou redução significativa no desfecho primário de eventos relacionado à IC (hospitalizações, visitas à emergência ou clínicas de urgências, requerendo terapia intravenosa), embora tenha reduzido hospitalizações relacionadas à IC501. No entanto, a custo-eficácia desta abordagem não está definida, limitando seu uso rotineiro.
b) Bioimpedância transtorácica
A bioimpedância transtorácica cardiológica (BTC) é uma forma de pletismografia que utiliza mudanças na impedância elétrica torácica para estimar mudanças no volume sanguíneo no interior da Aorta e mudanças no volume de fluido do tórax, podendo-se estimar, de modo não invasivo, parâmetros hemodinâmicos e o estado volêmico. Um estudo multicêntrico, randomizado (estudo PREDICT)502, avaliou seu valor na identificação de pacientes com risco de morte ou readmissão por IC após hospitalização. O desfecho primário foi combinação de morte por qualquer causa e hospitalizações ou visitas à sala de emergência por IC. Os pacientes que apresentaram evolutivamente débito sistólico indexado <35 ml/m2 e conteúdo de fluido torácico >35 /kOhm tiveram uma taxa de eventos de 6,5% contra 0,9% naqueles com valores >35 mL/m2 e <35 /kOhm, respectivamente. No entanto, o valor da BTC na prevenção destes desfechos ainda não está estabelecido. O estudo PREVENT, em andamento, deverá responder esta questão.
c) Hormônio do crescimento
Hormônio do crescimento (GH) e o fator de crescimento insulina-like-1 (IGF-1) parecem ser moduladores fisiológicos da estrutura e função miocárdica. Alterações na função cardíaca podem ser observadas em pacientes com deficiência de GH e a reposição desse hormônio nesses pacientes esteve associada a aumento da espessura parietal e normalização da função cardíaca503,504. Estudos não controlados com pequeno número de pacientes com características selecionadas mostraram efeitos benéficos com a administração de GH a pacientes com IC505,506,507,508.
No entanto, outros dois estudos randomizados, controlados com placebo não demonstraram melhora de desfechos clínicos com a administração de GH, por três meses, em portadortes de IC de várias etiologias, apesar do aumento de massa miocárdica demonstrada em um deles509,510. Portanto, a administração rotineira de GH a pacientes com IC não é indicada, e deve ser investigada em situações especiais.
d) Estatinas
A IC envolve mediadores inflamatórios que contribuem para o remodelamento cardíaco. Há aumento dos níveis de citocinas inflamatórias (fator de necrose tumoral-alfa, interleucina 1-beta e interleucina 6)511. Por seus efeitos antiinflamatórios, as estatinas, em pequenos estudos clínicos, mostraram melhora da função endotelial, normalização da função autonômica e efluxo simpático com melhora da variabilidade da freqüência cardíaca, sugerindo melhora da função do VE deprimido na IC. Além disso, as estatinas podem aumentar a mobilização de células progenitoras endoteliais contribuindo para o remodelamento ventricular512.
Na IC, em classes funcionais avançadas, o colesterol total (CT) baixo está associado a um pior prognóstico513. Níveis elevados de colesterol poderiam ser benéficos, porque as lipoproteínas, ricas em colesterol, contraporiam os efeitos deletérios dos lipopolissacarídeos de bactérias.
As estatinas produzem redução da coenzima Q10 causando piora funcional do VE em portadores de IC514,515,516.
Até o momento, não existem evidências para que as estatinas utilizadas no tratamento da IC de qualquer etiologia, de forma independente dos níveis de LDL-colesterol e também na ausência de doença aterosclerótica517,518,519. No "trial" CORONA, a utilização de rosuvastatina não demonstrou benefício quanto à morte de origem cardiovascular, infarto agudo do miocárdio não fatal, e acidente vascular cerebral não fatal em pacientes idosos com IC sistólica em que predominava a etiologia isquêmcia520. Houve menor taxa de hospitalização de origem cardiovascular com rosuvastatina. O GISSI-HF, que testou rosuvastatina em pacientes com IC, não demonstrou benefícios na utilização desta medicação521.
e) Antagonistas da Vasopressina
Os antagonistas dos receptores da vasopressina (ARV) têm sido estudados como terapia adjunta ao diurético ou outras terapias na IC descompensada. Entre eles estão o conivaptan, um antagonista dos receptores V1a (vasoconstrição) e V2 (reabsorção hídrica renal), e o tolvaptan, um antagonista seletivo do receptor V2 que, portanto, apresenta apenas ação renal.
Os níveis de vasopressina se elevam na IC e após infarto agudo do miocárdio com queda na função do VE522. Os ARV levam a alterações favoráveis no débito urinário e na hemodinâmica sem uma significativa alteração na pressão sangüínea e na freqüência cardíaca. Estes fármacos diminuem o edema e o peso corporal e normalizam o sódio sérico em hiponatrêmicos, porém a duração e a significância clínica destes efeitos não estão claras522,523,524. O tolvaptan foi estudado no EVEREST e demonstrou alívio de sintomas na IC descompensada, porém não foi observado efeito sobre mortalidade525.
Não têm uso preconizado como rotina nos portadores de IC, mostrando-se em caráter experimental.
f) Antagonistas da Endotelina
Fármacos que parecem possuir efeitos hemodinâmicos benéficos em modelos animais, porém, estudos randomizados não demostraram benefícios em humanos526,527. O bosentan é indicado para hipertensão pulmonar em pacientes em classes III-IV, com sintomas incapacitantes e deteriorização clínica.
g) Antagonista de Adenosina
Quatro subtipos de receptores A1, A2a, A2b e A3 mediam o efeito da adenosina nos rins, coração e vasos sanguíneos. A inibição seletiva dos receptores A1 mostra benefício na diurese em portadores de IC classe funcional III ou IV (NYHA), preservando a taxa de filtração glomerular basal, que se encontra reduzida com o uso de furosemida528. Em contrapartida, a sua inibição no miocárdio propicia piora evolutiva da disfunção do VE, naqueles submetidos a evento isquêmico529. Se os receptores da adenosina (A1) no miocárdio têm função protetora, a sua inibição terapêutica, naqueles com descompensação do VE, necessitam maior ação renal para se obter efetiva diurese, tendo observação cuidadosa quanto ao comprometimento cardíaco.
Portanto, não existem evidências de sua indicação na IC.
h) Modificadores do metabolismo (trimetazidina, perexilina, ranolazina)
Em corações humanos, a maior produção de ATP (60 a 90%) resulta do metabolismo de ácidos graxos livres (AGL) e o restante, da glicose (β-fosforilação). Sob condições isquêmicas, com o oxigênio sendo um substrato limitado, a glicose transforma-se em caminho mais eficiente, requerendo 10 a 15% menos oxigênio, quando comparado com a quebra dos AGL. Com isso, diminui a acidose celular, a sobrecarga de cálcio e a injúria por radicais livres, com preservação dos níveis da fosfocreatinina e ATP intracelular.
O uso de trimetazidina, em pequenos estudos randomizados, não-cego, mostrou benefício com melhora na classe funcional e tolerância ao exercício, diminuindo o remodelamento do VE na cardiomiopatia isquêmica e na mortalidade por todas as causas e hospitalização por IC530,531. A ranolazina demonstrou, em estudos experimentais, melhora da função diastólica com a inibição do INa+ e, conseqüente, redução da sobrecarga de Ca++ citoplasmático, com reversão da fibrilação atrial e manutenção do ritmo cardíaco sem influência em desfechos clínicos.
Devido à baixa evidência, ainda sem indicação do ponto de vista clínico.
i) Inibidores adrenérgicos centrais
Inibidores adrenérgicos centrais (moxonidina, nolomirole) atuam na inibição da secreção de norepinefrina nas terminações nervosas simpáticas através da estimulação pré-sináptica do receptor DA2-dopaminérgico e alfa2-adrenérgico. Estudo clínico, randomizado, duplo-cego, multicêntrico com moxonidina requereu sua suspensão precoce por aumento na mortalidade532. Nolomirole, em recente estudo clínico, randomizado, duplo-cego, multicêntrico, com grupos paralelos não demonstrou evidência nos objetivos primários de mortalidade ou hospitalização por IC, com tendência a sua piora533. O uso de parexilina nas décadas de 70 e 80 ocasionou hepatotoxidade e neuropatia periférica quando tomado por longo período. Esses efeitos adversos foram controlados com rígido acompanhamento de doses e nível plasmático, mostrando benefício em portadores de IC isquêmica e não-isquêmica534.
No momento, estão contra-indicados para uso na IC.
j) G-CSF
G-CSF - "Granulocyte Colony-Stimulating Factor": glicoproteína com indicação no tratamento primário da neutropenia atua na mobilização de células-tronco da medula óssea, inclusive de células-tronco mesenquimais e células progenitoras endoteliais. Neste contexto, G-CSF serve como uma resposta primitiva de reparo à lesão orgânica. Apesar de estudos experimentais evidenciarem benefícios na disfunção miocárdica, seu uso na disfunção ventricular pós-infarto não mostrou benefício em meta-análise535,536. Estudo preliminar com G-CSF, de fase I para fase II, mostrou benefícios em pacientes em avaliação para transplante cardíaco. A utilização de G-CSF é terapia em investigação537.
k) Terapia celular
O uso de terapia celular em portadores de IC crônica ainda se reveste de incertezas quanto ao método de seu implante assim como qual a melhor linhagem. Estudos preliminares realizados no Brasil têm demonstrado efeito benéfico para pacientes com insuficiência cardíaca537,538. O método é promissor, porém, ainda são necessários estudos prospectivos randomizados e com maior número de pacientes para que possa ser adotado como terapêutica estabelecida539. No momento é considerada como terapia em investigação.
l) Ácidos graxos polinsaturados n-3 (ômega-3)
Evidências experimentais dão suporte para potenciais benefícios dos ácidos graxos poli-insaturados n-3 (ômega-3) em pacientes com IC. Recente estudo, GISSI-HF, avaliou 6795 pacientes com IC CF II-IV, sendo que 3494 pacientes receberam 1g/dia de ômega-3. Observou-se modesta, mas significativa redução (9%), na mortalidade geral. Foram necessários 56 pacientes tratados ao longo de 3,9 anos para evitar-se uma morte540.
m) Ivabradina
Ivabradina é um inibidor específico da corrente If do nó sinoatrial e redutor puro da frequência cardíaca. O recente estudo BEAUTIFUL541 investigou 10917 pacientes com DAC e FEVE < 40%, tendo 5479 deles recebido dose alvo de 7,5 mg de ivabradina duas vezes ao dia pelo seguimento médio de 19 meses. Ivabradina promoveu redução de 6 bpm na FC sem efeito sobre o desfecho combinado de morte cardiovascular, admissão hospitalar por IAM ou piora da IC (HR=1,00, p=0,94).
Não há evidência de benefício do seu uso em pacientes com IC em pacientes em uso de IECA e BB para IC.
n) Imunomoduladores
Imunomoduladores poderiam contrapor os efeitos dos mediadores inflamatórios que contribuem para a progressão da IC crônica. Um estudo placebo controlado testou o uso de terapia imunomoduladora inespecífica em 1.213 pacientes com IC CF II-IV com disfunção sistólica VE seguidos por 10,2 meses. Não se observou diferença do desfecho combinado de morte e internação cardiovascular na coorte geral, contudo, no subgrupo com CF II observou-se redução de 39%542.
As evidências ainda são insuficientes para definir-se o papel dos imunomoduladores na IC.
- 1. Sniderman AD. Clinical trials, consensus conferences, and the clinical practice. Lancet 1999;354:327-30.
- 2. Bocchi EA, Marin-Neto JA. Aplicação dos princípios da medicina baseada em evidências em programas de avaliação de procedimentos e medicamentos de alto custo. Arq Bras Cardiol 2001;76:343-46.
- 3. Bocchi EA. Introdução. Diretrizes da Sociedade Brasileira de Cardiologia para Transplante Cardíaco. Arq Bras Cardiol 1999;73(supl V):5.
- 4. Altman DG, Schulz KF, Moher D, Egger M, Davidoff F, Elbourne D, et al, for the CONSORT group. The revised CONSORT Statement for reporting randomized trials:explanation and elaboration. Ann Intern Med 2001;134;663-94.
- 5. Boutron I, Moher D, Altman DG, Schulz KF, Ravaud P; CONSORT Group Extending the CONSORT statement to randomized trials of nonpharmacologic treatment: explanation and elaboration. Ann Intern Med 2008;148:295-309.
- 6. Cowie MR - The epidemiology of heart failure - An epidemic in progress. In: Coats A, Cleland JGF (ed). Controversies in the management of heart failure. Churchill Livingstone, 1997, p.11-23.
- 7. Albanesi Filho, F.M. - O que vem ocorrendo com a insuficiência cardíaca no Brasil? Arq Bras Cardiol 2005;85:155-6.
- 8. Bocchi EA, Guimarães G, Tarasoutshi F, Spina G, Mangini S, Bacal F. Cardiomyopathy, adult valve disease, and heart failure in South América. Heart 2008;(Electronic publication ahead of print).
- 9. Achutti A, Achutti VR. Epidemiology of rheumatic fever in the developing word. Cardiol Young 1992; 2:206-15.
-
10World Health Organization-WHO. Community control of rheumatic fever disease in developing countries: 1. A major public health problem. WHO Chronicle 1980; 34: 336-45.
- 11. Silva LM, Mansur AJ, Bocchi EA, Stolf NAG, Bellotti G. Unspected rheumatic fever carditis ending in heart transplantation. Thorac Cardiovasc Surg 1994;42:191-3.
-
12DATASUS. Disponível em http// www.datasus.org.br
» link -
13Organizacion Panamericana de la Salud. Estimacion cuantitativa de la enfermedad de Chagas en las Ameritas. Montevideo, Uruguay: Organización Panamericana de la Salud; 2006.
- 14. Ministério da Saúde. Secretaria de Vigilância em Saúde. Brasil. Brazilian Consensus on Chagas disease. Rev Soc Bras Med Trop. 2005;38(suppl 3):7-29.
- 15. Pinto Dias JC. Natural history of Chagas disease. Arq Bras Cardiol 1995;65:359-66.
- 16. Marin-Neto JA, Cunha-Neto E, Maciel BC, Simoes MV. Pathogenesis of chronic Chagas heart disease. Circulation 2007;115:1109-23.
- 17. Bocchi EA, Situação atual das indicações e resultados do tratamento cirúrgico da insuficiência cardíaca. Arq Bras Cardiol 1994;63:523-30.
- 18. Contreras R, Bialostozky D, Medrano G, Fishleder B, Guadalajara JF. African or tropical endomyocardial fibrosis. Report of the 1st case seen in Mexico. Arch Inst Cardiol Mex 1971;476-89.
- 19. Barretto AC, da Luz PL, de Oliveira SA, Stolf NA, Mady C, Bellotti G, et al. Determinants of survival in endomyocardial fibrosis. Circulation 1989;80:177-82.
- 20. Freitas HFG, Castro PPN, Chizzola PR, Bocchi EA. Transplante cardíaco em portadora de endomiocardiofibrose. Arq Bras Cardiol 2005;84:49-54.
- 21. Fonseca C, Morais, H, Mota T, Matias F, Costa C, Gouveia-Oliveira A, et al. The diagnosis of heart failure in primary care: value of synptoms and signs. Eur J Heart Fail 2004;6:795-800.
- 22. Di Bari M, Pozzi C, Cavallini MC, Innocenti F, Baldereschi G, De Alfieri W, et al. The diagnosis of heart failure in the community. Comparative validation of four sets of criteria in unselected older adults: the ICARe'Dicomano Study. J Am Coll Cardiol 2004,44:1601-8.
- 23. McDermott MM, Feinglass J, Sy J, Gheorghiade M. Hospitalized congestive heart failure patients with preserved versus abnormal left ventricular systolic function: clinical characteristics and drug therapy. Am J Med 1995;99:629-35.
- 24. Stevenson LW, Perloff J. The limited reliability of physical signs for estimating hemodynamics in chronic heart failure. JAMA 1989;261:884-88.
- 25. Rihal CS, Davis KB, Kennedy JW, Gersh BJ. The utility of clinical, electrocardiographic and roentgenographic variables in the prediction of left ventricular function. Am J Cardiol 1995;75:220-3.
- 26. Badgett RG, Mulrow CD, Otto PM, Ramírez G. How well can the chest radiography diagnose left ventricular dysfunction? J Gen Intern Med 1996;11:625-34.
- 27. Ferreira SM, Guimarães GV, Cruz FD, Issa VS, Bacal F, Souza GE, et al. Anemia and renal failure as predictors of risk in mainly non-ischemic heart failure population. Int J Cardiol 2008; [Epub ahead of print]
- 28. Maisel AS, Krishnaswamy P, Nowak RM, McCord J, Hollander JE, Duc P, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med 2002;347:161-7.
- 29. Wright SP, Doughty RN, Pearl A, Gamble GD, Whalley GA, Walsh HJ, et al. Plasma amino-terminal pro-brain natriuretic peptide and accuracy of heart-failure diagnosis in primary care: A randomized, controlled trial. J Am Coll Cardiol 2003;42:1793-800.
- 30. Anwaruddin S, Lloyd-Jones DM, Baggish A, Chen A, Krauser D, Tung R, et al. Renal function, congestive heart failure, and amino-terminal pro-brain natriuretic peptide measurement: Results from the ProBNP Investigation of Dyspnea in the Emergency Department (PRIDE) Study. J Am Coll Cardiol 2006;47:91-7.
- 31. Gardner RS, Ozalp F, Murday AJ, Robb SD, McDonagh TA. N-terminal pro-brain natriuretic peptide. A new gold standard in predicting mortality in patients with advanced heart failure. Eur Heart J 2003;24:1735-43.
- 32. Mocelin AO, Issa VS, Guimarães GV, Cunha E, Bocchi EA. The influence of aetiology on inflammatory and neurohormonal activation in patients with heart failure: a prospective study comparing Chagas´heart disease and idiopathic dilated cardiomyopathy. Eur J Heart Fail 2005;7:869-73.
- 33. Vilas-Boas F, Feitosa GS, Soares MB, Pinho-Filho JA, Nascimento T, Barojas MM, et al. BNP in Chagas disease heart failure Congestive Heart Failure 2008;14:121-6.
- 34. Jourdain P, Jondeau G, Funck F, Gueffet P, Le Helloco A, Donal E, et al. Plasma Brain Natriuretic Peptide-Guided Therapy to Improve Outcome in Heart Failure. The STARS-BNP Multicenter Study. J Am Coll Cardiol 2007;49:1733-9.
- 35. Mueller C, Scholer A, Laule-Kilian K, Martina B, Schindler C, Buser P, et al. Use of B-type natriuretic peptide in the evaluation and management of acute dyspnea. N Engl J Med 2004;350:647-54.
- 36. Rohde LE, Palombini DV, Polanczyk CA, Goldraich LA, Clausell N. A hemodinamically oriented echocardiography-based strategy in the treatment of congestive heart failure. J Card Fail 2007;13:618-25.
- 37. Chung ES, Leon AR, Tavazzi L, Sun JP, Nihoyannopoulos P, Merlino J, et al. Results of the Predictors of Response to CRT (PROSPECT) trial. Circulation 2008;117:2608-16.
- 38. Dickstein K, Cohen-Solal A, Filippatos G, McMurray JJ, Ponikowski P, Poole-Wilson PA, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur Heart J 2008;29:2388-442.
- 39. Allman KC, Shaw LJ, Hachamovitch R, Udelson JE. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002;39:1151-8.
- 40. Cheitlin MD, Armstrong WF, Aurigemma GP, Beller GA, Bierman FZ, Davis JL, et al. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). Circulation 2003;108:1146-62.
- 41. Quinones MA, Verani MS, Haichin RM, Mahmarian JJ, Suarez J, Zoghbi WA. Exercise echocardiography versus 201Tl single-photon emission computed tomography in evaluation of coronary artery disease. Analysis of 292 patients. Circulation 1992;85:1026-31.
- 42. Brindis RG, Douglas PS, Hendel RC, Peterson ED, Wolk MJ, Allen JM, et al. ACCF/ASNC appropriateness criteria for single-photon emission computed tomography myocardial perfusion imaging (SPECT MPI): a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group and the American Society of Nuclear Cardiology endorsed by the American Heart Association. J Am Coll Cardiol 2005;46:1587-605.
- 43. Klocke FJ, Baird MG, Lorell BH, Bateman TM, Messer JV, Berman DS, et al. ACC/AHA/ASNC guidelines for the clinical use of cardiac radionuclide imagingexecutive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASNC Committee to Revise the 1995 Guidelines for the Clinical Use of Cardiac Radionuclide Imaging). Circulation 2003;108:1404-18.
- 44. Cleland JG, Pennell DJ, Ray SG, Coats AJ, Macfarlane PW, Murray GD, et al. Myocardial viability as a determinant of the ejection fraction response to carvedilol in patients with heart failure (CHRISTMAS trial): randomised controlled trial. Lancet 2003;362:14-21.
- 45. Rochitte CE, Pinto IM, Fernandes JL, Filho CF, Jatene A, Carvalho AC, et al. Cardiovascular magnetic resonance and computed tomography imaging guidelines of the Brazilian Society of Cardiology. Arq Bras Cardiol 2006;87:e60-100.
- 46. Hendel RC, Patel MR, Kramer CM, Poon M, Carr JC, Gerstad NA, et al. ACCF / ACR / SCCT / SCMR / ASNC / NASCI / SCAI / SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging: a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group, American College of Radiology, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance, American Society of Nuclear Cardiology, North American Society for Cardiac Imaging, Society for Cardiovascular Angiography and Interventions, and Society of Interventional Radiology. J Am Coll Cardiol 2006;48:1475-97.
- 47. Kim RJ, Wu E, Rafael A, Chen EL, Parker MA, Simonetti O, et al. The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. N Engl J Med 2000;343:1445-53.
- 48. Schwitter J, Wacker CM, van Rossum AC, Lombardi M, Al-Saadi N, Ahlstrom H, etal. MR-IMPACT: comparison of perfusion-cardiac magnetic resonance with single-photon emission computed tomography for the detection of coronary artery disease in a multicentre, multivendor, randomized trial. Eur Heart J 2008;29:480-9.
- 49. Hamon M, Biondi-Zoccai GG, Malagutti P, Agostoni P, Morello R, Valgimigli M. Diagnostic performance of multislice spiral computed tomography of coronary arteries as compared with conventional invasive coronary angiography: a meta-analysis. J Am Coll Cardiol 2006;48:1896-1910.
- 50. Cooper LT, Baughman KL, Feldman AM, Frustaci A, Jessup M, Kuhl U, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. Eur Heart J 2007;28:3076-93.
- 51. Bocchi EA, Cruz F, Guimarães G, Moreira LFP, Issa VS, Ferreira SMA, et al. A Long-term Prospective Randomized Controlled Study Using Repetitive Education at Six-Month Intervals and Monitoring for Adherence in Heart Failure Outpatients: The REMADHE Study. Circ Heart Fail 2008;1:115-124.
- 52. Bonow RO, Bennett S, Casey DE Jr, Ganiats TG, Hlatky MA, Konstam MA, et al. ACC/AHA Clinical Performance Measures for Adults With Chronic Heart Failure A Report of the American College of Cardiology/American Heart Association Task Force on Performance Measures (Writing Committee to Develop Heart Failure Clinical Performance Measures) Circulation 2005;112;1853-87.
- 53. Lucas C, Johnson W, Hamilton MA, Fonarow GC, Woo MA, Flavell CM, et al. Freedom from congestion predicts good survival despite previous class IV symptoms of heart failure. Am Heart J 2000;140:840-7.
- 54. Beck-da-Silva L, Mielniczuk L, Laberge M, Anselm A, Fraser M, Williams K, et al. Persistent orthopnea and the prognosis of patients in the heart failure clinic. Congest Heart Fail 2004;10:177-80.
- 55. Rohde LE, Beck-da-Silva L, Goldraich L, Grazziotin TC, Palombini DV, Polanczyk CA, et al. Reliability and prognostic value of traditional signs and symptoms in outpatients with congestive heart failure. Can J Cardiol 2004;20:697-702.
- 56. Falcão LM, Pinto F, Ravara L, van Zwieten PA.BNP and ANP as diagnostic and predictive markers in heart failure with left ventricular systolic dysfunction.J Renin Angiotensin Aldosterone Syst 2004 Sep;5(3):121-9.
- 57. Troughton RW, Frampton C, Yandle TG, Espiner EA, Nicholls MG, Richards AM. Treatment of heart failure guided by plasma aminoterminal brain natriuretic peptide (N-BNP) concentrations. Lancet 2000;355:1126-30.
- 58. Meyer T, Schwab B, Gorge G, Scharhag J, Herrmann M, Kindermann W. Can serum NT-proBNP detect changes of functional capacity in patients with chronic heart failure? Z Kardiol 2004;93:540-5.
- 59. O'Neill JO, Bott-Silverman CE, McRae AT3, Troughton RW, Ng K, Starling RC, et al. B-type natriuretic peptide levels are not a surrogate marker for invasive hemodynamics during management of patients with severe heart failure. Am Heart J 2005; 149:363-9.
- 60. Beck-da-Silva L, de Bold AJ, Fraser M, Williams K, Haddad H. BNP-Guided Therapy Not Better Than Expert's Clinical Assessment for Beta-Blocker Titration in Patients With Heart Failure. Congest Heart Fail 2005;11:248-53.
- 61. Tang WH, Girod JP, Lee MJ, Starling RC, Young JB, Van Lente F et al. Plasma B-type natriuretic peptide levels in ambulatory patients with established chronic symptomatic systolic heart failure. Circulation 2003;108:2964-6.
- 62. Stein JH, Neumann A, Preston LM, Costanzo MR, Parrillo JE, Johnson MR, et al. Echocardiography for hemodynamic assessment of patients with advanced heart failure and potential heart transplant recipients. J Am Coll Cardiol 1997;30:1765-72.
- 63. Revisão das II Diretrizes da Sociedade Brasileira de Cardiologia para o Diagnóstico e Tratamento da Insuficiência Cardíaca. Arq Bras Cardiol 2002;79:S1-30.
- 64. Swedberg K, Cleland J, Dargie H, Drexler H, Follath F, Komajda M, et al. Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005): The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur Heart J 2005;26:1115-40.
- 65. Hunt SA; American College of Cardiology; American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol 2005;46:e1-82.
- 66. Kannel WB. Incidence and Epidemiology of Heart Failure. Heart Fail Rev 2000;5:167-73.
- 67. Aaronson KD, Schwartz JS, Chen TM, Wong KL, Goin JE, Mancini DM. Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation. Circulation 1997;95:2660-7.
- 68. Butler J, Khadim G, Paul KM, Davis SF, Kronenberg MW, Chomsky DB, et al. Selection of patients for heart transplantation in the current era of heart failure therapy. J Am Coll Cardiol 2004;43:787-93.
- 69. Guimarães GV, dÁvila VM, Camargo PR, Moreira LF, Lanz JR, Bocchi EA. Prognostic value of cardiopulmonary exercise testing in children with heart failure secondary to idiopathic dilated cardiomyopathy in a non-beta-blocker therapy setting.Eur Heart Fail 2008;10:560-5.
- 70. Guimarães GV, Bellotti G, Mocelin AO, Camargo PR, Bocchi EA. Cardiopulmonary exercise testing in children with heart failure secondary to idiopathic cardiomyopathy. Chest 2001;120:816-24.
- 71. Bocchi EA, Vilas-Boas F, Moreira MC, Barretto AC, Lage S, Albuquerque D, et al. Levosimendan in decompensated heart failure patients: efficacy in a Brazilian cohort. Results of the BELIEF study. Arq Bras Cardiol 2008; 90:201-10.
- 72. Mangini S, Silveira FS, Silva CP, Grativvol PS, Seguro LF, Ferreira SM, et al. Decompensated heart failure in the emergency department of a cardiology hospital. Arq Bras Cardiol. 2008;90:400-6.
- 73. Levy WC, Mozaffarian D, Linker DT, Sutradhar SC, Anker SD, Cropp AB, et al. The Seattle Heart Failure Model: prediction of survival in heart failure. Circulation 2006;113:1424-33.
- 74. Aaronson KD, Schwartz JS, Chen TM, Wong KL, Goin JE, Mancini DM. Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation. Circulation 1997;95:2660-7.
- 75. May HT, Horne BD, Levy WC, Kfoury AG, Rasmusson KD, Linker DT, et al. Validation of the Seattle heart Failure in a community-based heart failure population and enhancement by adding B-type natriuretic peptide.Am J Cardiol 2007;100:697-700.
- 76. Aquilani R, Opasich C, Verri M, Boschi F, Febo O, Pasini E, et al. Is Nutritional Intake Adequate in Chronic Heart Failure Patients? J Am Coll Cardiol 2003;42:1218-23.
- 77. Chess DJ, Stanley WC. Role of diet and fuel overabundance in development and progression of heart failure. Card Res 2008;79,269-78.
- 78. Berry C, Clarck AL. Catabolism in chronic heart failure. Eur Heart J 2000;21:521-32.
- 79. Lennie TA, Chung ML, Habash DL, Moser DK. Dietary Fat Intake and Proinflammatory Cytokine Levels in Patients With Heart Failure. J Card Fail 2005;11:613-8.
- 80. Schacky C, Harris WS. Cardiovascular benefits of omega-3 fatty acids. Cardiovasc Res 2007;73,310-5.
- 81. Guillo P, Mansourati J, Maheu. Long Term Prognosis in Patients with alcoholic cardiomyopathy and severe heart failure after total abstinence. Am J Cardiol 1997;79:1276-85.
- 82. von Haehling S, Doehner W, Anker SD. Nutrition, metabolism, and the complex pathophysiology of cachexia in chronic heart failure. Cardiovasc Res 2007,73,298-309.
- 83. Witte KK, Nikitin NP, Parker AC, von Haehling S, Volk HD, Anker SD, et al. The effect of micronutrient supplementation on quality-of-life and left ventricular function in elderly patients with chronic heart failure. Eur Heart J 2005,26:2238-44.
- 84. Anker SD, Negassa A, Coats AJ, Afzal R, Poole-Wilson PA, Cohn JN, et al. Prognostic importance of weight loss in chronic heart failure and the effect of treatment with angiotensin-converting-enzyme inhibitors: an observational study. Lancet 2003;36:1077-83.
- 85. Lavie CJ, Osman AF, Milani RV, Mehra MR. Body Composition and Prognosis in Chronic Systolic Heart Failure: The Obesity Paradox. Am J Cardiol 2003;91:891-4.
- 86. Curtis JP, Selter JG, Wang GY, Rathore SS, Jovin IS, Jadbabaie F. The obesity paradox body mass index and outcomes in patients with heart failure. Arch Intern Med 2005;165:55-61.
- 87. Jefferson T, Rivetti D, Rivetti A, Rudin M, Di Pietrantonj C, Demicheli V. Efficacy and effectiveness of influenza vaccines in elderly people: a systematic review. Lancet 2005;366:1165-74.
- 88. Bouza E, Pintado V, Rivera S, Blázquez R Nosocomial bloodstream infections caused by Streptococcus pneumoniae.Clin Microbiol Infect 2005;11:919-24.
- 89. Meirelles RHS, Gonçalves, C.M.C. Abordagem Cognitivo-comportamental do Fumante. Diretrizes para Cessação do Tabagismo, Jornal Brasileiro de Pneumologia, Brasília, DF, 2004.
- 90. Hudson M, Richard H, Pilote L: Differences in outcomes of patients with congestive heart failure prescribed celecoxib, rofecoxib, or non-steroidal anti-inflammatory drugs: population based study. BMJ 2005;330:1370-80.
- 91. Mamdani M, Juurlink DN, Lee DS, Rochon PA, Kopp A, Naglie G, et al. Cyclo-oxygenase-2 inhibitors versus non-selective non-steroidal anti-inflammatory drugs and congestive heart failure outcomes in elderly patients: a population-based cohort study. Lancet 2004;363:1751-6.
- 92. Chakko S, Fernandez A, Mellan TA: Cardiac manifestation of cocaine abuse: across-sectional study of asymptomatic men with a history of long-term abuse of crack cocaine. J Am Coll Cardiol 1992,20:1168-74.
- 93. Frishman WH, Del Vecchio A, Sanal S, Ismail A. Cardiovascular manifestations of substance abuse: part 2: alcohol, amphetamines, heroin, cannabis, and caffeine.Heart Dis 2003;5:253-71.
- 94. Atienza F. Integración del tratamento de la Insuficiencia Cardiaca: Unidades de Insuficiencia Cardiaca. In: Anguita M, editor. Manual de Insuficiencia Cardiaca. Sociedad Española de Cardiologia Madrid; 2003, p 243-56.
- 95. Bocchi EA. Heart failure clinics: the Brazilian Experience. Rev Port Cardiol 2004;23:suppl III:47-55.
- 96. Silva CP, Bacal F, Pires PV, Mangini S, Issa VS, Moreira SF, et al. Heart failure treatment profile at the beta blockers era.Arq Bras Cardiol. 2007;88:475-9.
- 97. McAlister FA, Lawson FM, Teo KK, Armstrong PW. A systematic review of randomised trials of disease management programs in heart fatlure. Am J Med 2001;110:378-84.
- 98. Grancelli H, Varini S, Ferrante D, Schwartzman R, Zambrano C, Soifer S, et al. Randomized Trials of telefhone intervention in chronic heart failure. Study Design and Preliminary observations. J Card Fail 2003,9:172-9.
- 99. Roccaforte R, Demers C, Baldassarre F, Teo KK, Yusuf S. Effectiveness of comprehensive disease management programmes in improving clinical outcomes in heart failures patients. A meta-analysis. Eur J Heart Fail 2005;7:1133-44.
- 100. Bocchi EA. Clínica de Insuficiência Cardíaca. In: Barreto, A. C. P.; Bocchi, E. A. (Org.). Insuficiência Cardíaca. São Paulo, 2003 v. 1, p.269-277
- 101. Uretsky BF, Pina I, Quigg RJ, Brill JV, MacInerney EJ, Mintzer R, et al. Beyond drug therapy: Nonpharmacologic care of the patient with advanced heart failure. Am Heart J 1998;135:S264-84.
- 102. Erhardt LR, Cline CM. Organization of the care of patients with heart failure. Lancet 1998;352(suppII):15-8.
- 103. Cruz FD, Nakassato M, Issa, VS. Tratamento não medicamentoso da insuficiência cardíaca - Como melhorar a qualidade de vida. In: Barreto, A. C. P.; Bocchi, E. A. (Org.). Insuficiência Cardíaca. São Paulo, 2003, v. 1, p.151-159
- 104. Romano BW, (1999). Princípios para a prática da psicologia em hospitais. São Paulo, Casa do psicólogo.
- 105. Trindade I, Teixeira JAC. Aconselhamento psicológico em contextos de saúde e doença: Intervenção privilegiada em psicologia da saúde. Ana Psicológica 2000;18:3-14.
- 106. Curiati JA, Bocchi EA, Freire JO, Arantes AC, Braga M, Garcia Y, et al. Meditation reduces sympathetic activation and improves the quality of life in elderly patients with optimally treated heart failure: a prospective randomized study. J Altern Complement Med. 2005;11:465-72.
- 107. North TC, McCullagh P, Tran ZV. Effect of exercise on depression. Exerc Sport Sci Rev 1990;18:379-415.
- 108. Sinoway LI. Effect of conditioning and deconditioning stimuli on metabolically determined blood flow in humans and implications for congestive heart failure. Am J Cardiol 1988;62:45E8E.
- 109. Nakamura M, Ishikawa M, Funakoshi T, Hashimoto K, Chiba M, Hiramori K. Attenuated endothelium dependent peripheral vasodilation and clinical characteristics in patients with chronic heart failure. Am Heart J 1994;128:1164-9.
- 110. McKelvie RS, Teo KK, Roberts R, McCartney N, Humen D, Montague T, et al. Effects of exercise training in patients with heart failure: the ExerciseRehabilitation Trial (EXERT). Am Heart J 2002;144:23-30.
- 111. Dall'Ago P, Chiappa GRS, Guths H, Stein R, Ribeiro JP. Inspiratory muscle training in patients with heart failure and inspiratory muscle training. J Am Coll Cardiol 2006;46:747-63.
- 112. Belardinelli R, Georgiou D, Cianci G, Purcaro A. Randomized, controlled trial of long-term moderate exercise training in chronic heart failure: effects on functional capacity, quality of life, and clinical outcome. Circulation 1999;99:1173-82.
- 113. Hambrecht R, Fiehn E, Weigl C, Gielen S, Hamann C, Kaiser R, et al. Regular physical exercise corrects endothelial dysfunction and improves exercise capacity in patients with chronic heart failure. Circulation 1998;98:2709-15.
- 114. Ferraz AS, Bocchi EA, Guimarães GV, Meneghelo RS, Umeda II, Sousa JE. Low intensity is better than high intensity exercise training in chronic heart failure patients concerning pulmonary ventilation, brain natriuretic peptide, and quality of life evaluation: A prospective randomized ,study. J Am Coll Cardiol 2003; 41:182A.
- 115. Smart N, Marwick TH. Exercise training for patients with heart failure: a systematic review of factors that improvemortality and morbidity. Am J Med 2004;116:693-706.
- 116. Silva MS, Bocchi EA, Guimaraes GV, Padovani CR, Silva MH, Pereira SF, et al. Benefits of exercise training in the treatment of heart failure: study with a control group. Arq Bras Cardiol. 2002;79:351-62.
- 117. Whellan DJ, O'Connor CM, Lee KL, Keteyian SJ, Cooper LS, Ellis SJ, et al. Heart Failure and a controlled trial investigating outcomes of exercise training (HF-Action): design and rationale. Am Heart J 2007 153:201-11.
- 118. Piepoli MF, Davos C, Francis DP, Coats AJ; ExTraMATCH Collaborative. Exercise training meta-analysis of trials in patients with chronic heart failure (ExTraMATCH). BMJ 2004;328:189.
- 119. Jessup M, Banner N, Brozena S, Campana C, Costard-Jäckle A, Dengler T, et al. Optimal pharmacologic and non-pharmacologic management of cardiac transplant candidates: approaches to be considered prior to transplant evaluation: International society for heart and lung transplantation guidelines for the care of cardiac transplant candidates 2006. J Heart Lung Transplant 2006;25:1003-23.
- 120. Coats AJ, Adamopoulos S, Meyer TE, Conway J, Sleight P. Effects of physical training in chronic heart failure. Lancet 1990; 335:63-6.
- 121. Hambrecht R, Niebauer J, Fiehn E, Kälberer B, Offner B, Hauer K, et al. Physical training in patients with stable chronic heart failure: effects on cardiorespiratory fitness and ultrastructural abnormalities of leg muscles. J Am Coll Cardiol 1995;25:1239-49.
- 122. European Heart Failure Training Group. Experience from controlled trials of physical training in chronic heart failure: protocol and patient factors in effectiveness in the improvement in exercise tolerance. Eur Heart J 1998;19:466-75.
- 123. Rector TS, Kubo SH, Cohn JN. Validity of the Minnesota Living with Heart Failure questionnaire as a measure of therapeutic response to enalapril or placebo. Am J Cardiol 1993;71:1106-7.
- 124. Gottlieb SS, Fisher ML, Freudenberger R, Robinson S, Zietowski G, Alves L, et al. Effects of exercise training on peak performance and quality of life in congestive heart failure patients. J Card Fail 1999;5:188-94.
- 125. Ferraz AS, Bocchi EA, Guimarães GV, Meneghelo RS, Moreira DAR, Umeda II, et al. Effects of Aerobic Exercise Training on Autonomic Balance, Brain Natriuretic Peptide, and Quality of Life Evaluation in Dilated Cardiomyopathy Patients. A Prospective Randomized Controlled Study. Circulation 2003;108(suppl IV):739
- 126. Stein R, Hohmann CB. Atividade sexual e coração. Arq Bras Cardiol 2006;86:61-7.
- 127. Oliveira Jr, WA. Sexualidade e doença do coração. In: Porto, CC. Doenças do Coração , 2ş Edição. Rio de Janeiro. Guanabara Koogan 2005; 93-96.
- 128. Taylor HA. Sexual Activity and the Cardiovascular Patient: Guidelines. Am J Cardiol 1999;84:6N-10N.
- 129. Bocchi EA, Guimarães G, Mocelin A, Bacal F, Bellotti G, Ramires JF. Sildenafil effects on exercise, neurohormonal activation, and erectile dysfunction in congestive heart failure: a double-blind, placebo-controlled, randomized study followed by a prospective treatment for erectile dysfunction. Circulation 2002;106:1097-103.
- 130. Corrà U, Mezzani A, Giannuzzi P, Tavazzi L. Chronic heart failure-related myopathy and exercise training: a developing therapy for heart failure symptoms. Curr Probl Cardiol 2003;28:521-47.
- 131. Mehra MR, Kobashigawa J, Starling R, Russell S, Uber PA, Parameshwar J, et al. Listing criteria for heart transplantation: International Society for Heart and Lung Transplantation guidelines for the care of cardiac transplant candidates-2006. J Heart Lung Transplant 2006;25:1024-42.
- 132. Guimarães GV, Silva MS, d'Avila VM, Ferreira SM, Silva CP, Bocchi EA. Peak VO2 and VE/VCO2 slope in betablockers era in patients with heart failure: a Brazilian experience. Arq Bras Cardiol 2008;91:39-48.
- 133. Leite JJ, Mansur AJ, Freitas HFG, Chizzola PR, Bocchi EA, Terra-Filho M, et al. Periodic breathing during incremental exercise predicts mortality in patients with chronic heart failure evaluated for cardiac transplantation. J Am Coll Cardiol 2003;41:2175-81.
- 134. Guimarães GV, Carvalho VO, Bocchi EA.Reproducibility of the self-controlled six-minute walking test in heart failure patients. Clinics 2008;63:201-6.
- 135. Guimarães GV, Bellotti G, Bacal F, Mocelin A, Bocchi EA. Pode o teste ergométrico de caminhada de seis minutos ser representativo das atividades habituais do paciente? Arq Bras Cardiol 2002;78:553-6.
- 136. Wisloff U, Støylen A, Loennechen JP, Bruvold M, Rognmo Ø, Haram PM, et al. Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients: a randomized study. Circulation 2007;115:3086-94.
- 137. Niebauer J, Clark AL, Webb-Peploe KM, Böger R, Coats AJ. Home-based exercise training modulates pro-oxidant substrates in patients with chronic heart failure. Eur J Heart Fail 2005;7:183-8.
- 138. Schmid JP, Noveanu M, Morger C, Gaillet R, Capoferri M, Anderegg M, et al. Influence of water immersion, water gymnastics and swimming on cardiac output in patients with heart failure. Heart 2007;93:722-7.
- 139. Pullen PR, Nagamia SH, Mehta PK, Thompson WR, Benardot D, Hammoud R, et al. Effects of yoga on inflammation and exercise capacity in patients with chronic heart failure. J Card Fail 2008;14:407-13.
- 140. Yeh GY, Wood MJ, Lorell BH, Stevenson LW, Eisenberg DM, Wayne PM, et al. Effects of tai chi mind-body movement therapy on functional status and exercise capacity in patients with chronic heart failure: a randomized controlled trial. Am J Med 2004;117:541-8.
- 141. Opie LH, Poole-Wilson PA and Pfeffer MA. Angiotensin-converting enzyme inhibitors, angiotensin-II receptors blockers and aldosterone antagonists. IN: Opie L. Drugs for the heart. 6th Ed. P.104-148, 2005.
- 142. Cohn JN, Johnson G, Ziesche S, Cobb F, Francis G, Tristani F, et al. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991; 325:303-10.
- 143. The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987;316:1429-35.
- 144. Yusuf S. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991;325:293-302.
- 145. The SOLVD Investigattors. Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions.. N Engl J Med 1992;327:685-91.
- 146. Pfeffer MA, Braunwald E, Moye LA, Basta L, Brown EJ Jr, Cuddy TE, et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. N Engl J Med 1992;327:669-77.
- 147. Hall AS, Murray GD, Ball SG. Follow-up study of patients randomly allocated ramipril or placebo for heart failure after acute myocardial infarction: AIRE Extension (AIREX) Study. Acute Infarction Ramipril Efficacy. Lancet 1997;349:1493-7.
- 148. Cohn JN, Archibald DG, Ziesche S, Franciosa JA, Harston WE, Tristani FE, et al. Effect of vasodilator therapy on mortality in chronic congestive heart failure: results of a Veterans Administration Cooperative Study. N Engl J Med 1986;314:1547-52.
- 149. Bristow MR. Adrenergic receptor blockade in chronic heart failure. Circulation 2000;101:558-69.
- 150. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999;353:9-13.
- 151. Flather MD, Shibata MC,Coat AJS, Van Veldhuisen DJ, Parkhomenko A, Borbola J, et al. SENIORS Investigators. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005; 26: 215-25.
- 152. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999;353:2001-7.
-
153Foody JM, Farrell MH, Krumholz HM. β-Blockers therapy in Heart Failure.Scientific Review. JAMA 2002;287:883-8.
- 154. Chizzola PR, Freitas HF, Marinho NV, Mansur JA, Meneghetti JC, Bocchi EA, The effect of beta-adrenergic receptor antagonism in cardiac sympathetic neuronal remodeling in patients with heart failure. Int J Cardiol 2006;106:29-34.
- 155. Packer M, Bristow MR, Cohn JN, Colucci WS, Fowler MB, Gilbert EM, et al, for the U.S. Carvedilol Heart Failure Study Group. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med 1996;334:1349-55.
- 156. Packer M, Coats AJ, Fowler MB, Katus HA, Krum H, Mohacsi P, et al. Carvedilol Prospective Randomized Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med 2001;344:1651-8.
- 157. Dargie HJ. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial. Lancet 2001;357:1385-90.
- 158. Colucci WS, Packer M, Bristow MR, Gilbert EM, Cohn JN, Fowler MB, et al, for the US Carvedilol Heart Failure Study Group. Carvedilol inhibits clinical progression in patients with mild symptoms of heart failure. Circulation 1996;94:2800-6.
- 159. Australia/New Zealand Heart Failure Research Collaborative Group. Randomised, placebo-controlled trial of carvedilol in patients with congestive heart failure due to ischaemic heart disease. Lancet 1997;349:375-80.
- 160. Issa VS, Guimarães GV, Rezende MV, Cruz FD, Ferreira SM, Bacal F, et al. Effects of bisoprolol on cardiac function and exercise in patients with heart failure. Arq Bras Cardiol 2007;88:340-5.
- 161. Bocchi EA, Bacal F, Bellotti G, Carrara D, Ramires JAF. Efeitos do carvedilol (bloqueador β1,β2, α1) na insuficiência cardíaca. Arq Bras Cardiol 1998;71:169-73.
- 162. Chizzola PR, Freitas HFG, Marinho NVS, Mansur A, Ramires JAF, Bocchi EA. Efeitos do carvedilol na insuficiência cardíaca por cardiomiopatia dilatada. Resultado do estudo duplo-cego, randômico, com grupo placebo-controle (Estudo CARIBE). Arq Bras Cardiol 2000;74:233-7.
- 163. Komajda M, Lutiger B, Madeira H, Thygesen K, Bobbio M, Hildebrandt P, et al. On behalf of the CARMEN investigators and co-ordinators. Tolerability of carvedilol and ACE-Inhibition in mild heart failure.Results of CARMEN (Carvedilol ACE-Inhibitor Remodelling Mild CHF EvaluatioN) Eur J Heart Fail 2004;6:467-75.
- 164. Sliwa K, Norton GR, Kone N. Impact of Initiating Carvedilol Before Angiotensin-Converting Enzyme Inhibitor Therapy on Cardiac Function in Newly Diagnosed Heart Failure. J Am Coll Cardiol 2004;44:1825-30.
- 165. Willenheimer R, van Veldhuisen DJ, Silke B, Erdmann E, Follath F, Krum H, et al. Effect on Survival and Hospitalization of Initiating Treatment for Chronic Heart Failure With Bisoprolol Followed by Enalapril, as Compared With the Opposite Sequence Results of the Randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation 2005;112:2426-35.
- 166. Pfeffer MA, McMurray JJ, Velazquez EJ, Rouleau JL, Køber L, Maggioni AP, et al. Valsartan in Acute Myocardial Infarction Trial Investigators.Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both.N Engl J Med 2003;349:1893-906.
- 167. Granger CB, McMurray JJ, Yusuf S, Held P, Michelson EL, Olofsson B, et al. CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet 2003;362:772-6.
- 168. Yusuf S, Pfeffer MA, Swedberg K, Granger CB, Held P, McMurray JJ, et al. CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003;362:777-81.
- 169. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999;341:709-17.
- 170. Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B, et al. Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study Investigators.Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003;348:1309-21.
- 171. Cody RJ, Covit AB, Schaer GL, Laragh JH, Sealey JE, Feldschuh J. Sodium and water balance in chronic congestive heart failure. J Clin Invest 1986;77:1441-52.
- 172. Brater DC. Diuretic therapy. N Engl J Med 1998;339:387-95.
- 173. Daskalopoulos G, Laffi G, Morgan T, Pinzani M, Harley H, Reynolds T, et al. Immediate effects of furosemide on renal hemodynamics in chronic liver disease with ascites. Gastroenterology 1987;92:294-8.
- 174. Voelker JR, Cartwright-Brown D, Anderson S, Leinfelder J, Sica DA, Kokko JP, et al. Comparison of loop diuretics in patients with chronic renal insufficiency. Kidney Int 1987;32:572-8.
- 175. Pickkers P, Dormans TP, Russel FG, Hughes AD, Thien T, Schaper N, et al. Direct vascular effects of furosemide in humans. Circulation 1997;96:1847-52.
- 176. Cody RJ, Kubo SH, Pickworth KK. Diuretic treatment for the sodium retention of congestive heart failure. Arch Intern Med 1994;154:1905-14.
- 177. The Captopril-Digoxin Multicenter Research Group. Comparative effects of therapy with captopril and digoxin in patients with mild to moderate heart failure. JAMA 1988;259:539-44.
- 178. Domanski M, Norman J, Pitt B, Haigney M,Hanlon S. Diuretic Use, Progressive Heart Failure, and Death in Patients in the Studies Of Left Ventricular Dysfunction (SOLVD).J Am Coll Cardiol 2003;42:705-8.
- 179. Sydow K, Daiber A, Oelze M, Chen Z, August M, Wendt M, et al. Central role of mitochondrial aldehyde dehydrogenase and reactive oxygen species in nitroglycerin tolerance and cross-tolerance. J Clin Invest 2004;113:482-9.
- 180. Lincoln TM, Dey N, Sellak H. Invited review: cGMP-dependent protein kinase signaling mechanisms in smooth muscle: from the regulation of tone to gene expression. J Appl Physiol 2001;91:1421-30.
- 181. Rinde-Hoffman D, Glasser SP, Arnett DK. Update on nitrate therapy. J Clin Pharmacol 1991;31:697-701.
- 182. Bauer JA, Fung HL. Arterial versus venous metabolism of nitroglycerin to nitric oxide: a possible explanation of organic nitrate venoselectivity. J Cardiovasc Pharmacol 1996;28:371-4.
- 183. Machado JD, Gomez JF, Bentacor G, Camacho M, Brioso MA, Borges R. Hydralazine reduces the quantal size of secretory events by displacement of catecholamines from adrenomedullary chromaffin secretory vesicles. Circ Res 2002;91:830-6.
- 184. Borges R, Machado D, Betancor G, Camacho M. Pharmacological regulation of the late steps of exocytosis. Ann N Y Acad Sci 2002;971:184-92.
- 185. Daiber A, Oelze M, Coldewey M, Kaiser K, Huth C, Schildknecht S, et al. Hydralazine is a powerful inhibitor of peroxynitrite formation as a possible explanation for its beneficial effects on prognosis in patients with congestive heart failure. Biochem Biophys Res Commun 2005;338:1865-74.
- 186. Carson P, Ziesche S, Johnson G, Cohn JN, for the Vasodilator-Heart Failure Trial Study Group. Racial differences in response to therapy for heart failure: analysis of the Vasodilator-Heart Failure trials. J Card Fail 1999;5:178-87.
- 187. Taylor AL, Ziesche S, Yancy C, Carson P, D'Agostino R Jr, Ferdinand K, et al. Combination of isosorbide dinitrate and hydralazine in blacks with heart failure. N Engl J Med 2004;351:2049-57.
- 188. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997;336:525-33.
- 189. Uretsky BF, Young JB, Shahidi FE, Yellen LG, Hrrison MC, Jolly MK. Randomised study assessing the effect of digoxin withdrawal in patients with mild to moderate chronic congestive heart failure: results of the PROVED trial. J Am Coll Cardiol 1993;22:955-62.
- 190. Packer M, Gheorghiade M, Young JB, Costantini PJ, Adams KF, Cody RJ, et al. Withdrawal of digoxin from patients with chronic heart failure treated with angiotensin-converting-enzyme inhibitors: RADIANCE Study. N Engl J Med 1993;329:1-7.
- 191. Ahmed A, Rich MW, Flef JL, Zile MR, Young JB, Kitzman DW, et al. Effects of Digoxin on Morbidity and Mortality in Diastolic Heart Failure: The Ancillary Digitalis Investigation Group Trial. Circulation 2006;114:397-403.
- 192. Silva MAD, Filho EM. Digitálicos. In Batlouni M, Ramires JAF (ed). Farmacologia e Terapêutica cardiovascular - Primeira edição - Atheneu - São Paulo 1999; 83-100.
- 193. Van Veldhuisen DJ, Mann in't Veld AJ, Dunselman PHJM, Lok DJA, Dohmen HJM, Pootermans JC, et al. Double blind palcebo controlled study of ibopamine and digoxin in patients with mild to moderate heart failure: results of the Dutch ibopamine multicenter trial (DIMT). J Am Coll Cardiol 1993;22:1564-73.
- 194. Rathore SS, Curtis JP, Wang Y, Bristow MR, Krumholz HM. Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA 2003;289:871-8.
- 195. Ahmed A, Gambassi G, Weaver MT, Young JB, Wehrmacher WH, Rich MW. Effects of discontinuation of digoxin versus continuation at low serum digoxin concentrations in chronic heart failure. Am J Cardiol 2007;100:280-84.
- 196. Ahmed A, Pitt B, Rahimtoola SH, Waagstein F, White M, Love TE, et al. Effects of digoxin at low serum concentrations on mortality and hospitalization in heart failure: A propensity-matched study of the DIG trial. Int J Cardiol 2008;123:138-46.
- 197. Cleland JG. Ghosh J, Freemantltle N, Kaye GC, Nasir M, Clark AL, et al. Clinical trials and cumulative meta-analysis from the American College of Cardiology: WATCH, SCD-HeFT, DINAMIT, CASINO, INSPIRE, STRATUS-US, RIO-lipids and cardiac resynchronization therapy in heart failure. Eur J Heart Fail 2004;6:501-8.
- 198. Cioffi G, Pozzoli M, Forni G, Franchini M, Opasich C, Cobelli F, et al. Systemic thromboembolism in chronic heart failure. A prospective study in 406 patients. Eur Heart J 1996;17:1381-9.
- 199. Dunkman WB; Johnson GR; Carson PE; Bhat G; Farrell L; Cohn JN. Incidence of thromboembolic events in congestive heart failure. The V-HeFT VA Cooperative Studies Group. Circulation 1993;87(6 Suppl):VI94-101.
- 200. Shivkumar K, Jafri SM, Gheorghiade M. Antithrombotic therapy in atrial fibrillation: a review of randomized trials with special reference to the Stroke Prevention Trial II (SPAF II) Trial. Prog Cardiovasc Dis 1996;38:337-42.
- 201. Cleland JG, Cowburn PJ, Falk RH. Should all patients with atrial fibrillation receive warfarin? Evidence from randomized clinical trials. Eur Heart J 1996;17:674-681.
- 202. Fuster V, Ryden LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA, et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation executive summary: a report of the American College of Cardiology/ American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients with Atrial Fibrillation). Eur Heart J 2006;27:1979-2030.
- 203. Colaborative meta-analysis of randomized trials of antiplatelet therapy for prevention of death, myocardial infarction and stroke in high risk patients. BMJ 2002;324;71-86.
- 204. Pullicino P, Thompson JL, Barton B, Levin B, Graham S, Freudenberger RS, et al. Warfarin versus aspirin in patients with reduced cardiac ejection fraction (WARCEF): Rationale, objectives, and design. J Card Fail 12:39,2006.
- 205. Samama MM, Cohen AT, Darmon JY, Desjardins L, Eldor A, Janbon C, et AL. A comparison of enoxararin with placebo for the prevention of venous thromboembolism in acutely ill medical patients. Prrophylaxis in Medical Patients with Enoxaparin Study Group. N Engl J Med 1999;341:793-800.
- 206. Douglas L. Mann. Management of Heart Failure Patients with Reduced Ejection Fraction in Libby: Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine, 8th ed. Elsevier. Philadelphia. 2008: 611.
- 207. Naccarelli GV, Lukas MA. Carvedilol's antiarrhythmic properties: therapeutic implications in patients with left ventricular dysfunction. Clin Cardiol 2005;28:165-73.
- 208. European Heart Rhythm Association; Heart Rhythm Society, Zipes DP, Camm AJ, Borggrefe M, Buxton AE, Chaitman B, Fromer M, et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death). J Am Coll Cardiol 2006;48:e247-346.
- 209. Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, et al, for the Sudden Cardiac Death in Heart Failure Trial. (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005;352:225-37.
- 210. Connolly SJ, Dorian P, Roberts RS, Gent M, Bailin S, Fain ES, et al. Comparison of beta-blockers, amiodarone plus beta-blockers, or sotalol for prevention of shocks from implantable cardioverter defibrillators: the OPTIC Study: a randomized trial. JAMA 2006;295:165-71.
- 211. Boutitie F, Boissel JP, Connolly SJ, Camm AJ, Cairns JA, Julian DG, et al. Amiodarone interaction with beta-blockers: analysis of the merged EMIAT (European Myocardial Infarct Amiodarone Trial) and CAMIAT (Canadian Amiodarone Myocardial Infarction Trial) databases. The EMIAT and CAMIAT Investigators. Circulation 1999;99:2268-75.
- 212. Vassallo P, Trohman RG. Prescribing amiodarone: an evidence-based review of clinical indications. JAMA 2007;298:1312-22.
- 213. Silva CP, Bacal F, Pires PV, Drager LF, Souza GE, Fajardo GM, et al. The importance of amiodarone pulmonary toxicity in the diffrencial diagnosis of a patient with dyspnea awaiting a heart transplant. Arq Bras Cardiol 2006;87:e4-7.
- 214. Elkayam U, Amin J, Mahra A, Vasquez J, Weber L, Rahimtoola SH, et al. A prospective, randomized, double-blind crossover study to compare the efficacy and safety of chronic nifedipine therapy with that of isosorbide dinitrate and their combination in the treatment of chronic congestive heart failure. Circulation 1990;82:1954 61.
- 215. Goldstein RE, Voccuzzi SJ, Cruess D, Nattel S. Multicentered diltiazem post-infarction research group. Diltiazem increases late-onset CHF in post-infarction patients with early reduction in ejection fraction. Circulation 1991;83:52-60.
- 216. Cohn JN, Ziesche S, Smith R, Anand I, Dunkman WB, Loeb H, et al, for the Vasodilator-Heart Failure Trial (V-HeFT) Study Group. Effect of the calcium antagonist felodipine as supplementary vasodilator therapy in patients with chronic heart failure treated with enalapril. V-HeFT III. Circulation 1997;96:856-63.
- 217. de Vries, RJ, van Veldhuisen, DJ, Dunselman, PH. Efficacy and safety of calcium channel blockers in heart failure: Focus on recent trials with second-generation dihyrdopyridines. Am Heart J 2002;139:185-94.
- 218. Clinical trials update: OPTIME-CHF, PRAISE-2, ALL-HAT. Eur J Heart Fail 2000;2:209-12.
- 219. Packer M, O'Connor CM, Ghali JK, Pressler ML, Carson PE, Belkin RN, et al. Effect of amlodipine on morbidity and mortality in severe chronic heart failure. Prospective Randomized Amlodipine Survival Evaluation Study Group. N Engl J Med. 1996 335:1107-14.
- 220. Voors AA, de Jong RM. Treating diastolic heart failure. Heart 2008;94:971-2.
- 221. Moreira LF, Benicio A, Bacal F, Bochi EA, Stolf NA, Oliveira AS. Determinants of long-term mortality of current palliative surgical treatment for dilated cardiomyopathy. Eur J Cardiothorac 2003;23:756-63.
- 222. Freitas HFG, Mansur AJ, Bocchi EA, Moreira LFP, Barreto ACP, Bellotti G. Dinâmica da avaliação de pacientes para transplante cardíaco ou cardiomioplastia. Arq Bras Cardiol 1995;62:233-7.
- 223. Bocchi EA. Situação atual das indicações e resultados do tratamento cirúrgico da insuficiência cardíaca. Arq Brás Cardiol 1994;63:523-30.
- 224. Bocchi EA, Bellotti EA, Moreira LFP, Bacal F, de Moraes AV, Fiorelli A, et al. Results of heart transplantation, cardiomyoplasty, and medical treatment of refractory heart failure caused by idiopathic dilated cardiomyopathy. J Heart Lung Transpl 1996;15:736-745.
- 225. Moreira LFP, Stolf NAG, Bocchi EA, Bacal F, Pêgo-Fernandes PM, Abensur H, et al. Clinical and left ventricular fucntion outcomes up to five years after dynamic cardiomyoplasty. J Thoracic Cardiovasc Surg 1995;109;353-63.
- 226. Moreira LFP, Bocchi EA. Bacal F, Stolf NAG, Bellotti G, Jatene AD. Present trends in clinical experience with dynamic cardiomyoplasty. Artif Organs 1995;19:211-16.
- 227. Parga JR, Avila LFR, Bacal F, Moreira LF, Stolf NG, Ramires JA, et al. Partial left ventriculectomy in severe idiopathic dilated cardiomyopathy: assessment of short-term results and their impact on late survival by magnetic resonamce imaging. J Magnetic Resonance Imaging 2001;3:781-6.
- 228. Bocchi EA, Vieira ML, Fiorelli A, Hayashida S, Mayzato M, Leirner A, et al. Perfil hemodinâmico e neuro-hormonal durante assistência circulatória com ventrículo artificial seguida de transplante cardíaco. Arq Bras Cardiol 1994;62:23-7.
- 229. Galantier J, Moreira LF, Benício A, Leirner AA, Cestari I, Bocchi EA, et al. Desempenho hemodinâmico e resposta inflamatória durante o uso de DAV-Incor como ponte para transplante. Arq Bras Cardiol 2008;91:327-334.
- 230. CASS Registry long term surgical survival. Coronary Artery Surgery Study. J Am Coll Cardiol 1999;33:488-98.
- 231. Parisi AF, Folland ED, Hartigan P, for the Veterans Affairs ACME Investigators. A comparison of angioplasty with medical therapyin the treatment of single-vessel coronary artery disease. N Engl J Med 1992;326:10-6.
- 232. Passamani E, Davis KB, Gillespie MJ, Killip T. A randomized trial of coronary artery bypass surgery: survival of patients with alow ejection fraction. N Engl J Med 1985;312:1665-71.
- 233. Gibbons RJ, Abrams J, Chatterjee K, Daley J, Deedwania PC, Douglas JS, et al. ACC/AHA2002 guideline update for the management of patients with chronic stable angina: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines(Committee to Update the 1999 Guidelines for the Managementof Patients With Chronic Stable Angina). Available at: www.acc.org/clinical/guidelines/stable/stable.pdf Access date 08/01/08.
- 234. Bolling SF, Pagani FD, Deeb GM, Bach DS. Intermediate-term outcome of mitral reconstruction in cardiomyopathy. J Thorac Cardiovasc Surg 1998;115:381-6.
- 235. Wu AH, Aaronson KD, Bolling SF, Pagani FD, Welch K, Koelling TM. Impact of mitral valve annuloplasty on mortality risk in patients with mitral regurgitationand left ventricular systolic dysfunction. J Am Coll Cardiol 2005;45:381-7.
- 236. Bocchi EA, Esteves-Filho A, Bellotti G, Bacal F, Moreira LF, Stolf N, et al. Left ventricular regional wall motion, ejection fraction, and geometry after partial left ventriculectomy. Influence of associated valve repair. Eur J Cardiothoracic Surg 2000;18:458-65.
- 237. Moreira LF, Stolf NAG, Bocchi EA, Bacal F, Giorgi MC, Parga JR, et al. Partial left ventricylectomy with mitral valve preservation in the treatment of patients with dilated cardiomyopathy. J Thoracic Cardiovasc Surgery 1998;115:800-7.
- 238. Tonnessen T, Knudsen CW. Surgical left ventricular remodeling in heart failure. Eur J Heart Fail 2005;7:704-9.
- 239. Parolari A, Naliato M, Loardi C, Denti P, Trezzi M, Zanobini M, et al. Surgery of left ventricular aneurysm: a meta-analysis of early outcomes following different reconstruction techniques. Ann Thorac Surg 2007;83:2009-16.
- 240. Athanasuleas CL, Buckberg GD, Stanley AW, Siler W, Dor V, Di Donato M, et al, RESTORE group. Surgical ventricular restoration in the treatment of congestive heart failure due to post-infarction ventricular dilation. J Am Coll Cardiol 2004; 44:1439-45.
- 241. Ribeiro GA, da Costa CE, Lopes MM, Albuquerque NA, AntonialiF, Reinert GA, et al. Left ventricular reconstruction benefits patientes with ischemic cardiomyopathy and non-viable myocardium. Eur J Cardiothorac Surg 2006;29:169-201.
- 242. Jones RH, Velazquez EJ, Michler RE, Sopko G, Oh JK, O'Connor CM, et al. Coronary bypass surgery with or without surgical ventricular reconstruction. N Engl J Med 2009;360:1705-17.
- 243. Moreira LFP, Stolf NAG, Higuchi ML, Bacal F, Bocchi EA, Oliveira AS. Current perspectives of partial left ventriculectomy in nthe treatment of dilated cardiomyoplasty Eur J CardioTthoracic Surg 2001;19:54-60.
- 244. Bocchi EA, Bellotti G, Vilella de Moraes A, Bacal F, Moreira LF, Esteves-Filho A, et al. Clinical outcome after left ventricular surgical remodeling in partients with idiopathic dilated cardiomyopathy referred for heart transplantation. Short-term results. Circulation 1997;96:165-72.
- 245. Moreira LP, Stolf N, Higuchi ML, Bacal F, Bocchi EA, Benicio A. Determinants of poor long-term survival after partial ventriculectomy in patients with dilated cardiomyopathy. J Heart Lung Transplant 2001;20:217-8.
- 246. Cury PM, Higuchi ML, Gutierrez PS, Moreira LF, Bocchi EA, Stolf NA, et al. Autopsy findings in early and late postoperative death after partial left ventriculectomy. Ann Thorac Surg 2000;69:769-73.
- 247. Metzger M, Higuchi ML, Moreira LF, Chaves MJ, Castelli JB, Silvestre JM, et al. Relevance of apoptosis and cell proliferation for survival of patients with dilated cardiomyopathy undergoing partial left ventriculectomy. Eur J Clin Invest 2002;32:394-9.
- 248. Stolf NA, Moreira LF, Bocchi EA, Higuchi ML, Bacal F, Bellotti G, et al. Determinants of midterm outcome of partial left ventriculectomy in dilated cardiomyopathy. Ann Thorac Surg 1998;6:1585-91.
- 249. Moreira LF, Stolf NA. Dynamic cardiomyoplasty as a therapeutic alternative: current status. Heart Fail Rev 2001;6: 201-12.
- 250. Moreira LF, Stolf NA, Bocchi EA, Pereira-Barretto AC, Meneghetti JC, Giorgi MC, et al. Latissimus dorsi cardiomyoplasty in the treatment of patients with dilated cardiomyoplasty. Circulation 1990;82:257-63.
- 251. Bocchi EA. Cardiomyoplasty for treatment of heart failure. Eur J Heart Failure 2001;3:403-6.
- 252. Bocchi EA, Moreira LF, Bellotti G, Barreto ACP, Azul LG, Stolf N, et al. Hemodynamic study during upright isotonic exercise before and six months after dynamic cardiomyoplasty for idiopathic dilated cardiomyopathy or Chagas´disease. Am J Cardiol 1991;67:213-4.
- 253. Moreira LFP, Seferian-Jr P, Bocchi EA, Pêgo-Fernandes PM, Stolf NA, Pereira-Barretto AC, et al. Survival improvement with dynamic cardiomyoplasty in patients with dilated cardiomyopathy. Circulation 1991;84:296-302.
- 254. Bocchi EA, Moreira LF, de Moraes AV, Bellotti G, Gama M, Stolf NA, et al. Effects of dynamic cardiomyoplasty on regional wall motion, ejection fraction, and geometry of left ventricle. Circulation 1992;86(supplI)231-5.
- 255. Bellotti G, Moraes A, Bocchi E, Arie S, Medeiros C, Moreira LF, et al. Late effects of cardiomyoplasty on left ventricular mechanics and diastolic filling. Circulation 1993;88:304-8.
- 256. Borghetti-Maio SA, Romano BW, Bocchi EA, Moreira LF, Barreto AC, Stolf NA, et al. Quality of life after cardiomyoplasty. J Heart Lung Tranplant 1994;13:271-5.
- 257. Bocchi EA, Guimarães GV, Moreira LF, Bacal F, de Moraes AV, Barreto AC, et al. Peak oxygen consumption and resting left ventricular ejection fraction chagnges after cardiomyoplasty at 6 months of follow-up. Circulation 1995;92:216-22.
- 258. Bellotti G, Moraes A, Bocchi E, Esteves Filho A, Stolf N, Bacal F, et al. Efeitos da ventriculectomia parcial nas propriedades mecânicas, forma de geometria de ventrículo esquerdo em portadores de cardiomiopatia dilatada. Arq Bras Cardiol 1996;67:395-400.
- 259. Kalil-Filho R, Bocchi EA, Weiss RG, Rosemberg L, Bacal F, Moreira LF, et al. Magnetic resonance imaging evaluation of chronic changes in latissimus dorsi cardiomyoplasty. Circulation 1994;90(5 Pt 2):II102-6.
- 260. Kalil-Filho R, Bocchi EA, Rosemberg L, Bacal F, Moreira LF, Ferreira BM, et al. Avaliação das alterações morfológicas do músculo grande dorsal após cardiomioplastia através da ressonância magnética. Arq Bras Cardiol 1995;65:221-5.
- 261. Bocchi EA, Moreira LF, de Moraes AV, Bacal F, Sosa E, Stolf NA, et al. Arrhythmias and sudden death after dynamic cardiomyoplasty. Circulation 1994 Nov;90(5 Pt 2):II107-11.
- 262. Bocchi EA, Bellotti LF, Gutierrez OS, Stolf N, Jatene AD, Pileggi F. Prognostic indicators of one-year outcome after cardiomyoplasty for idiopathic dilated cardiomyopathy. Am J Cardiol 1994;73:604-8.
- 263. Moreira LFP, Bocchi EA, Stolf NAG, Pileggi F, Jatene AD. Current expectations in dynamic cardiomyoplasty. Ann Thorac Surg 1993;55:299-303.
- 264. Moreira LFM, Stolf NAG, Bacal F, Bocchi EA, Oliveira AS. Long-term outcomes of dynamic cardiomyoplasty: what we learned and challenegs for future applications. J Heart Lung Transplant 2001;20:189.
- 265. Mann DL, Acker MA, Jessup M, Sabbah HN, Starling RC, Kubo SH. Clinical evaluation of the CorCap cardiac support device in patients with dilated cardiomyopathy. Ann Thorac Surg 2007;84:1226-35.
- 266. Luckraz H, Sharples LD, Charman SC, Tsui SS, Wallwork J, Parameshwar J, et al. Does heart transplantation confer survival benefit in all risk groups? J Heart Lung Transplant 2005;24:1231-34.
- 267. Bacal F, Stolf NA, Veiga VC, Chalela WA, Grupi C, Rodrigues AC, et al. Diagnóstico não-invasivo da doença vascular do enxerto após transplante cardíaco. Arq Bras Cardiol 2001;76:29-35.
- 268. Bocchi EA, Mocelin AO, de Moraes AV, Menegheti C, de Lourdes Higuchi M, Bacal F, et al. Comparison between two strategies for rejection detection after heart transplantation: routine endomyocardial biopsy versus gallium-67 cardiac imaging. Transplant Proc 1997;29:586-588.
- 269. Auler Júnior JO, Carmona MJ, Bocchi EA, Bacal F, Fiorelli AI, Stolf NA, et al. Low dose of inhaled nitric oxide in patients submitted to heart transplantation. J Heart lung Transplant 1996;15:443-50.
- 270. Meneguetti JC, Camargo EE, Soares J Jr, Bellotti G, Bocchi E, Higuchi ML, et al. Gallium-67 imaging in human heart transplantation J Heart Lung Transplant 1987;6:171-6.
- 271. Bacal F, Sodré GL, Fernandes DA, Aiello VD, Stolf N, Bocchi E, et al. Methotrexate in acute persistent humoral rejection: an option for graft rescue. Ann Thorac Surg 2003;6:607-10.
- 272. Bocchi EA, Ahualli L, Amuchastegui M, Boullon F, Cerutti B, Colque R, et al. Recommendations for use of everolimus after heart transplantation: results from a Latin-American Consensus Meeting. Transplant Proceedings 2006;38:937-42.
- 273. Fiorelli AI, Stolf NA, Abreu Filho CA, Santos RH, Buco FH, Fiorelli LR, et al. Prophylatic donor tricuspid annuloplasty in orthotopic bicaval heart transplantation. Transplant Proc 2007;39:2527-30.
- 274. Bacal F, Veiga VC, Fiorelli AI, Bellotti G, Bocchi EA, Stolf NA, et al. Treatment of persistent rejection with methotrexate in stable patients submitted to heart transplantation. Arq Bras Cardiol 2000;74:141-4.
- 275. Taylor DO, Edwards LB, Boucek MM, Trulock EP, Aurora P, Christie J, et al. Registry of the International Society for Heart and Lung Transplantation:Twenty-fourth official adult heart transplant report - 2007. J Heart Lung Transplant 2007;26:769-81.
- 276. I Diretriz da Sociedade Brasileira de Cardiologia para Transplante Cardiaco. Arq Bras Cardiol 1999;73(suplemento V).
- 277. Bocchi EA, Fiorelli A; First Guideline Group for Heart Transplantation of the Brazilian Society of Cardiology. The Brazilian experience with heart transplantation. A Multicenter report J Heart Lung Transplant 2001;20:637-45.
- 278. Bocchi EA, Vilas-Boas F, Bacal F, Moreira LF, Fiorelli A, Stolf N, et al. Hemodynamic Evalution During Isotonic Exercise of Patients Submitted to Orthotopic Heart Transpantation. Arq Bras Cardiol 1994;63:7-12.
- 279. Stolf NA, Fiorelli AI, Bacal F, Camargo LF, Bocchi EA, Freitas A, et al. Mediastinitis after cardiac transplantation. Arq Bras Cardiol 2000;74:419-24.
- 280. Bocchi EA, Higuchi ML, Vieira ML, Stolf N, Bellotti G, Fiorelli A, et al. Higher incidence of malignant neoplasms after heart transplantation for treatment of chronic Chagas´ heart disease. J Heart Lung Transplant 1998;399-405.
- 281. Bacal F, Moreira L, Souza G, Rodrigues AC, Fiorelli A, Stolf N, et al. Dobutamine stress echocardiography predicts cardiac events or death in assymptomatic patients during long-term follow-up after heart transplantation: 4-year prospective evaluation. J Heart Lung Transplant 2004;23:1238-44.
- 282. Bocchi EA, Vilas-Boas F, Pedrosa A, Bacal F, Stolf N, Jatene A, et al. Doença coronariana após transplante cardíaco. Arq Bras Cardiol 1994;62;195-200.
- 283. Rodrigues AC, Bacal F, Medeiros CC, Bocchi E, Sbano J, Morhy SS, et al. Noninvasive detection of coronary allograft vasculopathy by myocardial contrast echocardiography. J Am Soc Echocardiogr 2005;18:116-21.
- 284. Bocchi EA, Vilas-Boas F, Pedrosa A, Bacal F, Fiorelli A, Ariê S, et al. Angioplastia coronariana transluminal percutânea após transplante cardíaco ortotópico. Arq Bras Cardiol 1994;62:177-9.
- 285. Bocchi EA, Vilas-Boas F, Sosa EA, Moreira LF, Fiorelli A, Bacal F, et al. Arritmias após transplante cardíaco ortotópico. Arq Bras Cardiol 1994;62:301-5.
- 286. Uip DE, Amato-Neto V, Strabelli TMV, Bocchi EA. Infecções em 100 pacientes submetidos a transplante cardíaco Arq Bras Cardiol 1995;64:537-40.
- 287. Uip DE, Amato-Neto V, Strabelli TMV, Bocchi EA, Fiorelli A, Stolf N, et al. Infeccções bacterianas em 100 pacientes submetidos a transplante cardíaco. Arq Bras Cardiol 1996;66:135-7.
- 288. Uip DE, Amato-Neto D, Strabelli TMV, Bocchi EA, Pileggi F, Jatene AD, et al. Endocardite infecciosa em 100 pacientes submetidos a transplante cardíaco. Arq Bras Cardiol 1996;66:1-3.
- 289. Uip DE, Amato Neto V, Strabelli TMV, Bocchi EA. Infecções causadas por vírus em 100 pacientes submetidos a transplante cardíaco. Arq Brás cardiol 1996;66:199-203.
- 290. Uip DE, Amata-Neto Jr, Strabelli TMV, Bocchi EA, Fiorelli A, Stolf N, et al. Infecções fúngicas em 100 pacientes submetidos a transplante cardíaco. Arq Bras Cardiol 1996;66:65-7.
- 291. Bellotti G, Moraes AV, Bocchi EA, Graziozi P, Medeiros CC, Cerri G, et al. Efeitos da rejeição na reserva de contratilidade do enxerto após o transplante cardáico. Arq Bras Cardiol 1996;67:5-9.
- 292. Bacal F, Magalhães AC, Migueletto BC, Bocchi EA, Stolf N, Fiorelli A, et al. Histoplasmose como complicação tardia após transplante cardíaco em portador de doença de Chagas. Arq Bras Cardiol 2001;76:403-5.
- 293. Bacal F, Veiga VC, Fiorelli A, Bellotti G,Bocchi EA, Stolf N, et al. Análise dos fatores de risco da doença vascular do enxerto em pacientes assintomáticos após transplante cardíaco. Arq Bras Cardiol 2000;75:413-20.
- 294. Giorgi DMA, Bortolotto LA, Seferian P, Bocchi EA, Bernardes-Silva H, Pereira-Barretto AC, et al. Twenty-four-hour monitoring of blood pressure and heart rate in heart transplant patients. J Hypertension 1991;9:340-1.
- 295. Vinagre CG, Stolf NAG, Bocchi EA, Maranhão RC. Chylomicron metabolism in patients submitted to cardiac transplantation. Transplantation 2000;69:532-7.
- 296. Puk CG, Vinagre CG, Bocchi EA, Bacal F, Stolf N, Maranhão RC. Plasma kinetics of a cholesterol-rich micromulsion in patients submitted to heart transplantation. Transplantation 2004;27:1171-81.
- 297. Rodrigues AC, Frimm C, Bacal F, Andreolli V, Tsutsui JM, Bocchi EA, et al. Coronary flow reserve impairment predicts cardiac events in heart transplant patients with preserved left ventricular function. Int J Cardiol 2005;18:201-6.
- 298. Guimaraes GV, d'Avila VM, Pires P, Bacal F, Stolf N, Bocchi EA. Acute effects of a single dose of phosphodiesterase type 5 inhibitor (sildenafil) on systemic arterial blood pressure during exercise and 24-hour ambulatory blood pressure monitoring in heart transplant recipients. Transplant Proc 2007;39:3142-9.
- 299. Maranhão R, Santos RD, Furlaneto C, Graziozi P, Stolf N, Vinagra C, et al. Lipoproteína (a), Apoliproteinas e perfil lipidico em fase tardia após transplante cardíaco. Arq Bras Cardiol 1994;63:465-8.
- 300. Bellotti G, Bocchi EA, Goiato MAC, Bacal F, Stolf N, Pileggi F, et al. Alterações do metabolismo lipidico na evolução tardia após transplante cardíaco. Arq Bras Cardiol 1996;66:263-6.
- 301. Bortolotto LA, Bernardes H, Bocchi EA, Bellotti G, Stolf N, Jatene AD. Evolução a longo prazo e complicações da hipertensão arterial após transplante cardíaco. Arq Bras Cardiol 1997;69:317-21.
- 302. Bacal F, Bocchi EA, Vieira MLC, Lopes N, Moreira LF, Fiorelli A, et al. Uso de marcapasso provisório e definitivo em pacientes submetidos a transplante cardíaco. Arq Bras Cardiol 2000;74:5-8.
- 303. Weiss ES, Nwakanma LU, Patel ND, Yuh DD. Outcomes in patients older than 60 years of age undergoing orthotopic heart transplantation:an analisys of the UNOS database. J Heart Lung Transplant 2008;27:184-91.
- 304. Bocchi EA, Bacal F, Auler Júnior JO, Carmone MJ, Bellotti G, Pileggi F. Inhaled nitric oxide leading to pulmonary edema in stable severe heart failure. Am J Cardiol 1994;74:70-2.
- 305. Bocchi EA, Moraes AV, Esteves-Filho AE, Bacal F, Auler JO, Carmona MJ, et al. Arginine reduces heart rate and improves hemodynamics in severe congestive heart failure. Clin Cardiol 2000;23:205-10.
- 306. Bocchi EA, Auler JO, Guimarães GV, Carmona MJ, Wajngarten M, Bellotti G, et al. Nitric oxide inhalation reduces pulmonary tidal volume during exercise in severe heart failure. Am Heart J 1997;134:737-44.
- 307. Luckraz H, Sharples LD, Charman SC, Tsui SS, Wallwork J, Parameshwar J, et al. Does heart transplantation confer survival benefit in all risk groups? J Heart Lung Transplant 2005;24:1231-4.
- 308. Chiribiri A, Anselmino M, Del Grosso A, Trevi GP, Bobbio M. Long-term follow-up of patients eligible,deferred or ineligible for heart transplantation. J Heart Lung Transplant 2008;27:380-6.
- 309. Odim J, Wheat J, Laks H, Kobashigawa J, Gjertson D, Osugi A, et al. Peri-operative renal function and outcome after orthotopic heart transplantation. J Heart Lung Transplantation 2006;25:162-6.
- 310. Bocchi EA, Fiorelli A. The paradox of survival results after heart transplantation for cardiomiopathy caused by trypanosoma cruzi. First Guidelines Group for Heart Transplantation of the Brazilian Society of Cardiology. Ann Thorac Surg 2001;71:1833-8.
- 311. Bocchi EA, Bellotti G, Uip D, Kalil J, de Lourdes Higuchi M, Fiorelli A, et al. Long-term follow-up after heart transplantation in Chagas' disease. Transplantation Proceedings 1993;25:1329-30.
- 312. Fiorelli AI, Stolf NA, Honorato R, Bocchi E, Bacal F, Uip D, et al. Later evolution after cardiac transplantation in Chagas' disease. Transplant Proc 2005 37:2793-8.
- 313. Campos SV, Strabelli TMV, Amato-Neto V, Silva CP, Bacal F, Bocchi EA, et al. Risk factor for Chagas' disease reactivation after heart transplnatation. J Heart Lung Transpl 2008; 27:597-602.
- 314. Bacal F, Silva CP, Bocchi EA, Pires PV, Moreira LF, Issa VS, et al. Mycophenolate mofetil increased Chagas' disease reactivation in heart transplanted patients: comparison between two different protocols. Am J Transplant 2005;5:2017-21.
- 315. Bocchi EA, Belotti G, Mocelin AO, Uip D, Bacal F, Higuchi ML, et al. Heart Transplantation for chronic Chagas' heart disease. Ann Thorac Surg 1996;61:1727-33.
- 316. Bellotti G, Bocchi EA, Moraes AV, Higuchi M L, Barbero-Marcial M, Sosa E, et al. In vivo detection of Trypanosoma cruzi antigens in hearts of patients with chronic Chagas' heart disease. Am Heart J 1996;131:301-7.
- 317. Occhetta E, Bortnik M, Francalacci G, Sarasso G, Piccinino C, Pistono M, et al. Dual-chamber DDD pacing in NYHA III-IV functional class dilated cardiomyopathy: short and middle-term evaluation. Cardiologia 1998;43:1327-35.
- 318. Yu CM, Lin H, Zhang Q. High prevalence of left ventricular systolic and diastolic asynchrony in patients with congestive heart failure and normal QRS duration. Heart 2003; 89:54-60.
- 319. Auricchio A, Stelbrink C, Block M, Vogt J, Bakker P, et al. The Pacing Therapies for Congestive Heart Failure (PATH-CHF) study: rationale, design and end-points of a prospective randomized multicenter study. Am J Cardiol 1999; 83:130D-5D.
- 320. Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De Marco T, et al. Cardiac-Resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004;350:2140-50.
- 321. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005;352:1539-49.
- 322. Freemantle N, Tharmanathan P, Calvert MJ, Abraham WT, Ghosh J, Cleland JG. Cardiac resynchronisation for patients with heart failure due to left ventricular systolic dysfunction a systematic review and meta-analysis. Eur Heart J Failure 2006;8:433-40.
- 323. Leclercq C, Cazeau S, Lellouche D, Fossati F, Anselme F, Davy JM, et al. Upgrading from single chamber right ventricular to biventricular pacing in permanently paced patients with worsening heart failure: The RD-CHF Study. Pacing Clin Electrophysiol. 2007;30 (Suppl 1):S23-30.
- 324. Higgins SL, Hummel JD, Niazi IK, Giudici MC, Worley SJ, Saxon LA, et al. Cardiac resynchronization therapy for the treatment of heart failure in patients with intraventricular conduction delay and malignant ventricular tachyarrhythmias. J Am Coll Cardiol 2003;42:1454-9.
- 325. Martinelli M, Costa R, Siqueira SF, Ramires JA. COMBAT-conventional versus multisite pacing for bradyarrhythmia therapy: rationale of a prospective randomized multicenter study. Eur J Heart Fail 2005;7:219-24.
- 326. Kindermann M, Hennen B, Jung J, Geisel J, Böhm M, Föhlig G. Biventricular versus conventional right ventricular stimulation for patients with standard pacing indication and left ventricular dysfunction: the Homburg Biventricular Pacing Evaluation (HOBIPACE). J Am Coll Cardiol 2006;47:1946-8.
- 327. Valls-Bertault V, Fatemi M, Gilard M, Pennec PY, Etienne Y, Blanc JJ. Assessment of upgrading to biventricular pacing in patients with right ventricular pacing and congestive heart failure after atrioventricular junctional ablation for chronic atrial fibrillation. Europace 2004;6:438e-43e.
- 328. Leon RA, Greenberg JM, Kanuru N, Baker CM, Mera FV, Andrew L, et al. Cardiac Resynchronization in Patients With Congestive Heart Failure and Chronic Atrial Fibrillation. Effect of Upgrading to Biventricular Pacing After Chronic Right Ventricular Pacing. J Am Coll Cardiol 2002;39:1258-63.
- 329. Feldman AM, de Lissovoy G, Bristow MR, Saxon LA, De Marco T, Kass DA, et al. Cost Effectiveness of Cardiac Resynchronization Therapy and Defibrillation in Heart Failure (COMPANION) Trial. J Am Coll Cardiol 2005;46:2311-21.
- 330. Narang R, Cleland JG, Erhardt I, Ball SG, Coats AJ, Cowley AJ, et al. Mode of death in chronic heart failure. Eur Heart J 1996;17:1390-403.
- 331. Buxton AE. Should everyone with an ejection fraction less than or equal to 30% receive an implantable cardioverter-defibrillator? Circulation 2005;111: 2437-549.
- 332. Arshad A, Mandava A, Kamat G, Musat D. Sudden cardiac death an the role of medical therapy. Progress Cardiov Dis 2008:50:420-38.
- 333. Pitt B, Pitt GS. Added benefit of mineralocorticoid receptor blockade in the primary prevention of sudden cardiac death. Circulation 2007;115:2976-82.
- 334. Adamson PB, Gilbert EM. Reducing the risk of sudden death in heart failure with beta-blokers. J Cardiac Fail 2006; 12:174-46
- 335. Connoly SJ, HalLstrom AP, Cappato R, Schron EB, Kuck KH, Zipes DP, et al. Meta-analysis of the implantable defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Eur Heart J 2000;21:2071-78.
- 336. Moss AJ, Zareba W, Hall JW, Klein H, Wilber DJ, Cannom DS, et al; Multicenter Automatic Defibrillator Trial II invesgator (MADIT II ). Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002;346:877-83.
- 337. Goldenberg I, Vyas AK, Hall WJ, Moss AJ, Wang H, He H, et al; MADIT-II Investigators. Risk stratification for primary implantation of a cardioverter-defibrillator in patients with ischemic left ventricular dysfunction. J Am Coll Cardiol;2008 51:288-98.
- 338. Nissan S, Breithardt G. Lessons leanerd from neutral ICD trials. Europace 2006;8:393-97.
- 339. Bigger JT. For the Coronary Artery Baypass Graft (CABG) Patch Trial investigators. Profilatic use of implanted cardiac defibrillator in patients at high risk for ventricular arrhytmias after coronary artery baypass grafth surgery. N Engl J Med 1997;337:1565-75.
- 340. Hohnloser SH, Kuck KH, Dorian P, Roberts RS, Hampton JR, Hatala R, et al. Defibrillator in Acute Mayocardial Infarction Trial (DINAMIT). N Eng J Med 2004;351:2481-88.
- 341. Strickberger SA, Hummel JD, Bartlett TG, Frumin HI, Schuger CD, Beau SL, et al. Amiodarone versus implantable cardioverter-defibrillator: randomized trial in patients with nonischemic cardiomayopathy an asymptomatic nonsustaind ventricular tachycardia-AMIOVIRT. J Am Coll Cardiol 2003;41:1707-12.
- 342. Kadish A, Dyer A, Daubert JP, Quigg R, Estes NA, Anderson KP, et al. Defibrillators in Nonischemic Cardiomayopathy Treatment Evaluatoin (DEFINITE) investigators. Prophylatic defibrillators implantation in patients with nonischemic dilated cardiomayopthy. N Engl J Med 2004;350:2151-8.
- 343. Hay JW, Lei C. Cost-effectiveness of primary implanted cardioverter defibrillator for sudden cardiac death prevention in congestive heart failure. Cardiov Drugs and Ther 2004; 18:161-70.
- 344. Sanders G, Hlatky MA, Owens DK. Cost-effectiveness of implantable cardioverter-defibrillator. N Eng J Med 2005;353:1471-80.
- 345. Tung R, Zimetbaum P, Josephson ME. A critical appraisal of implantable cardioverter-defibrillator therapy for prevention of sudden cardiac death. J Am Coll Cardiol 2008;52:1111-21.
- 346. May CD, Smith PR, Murdoch CJ, Davis MJE. The impact of the implantable cardioverter-defibrillator on Quality of Lyfe. PACE 1995;18:1411-17.
- 347. Maisel WH, Moynahan M, Zuckerman BD, Gross TP, Tovar OH, Tillman DB, et al. Pacemaker and ICD generator malfunctions: analysis of Food and Drug Administration annual reports. JAMA 2006;295:1944-46.
- 348. Levy D, Larson MG, Vasan RS, Kannel WB, Ho KK. The progression from hypertension to congestive heart failure. JAMA 1996;275:1557-62.
- 349. Heart Failure Society Of America. HFSA 2006 Comprehensive Heart Failure Practice Guideline. J Card Fail 2006;12:e1-119.
- 350. The European trial on Reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomized, double-blind, placebocontrolled, multicentre trial (the EUROPA study). Lancet 2003;362: 782-88.
- 351. Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving HH, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001;345:861-9.
- 352. Dahlöf B, Devereux RB, Kjeldsen SE, Julius S, Beevers G, de Faire U, et al. Cardiovascular morbidity and mortality in the Losartan Intervention for Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. Lancet 2002;359:995-1003.
- 353. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an angiotensin-convertingenzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000;342:145-53.
- 354. Lewis EJ, Hunsicker LG, Clarke WR, Berl T, Pohl MA, Lewis JB, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001;345:851-60.
- 355. Kjekshus J, Pedersen TR, Olsson AG, Faergeman O, Pyörälä K. The effects of simvastatin on the incidence of heart failure in patients with coronary heart disease. J Card Fail 1997;3:249-54.
- 356. Pfeffer MA, Swedberg K, Granger CB, Held P, McMurray JJ, Michelson EL, et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet 2003;362:759-66.
- 357. Garg R, Yussuf S. Overview of randomized trials of angiotensin-converting enzyme inhibitors on mortality and morbidity in patients with heart failure. JAMA 1995; 273: 1450-56.
- 358. Wilkoff BL, Auricchio A, Brugada J, Cowie M, Ellenbogen KA, Gillis AM, et al. HRS/EHRA Expert Consensus on the Monitoring of Cardiovascular Implantable Electronic Devices (CIEDs): description of techniques, indications, personnel, frequency and ethical considerations: developed in partnership with the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA); and in collaboration with the American College of Cardiology (ACC), the American Heart Association (AHA), the European Society of Cardiology (ESC), the Heart Failure Association of ESC (HFA), and the Heart Failure Society of America (HFSA). Endorsed by the Heart Rhythm Society, the European Heart Rhythm Association (a registered branch of the ESC), the American College of Cardiology, the American Heart Association. Europace 2008;10:707-25.
- 359. Paulus WJ, Tschöpe C, Sanderson JE, Rusconi C, Flachskampf FA, Rademakers FE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007;28:2539-50.
- 360. Zile MR, Brutsaert DL. New concepts in diastolic dysfunction and diastolic heart failure: part I: diagnosis, prognosis, and measurement of diastolic function. Circulation 2002;105:1387-93.
- 361. Hogg K, Swedberg K, McMurray J. Heart Failure with preserved left ventricular systolic function: epidemiology, clinical characteristics, and prognosis. J Am Coll Cardiol 2004;43:317-27.
- 362. Paulus WJ, Tschöpe C, Sanderson JE, Rusconi C, Flachskampf FA, Rademakers FE. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J. 2007 Oct;28(20):2539-50.
- 363. Lang RM, Bierig M, Devereux RB, Flachskampf FA, Foster E, Pellikka PA, et al. Recomendations for chamber quantification. Eur J Echocardiography 2006;7:79-108.
- 364. Carson P, Massie BM, McKelvie R, McMurray J, Komajda M, Zile M, et al. The Irbesartan in Heart Failure with Preserved Systolic Function (I PRESERVE) Trial: Rationale and Design. J Cardiac Fail 2005;11:576-85.
- 365. Massie BM, Carson PE, McMurray JJ, Komajda M, McKelvie R, Zile MR, et al. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008;359:2456-67.
- 366. Cleland JG, Tendera M, Adamus J, Freemantle N, Gray CS, Lye M, et al. Perindopril for the elderly people with chronic heart failure: the PEP-CHF study. Eur J Heart Fail 1999;1:211-17.
- 367. Heywood JT. The Cardiorenal Syndrome: Lessons from the ADHERE Database and treatment options. Heart Fail Rev 2004;9:195-201.
- 368. Fonarow GC, Heywood JT. The Confounding Issue of Comorbid Renal Insufficiency. Am J Med 2006;119:S17-S25.
- 369. Liang KV, Williams AW, Greene EL, Redfield MM. Acute decompensated heart failure and the cardiorenal syndrome. Crit Care Med 2008;36:S75-S88.
- 370. Hillege HL, Girbes ARJ, De Kam PJ, Boomsma F, De Zeeuw D, Charlesworth A, et al. Renal Function, Neurohormonal Activation, and Survival in Patients With Chronic Heart Failure. Circulation 2000;102:203-10.
- 371. Smith GL, Lichtman JH, Bracken MB, Shlipak MG, Phillips CO, Dicapua P, et al. Renal Impairment and Outcomes in Heart Failure: Systematic Review and Meta-Analysis. J Am Coll Cardiol 2006;47:1987-96.
- 372. Mcalister FA, Ezekowitz J, Tonelli M, Armstrong PW. Renal Insufficiency and Heart Failure: Prognostic and Therapeutic Implications from a Prospective Cohort Study. Circulation 2004;109:8:1004-9.
- 373. Saltzman HE, Sharma K, Mather PJ, Rubin S, Adams S, Whellan DJ. Renal dysfunction in heart failure patients: whatt is the evidence? Heart Fail Rev 2007; 12:37-41.
- 374. Ahmed A. Use de angiotensin-converting enzyme inhibitors in patients with heart failure and renal insufficiency: how concerned should we be by the rise in serum creatinine? J Am Geriatr Soc 2002;50:1297-300.
- 375. Ljungman S, Kjekshus J, Swedlberg K. Renal function in severe congestive heart failure during treatment with enelapril (CONSENSUS Trial). Am J Cardiol 1992;70:479-87.
- 376. Issa VS, Bacal F, Mangini S, Carneiro RM, Azevedo CH, Chizzola PR, et al. Hypertonic saline solution for renal failure prevention in patients with decompensated heart failure. Arq Bras Cardiol 2007 89:251-5.
- 377. Westenbrink BD, de Boer RA, Voors AA, van Gilst WH, van Veldhuisen DJ. Anemia in chronic heart failure: etiology and treatment options. Curr Opin Cardiol 2008;23:141-7.
- 378. Nanas JN, Matsouka C, Karageorgopoulos D, Leonti A, Tsolakis E, Drakos SG, et al. Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol 2006;48:2485-9.
- 379. Tang WH, Tong W, Jain A, Francis GS, Harris CM, Young JB. Evaluation and long-term prognosis of new-onset, transient, and persistent anemia in ambulatory patients with chronic heart failure. J Am Coll Cardiol 2008;51:569-76.
- 380. Murphy C, McMurray J. Approaches to the treatment of anaemia in patients with chronic heart failure. Heart Fail Rev 2008,13:431-8.
- 381. Anand I. Anemia and Chronic Heart Failure: Implications and Treatment Options. J Am Coll Cardiol 2008;52:501-11.
- 382. Komajda M, Anker SD, Charlesworth A, Okonko D, Metra M, Di Lenarda A, et al. The impact of new onset anaemia on morbidity and mortality in chronic heart failure: results from COMET. Eur Heart J 2006; 27:1440-6.
- 383. Ghali JK, Anand IS, Abraham WT, Fonarow GC, Greenberg B, Krum H, et al; on behalf of the Study of Anemia in Heart Failure Trial (STAMINA-HeFT) Group (2008) Randomized double-blind trial of darbepoetin alfa in patients with symptomatic heart failure and anemia. Circulation 2008;117:526-35.
- 384. Bolger AP, Bartlett FR, Penston HS, O'Leary J, Pollock N, Kaprielian R, et al. Intravenous iron alone for the treatment of anemia in patients with chronic heart failure. J Am Coll Cardiol 2006,48:1225-7.
- 385. Toblli JE, Lombrana A, Duarte P, Di Gennaro F. Intravenous iron reduces NT-pro-brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. J Am Coll Cardiol 2007,50:1657-5.
- 386. Beck-da-Silva L, Rohde LE, Pereira-Barretto AC, de Albuquerque D, Bocchi E, Vilas-Boas F, et al. Rationale and design of the IRON-HF study: a randomized trial to assess the effects of iron supplementation in heart failure patients with anemia. J Card Fail 2007;13:14-7.
- 387. Held C, Gerstein HC, Yusuf S, Zhao F, Hilbrich L, Anderson C, et al; ONTARGET/TRANSCEND Investigators. Glucose levels predict hospitalization for congestive heart failure in patients at high cardiovascular risk. Circulation 2007;115:1371-5.
- 388. Bobbio M, Ferrua S, Opasich C, Porcu M, Lucci D, Scherillo M, et al. Survival and hospitalization in heart failure patients with or without diabetes treated with beta-blockers. J Card Fail 2003;9:192-202.
- 389. Haas SJ, Vos T, Gilbert RE, Krum H. Are beta-blockers as efficacious in patients with diabetes mellitus as in patients without diabetes mellitus who have chronic heart failure? A meta-analysis of large-scale clinical trials. Am Heart J 2003;146:848-53.
- 390. Dargie HJ, Hildebrandt PR, Riegger GA, McMurray JJ, McMorn SO, Roberts JN, et al. A randomized, placebo-controlled trial assessing the effects of rosiglitazone on echocardiographic function and cardiac status in type 2 diabetic patients with New York Heart Association Functional Class I or II Heart Failure. J Am Coll Cardiol 2007;49:1696-1704.
- 391. Roberts F, Ryan GJ. The safety of metformin in heart failure. Ann Pharmather 2007;41:642-6.
- 392. Suskin NG, Heigenhauser G, Afzal R, Finegood D, Gerstein HC, McKelvie RS. The effects of exercise training on insulin resistance in patients with coronary artery disease. Eur J Cardiovasc Prev Rehabil 2007;14:803-8.
- 393. Jentel THL, Padeletti M, Jeck S. Diagnostic and therapeutic challenges in patients with coexistent chronic obstructive pulmonary disease and chronic heart failure. J Am Coll Cardiol 2007;49:171-80.
- 394. Rutten FH, Cramer MJ, Grobbee DE, Sachs AP, Kirkels JH, Lammers JW, et al. Unrecognized heart failure in elderly patients with stable chronic obstructive pulmonary disease. Eur Heart J 2005;261:1887-94.
- 395. Steg PG, Joubin L, McCord J, Abraham WT, Hollander JE, Omland T, et al. B-type natriuretic peptide and echocardiographic determination of ejection fraction in the diagnosis of congestive heart failure in patients with acute dyspnea. Chest 2005;128:21-9.
- 396. Mueller C, Laule-Kilian K, Frana B, Rodriguez D, Scholer A, Schindler C, et al. Use of B-type natriuretic peptide in the management of acute dyspnea in patients with pulmonary disease. Am Heart J 2006;151:471-7.
- 397. Van der Woude HJ, Zaagsma J, Postma DS, Winter TH, Van Hulst M, Aslbers R. Detrimental effects of bera-blockers in COPD: a concern for nonselective beta-blockers. Chest 2005;127:818-24.
- 398. Pingitore A, Landi P, Taddei MC, Ripoli A, L'Abbate A, Iervasi G. Triiodothyronine levels for risk stratification of patients with chronic heart failure. Am J Med 2005;118:132-6.
- 399. Hamilton MA, Stevenson LW, Luu M, Walden JA. Altered thyroid hormone metabolism in advanced heart failure. J Am Coll Cardiol 1990;16:91-95.
- 400. Klein I, Danzi S. Thyroid Disease and the Heart. Circulation 2007;116:1725-35.
- 401. Harjai KJ, Licata AA. Effects of amiodarone in thyroid function. Ann Intern Med 2006;126:63-73.
- 402. Ferreira S, Winck J, Bettencourt P, Rocha-Gonçalves F. Heart Falilure and sleep apnoea: to sleep perchance to dream. Eur J Heart Fail 2006;8:227-36.
- 403. Somers VK, White DP, Amin R, Abraham WT, Costa F, Culebras A, et al. Sleep Apnea and Cardiovascular Disease. An American Heart Association/American College of Cardiology Foundation Scientific Statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing Council. Circulation 2008;118:1080-111.
- 404. Arzt M, Young T, Finn L, Skatrud JB, Ryan CM, Newton GE, et al. Sleepiness and sleep in patients with both systolic heart failure and obstructive sleep apnea. Arch Intern Med 2006;166:1716-22.
- 405. Bradley TD, Floras JS. Sleep Apnea and Heart Failure: Part II: Central Sleep Apnea. Circulation 2003;107:1822-6.
- 406. Wang H, Parker JD, Newton GE, Floras JS, Mak S, Chiu KL, et al. Influence of obstructive sleep apnea on mortality in patients with heart failure. J Am Coll Cardiol 2007;49:1625-31.
- 407. Kaneko Y, Floras JS, Usui K, Plante J, Tkacova R, Kubo T, et al. Cardiovascular effects of continuous positive airway pressure in patients with heart failure and obstructive sleep apnea. N Engl J Med 2003;348:1233-41.
- 408. Sharafkhaneh A, Sharafkhaneh H, Bredikus A, Guilleminault C, Bozkurt B, Hirshkowitz M. Effect of atrial overdrive pacing on obstructive sleep apnea in patients with systolic heart failure. Sleep Med 2007;8:31-6.
- 409. Usui K, Bradley TD, Spaak J, Ryan CM, Kubo T, Kaneko Y, et al. Inhibition of awake sympathetic nerve activity of heart failure patients with obstructive sleep apnea by nocturnal continuous positive airway pressure. J Am Coll Cardiol 2005;45:2008-11.
- 410. Ruttanaumpawan P, Gilman MP, Usui K, Floras JS, Bradley TD. Sustained effect of continuous positive airway pressure on baroreflex sensitivity in congestive heart failure patients with obstruct sleep apnea. J Hypertens 2008;26:1163-8.
- 411. Kasai T, Narui K, Dohi T, Yanagisawa N, Ishiwata S, Ohno M, Yamaguchi T, Momomura S. Prognosis of patients with heart failure and obstructive sleep apnea treated with continuous positive airway pressure. Chest 2008;133:690-6.
- 412. Bradley TD, Logan AG, Kimoff RJ, Sériès F, Morrison D, Ferguson K, et al. Continuos Positive Airway pressure for Central Sleep Apneia and Heart Failure. N Eng J Med 2005;353:2025-33.
- 413. Maricle RA, Hosenpud JD, Norman DJ, Woodbury A, Pantley GA, Cobanoglu AM, et al. Depression in patients being evaluated for heart transplantation. Gen Hosp Psychiatry 1989;11:418-24.
- 414. Koenig HG. Depression in hospitalized older patients with congestive heart failure. Gen Hosp Psychiatry 1998;20:29-43.
- 415. Kulcu DG, Kurtais Y, Tur BS, Gülec S, Seckin B. The effect of cardiac rehabilitation on quality of life, anxiety and depression in patients with congestive heart failure. A randomized controlled trial, short-term results. Eura Medicophys 2007;43:489-497.
- 416. Gottlieb SS, Kop WJ, Thomas SA, Katzen S, Vesely MR, Greenberg N, et al. A double-blind placebo-controlled pilot study of controlled-release paroxetine on depression and quality of life in chronic heart failure. Am Heart J 2007;153:868-873.
- 417. Aimonino N, Tibaldi V, Barale S, Bardelli B, Pilon S, Marchetto C, et al. Depressive symptoms and quality of life in elderly patients with exacerbation of chronic obstructive pulmonary disease or cardiac heart failure: preliminary data of a randomized controlled trial. Arch Gerontol Geriatr 2007;44 Suppl 1:7-12
- 418. Hudson M, Rahme E, Richard H, Pilote L. Risk of congestive heart failure with nonsteroidal antiinflammatory drugs and selective Cyclooxygenase 2 inhibitors: a class effect? Arthritis Rheum 2007;57:516-23.
- 419. Bernatsky S, Hudson M, Suissa S. Anti-reumathic drug use and risk of hospitalization for congestive heart failure in rheumatoid arthritis. Reumatology 2005;44:677-80.
- 420. Leese PT, Hubbard RC, Karim A, Isakson PC, Yu SS, Geis GS. Effects of celecoxib, a novel cyclooxygenase 2 inhibitor, on platelet function in healthy adults: a randomized, controlled trial. J Clin Pharmacol 2000;40:124-32.
- 421. Becker RC. COX-2 inhibitors. Tex Heart Inst J 2005;32:380-83.
- 422. Pai VB, Nahata MC. Cardiotoxicity of chemotherapeutic agents: incidence, treatment and prevention. Drug Saf 2000;22:263-302.
- 423. Jurcut R, Wildiers H, Ganame J, D'hooge J, Paridaens R, Voigt JU. Detection and monitoring of cardiotoxicity-what does modern cardiology offer? Support Care Cancer 2008;16:437-45.
- 424. Kalyanaraman B, Joseph J, Kalivendi S, Wang S, Konorev E, Kotamraju S. Doxorubicin-induced apoptosis: implications in cardiotoxicity. Mol Cell Biochem 2002;235:119-24.
- 425. Wallace KB, Eells JT, Madeira VM, Cortopassi G, Jones DP. Mitochondria-mediated cell injury: symposium overview, Fundam Appl Toxicol 1977;38:23-37.
- 426. Bai P, Mabley JG, Liaudet L, Virág L, Szabó C, Pacher P. Matrix metalloproteinase activation is an early event in doxorubicin-induced cardiotoxicity. Oncol Rep 2004;11:505-08.
- 427. Olson RD, Mushlin PS. Doxorubicin cardiotoxicity: analysis of prevailing hypotheses, FASEB 1990;4:3076-86.
- 428. Singal PK, Deally CMR, Weinberg LE. Subcellular effects of Adriamycin in the heart: a concise review. J Mol Cell Cardiol 1987;19:817-28.
- 429. Cardinale D, Colombo A, Sandri MT, Lamantia G, Colombo N, Civelli M, et al. Prevention of high-dose chemotherapy-induced cardiotoxicity in high-risk patients by angiotensin-converting enzyme inhibition. Circulation 2006;114;2474-81.
- 430. Kalay N, Basar, Ozdogru I, Er O, Cetinkaya Y, Dogan A, et al. Protective Effects of Carvedilol Against Anthracycline-Induced Cardiomyopathy. J Am Coll Cardiol 2006;48:2258-62.
- 431. Roy D, Talajic M, Nattel S, Wyse DG, Dorian P, Lee KL, et al. Rhythm Control versus Rate Control for Atrial Fibrillation and Heart Failure. N Engl J Med 2008;358:2667-77.
- 432. The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators. A Comparison of Rate Control and Rhythm Control in Patients with Atrial Fibrillation. N Engl J Med 2002;347:1825-33.
- 433. Shaddy R, Tani LY. Chronic congestive heart failure. IN: Pediatric Cardilogy. Moss E, Shaddy R eds. 2008.
- 434. Lipshultz SE, Sleeper LA, Towbin JA, Lowe AM, Orav EJ, Cox GF, et al. The incidence of pediatric cardiomyopathy in two regions of the United States. N Engl J Med 2003;348:1647-55.
- 435. Nugent AW, Daubeney PE, Chondros P, Carlin JB, Cheung M, Wilkinson LC, et al. The epidemiology of childhood cardiomyopathy in Australia. N Engl J Med 2003;348:1639-46.
- 436. Ross RD, Bollinger RO, Pinsky WW. Grading the severity of congestive heart failure in infants. Pediatric Cardiol 1992;13:72-5.
- 437. Rosenthal D, Chrisant MRK, Edens E, Mahony L, Canter C, Colan S, et al. International Society for Heart and Lung Transplantation: Practice guidelines for management of heart failure in children. J Heart Lung Transplant 2004;23:1313-33.
- 438. Auslender M, Artman M. Overview of the management of pediatric heart failure. Prog Pediatr Cardiol 2000;11:231-41.
- 439. Azeka E, Franchini Ramires JA, Valler C, Bocchi EA. Delisting of infants and children from the heart transplantation waiting list after carvedilol treatment. J Am Coll Cardiol 2002;40:2034-8.
- 440. Shaddy RE, Boucek MM, Hsu DT, Boucek RJ, Canter CE, Mahony L, et al. Carvedilol for children and adolescents with heart failure. JAMA 2007;298:1171-9.
- 441. Canter CE, Shaddy R, Bernstein D, Hsu DT, Chrisant MR, Kirklin JE, et al. Indications for heart transplantation in pediatric disease: a scientific statement from the American Heart Association Council on Cardiovascular Disease in the young, the councils on clinical cardiology, cardiovascular nursing, and cardiovascular surgery and anesthesia, and the quality of care and outcomes research interdisciplinary working group. Circulation 2007;115:658-76.
- 442. Azeka E, Loures DR, Jatene M, Farvarato ME. I Guidelines of Brazilian Cardiology Society for heart transplantation: II: heart transplantation in children. Arq Bras Cardiol 1999;73: 5-11.
- 443. Boucek MM, Parisi F, Shaddy R. Pediatric heart transplantation. IN: Pediatric Cardiology. Moss E, Shaddy R,eds 2008,426- 438.
- 444. Batlouni M, Barretto AC, Armaganijan D, Vichi FL, Spritzer N, Simões R, et al. Tratamento da insuficiência cardíaca leve e moderada com captopril. Estudo multicêntrico. Arq Bras Cardiol 1992;58:417-421.
- 445. Ramires FJ, Salemi VM, Ianni BM, Fernandes F, Martins DG, Billate A, et al. Aldosterone antagonism in an inflammatory state: evidence for myocardial protection. J Renin Angiotensin Aldosterone Syst 2006;7:162-7.
- 446. Doval HC, Nul DR, Grancelli HO, Perrone SV, Bortman GR, Curiel R. Randomised trial of low-dose amiodarone in severe congestive heart failure. Grupo de Estudio de la Sobrevida en la Insuficiencia Cardiaca en Argentina (GESICA). Lancet 1994;344:493-8.
- 447. Lindheimer MD, Katz AI. Sodium and diuretics in pregnancy. N Engl J Med 1973; 288:891-4.
- 448. Cooper WO, Hernandez-Diaz S, Arbogast PG, Dudley JA, Dyer S, Gideon PS, et al. Major Congenital Malformations after First-Trimester Exposure to ACE Inhibitors. N Engl J Med 2006;354:2443-51.
- 449. Pearson GD, Veille JC, Rahimtoola S, Hsia J, Oakley CM, Hosenpud JD, et al. Peripartum cardiomyopathy: National Heart, Lung, and Blood Institute and Office of Rare Diseases (National Institutes of Health) workshop recommendations and review. JAMA 2000;283:1183-8.
- 450. Easterling TR, Carr DB, Brateng D, Diederichs C, Schmucker B. Treatment of hypertension in pregnancy: effect of atenolol on maternal disease, preterm delivery, and fetal growth. Obstet Gynecol 2001;98:427-33.
- 451. Groves TD, Corenblum B. Spironolactone Therapy During Human Pregnancy. Am J Obstet Gynecol 1995;172:1655-6.
- 452. Joglar, JA, Page, RL. Treatment of cardiac arrhythmias during pregnancy: safety considerations. Drug Saf 1999;20:85-94.
- 453. Ahmed A, Rich MW, Love TE, Lloyd-Jones DM, Aban IB, Colucci WS, et al. Digoxin and reduction in mortality and hospitalization in heart failure: A comprehensive post hoc analysis of the DIG trial. Eur Heart J 2006;27:178-86.
- 454. Turnbull F, Neal B, Algert C, Chalmers J, Chapman N, Cutler J, et al. Blood Pressure Lower Trialists Collaboration: effects of different blood pressure-lowering on major cardiovascular events in individuals with and without diabetes mellitus: Results of prospectively designed overviews of randomized trials. Arch Intern Med 2005;165:1410-9.
- 455. Curiati JA, Bocchi EA, Arantes AC, Braga M, Baccelli FC, Jacob-filho W. Otimização das doses de inibidores da enzima conversora da angiotensina ou inibidores da angiotensina II e carvedilol em pacientes idosos ambulatórias com insuficiência cardíaca Rev Bras Med 2005;62:343-50.
- 456. Rich MW, Beckham V, Wittenberg C, Leven CL, Freedland KE, Carney RM. A multidisciplinary intervention to prevent the readmission of elderly patients with congestive heart failure. N Engl J Med 1995;333:1190-5.
- 457. Naylor MD, Brooten DA, Campbell RL, Maislin G, McCauley KM, Schwartz JS. Transitional care of older adults hospitalized with heart failure: A randomized controlled trial. J Am Geriatr Soc 2004;52:672-84.
- 458. Thöni GJ, Fedou C, Brun JF, Fabre J, Renard E, Reynes J, et al. Reduction of fat accumulation and lipid disorders by individualized light aerobic training in human immunodeficiency virus infected patients with lipodystrophy and or dyslipidemia. Diabetes Metab 2002;28:397-404.
- 459. Grover SA, Coupal L, Gilmore N, Mukherjee J. Impact of dyslipidemia associated with Higlhly Active Antiretroviral Therapy (HAART) on cardiovascular risk and life expectancy. Am J Cardiol 2005;95:586-91.
- 460. Domanski MJ, Sloas MM, Follmann DA, Scalise PP 3rd, Tucker EE, Egan D, et al. Effect of zidovudine and didanoside treatment on heart function in children infected with human immunodeficiency virus. J Pediatr 1995;127:137-46.
- 461. Lewis W. Mitochondrial DNA replication, nucleoside reverse-trancriptase inhibitors, and AIDS cardiomiopathy. Prog Cardiovasc Dis 2003;45:305 18.
- 462. Koehler A, Lewis W. Mitochondrial cardiomyopathy in HIV-1 patients treated with zidovudine. Lab Invest 1995;72:33A.
- 463. Lipschultz SE, Orav EJ, Sanders SP, Colan SD: Immunoglobulins and left ventricular structure and function in pediatric HIV infection. Circulation 1995;92:2220-5.
- 464. Haddad F, Dole R, Murph DJ, Hunt AS. Right ventricular function in cardiovascular disease, part II. Circulation 2008;117:1717-31.
- 465. Chin KM, Nick HS, Rubin LJ. The right ventricle in pulmonary hypertension. Coron Artery Dis 2005;16:13-8.
- 466. McLaughlin VV, Rich S. Pulmonary hypertension. Curr Probl Cardiol 2004;29:575-634.
- 467. Lim SZ, Salmon AP, Vettukatitil JJ, Leldtman GR. Sildenafil therapy for pulmonary a\rtery hypertension associated with atrial septal defect. Int J Cardiol 2007;118:178-82.
- 468. Roeleveld RJ, Vonk-Noordgraaf A, Marcus JJ, Bronzwaer JG, Marques KM, Postmus PE, et al. Effects of epoprostenol on right ventricular hypertrophy and dilatation in pulmonary artery hypertension. Chest 2004;125:572-9.
- 469. Galie N, Hindrliter AL, Torbicki A, Fourmet T, Simonneaux G, Pulido T, et al. Effects of the oral endothelin-receptor antagonist bosentan on echocardiographic and Doppler measures in patients with Pulmonary Arterial Hypertension. J Am Coll Cardiol 2003;41:1380-6.
- 470. Suntharalingam J, Treacy CM, Doughty NJ, Goldsmith K, Soon E, Toshner MR, et Al. Long-term Use of Sildenafil in Inoperable Chronic Thromboembolic Pulmonary Hypertension. Chest 2008;134:229-36.
- 471. Ghio S, Gavazzi A, Campana C, Inserra C, Klersy C, Sebastiani R, et al. Independent and additive prognostic value of right ventricular systolic function and pulmonary artery pressure in patients with chronic heart failure. J Am Coll Cardiol 2001;37:183-8.
- 472. Brieke A, DeNofrio D. Right ventricular dysfunction in chronic dilated cardiomyopathy and heart failure. Coron Art Dis 2005;16:5-11.
- 473. Pengo V, Lensing AW, Prins MH, Marchiori A, Davidson BL, Tiozzo F, et al; Thromboembolic Pulmonary Hypertension Study Group. Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism. N Engl J Med. 2004;350:2257-64.
- 474. Lewis GD, Shah R, Shahzad K, Camuso JM, Pappagianopoulos PP, Hung J, et al. Sildenafil improves exercise capacity and quality of life in patients with systolic heart failure and secondary pulmonary hypertension. Circulation 2007;116:1555-62.
- 475. Behlig A, Rohde LE, Colombo FC, Goldraich LA, Stein R, Clausell N. Effects of 5-phosphodiesterase four-week long inhibition with sildenafil in patients with chronic heart failure: a double-blind, placebo-controlled clinical trial. J Card Fail 2008;14:189-97.
- 476. Sablotzki A, Czesliki E, Shubert S, Friedrich I, Muhling J, Dehne MJ, et al. Iloprost improves hemodynamics in patients with severe chronic cardiac failure and secondary pulmonary hypertension. Can J Anesthesiol 2002;49:1076-80.
- 477. Maruszewiski M, Zacliczynski M, Przyblski R, Czech-Kucewicz E, Zembala M. Use of sildenafil in heart transplant recipients with pulmonary hypertension may prevent right heart failure. Transplant Proc 2007;39:2850-2.
- 478. Zacklicznski M, Maruszewiaski M, Pyka L, Nadziakiewicz P, Przyblski R, Zembala M. Effectiveness and safety of treatment with sildenafil for secondary pulmonary hypertension in heart transplant candidates. Transpl Proc 2007;39:2856-8.
- 479. Jaïs X, D'Armini AM, Jansa P, Torbicki A, Delcroix M, Ghofrani HA, et al. Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension Study Group. Bosentan for treatment of inoperable chronic thromboembolic pulmonary hypertension: BENEFiT, a randomized, placebo-controlled trial. J Am Coll Cardiol 2008;52:2127-34.
- 480. Condliffe R, Kiely DG, Gibbs JS, Corris PA, Peacock AJ, Jenkins DP, et al. Improved outcomes in medically and surgically treated chronic thromboembolic pulmonary hypertension. Am J Respir Crit Care Med. 2008;177:1122-7.
- 481. Mahrholdt H, Wagner A, Deluigi CC, Kispert E, Hager S, Meinhardt G, et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation 2006;114:1581-90.
- 482. Afanasyeva M, Georgakopoulos D, Rose NR. Autoimmune myocarditis: cellular mediators of cardiac dysfunction. Autoimmun Rev 2004;3:476 86.
- 483. Smith SC, Ladenson JH, Mason JW, Jaffe AS. Elevations of cardiac troponin I associated with myocarditis: experimental and clinical correlates. Circulation 1997;95:163-8.
- 484. Gagliard M.G, Polletta B, DiRenzi P. MRI for the diagnosis and follow-up of myocarditis. Circulation 1999;99:458-59.
- 485. Dec GW, Palacios I, Yasuda T, Fallon JT, Khaw BA, Strauss HW, et al. Antimyosin antibody cardiac imaging: its role in the diagnosis of myocarditis. J Am Coll Cardiol 1990;16:97-104.
- 486. Caforio AL, Tona F, Bottaro S, Vinci A, Dequal G, Daliento L, et al. Clinical implications of anti-heart autoantibodies in myocarditis and dilated cardiomyopathy. Autoimmunity 2008; 41:35-45
- 487. Bocchi EA, Kalil R, Bacal F, de Lourdes Higuchi M, Meneghetti C, Magalhães A, et al. Magnetic resonance imaging in chronic Chagas´disease:correlation with endomyocardial biopsy findings and galliul-67 uptake. Echocardiography 1998;15:279-87.
- 488. Kalil Filho R, Bocchi EA, Ferreira BMA, Higuchi ML, Lopes NHM, Magalhães ACA, et al. Imagem por ressonância magnética na cardiopatia da doença de Chagas: correlação com biópsia endomicárdica. Arq Bras Cardiol 1995;65:413-6.
- 489. Calabrese F, Rigo E, Milanesi O, Boffa G, Angelini A, Valente M, et al. Molecular Diagnosis of Myocarditis and Dilated Cardiomyopathy in Children: Clinicopathologic Features and Prognostic Implications. Diagnostic Molecular Pathology 2002;11:212-221.
- 490. Parrillo JE, Cunnion RE, Epstein SE, Parker MM, Suffredini AF, Brenner M, et al. A prospective, randomized, controlled trial of predinisone for dilated cardiomyopathy. N Eng J Med 1989;321:1061 68.
- 491. Mason JW, O'Connell JB, Herskowitz A, Rose NR, McManus BM, Billinghan ME, et al. A clinical trial of immunosuppressive therapy for myocarditis. N Eng J Med 1995;333:269-75.
- 492.Lofiego C, Biagini E, Pasquale F, Ferlito M, Rocchi G, Perugini E, et al. Wide spectrum of presentation and variable outcomes of isolated left ventricular non-compaction. Heart 2007;93:65-71.
- 493. Freudenberger RS, Hellkamp AS, Halperin JL, Poole J, Anderson J, Johnson G, et al. SCD-HeFT Investigators. Risk of thromboembolism in heart failure: an analysis from the Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT). Circulation 2007;115:2637-41.
- 494. Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force For the Diagnosis And Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J 2008;29:2276-315.
- 495. Wells OS, Anderson DR, Rodger M, Ginsberg JS, Kearon C, Gent M et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer. Thromb Haemost 2000;83:416-420.
- 496. Wan S, Quinlan DJ, Agnelli G, Eikelboom JW. Thrombolysis compared with heparin for the initial treatment of pulmonary embolism: a meta-analysis of the randomized controlled trials. Circulation 2004;110:744-49.
- 497. Goldhaber SZ, Haire WD, Feldstein ML, Mller M, Toltzis R, Smith JL, et al. Alteplase versus heparin in acute pulmonary embolism: randomized trial assessing right ventricular funciton and pulmonary perfusion. Lancet 1993;341:507-11.
- 498. Dalla-Volta S, Palla A, Santolicandro A, Giuntini C, Pengo V, Visioli O, et al. PAIMS 2: alteplase combined with heprain versus heparin in the treatment of acute pulmonary embolism. Plasminogen activator Italian multicenter study 2. J Am Coll Cardiol 1992;20:520-26.
- 499. Stevenson LW. Tailored therapy to hemodynamic goals for advanced heart failure. Eur J Heart Fail 1999;1:251-7.
- 500. The ESCAPE Investigators and ESCAPE Study Coordinators. Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness: The ESCAPE Trial. JAMA 2005;294:1625-33.
- 501. Bourge RC, Abraham WT, Adamson PB, Aaron MF, Aranda JM Jr, Magalski A, et al. Randomized controlled trial of an implantable continous hemodynamic monitor in patients with advanced heart failure: The COMPASS-HF Study. J Am Coll Cardiol 2008;51:1073-9.
- 502. Packer M, Abraham WT, Mehra MR, for the Prospective Evaluation and Identification of Cardiac Decompensation by ICG Test (PREDICT) Study Investigators and Coordinators. Utility of impedance cardiography for the identification of short-term risk of clinical decompensation in stable patients with chronic heart failure. J Am Coll Cardiol 2006;47:2245-52.
- 503. Merola B, Cittadini A, Colao A, Longobardi S, Fazio S, Sabatini D, et al. Cardiac estructural and functional abnormalities in adult patients with growth hormone deficiency. J Clin Endocrinol Metab 1993;77:1658-61.
- 504. Cittadini A, Cuocolo A, Merola B, Fazio S, Sabatini D, Nicolai E, et al. Impaired cardiac performance in GH-deficient adults and its improvement after GH replacement. Am J Physiol 1994;267:E219-25.
- 505. Fazio S, Sabatini D, Capaldo B, Vigorito C, Giordano A, Guida R, et al. A preliminary study of growth hormone in the treatment of dilated cardiomyopathy. N Engl J Med 1996;334:809 14.
- 506. Hamilton MA, Stevenson LW. Thyroid hormone abnormalities in heart failure: possibilities for therapy. Thyroid 1996;6:527-9.
- 507. Bocchi EA, Massuda Z, Guilherme G, Carrara D, Bellotti G, Mocelin A, et al. Growth hormone for optimization of refractory heart failure treatment. Arq Bras Cardiol. 1999 73:391-8.
- 508. Bocchi E, Moura L, Guimarães G, Conceição Souza GE, Ramires JA. Beneficial effects of high doses of growth hormone in the introduction and optimization of medical treatment in decompensated congestive heart failure. Int J Cardiol 2006;110:313-7.
- 509. Osterziel KJ, Strohm O, Schuler J, Friedrich M, Hänlein D, Willenbrock R, et al. Randomized, double-blind, placebo-controlled trial of human recombinant growth hormone in patients with chronic heart failure due to dilated cardiomyopathy. Lancet 1998;351:1233-7.
- 510. Isgaard J, Bergh CH, Caidahl K, Lomsky M, Hjalmarson A, Bengtsson BA. A placebo-controlled study of growth hormone in patients with congestive heart failure. Eur Heart J 1998;19:1704-11.
- 511. Rauchhaus M, Coats AJ, Anker SD. The endotoxin-lipoprotein hypothesis. Lancet 2000;356:930-3.
- 512. Landmesser U, Engberding N, Bahlmann FH, Schaefer A, Wiencke A, Heineke A, et al. Statin-induced improvement of endothelial progenitor cell mobilization, myocardial neovascularization, left ventricular function, and survival after experimental myocardial infarction requires endothelial nitric oxide synthase. Circulation 2004;110:1933-9.
- 513. Horwich TB, Hamilton MA, Maclellan WR, Fonarow GC. Low serum total cholesterol is associated with marked increase in mortality in advanced heart failure. J Card Fail 2002;8:216-24.
- 514. Strey CH, Young JM, Molyneux SL, George PM, Florkowski CM, Scott RS, et al. Endothelium-ameliorating effects of statin therapy and coenzyme Q10 reductions in chronic heart failure. Atherosclerosis 2005;179:201-6.
- 515. Wojnicz R, Wilczek K, Nowalany-Kozielska E, SzyguBa-Jurkiewicz B, Nowak J, PoloDski L, et al. Usefulness of atorvastatin in patients with heart failure due to inflammatory dilated cardiomyopathy and elevated cholesterol levels. Am J Cardiol 2006;97:899-904.
- 516. Miname MH, Santos RD, Forti N, Diament J. Are statins beneficial in heart failure? Arq Bras Cardiol 2007;88:e127 131.
- 517. Horwich TB, MacLellan R, Fonarrow GC. Statin therapy is associated with improved survival in ischemic and non-ischemic heart failure. J Am Coll Cardiol 2004;43:642-8.
- 518. Laufs U, Wassmann S, Schackmann S, Heeschen C, Böhm M, Nickenig G. Beneficial effects of statins in patients with non-ischemic heart failure. Z Kardiol 2004;93:103-8.
- 519. Fukuta H, Sane DC, Brucks S, Little WC. Statin therapy may be associated with lower mortality in patients with diastolic heart failure: a preliminary report. Circulation 2005;112:357-63.
- 520. Kjekshus J, Apetrei E, Barrios V, Böhm M, Cleland JG, Cornel JH, et al; for the CORONA Group. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007;357:2248-61.
- 521. Gissi-HF Investigators, Tavazzi L, Maggioni AP, Marchioli R, Barlera S, Franzosi MG, Latini R, et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial.Lancet 2008:372:1231-9.
- 522. Goldsmith SR. Congestive heart failure: potential role of arginine vasopressin antagonists in the therapy of heart failure. Congest Heart Fail 2002;8:251-6.
- 523. Gheorghiade M, Niazi I, Ouyang J, Czerwiec F, Kambayashi J, Zampino M, et al. Vasopressin V2-receptor blockade with tolvaptan in patients with chronic heart failure: results from a double-blind, randomized trial. Circulation 2003;107:2690-6.
- 524. Udelson JE, Smith WB, Hendrix GH, Painchaud CA, Ghazzi M, Thomas I, et al. Acute hemodynamic effects of conivaptan, a dual V(1A) and V(2) vasopressin receptor antagonist, in patients with advanced heart failure. Circulation 2001;104:2417-23.
- 525. Konstam MA, Gheorghiade M, Burniette JC Jr, Grinfeld L, Magioni AP, Swedberg J, et al. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST outcome trial. JAMA 2007;297:1319-31.
- 526. Williams ES; Miller JM. Results from late-breaking clinical trial sessions at the American College of Cardiology 51st Annual Scientific Session. J Am Coll Cardiol 2002;40:1-18.
- 527. Anand I; McMurray J; Cohn JN; Konstam MA; Notter T; Quitzau K; et al. Long-term effects of darusentan on left-ventricular remodelling and clinical outcomes in the Endothelina Receptor Antagonist Trial in Heart Failure (EARTH): randomised, double-blind, placebo-controlled trial. Lancet 2004;364:347-54.
- 528. Gottlieb SS, Brater DC, Thomas I, Havranek E, Bourge R, Goldman S, et al. BG9719 (CVT-124), an A1 adenosine receptor antagonist, protects against the decline in renal function observed with diuretic therapy. Circulation 2002;105:1348-53.
- 529. Riksen NP, Smits P, Rogen GA. Ischaemic preconditioning: from molecular characterisation to clinical application - part I. Neth J Med 2004:62:353 63.
- 530. Fragasso G, Palloshi A, Puccetti P, Silipigni C, Rossodivita A, Pala M, et al. A randomized clinical trial of trimetazidine, a partial free fatty acid oxidation inhibitor, in patients with heart failure. J Am Coll Cardiol 2006;48:992-8.
- 531. El-Kady T, El-Sabban K, Gabaly M, Sabry A, Abdel-Hady S. Effectss of trimetazidine on miocardial perfusion and the contractile response of chronically dysfunctional myocardium in ischemic cardiomyopathy Am J Cardiovasc Drug 2006;5:271-8.
- 532. Pocock S, Wilhelmsen L, Dickstein K, Francis G, Wittes J. The data monitoring experience in the MOXICON trial. Eur Heart J 2004;25:1974-8.
- 533. Torp-Pedersen C, Kober L, Carlsen JE, Akkan D, Bruun NE, Dacoronias D, et al. A randomized trial of a pre-synaptic stimulator of DA2-dopaminergic and alpha2-adrenergic receptors on morbidity and mortality in patients with heart failure. Eur J Heart Fail 2008;10:89-95.
- 534. Lee L, Cambell R, Scheuermann-Freestone M, Taylor R, Gunaruwan P, Williams L, et al. Metabolic modulation with perhexiline in chronic heart failure: a randomized, controlled trial of short-term use of a novel treatment. Circulation 2005;112:3280-8.
- 535. Kang S, Yang Y, Li CJ, Gao R. Effectiveness and tolerability of administration of granulocyte colony-stimulating factor on left ventricular function in patients with myocardial infarction: meta-analysis of randomized controlled trials. Clin Ther 2007;29:2406-18.
- 536. Kurdi M, Booz GW. G-CSF-Based stem cell therapy for heart-unresolved issues part A: paracrine actions, mobilization, and delivery. Congest Heart Fail 2007;13:221-7.
- 537. Bocchi EA, Bacal F, Guimarães G, Mendroni A, Mocelin A, Filho AE, et al. Granulocyte-colony stimulating factor or granulocyte-colony stimulating factor associated to stem cell intracoronary infusion effects in non ischemic refractory heart failure. Int J Cardiol. 2008: [Epub ahead of print]
- 538. Vilas-Boas F, Feitosa GS, Soares MB, Mota A, Pinho-Filho JA, Almeida AJ, et al. Early results of bone marrow cell transplantation to the myocardium of patients with heart failure due to Chagas disease. Arq Bras Cardiol 2006 87:159-66.
- 539. Braile DM, Godoy MF. Stem cell therapy. A new perspective for the treatment of ischemic heart failure. Arq Bras Cardiol 2005;84:5:357-9.
- 540. GISSI-HF Investigators. Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI-HF trial): a randomized double-blind, placebo-controlled trial. Lancet 2008; 372:1223-30.
- 541. Fox K, Ford I, Steg PG, Tendera M, Ferrai R; BEAUTIFUL Investigators. Ivabradine for patients with stable coronary artery disease and left ventricular ystolic dysfunction (BEAUTFUL): a randomized, double-blind, placebo controlled trial. Lancet 2008;372:807-16.
- 542. Torre-Amione G, Anker SD, Bourge RC, Colucci WS, Greenberg BH, Hildebrandt P, et al; Advanced Chronic Heart Failure CLinical Assessment of Immune Modulation Therapy Investigators. Results of a non-specific immunomodulation therapy in chronic heart failure (ACCLAIM trial): a placebo-controlled randomised trial. Lancet 2008;371:228-36.
Datas de Publicação
-
Publicação nesta coleção
21 Out 2010 -
Data do Fascículo
2009