Resumos
FUNDAMENTO: Insuficiência cardíaca (IC) está associada com aumento da quimio-sensibilidade periférica e central em repouso, que pode estar correlacionada com um aumento na resposta ventilatória durante exercício. Entretanto, SUS sensibilidade na IC durante o exercício ainda não foi reportada. OBJETIVO: Testar se o estímulo dos quimiorreceptores centrais e periféricos em pacientes com IC pode modular respostas ventilatórias, cronotrópicas e neurohormonais durante exercício submáximo. MÉTODOS: Investigamos a quimio-sensibilidade central e periférica em 15 pacientes com insuficiência cardíaca (IC) e 7 controles normais (C), comparando a resposta durante 3 testes de caminhada de 6 minutos (TC6M), realizado em esteira ergométrica com: ar ambiente, em hipóxia e em hipercapnia (em ordem randômica). RESULTADOS: FR em ar ambiente nos grupos C e IC foi 17±2 e 22±2 (p<,0001); em hipóxia, foi 17±1 e 23±2 (p<,02); com CO25% foi 20±2 e 22±5 (p<,02). Volume tidal (VT) ou corrente em ar ambiente foi 1,25±0,17 e 1,08±0,19 (p<,01); em hipóxia 1,65±0,34 e 1,2±0,2(p<,0001); com CO25% 1,55±0,46 e 1,29±0,39 (p<,0001). Em repouso, o aumento na IC foi maior para VE (C 33±40%, IC 62±94%, p<,01), FC(C 7±10%, IC 10±10%, p<0,05) em repouso. Durante a hipóxia, o aumento durante o exercício na IC foi maior para FR (C 1±4, IC 11±6,p<,05), FC (C 12±2, IC 14±3, p<,05), VE/VO2 (C -4±18%, IC 24±21%, p<,01), FC/VO2 (C -26±11%, IC 11±5%, p<,01), VE/DC (C 36±10%, 46±14, p<,05% ) and FC/DC (C 18±8%, HF 29±11, p<,01). Durante exercício em hipóxia no grupo IC, o NO diminuiu e os níveis de IL-6 e aldosterona aumentaram. Os níveis neurohormonais permaneceram inalterados no grupo C. CONCLUSÃO: A quimio-sensibilidade central e a periférica durante o exercício estão aumentadas na IC e podem modular padrões respiratórios, cronotrópicos cardíacos e atividade neurohormonal durante exercício.
Insuficiência cardíaca; exercício; cardiomiopatias; óxido nítrico; Norepinefrina
BACKGROUND: Heart failure (HF) is associated with resting increased peripheral and central chemosensitivity which may correlate with an increased ventilatory response to exercise. However, its sensitivity in HF during exercise was never really reported. OBJECTIVE: We tested if stimulation of central and peripheral chemoreceptors in HF patients could modulate ventilatory, chronotropic, and neurohormonal response during submaximal exercise. METHODS: We investigated central and peripheral chemosensitivity in 15 HF and 7 control (C) comparing response through three 6 minute walking tests conducted in a treadmill with : room air, hypoxia, and hypercapnia (in a randomic order). RESULTS: RR at room air C and HF was 17±2 and 22±2 (p<.0001); at hypoxia 17±1 and 23±2 (p<.02); at CO25% was 20±2 and 22±5 (p<.02). Tidal volume (TV) at room air was 1.25±0.17 and 1.08±0.19 (p<.01); at hypoxia 1.65±0.34 and 1.2±0.2 (p<.0001); at CO25% 1.55±0.46 and 1.29±0.39 (p<.0001). At rest the increment in HF was higher for VE (C 33±40%, HF 62±94%, p<.01), HR(C 7±10%, HF 10±10%, p<0.05) at rest. During hypoxia exercise increment in HF was higher for RR (C 1±4, HF 11±6,p<.05), HR (C 12±2, HF 14±3, p<.05), VE/VO2 (C -4±18%, HF 24±21%, p<.01), HR/VO2 (C -26±11%, HF 11±5%, p<.01), VE/WD (C 36±10%, 46±14, p<.05%) and HR/WD (C 18±8%, HF 29±11, p<.01). During HF hypoxia exercise NO reduced, and IL-6, aldosterone levels increased. Neurohormonal levels unchanged in C. CONCLUSION: Exercise peripheral and central chemosensitivity are increased in HF and may modulate respiratory pattern, cardiac chronotropic, and neurohormonal activity during exercise.
Heart failure; exercise; cardiomyopathies; nitric oxide; Norepinephrine
FUNDAMENTO: La insuficiencia cardíaca (IC) está asociada con aumento de la quimiosensibilidad periférica y central en reposo, que puede estar correlacionada con un aumento en la respuesta ventilatoria durante ejercicio. Mientras tanto, SUS sensibilidad en la IC durante el ejercicio aun no fue reportada. OBJETIVO: Verificar si el estímulo de los quimiorreceptores centrales y periféricos en pacientes con IC puede modular respuestas ventilatorias, cronotrópicas y neurohormonales durante ejercicio submáximo. MÉTODOS: Investigamos la quimiosensibilidad central y periférica en 15 pacientes con insuficiencia cardíaca (IC) y 7 controles normales (C), comparando la respuesta durante 3 tests de caminata de 6 minutos (TC6M), realizado en cinta ergométrica con: aire ambiente, en hipoxia y en hipercapnia (en orden randómico). RESULTADOS: FR en aire ambiente en los grupos C y IC fue 17±2 y 22±2 (p<,0001); en hipoxia, fue 17±1 y 23±2 (p<.02); con CO25% fue 20±2 y 22±5 (p<,02). Volumen tidal (VT) o corriente en aire ambiente fue 1,25±0,17 y 1,08±0,19 (p<,01); en hipoxia 1,65±0,34 y 1,2±0,2 (p<,0001); con CO25% 1,55±0,46 y 1,29±0,39 (p<,0001). En reposo, el aumento en la IC fue mayor para VI (C 33±40%, IC 62±94%, p<,01), FC(C 7±10%, IC 10±10%, p<0,05) en reposo. Durante la hipoxia, el aumento durante el ejercicio en la IC fue mayor para FR (C 1±4, IC 11±6, p<.05), FC (C 12±2, IC 14±3, p<.05), VI/VO2 (C -4±18%, IC 24±21%, p<.01), FC/VO2 (C -26±11%, IC 11±5%, p<.01), VI/DC (C 36±10%, 46±14, p<.05%) y FC/DC (C 18±8%, HF 29±11, p<.01). Durante ejercicio en hipoxia en el grupo IC, el NO disminuyó y los niveles de IL-6 y aldosterona aumentaron. Los niveles neurohormonales permanecieron inalterados en el grupo C. CONCLUSIÓN: La quimiosensibilidad central y la periférica durante el ejercicio están aumentadas en la IC y pueden modular estándares respiratorios, cronotrópicos cardíacos y actividad neurohormonal durante ejercicio.
Insuficiencia cardíaca; ejercicio; cardiomiopatías; óxido nítrico; norepinefrina
ARTIGOS ORIGINAIS
INSUFICIÊNCIA CARDÍACA
Quimiossensibilidade durante exercício na insuficiência cardíaca: respostas ventilatórias, cronotrópicas e neurohormonais
Lídia Zytynski Moura; Guilherme Veiga Guimarães; Philippe Vieira Pires; Fátima Cruz; Gabriela Stopa; Edimar Alcides Bocchi
Instituto do Coração do Hospital de Clínicas/FMUSP, São Paulo, SP - Brasil
Correspondência Correspondência: Lídia Zytynski Moura Pres. Taunay, 1091/72 - Bigorrilho - 80430-000 - Curitiba, PR - Brasil E-mail: lidia.zyt@cardiol.br, lidia_zyt@yahoo.com.br
RESUMO
FUNDAMENTO: Insuficiência cardíaca (IC) está associada com aumento da quimio-sensibilidade periférica e central em repouso, que pode estar correlacionada com um aumento na resposta ventilatória durante exercício. Entretanto, SUS sensibilidade na IC durante o exercício ainda não foi reportada.
OBJETIVO: Testar se o estímulo dos quimiorreceptores centrais e periféricos em pacientes com IC pode modular respostas ventilatórias, cronotrópicas e neurohormonais durante exercício submáximo.
MÉTODOS: Investigamos a quimio-sensibilidade central e periférica em 15 pacientes com insuficiência cardíaca (IC) e 7 controles normais (C), comparando a resposta durante 3 testes de caminhada de 6 minutos (TC6M), realizado em esteira ergométrica com: ar ambiente, em hipóxia e em hipercapnia (em ordem randômica).
RESULTADOS: FR em ar ambiente nos grupos C e IC foi 17±2 e 22±2 (p<,0001); em hipóxia, foi 17±1 e 23±2 (p<,02); com CO25% foi 20±2 e 22±5 (p<,02). Volume tidal (VT) ou corrente em ar ambiente foi 1,25±0,17 e 1,08±0,19 (p<,01); em hipóxia 1,65±0,34 e 1,2±0,2(p<,0001); com CO25% 1,55±0,46 e 1,29±0,39 (p<,0001). Em repouso, o aumento na IC foi maior para VE (C 33±40%, IC 62±94%, p<,01), FC(C 7±10%, IC 10±10%, p<0,05) em repouso. Durante a hipóxia, o aumento durante o exercício na IC foi maior para FR (C 1±4, IC 11±6,p<,05), FC (C 12±2, IC 14±3, p<,05), VE/VO2 (C -4±18%, IC 24±21%, p<,01), FC/VO2 (C -26±11%, IC 11±5%, p<,01), VE/DC (C 36±10%, 46±14, p<,05% ) and FC/DC (C 18±8%, HF 29±11, p<,01). Durante exercício em hipóxia no grupo IC, o NO diminuiu e os níveis de IL-6 e aldosterona aumentaram. Os níveis neurohormonais permaneceram inalterados no grupo C.
CONCLUSÃO: A quimio-sensibilidade central e a periférica durante o exercício estão aumentadas na IC e podem modular padrões respiratórios, cronotrópicos cardíacos e atividade neurohormonal durante exercício.
Palavras-chave: Insuficiência cardíaca, exercício, cardiomiopatias, óxido nítrico, Norepinefrina.
Abreviações não-padronizadas
O2% - porcentagem de oxigênio; hipóxia - teste hipóxico isocápnico usando O2% inspirado a 14%; hipercapnia - teste hiperóxico hipercápnico usando CO2 inspirado a 5% e O2 95%; PetCO2 - pressão expiratória final de CO2; FR - frequência respiratória (rpm); VT - volume tidal (ou corrente) (l); VO2 - consumo de O2 (ml/kg); inclinação VE/VCO2 - coeficiente de regressão da regressão linear entre a ventilação e o VCO2; FC - frequência cardíaca (bpm); BNP - peptídeo natriurético tipo B; DC - distância caminhada (milhas); TC6M - teste de caminhada de 6 min; VA - valores absolutos; ICNC - grupo de pacientes com IC que não completou o protocolo de hipóxia; ? - diferença calculada entre o teste de ar ambiente e hipóxia ou hipercapnia.
Introdução
Quimiorreceptores periféricos são considerados como tendo um papel importante na regulação da ventilação durante exercício1. Além disso, os quimiorreceptores centrais exercem influência sobre a ventilação pulmonar, frequência cardíaca, pressão arterial e atividade simpática2.
Muitos estudos tem sugerido a existência de alta quimio-sensibilidade em pacientes com insuficiência cardíaca (IC), com consequente piora na ventilação e alterações nos padrões respiratórios3-5. Entretanto, a grande maioria dos estudos sobre os mecanismos da dispneia e o quimioreflexo foi realizada utilizando a sensibilização com gases de quimiorreceptores em repouso3-6. De fato, poucos estudos foram realizados com sensibilização de quimiorreceptores periféricos por hipóxia durante exercício e apenas em indivíduos saudáveis.
O presente estudo testou a hipótese original de que a estimulação dos quimiorreceptores centrais e periféricos em pacientes com IC poderia modular respostas ventilatórias, cronotrópicas, de óxido nítrico, pressão arterial sistêmica e neurohormonais durante exercício submáximo.
Métodos
Pacientes
Estudamos 22 indivíduos divididos em 2 grupos: Grupo Insuficiência Cardíaca (IC) com 15 pacientes e Grupo Controle (C) com 7 pacientes. Os critérios de inclusão foram classe funcional I ou II (NYHA), pelo menos 21 anos de idade, presença de sintomas e/ou disfunção ventricular por pelo menos 6 meses, tratamento médico otimizado e estado clínico estável por pelo menos 3 meses. Os critérios de exclusão foram cardiomiopatia isquêmica, hipertensão arterial não-controlada, doença pulmonar obstrutiva, diabetes e/ou outras endocrinopatias, marcapasso cardíaco, doenças hepáticas, níveis de creatinina sérica > 2,5 mg/dl, AVC nos últimos seis meses, limitações osteomusculares, caquexia cardíaca, doença valvular primária, cardiomiopatia chagásica, restritiva ou hipertrófica, pericardite constritiva e hipertensão arterial pulmonar primária. O grupo Controle incluiu indivíduos de 21 anos de idade ou mais, clinicamente assintomáticos, sem história de doença cardíaca, sem alterações no exame físico ou exames laboratoriais complementares. Todos os indivíduos deram seu consentimento informado para participar do estudo, que foi aprovado pelo comitê de ética institucional.
Desenho do estudo
O estudo foi prospectivo, randomizado, caso-controlado e cego para os pacientes do grupo IC e indivíduos do grupo C. Antes da inclusão, todos os participantes foram submetidos à avaliação inicial clínica e laboratorial, que incluiu um ecocardiograma transtorácico, cintilografia miocárdica, eletrocardiograma (ECG) e teste cardiopulmonar.
O teste de caminhada de 6 minutos (TC6M)
Medimos a pressão arterial sistólica (PAS) e diastólica (DAP) antes de cada teste de exercício, no último minuto e no 1º minuto da recuperação. O ECG foi monitorado de forma contínua. A ventilação pulmonar e os dados de trocas gasosas foram determinados com base respiração-a-respiração em um sistema computadorizado (modelo Vmax 229 Sensormedics).
O TC6M foi realizado em uma esteira programável sem inclinação com a velocidade programada pelo paciente (Series 2000, Marquette Electronics) pelo menos 2 horas após uma refeição leve e com temperatura ambiente controlada (21°C a 23°C). Os pacientes foram orientados a caminhar de acordo com a escala de Borg, com nível de esforço variando de leve a moderadamente árduo, de 11 to 137. O TC6M associado com a escala de Borg parece ser uma medida precisa das limitações de um grupo com IC e tem sido correlacionado com os esforços diários do individuo8,9.
Protocolo de quimiossensibilização
Pelo protocolo, os três TC6M foram realizados no mesmo dia nas seguintes condições: inalação de ar comprimido (O2 20%) para o teste de ar ambiente, teste hipóxico em hipóxia (O2 14%) e nitrogênio balanceado a 86%, e teste hipercápnico com CO2 5% e O2 95% (para bloquear quimiorreceptores periféricos). Os três testes foram conduzidos em ordem randômica com intervalos de 20 minutos entre eles.
O sistema usado para inalação foi um sistema de ventilação mecânica modelo Smart, marca Takaoka, em modo espontâneo, que foi adaptado através de um cotovelo de borracha anexado à válvula do ergoespirômetro e que recebeu a mistura gasosa. A análise do teste de hipercapnia foi realizada utilizando dados do ventilador respiratório mecânico sem avaliação do gás exalado devido à impossibilidade de avaliar adequadamente o sistema ergoespirométrico na presença de altas concentrações de CO2. Amostras de sangue foram colhidas nas condições basais e no último minuto de exercício. Foram medidos: catecolamina (ensaio cromatográfico)10, BNP (Biosite)11, aldosterona (radioimunoensaio)12, interleucina-6 (kit Immulite IL-6 (DPC))13, e oxido nítrico (NOx, Nitric Oxide Colorimetric Assay Kit, BioVision, Mountain View, CA, EUA).
Análise estatística
As variáveis são expressas como médias ± 1DP. Os dados foram analisados usando o teste de Newman-Keuls pareado. O nível de significância foi estabelecido como p < 0,05.
Para comparar entre o teste de ar ambiente e hipóxia ou hipercapnia, calculamos a diferença ou delta em % (Δ) usando a equação Δ:(((dados de hipóxia ou hipercapnia)-teste de ar ambiente)/teste de ar ambiente))x100.
Resultados
Onze pacientes do grupo IC completaram o protocolo e 4 pacientes não completaram o protocolo de hipóxia (grupo ICNC) (Tabela 1). Todos os indivíduos inspiraram uma fração de oxigênio de aproximadamente 14%, com concomitante redução na saturação da porcentagem de O2 periférico com constante PetCO2 sem a necessidade de suplementação de CO2.
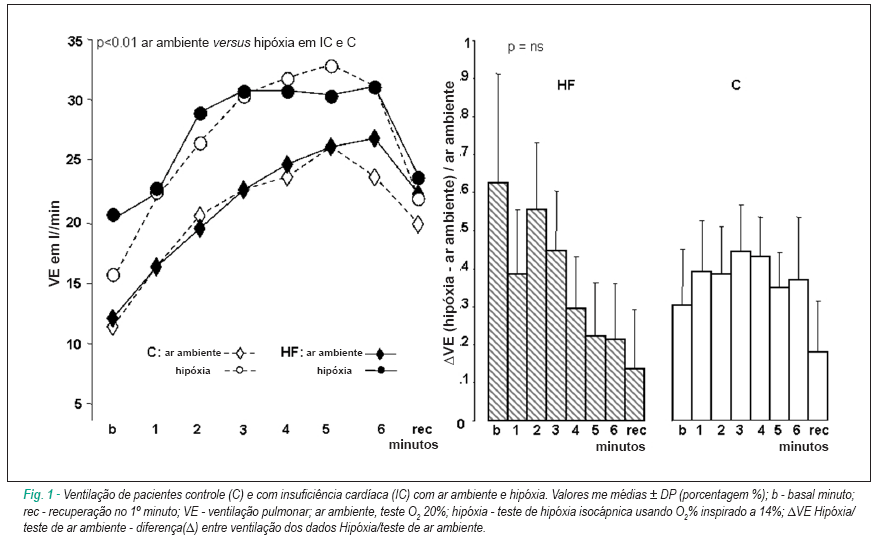
Resposta hipóxica isocápnica em repouso pré-exercício em comparação com o teste de ar ambiente ( Figura 1 )
Em repouso, ambos os grupos aumentaram a ventilação secundária ao aumento na frequência respiratória e volume tidal (corrente). O grupo IC apresentou uma resposta ventilatória aguda, caracterizada pela maior elevação na ventilação. Entretanto, o aumento na frequência respiratória foi maior no grupo C, enquanto o aumento no volume tidal foi maior no grupo IC. O grupo C apresentou aumento da ventilação com maior participação da frequência respiratória do que do volume tidal; entretanto, o grupo IC apresentou aumento da ventilação com igual contribuição do volume tidal e frequência respiratória.
Ambos os grupos demonstraram um declínio pronunciado (p < 0,02) e equivalente no espaço morto estimado. O grupo C apresentou maior elevação no consumo de oxigênio (VO2) do que o grupo IC. O grupo IC apresentou um maior aumento no DFC do que o grupo C. A razão entre a Ventilação/VO2 no grupo IC foi maior durante a hipóxia (5,03 ± 1) do que no teste de ar ambiente (3,13 ± 0,36; p<0,05). O grupo C não apresentou variação significante entre o teste de ar ambiente/hipóxia. A razão entre a FC/VO2 foi igual durante o teste de ar ambiente e hipóxia nos dois grupos.
Teste de exercício hipóxico isocápnico em comparação com o teste de ar ambiente (Tabela 2) (Figuras 1,2, 3)
Ambos os grupos apresentaram um aumento na ventilação durante o exercício. Entretanto, o volume tidal aumentou de forma mais pronunciada no grupo C do que grupo IC, em contraste com a FR, a qual aumentou mais no grupo IC. Ambos os grupos apresentaram um declínio equivalente no espaço morto estimado com concomitante aumento em VO2. Os grupos IC e C apresentaram um aumento mais significante na FC (p<0,006); entretanto, o grupo IC apresentou maior elevação no DFC do que o grupo C.
Ambos os grupos apresentaram os menores valores de pressão arterial (PA) no final do exercício e recuperação e aumento da relação Ventilação/VCO2. A distância caminhada estava reduzida especialmente no grupo IC. O grupo IC também apresentou valores mais altos das razões Ventilação/VO2 e FC/VO2 do que O2 20%. Os participantes do grupo C não apresentaram mudanças significantes na razão Ventilação/VO2 entre eles, enquanto a razão FC/VO2 era maior no teste de ar ambiente. Ambos os grupos apresentaram aumento nas razões Ventilação/distância caminhada e FC/ distância caminhada. Ao comparar o D (teste de ar ambiente/hipóxia) entre os dois grupos, todas as razões eram significantemente mais altas no grupo IC.
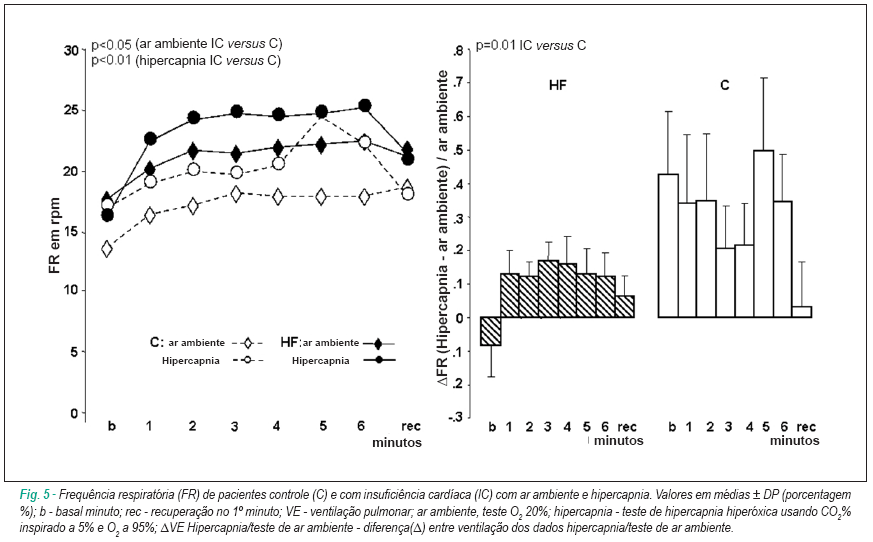
Resposta ao teste hiperóxico hipercápnico (hipercapnia) em repouso em comparação com o teste de ar ambiente
Em hipercapnia, ambos os grupos apresentaram valores menores de Ventilação, o que no grupo C foi devido principalmente ao decréscimo no volume tidal a despeito da alta FR, mas no grupo IC, estava associado à redução no volume tidal e FR.
Resposta ao teste de exercício hiperóxico hipercápnico (hipercapnia) em comparação com o teste de ar ambiente (Figuras 4, 5)
Os grupos IC e C apresentaram maior elevação na Ventilação, sem diferença significante entre eles. Durante o exercício, ambos os grupos aumentaram o ΔFR e Δvolume tidal (p<0,02), sem maior e significante aumento (p<0,01) no grupo C quando comparado ao grupo IC (Figuras 5,6). Nenhum dos dois grupos apresentou alterações significantes na PA e distância caminhada. Ambos os grupos apresentaram um aumento não estatisticamente significante na FC ao exercício. Os grupos IC e C apresentaram uma elevação aguda na FC no primeiro minuto de exercício, que foi maior em resposta à hipóxia. Ambos os grupos apresentaram aumento na relação Ventilação/distância caminhada sem alterações na relação FC/distância caminhada. Ao comparar o D(teste de ar ambiente/hipercapnia) das razões Ventilação/distância caminhada e FC/ distância caminhada, elas eram maiores no grupo IC do que no grupo C.
Marcadores neurohormonais durante hipóxia e hipercapnia em comparação com o teste de ar ambiente
O grupo C não apresentou alterações nos níveis de BNP, aldosterona, IL-6 e oxido nítrico em hipercapnia e hipóxia, mas apresentou uma tendência ao aumento nos níveis de catecolaminas durante a hipóxia (Tabela 3). O grupo IC apresentou um maior aumento nos níveis de catecolaminas e aldosterona no teste de ar ambiente, em comparação ao grupo C. Durante a hipóxia, o grupo IC apresentou um significante decréscimo nos níveis de NO com concomitante elevação nos níveis de IL-6 e aldosterona. No teste de hipercapnia, o grupo IC apresentou aumento nos níveis de catecolamina e NO. O grupo IC também apresentou aumento nos níveis de BNP durante o teste de ar ambiente; entretanto, em hipóxia e hipercapnia, os níveis de BNP apresentaram uma redução, mas nenhuma dessas alterações apresentou significância estatística.
Hipóxia isocápnica - protocolo não concluído
Os sintomas mais comuns associados com a interrupção do protocolo foram dispneia (3), tontura (4), pré-síncope (4) e "escurecimento" da visão (4), mas nenhum necessitou de intervenção mais específica. Um paciente interrompeu o protocolo no primeiro minuto, um no segundo e dois no terceiro minuto do exercício. Ao comparar o grupo IC com o grupo ICNC nos quatro minutos iniciais do protocolo de hipóxia, observamos que o aumento na Ventilação foi maior no grupo ICNC (HFNC 29,8±9,5 l/min versus grupo IC 25,6±5,1 l/min). Em relação ao Δteste de ar ambiente/hipóxia, a Ventilação em repouso do grupo ICNC não diminuiu, mas durante o exercício, apresentou um aumentou importante, similar à resposta ventilatória aguda, seguida por um decréscimo importante. O grupo ICNC apresentou maior FR (ICNC: 23±2,4 i/min versus grupo IC: 21,4±2,23 i/min, p<0,01) e volume tidal (ICNC: 1,33±0,26 l/min e grupo IC:1,14±0,25 l/min p<0,04). O grupo ICNC apresentou maior aumento de VO2 quando comparado ao grupo IC nos três primeiros minutos do exercício, com média de 10,40±5,7 para o grupo ICNC e 8,2±4,3 para o grupo IC (p<0,05), com um pico no 1° minuto seguido de um declínio a um nível menor do que no teste de ar ambiente. O grupo ICNC apresentou de forma geral, uma maior FC (106±15,31) do que o grupo IC (91,47±12,10; p<0,02), e antes da interrupção, apresentaram uma elevação aguda na FC, seguida por um declínio a um nível mais baixo do que no teste de ar ambiente.
Discussão
A quimiossensibilidade central e periférica no exercício está aumentada no grupo IC e pode modular o padrão respiratório, cronotropismo cardíaco e atividade neurohormonal durante o exercício físico. A resposta ventilatória à estimulação dos quimiorreceptores periféricos durante o exercício no grupo IC está associada à exacerbação da alteração no padrão respiratório com um aumento mais proporcional na FR.
Hipóxia isocápnica
Nosso achado de resposta hipóxica bifásica no grupo IC está de acordo com o que tem sido relatado em voluntários sadios em repouso e durante exercício14. A contribuição da exacerbação da FR, pelo nosso conhecimento, não havia ainda sido relatada. Os quimiorreceptores periféricos podem ser mais sensíveis no grupo IC e podem determinar uma resposta anormal no padrão ventilatório no grupo IC5. Alternativamente, a hipóxia poderia ter agravado os mecanismos pulmonares relacionados à resposta da FR durante o exercício no grupo IC, tais como aumento progressivo do espaço morto pulmonar no grupo IC15,16, fadiga dos músculos respiratórios e ação atenuada do ciclo óxido nítrico-L-arginina17. Em desacordo com essa hipótese é que a hipóxia, devido à seu efeito vasodilatador seletivo, pode levar à redistribuição do fluxo sanguíneo pulmonar, melhorando o componente alveolar e o distúrbio ventilação/perfusão. Além disso, a redução do espaço morto estimado durante o exercício, provavelmente devido à melhora no debito cardíaco no grupo IC não foi favorável16. Entretanto, ambos os mecanismos poderiam estar influenciando a resposta ventilatória.
Diferente de alguns autores, em nosso estudo o VO2 na hipóxia aumentou progressivamente, mas essa discrepância pode ser devida à diferentes níveis de hipóxia e exercício (O210-12%)18,19. Uma possibilidade potencial para o aumento do VO2 observado em ambos os grupos é que, provavelmente, o exercício altere a curva de dissociação O2-hemoglobina através da liberação de compostos de fosfato associados ao aumento da liberação de CO2 e produção de ácido pelos músculos.
A elevação na inclinação Ventilação/VCO2 observada está provavelmente associada à modificação primária no padrão respiratório em ambos os grupos (hiperventilação) e menos ao aumento do PCO2 ou espaço morto estimado, como anteriormente descrito durante teste de exercício máximo em ar ambiente em pacientes com IC20-26.
Não encontramos estudos que utilizaram o TC6M concomitantemente à hipóxia, mas apesar da falta de comparação, podemos supor que a redução na distância caminhada observada pode estar relacionada à maior hiperventilação, a qual poderia levar À fadiga do músculo torácico e hipóxia de tecidos. O aumento da FC em repouso, que foi similar em ambos os grupos, confirma que a hipóxia é uma grande estímulo cronotrópico, e que os quimiorreceptores periféricos, quando estimulados, podem modular a FC de repouso no grupo IC apesar dos beta-bloqueadores3-5,15,20,21. Entretanto, a maior resposta cronotrópica é indicativa de maior sensibilidade dos quimiorreceptores periféricos ao exercício no grupo IC durante o exercício.
Hipercapnia hiperóxica
As razões para a redução discordante da Ventilação em repouso em ambos os grupos C e IC em comparação à outros estudos22-24 são desconhecidas; entretanto, uma possível explicação seria que os quimiorreceptores centrais, apesar de serem poderosos estimuladores da Ventilação, são mais lentos do que os quimiorreceptores perifericos3,23, sem grande influência na sensibilização do primeiro minuto. Os resultados do nosso teste de exercício, como outros conduzidos em indivíduos saudáveis com hipercapnia em repouso, mostram um componente ventilatório agudo, provavelmente devido ao estímulo do quimiorreceptor periférico pelo CO225 mais exercício; e um componente lento, especificamente associado ao quimiorreceptor central com grande aumento da amplitude de Ventilação26. Em nosso estudo, como em outros, o estímulo hipercápnico resultou em um aumento importante e global na Ventilação, que foi maior do que o observado durante a hipóxia3. Entretanto, a razão Ventilação/distância caminhada foi maior no grupo IC do que no grupo C, o que sugere maior quimiossensibilização central.
A explicação para o inesperado aumento limitado na FR no grupo IC durante o exercício hipercápnico em comparação ao grupo C, que apresentou uma maior resposta do que o grupo IC, sugere que os quimiorreceptores centrais não tiveram um papel na resposta ventilatória durante o exercício no grupo IC, principalmente quando comparada à resposta obtida com O214%. Como em nossos estudos, outros compararam o efeito do estímulo hipercápnico sobre a FC em indivíduos saudáveis e com IC; entretanto, apenas em repouso, e diferentemente, demonstraram um aumento maior no grupo IC do que no grupo C24. De forma similar ao nosso, outro estudo demonstrou um aumento da FC em hipercapnia, globalmente inferior ao que ocorreu em hipóxia, embora o teste tenha sido realizado em indivíduos saudáveis e em repouso3. Sem descrições anteriores, a resposta cronotrópica aguda observada em nossos resultados em ambos os grupos, imediatamente após o início do exercício, foi mais alta do que o aumento visto nos testes de hipóxia. Alguns fatores possivelmente podem ter influenciado tal fato: a) quimiorreflexo periférico, estimulado pelo CO2; b) inadequado bloqueio da quimiossensibilidade periférica pela hipóxia24,25; c) importante e abrupta ativação simpática sem os efeitos atenuantes do reflexo vagal do estiramento pulmonar, já que ele é pouco estimulado no primeiro minuto de exercício; d) retirada abrupta da atividade parassimpática25.
O aumento atenuado da FC no grupo IC durante o exercício, quando comparado ao grupo C, pode estar relacionado ao estímulo cronotrópico menos importante da hipercapnia, associado com a maior significância da retirada do estímulo vagal parassimpático, junto com o uso de beta-bloqueadores24,25. Entretanto, quando analisamos a razão FC/distância caminhada, ela foi maior no teste de hipercapnia do que no teste de ar ambiente no grupo IC, diferentemente do grupo C, onde a razão foi maior no teste de ar ambiente. Esses resultados sugerem, para o mesmo esforço, uma maior resposta cronotrópica do exercício à quimioestimulação no grupo IC, apesar dos fatores atenuantes descritos acima.
Catecolaminas, BNP, aldosterona, óxido nítrico e interleucina-6
O aumento significante nos níveis de catecolaminas durante o teste de ar ambiente e hipercapnia, mas apenas uma tendência à elevação no teste de hipóxia no grupo IC, sugere que os quimiorreceptores centrais e periféricos podem modular a ativação neurohormonal no grupo IC, embora com maior ativação simpática com estímulo central. Estudos com animais tem sugerido um importante aumento da catecolamina sérica em repouso, com quimiossensibilização usando hipóxia e hipercapnia27. Entretanto, em seres humanos em repouso, os resultados são conflitantes, com alguns autores descrevendo aumento da aumento da noradrenalina sérica, enquanto outros descreveram modificações discretas ou não-existentes durante a hipóxia28.
Nossos dados estão de acordo com as descrições em indivíduos normais, onde há elevação nos níveis de catecolamina sérica durante o exercício com hipóxia, maior do que o aumento observado com a mesma carga de exercício em normóxia29. A tendência à redução nos níveis de BNP durante o exercício em hipóxia e hipercapnia é inesperada em comparação com o aumento no exercício normóxico30 e aumento nos níveis de ANP após hipóxia em repouso em indivíduos saudáveis31. Portanto, a estimulação dos quimiorreceptores periféricos e centrais durante exercício poderiam reduzir os efeitos fisiológicos consequentes da secreção de BNP.
As razões para o aumento da aldosterona durante o exercício hipóxico são desconhecidas; entretanto, esse fato é compatível com outras doenças de base (septicemia, DPOC) ou insuficiência respiratória hipoxêmica32. A diminuição nos níveis de NO durante a hipóxia e o aumento nos níveis de NO durante a teste hipercápnico no grupo IC diverge de nosso resultados em indivíduos saudáveis, similar à literatura, que demonstrou níveis de NO não afetados durante a hipóxia e O2 a 20% durante exercício moderado33. Não encontramos estudos que analisaram níveis de NO e hipóxia em pacientes com IC que nos ajudassem a justificar os níveis reduzidos, mas algumas considerações podem ser feitas: a) a síntese de NO sugere estar reduzida nas condições basais no grupo IC34; b) O2 molecular é um substrato essencial para a síntese de NO e possivelmente limita a produção de NO em condições hipóxicas33; c) NO é um potente vasodilatador sistêmico e pulmonar e sua produção reduzida tem sido associada ao desenvolvimento de hipertensão pulmonar e potencialmente, ao edema pulmonar de altitude35. Não encontramos estudos com hipercapnia e NO em ambos os grupos, mas em um modelo animal a hipercapnia cursou com dilatação de microvasos pulmonares e aumento do níveis de NO, como em nossos resultados no grupo IC. Essa elevação nos níveis de NO poderia estar relacionada a: a) efeito hiperóxico com maior oferta de O 2molecular34, b) efeito hipercápnico primário com níveis séricos mais altos de CO35.
Como descrito anteriormente, observamos em indivíduos saudáveis em repouso um aumento nos níveis de IL-6 com estímulo hipóxico agudo36,37. Como visto em nossos resultados, o grupo IC apresentou maiores níveis basais de IL-638, mas não observamos uma resposta hipóxica em repouso. Não encontramos na literatura outros estudos que analisaram IC e resposta níveis de IL-6 à hipóxia, mas tem sido descrito que o uso de beta-bloqueadores reprime a resposta da IL-6 mesmo em situações patológicas39. Portanto, nossa hipótese é de que em nosso estudo, a resposta da IL-6 em repouso do grupo IC poderia ter sido inibida pela ação do beta-bloqueador, ainda que na presença do estímulo hipóxico. A significância fisiológica da resposta da IL-6 à hipóxia permanece desconhecida, já que a IL-6 não age como mediadora de inflamação ou resposta protéica de fase aguda, pois a IL-1, TNFa e CRP permanecem inalterados. Duas outras possíveis ações tem sido sugeridas como um efeito angiogênico mais um efeito modulatório na produção de eritropoietina37.
Durante o exercício submáximo, ambos os grupos apresentavam níveis elevados de IL-6, com significância estatística apenas no grupo IC. O exercício tem sido descrito como um estressor com o aumento da IL-6, o qual estava relacionado à intensidade do esforço e potencialmente justificado pelos níveis de lactato, estresse de cisalhamento endotelial e lesão muscular, e menos com a produção de catecolaminas37,38. Em nosso estudo, presumimos que, apesar da IL_6 ser reprimida pela ação do beta-bloqueador no grupo IC, quando o estresse do exercício foi adicionado à hipóxia, esse bloqueio foi insuficiente, resultando em um grande aumento nos níveis de IL-637.
Limitações do estudo
O relativo pequeno tamanho da amostra poderia ser uma limitação; entretanto, uma amostra baseada nos resultados relevantes que foram obtidos nesse estudo original com quimiossensibilização durante exercício é aceitável. Os testes de função pulmonar não foram realizados antes da inclusão dos pacientes, mas nenhum paciente apresentava evidência de doença pulmonar ou hábito de fumar no histórico médico, exame clínico, radiografia de tórax e razão Ventilação/VCO2 obtidos durante os testes ergoespirométricos. Os pacientes não tiveram um período de repouso de 3 minutos em hipóxia ou hipercapnia antes do exercício; entretanto, havia preocupação acerca da potencial influência dessa prévia exposição na avaliação da sensibilidade ao quimiorreceptor no exercício e capacidade de exercício.
Os efeitos da hipóxia poderiam em parte ser mediados pela resposta hipertensiva pulmonar; entretanto, nenhuma investigação experimental já provou tal fato em IC e a hipóxia era moderada. A inalação hipóxica e de CO2 poderiam, em teoria, estimular outros receptores; entretanto, é aceito que os principais mecanismos ocorreriam através da ação nos quimiorreceptores centrais e periféricos. As pressões inspiratórias de CO2 e O2 não foram determinadas de forma contínua, mas a frequente monitoração da porcentagem de CO2 e O2 inspirados compensa essa falta de informação.
Um estímulo atenuado do quimiorreflexo periférico pelo CO2 é possível, baseado na rápida resposta ventilatória ao CO2 a despeito do bloqueio da quimiossensibilidade periférica pela hiperóxia. Entretanto, esse desenho é aceito na maioria dos protocolos para estímulo dos quimiorreceptores centrais.
O grupo controle pertencia à uma faixa etária diferente em comparação ao grupo IC; entretanto, os dois grupos eram relativamente jovens e não há informações sobre a influência da idade no quimiorreflexo.
Implicações clínicas
O conhecimento do aumento da quimiossensibilidade durante o exercício pode ter um papel potencial no desenvolvimento de pesquisas sobre intervenções para reduzir essa anormalidade. Além disso, novas estratégias de tratamentos farmacológicos e não-farmacológicos voltados à modulação do quimiorreflexo poderiam, em teoria, beneficiar mais pacientes.
Conclusão
O presente estudo demonstrou o aumento dos quimiorreceptores periféricos e centrais durante o exercício em um grupo de pacientes com IC. A resposta anormal à estimulação dos quimiorreceptores no grupo com IC durante o exercício, caracterizada pela exacerbação de aumento das frequências respiratória e cardíaca, aumento nos níveis de IL-6 e aldosterona, redução nos níveis de NO e BNP, sugere que o quimioreflexo periférico pode modular o padrão das respostas ventilatória, cardíaca, neurohormonal e vasodilatadora no grupo com IC durante o exercício. A resposta anormal à estimulação dos quimiorreceptores centrais no grupo com IC durante o exercício que inclui maior ventilação/distância caminhada, maior frequência cardíaca/distância caminhada, níveis mais elevados de catecolaminas e NO sem aumento nos níveis de BNP sugere que o quimioreflexo central também poderia modular o padrão das respostas ventilatória, cardíaca, neurohormonal e vasodilatadora do grupo com IC durante o exercício.
Potencial Conflito de Interesses
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo foi financiado pela FAPESP.
Vinculação Acadêmica
Este artigo é parte de tese de Doutorado de Lídia Zytynski Moura pelo Instituto do Coração do HCFMUSP.
Artigo recebido em 29/04/09; revisado recebido em 03/10/09; aceito em 23/10/09.
- 1. Ciarka A, Cuylits N, Vachiery JL, Lamotte M, Degaute JP, Naeije R, et al. Increased peripheral chemoreceptors sensitivity and exercise ventilation in heart transplant recipients. Circulation. 2006; 113 (2): 252-7.
- 2. Ainslie PN, Duffin J. - Am J Physiol Regul Integr Comp Physiol. 2009; 296 (5): R1473-95.
- 3. Somers V, Mark A, Zavala D, Abboud F. Contrasting effects of hypoxia and hypercapnia on ventilation and sympathetic activity in humans. J Appl Physiol. 1989; 67 (5): 2095-101.
- 4. Agostoni P, Apostolo A, Albert RK. Mechanisms of periodic breathing during exercise in patients with chronic heart failure. Chest. 2008; 133 (1): 197-203.
- 5. Kara T, Narkiewicz K, Somers VK. Chemoreflexes--physiology and clinical implications. Acta Physiol Scand. 2003; 177 (3): 377-84.
- 6. Arena R, Myers J, Abella J, Pinkstaff S, Brubaker P, Moore B, et al. The partial pressure of resting end-tidal carbon dioxide predicts major cardiac events in patients with systolic heart failure. Am Heart J. 2008; 156 (5): 982-8.
- 7. Bocchi EA, Guimarães G, Mocelin A, Bacal F, Belotti G, Ramires JF. Sildenafil effects on exercise, neurohormal activation, and erectile dysfunction in congestive heart. Circulation. 2002; 106 (9): 1097-103.
- 8. Rubim VS, Drumond Neto C, Romeo JL, Montera MW. Prognostic value of the six-minute walk test in heart failure. Arq Bras Cardiol. 2006; 86 (2): 120-5.
- 9. Guimarães GV, Bellotti G, Bacal F, Michelin A, Bocchi E. Pode o teste ergoespirometrico de caminhada de seis minutos ser representativo das atividades habituais de pacientes com insuficiência cardíaca? Arq Bras Cardiol. 2002; 78 (6): 557-60.
- 10. Hansson C, Agrup G, Rorsman H, Rosengren AM, Rosengren E, Edholm LE. Analysis of cysteinyldopas, dopa, dopamine, noradrenaline and adrenaline in serum and urine using high-performance liquid chromatography and electrochemical detection. J Chromatogr. 1979; 162 (1): 7-22.
- 11. Vogeser M, Jacob K. B-type natriuretic peptide (BNP)--validation of an immediate response assay. Clin Lab. 2001; 47 (1-2): 29-33.
- 12. Walsh PR, Wang MC, Gitterman ML. A simplified radioimmunoassay for plasma aldosterone. Ann Clin Lab Sci. 1981; 11 (2): 138-45.
- 13. Timmons BW, Hamadeh MJ, Tarnopolsky MA. Two methods for determining plasma IL-6 in humans at rest and following exercise. Eur J Appl Physiol. 2009; 105 (1): 13-8.
- 14. Easton PA, Slykerman LJ, Anthonisen NR. Ventilatory response to sustained hypoxia in normal adults. J Appl Physiol. 1986; 61: 906-11.
- 15. Olson LJ, Arruda-Olson AM, Somers VK, Scott CG, Johnson BD. Exercise oscillatory ventilation: instability of breathing control associated with advanced heart failure. Chest. 2008; 133 (2): 474-81.
- 16. Wensel R, Georgiadou P, Franas DP, Bayne S, Scott AC, Genth-Zotz S, et al. Differential contribution of dead space ventilation and low arterial pCO2 to exercise hyperpnea in patients with chronic heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol. 2004; 93 (3): 318-23.
- 17. Bocchi EA, Auler Jr JO, Guimarães GV, Carmona MJ, Wajngarten M, Bellotti G, et al. Nitric oxide inhalation reduces pulmonary tidal volume during exercise in severe chronic heart failure. Am Heart J. 1997; 134 (4): 737-44.
- 18. Fukuoka Y, Endo M, Oishi Y, Ikegami H. Chemoreflex drive and the dynamics of ventilation and gas exchange during exercise at hypoxia. Am J Respir Crit Care Med. 2003; 168 (9): 1115-22.
- 19. Peltonen JE, Tikkanen HO, Rusko HK. Cardiorespiratory responses to exercise in acute hypoxia, hyperoxia and normoxia. Eur J Appl Physiol. 2001; 85 (1-2): 82-8.
- 20. Tanabe Y, Hosaka Y, Ito M, Ito E, Suzuki K. Significance of end-tidal PCO2 response to exercise and its relation to functional capacity inpatients with chronic heart failure. Chest. 2001; 119 (3): 811-7.
- 21. Hopkins SR, Bogaard HJ, Niizeki K, Yamaya Y, Ziegler MG, Wagner PD. Beta-adrenergic or parasympathetic inhibition, heart rate and cardiac output during normoxic and acute hypoxic exercise in humans. J Physiol. 2003; 550 (Pt 2): 605-16.
- 22. Van de Borne P, Montano N, Narkiewicz K, Degaute J, Malliani A, Somers V. Importance of ventilation in modulation interaction between sympathetic drive and cardiovascular variability. Am J Physiol Heart Circ Physiol. 2001; 280 (2): H722-729.
- 23. Duffin J. Measuring the ventilatory response to hypoxia. J Physiol. 2007; 584 (Pt 1): 285-93.
- 24. Narkiewicz K, Pesek C, Van de Borne P, Kato M, Somers V. Enhanced sympathetic and ventilatory responses to central chemoreflex activation in heart failure. Circulation. 1999; 100 (3): 262-7.
- 25. Ogoh S, Ainslie PN, Miyamoto T. Onset responses of ventilation and cerebral blood flow to hypercapnia in humans: rest and exercise. J Appl Physiol. 2009; 106 (3): 880-6.
- 26. Janicki JS, Sheriff DD, Robothan JL, Wise RA. Cardiac output during exercise: contribution of the cardiac, circulatory, and respiratory systems. In: Rowell L, Sheperd JT. (eds). Handbook of physiology. Exercise: regulation and integration of multiple systems. Bethesda: Oxford University Press; 1996.
- 27. Kumar GK, Rai V, Sharma SD, Ramakrishnan DP, Peng YJ, Souvannakitti D, et al. Chronic intermittent hypoxia induces hypoxia-evoked catecholamine efflux in adult rat adrenal medulla via oxidative stress. J Physiol. 2006; 575 (Pt 1): 229-39.
- 28. Gamboa A, Gamboa JL, Holmes C, Sharabi Y, Leon-Velarde F, Fischman GJ, et al. Plasma catecholamines and blood volume in native Andeans during hypoxia and normoxia. Clin Auton Res. 2006; 16 (1): 40-5.
- 29. Leuenberger U. Norephinephrine clearance is increased during acute hypoxia in humans. Am J Physiol. 1991; 261 (5 Pt 2): H1659-H1664.
- 30. Larsen AI, Hall C, Aukrust P, Aarsland T, Faris P, Dickstein K. Prognostic usefulness of an increase of N-terminal proatrial natriuretic peptide during exercise in patients with chronic heart failure. Am J Cardiol. 2003; 92 (1): 91-4.
- 31. Cargill RI, Mcfarlane LC, Coutie WJ, Lipworth BJ. Acute neurohormonal responses to hypoxemia in man. Eur J Appl Physiol Occup Physiol. 1996; 72 (3): 256-60.
- 32. Pedersen BK, Steensberg A. Exercise and hypoxia: effects on leukocytes and interleukin-6-shared mechanisms? Med Sci Sports Exerc. 2002; 34 (12): 2004-13.
- 33. McAllister RM, Newcomer SC, Pope ER, Turk JR, Laughlin MH. Effects of chronic nitric oxide synthase inhibition on responses to acute exercise in swine. J Appl Physiol. 2008; 104 (1): 186-97.
- 34. Ennezat PV, Van Belle E, Asseman P, Cohen-Solal A, Evans T, Lejemtel TH. Steady endothelial nitric oxide synthase expression in heart failure. Acta Cardiol. 2007; 62 (3): 265-8.
- 35. Ide K, Worthley M, Anderson T, Poulin MJ. Effects of the nitric oxide synthase inhibitor L-NMMA on cerebrovascular and cardiovascular responses to hypoxia and hypercapnia in humans. J Physiol. 2007; 584 (Pt 1): 321-32.
- 36. Lundby C, Steensberg A. Interleukin-6 response to exercise during acute and chronic hypoxia. Eur J Appl Physiol. 2004; 91 (1): 88-93.
- 37. Minetto MA, Rainoldi A, Gazzoni M, Ganzit GP, Saba L, Paccotti P. Interleukin-6 response to isokinetic exercise in elite athletes: relationships to adrenocortical function and to mechanical and myoelectric fatigue. Eur J Appl Physiol. 2006; 98 (4): 373-82.
- 38. Plenz G, Song ZF, Tjan TD, Koenig C, Baba HA, Erren M, et al. Activation of the cardiac interleukin-6 system in advanced heart failure. Eur J Heart Fail. 2001; 3 (4): 415-21.
- 39. Maayer B, Holmer S, Hengstenberg C, Lieb W, Pfeifer M, Schunkert H. Functional improvement in HF patients treated with beta-blockers is associated with a decline of cytokine levels. Int J Cardiol. 2005; 18 (2): 182-6.
 Correspondência:
Correspondência: Datas de Publicação
-
Publicação nesta coleção
13 Ago 2010 -
Data do Fascículo
Set 2010
Histórico
-
Revisado
03 Out 2009 -
Recebido
29 Abr 2009 -
Aceito
23 Out 2009