MENSAGEM DOS COORDENADORES
Departamento de Aterosclerose da Sociedade Brasileira de Cardiologia (SBC), acompanhando o amplo cenário de publicações científicas sobre o tratamento das dislipidemias e prevenção da aterosclerose, bem como a importância de seu impacto sobre o risco cardiovascular, e reconhecendo a necessidade de atualização de sua última diretriz, publicada em 2013, em conformidade com as recomendações da SBC, reuniu um comitê de especialistas, da clínica e do laboratório clínico, a partir de janeiro de 2016, para a elaboração deste documento, que ora apresentamos à comunidade médica.
São diversos os ensaios clínicos e metanálises que demonstram, de maneira inequívoca, que o controle das dislipidemias e, em especial, as reduções mais intensivas do Colesterol da Lipoproteína de Baixa Densidade (LDL-c, sigla do inglês low density lipoprotein-cholesterol) têm se associado a importantes benefícios na redução de eventos e mortalidade cardiovasculares. Desta forma, a importância da estratificação do risco individual, a necessidade do tratamento mais eficaz e o alcance da meta terapêutica preconizada devem ser reconhecidos e adotados na boa prática médica. No entanto, reconhecemos a necessidade de estender a estratificação de risco e a definição das metas a pacientes que já se encontrem em tratamento hipolipemiante, e ainda de ampliar a utilização desta diretriz a não especialistas − medidas estas que visam à maior abrangência dos pacientes. Assim, além da proposta de estratificação de risco clássica atualizada, propomos a abordagem do risco cardiovascular também em pacientes sob tratamento hipolipemiante e a utilização de aplicativo para estratificação do risco cardiovascular, definição das metas terapêuticas e sugestão da proposta terapêutica.
Reconhecemos que desafios importantes se colocam como obstáculos ao tratamento otimizado do colesterol. Do diagnóstico correto das dislipidemias ao custo de seu tratamento, ele envolve, sobretudo, a relação médico-paciente, e a inércia terapêutica e a falta de adesão dificultam que a maioria dos pacientes seja contemplada pelos benefícios já comprovados.
É neste panorama que a Atualização da Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose – 2017 pretende se inserir como ferramenta útil e instrumento da prática clínica diária. Nosso objetivo é a uniformização de condutas para que os clínicos e laboratórios tenham segurança em suas ações, respaldados por evidências científicas. Desejamos que as recomendações deste documento repercutam nacionalmente, garantindo o melhor tratamento e os benefícios da redução do risco cardiovascular tanto aos médicos como a seus pacientes.
André Arpad Faludi
Maria Cristina O. Izar
José Francisco Kerr Saraiva
Henrique Tria Bianco
Ana Paula Marte Chacra
Departamento de Aterosclerose Sociedade Brasileira de Cardiologia SBC-DA - Biênio 2016/2017
1. Hierarquia de Evidências
1.1. Evidências Científicas que Impactam na Prática Clínica
As evidências científicas que determinam mudanças na prática clínica devem ser baseadas nos desfechos de saúde-doença, como morte e incidência de doença. Dados de pesquisas que interferem em desfechos substitutos (marcadores fisiopatológicos, bioquímicos etc.) têm menor impacto direto na prática clínica, embora possam ser relevantes para melhor compreensão da doença, e desenvolvimento de metodologias diagnósticas e terapêuticas.
1.2. Hierarquia das evidências
Para situar o leitor sobre a consistência das recomendações desta diretriz, o grau de recomendação e os níveis de evidência foram baseados nos parâmetros descritos no quadro 1.
2. Metabolismo Lipídico
2.1. Aspectos gerais
Dos pontos de vista fisiológico e clínico, os lípides biologicamente mais relevantes são os fosfolípides, o colesterol, os Triglicérides (TG) e os ácidos graxos. Os fosfolípides formam a estrutura básica das membranas celulares. O colesterol é precursor dos hormônios esteroides, dos ácidos biliares e da vitamina D. Além disso, como constituinte das membranas celulares, o colesterol atua na fluidez destas e na ativação de enzimas aí situadas. Os TG são formados a partir de três ácidos graxos ligados a uma molécula de glicerol e constituem uma das formas de armazenamento energético mais importantes no organismo, sendo depositados nos tecidos adiposo e muscular. Os ácidos graxos podem ser classificados como saturados (sem duplas ligações entre seus átomos de carbono), mono ou poli-insaturados, de acordo com o número de ligações duplas em sua cadeia. Os ácidos graxos saturados mais frequentemente presentes em nossa alimentação são: láurico, mirístico, palmítico e esteárico (que variam de 12 a 18 átomos de carbono). Entre os monoinsaturados, o mais frequente é o ácido oleico, que contém 18 átomos de carbono. Quanto aos poli-insaturados, podem ser classificados como ômega 3 (Eicosapentaenoico − EPA, Docosahexaenoico − DHA e linolênico), ou ômega 6 (linoleico), de acordo com presença da primeira dupla ligação entre os carbonos, a partir do grupo hidroxila.
2.2. Lipoproteínas: estrutura e função
As lipoproteínas permitem a solubilização e o transporte dos lípides, que são substâncias geralmente hidrofóbicas, no meio aquoso plasmático. São compostas por lípides e proteínas denominadas Apolipoproteínas (apo). As apos têm diversas funções no metabolismo das lipoproteínas, como a formação intracelular das partículas lipoproteicas, caso das apos B100 e B48, e a atuação como ligantes a receptores de membrana, como as apos B100 e E, ou cofatores enzimáticos, como as apos CII, CIII e AI.
Existem quatro grandes classes de lipoproteínas separadas em dois grupos: (i) as ricas em TG, maiores e menos densas, representadas pelos quilomícrons, de origem intestinal, e pelas Lipoproteínas de Densidade Muito Baixa (VLDL, sigla do inglês very low density lipoprotein), de origem hepática; e (ii) as ricas em colesterol, incluindo as LDL e as de Alta Densidade (HDL, do inglês high density lipoprotein). Existe ainda uma classe de Lipoproteínas de Densidade Intermediária (IDL, do inglês intermediary density lipoprotein) e a Lipoproteína (a) − Lp(a), que resulta da ligação covalente de uma partícula de LDL à Apo (a). A função fisiológica da Lp(a) não é conhecida, mas, em estudos mecanísticos e observacionais, ela tem sido associada à formação e à progressão da placa aterosclerótica.
2.3. Metabolismo das lipoproteínas
2.3.1. Via intestinal
Os TG representam a maior parte das gorduras ingeridas. Após ingestão, as lipases pancreáticas hidrolizam os TG em ácidos graxos livres, monoglicerídeos e diglicerídeos. Sais biliares liberados na luz intestinal emulsificam estes e outros lípides oriundos da dieta e da circulação entero-hepática, com formação de micelas. A solubilização dos lípides sob a forma de micelas facilita sua movimentação através da borda em escova das células intestinais. A proteína Niemann-Pick C1-like 1 (NPC1-L1), parte de um transportador de colesterol intestinal, está situada na membrana apical do enterócito e promove a passagem do colesterol através da borda em escova desta célula, facilitando a absorção intestinal do colesterol.11 Altmann SW, Davis HR Jr, Zhu LJ, Yao X, Hoos LM, Tetzloff G, et al. Niemann-Pick C1 like 1 protein is critical for intestinal cholesterol absorption. Science. 2004;303(5661):1201-4. A inibição da proteína NPC1-L1, com consequente inibição seletiva da absorção intestinal do colesterol, tem sido reconhecida como importante alvo terapêutico no tratamento da hipercolesterolemia.11 Altmann SW, Davis HR Jr, Zhu LJ, Yao X, Hoos LM, Tetzloff G, et al. Niemann-Pick C1 like 1 protein is critical for intestinal cholesterol absorption. Science. 2004;303(5661):1201-4.
Após serem absorvidas pelas células intestinais, as diversas partículas lipídicas, particularmente os ácidos graxos, são utilizadas na produção de quilomícrons, que também contêm ApoB48, o componente amino-terminal da ApoB100. Os quilomícrons são, em seguida, secretados pelas células intestinais para o interior do sistema linfático, de onde alcançam a circulação através do ducto torácico. Enquanto circulam, os quilomícrons sofrem hidrólise pela Lipase Lipoproteica (LPL), uma enzima localizada na superfície endotelial de capilares do tecido adiposo e músculos, com consequente liberação de ácidos graxos e glicerol do core, e de colesterol não esterificado da superfície destas partículas. Após este processo de lipólise, os ácidos graxos são capturados por células musculares e também adipócitos − estes últimos importantes reservatórios de TG elaborados a partir de ácidos graxos. Remanescentes de quilomícrons e ácidos graxos também são capturados pelo fígado, onde são utilizados na formação de VLDL.
2.3.2. Via Hepática
O transporte de lípides de origem hepática ocorre por meio das VLDL, IDL e LDL. As VLDL são lipoproteínas ricas em TG e contêm a ApoB100 como sua Apo principal. As VLDL são montadas e secretadas pelo fígado, sendo liberadas na circulação periférica. A montagem das partículas de VLDL no fígado requer a ação de uma proteína intracelular, a chamada proteína de transferência de TG microssomal (MTP, do inglês microsomal triglyceride transfer protein), responsável pela transferência dos TG para a ApoB, permitindo a formação da VLDL. A montagem hepática da VLDL também tem sido reconhecida como foco terapêutico no tratamento da hipercolesterolemia, seja pela inibição da síntese de Apolipoproteína B 100 (ApoB),22 Raal FJ, Santos RD, Blom DJ, Marais AD, Charng MJ, Cromwell WC, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998-1006. ou pela inibição da MTP.33 Cuchel M, Bloedon LT, Szapary PO, Kolansky DM, Wolfe ML, Sarkis A, et al. Inhibition of microsomal triglyceride transfer protein in familial hypercholesterolemia. N Engl J Med. 2007;356(2):148-56.
Já na circulação, os TG das VLDL, assim como no caso dos quilomícrons, são então hidrolisados pela LPL, enzima estimulada pela ApoC-II e inibida pela ApoC-III. Os ácidos graxos assim liberados são redistribuídos para os tecidos, nos quais podem ser armazenados (como no tecido adiposo), ou prontamente utilizados, como nos músculos esqueléticos. Por ação da LPL, as VLDL, progressivamente depletadas de TG, transformam-se em remanescentes, também removidos pelo fígado por receptores específicos. Uma parte das VLDL dá origem às IDL, que são removidas rapidamente do plasma. O processo de catabolismo continua e inclui a ação da lipase hepática, resultando na formação das LDL.
Durante a hidrólise das VLDL, estas lipoproteínas também estão sujeitas a trocas lipídicas com as HDL e as LDL. Por intermédio da ação da Proteína de Transferência de Ésteres de Colesterol (CETP, do inglês cholesteryl ester transfer protein), as VLDL trocam TG por ésteres de colesterol com as HDL e LDL. A CETP vem sendo testada como alvo terapêutico no tratamento de dislipidemias, em particular no tratamento da HDL baixa, e na redução do risco cardiovascular.44 Tall AR. CETP inhibitors to increase HDL cholesterol levels. N Engl J Med. 2007;356(13):1364-6.
2.3.3. LDL
A LDL tem um conteúdo apenas residual de TG e é composta principalmente de colesterol e uma única apo, a ApoB100. As LDL são capturadas por células hepáticas ou periféricas pelos Receptores de LDL (LDLR). No interior das células, o colesterol livre pode ser esterificado para depósito por ação da enzima Acil-CoA:Colesteril Aciltransferase (ACAT).
A expressão dos LDLR nos hepatócitos é a principal responsável pelo nível de colesterol no sangue e depende da atividade da enzima Hidroximetilglutaril Coenzima A (HMG-CoA) redutase, enzima-chave para a síntese intracelular do colesterol hepático. A inibição da HMG-CoA redutase e, portanto, da síntese intracelular do colesterol é um importante alvo terapêutico no tratamento da hipercolesterolemia. Com a queda do conteúdo intracelular do colesterol, ocorrem o aumento da expressão de LDLR nos hepatócitos e a maior captura de LDL, IDL e VLDL circulantes por estas células.
Recentemente, a identificação e a caracterização da Pró-proteína Convertase Subtilisina/Kexina Tipo 9 (PCSK9) introduziram novos conhecimentos ao metabolismo do colesterol. A PCSK9 é uma protease expressa predominantemente pelo fígado, intestino e rins,55 Horton JD, Cohen JC, Hobbs HH. PCSK9: a convertase that coordinates LDL catabolism. J Lipid Res. 2009;50 Suppl:S172-7. capaz de inibir a reciclagem do LDLR de volta à superfície celular, resultando em menor número de receptores e aumento dos níveis plasmáticos de LDL.66 Steinberg D1, Witztum JL.Inhibition of PCSK9: a powerful weapon for achieving ideal LDL cholesterol levels. Proc Natl Acad Sci USA. 2009;106(24):9546-7. A inibição da PCSK9, outro potencial foco na terapêutica da hipercolesterolemia, bloqueia a degradação do LDLR, com maior capacidade de clearance da LDL circulante.66 Steinberg D1, Witztum JL.Inhibition of PCSK9: a powerful weapon for achieving ideal LDL cholesterol levels. Proc Natl Acad Sci USA. 2009;106(24):9546-7.
2.3.4. HDL
As partículas de HDL são formadas no fígado, no intestino e na circulação. Seu principal conteúdo proteico é representado pelas apos AI e AII. O colesterol livre da HDL, recebido das membranas celulares, é esterificado por ação da Lecitina-Colesterol Aciltransferase (LCAT). A ApoA-I, principal proteína da HDL, é cofator desta enzima. O processo de esterificação do colesterol, que ocorre principalmente nas HDL, é fundamental para sua estabilização e seu transporte no plasma, no centro desta partícula. A HDL transporta o colesterol até o fígado, no qual ela é captada pelos receptores SR-B1.
O circuito de transporte do colesterol dos tecidos periféricos para o fígado é denominado transporte reverso do colesterol. Neste transporte, é importante a ação do complexo ATP-Binding Cassette A1 (ABC-A1) que facilita a extração do colesterol da célula pelas HDL. A HDL também tem outras ações que contribuem para a proteção do leito vascular contra a aterogênese, como a remoção de lípides oxidados da LDL, a inibição da fixação de moléculas de adesão e monócitos ao endotélio, e a estimulação da liberação de óxido nítrico.
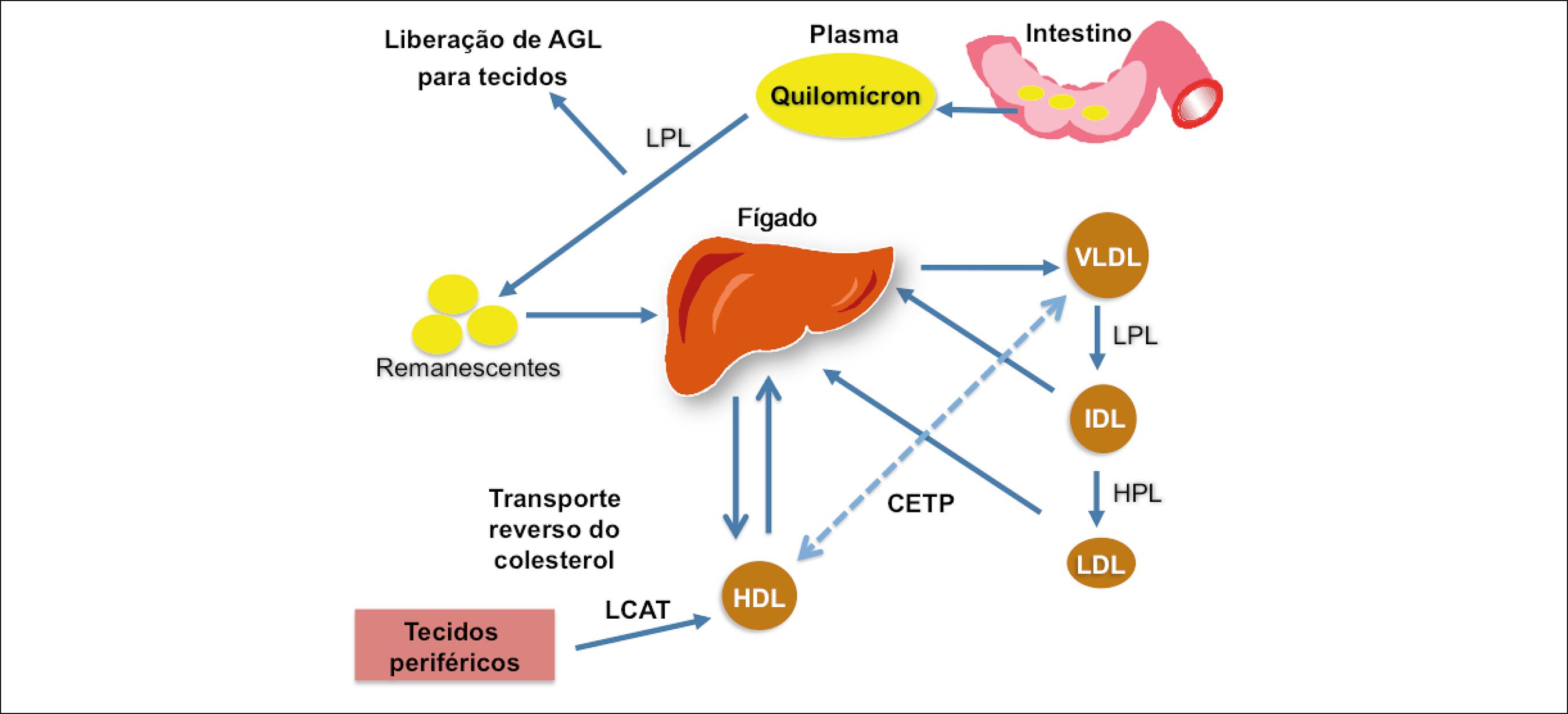
Além das diferenças em tamanho, densidade e composição química, as lipoproteínas podem diferir entre si em relação à modificação in vivo por oxidação, glicação ou dessialização. Estas modificações influenciam em seu papel no metabolismo lipídico e no processo aterogênico. Os ciclos exógeno e endógeno, e o transporte reverso de colesterol são apresentados na Figura 1.
Ciclos de transporte de lípides no plasma. As lipoproteínas participam de três ciclos básicos de transporte de lípides no plasma: (1) ciclo exógeno, no qual as gorduras são absorvidas no intestino e chegam ao plasma, sob a forma de quilomícrons, e, após degradação pela lipase lipoproteica (LPL), ao fígado ou a tecidos periféricos; (2) ciclo endógeno, em que as gorduras do fígado se direcionam aos tecidos periféricos; a lipoproteína de densidade muito baixa (VLDL) é secretada pelo fígado e, por ação da LPL, transforma-se em lipoproteína de densidade intermediária e, posteriormente, em LDL, a qual carrega os lípides, principalmente o colesterol, para os tecidos periféricos; (3) transporte reverso do colesterol, em que as gorduras, principalmente o colesterol dos tecidos, retorna para o fígado; as HDL nascentes captam colesterol não esterificado dos tecidos periféricos pela ação da lecitina-colesterol aciltransferase (LCAT), formando as HDL maduras; por meio da CETP, ocorre também a transferência de ésteres de colesterol da HDL para outras lipoproteínas, como as VLDL. AGL: ácidos graxos livres; HPL: lipase hepática.
2.4. Bases fisiopatológicas das dislipidemias primárias
O acúmulo de quilomícrons e/ou de VLDL no compartimento plasmático resulta em hipertrigliceridemia e decorre da diminuição da hidrólise dos TG destas lipoproteínas pela LPL ou do aumento da síntese de VLDL. Variantes genéticas das enzimas ou Apo relacionadas a estas lipoproteínas podem causar ambas as alterações metabólicas, aumento de síntese ou redução da hidrólise. O acúmulo de lipoproteínas ricas em colesterol, como a LDL no compartimento plasmático, resulta em hipercolesterolemia. Este acúmulo pode se dar por doenças monogênicas, em particular, por defeito no gene do LDLR ou no gene APOB100. Centenas de mutações do LDLR já foram detectadas em portadores de Hipercolesterolemia Familiar (HF), algumas causando redução de sua expressão na membrana, outras, deformações em sua estrutura e função. Mutação no gene que codifica a APOB pode também causar hipercolesterolemia por conta da deficiência no acoplamento da LDL ao receptor celular. Mais comumente a hipercolesterolemia resulta de mutações em múltiplos genes envolvidos no metabolismo lipídico, as hipercolesterolemias poligênicas. Nestes casos, a interação entre fatores genéticos e ambientais determina o fenótipo do perfil lipídico.
3. Aterogênese
A aterosclerose é uma doença inflamatória crônica de origem multifatorial, que ocorre em resposta à agressão endotelial, acometendo principalmente a camada íntima de artérias de médio e grande calibre.77 Ross R. Atherosclerosis--an inflammatory disease. N Engl J Med. 1999;340(2):115-26. Em geral, as lesões iniciais, denominadas estrias gordurosas, formam-se ainda na infância e caracterizam-se por acúmulo de colesterol em macrófagos.88 Berenson GS, Wattigney WA, Tracy RE, Newman WP 3rd, Srinivasan SR, Webber LS, et al. Atherosclerosis of the aorta and coronary arteries and cardiovascular risk factors in persons aged 6 to 30 years and studied at necropsy (The Bogalusa Heart Study). Am J Cardiol. 1992;70(9):851-8. Com o tempo, mecanismos protetores levam ao aumento do tecido matricial, que circunda o núcleo lipídico, mas, na presença de subtipos de linfócitos de fenótipo mais inflamatório, a formação do tecido matricial se reduz, principalmente por inibição de síntese de colágeno pelas células musculares lisas que migraram para íntima vascular e por maior liberação de metaloproteases de matriz, sintetizadas por macrófagos, tornando a placa lipídica vulnerável a complicações.99 Libby P. Mechanisms of acute coronary syndromes and their implications for therapy. N Engl J Med. 2013;368(21):2004-13.
10 Quillard T, Araújo HA, Franck G, Shvartz E, Sukhova G, Libby P. TLR2 and neutrophils potentiate endothelial stress, apoptosis and detachment: implications for superficial erosion. Eur Heart J. 2015;36(22):1394-404.-1111 Ammirati E, Moroni F, Magnoni M, Camici PG. The role of T and B cells in human atherosclerosis and atherothrombosis. Clin Exp Immunol. 2015;179(2):173-87.
A formação da placa aterosclerótica inicia-se com a agressão ao endotélio vascular por diversos fatores de risco, como dislipidemia, hipertensão arterial ou tabagismo. Como consequência, a disfunção endotelial aumenta a permeabilidade da íntima às lipoproteínas plasmáticas, favorecendo a retenção destas no espaço subendotelial. Retidas, as partículas de LDL sofrem oxidação, causando a exposição de diversos neoepítopos, tornando-as imunogênicas. O depósito de lipoproteínas na parede arterial, processo-chave no início da aterogênese, ocorre de maneira proporcional à concentração destas lipoproteínas no plasma. Além do aumento da permeabilidade às lipoproteínas, outra manifestação da disfunção endotelial é o surgimento de moléculas de adesão leucocitária na superfície endotelial, processo estimulado pela presença de LDL oxidada. As moléculas de adesão são responsáveis pela atração de monócitos e linfócitos para a intimidade da parede arterial. Induzidos por proteínas quimiotáticas, os monócitos migram para o espaço subendotelial, no qual se diferenciam em macrófagos, que, por sua vez, captam as LDL oxidadas. Os macrófagos repletos de lípides são chamados de células espumosas e são o principal componente das estrias gordurosas, lesões macroscópicas iniciais da aterosclerose. Uma vez ativados, os macrófagos são, em grande parte, responsáveis pela progressão da placa aterosclerótica por meio da secreção de citocinas, que amplificam a inflamação, e de enzimas proteolíticas, capazes de degradar colágeno e outros componentes teciduais locais.1212 Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005;352(16):1685-95.
Outras células inflamatórias também participam do processo aterosclerótico. Os linfócitos T, embora menos numerosos que os macrófagos no interior do ateroma, são de grande importância na aterogênese. Mediante interação com os macrófagos, as células T podem se diferenciar e produzir citocinas que modulam o processo inflamatório local.1212 Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005;352(16):1685-95. Diversos mecanismos têm sido propostos para a aterogênese e suas complicações, como a oxidação de lipoproteínas (principalmente lipoproteínas de baixa densidade) e a alteração fenotípica do endotélio vascular, produzindo substâncias quimiotáticas de linfócitos, liberando espécies reativas de oxigênio, promovendo vasoconstrição e reduzindo propriedades antitrombóticas.
Recentemente, o comprometimento da resposta imune de linfócitos, diminuindo a produção de anticorpos anti-LDL oxidada, foi associado à aterosclerose e complicações.1111 Ammirati E, Moroni F, Magnoni M, Camici PG. The role of T and B cells in human atherosclerosis and atherothrombosis. Clin Exp Immunol. 2015;179(2):173-87.,1313 Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauernfeind FG, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature 2010;464(7293):1357-61. Erratum in: Nature. 2010;466(7306):652.
14 Tsiantoulas D, Diehl CJ, Witztum JL, Binder CJ. B cells and humoral immunity in atherosclerosis. Circ Res. 2014;114(11):1743-56.-1515 Izar MC, Fonseca HA, Pinheiro LF, Monteiro CM, Póvoa RM, Monteiro AM, et al. Adaptive immunity is related to coronary artery disease severity after acute coronary syndrome in subjects with metabolic syndrome. Diab Vasc Dis Res. 2013;10(1):32-9. A maior gravidade da aterosclerose está relacionada com fatores de risco clássicos, como dislipidemia, diabetes, tabagismo, hipertensão arterial, entre outros, mas, a nível celular, cristais de colesterol, microfilamentos liberados por neutrófilos, isquemia e alterações na pressão de arrasto hemodinâmico têm sido implicados na ativação de complexo inflamatório, que se associa com ruptura da placa aterosclerótica ou erosão endotelial.1616 Ridker PM. From C-reactive protein to interleukin-6 to interleukin-1: moving upstream to identify novel targets for atheroprotection. Circ Res. 2016;118(1):145-56. A partir destas complicações, ocorre interação do fator tecidual da íntima vascular com fator VIIa circulante, levando à geração de trombina, ativação plaquetária e formação do trombo, determinando as principais complicações da aterosclerose, infarto agudo do miocárdio e Acidente Vascular Cerebral (AVC).1717 Coughlin SR. Thrombin signalling and protease-activated receptors. Nature. 2000;407(6801):258-64.,1818 Mackman N. Triggers, targets and treatments for thrombosis. Nature. 2008;451(7181):914-8.
Alguns mediadores da inflamação estimulam a migração e a proliferação das células musculares lisas da camada média arterial. Estas, ao migrarem para a íntima, passam a produzir não só citocinas e fatores de crescimento, como também matriz extracelular, que formará parte da capa fibrosa da placa aterosclerótica. A placa aterosclerótica plenamente desenvolvida é constituída por elementos celulares, componentes da matriz extracelular e núcleo lipídico e necrótico, formado principalmente por debris de células mortas. As placas estáveis caracterizam-se por predomínio de colágeno, organizado em capa fibrosa espessa, escassas células inflamatórias, e núcleo lipídico e necrótico de proporções menores.1919 Libby P, Theroux P. Pathophysiology of coronary artery disease. Circulation. 2005;111(25):3481-8. As instáveis apresentam atividade inflamatória intensa, especialmente em suas bordas laterais, com grande atividade proteolítica, núcleo lipídico e necrótico proeminente, e capa fibrótica tênue.1919 Libby P, Theroux P. Pathophysiology of coronary artery disease. Circulation. 2005;111(25):3481-8. A ruptura desta capa expõe material lipídico altamente trombogênico, levando à formação de um trombo sobrejacente. Este processo, também conhecido por aterotrombose, é um dos principais determinantes das manifestações clínicas da aterosclerose.
4. Avaliação Laboratorial dos Parâmetros Lipídicos e das Apolipoproteínas
4.1. Fases pré-analítica e analítica
Os lípides circulam na corrente sanguínea ligados a proteínas específicas formando complexos denominados lipoproteínas. O conteúdo de proteínas e de lípides nestes complexos faz com que eles assumam características de flutuação em gradientes de densidade específica da mesma forma, possuem mobilidade eletroforética própria e expressões de determinantes antigênicos específicos. Diante destas características, o desenvolvimento da pesquisa permitiu que diversos métodos quantificassem e classificassem estas lipoproteínas.2020 Lusis AJ, Pajukanta P. A treasure trove for lipoprotein biology. Nat Genet. 2008;40(2):129-30.
A acurácia na determinação das lipoproteínas pode ser determinada principalmente por duas fases no processo laboratorial: a fase pré-analítica, relacionada a procedimentos de coleta, preparo da amostra ou a fatores intrínsecos do indivíduo, como estilo de vida, uso de medicações e doenças associadas; e a analítica, relacionada aos métodos e procedimentos utilizados pelos laboratórios.2121 Report from the Laboratory Standardization PaneI of the National Cholesterol Education Program - Recommendations for Improving Cholesterol Measurement. 1993. (NIH Publication N° 93-2964).
4.1.1. Fase pré-analítica
Nesta fase, encontram-se todos os procedimentos realizados antes da amostra do paciente ser processada pelos equipamentos nos laboratórios, com seus respectivos métodos descritos anteriormente.
Variação biológica: as lipoproteínas podem sofrer alterações ao longo do tempo, caracterizadas como variação biológica intraindividual. Estas variações podem ser expressas pelo Coeficiente de Variação (CV). Para Colesterol Total (CT), HDL-c e LDL-c, é cerca de 10% e, para os TG, cerca de 25%.2222 Hegsted DM, Nicolosi RJ. Individual variation in serum cholesterol levels. Proc Natl Acad Sci USA. 1987;84(17):6259-61.
Uso do torniquete na punção venosa: após 1 minuto de torniquete, pode haver hemoconcentração e, com relação ao perfil lipídico, ocorrer aumento de cerca de 5% no CT. Este efeito pode chegar a 10 a 15% com duração superior a 5 minutos. Visando minimizar o "efeito torniquete", este deve ser desfeito tão logo a agulha penetre na veia.2323 Guder WG, Narayanan S, Wisser H, Zawta B. Samples: from the patient to the laboratory. The impact of pre-analytical variables on the quality of laboratory results. 2nd ed. Darmstadt, Germany: Git Verlag GmbH; 2011.
4.1.1.1. Condições de preparo do paciente para a coleta
No preparo do paciente para a realização das dosagens do perfil lipídico, recomenda-se manter o estado metabólico estável e a dieta habitual. O jejum não é necessário para realização do CT, HDL-c e Apolipoproteínas (ApoAI e ApoB), pois o estado pós-prandial não interfere na concentração destas partículas.2424 Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001;285(19):2486-97.,2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20. Alguns países da Europa retiraram a obrigatoriedade do jejum de sua rotina, fato que passou a ser questionado na comunidade médica mundial. Vale ressaltar que o período de jejum de 12 horas não representa nosso estado metabólico normal, pois não ficamos constantemente neste tempo sem nos alimentar. Como já está bem sedimentado na literatura, valores aumentados de triglicerídeos no pós-prandial representam um maior risco para eventos cardiovasculares.2626 Langsted A, Nordestgaard BG. Nonfasting Lipid Profiles: the way of the future. Clin Chem. 2015;61(9):1123-5.
27 Nordestgaard BG, Varbo A. Triglycerides and cardiovascular disease. Lancet. 2014;384(9943):626-35.
28 Langsted A, Freiberg JJ, Nordestgaard BG. Fasting and nonfasting lipid levels: influence of normal food intake on lipids, lipoproteins, apolipoproteins, and cardiovascular risk prediction. Circulation. 2008;118(20):2047-56.-2929 Bansal S, Buring JE, Rifai N, Mora S, Sacks FM, Ridker PM. Fasting compared with nonfasting triglycerides and risk of cardiovascular events in women. JAMA. 2007;298(3):309-16. Alguns autores anteciparam que o fim do jejum para o perfil lipídico seria indicado para a rotina laboratorial.2626 Langsted A, Nordestgaard BG. Nonfasting Lipid Profiles: the way of the future. Clin Chem. 2015;61(9):1123-5.,3030 Rifai N, Young IS, Nordestgaard BG, Wierzbicki AS, Vesper H, Mora S, et al. Nonfasting sample for the determination of routine lipid profile: is it an idea whose time has come? Clin Chem. 2016;62(3):428-35.
Duas publicações em 2016 recomendaram o fim do jejum para o perfil lipídico: o consenso da European Atherosclerosis Society (EAS) e da European Federation of Clinical Chemistry and Laboratory Medicine (EFLM)3131 Nordestgaard BG, Langsted A, Mora S, Kolovou G, Baum H, Bruckert E, et al; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) joint consensus initiative. Fasting is not routinely required for determination of a lipid profile: clinical and laboratory implications including flagging at desirable concentration cut-points-a joint consensus statement from the European Atherosclerosis Society and European Federation of Clinical Chemistry and Laboratory Medicine. Eur. Heart J. 2016,37(25):1944-58. e outra publicação americana.3232 Driver SL, Martin SS, Gluckman TJ, Clary JM, Blumenthal RS, Stone NJ. Fasting or nonfasting lipid measurements. it depends on the question. J Am Coll Cardiol. 2016;67(10):1227-34. Esta quebra de paradigma traz para a rotina o estado metabólico habitual dos pacientes. A concentração de TG sofre um incremento nesta mudança e, como descrito anteriormente, a elevação dos triglicerídeos no estado pós-prandial é indicativa de maior risco cardiovascular. Pacientes idosos, diabéticos, gestantes e crianças devem se beneficiar do fim do jejum, evitando hipoglicemias secundárias ao jejum prolongado.
Os laboratórios devem adequar seus procedimentos, incluindo a flexibilização do tempo de jejum, respeitando sempre a orientação do médico solicitante. O laboratório deve informar no laudo as duas diferentes situações: sem jejum e jejum de 12 horas, de acordo com o critério do médico solicitante. Em algumas situações clínicas específicas, em que a concentração de TG encontra-se muito elevada (> 440 mg/dL) uma nova coleta de amostra para o perfil lipídico deve ser solicitada pelo médico ao paciente com jejum de 12 horas. Estão entre elas a Doença Cardiovascular (DCV) aterosclerótica precoce e a história de hiperlipidemia genética familiar. O médico deve avaliar o resultado do perfil lipídico do paciente, de acordo com a indicação do exame, o estado metabólico e a estratificação de risco.
4.1.2. Fase analítica
Existem vários métodos disponíveis e utilizados na rotina dos laboratórios clínicos, mas alguns ainda são restritos à pesquisa.
A ultracentrifugação é o método de referência para a separação das diferentes lipoproteínas, sendo sua classificação derivada deste método. Ela se baseia na propriedade de flutuação das partículas em relação às suas densidades de equilíbrio em campo gravitacional intenso. Por ultracentrifugação, é possível separar grande parte das lipoproteínas: LDL, IDL, Lp(a), HDL e VLDL, além dos quilomícrons. O método, apesar de todas estas virtudes, não é adequado à rotina laboratorial, por ser muito caro e moroso. Assim, é restrito a protocolos de pesquisa.3333 Chapman MJ, Goldstein S, Lagrange D, Laplaud PM. A density gradient ultracentrifugal procedure for the isolation of the major lipoprotein classes from human serum. Lipid Res. 1981;22(2):339-58.
A espectroscopia por ressonância magnética e a espectrometria de massas com a técnica de MALDI-TOF (Matrix-Assisted Laser Desorption/Ionization Time-of-Flight) são métodos também restritos à pesquisa, que podem ser utilizados para mensuração das lipoproteínas.3434 Otvos JD, Jeyarajah EJ, Bennett DW, Krauss RM. Development of a proton nuclear magnetic resonance spectroscopic method for determining plasma lipoprotein concentrations and subspecies distributions from a single, rapid measurement. Clin Chem. 1992;38(9):1632-8.
35 Serna J, García-Seisdedos D, Alcázar A, Lasunción MÁ, Busto R, Pastor Ó. Quantitative lipidomic analysis of plasma and plasma lipoproteins using MALDI-TOF mass spectrometry. Chem Phys Lipids. 2015;189:7-18.-3636 Warnick GR, McNamara JR, Boggess CN, Clendenen F, Williams PT, Landolt CC. Polyacrylamide gradient gel electrophoresis of lipoprotein subclasses. Clin Lab Med. 2006;26(4):803-46.
A eletroforese se baseia na propriedade das proteínas se tornarem carregadas negativamente quando colocadas em meio com pH superior ao seu ponto isoelétrico, dentro de um campo elétrico. Além da carga das proteínas, o tamanho da partícula interfere na migração. As lipoproteínas HDL, LDL e VLDL e os quilomícrons podem ser separados eletroforeticamente em fitas de acetato de celulose, gel agarose e gel de poliacridamida. Esta separação permite sua análise qualitativa e semiquantitativa. Dependendo da técnica empregada, pode-se conseguir maior resolução técnica, permitindo melhor separação das diferentes lipoproteínas e de suas subfrações. A eletroforese de baixa resolução praticamente não é mais realizada nos laboratórios clínicos, pois não consegue discriminar com precisão as diferentes lipoproteínas, enquanto as eletroforeses de maior resolução conseguem separar diversas frações das lipoproteínas, mas com custo elevado e pouca difusão na prática clínica.3636 Warnick GR, McNamara JR, Boggess CN, Clendenen F, Williams PT, Landolt CC. Polyacrylamide gradient gel electrophoresis of lipoprotein subclasses. Clin Lab Med. 2006;26(4):803-46.
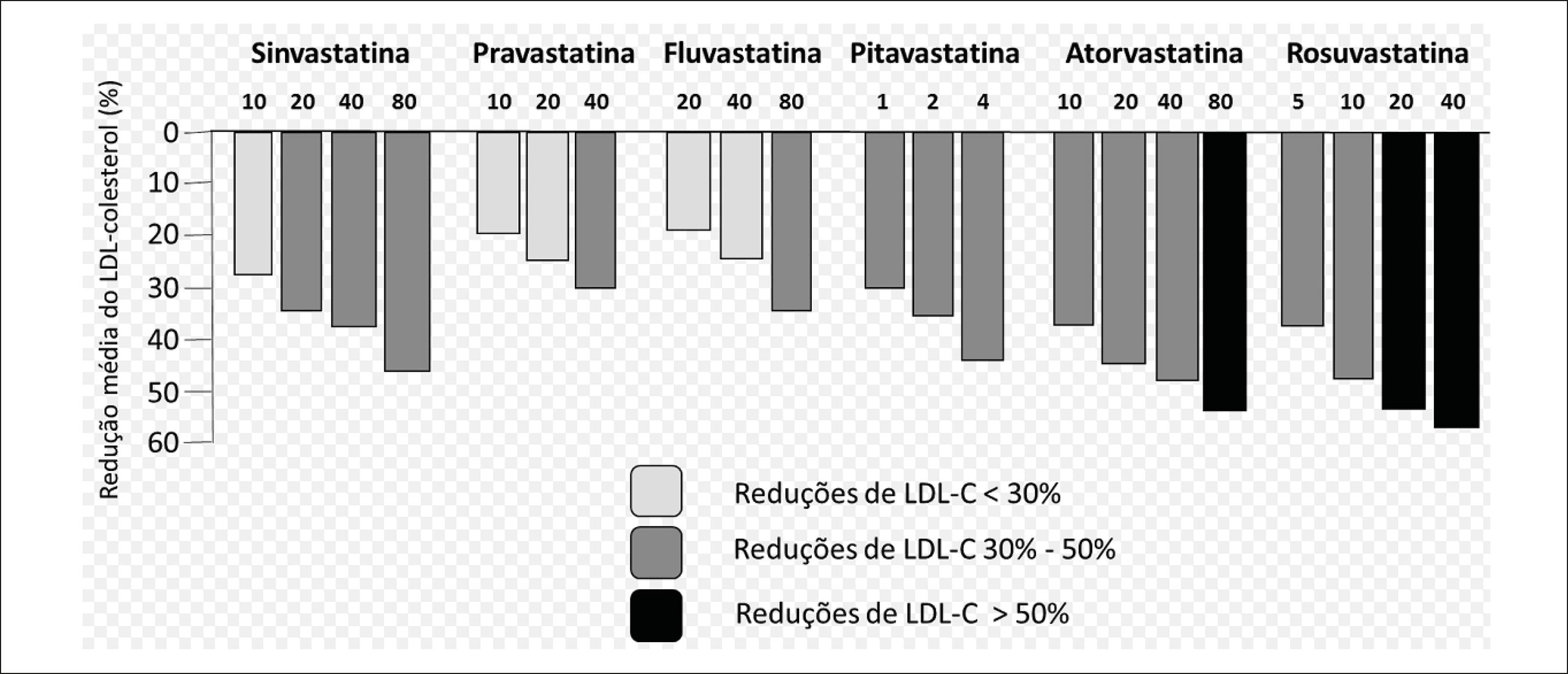
Os métodos enzimáticos colorimétricos são os mais utilizados nos dias de hoje em laboratórios clínicos para a determinação do CT, do HDL-c e dos triglicerídeos. Para o CT e os triglicerídeos, os diversos kits comerciais apresentam boa correlação e baixo CV entre eles, podendo comparar os resultados de diferentes laboratórios em uma mesma amostra. Já para o HDL-c, podem-se encontrar variações de até 15% entre os métodos disponíveis. Estes métodos constituem a melhor opção por apresentarem muito boa sensibilidade e especificidade, simplicidade operacional, baixo custo e possibilidade de automação em laboratórios clínicos. Para o LDL-c, existem duas opções: o cálculo ou a dosagem direta. Ainda hoje, a maior parte dos laboratórios pelo mundo utiliza para o cálculo a fórmula de Friedewald descrita em 1972 e que apresenta muitas limitações em sua utilização. Na fórmula de Friedewald, LDL-c = CT - HDL-c -TG/5, sendo o valor de TG/5 uma estimativa da VLDL-c e todas as concentrações expressas em mg/dL.3737 Friedewald WT, Lavy RI, Fredrickson DS. Estimation to density lipoprotein without use of the preparative ultracentrifuge. Clin Chem. 1972;18(6):499-502. Algumas condições são exigidas para que os resultados sejam confiáveis e possam ser considerados com exatidão adequada. A concentração dos triglicerídeos deve ser menor que 400 mg/dL, e valores acima de 100 mg/dL de TG já começam a subestimar os valores de LDL quando comparados à ultracentrifugação. Outra limitação ao uso da fórmula é que as amostras não devem conter beta-VLDL, característica da hiperlipoproteinemia tipo III. Quando uma ou mais das condições anteriores não são cumpridas, a fórmula não pode ser utilizada.
Recentemente, Martin et al. sugeriram outro método para estimar os valores de LDL-c, utilizando como referência a ultracentrifugação, e, por meio de cálculos estatísticos, definiram diferentes divisores para o valor de TG, que permitem estimar com maior fidedignidade os valores de VLDL-c. Para obter estes divisores depende-se das concentrações do Colesterol Não HDL (não HDL-c) e do TG da amostra do paciente (Tabela 1). Com este novo divisor (x) aplica-se a fórmula: LDL-c = CT - HDL-c - TG/x, onde x varia de 3,1 a 11,9 (Grau de Recomendação: IIa; Nível de Evidência: C).3838 Martin SS, Blaha MJ, Elshazly MB, Toth PP, Kwiterovich PO, Blumenthal RS, et al. Comparison of a novel method vs the Friedewald equation for estimating low-density lipoprotein cholesterol levels from the standard lipid profile. JAMA. 2013;310(19):2061-8.
Valores utilizados para o cálculo do colesterol da lipoproteína de densidade muito baixa e posterior cálculo do colesterol da lipoproteína de baixa densidade
Outra forma de apresentar os valores de LDL-c seria a dosagem direta da fração por meio de ensaios colorimétricos. O principal problema da dosagem direta do LDL-c é a grande variação existente entre os ensaios disponíveis no mercado. Esta variação pode chegar a 30% e ainda não é muito bem entendida na literatura, mas provavelmente isso se deve às diferentes especificidades de cada ensaio por cada subfração da LDL. Esta variação poderia ser uma condição limitante para a utilização ampla da dosagem direta na prática clínica.
A utilização do não HDL-c também serve como parâmentro para avaliação das dislipidemias, que pode ser obtido subtraindo o valor de HDL-c do valor de CT (não HDL-c = CT - HDL-c). Este parâmetro pode ser utilizado na avaliação dos pacientes dislipidêmicos, principalmente naqueles com concentrações de triglicerídeos superiores a 400 mg/dL.3939 Virani SS. Non-HDL cholesterol as a metric of good quality of care: opportunities and challenges. Tex Heart Inst J. 2011;38(2):160-2.
Os métodos de turbidimetria e nefelometria são rotineiramente utilizados para dosagem de grande parte das proteínas plasmáticas e amplamente usados para a dosagem das apolipoproteínas. Estes métodos apresentam boa correlação entre eles e um CV abaixo de 10%.
A acurácia na determinação dos valores do perfil lipídico é fundamental, pois os alvos terapêuticos (valores referenciais) são os mesmos utilizados por todos os laboratórios. O treinamento do pessoal técnico, o processamento dos controles de qualidade e a adequada calibração dos equipamentos automatizados são fundamentais para a manutenção de elevados níveis de precisão e exatidão das dosagens.
4.2. Microtécnica (ponta de dedo)
A utilização da metodologia de punção capilar (POCT, sigla to inglês Point-of-Care Testing) ou Teste Laboratorial Remoto (TLR) na cardiologia tem demonstrado eficácia para investigar as variações dos lípides no sangue. Nas dislipidemias, o início precoce do tratamento farmacológico previne as consequências das DCV e suas intervenções clínicas, especialmente na HF.
O investimento em tecnologia dos equipamentos portáteis tornou-os mais sofisticados e precisos, levando o paciente próximo do local dos testes, principalmente para os tratamentos intensivos e de Atenção Primária à Saúde.4040 Price CP, St John A. Point-of-care testing. In: Curtis C, Ashwood E, Bruns D. Tietz textbook of clinical chemistry and molecular diagnosis. Deutscher Biosensor Symposium, Heilbad Heiligenstadt. Germany, 03-06 April 2011. p. 487-505.
No sistema POCT, é possível quantificar os lípides isoladamente ou o perfil lipídico completo. Estes analisadores portáteis possibilitam avaliar o perfil lipídico em uma única tira reagente, utilizando o sangue total de punção capilar, e o resultado é obtido em poucos minutos. No teste do perfil lipídico, são dosados diretamente o CT, os TG e HDL-c; o LDL-c é calculado pela equação de Friedewald, quando TG < 400 mg/dL. Os valores obtidos permitem estimar o não HDL-c e, como geralmente a coleta é realizada em situação pós-prandial, é importante porque agrega a avaliação de risco para DCV.
É recomendado seguir as normas de coleta de polpa digital, de acordo com as diretrizes nacionais. Para o perfil lipídico é indispensável a limpeza do dedo com o álcool isopropílico 70%, para retirar resíduo de gordura natural ou de cremes cosméticos, e a pipeta calibrada, para transferir a amostra para a tira de teste.
Em geral, os dispositivos TLR podem ter maior variabilidade em relação aos equipamentos encontrados nos laboratórios clínicos. Estas diferenças analíticas podem ser devidas a uma combinação de variações ambientais, como temperatura, umidade, uso de uma amostra de sangue total e treinamento de operadores individuais. O desempenho do sistema TRL é considerado aceitável se o CV estiver nos valores de ± 10% (CT), ± 12% (HDL-c) e ± 15% TG.4141 Diretrizes para gestão e garantia da qualidade de testes laboratoriais remotos (TLR) da Sociedade Brasileira de Patologia Clínica e Medicina Laboratorial (SBPC/ML). 2ª ed. Barueri (SP): Minha Editora; 2016.
Para decidir qual o melhor equipamento POCT a ser utilizado, devem-se verificar a exatidão e a precisão, realizando a validação do equipamento, sempre em comparação com um laboratório clínico acreditado, para verificar a efetividade desta metodologia, rápida e prática.4242 Ferreira CE, França CN, Correr CJ, Zucker ML, Andriolo A, Scartezini M. Clinical correlation between a point-of-care testing system and laboratory automation for lipid profile. Clin Chim Acta. 2015;446:263-6.
Avaliando as alternativas no mercado para implantação do perfil lipídico na plataforma POCT, é vantajoso utilizar o equipamento que possui a análise completa do perfil lipídico, incluindo o HDL-c, viabilizando o cálculo do não HDL-c. Este parâmetro é importante porque permite avaliar as lipoproteínas aterogênicas e o risco de DCV.
Apesar do custo do teste POCT ainda ser relevante, as vantagens para o perfil lipídico neste sistema são várias, como nas situações de triagem da HF, em programas de saúde para avaliação de funcionários nas empresas, quando é necessário obter amostras de comunidades isoladas, em crianças e idosos com dificuldade para a punção venosa e outras ocorrências de risco iminente.
4.3. Variação intraindividual
A variação intraindividual dos lipídios plasmáticos é considerável e importante, principalmente nos pacientes que apresentam valores próximos aos limites de tomada de decisão clínica. Esta variação pode ser de 5 a 10% para o CT e em torno de 20% para os TG − esta última particularmente presente nos indivíduos com hipertrigliceridemia.2222 Hegsted DM, Nicolosi RJ. Individual variation in serum cholesterol levels. Proc Natl Acad Sci USA. 1987;84(17):6259-61.
Pacientes com alterações no perfil lipídico devem ter seus exames confirmados com a coleta de uma nova amostra. Caso ainda persista a variação, o paciente deve ser encaminhado a um serviço especializado para investigação complementar e confirmação diagnóstica.2424 Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001;285(19):2486-97.,2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.
4.4. Valores referenciais do perfil lipídico
Esta atualização sugere que os valores referenciais e de alvo terapêutico do perfil lipídico (adultos > 20 anos) sejam apresentados de acordo com o estado metabólico que antecede a coleta da amostra, sem jejum e com jejum de 12 horas. Assim, os valores referenciais e de alvo terapêutico, obtidos de acordo com a avaliação de risco cardiovascular estimado pelo médico solicitante, são apresentados na tabela 2 e devem constar dos laudos laboratoriais, em todo o território nacional, para que se obtenha uniformidade no tratamento das dislipidemias.2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20. É importante ressaltar que esta atualização sugere ainda a inclusão de um texto observando que valores de CT ≥ 310 mg/dL (para adultos) ou CT ≥ 230 mg/dL (crianças e adolescentes) podem ser indicativos de HF, se excluídas as dislipidemias secundárias.4343 Nordestgaard BG, Chapman MJ, Humphries SE, Ginsberg HN, Masana L, Descamps OS, et al; European Atherosclerosis Society Consensus Panel. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: Consensus Statement of the European Atherosclerosis Society. Eur Heart J. 2013;34(45):3478-90. A HF é a mais comum entre as dislipidemias e seus portadores têm 20 vezes mais risco de morte precoce por DCV.
Valores referenciais e de alvo terapêutico* * Conforme avaliação de risco cardiovascular estimado pelo médico solicitante; do perfil lipídico (adultos > 20 anos)
Como para o LDL-c e o não HDL-c, os valores referenciais variam de acordo com o risco cardiovascular estimado, nesta atualização são sugeridos valores de alvo terapêutico para estas variáveis, de acordo com a categoria de risco. Os parâmetros CT, HDL-c, LDL-c e não HDL-c não sofrem influência do estado alimentar. Para os TG sem jejum o valor desejável é considerado < 175 mg/dL.3131 Nordestgaard BG, Langsted A, Mora S, Kolovou G, Baum H, Bruckert E, et al; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) joint consensus initiative. Fasting is not routinely required for determination of a lipid profile: clinical and laboratory implications including flagging at desirable concentration cut-points-a joint consensus statement from the European Atherosclerosis Society and European Federation of Clinical Chemistry and Laboratory Medicine. Eur. Heart J. 2016,37(25):1944-58.
O laboratório deve informar no laudo o tempo de jejum para as seguintes situações: sem jejum ou com jejum de 12 horas, de acordo com o critério do médico solicitante. Informar no laudo os valores referenciais para TG com e sem jejum.
4.5. Análises do perfil lipídico e apolipoproteínas
4.5.1. Colesterol total
O método de dosagem do CT disponível é enzimático, com boa precisão, sendo a preferência pelo uso de calibradores baseados em soros. A avaliação do CT é recomendada nos programas de rastreamento populacional para mensurar o risco cardiovascular. Porém, para a avaliação adequada do risco cardiovascular é imperativa a análise das frações não HDL-c, HDL-c e LDL-c.2424 Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001;285(19):2486-97.,2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.
Sugerimos a determinação do CT para que o clínico possa utilizar seu valor no cálculo das frações de LDL-c e não HDL-c.
4.5.2. Colesterol da lipoproteína de baixa densidade
O LDL-c pode ser avaliado por metodologia direta (homogênea) ou estimada pela fórmula de Friedewald, que sofre interferência à medida que aumentam os valores de TG, no cálculo da VLDL-c. Com isso o método de Friedewald tende a superestimar a participação da VLDL e a subestimar a da LDL. Esse problema pode ser contornado pela nova fórmula sugerida por Martin et al.3838 Martin SS, Blaha MJ, Elshazly MB, Toth PP, Kwiterovich PO, Blumenthal RS, et al. Comparison of a novel method vs the Friedewald equation for estimating low-density lipoprotein cholesterol levels from the standard lipid profile. JAMA. 2013;310(19):2061-8. (Tabela 1) com o uso de diferentes divisores (x) para o TG, onde x varia de 3,1 a 11,9. Assim, o LDL-c pode ser calculado com valores de TG na amplitude de 7 mg/dL a 13.975 mg/dL, ficando na dependência dos valores do não HDL-c para obter seu respectivo divisor (x).
Existem vários métodos comercialmente disponíveis para determinação direta ou homogênea do LDL-c. Apesar destes métodos terem a vantagem de que a análise é feita em uma única etapa, sem a interferência de altos níveis de TG, ainda persiste um alto grau de variação entre as metodologias disponíveis no mercado.
4.5.3. Colesterol não HDL
O não HDL-c representa a fração do colesterol nas lipoproteínas plasmáticas, exceto a HDL, e é estimado subtraindo-se o valor do HDL-c do CT: não HDL-c = CT- HDL-c.
A utilização do não HDL-c tem a finalidade de estimar a quantidade de lipoproteínas aterogênicas circulantes no plasma, especialmente em indivíduos com TG elevados.3939 Virani SS. Non-HDL cholesterol as a metric of good quality of care: opportunities and challenges. Tex Heart Inst J. 2011;38(2):160-2.
4.5.4. Colesterol da lipoproteína de alta densidade
O método disponível baseia-se na separação da lipoproteína HDL por meio de um agente precipitante, inibidor ou de substâncias que formam um complexo estável. Estas técnicas são de alta eficiência e seus resultados em plataformas automatizadas apresentam menor variabilidade analítica, com excelentes resultados.2424 Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001;285(19):2486-97.,2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.
4.5.5. Triglicérides
A avaliação de TG é determinada por técnica enzimática, e o método é preciso e de baixo custo. Níveis elevados de TG se associam frequentemente a baixos níveis de HDL-c e a altos níveis de partículas de LDL pequenas e densas, mas a grande variabilidade biológica dos TG é a principal fonte de oscilações nos seus resultados.
A análise dos níveis de TG sem jejum prévio fornece informações importantes sobre lipoproteínas remanescentes associadas com risco aumentado de doença coronária.4444 Nordestgaard BG, Benn M, Schnohr P, Tybjaerg-Hansen A. Nonfasting triglycerides and risk of myocardial infarction, ischemic heart disease, and death in men and women. JAMA. 2007;298(3):299-308.
4.5.6. Apolipoproteínas B e A-I
A dosagem da ApoB e da apoA-I pode ser realizada em amostra sem jejum prévio, e os métodos imunoquímicos não sofrem a influência dos níveis de TG moderadamente elevados. O desempenho analítico desta metodologia é bom, e a dosagem pode ser realizada em plataformas automatizadas com perfil de imunoturbidimetria ou nefelometria.4545 Catapano AL, Reiner Z, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; European Society of Cardiology (ESC).; European Atherosclerosis Society (EAS). ESC/EAS guidelines for the management of dyslipidaemias the task force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis. 2011;217(1):3-46.
A ApoB encontra-se nas lipoproteínas aterogênicas VLDL, IDL, LDL e Lp(a) originadas do fígado e nos remanescentes da via exógena do metabolismo, na proporção de uma partícula de ApoB por cada partícula de lipoproteína. Assim, a dosagem da ApoB constitue uma medida indireta de todas as partículas aterogênicas presentes na corrente sanguínea, correspondendo à fração do não HDL-c. Grandes estudos comprovaram a superioridade do não HDL-c e da ApoB em relação à LDL-c na predição do risco cardiovascular.4646 Schaefer EJ, Lamon-Fava S, Ordovas JM, Cohn SD, Schaefer MM, Castelli WP, et al. Effects of age, gender, and menopausal status on plasma low density lipoprotein cholesterol and apolipoprotein B levels in the Framingham Offspring Study. J. Lipid Res. 1994;35(5):779-92.
47 Kastelein JJ, van der Steeg WA, Holme I, Gaffney M, Cater NB, Barter P, et al. TNT Study Group; IDEAL Study Group. Lipids, apolipoproteins, and their ratios in relation to cardiovascular events with statin treatment. Circulation. 2008;117(23):3002-9.
48 Ramjee V, Sperling LS, Jacobson TA. Non-high-density lipoprotein cholesterol versus apolipoprotein B in cardiovascular risk stratification: do the math. J Am Coll Cardiol. 2011;58(5):457-63.
49 Virani SS, Catellier DJ, Pompeii LA, Nambi V, Hoogeveen RC, Wasserman BA, et al. Relation of cholesterol and lipoprotein parameters with carotid artery plaque characteristics: the Atherosclerosis Risk in Communities (ARIC) carotid MRI study. Atherosclerosis. 2011;219(2):596-602.-5050 Expert Dyslipidemia Panel of the International Atherosclerosis Society Panel members. An International Atherosclerosis Society Position Paper. Global recommendations for the management of dyslipidemia-Full report. J Clin Lipidol. 2014;8(1):29-60. Entretanto, a ApoB não se mostrou superior ao não HDL-c em diversos grandes estudos,5151 Di Angelantonio E, Sarwar N, Perry P, Kaptoge S, Ray KK, Thompson A, et al; Emerging Risk Factors Collaboration, Major lipids, apolipoproteins, and risk of vascular disease. JAMA. 2009;302(18):1993-2000.,5252 Parish S, Offer A, Clarke R, Hopewell JC, Hill MR, Otvos JD, Armitage J, et al; Heart Protection Study Collaborative Group. Lipids and lipoproteins and risk of different vascular events in the MRC/BHF Heart Protection Study. Circulation. 2012;125(20):2469-78. exceto em uma grande metanálise comparativa entre ApoB, não HDL-c e LDL-c, que concluiu ser a ApoB o mais potente preditor de risco, o LDL-c com a menor potência e o não HDL-c como de robustez intermediária.5353 Sniderman AD, Williams K, Contois JH, Monroe HM, McQueen MJ, de Graaf J, et al. A meta-analysis of low-density lipoprotein cholesterol, non-high-density lipoprotein cholesterol, and apolipoprotein B as markers of cardiovascular risk. Circ Cardiovasc Qual Outcomes. 2011;4(3):337-45. Considerando a falta de um consenso na atualidade sobre a relevância clínica do uso da ApoB como preditor de risco cardiovascular e o custo adicional que representa em relação à fração não HDL-c (gratuitamente implícita no perfil lipidico de rotina), surge uma natural limitação de seu uso na prática clínica. Em conclusão, a dosagem de rotina da ApoB não é recomendada na avaliação ou estratificação do risco cardiovascular (Grau de Recomendação: IIa; Nível de Evidência: A). Concentrações de ApoB de 120 mg/dL equivalem ao não HDL-c de 160 mg/dL e de ApoB de 80 mg/dL correspondem ao não HDL-c de 100 mg/dL.5353 Sniderman AD, Williams K, Contois JH, Monroe HM, McQueen MJ, de Graaf J, et al. A meta-analysis of low-density lipoprotein cholesterol, non-high-density lipoprotein cholesterol, and apolipoprotein B as markers of cardiovascular risk. Circ Cardiovasc Qual Outcomes. 2011;4(3):337-45.
A ApoA-I é a principal apoproteína da HDL e fornece uma boa estimativa da concentração de HDL-c. Cada partícula de HDL pode transportar várias moléculas de ApoA-I. Concentrações plasmáticas de ApoA-I < 120 mg/dL para homens e < 140 mg/dL para mulheres correspondem aproximadamente às que são consideradas baixas concentrações de HDL-c. De modo semelhante ao desempenho da ApoB, a utilização da dosagem da ApoA-I não mostrou superioridade à dosagem do HDL-c na previsão do risco cardiovascular. Diversos estudos prospectivos analisaram a relação entre a ApoB e ApoA-I (indicadora do balanço aterogênico no plasma), mas não se mostraram efetivas na melhora da estratificação do risco.5151 Di Angelantonio E, Sarwar N, Perry P, Kaptoge S, Ray KK, Thompson A, et al; Emerging Risk Factors Collaboration, Major lipids, apolipoproteins, and risk of vascular disease. JAMA. 2009;302(18):1993-2000.
4.5.7. Lipoproteína (a)
A Lp(a) é uma partícula de LDL com uma Apo adicional, a Apo (a), ligada à ApoB. A Apo (a) é composta de estruturas peptídicas chamadas kringles. As concentrações plasmáticas de Lp(a) são, em grande parte, determinadas geneticamente. Um dos principais determinantes genéticos para as concentrações de Lp(a) são os polimorfismos, que determinam o tamanho do Kringle IV Tipo 2 (KIV-2), sendo que, quanto maior o número de repetições do KIV-2, maior o tamanho da Lp(a), porém, com uma associação inversa com suas concentrações plasmáticas. Isto porque as isoformas maiores são capturadas e degradadas pelo fígado, enquanto as isoformas menores permanecem em circulação,5454 Nordestgaard BG, Chapman MJ, Ray K, Borén J, Andreotti F, Watts GF, et al. European Atherosclerosis Society Consensus Panel. Lipoprotein(a) as cardiovascular risk factor: current status. Eur Heart J. 2010;31(23):2844-53. podendo ser quantificadas.
Existem evidências robustas de associação independente entre elevações de Lp(a) e risco de DCV na população geral.5454 Nordestgaard BG, Chapman MJ, Ray K, Borén J, Andreotti F, Watts GF, et al. European Atherosclerosis Society Consensus Panel. Lipoprotein(a) as cardiovascular risk factor: current status. Eur Heart J. 2010;31(23):2844-53. Esta associação existe não apenas pelo conteúdo lipídico da Lp(a), mas também por suas propriedades pró-trombóticas e pró-inflamatórias. Para quantificação de suas concentrações plasmáticas, o padrão-ouro é a dosagem de Apo (a) massa por turbidimetria, nefelometria ou quimiluminesência, utilizando ensaios isoforma-insensitivos, que são pouco afetados pela heterogeneidade nas isoformas da Apo (a). Ele dispensa o jejum e fornece dados acurados.
Em levantamentos de diferentes grupos étnicos e populacionais, que avaliaram a Lp(a) como preditora de risco de DCV, os valores de corte arbitrados variaram em uma ampla faixa. O estudo de Copenhagen estabeleceu como valor elevado de Lp(a) acima de 50 mg/dL, equivalente ao percentil 80,5454 Nordestgaard BG, Chapman MJ, Ray K, Borén J, Andreotti F, Watts GF, et al. European Atherosclerosis Society Consensus Panel. Lipoprotein(a) as cardiovascular risk factor: current status. Eur Heart J. 2010;31(23):2844-53. o que também foi recomendado pelo painel de consenso da EAS. Quando o resultado for em nmol/L, deve-se multiplicar o resultado por 2,5, sendo considerados elevados valores de Lp(a) superiores a 125 nmol/L.
Sua análise não é recomendada de rotina para avaliação do risco de DCV na população geral, mas sua determinação deve ser considerada na estratificação de risco em indivíduos com história familiar de doença aterosclerótica de caráter prematuro e na HF.
4.6. Tamanho das partículas de lipoproteínas
Existe considerável heterogeneidade no tamanho das partículas de LDL, cuja densidade pode variar entre 1,019 a 1,063 g/L,5555 Fisher WR, Hammond MG, Warmke GL. Measurements of the molecular weight variability of plasma low density lipoproteins among normals and subjects with hyper-lipoproteinemia: demonstration of macromolecular heterogeneity. Biochemistry. 1972;11(4):519-25. particularmente em pacientes com hiperlipidemia mista, quando comparados a portadores de HF isolada. As partículas de LDL pequenas e densas coexistem com níveis elevados de TG, sendo consideradas mais aterogênicas do que LDL maiores e boiantes, que predominam em concentrações mais baixas de TG.5656 Kathiresan S, Otvos JD, Sullivan LM, Keyes MJ, Schaefer EJ, Wilson PW, et al. Increased small low-density lipoprotein particle number: a prominent feature of the metabolic syndrome in the Framingham Heart Study. Circulation. 2006;113(1):20-9.,5757 Cromwell WC, Otvos JD. Heterogeneity of low-density lipoprotein particle number in patients with type 2 diabetes mellitus and low-density lipoprotein cholesterol <100 mg/dl. Am J Cardiol. 2006;98(12):1599-602. Apesar da possível maior aterogenicidade das partículas LDL pequenas e densas, alguns estudos têm mostrado que o tamanho da partícula de LDL por si só pode não se associar com o risco futuro de eventos cardiovasculares, quando se leva em conta o aumento da concentração do total de partículas de LDL presente nestas situações.5858 Kuller L, Arnold A, Tracy R, Otvos J, Burke G, Psaty B, et al. Nuclear magnetic resonance spectroscopy of lipoproteins and risk of coronary heart disease in the Cardiovascular Health Study. Arterioscler Thromb Vasc Biol 2002;22(7):1175-80.,5959 Mora S, Szklo M, Otvos JD, Greenland P, Psaty BM, Goff DC Jr, et al. LDL particle subclasses, LDL particle size, and carotid atherosclerosis in the Multi-Ethnic Study of Atherosclerosis (MESA). Atherosclerosis. 2007;192(1):211-7.
A quantificação da fração de partículas LDL pequenas e densas , geralmente limitada a técnicas complexas, mais recentemente passou a contar com um método de ensaio simples e inovador,6060 Ito Y, Fujimura M, Ohta M, Hirano T. Development of a homogeneous assay for measurement of small dense LDL cholesterol. Clin Chem. 2011;57(1):57-65. utilizado no estudo ARIC (Atherosclerosis Risk in Communities), que revelou incidência de Doença Arterial Coronariana (DAC) associada à fração de partículas LDL pequenas e densas em indivíduos de menor risco com LDL-c < 100 mg/dL.6161 Tsai MY, Steffen BT, Guan W, McClelland RL, Warnick R, McConnell J, et al. New automated assay of small dense low-density lipoprotein cholesterol identifies risk of coronary heart disease: the Multi-ethnic Study of Atherosclerosis. Arterioscler Thromb Vasc Biol. 2014;34(1):196-201.,6262 Hoogeveen RC, Gaubatz JW, Sun W, Dodge RC, Crosby JR, Jiang J, et al. Small dense low-density lipoprotein-cholesterol concentrations predict risk for coronary heart Disease: The Atherosclerosis Risk in Communities (ARIC) Study. Arterioscler Thromb Vasc Biol. 2014;34(5):1069-77. De modo semelhante ao considerado com relação às apo, não existem evidências atuais para a prática clínica custo-efetiva, que justifiquem a determinação laboratorial do tamanho das partículas de lipoproteínas (particularmente das partículas LDL pequenas e densas) ou da quantificação de seu número presente no plasma. Diretrizes futuras podem examinar o quanto a inclusão destes parâmetros pode ser útil na melhora da predição do risco cardiovascular.
4.7. Genotipagem em hipercolesterolemia familiar
A HF, uma das doenças monogênicas mais comuns, foi descrita como doença de herança autossômica dominante,6363 Khachadurian AK. The inheritance of essential familial hypercholesterolemia. Am J Med. 1964;37:402-7. sendo caracterizada pela elevação do CT e do LDL-c. O defeito mais frequente na HF é uma mutação no gene específico do receptor para LDL plasmático. Localizado na superfície das células hepáticas e de outros órgãos, o receptor liga-se à LDL via ApoB e facilita sua captação, realizada por um mecanismo de internalização e endocitose do complexo LDL/ApoB/LDLR − processo este mediado pela proteína adaptadora do receptor de LDL Tipo 1 (LDLRAP1) presente nas depressões revestidas com clatrina (clathrin-coated pits). Após internalização, a partícula LDL e o LDLR separam-se no endossomo, sendo que o LDLR pode sofrer degradação lisossomal facilitada pela PCSK9 ou ser transferido de volta à superfície da célula, sendo o colesterol liberado na célula para uso metabólico. Alternativamente, o LDLR pode ser degradado via ligação do PCSK9 exógeno ao LDLR na superfície celular, na qual é internalizado e processado para degradação lisossomal.6464 Abifadel M, Varret M, Rabès JP, Allard D, Ouguerram K, Devillers M, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003;34(2):154-6. Quando os LDLR possuem alguma mutação que altere sua estrutura ou função, o nível de remoção de LDL do plasma diminui, e o nível plasmático de LDL aumenta em proporção inversa ao número de receptores funcionais presentes.6565 Seidah NG, Awan Z, Chrétien M, Mbikay M. PCSK9: a key modulator of cardiovascular health. Circ Res. 2014;114(6):1022-36.
A HF pode ser causada principalmente por mutações em qualquer um dos genes desta via. A maior frequência de mutações se situa no gene que codifica o receptor da LDL, mas também são encontradas mutações nos genes codificadores da ApoB e da PCSK9.6464 Abifadel M, Varret M, Rabès JP, Allard D, Ouguerram K, Devillers M, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003;34(2):154-6.,6565 Seidah NG, Awan Z, Chrétien M, Mbikay M. PCSK9: a key modulator of cardiovascular health. Circ Res. 2014;114(6):1022-36. Variantes genéticas, que levem a uma menor produção de uma destas proteínas ou mesmo a proteínas com menor atividade biológica, têm como consequência um clearance menor das partículas de LDL e resultam em hipercolesterolemia. A penetrância para HF depende do gene mutado, chegando a ser de 90% em variantes patogênicas mesmo em heterozigose nos genes LDLR e ApoB e em algumas mutações no gene PCSK9.6666 Civeira F; International Panel on Management of Familial Hypercholesterolemia. Guidelines for the diagnosis and management of heterozygous familial hypercholesterolemia. Atherosclerosis. 2004;173(1):55-68.
Pesquisas recentes sugerem um efeito aditivo de mutações únicas em diferentes genes componentes da via do LDLR, que, combinadas, podem levar a um fenótipo intermediário entre indivíduos com mutações em heterozigose e homozigose para a HF.6767 Tada H, Kawashiri M, Ohtani R, Noguchi T, Nakanishi C, Konno T, et al. A novel type of familial hypercholesterolemia: double heterozygous mutations in LDL receptor and LDL receptor adaptor protein 1 gene. Atherosclerosis. 2011;219(2):663-6.
68 Benlian P, de Gennes J, Dairou F, Hermelin B, Ginon I, Villain E, et al. Phenotypic expression in double heterozygotes for familial hypercholesterolemia and familial defective apolipoprotein B-100. Hum Mutat. 1996;7(4):340-5.-6969 Cuchel M, Bruckert E, Ginsberg H, Raal FJ, Santos RD, Hegele RA, et al; European Atherosclerosis Society Consensus Panel on Familial Hypercholesterolaemia. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J. 2014;35(32):2146-57. Apesar disto, níveis normais de colesterol já foram descritos em indivíduos portadores de variantes patogênicas, em cujas famílias já foram detectados pacientes afetados.7070 Garcia-Garcia A, Ivorra C, Martinez-Hervas S, Blesa S, Fuentes MJ, Puig O, et al. Reduced penetrance of autosomal dominant hypercholesterolemia in a high percentage of families: importance of genetic testing in the entire family. Atherosclerosis. 2011;218(2):423-30. Estes achados evidenciam a importância de se realizar o teste genético familiar e de se conhecer melhor o impacto de cada mutação no espectro da HF.
O gene que codifica o receptor humano para LDL compreende aproximadamente 45 mil pares de bases de DNA e localiza-se no cromossomo 19, sendo formado por 18 éxons e 17 íntrons. O LDLR é uma proteína composta de 839 aminoácidos, incluindo um peptídeo sinal de 21 aminoácidos, contendo vários domínios funcionais.
A análise das mutações descritas no gene LDLR demonstra que não existem regiões principais na sequência do gene (hot spots) para o aparecimento de alterações.7171 Soutar AK, Naoumova RP. Mechanisms of disease: genetic causes of familial hypercholesterolemia. Nat Clin Pract Cardiovasc Med. 2007;4(4):214-25.,7272 Usifo E, Leigh S, Whittall R, Lench N, Taylor A, Yeats C, et al. Low-density lipoprotein receptor gene familial hypercholesterolemia variant database: update and pathological assessment. Ann Hum Genet. 2012;76(5):387-401. Apesar disto, mutações no éxon 4, responsável pela ligação à LDL via ApoB, parecem estar correlacionadas a fenótipos mais graves da doença.7373 Gudnason V, Day I, Humphries S. Effect on plasma lipid levels of different classes of mutation in the low-density lipoprotein receptor gene in patients with familial hypercholesterolemia. Arterioscler Thromb. 1994;14(11):1717-22.,7474 Hobbs H, Brown M, Goldstein J. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992;1(6):445-66. Interessantemente, mutações de novo no gene LDLR parecem ser raras.7575 Pisciotta L, Cantafora A, De Stefano F, Langheim S, Calandra S, Bertolini S. A "de novo" mutation of the LDL-receptor gene as the cause of familial hypercholesterolemia. Biochim Biophys Acta. 2002;1587(1):7-11. A produção é finamente regulada por um mecanismo de retroalimentação sofisticado, que controla a transcrição do gene LDLR em resposta a variações no conteúdo intracelular de esteróis e da demanda celular de colesterol.7676 Goldstein JL, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL, Sly WS, Valle D. (editors). The metabolic bases of inherited diseases. New York: McGraw-Hill; 1989. p. 1215-50.
Existem mais de 1.800 mutações do gene LDLR documentadas como causadoras de HF até o momento,7777 Human Gene Mutation Database. [Internet]. [Accessed in 2016 July 10]. Available from: http://www.hgmd.cf.ac.uk/ac/gene.php?gene5LDLR
http://www.hgmd.cf.ac.uk/ac/gene.php?gen...
representando cerca de 85 a 90% dos casos de HF. A HF é mais comumente atribuível a mutações (incluindo deleções, missense, nonsense e inserções) no gene LDLR, resultando em LDLR com reduções funcionais (parcial a completa) em sua capacidade de remover LDL da circulação. Dependendo do impacto da mutação sobre a proteína resultante, o paciente pode ser receptor-negativo, que expressa pouco ou nenhum LDLR, ou receptor-defeituoso, que, por sua vez, expressa isoformas de LDLR com afinidade reduzida para LDL na superfície dos hepatócitos.7474 Hobbs H, Brown M, Goldstein J. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992;1(6):445-66.,7878 Horsthemke B, Dunning A, Humphries S. Identification of deletions in the human low density lipoprotein receptor gene. J Med Genet. 1987;24(3):144-7.
79 Hobbs HH, Brown MS, Russell DW, Davignon J, Goldstein JL. Deletion in the gene for the low-density-lipoprotein receptor in a majority of French Canadians with familial hypercholesterolemia. N Engl J Med. 1987;317(12):734-7.
80 Hobbs HH, Leitersdorf E, Goldstein JL, Brown MS, Russell DW. Multiple CRM-mutations in familial hypercholesterolemia: evidence for 13 alleles, including four deletions. J Clin Invest. 1988;81(3):909-17.
81 Hobbs HH, Russell DW, Brown MS, Goldstein JL. The LDL receptor locus in familial hypercholesterolemia: mutational analysis of a membrane protein. Annu Rev Genet. 1990;24:133-70.-8282 Langlois S, Kastelein JJ, Hayden MR. Characterization of six partial deletions in the low-density-lipoprotein (LDL) receptor gene causing familial hypercholesterolemia (FH). Am J Hum Genet. 1988;43(1):60-8.
Em pacientes heterozigotos, um alelo mutado para o LDLR é herdado de um dos pais e um alelo normal, do outro. Como dois alelos funcionais são necessários para manter o nível plasmático normal de LDL-c, a ausência de um alelo funcional pode causar um aumento no nível de LDL para aproximadamente duas vezes o normal já na infância.7676 Goldstein JL, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL, Sly WS, Valle D. (editors). The metabolic bases of inherited diseases. New York: McGraw-Hill; 1989. p. 1215-50.
Os pacientes homozigotos herdam dois alelos mutados; consequentemente, os LDLR não têm funcionalidade e os pacientes são portadores de uma hipercolesterolemia do tipo grave (650 a 1.000 mg/dL).7676 Goldstein JL, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL, Sly WS, Valle D. (editors). The metabolic bases of inherited diseases. New York: McGraw-Hill; 1989. p. 1215-50.
Existem cinco principais classes de mutações no gene 7474 Hobbs H, Brown M, Goldstein J. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992;1(6):445-66.,8181 Hobbs HH, Russell DW, Brown MS, Goldstein JL. The LDL receptor locus in familial hypercholesterolemia: mutational analysis of a membrane protein. Annu Rev Genet. 1990;24:133-70.
-
Classe I (mutações nulas): estas alterações afetam a região promotora do gene ou a região codificante, o que resulta na total ausência de síntese do LDLR ou na síntese de um receptor não funcional.
-
Classe II: ocasionados por defeitos no processamento pós-tradução ou falha no transporte do LDLR do retículo endoplasmático para o complexo de Golgi, resultando em uma menor expressão na superfície celular.
-
Classe III: a LDL não se liga corretamente ao LDLR na superfície da célula, graças a um defeito no domínio de ligação do substrato ou no domínio que apresenta homologia estrutural ao Fator de Crescimento Epidérmico (EGF), presentes no LDLR.
-
Classe IV: o LDLR liga-se normalmente à LDL, mas esta não é internalizada eficientemente pelo mecanismo de endocitose via depressões revestidas com clatrina (clathrin-coated pits).
-
Classe V: o LDLR não é reciclado de volta para a superfície celular.
O gene ApoB possui 42 kb, é formado por 29 éxons e 28 íntrons e dá origem a duas isoformas de proteínas: uma pequena denominada ApoB-48 e uma grande denominada de ApoB-100. ApoB-48 é produzida no intestino, sendo um componente dos quilomícrons. A ApoB-100 é produzida no fígado e é um componente de várias lipoproteínas, como VLDL, IDL e LDL. A hipercolesterolemia, devido à mutação no gene ApoB, resulta em um fenótipo clínico de HF semelhante ao produzido por mutações em outros genes, sendo referida como Defeito Familiar da ApoB (FDB, do inglês Familial Defective ApoB).8383 Innerarity TL, Mahley RW, Weisgraber KH, Bersot TP, Krauss RM, Vega GL, et al. Familial defective apolipoprotein B-100: a mutation of apolipoprotein B that causes hypercholesterolemia. J Lipid Res. 1990; 31(8):1337-49.,8484 Whitfield AJ, Barrett PH, van Bockxmeer FM, Burnett JR. Lipid disorders and mutations in the APOB gene. Clin Chem. 2004;50(10):1725-32.
Na ausência de teste genético, indivíduos com FDB podem ser clinicamente confundidos com HF de outras etiologias. Em contraste com o gene LDLR, apenas 157 mutações patogênicas estão descritas para o gene ApoB,7777 Human Gene Mutation Database. [Internet]. [Accessed in 2016 July 10]. Available from: http://www.hgmd.cf.ac.uk/ac/gene.php?gene5LDLR
http://www.hgmd.cf.ac.uk/ac/gene.php?gen...
sendo que a maioria delas encontra-se no éxon 26. A mutação mais comum no gene ApoB é a substituição Arg3500Gln, que causa o rompimento da estrutura da proteína. Esta variante corresponde a 5 a 10% dos casos de HF nas populações do norte da Europa, sendo, porém, rara em outras populações.8585 Varret M, Abifadel M, Rabès JP, Boileau C. Genetic heterogeneity of autosomal dominant hypercholesterolemia. Clin Genet. 2008;73(1):1-13.
Outra possível condição que leva a um fenótipo do tipo HF é o aumento da atividade de PCSK9, também chamada HF3, na qual mutações com ganho de função levam a maior degradação do LDLR.8585 Varret M, Abifadel M, Rabès JP, Boileau C. Genetic heterogeneity of autosomal dominant hypercholesterolemia. Clin Genet. 2008;73(1):1-13.,8686 Horton JD, Cohen JC, Hobbs HH. Molecular biology of PCSK9: its role in LDL metabolism. Trends Biochem Sci. 2007;32(2):71-7. Esta é a causa menos comum de HF, representando 1 a 3% dos casos de HF clinicamente diagnosticados.8585 Varret M, Abifadel M, Rabès JP, Boileau C. Genetic heterogeneity of autosomal dominant hypercholesterolemia. Clin Genet. 2008;73(1):1-13. O gene PCSK9 possui 25 kb, contém 12 éxons e dá origem a uma proteína de 692 aminoácidos.
Além destes genes descritos, tem-se considerado como uma possível causa de Hipercolesterolemia Autossômica Recessiva (ARH, do inglês Autosomal Recessive Hypercholesterolemia) a expressão reduzida da proteína adaptadora do receptor de LDL (LDLRAP1), que facilita a associação de LDLR nas depressões revestidas com clatrina (clathrin-coated pits) da superfície celular.7171 Soutar AK, Naoumova RP. Mechanisms of disease: genetic causes of familial hypercholesterolemia. Nat Clin Pract Cardiovasc Med. 2007;4(4):214-25.,8787 Garcia CK, Wilund K, Arca M, Zuliani G, Fellin R, Maioli M, et al. Autosomal recessive hypercholesterolemia caused by mutations in a putative LDL receptor adaptor protein. Science. 2001;292(5520):1394-8.,8888 He G, Gupta S, Yi M, Michaely P, Hobbs HH, Cohen JC. ARH is a modular adaptor protein that interacts with the LDL receptor, clathrin, and AP-2. J Biol Chem. 2002;277(46):44044-9. O gene LDLRAP1 possui 25 kb, é composto por nove éxons e dá origem a uma proteína de 308 aminoácidos. Apenas pacientes com mutações no gene LDLRAP1 em homozigose ou heterozigose composta são afetados; indivíduos heterozigotos simples são considerados apenas portadores, pois geralmente não apresentam hipercolesterolemia. Entretanto, existem casos descritos na literatura de portadores que possuem níveis de LDL-c mais altos que outros membros da família, que não possuem nenhuma alteração.8989 Pisciotta L, Priore Oliva C, Pes GM, Di Scala L, Bellocchio A, Fresa R, et al. Autosomal recessive hypercholesterolemia (ARH) and homozygous familial hypercholesterolemia (FH): a phenotypic comparison. Atherosclerosis. 2006;188(2):398-405.
Além destes genes apresentados, outros candidatos a serem causadores de HF são: APOE, IDOL (MYLIP), HCHOLA4 e STAP1.9090 Brautbar A, Leary E, Rasmussen K, Wilson DP, Steiner RD, Virani S. Genetics of familial hypercholesterolemia. Curr Atheroscler Rep. 2015;17(4):491. Formas raras de ARH incluem sitosterolemia ou fitosterolemia, em razão de mutações em dois genes adjacentes e com orientações opostas (ABCG5 e ABCG8), que codificam proteínas transportadoras da família ABC (ATP-binding cassette) denominadas esterolina-1 e esterolina-2,9191 Wang J, Joy T, Mymin D, Frohlich J, Hegele RA. Phenotypic heterogeneity of sitosterolemia. J Lipid Res. 2004;45(12):2361-7. envolvidas na eliminação de esteróis de plantas, que não podem ser utilizados pelas células humanas, e a deficiência de Colesterol 7-Alfa Hidroxilase (CYP7A1), que é a enzima da primeira etapa na síntese de ácidos biliares, resultando em colesterol intra-hepático aumentado e expressão reduzida de LDLR na superfície do hepatócito. A deficiência de CYP7A1 é a menos comum das condições autossômicas recessivas que podem causar graves hipercolesterolemias.7171 Soutar AK, Naoumova RP. Mechanisms of disease: genetic causes of familial hypercholesterolemia. Nat Clin Pract Cardiovasc Med. 2007;4(4):214-25.
O colesterol elevado hereditário pode incluir outras formas de hipercolesterolemia, como a disbetalipoproteinemia (tipo III de Friedrickson), hiperlipidemia familiar combinada, hipercolesterolemia por polimorfismos no gene APOE, bem como hipercolesterolemia poligênica, além de outras variantes em genes ainda não identificados, que podem mimetizar a HF,9292 Graham CA, McIlhatton BP, Kirk CW, Beattie ED, Lyttle K, Hart P, et al. Genetic screening protocol for familial hypercholesterolemia which includes splicing defects gives an improved mutation detection rate. Atherosclerosis. 2005;182(2):331-40.,9393 Ose L. An update on familial hypercholesterolaemia. Ann Med. 1999;31 Suppl 1:13-8. mas que não são o foco desta atualização.
4.7.1. Rastreamento em cascata
O rastreamento em cascata para HF geralmente não é necessário para diagnóstico ou tratamento clínico, mas pode ser útil quando o diagnóstico é incerto e para diagnóstico de familiares de um indivíduo afetado.
A identificação de uma mutação causal pode fornecer uma motivação adicional para alguns pacientes iniciarem o tratamento adequado, e o teste genético é padrão de referência para o diagnóstico de certeza de HF. Pode ser particularmente útil nos casos de familiares com diagnóstico clínico equivocado ou apenas com nível de LDL-c sugestivo de HF. Testes genéticos também podem ser importantes para a identificação de uma mutação causal em famílias recém-identificadas ou com forte suspeita de HF. Além disso, quando encontrada a mutação, o teste fornece uma resposta simples e definitiva para o diagnóstico da HF, tornando-se ferramenta definitiva para a presença de hipercolesterolemia como traço familiar.9393 Ose L. An update on familial hypercholesterolaemia. Ann Med. 1999;31 Suppl 1:13-8.
Os testes genéticos, no entanto, têm limitações. Entre os pacientes hipercolesterolêmicos com diagnóstico de HF possível, a taxa de identificação de uma mutação causal por meio do teste genético é de 50% ou menos, enquanto em pacientes com HF definitiva, a taxa de identificação da mutação pode ser tão alta quanto 86%.9393 Ose L. An update on familial hypercholesterolaemia. Ann Med. 1999;31 Suppl 1:13-8.,9494 Pollex RL, Hegele RA. Genomic copy number variation and its potential role in lipoprotein and metabolic phenotypes. Curr Opin Lipidol. 2007;18(2):174-80.
É importante ressaltar que um teste genético negativo não exclui a HF. Além disto, indivíduos com LDL-c elevado permanecem em alto risco e devem ser tratados de acordo com diretrizes aceitas, independentemente dos resultados dos testes genéticos.
A estratégia mais custo-efetiva para diagnóstico de HF é o rastreamento de mutações em parentes de primeiro grau de indivíduos em quem uma mutação causal para HF tenha sido identificada.9595 Marks D, Wonderling D, Thorogood M, Lambert H, Humphries SE, Neil HA. Screening for hypercholesterolaemia versus case finding for familial hypercholesterolaemia: a systematic review and cost effectiveness analysis. Health Technol Assess. 2000;4(29):1-123.,9696 Watts GF, van Bockxmeer FM, Bates T, Burnett JR, Juniper A, O'Leary P. A new model of care for familial hypercholesterolaemia from Western Australia: closing a major gap in preventive cardiology. Heart Lung Circ. 2010;19(7):419-22. Os indivíduos diagnosticados como portadores de HF por meio de teste genético passam a ser os casos-índice, sendo, a partir destes, rastreados os parentes de primeiro grau e, subsequentemente, os demais parentes (segundo e terceiro graus), em uma abordagem genética combinada à análise do perfil lipídico dos familiares suspeitos e de uma anamnese dirigida e exame físico, pesquisando-se os achados clínicos típicos da HF (arco corneal precoce, xantomas tendíneos e xantelasmas). Isto é referido como rastreamento genético em cascata.9797 Leren TP, Manshaus T, Skovholt U, Skodje T, Nossen IE, Teie C, et al. Application of molecular genetics for diagnosing familial hypercholesterolemia in Norway: results from a family-based screening program. Semin Vasc Med. 2004;4(1):75-85. Pode-se, no entanto, como primeira abordagem, realizar o teste genético, no qual se busca a mesma alteração do caso-índice. Há 50% de probabilidade de detecção em parentes de primeiro grau; 25% de probabilidade em parentes de segundo grau, e 12,5% de probabilidade em parentes de terceiro grau.6363 Khachadurian AK. The inheritance of essential familial hypercholesterolemia. Am J Med. 1964;37:402-7.
Estudos mostram que pouquíssimos indivíduos com HF são diagnosticados. Em qualquer população, estima-se que aproximadamente 20% dos pacientes com HF são diagnosticados e menos de 10% dos pacientes com HF recebem tratamento adequado.6363 Khachadurian AK. The inheritance of essential familial hypercholesterolemia. Am J Med. 1964;37:402-7. O rastreamento em cascata aumenta o número de diagnósticos e diminui a idade com que o indivíduo é diagnosticado, havendo maior chance de tratamento precoce e diminuição do risco cardiovascular global.
Marks et al.9595 Marks D, Wonderling D, Thorogood M, Lambert H, Humphries SE, Neil HA. Screening for hypercholesterolaemia versus case finding for familial hypercholesterolaemia: a systematic review and cost effectiveness analysis. Health Technol Assess. 2000;4(29):1-123. analisaram a custo-efetividade do rastreamento em cascata de indivíduos com HF. Foi determinado o custo incrementado por ano de vida adquirida de £ 3.300 por vida/ano adquirido. O programa de rastreamento em cascata foi o mais custo-efetivo na Dinamarca, e o custo por vida/ano foi de US$ 8.700,00, demonstrando uma estimativa de custos menor que o gasto com prevenção secundária em indivíduos não portadores de HF.9696 Watts GF, van Bockxmeer FM, Bates T, Burnett JR, Juniper A, O'Leary P. A new model of care for familial hypercholesterolaemia from Western Australia: closing a major gap in preventive cardiology. Heart Lung Circ. 2010;19(7):419-22. O rastreamento em cascata para indivíduos com HF pode ser considerado como altamente custo-efetivo.9595 Marks D, Wonderling D, Thorogood M, Lambert H, Humphries SE, Neil HA. Screening for hypercholesterolaemia versus case finding for familial hypercholesterolaemia: a systematic review and cost effectiveness analysis. Health Technol Assess. 2000;4(29):1-123.
4.7.2. Metodologias para diagnóstico genético
O gene causal, se LDLR, ApoB, PCSK9 ou LDLRAP1, além dos outros mais raros já citados, não pode ser determinado clinicamente, sendo necessário teste genético para sua verificação. Desta forma, por conta da variabilidade de genes e do grande número de mutações possíveis, o método de diagnóstico genético deve incluir o sequenciamento da região codificadora de todos os genes possivelmente ligados à etiologia da doença.9797 Leren TP, Manshaus T, Skovholt U, Skodje T, Nossen IE, Teie C, et al. Application of molecular genetics for diagnosing familial hypercholesterolemia in Norway: results from a family-based screening program. Semin Vasc Med. 2004;4(1):75-85.
Para que seja possível este sequenciamento em grande escala, de modo que um grupo de genes seja sequenciado (painel de genes alvo), é necessária a utilização da tecnologia de Sequenciamento de Nova Geração (NGS, do inglês Next-Generation Sequencing). Nesta técnica, é feito um painel contendo todos os genes a serem sequenciados, os quais são colocados em um chip. Outro enfoque mais amplo é a utilização do sequenciamento de exomas, o qual permite determinar a sequência da região codificante de praticamente todos os genes presentes no genoma em questão. Apesar deste enfoque fornecer uma extensa cobertura do genoma, muitos genes podem não ser sequenciados perfeitamente. Em casos específicos de doenças monogenéticas, como é o caso da HF, painéis contendo os genes alvo configuram-se como uma alternativa mais custo-efetiva, além de mais precisa.
A tecnologia NGS apresenta muitas vantagens em relação ao sequenciamento Sanger, considerado padrão-ouro nesta técnica. Dentre as vantagens, podemos citar a velocidade de obtenção de resultados, a quantidade de material necessário utilizado na reação, o custo do sequenciamento por base, a quantidade de informação gerada e a precisão dos resultados obtidos. Resumidamente, para o estudo genético, é efetuada coleta de sangue periférico em tubo contendo EDTA, obtendo-se o DNA genômico de leucócitos. A primeira etapa na preparação do material consiste na geração de uma biblioteca de fragmentos de DNA flanqueados por adaptadores específicos. As regiões de interesse dos genes em estudo são amplificadas por meio da reação em cadeia da polimerase em larga escala, em reações multiplexadas, com centenas de pares de oligonucleotideos em um mesmo tubo de reação. A partir destas reações, são construídas bibliotecas com códigos de barras para identificar cada paciente analisado. Os fragmentos gerados são amplificados por clonagem em esferas por reação em cadeia da polimerase em emulsão. Estas esferas contendo os fragmentos são aplicadas em um chip e inseridas no equipamento de sequenciamento de nova geração. Uma vez gerados os dados, os mesmos são transferidos para uma plataforma, na qual as leituras são mapeadas com o genoma humano (hg19/GRCh37) e é realizada a interpretação das variantes encontradas.
O rastreamento em cascata é custo-efetivo e deve ser realizado em todos os pacientes e familiares em primeiro grau de pacientes com diagnóstico de HF. O rastreamento em cascata mais custo-efetivo é o que utiliza informação genética de indivíduos afetados, no qual uma mutação causadora da doença tenha sido identificada. O rastreamento clínico/bioquímico deve ser realizado mesmo quando a realização de teste genético não é possível.9898 Wonderling D, Umans-Eckenhausen MA, Marks D, Defesche JC, Kastelein JJ, Thorogood M. Cost-effectiveness analysis of the genetic screening program for familial hypercholesterolemia in The Netherlands. Semin Vasc Med. 2004;4(1):97-104.,9999 Johannesson M, Jönsson B, Kjekshus J, Olsson AG, Pedersen TR, Wedel H. Cost effectiveness of simvastatin treatment to lower cholesterol levels in patients with coronary heart disease. Scandinavian Simvastatin Survival Study Group. N Engl J Med. 1997;336(5):332-6.
4.8. Biomarcadores inflamatórios
Atualmente, a associação entre inflamação e DCV está muito bem estabelecida. Entre os diversos biomarcadores inflamatórios propostos para estratificação do risco cardiovascular (moléculas de adesão: ICAM-1 e VCAM-1, E-selectina e P-selectina; citocinas: Interleucina 6 − IL-6 e Fator de Necrose Tumoral alfa - TNF-α; bem como proteínas de fase aguda: proteina C-reativa, fibrinogênio e amiloide sérica A), a Proteína C-Reativa de Alta Sensibilidade (PCR-us) parece contribuir para a identificação de indivíduos sob risco de desenvolvimento de DCV.100100 Pearson TA, Mensah GA, Alexander RW, Anderson JL, Cannon RO 3rd, Criqui M, et al; Centers for Disease Control and Prevention; American Heart Association. Markers of inflammation and cardiovascular disease: application to clinical and public health pratice: a statement from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107(3):499-511. Metanálise de 15 estudos populacionais de associação genômica demonstrou 18 loci implicados na variabilidade da Proteína C-Reativa, porém a elevação genética nos níveis de Proteína C-Reativa não se associou com doença coronária, não sendo considerado um fator de risco causal.101101 CRP CHD Genetics Collaboration. Collaborative pooled analysis of data on C-reactive protein gene variants and coronary disease: judging causality by Mendelian randomisation. Eur J Epidemiol. 2008;23(8):531-40.
4.8.1. Proteína C-Reativa ultrassensível
Diversos estudos avaliaram a associação entre DCV e inflamação por meio da mensuração de uma série de analitos. Apenas alguns destes ensaios podem ser utilizados na prática clínica, por sua estabilidade, disponibilidade do ensaio, padronização e precisão. A dosagem imunoquímica do PCR-us, dentre as proteínas de fase aguda, é estável, disponível e apresenta coeficientes de variação aceitáveis (< 10%), sendo capaz de reclassificar indivíduos de risco intermediário para uma categoria superior, quando seus níveis são elevados. Embora esta atualização não utilize fatores agravantes de risco para reclassificação do risco, a presença de PCR-us > 2 mg/L sugere a necessidade de intensificar o tratamento hipolipemiante. Não é recomendada sua dosagem com finalidade de estratificação de risco em indivíduos com doença aterosclerótica manifesta ou subclínica, nos diabéticos e naqueles de alto risco cardiovascular global, embora possa acrescentar informação prognóstica nestes indivíduos.
Interpretação dos valores, quando excluídas causas inflamatórias, infecciosas ou imunes de elevação de PCR-us:
-
Baixo risco: < 1mg/L.
-
Médio risco: 1 a 2 mg/L.
-
Alto risco: > 2mg/L.
-
Muito alto risco: ≥ 10mg/L.
5. Classificação das Dislipidemias
As dislipidemias podem ser classificadas em hiperlipidemias (níveis elevados de lipoproteínas) e hipolipidemias (níveis plasmáticos de lipoproteínas baixos).
Várias são as classificações propostas, dentre as mais importantes temos as que se seguem.
5.1. Classificação etiológica
Tanto as hiper quanto as hipolipidemias podem ter causas primárias ou secundárias:
-
Causas primárias: são aquelas nas quais o distúrbio lipídico é de origem genética.
-
Causas secundárias: a dislipidemia é decorrente de estilo de vida inadequado, de certas condições mórbidas, ou de medicamentos (Quadros 2 e 3).
5.2. Classificação laboratorial
A classificação laboratorial das dislipidemias nesta atualização sofreu modificações, e os valores referenciais e os alvos terapêuticos foram determinados de acordo com o risco cardiovascular individual e com o estado alimentar (Tabela 3). As dislipidemias podem ser classificadas de acordo com a fração lipídica alterada em:
Valores referenciais e de alvo terapêutico, conforme avaliação de risco cardiovascular estimado pelo médico solicitante do perfil lipídico para adultos com mais de 20 anos
-
Hipercolesterolemia isolada: aumento isolado do LDL-c (LDL-c ≥ 160 mg/dL).
-
Hipertrigliceridemia isolada: aumento isolado dos triglicérides (TG ≥ 150 mg/dL ou ≥ 175 mg/dL, se a amostra for obtida sem jejum).
-
Hiperlipidemia mista: aumento do LDL-c (LDL-c ≥ 160 mg/dL) e dos TG (TG ≥ 150 mg/dL ou ≥ 175 mg/dL, se a amostra for obtida sem jejum). Se TG ≥ 400 mg/dL, o cálculo do LDL-c pela fórmula de Friedewald é inadequado, devendo-se considerar a hiperlipidemia mista quando o não HDL-c ≥ 190 mg/dL.
-
HDL-c baixo: redução do HDL-c (homens < 40 mg/dL e mulheres < 50 mg/dL) isolada ou em associação ao aumento de LDL-c ou de TG.
5.3. Classificação fenotípica (Fredrickson)
A classificação proposta por Fredrickson é baseada nos padrões de lipoproteínas associados a concentrações elevadas de colesterol e/ou TG, não sendo considerado o HDL-c. A classificação de Fredrickson tem por base a separação eletroforética e/ou por ultracentrifugação das frações lipoproteicas, distinguindo-se seis tipos. Embora se reconheça a grande contribuição desta classificação, ela é hoje muito pouco utilizada, pois pouco colabora para o conhecimento da etiologia (exceto na disbetalipoproteinemia) ou da decisão terapêutica (Quadro 4).103103 Fredrickson DS, Levy RI, Lees RS. Fat transport in lipoproteins - an integrated approach to mechanisms and disorders. N Engl J Med. 1967;276(5):273-81.
5.4. Dislipidemias de forte componente genético
A biologia molecular acrescentou um vasto campo de conhecimento no metabolismo lipídico. Atualmente, foi facilitada a compreensão da influência genética na interação entre lipoproteínas e receptores e na expressão de diversas enzimas.
Os principais tipos de dislipidemias com forte componente genético serão apresentados em situações especiais.
O lipidograma (eletroforese de lipoproteínas) não é exame rotineiramente solicitado, mas pode auxiliar no diagnóstico da dislipidemia em raras situações.
6. Estratificação do Risco Cardiovascular para Prevenção e Tratamento da Aterosclerose e Metas Terapêuticas
Um evento coronário agudo é a primeira manifestação da doença aterosclerótica em pelo menos metade dos indivíduos que apresentam esta complicação. Desta forma, a identificação dos indivíduos assintomáticos que estão mais predispostos é crucial para a prevenção efetiva, com a correta definição das metas terapêuticas individuais.104104 Wilson PW, D'Agostino RB, Levy D, Belanger AM, Silbershatz H, Kannel WB. Prediction of coronary heart disease using risk factor categories. Circulation. 1998;97(18):1837-47.
A estimativa do risco de doença aterosclerótica resulta da somatória do risco associado a cada um dos fatores de risco mais a potenciação causada por sinergismos entre alguns destes fatores. Diante da complexidade destas interações, a atribuição intuitiva do risco frequentemente resulta em sub ou superestimação dos casos de maior ou menor risco, respectivamente. Para contornar esta dificuldade, diversos algoritmos têm sido criados, baseados em análises de regressão de estudos populacionais, por meio dos quais a identificação do risco é substancialmente aprimorada.
Dentre os diversos algoritmos existentes, esta atualização recomenda a utilização do Escore de Risco Global (ERG),105105 D'Agostino RB Sr, Vasan RS, Pencina MJ, Wolf PA, Cobain M, Massaro JM, et al. General cardiovascular risk profile for use in primary care the Framingham Heart Study. Circulation. 2008;117(6):743-53. que estima o risco de infarto do miocárdio, AVC, ou insuficiência cardíaca, fatais ou não fatais, ou insuficiência vascular periférica em 10 anos. Ele deve ser utilizado na avaliação inicial, ou mesmo em pacientes em uso de estatinas, entre os indivíduos que não foram enquadrados nas condições de muito alto ou alto risco apresentadas a seguir e pode ser encontrado pelo aplicativo obtido no site do Departamento de Aterosclerose da SBC para os sistemas Android e IOS.
6.1. Estratificação do risco cardiovascular em pacientes sem tratamento hipolipemiante
6.1.1. Risco muito alto
Indivíduos que apresentem doença aterosclerótica significativa (coronária, cerebrovascular, vascular periférica (Grau de Recomendação: IIa; Nível de Evidência: B), com ou sem eventos clínicos, ou obstrução ≥ 50% em qualquer território arterial (Grau de Recomendação: IIa; Nível de Evidência: C).2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,4545 Catapano AL, Reiner Z, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; European Society of Cardiology (ESC).; European Atherosclerosis Society (EAS). ESC/EAS guidelines for the management of dyslipidaemias the task force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis. 2011;217(1):3-46.,106106 Stone NJ, Robinson J, Lichtenstein AH, Goff DC Jr, Lloyd-Jones DM, Smith SC Jr, et al; 2013 ACC/AHA Cholesterol Guideline Panel. Treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: synopsis of the 2013 ACC/AHA cholesterol guideline. Ann Intern Med. 2014;160(5):339-43.
6.1.2. Alto risco
Para fins desta atualização, foram considerados de alto risco os indivíduos em prevenção primária:2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,4545 Catapano AL, Reiner Z, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; European Society of Cardiology (ESC).; European Atherosclerosis Society (EAS). ESC/EAS guidelines for the management of dyslipidaemias the task force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis. 2011;217(1):3-46.,106106 Stone NJ, Robinson J, Lichtenstein AH, Goff DC Jr, Lloyd-Jones DM, Smith SC Jr, et al; 2013 ACC/AHA Cholesterol Guideline Panel. Treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: synopsis of the 2013 ACC/AHA cholesterol guideline. Ann Intern Med. 2014;160(5):339-43.
-
Portadores de aterosclerose na forma subclínica documentada por metodologia diagnóstica: ultrassonografia de carótidas com presença de placa; Índice Tornozelo-Braquial (ITB) < 0,9; escore de Cálcio Arterial Coronariano (CAC) > 100 ou a presença de placas ateroscleróticas na angiotomografia (angio-CT) de coronárias.
-
Aneurisma de aorta abdominal.
-
Doença renal crônica definida por Taxa de Filtração Glomerular (TFG) < 60 mL/min, e em fase não dialítica.
-
Aqueles com concentrações de LDL-c ≥ 190 mg/dL.
-
Presença de diabetes melito tipos 1 ou 2, e com LDL-c entre 70 e 189 mg/dL e presença de Estratificadores de Risco (ER) ou Doença Aterosclerótica Subclínica (DASC).
Definem-se ER e DASC no diabetes como:
ER: idade ≥ 48 anos no homem e ≥ 54 anos na mulher; tempo de diagnóstico do diabetes > 10 anos; história familiar de parente de primeiro grau com DCV prematura (< 55 anos para homem e < 65 anos para mulher); tabagismo (pelo menos um cigarro no último mês); hipertensão arterial sistêmica; síndrome metabólica, de acordo com a International Diabetes Federation; presença de albuminúria > 30 mg/g de creatinina e/ou retinopatia; TFG < 60 mL/min.
DASC: ultrassonografia de carótidas com presença de placa > 1,5 mm; ITB < 0,9; escore de CAC > 10; presença de placas ateroscleróticas na angio-CT de coronárias.
• Pacientes com LDL-c entre 70 e 189 mg/dL, do sexo masculino com risco calculado pelo ERG > 20% e nas mulheres > 10%.2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,105105 D'Agostino RB Sr, Vasan RS, Pencina MJ, Wolf PA, Cobain M, Massaro JM, et al. General cardiovascular risk profile for use in primary care the Framingham Heart Study. Circulation. 2008;117(6):743-53.,107 107 Mosca L, Benjamin EJ, Berra K, Bezanson JL, Dolor RJ, Lloyd-Jones DM, et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women - 2010 update. A guideline from the American Heart Association. Circulation. 2011;123(11):1243-62. Erratum in: Circulation. 2011;123(22):e624. Circulation. 2011;124(16):e427.
(Grau de Recomendação: IIa; Nível de Evidência: C).
6.1.3. Risco intermediário
Indivíduos com ERG entre 5 e 20% no sexo masculino e entre 5 e 10% no sexo feminino (Grau de Recomendação: I; Nível de Evidência: A),2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,105105 D'Agostino RB Sr, Vasan RS, Pencina MJ, Wolf PA, Cobain M, Massaro JM, et al. General cardiovascular risk profile for use in primary care the Framingham Heart Study. Circulation. 2008;117(6):743-53.,107107 Mosca L, Benjamin EJ, Berra K, Bezanson JL, Dolor RJ, Lloyd-Jones DM, et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women - 2010 update. A guideline from the American Heart Association. Circulation. 2011;123(11):1243-62. Erratum in: Circulation. 2011;123(22):e624. Circulation. 2011;124(16):e427. ou ainda os diabéticos sem os critérios de DASC ou ER listados anteriormente.
6.1.4. Baixo risco
Pacientes do sexo masculino e feminino com risco em 10 anos < 5%, calculado pelo ERG (Grau de Recomendação: I; Nível de Evidência: A).2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.
Observação: esta atualização não utiliza os fatores agravantes para reclassificação do risco cardiovascular.
6.2. Estratificação De Risco Em Pacientes Em Uso De Estatinas
Os escores de risco para avaliação do risco cardiovascular devem ser utilizados na avaliação inicial naqueles indivíduos que não se enquadram nas situações de alto e muito alto risco, e que não recebam terapia modificadora de lípides. No entanto, aqueles sob terapêutica hipolipemiante não podem ter sua estratificação de risco e determinação das metas estabelecidas.
Este documento propõe a utilização de um fator de correção para o CT para o cálculo do ERG em pacientes sob terapia hipolipemiante. Assim, em pacientes em uso de estatina, deve-se multiplicar o CT por 1,43, como utilizado em alguns ensaios clínicos que tomam por base uma redução média de 30% do CT com estatinas.108108 Baigent C, Keech A, Kearney PM, Blackwell L, Buck G, Pollicino C, et al. Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy and safety of cholesterol lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 2005;366(9493):1267-78. Erratum in: Lancet. 2005;366(9494):1358; Lancet. 2008;371(9630):2084. Este valor foi derivado de estudos que compararam a eficácia de várias estatinas nas doses utilizadas e que admitem uma redução média de LDL-c ~ 30% com o tratamento. Isto se aplica à maior parte dos pacientes que usam doses moderadas de estatinas.
A utilização deste fator de correção tem limitações. Pode subestimar o CT basal nos pacientes utilizando estatinas potentes e em doses altas, ou combinações de fármacos; não considera a variabilidade na resposta individual ao tratamento, e nem os efeitos do tempo de exposição ao tratamento na atenuação do risco. Porém, como o colesterol é classificado em faixas, o impacto do fator de correção é atenuado (Grau de Recomendação: IIa; Nível de Evidência: C).
Observação: o escore de risco é dinâmico, pois o controle dos fatores de risco, por meio de intervenções não farmacológicas ou farmacológicas, reduz o risco calculado do paciente. Este documento orienta que, na vigência de medicamentos hipolipemiantes, mesmo que o valor absoluto de LDL-c alcançado seja muito menor do que a meta atual preconizada pelo ERG, a dose e a intensidade de tratamento não devem ser modificadas.
Exemplo de caso clínico: paciente do sexo masculino, 61 anos, em prevenção primária, tabagista, pressão arterial sistólica (não tratada) de 155 mmHg, CT de 210 mg/dL, HDL-c de 40 mg/dL, LDL-c (calculado) de 140 mg/dL, TG de 150 mg/dL. Cálculo do ERG > 20% (alto risco) com proposta de redução de LDL-c > 50%. Recebeu orientação para uso de estatina de alta potência. Após 18 meses, procura outro médico, informando que parou de fumar, está com pressão arterial sistólica de 125 mmHg, tratada com anti-hipertensivo, e traz exames recentes em uso de estatina de alta potência, com CT de 111 mg/dL, HDL-c de 43 mg/dL, LDL de 38 mg/dL e TG de 150 mg/dL, além de risco calculado intermediário.
Apesar da diminuição do escore de risco calculado após as intervenções terapêuticas, este documento reforça a importância da manutenção das medidas não farmacológicas e farmacológicas, em especial o uso da estatina de alta potência.
6.3. Metas terapêuticas absolutas e redução porcentual
6.3.1. LDL-c
Estudos caso-controle, observacionais e genéticos atestam a importância do colesterol plasmático elevado como um dos principais fatores de risco modificáveis para DCV, principalmente para DAC, mas também para AVC isquêmico.109109 Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al; INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004;364(9438):937-52.
110 Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J, et al; Prospective Studies Collaboration. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet. 2007;370(9602):1829-39. Erratum in: Lancet. 2008;372(9635):292.-111111 Ference BA, Yoo W, Alesh I, Mahajan N, Mirowska KK, Mewada A, et al. Effect of long-term exposure to lower low-density lipoprotein cholesterol beginning early in life on the risk of coronary heart disease: a Mendelian randomization analysis. J Am Coll Cardiol. 2012;60(25):2631-9. Estudos de intervenção, por sua vez, demonstram inequívoca diminuição da taxa de desfechos cardiovasculares proporcionada pela redução do colesterol plasmático, particularmente dos níveis de LDL-c.112112 Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170?000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81. Grandes ensaios clínicos com estatinas demonstram que, quanto maior a redução absoluta do LDL-c, maior a redução do risco relativo de eventos cardiovasculares.112112 Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170?000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81. Até o momento, não se identifica um limiar abaixo do qual o tratamento hipolipemiante deixa de promover benefício cardiovascular.112112 Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170?000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81.,113113 Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al; IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372(25):2387-97.
Esta atualização mantém a recomendação de se alcançar metas de LDL-c (meta primária) e de não HDL-c (meta secundária) de acordo com o risco cardiovascular (Tabela 4), embora reconheça que tais metas sejam derivadas de subanálises de estudos randomizados e controlados. Estes ensaios, em sua maioria, não testaram diretamente o benefício de se alcançarem diferentes metas de LDL-c, mas avaliaram o resultado da prescrição de doses fixas de medicamentos hipolipemiantes, quase sempre estatinas, para pacientes com determinadas características.
Metas terapêuticas absolutas e redução porcentual do colesterol da lipoproteína de baixa densidade e do colesterol não-HDL para pacientes com ou sem uso de estatinas
Desta forma, esta atualização passa a recomendar, além do alcance de metas, o uso preferencial de medicamentos nas doses utilizadas nos grandes ensaios clínicos e que demonstraram benefício clínico. Esquematicamente, os regimes terapêuticos podem ser classificados de acordo com sua intensidade em reduzir porcentualmente o LDL-c (Tabela 5).
Para o subgrupo de indivíduos com risco cardiovascular muito alto, a meta de LDL-c deve ser < 50 mg/dL (Quadro 5). Esta recomendação baseia-se no estudo IMPROVE-IT (IMProved Reduction of Outcomes: Vytorin Efficacy International Trial), no qual a associação entre ezetimiba e sinvastatina promoveu redução adicional do LDL-c e diminuiu a chance de eventos cardiovasculares em relação à sinvastatina isolada, em pacientes após síndrome coronária aguda, particularmente aqueles com diabetes melito.113113 Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al; IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372(25):2387-97.
Para os indivíduos classificados como de risco cardiovascular alto, esta atualização recomenda meta de LDL-c < 70 mg/dL (Quadro 5). Sempre que possível e tolerado, deve-se dar preferência para o uso de estatina de alta intensidade ou da associação entre ezetimiba e estatina (sinvastatina 40 mg ou outra estatina com potência pelo menos equivalente), ou seja, os tratamentos que promovem, em média, redução do LDL-c de pelo menos 50% (Tabela 5 e Quadro 5).
Para os indivíduos de risco cardiovascular intermediário, esta atualização propõe meta de LDL-c < 100 mg/dL (Quadro 5). Nestes casos, sempre que possível e tolerado, deve-se preferir o uso de estatina de intensidade pelo menos moderada, ou seja, tratamentos associados à redução do LDL-c entre 30 a 50% (Tabela 5 e Quadro 5).
Para indivíduos de baixo risco cardiovascular, a meta de LDL-c deve ser < 130 mg/dL. O tratamento medicamentoso deve ser considerado principalmente naqueles com LDL-c persistentemente acima de 160 mg/dL (Quadro 5).
6.3.2. Não HDL-c
A meta secundária para o não HDL-c deve ser 30 mg/dL acima da meta para o LDL-c. Assim, no risco muito alto, a meta do não HDL-c deve ser < 80 mg/dL; no alto risco, < 100 mg/dL; no risco intermediáro, < 130 mg/dL; e no baixo risco, < 160 mg/dL.2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,4545 Catapano AL, Reiner Z, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; European Society of Cardiology (ESC).; European Atherosclerosis Society (EAS). ESC/EAS guidelines for the management of dyslipidaemias the task force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis. 2011;217(1):3-46.
6.3.3. HDL-c, triglicérides e outras variáveis
Não são propostas metas para o HDL-c e não se recomenda tratamento medicamentoso visando à elevação dos níveis de HDL-c. Embora se reconheça a relação epidemiológica inversa entre níveis de HDL-c e incidência de DCV,114114 Gordon T, Castelli WP, Hjortland MC, Kannel WB, Dawber TR. High density lipoprotein as a protective factor against coronary heart disease. The Framingham Study. Am J Med. 1977;62(5):707-14.,115115 Assmann G, Schulte H. Relation of high-density lipoprotein cholesterol and triglycerides to incidence of atherosclerotic coronary artery disease (the PROCAM experience). Prospective Cardiovascular Münster study. Am J Cardiol. 1992;70(7):733-7. os estudos de intervenção mais recentes falharam em demonstrar benefício clínico por meio da elevação do HDL-c.116116 Barter PJ, Caulfield M, Eriksson M, Grundy SM, Kastelein JJ, Komajda M, et al; ILLUMINATE Investigators. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med. 2007;357(21):2109-2122.,117117 Schwartz GG, Olsson AG, Abt M, Ballantyne CM, Barter PJ, Brumm J, et al; dal-OUTCOMES Investigators. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N Engl J Med. 2012;367(22):2089-99.
Com relação aos TG, considera-se que pacientes com valores ≥ 500 mg/dL devem receber terapia apropriada para redução do risco de pancreatite.118118 Lederle FA, Bloomfield HE. Drug treatment of asymptomatic hypertriglyceridemia to prevent pancreatitis: where is the evidence? Ann Intern Med. 2012;157(9):662-4. Aqueles com valores entre 150 e 499 mg/dL devem receber terapia individualizada, com base no risco cardiovascular e nas condições associadas.
Para outras variáveis, como níveis de Apolipoproteínas ou de Lp(a), também não são especificadas metas terapêuticas, embora se reconheça que a ApoB119119 Chien KL, Hsu HC, Su TC, Chen MF, Lee YT, Hu FB. Apolipoprotein B and non-high density lipoprotein cholesterol and the risk of coronary heart disease in Chinese. J Lipid Res. 2007;48(11):2499-505. e a Lp(a)120120 Helgadottir A, Gretarsdottir S, Thorleifsson G, Holm H, Patel RS, Gudnason T, et al. Apolipoprotein(a) genetic sequence variants associated with systemic atherosclerosis and coronary atherosclerotic burden but not with venous thromboembolism. J Am Coll Cardiol. 2012;60(8):722-9. possam adicionar informação prognóstica em relação à LDL-c em alguns subgrupos de pacientes.
7. Tratamento Não Medicamentoso das Dislipidemias
7.1. Medidas no controle da hipercolesterolemia
7.1.1. Terapia nutricional
Nos últimos anos, o padrão alimentar e o estilo de vida saudável ganharam evidência em estudos epidemiológicos observacionais e de intervenção, como o DASH (Dietary Approachs to Stop Hypertension),121121 Sacks FM, Appel LJ, Moore TJ, Obarzanek E, Vollmer WM, Svetkey LP, et al. A dietary approach to prevent hypertension: a review of the Dietary Approaches to Stop Hypertension (DASH) Study. Clin Cardiol. 1999;22(7 Suppl):III6-10. o INTERHEART109109 Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al; INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004;364(9438):937-52. e o PREDIMED (PREvención con DIeta MEDiterránea),122122 Estruch R, Martínez-González MA, Corella D, Salas-Salvadó J, Ruiz-Gutiérrez V, Covas MI, et al; PREDIMED Study Investigators. Effects of a Mediterranean-style diet on cardiovascular risk factors: a randomized trial. Ann Intern Med. 2006;145(1):1-11. e reforçaram as diretrizes nutricionais que preconizam dieta isenta de ácidos graxos trans, o consumo de < 10% do valor calórico total de ácidos graxos saturados para indivíduos saudáveis e < 7% do valor calórico total para aqueles que apresentarem risco cardiovascular aumentado.2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,106106 Stone NJ, Robinson J, Lichtenstein AH, Goff DC Jr, Lloyd-Jones DM, Smith SC Jr, et al; 2013 ACC/AHA Cholesterol Guideline Panel. Treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: synopsis of the 2013 ACC/AHA cholesterol guideline. Ann Intern Med. 2014;160(5):339-43.,123123 Eckel RH, Jakicic JM, Ard JD, de Jesus JM, Houston Miller N, Hubbard VS, et al; American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;129(25 Suppl 2):S76-99. Erratum in: Circulation. 2014;129(25 Suppl 2):S100-1. Circulation. 2015;131(4):e326.
O padrão alimentar deve ser resgatado por meio do incentivo à alimentação saudável, juntamente da orientação sobre a seleção dos alimentos, o modo de preparo, a quantidade e as possíveis substituições alimentares, sempre em sintonia com a mudança do estilo de vida. Na tabela 6, estão expostas as recomendações dietéticas para tratamento da hipercolesterolemia.
7.1.2. Substituição parcial de ácidos graxos saturados por mono e poli-insaturados
Apesar de os ácidos graxos saturados apresentarem importantes funções biológicas, seu elevado consumo está associado a comprovados efeitos deletérios, tanto sob o ponto de vista metabólico124124 Haag M, Dippenaar NG. Dietary fats, fatty acids and insulin resistance: short review of a multifaceted connection. Med Sci Monit. 2005;11(12):RA359-67. quanto o cardiovascular,125125 Tanasescu M, Cho E, Manson JE, Hu FB. Dietary fat and cholesterol and the risk of cardiovascular disease among women with type 2 diabetes. Am J Clin Nutr. 2004;79(6):999-1005.,126126 Astrup A, Dyerberg J, Elwood P, Hermansen K, Hu FB, Jakobsen MU, et al. The role of reducing intakes of saturated fat in the prevention of cardiovascular disease: where does the evidence stand in 2010? Am J Clin Nutr. 2011;93(4):684-8. em razão de elevar o colesterol plasmático127127 Nicolosi RJ, Stucchi AF, Kowala MC, Hennessy LK, Hegsted DM, Schaefer EJ. Effect of dietary fat saturation and cholesterol on LDL composition and metabolism. In vivo studies of receptor and nonreceptor-mediated catabolism of LDL in cebus monkeys. Arteriosclerosis. 1990;10(1):119-28. e por sua ação pró-inflamatória.128128 de Lima-Salgado TM, Alba-Loureiro TC, do Nascimento CS, Nunes MT, Curi R. Molecular mechanisms by which saturated fatty acids modulate TNF-a expression in mouse macrophage lineage. Cell Biochem Biophys. 2011;59(2):89-97. Recente metanálise, com aproximadamente 59 mil indivíduos, realizada pela Biblioteca Cochrane, reafirmou que a substituição parcial de ácidos graxos saturados por poli-insaturados, por mais de 2 anos, reduziu em 17% o risco de eventos cardiovasculares. Nesta metanálise foram incluídos apenas estudos randomizados e controlados e com alto Grau de Evidência.129129 Hooper L, Martin N, Abdelhamid A, Davey Smith G. Reduction in saturated fat intake for cardiovascular disease. Cochrane Database Syst Rev. 2015 Jun 10;(6):CD011737.
A substituição na dieta de ácidos graxos saturados por carboidratos pode elevar o risco de eventos cardiovasculares.130130 Howard BV, Van Horn L, Hsia J, Manson JE, Stefanick ML, Wassertheil-Smoller S, et al. Low-fat dietary pattern and risk of cardiovascular disease: the Women's Health Initiative Randomized Controlled Dietary Modification Trial. JAMA. 2006;295(6):655-66. Neste sentido, a substituição de ácidos graxos saturados e carboidratos na alimentação por ácidos graxos poli-insaturados está associada ao baixo risco cardiovascular.131131 Siri-Tarino PW, Chiu S, Bergeron N, Krauss RM. Saturated fats versus polyunsaturated fats versus carbohydrates for cardiovascular disease prevention and treatment. Annu Rev Nutr. 2015;35:517-43.
Importante estudo epidemiológico, que avaliou a dieta da população de 20 países, mostrou que naqueles com alto consumo de óleos tropicais, a mortalidade por doença coronariana foi associada ao alto consumo de ácidos graxos saturados presentes nestas gorduras e também ao baixo consumo de ácidos graxos poli-insaturados da série ômega 6.132132 Food and Agriculture Organization, World Health Organization. Ann Nutr Metab. 2009;91:502-9. No Brasil, mostrou-se associação com alto consumo de trans e com o baixo consumo de poli-insaturados, quando substituídos por saturados. Estabeleceram-se os pontos de corte de > 10% para ácidos graxos saturados, de < 12% para poli-insaturados e de > 0,5% para trans.132132 Food and Agriculture Organization, World Health Organization. Ann Nutr Metab. 2009;91:502-9.,133133 Wang Q, Afshin A, Yakoob MY, Singh GM, Rehm CD, Khatibzadeh S, et al; Global Burden of Diseases Nutrition and Chronic Diseases Expert Group (NutriCoDE). Impact of nonoptimal intakes of saturated, polyunsaturated, and trans fat on global burdens of coronary heart disease. J Am Heart Assoc. 2016;5(1).pii: e002891.
Importante salientar que para o tratamento da hipercolesterolemia recomendam-se no máximo 7% das calorias na forma de ácidos graxos saturados e, segundo os dados do Instituto Brasileiro de Geografia e Estatística (IBGE), o consumo médio atual deste ácido é de 9%.
Estudo conduzido apenas no Brasil mostrou que a inadequação alimentar é a principal causa de mortalidade cardiovascular e reiterou que o baixo consumo de poli-insaturados, em substituição à gordura saturada, aumenta a mortalidade por cardiopatia isquêmica.134134 de Oliveira Otto MC, Afshin A, Micha R, Khatibzadeh S, Fahimi S, Singh G, et al; Global Burden of Diseases, Injuries, and Risk Factors Metabolic Risk Factors of Chronic Diseases Expert Group and Nutrition and Chronic Diseases Expert Group (NutriCoDE). The impact of dietary and metabolic risk factors on cardiovascular diseases and type 2 diabetes mortality in Brazil. PLoS One. 2016;11(3):e0151503. O consumo de gorduras saturadas deve ser limitado, porém o mais importante é sua substituição parcial por insaturadas − principalmente por poli-insaturadas, que estão associadas a diminuição de CT e LDL-c, como também estão relacionadas à diminuição de eventos e morte cardiovasculares.135135 Berger S, Raman G, Vishwanathan R, Jacques PF, Johnson EJ. Dietary cholesterol and cardiovascular disease: a systematic review and meta-analysis. Am J Clin Nutr. 2015;102(2):276-94.
136 U.S. Department of Health and Human Services and U.S. Department of Agriculture. 2015-2020 Dietary Guidelines for Americans. 8th ed. 2015. [Accessed in 2016 Oct 10]. Available from: http://health.gov.dietaryguidelines/2015/guidelines/
http://health.gov.dietaryguidelines/2015...
-137137 Willians CM, Salter A. Saturated fatty acids and coronary heart disease risk: the debate goes on. Curr Opin Clin Nutr Metab Care. 2016;19(2):97-102. (Grau de Recomendação: I; Nível de Evidência: A). Faltam dados conclusivos para a indicação de suplementação de ácidos graxos insaturados.138138 Al Khudary L, Hartley L, Clar C, Flowers N, Hooper L, Rees K. Omega 6 fatty acids for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2015 Nov 16;(11):CD011094.,139139 Scherr C, Figueredo VN, Moura FA, Sposito AC. Not simply a matter of fish intake. Cur Vasc. Pharmacol. 2015;13(5):676-8. (Grau de Recomendação: IIa; Nível de Evidência: B).
É importante realçar que o modo de preparo de alguns alimentos tem papel fundamental no teor de gorduras nos alimentos. No caso dos peixes, o teor de poli-insaturados pode variar até 220 vezes para uma mesma espécie.139139 Scherr C, Figueredo VN, Moura FA, Sposito AC. Not simply a matter of fish intake. Cur Vasc. Pharmacol. 2015;13(5):676-8.,140140 Scherr C, Gagliardi AC, Miname MH, Santos RD. Fatty acid cholesterol concentrations in usually consumed fish in Brazil. Arq Bras Cardiol. 2015;104(2):152-8.
A substituição por gorduras monoinsaturadas, como azeite de oliva e frutas oleaginosas, pode estar associada à redução do risco cardiovascular, porém as evidências são menos robustas do que em relação às poli-insaturadas136136 U.S. Department of Health and Human Services and U.S. Department of Agriculture. 2015-2020 Dietary Guidelines for Americans. 8th ed. 2015. [Accessed in 2016 Oct 10]. Available from: http://health.gov.dietaryguidelines/2015/guidelines/
http://health.gov.dietaryguidelines/2015...
(Grau de Recomendação: IIa; ; Nível de Evidência: B).
7.1.3. Ácidos graxos trans
Os ácidos graxos trans devem ser excluídos da dieta por aumentarem a concentração plasmática de LDL-c e induzirem intensa lesão aterosclerótica,141141 Machado RM, Nakandakare ER, Quintao EC, Cazita PM, Koike MK, Nunes VS, et al. Omega-6 polyunsaturated fatty acids prevent atherosclerosis development in LDLr-KO mice, in spite of displaying a pro-inflammatory profile similar to trans fatty acids. Atherosclerosis. 2012;224(1):66-74. condições que culminam em maior risco cardiovascular, conforme demonstrado em estudos experimentais, clínicos e epidemiológicos.131131 Siri-Tarino PW, Chiu S, Bergeron N, Krauss RM. Saturated fats versus polyunsaturated fats versus carbohydrates for cardiovascular disease prevention and treatment. Annu Rev Nutr. 2015;35:517-43.,133133 Wang Q, Afshin A, Yakoob MY, Singh GM, Rehm CD, Khatibzadeh S, et al; Global Burden of Diseases Nutrition and Chronic Diseases Expert Group (NutriCoDE). Impact of nonoptimal intakes of saturated, polyunsaturated, and trans fat on global burdens of coronary heart disease. J Am Heart Assoc. 2016;5(1).pii: e002891. (Grau de Recomendação: III; Nível de Evidência: A).
7.1.4. Colesterol alimentar
Recente metanálise mostrou que o colesterol alimentar exerce pouca influência na mortalidade cardiovascular,135135 Berger S, Raman G, Vishwanathan R, Jacques PF, Johnson EJ. Dietary cholesterol and cardiovascular disease: a systematic review and meta-analysis. Am J Clin Nutr. 2015;102(2):276-94. embora neste estudo tenha sido demonstrada linearidade entre o consumo de colesterol alimentar e a concentração plasmática de LDL-c. Já o aumento do consumo de ovos, em um contexto de dieta com baixo teor de gordura, manteve a relação LDL-c/HDL-c, tanto entre indivíduos que absorvem mais colesterol da dieta quanto nos hiporresponsivos.142142 Mutungi G, Ratliff J, Puglisi M, Torres-Gonzalez M, Vaishnav U, Leite JO, et al. Dietary cholesterol from eggs increases plasma HDL cholesterol in overweight men consuming a carbohydrate-restricted diet. J Nutr. 2008;138(2):272-6.
Em razão destes estudos mais recentes da literatura, as atuais diretrizes internacionais sobre prevenção cardiovascular mostram que não há evidências suficientes para estabelecimento de um valor de corte para o consumo de colesterol.
7.2. Medidas no controle da hipertrigliceridemia
7.2.1. Terapia nutricional
A concentração plasmática de TG é muito sensível a variações do peso corporal e a alterações na composição da dieta, particularmente quanto à qualidade e à quantidade de carboidratos e gorduras. A quantidade recomendada destes nutrientes na dieta depende do tipo de hipertrigliceridemia, que pode se apresentar na forma primária ou secundária, cujas bases fisiopatológicas são distintas. A terapia nutricional indicada para a hipertrigliceridemia primária grave, caracterizada pelo aumento da concentração plasmática de quilomícrons, por diminuição da enzima lipoproteína lipase, baseia-se na redução importante da gordura na dieta, que deve atingir, no máximo, 10% do valor calórico total.145145 Capell WH, Eckel RH. Severe hypertriglyceridemia with a history of treatment failure. Nat Clin Pract Endocrinol Metab. 2005;1(1):53-8. Na hipertrigliceridemia primária moderada, recomendam-se aproximadamente 25 a 35% das calorias na forma de gorduras e controle da ingestão de açúcares. Já na hipertrigliceridemia de causa secundária, observada na obesidade e no diabetes, mantêm-se o controle de gorduras (30 a 35% das calorias) e a adequação no consumo de carboidratos, com ênfase na restrição de açúcares.144144 Santos RD, Gagliardi AC, Xavier HT, Magnoni CD, Cassani R, Lottenberg AM, et al; Sociedade Brasileira de Cardiologia. [First guidelines on fat consumption and cardiovascular health]. Arq Bras Cardiol. 2013;100(1 Suppl 3):1-40.
Atualmente, as recentes diretrizes e guias internacionais apontam para os benefícios de padrões alimentares saudáveis, como demonstrado nos estudos INTERHEART109109 Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al; INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004;364(9438):937-52. e em diversos estudos que testaram a eficiência da Dieta do Mediterrâneo,122122 Estruch R, Martínez-González MA, Corella D, Salas-Salvadó J, Ruiz-Gutiérrez V, Covas MI, et al; PREDIMED Study Investigators. Effects of a Mediterranean-style diet on cardiovascular risk factors: a randomized trial. Ann Intern Med. 2006;145(1):1-11.,146146 Mente A, de Koning L, Shannon HS, Anand SS. A systematic review of the evidence supporting a causal link between dietary factors and coronary heart disease. Arch Intern Med. 2009;169(7):659-69. nos quais a matriz alimentar assume papel de destaque. Em comum, todos estes estudos reafirmam a relevância de se manterem quantidades moderadas de gordura na dieta, eliminar ácidos graxos trans, controlar o consumo de saturados, priorizar poli-insaturados e monoinsaturados, reduzir açúcares e incluir carnes magras, frutas, grãos e hortaliças na dieta146146 Mente A, de Koning L, Shannon HS, Anand SS. A systematic review of the evidence supporting a causal link between dietary factors and coronary heart disease. Arch Intern Med. 2009;169(7):659-69. (Quadro 6).
7.2.2. Controle de peso corporal
O alcance das metas nutricionais no tratamento é variável e depende da adesão à dieta e às correções no estilo de vida, como perda de peso, e pode resultar na redução de 20% da concentração plasmática de TG.147147 Godoy-Matos AF, Oliveira J, Guedes EP, Carraro L, Lopes AC, Mancini MC, et al; Associação Brasileira para o Estudo da Obesidade e da Síndrome Metabólica (ABESO). Diretrizes Brasileiras de Obesidade. Associação Brasileira para Estudos da Obesidade e Síndrome Metabólica. (ABESO). 2009/2010. 3ª ed. Itapevi (SP): AC Farmacêutica; 2009. p. 1-85. Além do controle de calorias na dieta (défice de 500 a 1.000 Kcal),148148 Mozaffarian D. Dietary and policy priorities for cardiovascular disease, diabetes and obesity: a comprehensive review. Circulation. 2016;133(2):187-225. enfatiza-se a relevância da qualidade dos nutrientes em aspectos relacionados ao desenvolvimento da obesidade, como saciedade, resposta insulínica, lipogênese hepática, adipogênese, gasto energético e microbiota.148148 Mozaffarian D. Dietary and policy priorities for cardiovascular disease, diabetes and obesity: a comprehensive review. Circulation. 2016;133(2):187-225.
7.2.3. Redução de bebida alcoólica
O consumo de bebida alcoólica não é recomendado para indivíduos com hipertrigliceridemia.149149 Ford ES, Li C, Zhao G, Pearson WS, Mokdad AH. Hypertriglyceridemia and its pharmacologic treatment among US adults. Arch Intern Med. 2009;169(6):572-8. Porém, há alguma divergência no impacto da ingestão de etanol nos triacilgliceróis (TAG) em situações de consumo moderado (até 30 g/dia). A combinação de um consumo excessivo de etanol e ácidos graxos saturados potencializa a elevação da trigliceridemia. A inibição da lipase das lipoproteínas pelo excesso de etanol e a consequente redução na hidrólise de quilomícrons parecem justificar a lipemia induzida pelo etanol. Além disso, o produto da metabolização do álcool é a Acetilcoenzima A (acetil-CoA), principal precursora da síntese de ácidos graxos.
7.2.4. Redução de açúcares e de carboidratos
A Organização Mundial da Saúde passou a recomendar, a partir de 2015, o consumo máximo de 5% em Kcal do valor energético da dieta na forma de açucares de adição,143143 Miller M, Stone NJ, Ballantyne C, Bittner V, Criqui MH, Ginsberg HN, et al. American Heart Association Clinical Lipidology, Thrombosis, and Prevention Committee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Cardiovascular Nursing; Council on the Kidney in Cardiovascular Disease. Triglycerides and cardiovascular disease: a scientific statement from the American Heart Association. Circulation. 2011;123(20):2292-333. nos quais se incluem a sacarose e o xarope de milho (American Heart Association − AHA). O guia alimentar americano publicado naquele ano incluiu ainda como açúcares de adição os sucos de frutas concentrados, mesmo que não adoçados.136136 U.S. Department of Health and Human Services and U.S. Department of Agriculture. 2015-2020 Dietary Guidelines for Americans. 8th ed. 2015. [Accessed in 2016 Oct 10]. Available from: http://health.gov.dietaryguidelines/2015/guidelines/
http://health.gov.dietaryguidelines/2015...
Tanto a sacarose quanto os xaropes são constituídos por aproximadamente partes iguais de frutose e glicose, os quais são metabolizados de forma diferente. Enquanto existe um mecanismo celular de feedback de regulação da glicose mediado pela fosfofrutoquinase, para a produção de piruvato e consequentemente de acetil-CoA e ácidos graxos, o mesmo mecanismo não ocorre para metabolização da frutose, que é metabolizada pela frutoquinase. Desta forma, a frutose gera ácidos graxos mais rapidamente do que a glicose, aumentando tanto o depósito de gordura hepática, como o aumento da produção de VLDL.150150 Spruss A, Bergheim I. Dietary fructose and intestinal barrier: potential risk factor in the pathogenesis of nonalcoholic fatty liver disease. J Nutr Biochem. 2009;20(9):657-62.
Estudos mostram que o consumo superior a 50 g de frutose ao dia eleva o TG pós-prandial.151151 Livesey G, Taylor R. Fructose consumption and consequences for glycation, plasma triacylglycerol, and body weight: meta-analyses and meta-regression models of intervention studies. Am J Clin Nutr. 2008;88(5):1419-37. A elevada ingestão de carboidratos aumenta a glicemia, o que promove o aumento da insulinemia; esta, por sua vez, ativa os fatores de transcrição que promovem a síntese de ácidos graxos e TG, favorecendo outros fatores de risco.152152 Cassani R. O que é uma dieta saudável para prevenção da doença cardiovascular: o papel dos nutrientes sobre lípides, sobrepeso, hipertensão arterial e inflamação subclínica. Rev Soc Cardiol Estado de São Paulo. 2012;22(2):9-13.
7.2.5. Substituição parcial de ácidos graxos saturados por mono e poli-insaturados
Os ácidos graxos saturados da dieta relacionam-se com a elevação da trigliceridemia, por aumentarem a lipogênese hepática e a secreção de VLDL. Desta forma, recomenda-se a inclusão de poli e monoinsturados.153153 Lottenberg AM, Afonso Mda S, Lavrador MS, Machado RM, Nakandakare ER. The role of dietary fatty acids in the pathology of metabolic syndrome. J Nutr Biochem. 2012;23(9):1027-40. Para indivíduos com níveis de TG muito altos, a AHA recomenda uma redução significativa em gordura saturada, o que diminui o risco de pancreatite.143143 Miller M, Stone NJ, Ballantyne C, Bittner V, Criqui MH, Ginsberg HN, et al. American Heart Association Clinical Lipidology, Thrombosis, and Prevention Committee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Cardiovascular Nursing; Council on the Kidney in Cardiovascular Disease. Triglycerides and cardiovascular disease: a scientific statement from the American Heart Association. Circulation. 2011;123(20):2292-333.
Dentre os ácidos graxos poli-insaturados, os da série ômega 3 são reconhecidos pela atividade cardioprotetora.154154 Din JN, Sarma J, Harding SA, Lyall K, Newby DE, Flapan AD. Effect of w-3 fatty acid supplementation on endothelial function, endogenous fibrinolysis and platelet activation in patients with a previous myocardial infarction: a randomised controlled trial. BMJ Open. 2013;3(9):e003054. O consumo de ômega 3 proveniente de fontes animais fornece os ácidos graxos EPA e DHA, mais associados à proteção cardiovascular. O ácido Alfalinolenico (ALA) produz pequenas quantidades endógenas de EPA e DHA, e também exerce ação cardioprotetora.155155 Wang C, Harris WS, Chung M, Lichtenstein AH, Balk EM, Kupelnick B, et al. n-3 Fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr. 2006;84(1):5-17. As diferentes fontes de ômega 3, por meio da diminuição da lipogênese hepática e da LPL, contribuem de forma significativa com a redução de triglicerídeos.156156 Lottemberg AM. Importance of the dietary fat on the prevention and control of metabolic disturbances and cardiovascular disease. Arq Bras Endocrinol Metab. 2009;53(5):595-607.
7.3. Ácidos graxos ômega 3
Os principais ácidos graxos da série ômega 3 são o ácido ALA (C18:3), de origem vegetal (soja, canola e linhaça), e os ácidos EPA (C20:5) e DHA (C22:6), provenientes de peixes e crustáceos de águas muito frias dos oceanos Pacífico e Ártico. EPA e DHA também podem ser obtidos por ação enzimática de dessaturases e elongases sobre o ALA, que é um ácido graxo essencial e apresenta recomendação de consumo pelas Dietary Reference Intakes (DRIs), que pode ser alcançada pela ingestão moderada de óleo de soja ou canola, não sendo necessária sua suplementação na dieta.157157 Augustine AH, Lowenstein LM, Harris WS, Shearer GC, Block RC. Treatment with omega-3 fatty acid ethyl-ester alters fatty acid composition of lipoproteins in overweight or obese adults with insulin resistance. Prostaglandins Leukot Essent Fatty Acids 2014; 90(2-3):69-75. A conversão de ALA em EPA e DHA é limitada e sofre interferência de fatores fisiológicos e externos. Especialmente, EPA e DHA têm sido investigados quanto ao seu potencial na redução do risco cardiovascular. Os mecanismos propostos para os benefícios cardiovasculares incluem redução de marcadores inflamatórios e da agregação plaquetária, melhora da função endotelial, redução da pressão arterial e redução da trigliceridemia.158158 Bosch J, Gerstein HC, Dagenais GR, Díaz R, Dyal L, Jung H, et al; ORIGIN Trial Investigators. n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia. N Engl J Med 2012;367(4):309-18.
159 Flock MR, Skulas-Ray AC, Harris WS, Gaugler TL, Fleming JA, Kris-Etherton PM. Effects of supplemental long-chain omega-3 fatty acids and erythrocyte membrane fatty acid content on circulating inflammatory markers in a randomized controlled trial of healthy adults. Prostaglandins Leukot Essent Fatty Acids 2014; 91(4):161-8.-160160 Ito MK. Long-chain omega-3 fatty acids, fibrates and niacin as therapeutic options in the treatment of hypertriglyceridemia: a review of the literature. Atherosclerosis. 2015;242(2):647-56.
Em regiões onde estão disponíveis peixes que são fonte de ômega 3, é recomendada a utilização de padrões alimentares saudáveis, que incluam, no mínimo, duas porções deles por semana, pelos efeitos benéficos em fatores de risco e pela redução de risco de desfechos em prevenção primária e secundária.161161 Zhang J, Wang C, Li L, Man Q, Song P, Meng L, et al. Inclusion of Atlantic salmon in the Chinese diet reduces cardiovascular disease risk markers in dyslipidemic adult men. Nutr Res. 2010;30(7):447-54.
162 Erkkilä AT, Lichtenstein AH, Mozaffarian D, Herrington DM. Fish intake is associated with a reduced progression of coronary artery atherosclerosis in postmenopausal women with coronary artery disease. Am J Clin Nutr. 2004;80(3):626-32.-163163 Kris-Etherton PM, Harris WS, Appel LJ; AHA Nutrition Committee. American Heart Association. Omega-3 fatty acids and cardiovascular disease: new recommendations from the American Heart Association. Arterioscler Thromb Vasc Biol. 2003;23(2):151-2. Em prevenção primária de indivíduos com alto risco, o consumo de peixes que resultem na ingestão diária de 500 mg de EPA + DHA está relacionado à redução de 39% do risco de DCV fatal e de 46% do risco de DAC fatal.164164 Sala-Vila A, Guasch-Ferré M, Hu FB, Sánchez-Tainta A, Bulló M, Serra-Mir M, et al; PREDIMED Investigators. Dietary α-linolenic acid, marine ω-3 fatty acids, and mortality in a population with high fish consumption: findings from the PREvención con DIeta MEDiterránea (PREDIMED) Study. J Am Heart Assoc. 2016;5(1). pii: e002543. Erratum in: J Am Heart Assoc. 2016;5(2). pii: e002077
Efeitos controversos são observados entre o consumo de peixes ricos em ômega 3 e a prevenção secundária de eventos cerebrovasculares.165165 Chowdhury R, Stevens S, Gorman D, Pan A, Warnakula S, Chowdhury S, et al. Association between fish consumption, long chain omega 3 fatty acids, and risk of cerebrovascular disease: systematic review and meta-analysis. BMJ. 2012;345:e6698. Em prevenção primária, independente do grau de risco cardiovascular, o consumo diário de 250 mg de EPA e DHA pela alimentação está relacionado à redução de 35% da morte súbita.166166 Musa-Veloso K, Binns MA, Kocenas A, Chung C, Rice H, Oppedal-Olsen H, et al. Impact of low v. moderate intakes of long-chain n-3 fatty acids on risk of coronary heart disease. Br J Nutr. 2011;106(8):1129-41.
Apesar de haver correlação positiva entre os níveis séricos de EPA e DHA e redução do risco cardiovascular,167167 de Oliveira Otto MC, Wu JH, Baylin A, Vaidya D, Rich SS, Tsai MY, et al. Circulating and dietary omega-3 and omega-6 polyunsaturated fatty acids and incidence of CVD in the Multi-Ethnic Study of Atherosclerosis. J Am Heart Assoc. 2013;2(6):e000506. estudos clínicos randomizados recentes não comprovam benefício da suplementação de EPA e DHA na redução de eventos cardiovasculares maiores, como infarto agudo do miocárdio, AVC e morte por DCV (Quadro 7).168168 Bonds DE, Harrington M, Worrall BB, Bertoni AG, Eaton CB, Hsia J, et al; Writing Group for the AREDS2 Research Group. Effect of long-chain ω-3 fatty acids and lutein + zeaxanthin supplements on cardiovascular outcomes: results of the Age-Related Eye Disease Study 2 (AREDS2) randomized clinical trial. JAMA Intern Med. 2014;174(5):763-71.
169 Galan P, Kesse-Guyot E, Czernichow S, Briancon S, Blacher J, Hercberg S; SU.FOL.OM3 Collaborative Group. Effects of B vitamins and omega 3 fatty acids on cardiovascular diseases: a randomised placebo controlled trial. BMJ. 2010;341:c6273.
170 Kromhout D, Giltay EJ, Geleijnse JM; Alpha Omega Trial Group. n-3 fatty acids and cardiovascular events after myocardial infarction. N Engl J Med. 2010;363(21):2015-26.
171 Eussen SR, Geleijnse JM, Giltay EJ, Rompelberg CJ, Klungel OH, Kromhout D. Effects of n-3 fatty acids on major cardiovascular events in statin users and non-users with a history of myocardial infarction. Eur Heart J. 2012;33(13):1582-8.
172 Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997;65(5 Suppl):1645S-54S.-173173 Leslie MA, Cohen DJ, Liddle DM, Robinson LE, Ma DW. A review of the effect of omega-3 polyunsaturated fatty acids on blood triacylglycerol levels in normolipidemic and borderline hyperlipidemic individuals. Lipids Health Dis. 2015;14:53.
Como adjuvante no tratamento da hipertrigliceridemia, a suplementação de ômega 3 (EPA e DHA) entre 2 a 4 g ao dia, pode reduzir a concentração plasmática de TG em até 25 a 30%.163163 Kris-Etherton PM, Harris WS, Appel LJ; AHA Nutrition Committee. American Heart Association. Omega-3 fatty acids and cardiovascular disease: new recommendations from the American Heart Association. Arterioscler Thromb Vasc Biol. 2003;23(2):151-2.,172172 Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997;65(5 Suppl):1645S-54S. Em estudo recente, indivíduos normolipidêmicos e levemente hiperlipidêmicos (TG > 150 e < 200 mg/dL) também se beneficiam com o consumo > 4 g ao dia de EPA e DHA provenientes de alimentos enriquecidos ou de animais marinhos, com redução entre 9 a 26% da trigliceridemia, enquanto que a suplementação entre 1 a 5 g de EPA e/ou DHA pode reduzir entre 4 a 51% em indivíduos com níveis limítrofes.173173 Leslie MA, Cohen DJ, Liddle DM, Robinson LE, Ma DW. A review of the effect of omega-3 polyunsaturated fatty acids on blood triacylglycerol levels in normolipidemic and borderline hyperlipidemic individuals. Lipids Health Dis. 2015;14:53. Alguns estudos mostram que a suplementação com ômega 3 pode aumentar discretamente a concentração plasmática de HDL-c (1 a 3%) e aumentar o LDL-c (até 5 a 10%),172172 Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997;65(5 Suppl):1645S-54S. em razão de reduzir os receptores de LDL, também chamados de receptores B/E.
7.4. Fitosteróis
Fitosteróis, fitostanóis e seus ésteres são um grupo de esteroides alcoólicos e ésteres, que ocorrem exclusivamente em plantas e vegetais. Possuem estrutura semelhante à do colesterol, diferindo apenas pela presença de um ou dois grupamentos metil ou etil em sua cadeia lateral, ligada ao C-24, sendo os esteróis as formas insaturadas (sitosterol e campesterol) e os estanóis, seus derivados saturados (sitostanol e campestanol).174174 Amundsen ǺL, Ose L, Nenseter MS, Ntanios FY. Plant sterol ester-enriched spread lowers plasma total and LDL cholesterol in children with familial hypercholesterolemia. Am J Clin Nutr. 2002;76(2):338-44. Óleos vegetais, cereais, grãos e demais vegetais são fontes de fitosteróis, sendo o consumo habitual variável em populações ocidentais (de 100 a 300 mg ao dia),175175 Valsta LM, Lemström A, Ovaskainen ML, Lampi AM, Toivo J, Korhonen T, et al. Estimation of plant sterol and cholesterol intake in Finland: quality of new values and their effect on intake. Br J Nutr. 2004;92(4):671-8.
176 Piironen V, Lampi AM. Occurrence and levels of phytosterols in foods. In: Dutta PC. (editor). Phytosterols as functional food components and nutra- ceuticals. New York: Marcel Dekker, Inc; 2004. p. 1-32.-177177 Martins CM, Fonseca FA, Ballus CA, Figueiredo-Neto AM, Meinhart AD, de Godoy HT, et al. Common sources and composition of phytosterols and their estimated intake by the population in the city of Sao Paulo, Brazil. Nutrition. 2013;29(6):865-71. alcançando 600 mg ao dia em vegetarianos.178178 Vuoristo M, Miettinen TA. Absorption, metabolism, and serum concentrations of cholesterol in vegetarians: effects of cholesterol feeding. Am J Clin Nutr. 1994;59:1325-31. São pouco absorvidos (0,5 a 2% para os esteróis, e 0,04% a 0,2% para os estanóis)179179 Ostlund RE Jr. Phytosterols in human nutrition. Annu Rev Nutr. 2002;22:533-49. e possuem eficiente excreção biliar após captação hepática, com concentrações séricas 500 a 10 mil vezes menores do que as concentrações de colesterol.180180 Björkhem I, Boberg KM, Leitersdorf E. Inborn errors in bile acid biosynthesis and storage of sterols other than cholesterol. In: Scriver CR, Beaudet AL, Sly WS, Valle D. (editors). The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2001. p. 2961-88.
A ação dos fitosteróis no intestino delgado ocorre em três etapas: (1) incorporação às micelas que permitem o transporte destes até a borda em escova do enterócito; (2) transporte dos esteróis das micelas para o interior do enterócito via transportador NPC1-L1; (3) transporte de volta à luz intestinal pelos cotransportadores ABC G5/G8.181181 Nguyen TM, Sawyer JK, Kelley KL, Davis MA, Rudel LL. Cholesterol esterification by ACAT2 is essential for efficient intestinal cholesterol absorption: evidence from thoracic lymph duct cannulation. J Lipid Res. 2012;53(1):95-104.
182 Gylling HK, Hallikainen M, Vidgren H, Agren J, Miettinen TA. Ester percentages of plant sterols and cholesterol in chylomicrons and VLDL of humans with low and high sterol absorption. Atherosclerosis. 2006;187(1):150-2.
183 Calandra S, Tarugi P, Speedy HE, Dean AF, Bertolini S, Shoulders CC. Mechanisms and genetic determinants regulating sterol absorption, circulating LDL levels, and sterol elimination: implications for classification and disease risk. J Lipid Res. 2011;52(11):1885-926.-184184 Lee S, Gershkovich P, Darlington JW, Wasan KM. Inhibition of cholesterol absorption: targeting the intestine. Pharm Res. 2012;29(12):3235-50. O consumo de fitosteróis reduz a absorção de colesterol, principalmente por comprometimento da solubilização intraluminal (micelas),185185 Nissinen M, Gylling H, Vuoristo M, Miettinen TA. Micellar distribution of cholesterol and phytosterols after duodenal plant stanol ester infusion. Am J Physiol Gastrointest Liver Physiol. 2002;282(6):G1009-15. embora novos mecanismos também tenham sido propostos.186186 De Smet E, Mensink RP, Plat J. Effects of plant sterols and stanols on intestinal cholesterol metabolism: suggested mechanisms from past to present. Mol Nutr Food Res. 2012;56(7):1058-72.
187 Katan MB, Grundy SM, Jones P, Law M, Miettinen T, Paoletti R; Stresa Workshop Participants Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc. 2003;78(8):965-78.-188188 Ostlund RE Jr, McGill JB, Zeng CM, Covey DF, Stearns J, Stenson WF, et al. Gastro-intestinal absorption and plasma kinetics of soy D5-phytosterols and phytostanols in humans. Am J Physiol Endocrinol Metab. 2002;282(4):E911-6.
Existe relação inversa entre o consumo habitual de fitoesteróis na dieta e os níveis séricos de colesterol ou de LDL-c. Já a suplementação de 2 g ao dia de fitoesteróis reduziu o CT e o LDL-c em 8,2% e 9,3%, respectivamente,189189 Demonty I, Ras RT, van der Knaap HC, Duchateau GS, Meijer L, Zock PL, et al. Continuous dose-response relationship of the LDL-cholesterol-lowering effect of phytosterol intake. J Nutr. 2009;139(2):271-84.-190190 Williams CL, Bollella MC, Strobino BA, Boccia L, Campanaro L. Plant stanol ester and bran fiber in childhood: effects on lipids, stool weight and stool frequency in preschool children. J Am Coll Nutr. 1999;18(6):572-81. com reduções maiores em crianças e adolescentes (19%), bem como em pacientes com HF. Pode haver redução de TG de 6 a 20%.191191 Plat J, Mensink RP. Plant stanol esters lower serum triacylglycerol concentrations via a reduced hepatic VLDL-1 production. Lipids. 2009;44(12):1149-53.,192192 Demonty I, Ras RT, van der Knaap HC, Meijer L, Zock PL, Geleijnse JM, et al. The effect of plant sterols on serum triglyceride concentrations is dependent on baseline concentrations: a pooled analysis of 12 randomised controlled trials. Eur J Nutr. 2013;52(1):153-60. Considera-se que, em média, o consumo de 2 g ao dia reduza em cerca de 10% o LDL-c, com diminuições maiores quando associado a uma dieta pobre em gorduras saturadas e colesterol.189189 Demonty I, Ras RT, van der Knaap HC, Duchateau GS, Meijer L, Zock PL, et al. Continuous dose-response relationship of the LDL-cholesterol-lowering effect of phytosterol intake. J Nutr. 2009;139(2):271-84.
Em adição às estatinas, os fitosteróis reduzem em 10 a 15% o LDL-c, um efeito superior ao dobro da dose da estatina, geralmente próximo de 6%;193193 Blair SN, Capuzzi DM, Gottlieb SO, Nguyen T, Morgan JM, Cater NB. Incremental reduction of serum total cholesterol and low-density lipoprotein cholesterol with the addition of plant stanol ester-containing spread to statin therapy. Am J Cardiol. 2000;86(1):46-52.
194 Scholle JM, Baker WL, Talati R, Coleman CI. The effect of adding plant sterols or stanols to statin therapy in hypercholesterolemic patients: systematic review and meta-analysis. J Am Coll Nutr. 2009; 28(5):517-24.-195195 Castro Cabezas M, de Vries JH, Van Oostrom AJ, Iestra J, van Staveren WA. Effects of a stanol-enriched diet on plasma cholesterol and triglycerides in patients treated with statins. J Am Diet Assoc 2006;106(10):1564-9. em adição à ezetimiba, foi observada redução adicional de 8% no LDL-c com 2 g ao dia de fitosteróis.196196 Lin X, Racette SB, Lefevre M, Ma L, Spearie CA, Steger-May K, et al. Combined effects of ezetimibe and phytosterols on cholesterol metabolism: a randomized, controlled feeding study in humans. Circulation. 2011;124(5):596-601. Efeitos aditivos a outros hipolipemiantes, como fibratos ou sequestrantes de ácidos biliares, são menos descritos.
O uso de fitosteróis deve ser parte das mudanças de estilo de vida e estão indicados para: Indivíduos com colesterol elevado e que estejam sob risco cardiovascular baixo ou intermediário, que não se qualifiquem para tratamento farmacológico (Grau de Recomendação: IIa; Nível de Evidência: A);2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,197197 Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; ESC Committee for Practice Guidelines (CPG) 2008-2010 and 2010-2012 Committees. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32(14):1769-818. como medida adjunta ao tratamento farmacológico em pacientes que não atingem as metas de LDL-c em tratamento com estatinas (Grau de Recomendação: IIa; Nível de Evidência: A),194194 Scholle JM, Baker WL, Talati R, Coleman CI. The effect of adding plant sterols or stanols to statin therapy in hypercholesterolemic patients: systematic review and meta-analysis. J Am Coll Nutr. 2009; 28(5):517-24. ou sejam intolerantes a estas (Grau de Recomendação: IIa; Nível de Evidência: C);198198 Gylling H, Plat J, Turley S, Ginsberg HN, Ellegård L, Jessup W, et al; European Atherosclerosis Society Consensus Panel on Phytosterols. Plant sterols and plant stanols in the management of dyslipidaemia and prevention of cardiovascular disease. Atherosclerosis. 2014;232(2):346-60. e adultos ou crianças (a partir dos 5 anos) com HF (Grau de Recomendação: IIa; Nível de Evidência: A).198198 Gylling H, Plat J, Turley S, Ginsberg HN, Ellegård L, Jessup W, et al; European Atherosclerosis Society Consensus Panel on Phytosterols. Plant sterols and plant stanols in the management of dyslipidaemia and prevention of cardiovascular disease. Atherosclerosis. 2014;232(2):346-60.,199199 Santos RD, Gagliardi AC, Xavier HT, Casella Filho A, Araújo DB, Cesena FY, et al. Sociedade Brasileira de Cardiologia. I Diretriz Brasileira de Hipercolesterolemia Familiar (HF). Arq Bras Cardiol. 2012;99(2 Supl. 2):1-28.
Os fitosteróis podem ser administrados incorporados a alimentos ou sob a forma de cápsulas, sendo sua eficácia semelhante. Devem ser ingeridos preferencialmente nas refeições, podendo ou não ser fracionados em várias tomadas, sendo seus efeitos observados a partir de 3 a 4 semanas. Em nosso país, estão disponíveis cremes vegetais acrescidos de fitosteróis e cápsulas contendo entre 650 a 900 mg por cápsula, devendo ser consumidas duas colheres de sopa de creme vegetal com fitosteróis, ou duas a três cápsulas de fitosteróis por dia, para obtenção dos efeitos hipolipemiantes, e estar associado a uma alimentação equilibrada e hábitos de vida saudáveis. Pode haver modesta redução nos níveis de vitaminas lipossolúveis (carotenoides), uma condição que pode ser revertida aumentando-se o consumo de vegetais.200200 Noakes M, Clifton P, Ntanios F, Shrapnel W, Record I, McInerney J. An increase in dietary carotenoids when consuming plant sterols or stanols is effective in maintaining plasma carotenoid concentrations. Am J Clin Nutr. 2002;75(1):79-86.
7.4.1. Uso terapêutico dos fitosteróis na infância, gestação e lactação
Os fitosteróis têm sido usados de maneira crescente na prevenção e no tratamento da hipercolesterolemia também em crianças, com redução das concentrações de LDL-c na HF,201201 Gylling H, Siimes MA, Miettinen TA. Sitostanol ester margarine in dietary treatment of children with familial hypercholesterolemia. J Lipd Res. 1995;36(8):1807-12.,202202 De Jongh S, Vissers MN, Rol P, Bakker HD, Kastelein JJ, Stroes ES. Plant sterols lower LDL cholesterol without improving endothelial function in prepubertal children with familial hypercholesterolaemia. J Inherit Metab Dis. 2003;26(4):343-51. hiperlipidemia familiar combinada e em dislipidemias não familiares. Seu uso é seguro e bem tolerado.203203 Guardamagna O, Abello F, Baracco V, Federici G, Bertucci P, Mozzi A, et al. Primary hyperlipidemias in children: effect of plant sterol supplementation on plasma lipids and markers of cholesterol synthesis and absorption. Acta Diabetol. 2011;48(2):127-33. Na HF, metanálise de estudos que incluíram crianças demonstrou redução do CT (7 a 11%) e do LDL-c (10 a 15%).204204 Moruisi KG, Oosthuizen W, Opperman AM. Phytosterols/stanols lower cholesterol concentrations in familial hypercholesterolemic subjects: a systematic review with meta-analysis. J Am Coll Nutr. 2006;25(1):41-8. O Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents205205 Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents; National Heart, Lung, and Blood Institute. Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents: summary report. Pediatrics. 2011;128 Suppl 5:S213-56. recomenda o uso de esteróis/estanóis até 2 g ao dia como uma medida de suporte em crianças com HF.
Os fitosteróis são aprovados para uso pediátrico a partir dos 5 anos no Brasil. A I Diretriz de Brasileira de Hipercolesterolemia Familiar199199 Santos RD, Gagliardi AC, Xavier HT, Casella Filho A, Araújo DB, Cesena FY, et al. Sociedade Brasileira de Cardiologia. I Diretriz Brasileira de Hipercolesterolemia Familiar (HF). Arq Bras Cardiol. 2012;99(2 Supl. 2):1-28. recomenda a ingestão de 1,2 a 1,5 g por dia em crianças portadoras de HF Heterozigótica (HeHF) (Grau de Recomendação: I; Nível de Evidência: A). A European Society of Cardiology (ESC) e EAS orientam o consumo de suplementos contendo fitosteróis em adultos e crianças com dislipidemias.206206 Ras RT, Hiemstra H, Lin Y, Vermeer MA, Duchateau GS, Trautwein EA. Consumption of plant sterol-enriched foods and effects on plasma plant sterol concentrations--a meta-analysis of randomized controlled studies. Atherosclerosis. 2013;230(2):336-46. Poucos estudos testaram o uso de fitosteróis na gestação e lactação,207207 Laitinen K, Isolauri E, Kaipiainen L, Gylling H, Miettinen TA. Plant stanol ester spreads as components of a balanced diet for pregnant and breast-feeding women: evaluation of clinical safety. Br J Nutr. 2009;101(12):1797-804. sendo seu uso recomendado com cautela por este documento.
A ingestão de fitosteróis se acompanha do aumento dos esteróis plasmáticos, no entanto, metanálise demonstra que os níveis circulantes destes esteróis são inferiores a 1% de todos os esteróis.206206 Ras RT, Hiemstra H, Lin Y, Vermeer MA, Duchateau GS, Trautwein EA. Consumption of plant sterol-enriched foods and effects on plasma plant sterol concentrations--a meta-analysis of randomized controlled studies. Atherosclerosis. 2013;230(2):336-46. Na fitosterolemia, seu uso é contraindicado. Os fitosteróis são bem tolerados e não se acompanham de efeitos adversos significativos; no entanto, não existem estudos de desfechos cardiovasculares em longo prazo para demonstrar a existência de benefícios na redução de desfechos cardiovasculares.
7.5. Proteína de soja
O consumo diário de uma a duas porções de alimentos fonte de proteína de soja, totalizando 15 a 30 g de proteína, está associado à redução de 5% de LDL-c, ao aumento de 3% de HDL-c e à redução de 11% na concentração de TG (Grau de Recomendação: IIa; Nível de Evidência: A).208208 Anderson JW, Bush HM. Soy protein effects on serum lipoproteins: a quality assessment and meta-analysis of randomized, controlled studies. J Am Coll Nutr. 2011;30(2):79-91.
7.6. Fibras solúveis
A ação das fibras na redução do colesterol está relacionada ao consumo de fibras solúveis, que formam um gel que se liga aos ácidos biliares no lúmen intestinal, aumentando sua excreção nas fezes e diminuindo sua reabsorção durante o ciclo entero-hepático. Essa redução induz a síntese de novos ácidos biliares, diminuindo o colesterol disponível para incorporação em lipoproteínas. Quanto maior o grau de viscosidade da fibra, maior o efeito de redução do colesterol. Além disto, as fibras solúveis e o amido resistente são fermentados por bactérias presentes no intestino grosso, produzindo ácidos graxos de cadeia curta, que auxiliam na redução dos níveis de colesterol. Em contraste, o consumo de fibras insolúveis não mostra efeitos na redução do colesterol e do risco cardiovascular.209209 Castellanos-Jankiewicz A, Bosque-Plata L, Tejero ME. Combined effect of plant sterols and dietary fiber for treatment of hypercholesterolemia. Plant Foods Hum Nutr. 2014;69(2):93-100.,210210 Chutkan R, Fahey G, Wright WL, McRorie J. Viscous versus nonviscous soluble fiber supplements mechanisms and evidence for fiber specific health benefits. J Am Acad Nurse Pract. 2012;24(8):476-87.
Psyllium é a fibra solúvel mais estudada na redução do colesterol. Uma revisão de estudos indica que doses de 7 a 15 g ao dia estão associadas com uma redução de 5,7% a 20,2% de LDL-c e redução de 2 a 14,8% de CT. O Psyllium parece não afetar significativamente os níveis de HDL-c e TG. Deve-se orientar o consumo fracionado, antes das grandes refeições. Estudos com aveia demonstram resultados semelhantes ao Psyllium, com redução de 5,3 a 5,6% do LDL-c, sem efeitos significativos sobre o HDL-c e os TG. Vale ressaltar que é no farelo de aveia que encontramos os maiores teores de fibras solúveis (betaglucanas). Sugere-se o consumo de aproximadamente 3 g ao dia de betaglucanas.210210 Chutkan R, Fahey G, Wright WL, McRorie J. Viscous versus nonviscous soluble fiber supplements mechanisms and evidence for fiber specific health benefits. J Am Acad Nurse Pract. 2012;24(8):476-87.
A ingestão recomendada mínima de fibras por dia é de 25 g, a fim de proteger contra DCV e câncer (Grau de Recomendação: I; Nível de Evidência: A).210210 Chutkan R, Fahey G, Wright WL, McRorie J. Viscous versus nonviscous soluble fiber supplements mechanisms and evidence for fiber specific health benefits. J Am Acad Nurse Pract. 2012;24(8):476-87.
211 Ministério da Saúde. Coordenação Geral da Política de Alimentação e Nutrição, Departamento de Atenção Básica, Secretaria de Assistência à Saúde. Guia alimentar para a população brasileira: promovendo a alimentação saudável. Brasília; 2006.-212212 Kim Y, Je Y. Dietary fibre intake and mortality from cardiovascular disease and all cancers: a meta-analysis of prospective cohort studies. Arch Cardiovasc Dis. 2016;109(1):39-54.
7.7. Probióticos
Apesar do crescente interesse em investigar o uso de probióticos na colesterolemia, os estudos mostram ausência de seu efeito ou redução muito modesta de concentração plasmática de LDL-c.
Uma metanálise com 485 indivíduos mostrou que a administração de probióticos reduziu em 4,9 mg/dL o LDL-c, em 6,4 mg/dL o CT e em 3,95 mg/dL os TG, sem efeitos sobre o HDL-c.213213 Guo Z, Liu XM, Zhang QX, Shen Z, Tian FW, Zhang H, et al. Influence of consumption of probiotics on the plasma lipid profile: a meta-analysis of randomised controlled trials. Nutr Metab Cardiovasc Dis. 2011;21(11):844-50. Outra metanálise mostrou que a redução de CT em indivíduos tratados com probióticos foi de 7,8 mg/dL e 7,3 mg/dL para LDL-c, quando comparados com o grupo controle. Entre as cepas utilizadas que mostraram reduções significativas estão os Lactobacillus acidophilus, uma mistura de L. acidophilus e Bifidobacterium lactis, e Lactobacillus plantarum. Não houve diferenças significativas para HDL-c e TG.214214 Cho YA, Kim J. Effect of probiotics on blood lipid concentrations: a meta-analysis of randomized controlled trials. Medicine (Baltimore). 2015;94(43):e1714.
É importante ressaltar que cada cepa possui um efeito clínico diferente, sendo a dose usual de 1099 Libby P. Mechanisms of acute coronary syndromes and their implications for therapy. N Engl J Med. 2013;368(21):2004-13. UFC.215215 DiRienzo DB. Effect of probiotics on biomarkers of cardiovascular disease: implications for heart-healthy diets. Nutr Rev. 2014;72(1):18-29. A duração do tratamento também pode afetar os resultados. Uma forte associação foi observada quando o estudo teve duração maior que 8 semanas.214214 Cho YA, Kim J. Effect of probiotics on blood lipid concentrations: a meta-analysis of randomized controlled trials. Medicine (Baltimore). 2015;94(43):e1714.
7.8. Mudanças no estilo de vida
7.8.1. Estratégias de adesão
Praticar saúde vai além de expressões superficiais como: "coma bem", "use álcool com moderação" ou "use escadas e não elevador". São falas politicamente corretas, mas sem a especificidade necessária.216216 Campbell TC, Jacobson H. Whole-rethinking the science of nutrition. Dallas (Texas): Benbella Books; 2014.
Os programas de mudanças no estilo de vida têm se mostrado efetivos no tratamento das DCV.217217 Esselstyn CB Jr. Updating a 12-year experience with arrest and reversal therapy for coronary heart disease (an overdue requiem for palliative cardiology). Am J Cardiol. 1999;84(3):339-41. Um programa que tem demonstrado uma relação de custo e efetividade adequada com reduções significativas em risco cardiovascular é o Coronary Health Improvement Project (CHIP),218218 Diehl HA. Coronary risk reduction through intensive community-based lifestyle intervention: the Coronary Health Improvement Project (CHIP) experience. Am J Cardiol. 1998;82(10B):83T-87T. aplicado por profissionais de saúde em hospitais219219 Merrill RM, Aldana SG. Cardiovascular risk reduction and factors influencing loss to follow-up in the coronary health improvement project. Med Sci Monit. 2008;14(4):PH17-25. e ambientes de trabalho.220220 Aldana SG, Greenlaw R, Diehl HA, Englert H, Jackson R. Impact of the coronary health improvement project (CHIP) on several employee populations. J Occup Environ Med. 2002;44(9):831-9. Apesar do sucesso deste trabalho desde 1987, uma versão deste programa, gravada em vídeo, tem sido aplicada por voluntários treinados e certificados para uma boa relação com os participantes, em suas comunidades.
Em estudo feito para avaliar a efetividade desta prática que aumenta a adesão da população,221221 Rankin P, Morton DP, Diehl H, Gobble J, Morey P, Chang E. Effectiveness of a volunteer- delivered lifestyle modification program for reducing cardiovascular disease risk factors. Am J Cardiol. 2012;109(1):82-6. mudanças significativas em peso, pressão arterial, CT, LDL, TG e glicemia de jejum foram registradas.
7.9. Atividade Física
Evidências acumuladas ao longo das últimas décadas mostram que o exercício físico tem papel muito importante na prevenção e no tratamento de DCV. Ele melhora a estrutura e a função vascular. No endotélio, o exercício físico aumenta a biodisponibilidade de óxido nítrico e diminui a concentração de endotelina (Grau de Recomendação: I; Nível de Evidência: A).222222 Maeda S, Miyauchi T, Kakiyama T, Sugawara J, Iemitsu M, Irukayama-Tomobe Y, et al. Effects of exercise training of 8 weeks and detraining on plasma levels of endothelium-derived factors, endothelin-1 and nitric oxide, in healthy young humans. Life Sci. 2001;69(9):1005-16. O efeito do exercício físico na função endotélio-independente não é comprovado. A resposta vasodilatadora à administração de nitroprussiato de sódio é semelhante em indivíduos treinados e em sedentários.223223 Green DJ, Spence A, Halliwill JR, Cable NT, Thijssen DH. Exercise and vascular adaptation in asymptomatic humans. Exp Physiol. 2011;96(2):57-70. Estes resultados corroboram a ideia de que os efeitos do treinamento físico na função vascular estão relacionados ao endotélio.
Na presença de DCV, há evidências de que o exercício físico praticado regularmente diminui a formação de neoíntima, aumenta a circunferência luminal e provoca angiogênese (Grau de Recomendação: I; Nível de Evidência: A).224224 Laufs U, Werner N, Link A, Endres M, Wassmann S, Jürgens K, et al. Physical training increases endothelial progenitor cells, inhibits neointima formation, and enhances angiogenesis. Circulation. 2004;109(2):220-6. O exercício aumenta a mobilização de células progenitoras do endotélio e a expressão da Óxido Nítrico-Sintase Endotelial (eNOS) (Grau de Recomendação: I; Nível de Evidência: A).224 Esta melhora na vasculatura está associada ao fator de crescimento derivado do endotélio e de fibroblastos. Finalmente, esta conduta não farmacológica reverte a resposta vasoconstritora da artéria coronária à administração de acetilcolina e aumenta o fluxo de reserva coronária à infusão intracoronária de adenosina (Grau de Recomendação: I; Nível de Evidência: A).224224 Laufs U, Werner N, Link A, Endres M, Wassmann S, Jürgens K, et al. Physical training increases endothelial progenitor cells, inhibits neointima formation, and enhances angiogenesis. Circulation. 2004;109(2):220-6.,225225 Möbius-Winkler S, Uhlemann M, Adams V, Sandri M, Erbs S, Lenk K, et al. Coronary collateral growth induced by physical exercise: results of the Leipzig EXerCIse Training versus mEdical management in patients with stable coronary artery disease (EXCITE) Trial. Circulation. 2016;133(15):1438-48.
Em relação aos lípides plasmático, o exercício físico aumenta os níveis de HDL-c (Grau de Recomendação: I; Nível de Evidência: B).226226 Iborra RT, Ribeiro IC, Neves MQ, Charf AM, Lottenberg SA, Negrão CE, et al. Aerobic exercise training improves the role of high-density lipoprotein antioxidant and reduces plasma lipid peroxidation in type 2 diabetes mellitus. Scand J Med Sci Sports. 2008;18(6):742-50. Seus efeitos nos níveis absolutos de LDL-c são menos evidenciados. Entretanto, o exercício físico aumenta a cinética de LDL-c na circulação (Grau de Recomendação: I; Nível de Evidência: B)227227 Vinagre CG, Ficker ES, Finazzo C, Alves MJ, de Angelis K, Irigoyen MC, et al. Enhanced removal from the plasma of LDL-like nanoemulsion cholesteryl ester in trained men compared with sedentary healthy men. J Appl Physiol (1985). 2007;103(4):1166-71. e prolonga o período que o LDL-c permanece na forma reduzida (Grau de Recomendação: I; Nível de Evidência: B).228228 Ribeiro IC, Iborra RT, Neves MQ, Lottenberg SA, Charf AM, Nunes VS, et al. HDL atheroprotection by aerobic exercise training in type 2 diabetes mellitus. Med Sci Sports Exerc. 2008;40(5):779-86.
Os efeitos do exercício físico nos níveis plasmáticos de TG são muito significativos. A redução da concentração plasmática de TG tem sido consistentemente demonstrada (Grau de Recomendação: I; Nível de Evidência: A).229229 Trombetta IC, Batalha LT, Rondon MU, Laterza MC, Kuniyoshi FH, Gowdak MM, et al. Weight loss improves neurovascular and muscle metaboreflex control in obesity. Am J Physiol Heart Circ Physiol. 2003;285(3):H974-82.
O programa de exercício deve começar com uma avaliação clínica e um teste ergoespirométrico progressivo máximo230230 Negrão CE, Barretto AC. Cardiologia do exercício: do atleta ao cardiopata. 3ª. ed. Barueri (SP): Editora Manole; 2010. para avaliar as respostas cardiovasculares e metabólicas em esforço, e a capacidade física. Na impossibilidade de um teste ergoespirométrico, deve ser realizado um teste ergométrico. A sessão deve ter duração de 60 minutos e intensidade entre o limiar aeróbio e o ponto de compensação respiratória, ou 60 a 80% da frequência cardíaca de pico. A frequência deve ser de três a cinco sessões por semana. A sessão de exercício deve incluir aquecimento e alongamento (5 minutos), exercício aeróbio (30 a 40 minutos), exercício de resistência muscular localizada com intensidade menor ou igual a 50% da força de contração voluntária máxima (15 a 20 minutos) e exercícios de alongamento e relaxamento (5 minutos).
7.10. Cessação do tabagismo
A doença aterosclerótica encontra-se relacionada com a disfunção endotelial. A exposição à fumaça do cigarro causa prejuízos à vasodilatação dependente do endotélio em artérias coronárias, assim como em leitos microvasculares.231231 Yugar-Toledo JC, Tanus-Santos JE, Sabha M, Sousa MG, Cittadino M, Tácito LH, et al Uncontrolled hypertension, uncompensated type II diabetes, and smoking have different patterns of vascular dysfunction. Chest. 2004;125(3):823-30.,232232 Ijzerman RG, Serne EH, van Weissenbruch MM, de Jongh RT, Stehouwer CD. Cigarette smoking is associated with an acute impairment of microvascular function in humans. Clin Sci (Lond). 2003;104(3):247-52. A cessação do tabagismo é benéfica em qualquer fase da vida do fumante. A prática clínica233233 Fiore MC, Jaén CR, Baker TB, Bailey WC, Benowitz NL, Curry SJ, et al; 2008 PHS Guideline Update Panel, Liaisons, and Staff. Treating Tobacco Use and Dependence: 2008 update U.S. Public Health Service Clinical Practice Guideline executive summary. Respir Care. 2008;53(9):1217-22. recomenda o uso de farmacoterapia para a cessação do tabagismo em fumantes motivados a parar de fumar. Os medicamentos de primeira linha para a cessação tabágica são a Terapia de Reposição de Nicotina (TRN) com goma ou patch, bupropiona e vareniclina. Estes medicamentos demonstraram eficácia na cessação do tabagismo,233233 Fiore MC, Jaén CR, Baker TB, Bailey WC, Benowitz NL, Curry SJ, et al; 2008 PHS Guideline Update Panel, Liaisons, and Staff. Treating Tobacco Use and Dependence: 2008 update U.S. Public Health Service Clinical Practice Guideline executive summary. Respir Care. 2008;53(9):1217-22. embora algumas vezes surjam questionamentos quanto a segurança do uso em pacientes com DCV. As dúvidas em relação ao uso de TRN, bupropiona e vareniclina foram revistas em metanálise recente e a conclusão é que estes medicamentos não determinam eventos cardiovasculares maiores, como infarto e AVC,234234 Mills EJ, Thorlund K, Eapen S, Wu P, Prochaska JJ. Cardiovascular events associated with smoking cessation pharmacotherapies: a network metaanalysis. Circulation. 2014;129(1):28-41. e que o benefício da cessação é indiscutivelmente impactante na morbimortalidade dos pacientes. Recente estudo avaliou influência destas drogas na frequência cardíaca e na pressão arterial de fumantes portadores de DCV e demostrou que, em monoterapia ou uso combinado, elas não influenciam na frequência cardíaca e na pressão arterial desta população com DCV235235 Silva AP, Scholz J, Abe TO, Pinheiro GG, Gaya PV, Pereira AC, et al. Influence of smoking cessation drugs on blood pressure and heart rate in patients with cardiovascular disease or high risk score: real life setting. BMC Cardiovasc Disord. 2016;16:2. (Grau de Recomendação: I; Nível de Evidência: A).
7.11. Exercício físico e aterosclerose
O sedentarismo destaca-se entre os maiores fatores de risco na mortalidade global.236236 World Health Organization. (WHO). Global recommendations on physical activity for health. Geneva; 2010. A prática regular de exercícios físicos aeróbios é associada a decréscimo da morbidade e mortalidade cardiovascular, comprovadamente reduzindo o risco de evento coronariano fatal e não fatal em indivíduos aparentemente saudáveis, com escore de risco coronariano elevado e também em cardiopatas (Grau de Recomendação: I; Nível de Evidência: A).237237 Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren WM, et al; Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice; European Association for Cardiovascular Prevention and Rehabilitation. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012): The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Atherosclerosis. 2012;223(1):1-68. No contexto da reabilitação cardíaca, o exercício contínuo de moderada intensidade, consensualmente uma forma segura e eficaz de treinamento físico, tem sido considerado prioritário (Grau de Recomendação: I; Nível de Evidência: A).238238 Franklin BA, Lavie CJ, Squires RW, Milani RV. Exercise-based cardiac rehabilitation and improvements in cardiorespiratory fitness: implications regarding patient benefit. Mayo Clin Proc. 2013;88(5):431-7.
Em pacientes com doença coronária aterosclerótica, o exercício físico promove estabilização ou mesmo regressão da aterosclerose (Grau de Recomendação: I; Nível de Evidência: A),239239 Hambrecht R, Niebauer J, Marburger C, Grunze M, Kälberer B, Hauer K, et al. Various intensities of leisure time physical activity in patients with coronary artery disease: effects on cardiorespiratory fitness and progression of coronary atherosclerotic lesions. J Am Coll Cardiol. 1993;22(2):468-77. além de acentuada queda da mortalidade, tanto por causa cardíaca quanto por outras causas (Grau de Recomendação: I; Nível de Evidência: A),240240 Taylor RS, Brown A, Ebrahim S, Jolliffe J, Noorani H, Rees K, et al. Exercise-based rehabilitation for patients with coronary heart disease: systematic review and meta-analysis of randomized controlled trials. Am J Med. 2004;116(10):682-92. existindo uma inversa e independente associação entre HDL-c e DAC, com destaque para a ação protetora de um de seus componentes, a ApoA-I (Grau de Recomendação: I; Nível de Evidência: A).241241 Duffy D, Rader DJ. Update on strategies to increase HDL quantity and function. Nat Rev Cardiol. 2009;6(7):455-63. Entretanto, apesar do exercício proporcionar desfechos clínicos altamente favoráveis, a elevação de HDL-c e as quedas de CT, LDL-c e TG decorrentes de sua ação são modestas, conforme demonstrado em metanálises,242242 Leon AS, Sanchez OA. Response of blood lipids to exercise training alone or combined with dietary intervention. Med Sci Sports Exerc. 2001;33(6Suppl):S502-15. pouco contribuindo para a obtenção das rigorosas metas terapêuticas atualmente propostas.
A explicação para os desfechos clínicos favoráveis proporcionados pelo exercício se dá principalmente pelas modificações funcionais, ocorrendo aprimoramento do funcionamento da HDL e da LDL, com aumento da resistência à oxidação da LDL, indução da produção de paraoxonase, modificações da HDL2 e HDL3, e aumento do efluxo de colesterol.243243 Casella-Filho A, Chagas AC, Maranhão RC, Trombetta IC, Cesena FH, Silva VM, et al. Effect of exercise training on plasma levels and functional properties of high-density lipoprotein cholesterol in the metabolic syndrome. Am J Cardiol. 2011;107(8):1168-72. Em estudo realizado com triatletas, foram constatados decréscimos do CT, VLDL-c, ApoB100 e Lp(a), e elevação do HDL-c imediatamente após uma competição, ocorrendo redução das partículas de LDL-c pequenas e densas (-62%) e aumento de subclasse de HDL-c (+11% HDL2), relacionados inversamente com o risco de DAC. Também foi observado redução das subclasses de HDL-c (-16% HDL3), as quais são positivamente relacionadas com a DAC.244244 Yu HH, Ginsburg GS, O'Toole ML, Otvos JD, Douglas PS, Rifai N. Acute changes in serum lipids and lipoprotein subclasses in triathletes as assessed by proton nuclear magnetic resonance spectroscopy. Arterioscler Thromb Vasc Biol. 1999;19(8):1945-9.
A atividade física de moderada intensidade promove redução sustentada de VLDL-c e TG e atividade de grande volume em significativo aumento do HDL-c, que adquire características que favorecem suas múltiplas ações antiateroscleróticas, com maiores quantidades de exercício proporcionando benefícios mais amplos, sendo, portanto, mais relevante o aumento do volume do que a intensidade (Grau de Recomendação: I; Nível de Evidência: A).245245 Kodama S, Tanaka S, Saito K, Shu M, Sone Y, Onitake F, et al. Effect of Aerobic exercise training on serum levels of high-density lipoprotein cholesterol: a meta-analysis. Arch Intern Med. 2007;167(10):999-1008.,246246 Vaisberg M, Bachi AL, Latrilha C, Dioguardi GS, Bydlowski SP, Maranhão RC. Lipid Transfer to HDL is higher in marathon runners than in sedentary subjects, but is acutely inhibited during the run. Lipids. 2012;47(7):679-86.
Confirmando a importância do tratamento clínico pleno, em estudo de seguimento de 10.043 indivíduos em média durante 10 anos, constatou-se que, embora a aptidão cardiorrespiratória tenha sido preditora independente de risco de morte, com menores taxas de mortalidade conforme se elevava o desempenho em teste ergométrico, o tratamento com estatina proporcionou um acréscimo de benefício em todos os níveis de aptidão, inclusive para os mais aptos, evidenciando a importância do tratamento clínico pleno (Grau de Recomendação: I; Nível de Evidência: B).247247 Kokkinos PF, Faselis C, Myers J, Panagiotakos D, Doumas M. Interactive effects of fitness and statin treatment on mortality risk in veterans with dyslipidaemia: a cohort study. Lancet. 2013;381(9864):394-9.
Um programa de exercícios físicos, que devem ser realizados na maioria dos dias da semana, além dos exercícios aeróbios, deve contemplar exercícios resistidos e de flexibilidade (Grau de Recomendação: I; Nível de Evidência: B).248248 Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Lee IM, et al; American College of Sports Medicine. American College of Sports Medicine position stand. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011;43(7):1334-59. Os exercícios de resistência devem ser executados por grandes grupos musculares, em séries de oito a 15 repetições, com cargas progressivas, suficientes para causar fadiga nas últimas três repetições, porém, sem falha do movimento. Idealmente, devem ser realizados três vezes por semana, enquanto os exercícios para melhorar a flexibilidade devem ser realizados no começo e no final de cada sessão (Grau de Recomendação: I; Nível de Evidência: B).248248 Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Lee IM, et al; American College of Sports Medicine. American College of Sports Medicine position stand. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011;43(7):1334-59.,249249 Herdy AH, López-Jiménez F, Terzic CP, Milani M, Stein R, Carvalho T, et al; Sociedade Brasileira de Cardiologia. South American Guidelines for Cardiovascular Disease Prevention and Rehabilitation. Arq Bras Cardiol. 2014;103(2Supl.1):1-31. Os exercícios aeróbios devem ser realizados pelo menos três vezes por semana, em sessões de 30 a 60 minutos de duração.
Na ausência de teste ergométrico, a intensidade do exercício pode ser controlada subjetivamente pela percepção de esforço e, objetivamente, pela ventilação pulmonar, sendo a atividade considerada predominantemente aeróbia quando o indivíduo que caminha ou corre, por exemplo, permanece apenas discretamente ofegante, conseguindo falar frases completas sem interrupções, inspirando no decorrer de duas ou três passadas e expirando no decorrer de uma ou duas passadas. O mesmo vale para as outras modalidades: ciclismo, natação, dança etc. Assim, se houver uma atividade prolongada, realizada com a participação de grandes grupos musculares, em que o individuo permanece confortável, podendo sincronizar o movimento do corpo com a ventilação pulmonar, pode-se dizer que existe uma participação predominante do metabolismo aeróbio (Grau de Recomendação: I; Nível de Evidência: A).250250 Fletcher GF, Balady GJ, Amsterdam EA, Chaitman B, Eckel R, Fleg J, et al. Exercise standards for testing and training: a statement for healthcare professionals from the American Heart Association. Circulation. 2001;104(14):1694-740.
Caso esteja disponível um teste ergométrico realizado na vigência da medicação cardiovascular de uso contínuo, pode ser determinada a intensidade a partir da frequência cardíaca pico do teste ergométrico, conforme propõe o American College of Sports Medicine:248248 Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Lee IM, et al; American College of Sports Medicine. American College of Sports Medicine position stand. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011;43(7):1334-59. para atividades leves e/ou leves a moderadas, 50 a 70% da frequência cardíaca pico do teste ergométrico considerado máximo; para atividades moderadas, 70 a 85% da frequência cardíaca pico, sendo recomendada para treinamento dos que já estão bem adaptados à prática de exercícios físicos; para atividades moderadas a intensas e/ou intensas, acima de 85% da frequência cardíaca pico, sendo situação em que existe participação cada vez mais expressiva do metabolismo anaeróbio, com pequenos incrementos da intensidade.
A prescrição da intensidade do exercício aeróbio a partir do teste ergométrico cardiopulmonar é considerado o padrão-ouro (Grau de Recomendação: I; Nível de Evidência: A).251251 Carvalho T, Benetti M, Mara LS. Teste cardiopulmonar: visão para o clinico. Procardiol. Programa de Atualização. 2012;8:31-51. Neste caso, deve ser considerada a classificação baseada nos limiares ventilatórios: para atividades aeróbias leves, intensidade abaixo do primeiro limiar ventilatório (limiar anaeróbio); para atividades aeróbias moderadas, intensidade entre o primeiro limiar (limiar anaeróbio) e o segundo limiar ventilatório (ponto de compensação respiratória), sendo considerada a zona alvo ideal do treinamento, visando ao aumento da aptidão cardiorrespiratória, no contexto da prevenção e do tratamento das DCV e metabólicas; para atividades aeróbias vigorosas, intensidade em torno ou acima do ponto de compensação respiratória, exigindo, por vezes, que a atividade seja intervalada.
8. Tratamento Farmacológico das Dislipidemias
A decisão para o início da terapia medicamentosa das dislipidemias depende do:
- Risco cardiovascular do paciente: em pacientes de muito alto ou alto risco cardiovascular,2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,4545 Catapano AL, Reiner Z, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; European Society of Cardiology (ESC).; European Atherosclerosis Society (EAS). ESC/EAS guidelines for the management of dyslipidaemias the task force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis. 2011;217(1):3-46.,106106 Stone NJ, Robinson J, Lichtenstein AH, Goff DC Jr, Lloyd-Jones DM, Smith SC Jr, et al; 2013 ACC/AHA Cholesterol Guideline Panel. Treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: synopsis of the 2013 ACC/AHA cholesterol guideline. Ann Intern Med. 2014;160(5):339-43. o tratamento da dislipidemia deve incluir medicamentos já em associação com as modificações do estilo de vida a serem propostas. Para os pacientes de risco moderado ou baixo, o tratamento será iniciado apenas com as medidas do estilo de vida, com a associação, em uma segunda etapa, de medicamentos, se necessário, para obtenção das metas definidas do LDL-c. O tempo de reavaliação após a implantação das medidas de modificações do estilo de vida pode ser de 3 a 6 meses.
- Tipo de dislipidemia presente: define a escolha da classe terapêutica.
Os medicamentos hipolipemiantes costumam ser divididos nos que agem predominantemente nas taxas séricas de colesterol e naqueles que agem predominantemente nas taxas de TG.
8.1. Medicamentos com ação predominante na colesterolemia
Na hipercolesterolemia isolada, os medicamentos recomendados são as estatinas, que podem ser administradas em associação à ezetimiba, à colestiramina e, eventualmente, aos fibratos ou ao ácido nicotínico.
8.1.1. Estatinas
Até o presente, a redução do LDL-c por inibidores da HMG-CoA redutase ou pelas estatinas permanece a terapia mais validada por estudos clínicos para diminuir a incidência de eventos cardiovasculares. A depleção intracelular de colesterol estimula a liberação de fatores transcricionais e, consequentemente, a síntese e a expressão na membrana celular de receptores para captação do colesterol circulante, como o LDLR. Assim, a ação das estatinas pode potencialmente influenciar em todo conjunto das lipoproteínas circulantes que interagem com o LDLR, como a LDL, a VLDL e os remanescentes de quilomícrons. Em metanálise com 170 mil pacientes e 26 estudos clínicos, para cada 40 mg/dL de redução do LDL-c com estatinas, ocorreu diminuição da mortalidade por todas as causas em 10%, refletindo, em grande parte, a redução no número de mortes por DAC (−20%).112112 Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170?000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81. Os estudos mostram redução também dos eventos isquêmicos coronários agudos, da necessidade de revascularização do miocárdio e do AVC.
Com base nestas evidências, o uso de estatina está indicado em terapias de prevenção primária e secundária como primeira opção (Grau de Recomendação: I; Nível de Evidência: A).
A redução do LDL-c varia entre as estatinas, e esta diferença está fundamentalmente relacionada à dose inicial, conforme Figura 2. A cada vez que dobramos a dose de qualquer uma destas estatinas, a redução média adicional do LDL-c é de 6 a 7 %.
Reduções do colesterol da lipoproteína de baixa densidade com as estatinas e as doses disponíveis no mercado nacional.
Embora estudos mostrem diferenças na potência das estatinas quanto à sua capacidade de levar à redução do LDL-c, todas foram capazes, em estudos clínicos randomizados, de reduzir eventos e mortes cardiovasculares. Assim, esta atualização recomenda que seja empregada a estatina que estiver disponível no serviço, procurando-se atingir as metas terapêuticas recomendadas, com o ajuste de doses e a eventual associação de fármacos.
As estatinas reduzem os TG, em geral, tanto mais quanto maior sua capacidade de reduzir o LDL-c. Com relação à HDL-c, as estatinas podem elevar suas taxas, mas, em geral, com pequeno aumento porcentual. No entanto, nos estudos de prevenção primária ou secundária com estatinas, a variação do HDL-C ou TG não influenciou na redução de eventos cardiovasculares.
Efeitos colaterais são raros no tratamento com estatinas. Dentre estes, os efeitos musculares são os mais comuns e podem surgir em semanas ou anos após o início do tratamento. Variam desde mialgia, com ou sem elevação da Creatinoquinase (CK), até a rabdomiólise. A dosagem de CK deve ser avaliada no início do tratamento, principalmente em indivíduos de alto risco de eventos adversos musculares, como pacientes com antecedentes de intolerância à estatina; indivíduos com antecedentes familiares de miopatia; o uso concomitante de fármacos que aumentem o risco de miopatia. A dosagem rotineira de CK não é recomendada em pacientes já em uso de estatina, exceto se ocorrerem sintomas musculares (dor, sensibilidade, rigidez, câimbras, fraqueza e fadiga localizada ou generalizada), introdução de fármacos que possam interagir com estatina ou quando se eleva a dose desta (Grau de Recomendação: IIa; Nível de Evidência: B).
A avaliação basal das enzimas hepáticas (ALT e AST) deve ser realizada antes do início da terapia com estatina. Durante o tratamento, deve-se avaliar a função hepática quando ocorrerem sintomas ou sinais sugerindo hepatotoxicidade (fadiga ou fraqueza, perda de apetite, dor abdominal, urina escura ou aparecimento de icterícia) (Grau de Recomendação: IIa; Nível de Evidência: B).
8.1.2. Ezetimiba
A ezetimiba inibe a absorção de colesterol na borda em escova do intestino delgado, atuando seletivamente nos receptores NPC1-L1 e inibindo o transporte intestinal de colesterol. A inibição da absorção de colesterol (em grande parte do colesterol biliar) leva à diminuição dos níveis de colesterol hepático e ao estímulo à síntese de LDLR, com consequente redução do nível plasmático de LDL-c de 10 a 25%. Em comparação com placebo, a ezetimiba associada à estatina reduziu eventos cardiovasculares em pacientes com estenose aórtica degenerativa252252 Rossebo AB, Pedersen TR, Boman K, Brudi P, Chambers JB, Egstrup K, et al; SEAS Investigators. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med. 2008;359(13):1343-56. e doença renal crônica.253253 Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377(9784):2181-92. Em comparação com monoterapia com sinvastatina, o estudo IMPROVE-IT mostrou redução significativa de eventos cardiovasculares após síndrome coronária aguda com uso da associação estatina e ezetimiba.113113 Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al; IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372(25):2387-97.
A ezetimiba isolada constitui opção terapêutica em pacientes que apresentam intolerância às estatinas. A ezetimiba associada a doses toleradas de estatina é uma alternativa em pacientes que apresentam efeitos adversos com doses elevadas de estatina (Grau de Recomendação: IIa; Nível de Evidência: C).
Em pequenos estudos, o tratamento com ezetimiba reduziu esteatose hepática não alcoólica.254254 Park H, Shima T, Yamaguchi K, Mitsuyoshi H, Minami M, Yasui K, et al. Efficacy of long-term ezetimibe therapy in patients with nonalcoholic fatty liver disease. J Gastroenterol. 2011;46(1):101-7. No entanto, o benefício clínico deste efeito ainda requer investigação em ensaios dimensionados para avaliar desfechos clínicos (Grau de Recomendação: IIb; Nível de Evidência: C).
A ezetimiba é empregada na dose única de 10 mg ao dia. Pode ser administrada a qualquer hora do dia, com ou sem alimentação, não interferindo na absorção de gorduras e vitaminas lipossolúveis. Raros efeitos colaterais têm sido apontados e estão em geral relacionados com o trânsito intestinal. Por precaução, recomenda-se que ela não seja utilizada em casos de dislipidemia com doença hepática aguda.
8.1.3. Resinas
As resinas, ou sequestradores dos ácidos biliares, atuam reduzindo a absorção enteral de ácidos biliares. Como resultado, ocorre depleção do colesterol celular hepático, estimulando a síntese de LDLR e de colesterol endógeno. Como consequência deste estímulo à síntese, pode ocorrer aumento da produção de VLDL e, consequentemente, de TG plasmáticos.
Três resinas foram desenvolvidas: a colestiramina, o colestipol e o colesevelam. No entanto, no Brasil, somente a colestiramina está disponível. Esta resina foi testada no estudo LRC-CPPT (Lipid Research Clinics Coronary Prevention Trial),255255 The Lipid Research Clinics Coronary Primary Prevention Trial results. I. Reduction in incidence of coronary heart disease. JAMA. 1984;251(3):351-64. cujo desfecho primário combinado de morte por doença coronária e infarto do miocárdio foi reduzido em 19%. Em adição às estatinas, não existe estudo clínico que comprove benefício adicional.
Assim, a adição de colestiramina ao tratamento com estatinas pode ser recomendada quando a meta de LDL-c não é obtida apesar do uso de estatinas potentes em doses efetivas (Grau de Recomendação: IIa; Nível de Evidência: C). A redução do LDL-c é dose-dependente e pode variar de 5% a 30% nas doses de 4 a 24 g ao dia. Devem ser administradas longe de outros medicamentos, pois podem interferir na absorção de muitos deles. Recomenda-se que sejam tomados os remédios rotineiros 1 hora antes da tomada da colestiramina e/ou 4 horas depois desta.
Por não ser absorvida para a circulação sistêmica, tem sido recomendada para crianças hipercolesterolêmicas, isoladamente ou em associação com estatinas, e é o único fármaco liberado para mulheres no período reprodutivo sem método anticoncepcional efetivo, e durante os períodos de gestação e amamentação (Grau de Recomendação: IIa; Nível de Evidência: A).
A colestiramina (único inibidor disponível no Brasil) é apresentada em envelopes de 4 g. A posologia inicial é de 4 g ao dia, podendo-se atingir, no máximo, 24 g ao dia. Posologias superiores a 16 g ao dia são dificilmente toleradas. A apresentação na forma light pode melhorar sua tolerância, mas contém fenilalanina, o que restringe seu uso em portadores de fenilcetonúria.
Os principais efeitos colaterais relacionam-se ao aparelho digestivo, por interferir na motilidade intestinal: obstipação (particularmente em idosos), plenitude gástrica, náuseas e meteorismo, além de exacerbação de hemorroidas preexistentes. Raramente, pode ocorrer obstrução intestinal e acidose hiperclorêmica em idosos e crianças, respectivamente. Diminui, eventualmente, a absorção de vitaminas lipossolúveis (A, D, K e E) e de ácido fólico. A suplementação destes elementos em crianças ou, eventualmente, em adultos pode ser necessária. Entre os efeitos bioquímicos, é possível o aumento dos níveis de TG, secundário ao estímulo à síntese hepática de VLDL. Como consequência, seu uso deve ser evitado na hipertrigliceridemia, particularmente se houver níveis acima de 400 mg/dL.
8.2. Medicamentos que atuam predominantemente nos triglicérides
No tratamento da hipertrigliceridemia isolada são prioritariamente indicados os fibratos e, em segundo lugar, o ácido nicotínico ou a associação de ambos. Pode-se ainda utilizar, nesta dislipidemia, os ácidos graxos ômega 3, isoladamente ou em associação com outros fármacos. Na hiperlipidemia mista, a taxa sérica de TG deve orientar como o tratamento farmacológico será iniciado. Caso estas taxas estejam acima de 500 mg/dL, deve-se iniciar o tratamento com um fibrato, adicionando-se, se necessário, ácido nicotínico e/ou ômega 3. Nesta situação, a meta prioritária é a redução do risco de pancreatite.
Após reavaliação, caso haja a necessidade de redução adicional da colesterolemia, pode-se adicionar uma estatina e/ou outros redutores da colesterolemia. Nestes casos, o uso do genfibrozila deve ser evitado nas associações de fibratos e estatinas. Caso as taxas de TG estejam abaixo de 500 mg/dL, deve-se iniciar o tratamento com uma estatina isoladamente e, se necessário, associando-se a ezetimiba, priorizando-se a meta de LDL-c ou não HDL-c.
8.2.1. Fibratos
São fármacos derivados do ácido fíbrico que agem estimulando os receptores nucleares denominados "Receptores Alfa Ativados da Proliferação dos Peroxissomas" (PPAR-α). Este estímulo leva ao aumento da produção e da ação da LPL, responsável pela hidrólise intravascular dos TG, e à redução da ApoC-III, responsável pela inibição da LPL.
O estímulo do PPAR-α pelos fibratos também leva a maior síntese da ApoA-I e, consequentemente, de HDL. Reduz as taxas séricas de TG de 30 a 60%. No entanto, a redução deve ser mais pronunciada quanto maior o valor basal da trigliceridemia. Aumentam o HDL-c de 7 a 11%. Sua ação sobre o LDL-c é variável, podendo diminuí-lo, não o modificar ou até aumentá-lo. Parecem ter efeitos pleiotrópicos, mas não se conhece a relevância clínica dos mesmos. Na tabela 7 estão descritos os fibratos disponíveis e seus respectivos efeitos no perfil lipídico.
Os estudos clínicos disponíveis demonstraram resultados inconsistentes com relação ao benefício da monoterapia com fibrato na redução dos eventos cardiovasculares. Em metanálise com 18 estudos e 45.058 participantes, a terapia com fibratos reduziu o risco relativo de eventos cardiovasculares em 10%, eventos coronários em 13%, sem benefício em mortalidade cardiovascular (Grau de Recomendação: IIa; Nível de Evidência: B).256256 Jun M, Foote C, Lv J, Neal B, Patel A, Nicholls SJ, et al. Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet. 2010;375(9729):1875-84. Análises retrospectivas destes estudos indicaram haver benefício maior quando foram selecionados pacientes com TG plasmáticos elevados (> 204 mg/dL) e HDL-c baixo (< 34 mg/dL). No entanto, esta informação requer confirmação em estudos prospectivos.
Os efeitos do fenofibrato sobre a doença microvascular do paciente com diabetes melito tipo 2 foram examinados em dois grandes estudos257257 Keech A, Simes RJ, Barter P, Best J, Scott R, Taskinen MR, et al; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet. 2005;366(9500):1849-61.,258258 Group AS, Ginsberg HN, Elam MB, Lovato LC, Crouse JR 3rd, Leiter LA, et al; ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med. 2010;362(17):1563-74. Erratum in: N Engl J Med. 2010;362(18):1748. de forma isolada ou associado com a sinvastatina. O tratamento reduziu a incidência e a progressão da retinopatia, diminuiu micro e macroalbuminúria, e retardou a perda de função renal. Além disso, diminuiu as amputações, principalmente distais.
Os fibratos são indicados no tratamento da hipertrigliceridemia endógena quando houver falha das medidas não farmacológicas. Quando os TG forem muito elevados (> 500 mg/dL) são recomendados, inicialmente, junto das medidas não farmacológicas (Grau de Recomendação: I; Nível de Evidência: A) e no tratamento da dislipidemia mista com predomínio de hipertrigliceridemia (Grau de Recomendação IIa; Nível de Evidência: B).
É infrequente a ocorrência de efeitos colaterais graves durante tratamento com fibratos, levando à necessidade da interrupção do tratamento. Podem ocorrer: distúrbios gastrintestinais, mialgia, astenia, litíase biliar (mais comum com clofibrato), diminuição de libido, erupção cutânea, prurido, cefaleia e perturbação do sono. Raramente, observa-se aumento de enzimas hepáticas e/ou CK, também de forma reversível com a interrupção do tratamento. Casos de rabdomiólise têm sido descritos com o uso da associação de estatinas com gemfibrozila. Recomenda-se, por isso, evitar esta associação. Recomenda-se também cautela nas seguintes condições clínicas: portadores de doença biliar; uso concomitante de anticoagulante oral, cuja posologia deve ser ajustada; pacientes com função renal diminuída; e associação com estatinas.
8.2.2. Ácido nicotínico (niacina)
O ácido nicotínico reduz a ação da lipase tecidual nos adipócitos, levando à menor liberação de ácidos graxos livres para a corrente sanguínea. Como consequência, reduz-se a síntese de TG pelos hepatócitos. Reduz ainda o LDL-c em 5 a 25%; aumenta o HDL-c em 15 a 35%; e diminui o TG em 20 a 50%.
O Coronary Drug Project,259259 Clofibrate and niacin in coronary heart disease. JAMA. 1975;231(4):360-81. realizado na década de 1970, demonstrou que o tratamento com niacina em sua forma cristalina pode reduzir a incidência de eventos cardiovasculares. Em formulações mais toleráveis, como as formas estendidas, o tratamento com niacina reduziu a espessura íntima-média, mesmo em pacientes em uso de estatinas. Em dois estudos clínicos recentes, no entanto, a adição de niacina ao tratamento eficaz com estatinas, com ou sem ezetimiba, para meta de LDL-c < 70 mg/dL, não adicionou benefício algum.260260 Boden WE, Probstfield JL, Anderson T, Chaitman BR, Desvignes-Nickens P, Koprowicz K, et al; AIM-HIGH Investigators. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011;365(24):2255-67.,261261 Haynes R, Jiang L, Hopewell JC, Li J, Chen F, Parish S, et al; HPS2-THRIVE Collaborative Group.. HPS2-THRIVE randomized placebo-controlled trial in 25 673 high-risk patients of ER niacin/laropiprant: trial design, pre-specified muscle and liver outcomes, and reasons for stopping study treatment. Eur Heart J. 2013;34(17):1279-91. Em ambos os estudos, a taxa de interrupção do tratamento por efeitos colaterais foi de cerca de 25%. Assim, não há evidência de benefício com este fármaco em indivíduos com LDL-c controlado (Grau de Recomendação: III; Nível de Evidência: A).
O ácido nicotínico pode, excepcionalmente, ser utilizado em pacientes com HDL-C baixo isolado, mesmo sem hipertrigliceridemia associada, e como alternativa aos fibratos e estatinas ou em associação com esses fármacos em portadores de hipercolesterolemia, hipertrigliceridemia ou dislipidemia mista (Grau de Recomendação: IIa; Nível de Evidência: A). Devido a menor tolerabilidade com a forma de liberação imediata (rubor e prurido) e à descrição de hepatotoxicidade com a forma de liberação lenta, tem sido preconizado seu uso na forma de liberação intermediária, com melhor perfil de tolerabilidade. Como os efeitos adversos relacionados ao rubor facial ou prurido ocorrem com maior frequência no início do tratamento, recomenda-se dose inicial de 500 mg ao dia com aumento gradual − em geral para 750 mg e, depois, para 1.000 mg, com intervalos de 4 semanas a cada titulação de dose, buscando-se atingir 1 a 2 g diárias. O pleno efeito sobre o perfil lipídico apenas é atingido com o decorrer de vários meses de tratamento. Com a forma de liberação intermediária e o uso de doses atualmente mais baixas de niacina, outros efeitos como alterações gastrintestinais, hiperglicemia e hiperuricemia tornaram-se mais raros.
8.2.3. Ácidos graxos ômega 3
Ácidos graxos ômega 3 são poli-insaturados derivados dos óleos de peixes e de certas plantas e nozes. O óleo de peixe contém tanto o ácido DHA quanto o ácido EPA,155155 Wang C, Harris WS, Chung M, Lichtenstein AH, Balk EM, Kupelnick B, et al. n-3 Fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr. 2006;84(1):5-17. mas os óleos de origem vegetal contêm predominantemente o ácido ALA. Em altas doses (4 a 10g ao dia), reduzem os TG e aumentam discretamente o HDL-c, podendo, entretanto, aumentar o LDL-c. Seus efeitos no perfil lipídico são dose-dependentes e resultam de uma variedade de mecanismos, entre os quais a diminuição da produção de VLDL e o aumento de seu catabolismo.262262 Harris WS, Miller M, Tighe AP, Davidson MH, Schaefer EJ. Omega-3 fatty acids and coronary heart disease risk: clinical and mechanistic perspectives. Atherosclerosis. 2008;197(1):12-24.
A administração de ômega 3 (EPA + DHA) reduziu mortalidade e desfechos coronários em estudos de prevenção secundária (Grau de Recomendação: IIa; Nível de Evidência: A).263263 Marchioli R, Barzi F, Bomba E, Chieffo C, Di Gregorio D, Di Mascio R, et al; GISSI-Prevenzione Investigators. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardico (GISSI)-Prevenzione. Circulation. 2002;105(16):1897-903.,264264 Yokoyama M, Origasa H, Matsuzaki M, Matsuzawa Y, Saito Y, Ishikawa Y, et al; Japan EPA lipid intervention study (JELIS) Investigators. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open-label, blinded endpoint analysis. Lancet. 2007;369(9567):1090-8. Entretanto, nos anos mais recentes, com maior emprego de estatinas, não foram evidenciados benefícios na DCV, sendo recomendado seu uso principalmente como adjunto da terapia das hipertrigliceridemias.
Outra fonte de ácidos graxos ômega 3 é o óleo de krill. Processado do krill da Antártida (Euphausia superba), um crustáceo semelhante ao camarão, da superordem Eucarida, encontrado nos mares do Sul, o óleo de krill é uma fonte singular de EPA e DHA, pois a maior parte dos ácidos graxos ômega 3 ocorre naturalmente em fosfolípides e não na forma de TG, com uma razão da biodisponibilidade dos ácidos graxos ômega 3 de krill para os ácidos graxos ômega 3 marinhos da ordem de 2:1.
Por ser hidrossolúvel, o óleo de krill apresenta melhor digestibilidade, minimizando o odor residual de peixe. Vale ressaltar que o krill não tem o risco de contaminação por mercúrio.265265 Berge K, Musa-Veloso K, Harwood M, Hoem N, Burri L. Krill oil supplementation lowers triglycerides without increasing low-density lipoprotein cholesterol in adults with borderline high or high triglyceride levels. Nutr Res. 2014;34(2):126-33. Estudo realizado com indivíduos com valores limítrofes ou elevados de TG que receberam óleo de krill de 1,0 a 4,0 g ao dia, por 6 semanas, mostrou redução de 18,6 a 19,9 mg/dL, enquanto com 0,5 g, a redução foi de 13,3 mg/dL.265265 Berge K, Musa-Veloso K, Harwood M, Hoem N, Burri L. Krill oil supplementation lowers triglycerides without increasing low-density lipoprotein cholesterol in adults with borderline high or high triglyceride levels. Nutr Res. 2014;34(2):126-33.
8.3. Novos fármacos
8.3.1. Inibidores da proteína de transferência de ésteres de colesterol
A CETP é responsável pela transferência de ésteres de colesterol da HDL para lipoproteínas que contêm ApoB, em troca equimolar por TG. Como é previsível, a inibição da CETP aumenta a concentração de colesterol na HDL e diminui nas lipoproteínas que contêm ApoB, incluindo VLDL e LDL.
Quatro inibidores da CETP foram desenvolvidos: torcetrapibe, anacetrapibe, dalcetrapibe e evacetrapibe. O torcetrapibe foi o primeiro inibidor da CETP avaliado no estudo ILLUMINATE (Investigation of Lipid Level Management to Understand its Impact in Atherosclerotic Events).116116 Barter PJ, Caulfield M, Eriksson M, Grundy SM, Kastelein JJ, Komajda M, et al; ILLUMINATE Investigators. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med. 2007;357(21):2109-2122. Foi estudada sua associação à terapia intensiva com atorvastatina. O torcetrapibe aumentou o HDL-c em 72% e reduziu o LDL-c em 25%. Apesar dos benefícios nas frações lipídicas, o estudo foi interrompido precocemente pelo aumento de eventos e mortalidade cardiovasculares,266266 Barter P. Lessons learned from the Investigation of Lipid Level Management to Understand its Impact in Atherosclerotic Events (ILLUMINATE) trial. Am J Cardiol. 2009;104(10 Suppl):10E-5E. atribuído aos seus efeitos no sistema renina-angiotensina-aldosterona.267267 Vergeer M, Bots ML, van Leuven SI, Basart DC, Sijbrands EJ, Evans GW, et al. Cholesteryl ester transfer protein inhibitor torcetrapib and off-target toxicity: a pooled analysis of the rating atherosclerotic disease change by imaging with a new CETP inhibitor (RADIANCE) trials. Circulation. 2008;118(24):2515-22. Erratum in: Circulation. 2009;119(5):e197.
A seguir, em 2012, estudo em fase III com dalcetrapibe em pacientes com síndrome coronária aguda foi interrompido pela falta de eficácia clínica, a despeito da elevação de 30% nas concentrações de HDL-c.112112 Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170?000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81. Não houve evidência de danos com este fármaco.
Mais recentemente, o evacetrapibe no estudo ACCELERATE (Impact of the Cholesteryl Ester Transfer Protein Inhibitor Evacetrapib on Cardiovascular Outcome) também falhou em demonstrar benefício clínico em pacientes com alto risco cardiovascular, apesar da grande diferença nas taxas de HDL-c e LDL-c no grupo que recebeu o evacetrapibe quando comparado ao grupo placebo (HDL-c de 104 mg/dL vs. 46 mg/dL no grupo placebo, com diferença de 130%, e LDL-c de 55 mg/dL vs. 84 mg/dL no grupo placebo, com diferença de 37%).268268 Nicholls SJ, Lincoff AM, Barter PJ, Brewer HB, Fox KA, Gibson CM, et al. Assessment of the clinical effects of cholesteryl ester transfer protein inhibition with evacetrapib in patients at high-risk for vascular outcomes: Rationale and design of the ACCELERATE trial. Am Heart J. 2015;170(6):1061-9.
Atualmente, o anacetrapibe é o único inibidor do CETP que permanece em avaliação no estudo REVEAL (Randomized EValuation of the Effects of Anacetrapib Through Lipid-modification) com perspectiva de término para o ano de 2017.269269 Barter P, Rye KA. Cholesteryl ester transfer protein inhibition is not yet dead--Pro. Arteriosclerosis Thromb Vasc Biol. 2016;36(3):439-41.
8.3.2. Inibidores da PCSK-9
Sabe-se que a funcionalidade e o número de LDLR expressos na superfície dos hepatócitos constitui fator determinante dos níveis plasmáticos de LDL. A LDL circulante se liga aos LDLR na superfície do hepatócito, libera seu conteúdo para o endossoma e, posteriormente, o receptor é reciclado de volta à superfície do hepatócito, para captar mais partículas de LDL do plasma. Em condições normais, o LDLR refaz este ciclo aproximadamente 150 vezes, até que seja degradado. A PCSK9 é uma enzima que desempenha um papel importante no metabolismo lipídico, modulando a densidade de LDLR.270270 Lambert G, Sjouke B, Choque B, Kastelein JJ, Hovingh GK. The PCSK9 decade. J Lipid Res. 2012;53(12):2515-24. Sintetizada no núcleo celular e secretada pelos hepatócitos, liga-se aos LDLR na circulação, favorecendo sua degradação.
Estudos realizados6464 Abifadel M, Varret M, Rabès JP, Allard D, Ouguerram K, Devillers M, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003;34(2):154-6. em animais e mutações em seres humanos demonstraram que o ganho de função da PCSK9 ocasionava aumento da degradação dos LDLR com elevações dramáticas nas concentrações de LDL. Em contrapartida, mutações com perda de função da PCSK9 têm o efeito oposto: aumentam a densidade do LDLR na superfície dos hepatócitos com consequente aumento da remoção de partículas de LDL e redução do LDL-c. Assim, a inibição da PCSK9 previne a ligação do LDLR à PCSK9 e a subsequente degradação lisossomal do LDLR, aumentando a densidade de receptor na superfície do hepatócito e a depuração das partículas circulantes de LDL.
Dois inibidores da PCSK9 totalmente humanos foram aprovados no Brasil para comercialização em 2016, o alirocumabe e o evolocumabe. Ambos são aplicados por meio de injeção subcutânea − o alirocumabe a cada 2 semanas, na dose de 75 mg ou 150 mg, enquanto o evolucumab com injeção de 140 mg, a cada 2 semanas, ou 420 mg, uma vez ao mês.
Esta classe farmacológica reduz de forma bastante intensa as concentrações de LDL-c em comparação ao placebo (redução média de 60%). Estudo realizado com evolocumabe271271 Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J, et al; Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372(16):1500-9. demonstrou benefícios significativos também em outras lipoproteínas pró-aterogênicas, com redução de 52% na fração não HDL-c, 47,3% na ApoB, 12,6% nos TG, 25,5% na Lp(a), e aumento do HDL-c e da ApoA1 de 7,0 e 4,2%, respectivamente. O alirocumabe apresentou resposta semelhante no perfil lipídico, com redução significativa no não HDL-c de 52,3%, ApoB de 54%, Lp(a) de 25,6%, TG de 17,3%, e elevação de HDL-c e ApoA1 de 4,6% e 2,9%, respectivamente (p < 0,001 para todas as comparações).272272 Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna M, et al; ODYSSEY LONG TERM Investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372(16):1489-99.
O estudo FOURIER (Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk trial)273273 Sabatine MS, Giugliano RP, Keech A, Honarpour N, Wang H, Liu T, et al. Rationale and design of the Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk trial. Am Heart J. 2016;173:94-101.,274274 Sabatine MS, Giugliano RP, Keech A, Honarpour N, Wiviott SD, Murphy SA, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;Mar 16. [Epub ahead of print] avaliou mais de 27.500 pacientes de muito alto risco (infarto agudo do miocárdio prévio, AVC, ou Doença Arterial Periférica − DAP sintomática) sob tratamento hipolipemiante de alta ou moderada intensidade, com estatinas e/ou ezetimiba, que foram aleatorizados para receber evolocumabe (em um regime de 140 mg a cada 15 dias, ou 420 mg uma vez por mês), ou placebo (a cada 15 dias, ou uma vez por mês), com o objetivo primário de avaliar mortalidade cardiovascular, infarto agudo do miocárdio, AVC, angina instável requerendo hospitalização ou revascularização coronária, e objetivo secundário chave de avaliar morte cardiovascular, infarto agudo do miocárdio ou AVC. Os pacientes foram seguidos por 2,2 anos (mediana), houve redução de 59% no LDL-c comparado ao placebo, partindo de um LDL-c de 92 mg/dL no período basal e alcançando 30 mg/dL aos 48 meses (p < 0,001). Relativo ao placebo, evolocumabe reduziu o desfecho primário em 15% (1.344 pacientes − 9,8% vs. 1.563 pacientes − 11,3%; Hazard Ratio − HR 0,85; Intervalo de confiança de 95% − IC95% 0,79-0,92; p < 0,001) e o desfecho secundário chave em 20% (816 − 5,9% vs. 1.013 − 7,4%; HR: 0.80; IC95%: 0,73-0,88; p < 0,001). Os resultados foram consistentes entre os subgrupos, incluindo aqueles nos quartis inferiores dos valores basais de LDL-c (mediana, 74 mg/dL). Não houve diferenças entre os grupos quanto à ocorrência de eventos adversos (incluindo novos casos de diabetes e eventos neurocognitivos), com exceção de reações no local de injeção, que foram mais frequentes com o evolocumabe (2,1% vs. 1,6%).
Já o estudo ODYSSEY Outcomes (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment With Alirocumab),275275 Schwartz GG, Bessac L, Berdan LG, Bhatt DL, Bittner V, Diaz R, et al. Effect of alirocumab, a monoclonal antibody to PCSK9 on long-term cardiovascular outcomes following acute coronary syndromes rationale and design of the ODISSEY outcomes trial. Am Heart J. 2014;168(5):682-9. com o alirocumabe, avaliará os desfechos cardiovasculares em mais de 18 mil pacientes pós-síndrome coronária aguda com resultado previsto para 2018.
Quanto à indicação dos inibidores da PCSK9 (evolocumabe e alirocumabe) no tratamento das dislipidemias, esta atualização recomenda a utilização somente em pacientes com risco cardiovascular elevado, em tratamento otimizado com estatinas na maior dose tolerada, associado ou não à ezetimiba, e que não tenham alcançado as metas de LDL-c ou não HDL-c recomendadas.
O uso dos inibidores da PCSK9 em geral é seguro e bem tolerado. É descrita a ocorrência de nasofaringite, náuseas, fadiga e aumento da incidência de reações no local da injeção (vermelhidão, prurido, edema ou sensibilidade/dor).
8.3.3. Inibidor da proteína de transferência de triglicérides microssomal
A lomitapida é um fármaco que inibe a MTP, reduzindo a formação de quilomícrons no intestino e VLDL pelo fígado. Pelo fato da VLDL ser um precursor metabólico da LDL, as concentrações plasmáticas de LDL são reduzidas.276276 Hussain MM, Rava P, Walsh M, Rana M, Iqbal J. Multiple functions of microsomal triglyceride transfer protein. Nutr Metab (Lond). 2012;9:14. Está indicado somente nos casos de HF Homozigótica (HoHF), mas seu uso ainda não foi aprovado no Brasil.
A lomitapida é administrada via oral na dose inicial de 5 mg/dia e com dose de manutenção que varia de 5 a 60 mg/dia, sendo que a dose deve ser individualizada de acordo com as metas terapêuticas e com a resposta ao tratamento.
Estudo de fase 3 realizado em 29 pacientes com HoHF, com doses iniciais de 5 mg/dia e tituladas até 60 mg/dia, com mediana de 40 mg/dia, associadas à terapia de base, demonstraram após 26 semanas de seguimento (período de avaliação de eficácia) reduções de 50% no LDL-c e de 49% na ApoB. Foi descrita redução média de 12% no HDL-c nas fases iniciais do tratamento (semana 26), mas que retornaram aos valores basais com a manutenção do tratamento (78 semanas de seguimento).277277 Cuchel M, Meagher EA, du Toit Theron H, Blom DJ, Marais AD, Hegele RA, et al; Phase 3 HoFH Lomitapide Study investigators. Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolaemia: a single-arm, open-label, phase 3 study. Lancet. 2013;381(9860):40-6.
Os efeitos adversos mais comuns são gastrintestinais, como náuseas, flatulência e diarreia. Estes efeitos podem ser minimizados pela redução da ingesta de gordura ou pela titulação escalonada do medicamento.278278 Chandler CE, Wilder DE, Pettini JL, Savoy YE, Petras SF, Chang G, et al. CP-346086: an MTP inhibitor that lowers plasma cholesterol and triglycerides in experimental animals and in humans. J Lipid Res. 2003;44(10):1887-901. Tem sido descrito, em alguns pacientes, aumento das transaminases, em geral reversível com a redução ou a descontinuação do fármaco, ou mesmo, transitório com a manutenção do tratamento. Na maioria das vezes, não foram descritos elevação concomitante das bilirrubinas, fosfatase alcalina e nem surgimento de sintomas.
Por seu próprio mecanismo de ação, estudos com ressonância magnética em pacientes com HoHF demonstraram acúmulo de gordura hepática. Porém, o acúmulo de gordura no fígado varia de paciente para paciente, mas é acentuado pelo consumo de álcool. Os efeitos deste acúmulo de gordura em longo prazo, decorrentes desta intervenção medicamentosa, não são conhecidos.
Apesar de a MTP estar envolvida na absorção de vitaminas lipossolúveis estudos não demonstraram nenhum efeito significativo do tratamento com lomitapida sobre os níveis plasmáticos de vitaminas A e D.278278 Chandler CE, Wilder DE, Pettini JL, Savoy YE, Petras SF, Chang G, et al. CP-346086: an MTP inhibitor that lowers plasma cholesterol and triglycerides in experimental animals and in humans. J Lipid Res. 2003;44(10):1887-901. Lomitapida reduz os níveis plasmáticos de vitamina E, que é transportada principalmente por LDL. No entanto, portadores de HF têm níveis altos de vitamina E e, mesmo após o tratamento com lomitapida, as taxas desta vitamina ficaram dentro ou acima do normal.
Vale salientar que, pelo fato da lomitapida ser amplamente metabolizada pelo CYP3A4, deve-se ter precaução com sua coadministração com inibidores do CYP3A4 (antifúngicos, diltiazem, verapamil, antibióticos como ciprofloxacino, claritromicina e eritromicina, e os inibidores da protease). O uso associado da lomitapida 60 mg/dia com a sinvastatina 40 mg/dia aumentou a exposição a sinvastatina em 1,7 vez comparada a sinvastatina isolada, aumentando o risco de efeito colateral pela sinvastatina.279279 Tuteja S, Duffy D, Dunbar RL, Movva R, Gadi R, Bloedon LT, et al. Pharmacokinetic interactions of the microsomal triglyceride transfer protein inhibitor, lomitapide, with drugs commonly used in the management of hypercholesterolemia. Pharmacotherapy. 2014;34(3):227-39. Em contrapartida, estudos com outros hipolipemiantes não demonstraram interações significativas.
8.3.4. Inibidores da síntese de apolipoproteína B (antissenso anti-ApoB)
O antissenso da ApoB é indicado em portadores de HoHF. Ainda não aprovado no Brasil, o mipomersen, único representante da classe, é administrado por via subcutânea e consiste de oligonucleotídeos que atingem o núcleo do hepatócito e se hibridizam ao RNA mensageiro da ApoB, formando um RNA de fita dupla, que é reconhecido e degradado por uma Ribonuclease H RNase H e, portanto, impede a formação (tradução) da proteína (ApoB).280 280 Goldberg AC. Novel therapies and new targets of treatment for familial hypercholesterolemia. J Clin Lipidol. 2010;4(5):350-6.Além de reduzir a formação de VLDL, os produtos de sua metabolização também são reduzidos, como IDL, LDL e Lp(a).22 Raal FJ, Santos RD, Blom DJ, Marais AD, Charng MJ, Cromwell WC, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998-1006.,281281 Santos RD, Raal FJ, Catapano AL, Witztum JL, Steinhagen-Thiessen E, Tsimikas S. Mipomersen, an antisense oligonucleotide to apolipoprotein B-100, reduces lipoprotein(a) in various populations with hypercholesterolemia: results of 4 phase III trials. Arterioscler Thromb Vasc Biol. 2015;35(3):689-99.
Estudos fase 3 mostraram que a eficácia do produto é bastante variável, com reduções de 25 a 37%, em média, dependendo das características das populações estudadas (formas homozigóticas ou heterozigóticas da HF, hipercolesterolemias graves ou pacientes de alto risco cardiovascular). Eventos adversos são comuns, principalmente reações no local de aplicação, aumento de enzimas hepáticas e esteatose, que, em geral, declinam com o tempo de uso do fármaco, mas outro evento adverso comum, os sintomas de resfriado, tende a persistir mesmo em longo prazo.22 Raal FJ, Santos RD, Blom DJ, Marais AD, Charng MJ, Cromwell WC, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998-1006.,281281 Santos RD, Raal FJ, Catapano AL, Witztum JL, Steinhagen-Thiessen E, Tsimikas S. Mipomersen, an antisense oligonucleotide to apolipoprotein B-100, reduces lipoprotein(a) in various populations with hypercholesterolemia: results of 4 phase III trials. Arterioscler Thromb Vasc Biol. 2015;35(3):689-99.
8.3.5. Inibidores da síntese de apolipoproteína C-III (antissenso anti-ApoC-III)
A ApoC-III é um importante modulador do metabolismo das lipoproteínas e possui um papel crucial regulando as concentrações de TG plasmáticas. É sintetizada principalmente pelo fígado e é um componente das lipoproteínas ricas em TG.282282 Ooi EM, Barrett PH, Chan DC, Watts GF. Apolipoprotein C-III: understanding an emerging cardiovascular risk factor. Clin Sci (Lond). 2008;114(10):611-24. A ApoC-III inibe a hidrólise de TG mediada pela LPL e prejudica a captação hepática dos remanescentes de lipoproteínas ricas em TG.283283 Ginsberg HN, Le NA, Goldberg IJ, Gibson JC, Rubinstein A, Wang-Iverson P, et al. Apolipoprotein B metabolism in subjects with deficiency of apolipoproteins CIII and AI. Evidence that apolipoprotein CIII inhibits catabolism of triglyceride-rich lipoproteins by lipoprotein lipase in vivo. J Clin Invest. 1986;78(5):1287-95.,284284 Mendivil CO, Zheng C, Furtado J, Lel J, Sacks FM. Metabolism of very-low-density lipoprotein and low-density lipoprotein containing apolipoprotein C-III and not other small apolipoproteins. Arterioscler Thromb Vasc Biol. 2010;30(2):239-45. Erratum in: Arterioscler Thromb Vasc Biol. 2010;30(9):e171. Em altas concentrações, a ApoC-III inibe a atividade da LPL, enzima que participa do catabolismo das lipoproteínas ricas em TG e no remodelamento das HDL.283283 Ginsberg HN, Le NA, Goldberg IJ, Gibson JC, Rubinstein A, Wang-Iverson P, et al. Apolipoprotein B metabolism in subjects with deficiency of apolipoproteins CIII and AI. Evidence that apolipoprotein CIII inhibits catabolism of triglyceride-rich lipoproteins by lipoprotein lipase in vivo. J Clin Invest. 1986;78(5):1287-95. Concentrações elevadas de ApoC-III no plasma comprometem não só a lipólise, como a remoção da circulação das lipoproteínas ricas em TG, com acúmulo de lipoproteínas aterogênicas, sendo consideradas fator de risco independente para a DAC, especialmente quando a ApoC-III está contida em lipoproteínas que contêm ApoB.284284 Mendivil CO, Zheng C, Furtado J, Lel J, Sacks FM. Metabolism of very-low-density lipoprotein and low-density lipoprotein containing apolipoprotein C-III and not other small apolipoproteins. Arterioscler Thromb Vasc Biol. 2010;30(2):239-45. Erratum in: Arterioscler Thromb Vasc Biol. 2010;30(9):e171. Variantes genéticas da ApoC-III com perda de função e concentrações reduzidas de ApoC-III no plasma são associadas com risco reduzido de DAC,285285 Jorgensen AB, Frikke-Schmidt R, Nordestgaard BG, Tybjaerg-Hansen A. Loss-of-function mutations in APOC3 and risk of ischemic vascular disease. N Engl J Med. 2014;371(1):32-41.
286 Pollin TI, Damcott CM, Shen H, Ott SH, Shelton J, Horenstein RB, et al. A null mutation in human APOC3 confers a favorable plasma lipid profile and apparent cardioprotection. Science. 2008;322(5908):1702-5.-287287 Crosby J, Peloso GM, Auer PL, Crosslin DR, Stitziel NO, Lange LA, et al; TG and HDL Working Group of the Exome Sequencing Project NHL, Blood Institute. Loss-of-function mutations in APOC3, triglycerides, and coronary disease. N Engl J Med. 2014;371(1):22-31. sendo sua inibição considerada novo alvo terapêutico.
8.3.6. Antissenso antiapolipoproteína C-III
O composto ISIS 304801 (volanesorsen) é um oligonucleptídeo antissenso de segunda geração desenvolvido especialmente para reduzir os níveis do RNA Mensageiro (mRNA) da ApoC-III. A hibridização do ISIS 304801 ao mRNA da ApoC-III leva à degradação do mRNA alvo pela ribonuclease H1, impedindo a tradução da proteína ApoC-III.286286 Pollin TI, Damcott CM, Shen H, Ott SH, Shelton J, Horenstein RB, et al. A null mutation in human APOC3 confers a favorable plasma lipid profile and apparent cardioprotection. Science. 2008;322(5908):1702-5. Em modelos experimentais pré-clínicos e em estudos clínicos com voluntários saudáveis, o antissenso anti-ApoC-III reduziu as concentrações de ApoC-III e os TG de forma dose-dependente.288288 Graham MJ, Lee RG, Bell TA 3rd, Fu W, Mullick AE, Alexander VJ, et al. Antisense oligonucleotide inhibition of apolipoprotein C-III reduces plasma triglycerides in rodents, nonhuman primates, and humans. Circ Res. 2013;112(11):1479-90.
O antissenso anti-ApoC-III é de uso injetável por via subcutânea e demonstrou redução de ApoC-III e TG em pacientes com hipertrigliceridemia, em monoterapia ou em associação a fibratos,289289 Gaudet D, Alexander VJ, Baker BF, Brisson D, Tremblay K, Singleton W, et al. Antisense inhibition of Apolipoprotein C-III in patients with hypertriglyceridemia. N Engl J Med. 2015;373(5):438-47. e na quilomicronemia familiar.290290 Gaudet D, Brisson D, Tremblay K, Alexander VJ, Singleton W, Hughes SG, et al. Targeting APOC3 in the familial chylomicronemia syndrome. N Engl J Med. 2014;371(23):2200-6. O antissenso anti-ApoC-III reduziu as concentrações de ApoC-III em monoterapia de 40 a 79%, com doses de 100 a 300 mg, de maneira dose-dependente, e em associação com fibratos, reduziu entre 60 a 71%, nas doses de 200 e 300 mg. Reduções nas concentrações de TG plasmáticos da ordem de 30 a 71% foram observadas tanto em monoterapia como em associação a fibratos.289289 Gaudet D, Alexander VJ, Baker BF, Brisson D, Tremblay K, Singleton W, et al. Antisense inhibition of Apolipoprotein C-III in patients with hypertriglyceridemia. N Engl J Med. 2015;373(5):438-47. Na quilomicronemia familiar por deficiência da LPL e com concentrações basais de TG entre 1.406 e 2.083 mg/dL, o antissenso anti-ApoC-III reduziu ApoC-III de 71 a 90% e os TG de 56 a 86%, e todos os pacientes mantiveram-se com TG < 500 mg/dL durante o estudo.
Como o mecanismo de redução de TG na quilomicronemia familiar por deficiência da LPL está comprometido, foi postulado que a inibição da ApoC-III pelo antissenso anti-ApoC-III restaura o catabolismo das lipoproteínas ricas em TG por um mecanismo LPL-independente.290290 Gaudet D, Brisson D, Tremblay K, Alexander VJ, Singleton W, Hughes SG, et al. Targeting APOC3 in the familial chylomicronemia syndrome. N Engl J Med. 2014;371(23):2200-6.
O fármaco ainda não está aprovado para uso pelas agências regulatórias, e a experiência inicial mostra que podem ocorrer reações no local da injeção, doença do soro, redução da contagem de plaquetas, sem alterações da função hepática ou renal, e sem interação entre fármacos.289289 Gaudet D, Alexander VJ, Baker BF, Brisson D, Tremblay K, Singleton W, et al. Antisense inhibition of Apolipoprotein C-III in patients with hypertriglyceridemia. N Engl J Med. 2015;373(5):438-47.
8.3.7. Lipase ácida lisossômica recombinante humana
A Terapêutica de Reposição Enzimática (ERT) tem sido usada com sucesso em outras formas de doenças de depósito lisossomal, sendo uma perspectiva para os pacientes com Deficiência da Lipase Ácida Lisossomal (LAL-D, sigla do inglês lysosomal acid lipase deficiency). O objetivo da ERT é tentar normalizar os níveis fisiológicos de lipase ácida lisossomal291291 Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43. e evitar o acúmulo de ésteres de colesterol e TG - e, em consequência, restaurar a função normal dos órgãos.291291 Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43.
A sebelipase alfa é uma forma recombinante da lipase ácida lisossomal humana, testada em três ensaios clínicos de fase 3 e ainda não aprovada pelas agências regulatórias. No primeiro estudo, sete pacientes receberam quatro infusões semanais, que foram bem toleradas e resultaram em rápido declínio das transaminases, mas com aumento do CT, LDL-c e TG, sugerindo mobilização dos lípides acumulados nos tecidos.292292 Balwani M, Breen C, Enns GM, Deegan PB, Honzik T, Jones S, et al. Clinical effect and safety profile of recombinant human lysosomal acid lipase in patients with cholesteryl ester storage disease. Hepatology. 2013;58(3):950-7.,293293 Reiner Z, Guardamagna O, Nair D, Soran H, Hovingh K, Bertolini S, et al. Lysosomal acid lipase deficiency--an under-recognized cause of dyslipidaemia and liver dysfunction. Atherosclerosis. 2014;235(1):21-30. Ao final do estudo e após interrupção da medicação, tanto as enzimas hepáticas como os lípides voltaram aos valores basais. Os pacientes que participaram da fase de extensão receberam quatro infusões semanais de sebelipase alfa e foram transicionados para infusões a cada 2 semanas em longo prazo nas doses de 1 ou 3 mg/kg. Após 78 semanas de tratamento, as enzimas hepáticas continuaram caindo a níveis mais baixos do que no período basal, os níveis de LDL-c e TG reduziram-se em 52 e 40%, respectivamente, e houve aumento de HDL-c em 37%, embora alguns pacientes estivessem em uso de estatinas. O monitoramento da resposta ao tratamento deve ser feito com exames laboratoriais, incluindo função hepática, perfil lipídico e avaliação do risco cardiovascular. Exames de imagem hepática para quantificar o conteúdo de gordura, fibrose e complicações, como a hipertensão portal, são recomendados.294294 Thelwall PE, Smith FE, Leavitt MC, Canty D, Hu W, Hollingsworth KG, et al. Hepatic cholesteryl ester accumulation in lysosomal acid lipase deficiency: non-invasive identification and treatment monitoring by magnetic resonance. J Hepatol. 2013;59(3):543-9.
9. Formas Genéticas de Dislipidemias
Avanços no conhecimento do metabolismo lipídico delinearam as bases genéticas das dislipidemias, com implicações diagnósticas e terapêuticas. Técnicas de sequenciamento de DNA identificaram mutações em vários genes, causadoras das alterações observadas no perfil lipídico.295295 Creider JC, Hegele RA. Clinical evaluation for genetic and secondary causes of dyslipidemia. In: Ballantyne CM. Clinical lipidology: a companion to Braunwald's heart disease. 2nd ed. Philadelphia: Saunder Elsevier; 2015. p. 128-34.
Estudos em famílias com alterações lipídicas extremas (geralmente monogênicas) identificaram os genes com papel principal no metabolismo lipídico. Por resultarem em alterações presentes desde o nascimento, estes genes se associam à aterosclerose e ao risco cardiovascular aumentado.
Atualmente, mais de 20 síndromes genéticas monogênicas já foram descritas, de ocorrência rara, com padrão de transmissão dominante ou recessivo, ao passo que as poligênicas são bem mais frequentes, sem padrão definido de herdabilidade.295295 Creider JC, Hegele RA. Clinical evaluation for genetic and secondary causes of dyslipidemia. In: Ballantyne CM. Clinical lipidology: a companion to Braunwald's heart disease. 2nd ed. Philadelphia: Saunder Elsevier; 2015. p. 128-34.
O conhecimento das dislipidemias genéticas é importante, pois, apesar de menos frequentes que as dislipidemias secundárias, em algum momento o médico depara com um paciente portador de uma dislipidemia genética, o que pode ser um desafio diagnóstico e terapêutico.
Essa diretriz tem como objetivo sistematizar a avaliação inicial do paciente portador de uma dislipidemia genética, além de explorar as dislipidemias genéticas mais prevalentes, nos seus vários aspectos.
Quando o médico deve suspeitar de uma dislipidemia genética? Sempre que o paciente apresentar uma dislipidemia, deve-se considerar as causas primárias (genéticas) e as secundárias. A distinção entre ambas não é tão fácil, uma vez que a maioria das dislipidemias é poligênica, resultante da combinação de fatores genéticos e não genéticos. Na presença de alterações moderadas do perfil lipídico e descartadas as causas secundárias, considerar as dislipidemias primárias poligênicas ou monogênicas.296296 Stone NJ. Secondary causes of hyperlipidemia. Med Clin North Am. 1994;78(1):117-41.,297297 Anderson TJ, Gregoire J, Hegele RA, Couture P, Mancini GB, McPherson R, et al. 2012 update of the Canadian Cardiovascular Society guidelines for the diagnosis and treatment of dyslipidemia for the prevention of cardiovascular disease in the adult. Can J Cardiol. 2013;29(2):151-67.
9.1. Dislipidemias poligênicas
As dislipidemias poligênicas são causadas pelo efeito cumulativo de variantes genéticas denominadas polimorfismos de um único nucleotídeo (SNP, sigla do inglês single nucleotide polymorphism). Individualmente não alteram significativamente o perfil lipídico, mas o efeito cumulativo dos SNP dentro do genoma é amplificado, resultando em dislipidemia clínica. Estas variantes são segregadas em cromossomos independentes, sem padrões de transmissão mendeliana clássicas (transmissão dos caracteres de pai para filho).295295 Creider JC, Hegele RA. Clinical evaluation for genetic and secondary causes of dyslipidemia. In: Ballantyne CM. Clinical lipidology: a companion to Braunwald's heart disease. 2nd ed. Philadelphia: Saunder Elsevier; 2015. p. 128-34.,298298 Johansen CT, Hegele RA. Allelic and phenotypic spectrum of plasma triglycerides. Biochim Biophys Acta. 2012;1821(5):833-42.
As dislipidemias poligênicas apresentam as seguintes características: são pacientes geneticamente suscetíveis, ainda que com ou sem expressão clínica do fenótipo; são alterações moderadas a graves do perfil lipídico, não explicadas somente por causa secundária; são indivíduos com menor suscetibilidade, mas, se expostos intensamente a fatores secundários, desenvolvem franca dislipidemia; são indivíduos que, apesar da elevada suscetibilidade genética, mas com hábitos de vida saudáveis (que incluem dieta, atividade física e alimentação adequada), terão o risco minimizado de evoluir com dislipidemia; o diagnóstico genético das dislipidemias poligênicas por meio do escore genético de SNP não é indicado, pois não altera o tratamento; o rastreamento do perfil lipídico deve ser feito nos parentes de primeiro grau dos pacientes com dislipidemia poligênica; como alguns SNP tendem a permanecer segregados dentro de determinadas famílias, indivíduos com dislipidemia poligênica devem ter seus familiares identificados e tratados corretamente.299299 Talmud PJ, Shah S, Whittall R, Futema M, Howard P, Cooper JA, et al. Use of low-density lipoprotein cholesterol gene score to distinguish patients with polygenic and monogenic familial hypercholesterolaemia: a case-control study. Lancet. 2013;381(9874):1293-301.,300300 Teslovich TM, Musunuru K, Smith AV, Edmondson AC, Stylianou IM, Koseki M, et al. Biological, clinical and population relevance of 95 loci for blood lipids. Nature. 2010;466(7307):707-13.
9.2. Dislipidemias monogênicas
As dislipidemias monogênicas apresentam as seguintes características: alterações mais graves do perfil lipídico; histórico familiar de dislipidemia e/ou aterosclerose precoce; idade de apresentação da dislipidemia (infância ou adolescência); presença de sinais e sintomas determinados por alterações lipídicas extremas, muitos dos quais patognomônicos de algumas formas monogênicas; ausência de fatores secundários que justifiquem a presença de alterações lipídicas importantes ou em idades precoces.
Em indivíduos com dislipidemia grave, a probabilidade de uma causa monogênica não é absoluta. Muitos resultam de acentuada suscetibilidade genética interagindo com fatores secundários. Estes casos não apresentam os critérios listados anteriormente, exceto o perfil lipídico muito alterado. Nestes pacientes, o tratamento é mais fácil, com resposta terapêutica eficaz, pois os fatores secundários, apesar de exacerbarem em muito a dislipidemia, quando eliminados, podem normalizar os níveis lipídicos.295295 Creider JC, Hegele RA. Clinical evaluation for genetic and secondary causes of dyslipidemia. In: Ballantyne CM. Clinical lipidology: a companion to Braunwald's heart disease. 2nd ed. Philadelphia: Saunder Elsevier; 2015. p. 128-34.,298298 Johansen CT, Hegele RA. Allelic and phenotypic spectrum of plasma triglycerides. Biochim Biophys Acta. 2012;1821(5):833-42.,299299 Talmud PJ, Shah S, Whittall R, Futema M, Howard P, Cooper JA, et al. Use of low-density lipoprotein cholesterol gene score to distinguish patients with polygenic and monogenic familial hypercholesterolaemia: a case-control study. Lancet. 2013;381(9874):1293-301.
O diagnóstico das dislipidemias genéticas monogênicas é clínico, mas a determinação da mutação, pela análise de DNA, pode ser útil para um diagnóstico preciso. A análise de DNA é considerada parte dos critérios diagnósticos de algumas dislipidemias monogênicas. No entanto, a determinação genética não tem impacto no tratamento e nem no prognóstico dos pacientes.
9.2.1. Hipercolesterolemia familiar
A HF é uma doença hereditária autossômica dominante, caracterizada por concentrações de LDL-c plasmático aumentadas e risco considerável de DAC precoce.295295 Creider JC, Hegele RA. Clinical evaluation for genetic and secondary causes of dyslipidemia. In: Ballantyne CM. Clinical lipidology: a companion to Braunwald's heart disease. 2nd ed. Philadelphia: Saunder Elsevier; 2015. p. 128-34.,301301 Marks D, Thorogood M, Neil HA, Humphries SE. A review on the diagnosis, natural history, and treatment of familial hypercholesterolaemia. Atherosclerosis. 2003;168(1):1-14.
Os valores de LDL-c elevados são a principal característica da HF e resultam de mutações nos três genes que determinam as concentrações plasmáticas do LDL-c.6464 Abifadel M, Varret M, Rabès JP, Allard D, Ouguerram K, Devillers M, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003;34(2):154-6.,7171 Soutar AK, Naoumova RP. Mechanisms of disease: genetic causes of familial hypercholesterolemia. Nat Clin Pract Cardiovasc Med. 2007;4(4):214-25.,8383 Innerarity TL, Mahley RW, Weisgraber KH, Bersot TP, Krauss RM, Vega GL, et al. Familial defective apolipoprotein B-100: a mutation of apolipoprotein B that causes hypercholesterolemia. J Lipid Res. 1990; 31(8):1337-49.,8787 Garcia CK, Wilund K, Arca M, Zuliani G, Fellin R, Maioli M, et al. Autosomal recessive hypercholesterolemia caused by mutations in a putative LDL receptor adaptor protein. Science. 2001;292(5520):1394-8.,302302 Fouchier SW, Defesche JC, Umans-Eckenhausen MW, Kastelein JP. The molecular basis of familial hypercholesterolemia in The Netherlands. Hum Genet. 2001;109(6):602-15.,303303 Goldstein JL HH, Brown MS. The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2000. p. 2863-913.
A transmissão de um ou dois alelos condiciona dois fenótipos clínicos: HeHF e a HoHF.302302 Fouchier SW, Defesche JC, Umans-Eckenhausen MW, Kastelein JP. The molecular basis of familial hypercholesterolemia in The Netherlands. Hum Genet. 2001;109(6):602-15.
9.2.1.1. Hipercolesterolemia familiar heterozigótica
Os valores de LDL-c considerados para o diagnóstico são acima de 190 mg/dL para adultos e acima de 160 mg/dL para crianças e adolescentes (< 20 anos).
A prevalência varia entre 1/2004343 Nordestgaard BG, Chapman MJ, Humphries SE, Ginsberg HN, Masana L, Descamps OS, et al; European Atherosclerosis Society Consensus Panel. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: Consensus Statement of the European Atherosclerosis Society. Eur Heart J. 2013;34(45):3478-90.,304304 Benn M, Watts GF, Tybjaerg-Hansen A, Nordestgaard BG. Familial hypercholesterolemia in the danish general population: prevalence, coronary artery disease, and cholesterol-lowering medication. J Clin Endocrinol Metab. 2012;97(11):3956-64. Erratum in: J Clin Endocrinol Metab. 2014;99(12):4758-9. a 1/500,299299 Talmud PJ, Shah S, Whittall R, Futema M, Howard P, Cooper JA, et al. Use of low-density lipoprotein cholesterol gene score to distinguish patients with polygenic and monogenic familial hypercholesterolaemia: a case-control study. Lancet. 2013;381(9874):1293-301. dependendo do critério diagnóstico, do efeito fundador do gene e da origem étnica de cada família.
Na infância e adolescência os pacientes são assintomáticos. As manifestações clínicas não são muito prevalentes nesta fase; apenas a LDL é elevada.
A aterosclerose subclínica, detectada pelo aumento do espessamento médio intimal das carótidas, já é notada entre 8 e 10 anos de idade, quando comparada a não portadores. A calcificação coronária é descrita em 25% de jovens HeHF.305305 Neefjes LA, Ten Kate GJ, Alexia R, Nieman K, Galema-Boers AJ, Langendonk JG, et al. Accelerated subclinical coronary atherosclerosis in patients with familial hypercholesterolemia. Atherosclerosis. 2011;219(2):721-7.
O diagnóstico de HeHF é baseado nos valores de LDL-c e no histórico familiar de DAC precoce (< 55 anos para homens e < 65 anos para mulheres).306306 Gidding SS, Champagne MA, de Ferranti SD, Defesche J, Ito MK, Knowles JW, et al; American Heart Association Atherosclerosis, Hypertension, and Obesity in Young Committee of Council on Cardiovascular Disease in Young, Council on Cardiovascular and Stroke Nursing, Council on Functional Genomics and Translational Biology, and Council on Lifestyle and Cardiometabolic Health. The agenda for familial hypercholesterolemia: a scientific statement from the American Heart Association. Circulation. 2015;132(22):2167-92.
Alguns critérios diagnósticos têm sido propostos para uniformizar e formalizar o diagnóstico da HF, mas utilizamos os da Dutch Lipid Clinic Network, conhecido como Dutch MEDPED, conforme descrito no quadro 8.
Critérios diagnósticos de hipercolesterolemia familiar (HF), baseados nos critérios da Dutch Lipid Clinic Network (Dutch MEDPED)
9.2.1.1.1. Rastreamento
9.2.1.1. 2. Rastreamento dos níveis lipídicos
Como valores elevados de colesterol são um achado diagnóstico, o rastreamento da população por meio da determinação do CT e LDL-c é de fundamental importância para aumentar o diagnóstico de casos de HF. Ele pode ser feito pelo rastreamento universal e pelo rastreamento em cascata.
9.2.1.1.3. Rastreamento universal
Indivíduos acima dos 10 anos de idade devem ter a análise do perfil lipídico; a partir dos 2 anos de idade, nas seguintes situações:
-
Histórico familiar de colesterol elevado e/ou de DAC prematura (homens < 55 anos ou mulheres < 65 anos).
-
Se a criança apresentar xantomas, arco corneano, fatores de risco (hipertensão arterial, diabete melito, fumo ou obesidade) ou doença aterosclerótica.
9.2.1.1.4. Rastreamento em cascata
O rastreamento em cascata envolve a determinação do perfil lipídico em todos os parentes de primeiro grau (pai, mãe, irmãos e filhos) dos pacientes diagnosticados como portadores de HF. As chances de identificação de outros portadores de HF a partir de um caso-índice são de 50% nos familiares de primeiro grau, 25% nos de segundo grau e 12,5% nos de terceiro grau.
À medida que novos casos são identificados, novos parentes são recomendados para o rastreamento.
9.2.1.1.5. Rastreamento genético em cascata
O rastreamento genético é custo-efetivo e pode ser realizado em todos os pacientes e familiares em primeiro grau de pacientes com diagnóstico de HF. O rastreamento em cascata mais custo-efetivo é o que utiliza informação genética de indivíduos afetados, no qual uma mutação causadora da doença tenha sido identificada.307307 O'Brien EC, Roe MT, Fraulo ES, Peterson ED, Ballantyne CM, Genest J, et al. Rationale and design of the familial hypercholesterolemia foundation CAscade SCreening for Awareness and DEtection of Familial Hypercholesterolemia registry. Am Heart J. 2014;167(3):342-9 e17.,308308 Besseling J, Sjouke B, Kastelein JJ. Screening and treatment of familial hypercholesterolemia - Lessons from the past and opportunities for the future (based on the Anitschkow Lecture 2014). Atherosclerosis. 2015;241(2):597-606.
9.2.1.1.6. Prognóstico e estratificação de risco
Não se utilizam os escores clínicos de risco tradicionais (Framingham, dentre outros) na estratificação de risco desta população. O critério utilizado encontra-se no quadro 9. Os fatores de risco na HF estão no quadro 10.4343 Nordestgaard BG, Chapman MJ, Humphries SE, Ginsberg HN, Masana L, Descamps OS, et al; European Atherosclerosis Society Consensus Panel. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: Consensus Statement of the European Atherosclerosis Society. Eur Heart J. 2013;34(45):3478-90.,309309 Allard MD, Saeedi R, Yousefi M, Frohlich J. Risk stratification of patients with familial hypercholesterolemia in a multi-ethnic cohort. Lipids Health Dis. 2014;13:65.
Estratificação de risco na hipercolesterolemia familiar, baseada na Dutch Lipid Clinic Network (Dutch MEDPED), adotando um critério presente na proposta do Simon Broome Register Group
Apesar dos pacientes com HF serem considerados de alto risco, a chance de ocorrência de eventos cardiovasculares é variável. Deve-se considerar a pesquisa de aterosclerose nos pacientes assintomáticos, por meio de teste ergométrico, ecocardiograma (para avaliação da valva aórtica), escore de CAC, Doppler de carótidas e angio-CT de coronárias.309309 Allard MD, Saeedi R, Yousefi M, Frohlich J. Risk stratification of patients with familial hypercholesterolemia in a multi-ethnic cohort. Lipids Health Dis. 2014;13:65.
9.2.1.1.7.1. Tratamento farmacológico
Estatinas
As estatinas de alta potência, como a atorvastatina (40 a 80 mg) e a rosuvastatina (20 a 40 mg), são a opção de escolha para se obter redução de LDL-c ≥ a 50% a partir dos níveis basais, sendo difícil alcançar tal meta com o uso isolado da sinvastatina. Estatinas de menor potência, como fluvastatina, pravastatina e lovastatina, geralmente são inapropriadas para os portadores de HF.310310 Santos RD, Gidding SS, Hegele RA, Cuchel MA, Barter PJ, Watts GF, et al; International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Defining severe familial hypercholesterolaemia and the implications for clinical management: a consensus statement from the International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Lancet Diabetes Endocrinol. 2016;4(10):850-61.
Em pacientes intolerantes a doses elevadas de estatinas, deve-se considerar reduzir a dose de estatina ou tentar outra estatina, em combinação com outros hipolipemiantes, como ezetimiba, niacina ou colestiramina.
Para pacientes que não podem usar estatina, está indicada a terapia combinada de niacina, ezetimiba e/ou colestiramina. Fibratos estão indicados nos pacientes com hipertrigliceridemia associada.
9.2.2. Hipercolesterolemia familiar homozigótica
Historicamente, a prevalência da HoHF é muito rara, estimada em 1/1 milhão na população ao redor do mundo. Atualmente, são registradas prevalências maiores do que as inferidas em uma população geral, que variam de 1 em 160 mil a 300 mil.311311 Kastelein JJ, Ginsberg HN, Langslet G, et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with het- erozygous familial hypercholesterolaemia. Eur Heart J. 2015;36: 2996–3003.
9.2.2.1. Diagnóstico
Os critérios diagnósticos de HFHo são apresentados no quadro 11.
9.2.2.2. História natural
HoHF é caracterizada por níveis muito elevados de LDL-c e aterosclerose presente na primeira infância, que envolve arco aórtico, região supra-aórtica, válvula aórtica e óstio de coronárias. Isto resulta em pacientes com angina pectoris, infarto do miocárdio e morte súbita antes dos 30 anos de idade.311311 Kastelein JJ, Ginsberg HN, Langslet G, et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with het- erozygous familial hypercholesterolaemia. Eur Heart J. 2015;36: 2996–3003.
312 Raal FJ, Stein EA, Dufour R, Turner T, Civeira F, Burgess L, Langslet G, Scott R, Olsson AG, Sullivan D, Hovingh GK, Cariou B, Gouni-Berthold I, Somaratne R, Bridges I, Scott R, Wasserman SM, Gaudet D; RUTHERFORD-2 Investigators. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. Lancet. 2015 Jan 24;385(9965):331-40.-313313 Khachadurian AK, Uthman SM. Experiences with the homozygous cases of familial hypercholesterolemia: a report of 52 patients. Nutrition and metabolism. 1973;15(1):132-40.
9.2.2.3. Avaliação clínica
Além do perfil lipídico, deve ser realizada a determinação das concentrações de Lp(a), que, quando elevada, pode indicar maior risco cardiovascular.6969 Cuchel M, Bruckert E, Ginsberg H, Raal FJ, Santos RD, Hegele RA, et al; European Atherosclerosis Society Consensus Panel on Familial Hypercholesterolaemia. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J. 2014;35(32):2146-57.
Os testes de imagem devem incluir a visualização do arco aórtico e da região supravalvar e valvar aórtica, avaliação anatômica e funcional do coração. O exame inicial deve ser o ecocardiograma transtorácico, que deve ser repetido anualmente para monitoramento das lesões calcificadas valvares e das alterações de motilidade da parede do ventrículo esquerdo.313313 Khachadurian AK, Uthman SM. Experiences with the homozygous cases of familial hypercholesterolemia: a report of 52 patients. Nutrition and metabolism. 1973;15(1):132-40. A angio-CT de coronárias pode ser realizada a cada 5 anos, ou de acordo com a demanda do paciente, em escâner preferencialmente com 320 detectores, o que evita exposição a um excesso de radiação.314314 Stanbury JB, Wyngaarden JB, Fredrickson DS (eds.). The metabolic basis of inherited disease. 3rd ed. New York: McGraw-Hill;1972. A aorta torácica pode ser avaliada por ressonância magnética ou eco transesofágico, no caso da aorta proximal. A aorta abdominal pode ser avaliada em seu diâmetro por ultrasonografia abdominal ou ressonância magnética. A avaliação funcional de insuficiência coronária é feita por teste ergométrico, medicina nuclear ou ecocardiografia de estresse, dependendo da idade.313313 Khachadurian AK, Uthman SM. Experiences with the homozygous cases of familial hypercholesterolemia: a report of 52 patients. Nutrition and metabolism. 1973;15(1):132-40.
9.2.2.4. Tratamento
A terapia farmacológica é a base para o tratamento da HFHo. As estatinas são os medicamentos de primeira escolha e que reduzem, em média, os valores de LDL-c entre 10 a 25%, com diminuição de eventos cardiovasculares e aumento de sobrevida desta população.315315 Haitas B, Baker SG, Meyer TE, Joffe BI, Seftel HC. Natural history and cardiac manifestations of homozygous familial hypercholesterolaemia. Q J Med. 1990;76(279):731-40. A associação com ezetimiba pode elevar a redução dos valores de LDL-c em 40%. Outros hipolipemiantes podem ser associados para reduções adicionais nos valores do LDL-c, como resinas de troca e ácido nicotínico. Nos Estados Unidos, o mipomersen e a lomitapida foram aprovados para a HFHo como terapia adjuvante aos medicamentos clássicos.277277 Cuchel M, Meagher EA, du Toit Theron H, Blom DJ, Marais AD, Hegele RA, et al; Phase 3 HoFH Lomitapide Study investigators. Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolaemia: a single-arm, open-label, phase 3 study. Lancet. 2013;381(9860):40-6.,281281 Santos RD, Raal FJ, Catapano AL, Witztum JL, Steinhagen-Thiessen E, Tsimikas S. Mipomersen, an antisense oligonucleotide to apolipoprotein B-100, reduces lipoprotein(a) in various populations with hypercholesterolemia: results of 4 phase III trials. Arterioscler Thromb Vasc Biol. 2015;35(3):689-99. A aférese de lipoproteínas tem indicação para os casos refratários. Em 2015, os medicamentos evolocumabe e alirocumabe, anticorpos monoclonais contra a PCSK9, foram aprovados nos Estados Unidos e Europa e, em 2016, no Brasil, para tratamento da HF, podendo ser usados em homozigotos, desde que não seja um defeito causado por "receptor negativo".
A terapêutica cirúrgica é estabelecida conforme o acometimento cardíaco. A cirurgia de revascularização miocárdica está indicada na presença de DAC grave, bem como a correção de estenose aórtica com troca valvar por prótese biológica ou metálica. O arco aórtico pode apresentar placas ateroscleróticas difusas e calcificadas, além de estenose supra-aórtica, de modo que podem ser necessárias cirurgias como reconstrução do arco aórtico e troca valvar.316316 Santos RD, Miname MH, Martinez LR, Rochitte CE, Chacra AP, Nakandakare ER, et al. Non-invasive detection of aortic and coronary atherosclerosis in homozygous familial hypercholesterolemia by 64 slice multi-detector row computed tomography angiography. Atherosclerosis. 2008;197(2):910-5. Após a cirurgia, deve ser priorizada a otimização terapêutica, incluindo hipolipemiantes, antiplaquetários e prevenção de endocardite, no caso de próteses valvares. A avaliação cardiovascular é sempre necessária, mesmo após as cirurgias de correção previamente citadas, pois outras intervenções ou reintervenções não são descartadas no futuro.
9.2.3. Hipertrigliceridemias graves
Os níveis de TG plasmáticos são biomarcadores das lipoproteínas ricas em TG circulantes e de seus remanescentes. A hipertrigliceridemia é um achado frequente na cardiologia clínica, mas as formas graves necessitam ser reconhecidas, pois causam risco aumentado de pancreatite. Afastadas as causas secundárias, como hipotireoidismo, diabetes melito descompensado, nefropatia crônica, etilismo e medicações, deve-se considerar etiologia genética e de caráter familiar.
As hipertrigliceridemias primárias leves e moderadas são tipicamente poligênicas e resultam do efeito cumulativo de variantes genéticas comuns ou raras em mais de 30 genes. No entanto, existem formas graves de hipertrigliceridemias primárias, de apresentação muito rara, com modo de herança autossômico recessivo.295295 Creider JC, Hegele RA. Clinical evaluation for genetic and secondary causes of dyslipidemia. In: Ballantyne CM. Clinical lipidology: a companion to Braunwald's heart disease. 2nd ed. Philadelphia: Saunder Elsevier; 2015. p. 128-34.,317317 Raal FJ, Pilcher GJ, Panz VR, van Deventer HE, Brice BC, Blom DJ, et al. Reduction in mortality in subjects with homozygous familial hypercholesterolemia associated with advances in lipid-lowering therapy. Circulation. 2011;124(20):2202-7. Fenotipicamente, as hipertrigliceridemias são classificadas de acordo com a anormalidade lipoproteica primária (Quadro 12) em hiperlipidemia familiar combinada (tipo 2b), disbetalipoproteinemia (tipo 3), hipertrigliceridemia primária simples (tipo 4) e hipertrigliceridemia primária mista (tipo 5) e que têm uma base genética multigênica ou poligênica, sendo consequentes a efeitos aditivos de múltiplos alelos318318 Raal FJ, Honarpour N, Blom DJ, Hovingh GK, Xu F, Scott R, Wasserman SM, Stein EA; TESLA Investigators. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B): a randomised, double-blind, placebo-controlled trial. Lancet. 2015 Jan 24;385(9965):341-50. e de interação com fatores ambientais.
Classificação das hipertrigliceridemias genéticas, de acordo com a anormalidade lipoproteica primária
Um tipo de hipertrigliceridemia é de fato monogênica: a chamada quilomicronemia familiar, ou tipo 1, que se caracteriza pela persistência de quilomícrons elevados após jejum de 12 a 14 horas. Os níveis de TG são em geral acima de 1.000 mg/dL, e a condição se manifesta na infância ou na adolescência.318318 Raal FJ, Honarpour N, Blom DJ, Hovingh GK, Xu F, Scott R, Wasserman SM, Stein EA; TESLA Investigators. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B): a randomised, double-blind, placebo-controlled trial. Lancet. 2015 Jan 24;385(9965):341-50. Sabe-se que, na forma monogênica de hipertrigliceridemia, cinco genes são responsáveis por causar as alterações lipídicas. Três deles afetam a atividade da LPL, enquanto outros dois afetam a montagem e o transporte da LPL (Quadro 13). Entre os genes que afetam a função da LPL, estão defeitos no gene LPL, em seu cofator, APOC-II, ou no gene APOAV, embora o mecanismo da hipertrigliceridemia não seja bem compreendido nesta situação; os outros dois genes, o Fator de Maturação de Lípase-1 (LMF-1) e a Glycosyl-Phosfatidylinositol-Anchored HDL-Binding Protein (GPIHBP-1), afetam a montagem e o transporte da LPL.7575 Pisciotta L, Cantafora A, De Stefano F, Langheim S, Calandra S, Bertolini S. A "de novo" mutation of the LDL-receptor gene as the cause of familial hypercholesterolemia. Biochim Biophys Acta. 2002;1587(1):7-11.,7676 Goldstein JL, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL, Sly WS, Valle D. (editors). The metabolic bases of inherited diseases. New York: McGraw-Hill; 1989. p. 1215-50.,317137 Willians CM, Salter A. Saturated fatty acids and coronary heart disease risk: the debate goes on. Curr Opin Clin Nutr Metab Care. 2016;19(2):97-102.,318318 Raal FJ, Honarpour N, Blom DJ, Hovingh GK, Xu F, Scott R, Wasserman SM, Stein EA; TESLA Investigators. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B): a randomised, double-blind, placebo-controlled trial. Lancet. 2015 Jan 24;385(9965):341-50. Porém, em cerca de 30% das quilomicronemias, não foram encontradas mutações em nenhum destes genes, sugerindo que outros possam causar este fenótipo.
Sob o aspecto clínico, as hipertrigliceridemias podem se acompanhar de xantomas eruptivos, lipemia retinalis, pancreatite ou dores abdominais recorrentes. Na disbetalipoproteinemia são característicos os xantomas túbero-eruptivos. O aspecto do plasma deixado em geladeira por 24 horas é outro achado nas hipertrigliceridemias. É turvo nas hipertrigliceridemias, podendo apresentar camada cremosa quando os quilomícrons estiverem presentes, ou mesmo apresentar duas fases, com turbidez e camada cremosa em presença de quilomícrons e TG aumentados. Nas formas genéticas graves, como na quilomicronemia familiar, dores abdominais recorrentes e pancreatites são achados frequentes.
As formas monogênicas recessivas de hipertrigliceridemia (tipo 1) são muito raras (um caso para 1 milhão de indivíduos) e caracterizam a quilomicronemia familiar. Os genes associados a esta condição caracterizam-se por ausência ou atividade muito reduzida da LPL (mutações no gene LPL), com manifestações na infância ou adolescência; ausência da ApoC-II ou ApoC-II não funcionante (mutações no gene ApoC-II), com manifestações na adolescência ou na vida adulta; deficiência ou ausência de GPIHBP1; deficiência ou ausência de ApoA-V, ou do LMF-1, todos com manifestações na vida adulta. A confirmação diagnóstica se dá pelo teste de atividade da lipase pós-heparina reduzida.
9.2.3.1. Tratamento das hipertrigliceridemias graves
O tratamento das hipertrigliceridemias tem dois objetivos: a redução imediata do risco de pancreatite em pacientes com hipertrigliceridemias graves (> 1000 mg/dL) e a diminuição do risco cardiovascular global. Como as hipertrigliceridemias caracterizam-se por concentrações aumentadas de lipoproteínas remanescentes ricas em TG, as concentrações de não HDL-c são alvos terapêuticos secundários no tratamento das hipertrigliceridemias, após o LDL-c.4343 Nordestgaard BG, Chapman MJ, Humphries SE, Ginsberg HN, Masana L, Descamps OS, et al; European Atherosclerosis Society Consensus Panel. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: Consensus Statement of the European Atherosclerosis Society. Eur Heart J. 2013;34(45):3478-90. Nas hipertrigliceridemias leves a moderadas (TG < 500 mg/dL), se após mudanças de estilo de vida níveis de TG permanecerem entre 200 e 499 mg/dL, pode-se utilizar associação de estatina com derivados do ácido fíbrico (excetuando-se a genfibrozila, pelo risco aumentado de rabdomiólise associada à estatina), especialmente em diabéticos.319319 Hendry WG, Seed M. Homozygous familial hypercholesterolaemia with supravalvar aortic stenosis treated by surgery. J R Soc Med. 1985;78(4):334-5. Os fibratos disponíveis e que podem ser associados às estatinas são bezafibrato 200 a 400 mg, fenofibrato 160 a 250 mg e ciprofibrato 100 mg. Uma metanálise de estudos com fibratos demonstrou que indivíduos com TG > 204 mg/dL e HDL-c < 34 mg/dL podem se beneficiar da associação de fibrato e estatina, com 27% de redução de desfechos cardiovasculares.319319 Hendry WG, Seed M. Homozygous familial hypercholesterolaemia with supravalvar aortic stenosis treated by surgery. J R Soc Med. 1985;78(4):334-5.
Para TG acima de 500 mg/dL após mudanças de estilo de vida, os fibratos são a primeira opção. As hipertrigliceridemias graves, com concentrações de TG acima de 1.000 mg/dL, requerem medidas imediatas e redução intensa de TG, para minimizar o risco de pancreatite, sendo indicada dieta restrita em gorduras e carboidratos simples, restrição de álcool e o uso de fibratos, isolados ou associados a ácidos graxos, como ômega 3 (~ 4 g ao dia de EPA/DHA marinho), e a ácido nicotínico (500 mg a 2,0 g ao dia).317317 Raal FJ, Pilcher GJ, Panz VR, van Deventer HE, Brice BC, Blom DJ, et al. Reduction in mortality in subjects with homozygous familial hypercholesterolemia associated with advances in lipid-lowering therapy. Circulation. 2011;124(20):2202-7. No entanto, algumas formas genéticas, que incluem as quilomicronemias familiares, são pouco responsivas à associação de fármacos. Novas terapêuticas para estas formas graves estão sendo testadas e são discutidas em capítulo específico. A presença de dores abdominais ou de pancreatite requer hospitalização, interrupção da alimentação por via oral, plasmaferese (se disponível) e medidas de suporte que incluem reposição de fluidos e tratamento dos fatores desencadeantes (por exemplo, o diabetes).
9.2.4. Hipoalfalipoproteinemias
A relação inversa entre as concentrações de HDL-c e o risco cardiovascular está bem estabelecida. Esta associação é independente dos valores de LDL-c. Entretanto, valores baixos de HDL-c são, na maioria das vezes, associados a causas secundárias, como hipertrigliceridemia e/ou taxas elevadas de ApoB. Este perfil metabólico, muito prevalente na prática clínica, é secundário à obesidade e ao diabetes melito. Em contrapartida, pacientes com HDL-c muito baixo (< 20mg/dL) isolado, na ausência de hipertrigliceridemia ou outras causas secundárias, são infrequentes. Estes indivíduos têm reduções extremas de HDL-c de causa genética, característico das dislipidemias monogênicas, que incluem hipoalfalipoproteinemia familiar, doença de Tangier e deficiência de LCAT. O quadro 14 mostra as características de cada doença.
9.2.4.1. Hipoalfalipoproteinemia
A hipoalfalipoproteinemia familiar é uma doença relativamente comum e frequentemente associada à diminuição da produção de ApoA-I ou ao aumento de seu catabolismo. Os genes afetados envolvem ApoA-I, ApoC-III ou ApoA-IV. Indivíduos com deficiência familiar de ApoA-I causadas por deleções do gene ApoA-I apresentam ApoA-I indetectável e HDL-c muito baixo (inferior a 10 mg/dL). Na forma heterozigótica, as reduções de HDL-c são menos intensas.320320 Hegele RA, Ginsberg HN, Chapman MJ, Nordestgaard BG, Kuivenhoven JA, Averna M, et al; European Atherosclerosis Society Consensus Panel. The polygenic nature of hypertriglyceridaemia: implications for definition, diagnosis, and management. Lancet Diabetes Endocrinol. 2014;2(8):655-66.
Clinicamente, podem apresentar opacidade da córnea, xantomas e DAC prematura.320320 Hegele RA, Ginsberg HN, Chapman MJ, Nordestgaard BG, Kuivenhoven JA, Averna M, et al; European Atherosclerosis Society Consensus Panel. The polygenic nature of hypertriglyceridaemia: implications for definition, diagnosis, and management. Lancet Diabetes Endocrinol. 2014;2(8):655-66. O diagnóstico molecular pode ser feito pela eletroforese das Apo no plasma e pela análise do DNA, para determinar a mutação. Aumentar o HDL-c nesta população é difícil. O tratamento deve ser direcionado em reduzir as taxas do não HDL-c.
É importante ressaltar que nem todas as mutações da ApoA-I aumentam o risco cardiovascular. Um exemplo é a ApoA-I Milano, mutação rara acompanhada de níveis baixos de HDL-c (geralmente 15 a 30 mg/dL), herdada como um traço autossómico dominante, que está associada com um risco diminuido de DAC prematura, apesar dos níveis baixos de HDL-c.
9.2.4.2. Doença de tangier
A doença de Tangier é transmitida por herança autossômica codominante, que ocasiona ausência completa ou deficiência extrema de HDL-c e de ApoA-I. Estes pacientes apresentam níveis de HDL-c inferiores a 5mg/dL e concentrações reduzidas de LDL-c. Doença rara que, clinicamente, exterioriza-se pela presença de amígdalas aumentadas, com coloração alaranjada, neuropatia periférica, hepatoesplenomegalia e DAC prematura.
É causada por mutações no gene ABCA1, que codifica o transportador ABCA1 da membrana. Este transportador desempenha papel fundamental no transporte reverso de colesterol, por meio do qual o efluxo de colesterol livre das células periféricas é transferido para ApoA-I pobre em lípides.321321 Brahm A, Hegele RA. Hypertriglyceridemia. Nutrients. 2013;5(3):981-1001. Esta doença ainda não possui tratamento específico.
9.2.4.3. Deficiência familiar da lecitina-colesterol Aciltransferase
É uma doença autossômica recessiva muito rara caracterizada pela opacidade da córnea, anemia normocrômica e insuficiência renal em adultos jovens.
Foram descritas duas formas genéticas de deficiência da LCAT.322322 Sacks FM, Carey VJ, Fruchart JC. Combination lipid therapy in type 2 diabetes. N Engl J Med. 2010;363(7):692-4. A primeira é a deficiência completa de LCAT, que se manifesta por anemia, proteinúria e insuficiência renal. O diagnóstico pode ser feito com base nos resultados de quantificação de LCAT e pela atividade de esterificação do colesterol no plasma em laboratórios especializados. O segundo tipo é a deficiência parcial (doença de olho de peixe). Clinicamente, expressa-se por opacificação progressiva da córnea, níveis plasmáticos muito baixos de HDL-c (geralmente < 10 mg/dL) e hipertrigliceridemia variável. Não apresentam risco aumentado de DAC.
Como avaliar o paciente com níveis de HDL < 20 mg/dL? É importante saber como era o HDL-c prévio do paciente. Se normal, excluir as causas secundárias que reduzem as concentrações do HDL-c: hipertrigliceridemia; artefatos secundários à paraproteinemia; medicamentos (tibolona, andrógenos em doses elevadas e reações idiossincráticas a fibratos e tiazolidinedionas); quedas súbitas de HDL-c (abaixo de 20 mg/dL) − excluir doença maligna oculta; e doença hepática grave ou sepse, além de queimaduras extensas.
Se os valores de HDL-c prévios já eram muito baixos, pensar nas causas monogênicas ou primárias: história familiar detalhada e exame físico focado, com especial atenção para pele, olhos, amígdalas e baço. Nestes casos, os níveis plasmáticos de apoA-I devem ser obtidos.
9.2.5. Deficiência de lipase ácida lisossomal
A LAL-D é uma doença autossômica recessiva rara, do grupo das doenças de depósito lisossômico, resultando em um importante acúmulo sistêmico lisossomal de ésteres de colesterol e TG.291291 Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43.,293293 Reiner Z, Guardamagna O, Nair D, Soran H, Hovingh K, Bertolini S, et al. Lysosomal acid lipase deficiency--an under-recognized cause of dyslipidaemia and liver dysfunction. Atherosclerosis. 2014;235(1):21-30. A LAL-D era anteriormente conhecida como doença de Wolman (em lactentes) e Doença do Acúmulo dos Ésteres de Colesterol (CESD, sigla do inglês Cholesteryl Ester Storage Disease), em crianças e adultos.
A LAL-D é causada por mutações no gene LIPA, no cromossomo 10q23.2, o gene que codifica para a enzima lipase ácida lisossomal,291291 Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43. com mais de 40 mutações com perda de função identificadas até o momento,293293 Reiner Z, Guardamagna O, Nair D, Soran H, Hovingh K, Bertolini S, et al. Lysosomal acid lipase deficiency--an under-recognized cause of dyslipidaemia and liver dysfunction. Atherosclerosis. 2014;235(1):21-30. sendo as mais graves encontradas em lactentes.323323 van den Bogaard B, Holleboom AG, Duivenvoorden R, Hutten BA, Kastelein JJ, Hovingh GK, et al. Patients with low HDL-cholesterol caused by mutations in LCAT have increased arterial stiffness. Atherosclerosis. 2012;225(2):481-5. Em lactentes, a LAL-D é rapidamente progressiva e fatal, com sintomas nas primeiras semanas de vida, raramente sobrevivendo mais de 6 meses,323323 van den Bogaard B, Holleboom AG, Duivenvoorden R, Hutten BA, Kastelein JJ, Hovingh GK, et al. Patients with low HDL-cholesterol caused by mutations in LCAT have increased arterial stiffness. Atherosclerosis. 2012;225(2):481-5. e com uma média de idade de morte de 3,7 meses (intervalo: 1,4 a 46,3 meses). Crianças e adultos, em geral, apresentam-se com dislipidemia, hepatomegalia, elevação de transaminases hepáticas e esteatose microvesicular à biópsia.291291 Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43. Lesão hepática com progressão para fibrose e cirrose, e insuficiência hepática ocorrem em grande proporção de pacientes.291291 Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43. Elevação do LDL-c e diminuição das concentrações de HDL-c são as alterações lipídicas mais comuns, podendo haver hipertrigliceridemia associada. A dislipidemia aparece desde a infância, podendo se acompanhar de DCV e morte prematura.293293 Reiner Z, Guardamagna O, Nair D, Soran H, Hovingh K, Bertolini S, et al. Lysosomal acid lipase deficiency--an under-recognized cause of dyslipidaemia and liver dysfunction. Atherosclerosis. 2014;235(1):21-30.,323323 van den Bogaard B, Holleboom AG, Duivenvoorden R, Hutten BA, Kastelein JJ, Hovingh GK, et al. Patients with low HDL-cholesterol caused by mutations in LCAT have increased arterial stiffness. Atherosclerosis. 2012;225(2):481-5.,324324 Uehara Y, Tsuboi Y, Zhang B, Miura S, Baba Y, Higuchi MA, et al. POPC/apoA-I discs as a potent lipoprotein modulator in Tangier disease. Atherosclerosis. 2008;197(1):283-9. Estudos que avaliaram a expressão de LIPA em macrófagos consideram que a LAL-D é um fator de risco independente para DAC, mas faltam estudos clínicos para avaliar o risco de DCV na LAL-D.
Como as manifestações de LAL-D são comuns em outras DCV, metabólicas e hepáticas, a LAL-D pode não ser reconhecida na prática clínica. Os diagnósticos diferenciais incluem HF, hiperlipidemia familiar combinada, esteato-hepatite não alcoólica, doença do fígado gorduroso não alcoólico e cirrose criptogênica.324324 Uehara Y, Tsuboi Y, Zhang B, Miura S, Baba Y, Higuchi MA, et al. POPC/apoA-I discs as a potent lipoprotein modulator in Tangier disease. Atherosclerosis. 2008;197(1):283-9.
325 Santamarina-Fojo S, Hoegt JM, Assmann G, Brewer B Jr. Lecithin cholesterol acyltransferase deficiency and fish eye disease. In: Metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2001. p. 2817-33.-326326 Jones SA, Valayannopoulos V, Schneider E, Eckert S, Banikazemi M, Bialer M, et al. Rapid progression and mortality of lysosomal acid lipase deficiency presenting in infants. Genet Med. 2016;18(5):452-8.
Possui uma prevalência estimada entre 1:130 mil a 1:300 mil, mas esta pode ser muito maior em comunidades com casamentos consanguíneos, como judeus Ashkenazi, chegando a 1:4.200 na comunidade de Los Angeles.291291 Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43.,327 327 Quinn AG, Burton B, Deegan P, Di Rocco M, Enns G, Guardamagna O. Sustained elevations in LDL cholesterol and serum transaminases from early childhood are common in lysosomal acid lipase deficiency. Mol Genet Metab. 2014;111(2):589.Desde sua caracterização inicial, foi descoberto que CESD e doença de Wolman tinham a mesma base molecular, com deficiência na enzima responsável pela hidrólise dos ésteres de colesterol e TG, da partícula de LDL em colesterol livre e ácidos graxos livres.328328 Hulkova H, Elleder M. Distinctive histopathological features that support a diagnosis of cholesterol ester storage disease in liver biopsy specimens. Histopathology. 2012;60(7):1107-13.
329 Gasche C, Aslanidis C, Kain R, Exner M, Helbich T, Dejaco C, et al. A novel variant of lysosomal acid lipase in cholesteryl ester storage disease associated with mild phenotype and improvement on lovastatin. J Hepatol. 1997;27(4):744-50.-330330 Chatrath H, Keilin S, Attar BM. Cholesterol ester storage disease (CESD) diagnosed in an asymptomatic adult. Dig Dis Sci. 2009;54(1):168-73. Quando a lipase ácida lisossomal está deficiente ou ausente, os ésteres de colesterol e TG não são degradados e acumulam-se nos lisossomos. A escassez de colesterol intracelular leva à maior síntese endógena de colesterol, mediada pela maior expressão de HMG-CoA redutase, maior produção de ApoB e de VLDL, podendo explicar a dislipidemia na LAL-D.324324 Uehara Y, Tsuboi Y, Zhang B, Miura S, Baba Y, Higuchi MA, et al. POPC/apoA-I discs as a potent lipoprotein modulator in Tangier disease. Atherosclerosis. 2008;197(1):283-9. O acúmulo de ésteres de colesterol no fígado leva à elevação persistente de transaminases hepáticas e à progressão da fibrose e cirrose, mesmo com o uso de estatinas.331331 Scott SA, Liu B, Nazarenko I, Martis S, Kozlitina J, Yang Y, et al. Frequency of the cholesteryl ester storage disease common LIPA E8SJM mutation (c.894G>A) in various racial and ethnic groups. Hepatology. 2013;58(3):958-65.
A idade do aparecimento dos sintomas e o ritmo de progressão variam de acordo com o tipo de mutação e o grau de atividade enzimática residual. Porém, outros fatores podem contribuir para a progressão da doença.332332 Aslanidis C, Ries S, Fehringer P, Buchler C, Klima H, Schmitz G. Genetic and biochemical evidence that CESD and Wolman disease are distinguished by residual lysosomal acid lipase activity. Genomics. 1996;33(1):85-93.,333333 Pagani F, Pariyarath R, Garcia R, Stuani C, Burlina AB, Ruotolo G, et al. New lysosomal acid lipase gene mutants explain the phenotype of Wolman disease and cholesteryl ester storage disease. J Lipid Res. 1998;39(7):1382-8. Em lactentes, a LAL-D se manifesta por hepatoesplenomegalia, vômitos e diarreia, má absorção, hipodesenvolvimento, falência hepática (devido à fibrose e à cirrose), acúmulo anormal de lípides no baço, linfonodos, mucosa intestinal, endotélio vascular e músculos esqueléticos, sendo observado em 50% dos lactentes calcificações nas glândulas adrenais. Nas crianças, o curso da doença é variável, com início dos sintomas aos cinco anos, podendo se manifestar em adultos após os 40 anos de idade. Disfunção hepática e dislipidemias são achados comuns em todas as idades. Hepatomegalia e esplenomegalia são encontradas em 90% das crianças e 74% dos adultos com LAL-D.291291 Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43. À biópsia são encontrados um fígado de coloração amarelo-alaranjado brilhante, e à histologia graus variáveis de fibrose portal e perilobular, intensa esteatose por acúmulo de ésteres de colesterol e TG nos lisossomos dos hepatócitos.325325 Santamarina-Fojo S, Hoegt JM, Assmann G, Brewer B Jr. Lecithin cholesterol acyltransferase deficiency and fish eye disease. In: Metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2001. p. 2817-33. Achado característico é a presença de células de Kupffer muito hipertrofiadas, macrófagos portais, cristais líquidos de ésteres de colesterol.325325 Santamarina-Fojo S, Hoegt JM, Assmann G, Brewer B Jr. Lecithin cholesterol acyltransferase deficiency and fish eye disease. In: Metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2001. p. 2817-33.
No momento da suspeição clínica, um algoritmo diagnóstico proposto por especialistas deve ser utilizado. Este inclui os diagnósticos diferenciais com dislipidemias, hepatopatias em crianças e adultos (Figura 3). A confirmação diagnóstica (padrão ouro) é o teste enzimático de sangue para avaliar a atividade da lipase ácida lisossomal.334334 Ginsberg HN, Le NA, Short MP, Ramakrishnan R, Desnick RJ. Suppression of apolipoprotein B production during treatment of cholesteryl ester storage disease with lovastatin. Implications for regulation of apolipoprotein B synthesis. J Clin Invest. 1987;80(6):1692-7.
Algoritmo diagnóstico da deficiência de lipase ácida lisossomal (LAL-D). LDL-c ≥130 mg/dL em pacientes que tomam medicamentos hipolipemiantes. SNC: sistema nervoso central; NAFLD: fígado gorduroso não alcoólico; NASH: esteato-hepatite não alcoólica; ALT: alanina aminotransferase; LSN: limite superior da normalidade; FHC: hiperlipidemia familiar combinada; HeFH: hipercolesterolemia familiar heterozigótica; LDL-c: colesterol da lipoproteína de baixa densidade; HDL-c: colesterol da lipoproteína de alta densidade. Fonte: Adaptado de Reiner et al, Hamilton et al, Roberts et al, Manolaki et al.293293 Reiner Z, Guardamagna O, Nair D, Soran H, Hovingh K, Bertolini S, et al. Lysosomal acid lipase deficiency--an under-recognized cause of dyslipidaemia and liver dysfunction. Atherosclerosis. 2014;235(1):21-30.,334334 Ginsberg HN, Le NA, Short MP, Ramakrishnan R, Desnick RJ. Suppression of apolipoprotein B production during treatment of cholesteryl ester storage disease with lovastatin. Implications for regulation of apolipoprotein B synthesis. J Clin Invest. 1987;80(6):1692-7.
335 Burke JA, Schubert WK. Deficient activity of hepatic acid lipase in cholesterol ester storage disease. Science. 1972;176(4032):309-10.-336336 Patrick AD, Lake BD. Deficiency of an acid lipase in Wolman's disease. Nature. 1969;222(5198):1067-8.
Um novo método para detectar a atividade da lipase ácida lisossomal em sangue seco foi desenvolvido. A atividade da lipase ácida lisossomal é medida em spots de sangue seco (DBS, do inglês dried blood spots), por método fluorimétrico. Como as outras lipases podem interferir na medida da atividade da lipase ácida lisossomal, nos spots, sua atividade é comparada em presença e na ausência de um inibidor específico da lipase ácida lisossomal, o Lalistat 2, sendo a diferença entre a atividade da lipase total e daquela medida em presença do Lalistat 2 atribuída à atividade da lipase ácida lisossomal. A confirmação do tipo de mutação é feita pelo sequenciamento genético do gene LIPA, sendo a mutação mais comum a E8SJM em homozigose.328328 Hulkova H, Elleder M. Distinctive histopathological features that support a diagnosis of cholesterol ester storage disease in liver biopsy specimens. Histopathology. 2012;60(7):1107-13.
10. Dislipidemias em Situações Especiais e Formas Secundárias
10.1. Idosos
A decisão do tratamento dos idosos com dislipidemia continua um dilema na prática clínica. Esta população apresenta particularidades importantes, como farmacocinética dos medicamentos, etiologia das dislipidemias, falta de evidência de benefícios clínicos em determinadas faixas etárias e elevada prevalência de aterosclerose subclínica em adultos com mais de 65 anos de idade. O Cardiovascular Health Study (CHS) encontrou aterosclerose clínica em mais do que 30% e aumentou ainda mais com o avanço da idade.337337 Hamilton J, Jones I, Srivastava R, Galloway P. A new method for the measurement of lysosomal acid lipase in dried blood spots using the inhibitor Lalistat 2. Clin Chim Acta. 2012;413(15-16):1207-10.
O CT em geral é mais elevado até a sexta década de vida e, depois, cai ligeiramente, com o avançar da idade. Apesar disto, a prevalência de hipercolesterolemia ainda é alta nos idosos, principalmente no sexo feminino. Aproximadamente 25% dos homens e 42% das mulheres apresentam CT superior a 240 mg/dL.338338 Roberts EA, Schilsky ML; American Association for Study of Liver Diseases (AASLD). Diagnosis and treatment of Wilson disease: an update. Hepatology. 2008;47(6):2089-111. Dados do estudo de Framinghan confirmam a maior prevalência de hipercolesterolemia em idosos do sexo feminino e o declínio gradativo das taxas de colesterol com o envelhecimento.339339 Manolaki N, Nikolopoulou G, Daikos GL, Panagiotakaki E, Tzetis M, Roma E, et al. Wilson disease in children: analysis of 57 cases. J Pediatr Gastroenterol Nutr. 2009;48(1):72-7.,340340 Kuller L, Borhani N, Furberg C, Gardin J, Manolio T, O'Leary D, et al. Prevalence of subclinical atherosclerosis and cardiovascular disease and association with risk factors in the Cardiovascular Health Study. Am J Epidemiol. 1994;139(12):1164-79.
Outro fato relevante na hiperlipidemia do idoso é que raramente ocorrem grandes elevações de CT, TG e LDL-c, características das dislipidemias de caráter genético, sendo, em geral, elevações discretas a moderadas. Além disso, são frequentes as dislipidemias secundárias a hipotireoidismo, diabetes melito, intolerância à glicose, obesidade, síndrome nefrótica e uso de medicamentos, como diuréticos tiazidicos e bloqueadores beta-adrenérgicos não seletivos.
Altos níveis de colesterol se associam a risco aumentado de DAC em adultos de meia idade e pacientes no início da terceira idade. No entanto, esta associação fica enfraquecida com o progredir da idade e pode até ser invertida − fato denominado "paradoxo do colesterol".341341 Moran A, Gu D, Zhao D, Coxson P, Wang YC, Chen CS, et al. Future cardiovascular disease in china: markov model and risk factor scenario projections from the coronary heart disease policy model-china. Circ Cardiovasc Qual Outcomes. 2010;3(3):243-52. A queda dos níveis de colesterol, que ocorre com o aumento da idade, pode ser consequência de fragilidade ou presença de comorbidades, como o câncer. Assim, um aparente aumento na mortalidade associada a baixos níveis de colesterol em idosos pode estar relacionado a vários fatores, como alterações no metabolismo do colesterol, desnutrição, fragilidade e doenças crônicas que levam à redução simultaneamente do colesterol e do risco aumentado de morte.342342 Corti MC, Barbato GM, Baggio G. Lipoprotein alterations and atherosclerosis in the elderly. Curr Opin Lipidol. 1997;8(4):236-41.
Apesar do papel das dislipidemias na patogênese da aterosclerose e da DAC ter sido amplamente demonstrado em estudos observacionais e experimentais, estas evidências foram inicialmente demonstradas em estudos que envolviam apenas indivíduos de meia-idade.343343 Krumholz HM, Seeman TE, Merrill SS, Mendes de Leon CF, Vaccarino V, Silverman DI, et al. Lack of association between cholesterol and coronary heart disease mortality and morbidity and all-cause mortality in persons older than 70 years. JAMA. 1994;272(17):1335-40. No entanto, resultados de estudos posteriores forneceram informações importantes, que podem auxiliar na decisão de tratar também a população de idosos.344344 Schatz IJ, Masaki K, Yano K, Chen R, Rodriguez BL, Curb JD. Cholesterol and all-cause mortality in elderly people from the Honolulu Heart Program: a cohort study. Lancet. 2001;358(9279):351-5. Vale ressaltar que, no idoso, o tratamento da dislipidemia deve considerar o estado geral e mental do paciente, as condições socioeconômicas, o apoio familiar, as comorbidades presentes e os outros fármacos em uso, que podem interagir com os hipolipemiantes e, assim, influenciar na adesão e na manutenção da terapêutica.
No que diz respeito à terapia não farmacológica, a orientação deve obedecer aos princípios de indicação semelhantes aos dos adultos jovens, observando com cuidado as necessidades de aporte calórico, proteico e vitamínico, com recomendação da prática de atividade física (Grau de Recomendação: I; Nível de Evidência: B), reiterar o abandono do vício de fumar e a ingestão de bebidas alcoólicas. Não havendo resposta em 90 dias e dependendo do risco cardiovascular, as estatinas constituem os fármacos de escolha nesta população.
Alguns cuidados são necessários nesta população, pelo risco aumentado de interação medicamentosa, devido à coexistência de múltiplas comorbidades e à necessidade de polifarmácia.
Na avaliação do benefício do tratamento com estatinas nos idosos, é necessário compreender a diferença entre redução de risco relativo e absoluto.
Esta distinção foi a chave para a compreensão dos achados do Prospective Studies Collaboration, que combinaram os resultados de 61 estudos prospectivos observacionais.110110 Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J, et al; Prospective Studies Collaboration. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet. 2007;370(9602):1829-39. Erratum in: Lancet. 2008;372(9635):292. Trata-se de uma grande base de dados, que relacionou o CT com a mortalidade vascular em quase 900 mil indivíduos sem história de doença vascular, entre as idades de 40 e 89 anos. A taxa de risco para a morte por DAC, com redução de 1 mmol/L no CT, variou muito com a idade. Foi menor na quinta década (40-49 anos; HR = 0,44) e aumentou progressivamente até a nona década (80-89 anos; HR = 0,85). Em outras palavras, o CT parece ser um fator de risco muito mais potente para a morte por DAC nos mais jovens do que nos mais velhos (risco relativo). No entanto, a incidência de mortes por DAC foi menor na quinta década (38/105 pessoas-ano) e aumentou progressivamente até 2.534/105 pessoas-ano na nona década (risco absoluto). A partir destes achados, estimou-se que a redução de 1 mmol/L no CT estaria associada ao aumento de sobrevida de 21/105 pessoas-ano na quinta década, aumentando progressivamente para 380/105 pessoas-ano na nona década.
O PROSPER (PROspective Study of Pravastatin in the Elderly at Risk) foi o único estudo prospectivo que avaliou o impacto da redução do colesterol com estatinas em idosos. Foi um estudo randomizado, duplo-cego, controlado com placebo em pacientes de ambos os sexos, de 70 a 82 anos de idade, que demonstrou em pacientes de alto risco cardiovascular (DCV preexistente ou em alto risco) que a pravastatina na dose de 40 mg/dia, em seguimento médio de 3,2 anos, reduziu a mortalidade coronária em 24%.345345 Fontana L, Addante F, Copetti M, Paroni G, Fontana A, Sancarlo D, et al. Identification of a metabolic signature for multidimensional impairment and mortality risk in hospitalized older patients. Aging Cell. 2013;12(3):459-66.
O estudo HPS (Heart Protection Study) também envolveu um grande número de indivíduos acima de 65 anos de idade e demonstrou redução significativa de eventos coronários e cerebrovasculares em pacientes que tomaram sinvastatina 40 mg/dia.346346 Corti MC, Guralnik JM, Salive ME, Harris T, Ferrucci L, Glynn RJ, et al. Clarifying the direct relation between total cholesterol levels and death from coronary heart disease in older persons. Ann Intern Med. 1997;126(10):753-60.
A metanálise do CTT (Cholesterol Treatment Trialists) demonstrou redução do risco relativo significativa de 16% de eventos vasculares em pacientes com idade acima de 75 anos recebendo terapia com estatina.112112 Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170?000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81.
10.2. Crianças e adolescentes
Estudos brasileiros populacionais demonstram, segundo região e critério, prevalências de 10 a 23,5% de dislipidemias em crianças e adolescentes.347347 Lemaitre RN, Psaty BM, Heckbert SR, Kronmal RA, Newman AB, Burke GL. Therapy with hydroxymethylglutaryl coenzyme a reductase inhibitors (statins) and associated risk of incident cardiovascular events in older adults: evidence from the Cardiovascular Health Study. Arch Intern Med. 2002;162(12):1395-400.
348 Shepherd J, Blauw GJ, Murphy MB, Bollen EL, Buckley BM, Cobbe SM, et al; PROSPER study group. PROspective Study of Pravastatin in the Elderly at Risk. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet. 2002;360(9346):1623-30.-349349 Collins R, Armitage J, Parish S, Sleight P, Peto R, Heart Protection Study Collaborative Group. Effects of cholesterol-lowering with simvastatin on stroke and other major vascular events in 20536 people with cerebrovascular disease or other high-risk conditions. Lancet. 2004;363(9411):757-67. Isto é de grande importância, pois a infância é cada vez mais considerada a fase estratégica na prevenção da aterosclerose em nível populacional, na medida em que os hábitos de vida (causas importantes da modulação do risco cardiovascular) são formados nesta fase. Estudos longitudinais têm demonstrado que intervenções em crianças são efetivas na prevenção da DCV em adultos.350350 Giuliano Ide C, Coutinho MS, Freitas SF, Pires MM, Zunino JN, Ribeiro RQ. [Serum lipids in school kids and adolescents from Florianopolis, SC, Brazil--Healthy Floripa 2040 study]. Arq BrasCardiol. 2005;85(2):85-91.,351351 Gama SR, Carvalho MS, Chaves CR. [Childhood prevalence of cardiovascular risk factors]. Cad Saude Publica. 2007;23(9):2239-45.
10.2.1. Classificação e estratificação de risco
As principais causas de dislipidemia na infância e na adolescência podem ser classificadas como descrito no quadro 15. Para fins de planejamento de monitorização e tratamento, deve-se fazer a estratificação de risco cardiovascular desde a infância, pois a precocidade e a intensidade do tratamento variam segundo sua classificação, assim como as metas de LDL-c. As doenças e os fatores de risco associados com a aterosclerose na infância e na adolescência estão descritos no quadro 16.205205 Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents; National Heart, Lung, and Blood Institute. Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents: summary report. Pediatrics. 2011;128 Suppl 5:S213-56.
Condições clinicas e fatores de risco associados à aterosclerose desde a infância, segundo sua gravidade
10.2.2. Triagem
A dosagem sérica do perfil lipídico de crianças deve ocorrer a partir dos 2 anos de idade, pois, até esta idade, há a necessidade de maior ingestão de gorduras para a mielinização. Antes disto, os casos devem ser analisados individualmente, segundo doenças concomitantes, terapêuticas e história familiar (Grau de Recomendação: IIa; Nível de Evidência: C).
Devemos triar o perfil lipídico em criança entre 2 e 10 anos, quando elas:352352 de Franca E, Alves JG. Dyslipidemia among adolescents and children from Pernambuco. Arq Bras Cardiol. 2006;87(6):722-7. têm pais ou avós com história de doença arterial isquêmica precoce (Quadro 15); têm pais com CT superior a 240 mg/dL; apresentam outras doenças ou fatores de risco para aterosclerose (Quadro 16); são portadoras de doenças que cursam com dislipidemia (Quadro 15); utilizam medicamentos que alteram o perfil lipídico (Quadro 15); possuem manifestações clínicas de dislipidemias (xantomas, xantelasma, arco corneal, dores abdominais recorrentes e pancreatite) (Grau de Recomendação: IIa; Nível de Evidência: C).
Toda a criança deve ter calculado o não HDL-c entre 9 e 11 anos e entre 17 e 21 anos. Não há a necessidade de jejum. Se anormal, deve ser repetido o perfil lipídico entre 2 semanas e 3 meses. No caso de suspeita de dislipidemia de caráter genético, indica-se a determinação do perfil lipídico: CT, LDL-c, HDL-c e TG (Grau de Recomendação: IIa; Nível de Evidência: B).353353 Juonala M, Magnussen CG, Berenson GS, Venn A, Burns TL, Sabin MA, et al. Childhood adiposity, adult adiposity, and cardiovascular risk factors. N Engl J Med. 2011;365(20):1876-85.,354354 Juonala M, Viikari JS, Raitakari OT. Main findings from the prospective Cardiovascular Risk in Young Finns Study. Curr Opin Lipidol. 2013;24(1):57-64.
10.2.3. Valores de referência
Os valores de referência para lípides e lipoproteínas em crianças e adolescentes, com e sem jejum, estão descritos na tabela 8 (Grau de Recomendação: IIa; Nível de Evidência: C):205205 Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents; National Heart, Lung, and Blood Institute. Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents: summary report. Pediatrics. 2011;128 Suppl 5:S213-56.,355355 Daniels SR, Greer FR; Committee on Nutrition. Lipid screening and cardiovascular health in childhood. Pediatrics. 2008;122(1):198-208.
Valores de referência para lípides e lipoproteínas em crianças e adolescentes (Grau de Recomendação: IIa; Nível de Evidência: C)
10.2.4. Tratamento
Na maioria dos casos, a dislipidemia é decorrente de maus hábitos de vida: dieta rica em gorduras saturadas ou trans e sedentarismo. A obesidade exerce também um efeito metabólico desfavorável, com o aumento de triglicerídeos e LDL-c, e a diminuição do HDL-c, além de alterar as subfrações dos lípides, aumentando a concentração das frações pró-aterogênicas.356356 Bamba V. Update on screening, etiology, and treatment of dyslipidemia in children. J Clin Endocrinol Metab. 2014;99(9):3093-102.
10.2.5. Mudança do estilo de vida
A dieta saudável em qualidade e quantidade para a idade é a base da prevenção da dislipidemia na infância, com exceção dos casos de dislipidemias de caráter genético, que necessitam de abordagem específica. A alimentação deve ser a mais variada possível, equilibrada em quantidades de proteínas, carboidratos e gorduras. Devem ser preferidas as gorduras de origem vegetal naturais, monoinsaturadas ou poli-insaturadas (óleos vegetais e amêndoas); frituras, alimentos industrializados ricos em gorduras trans e gorduras visíveis das carnes ou pele de aves devem ser evitados. Deve-se ainda estimular a ingestão de alimentos ricos em fibras insolúveis (frutas, verduras, legumes e cereais integrais) e solúveis (leguminosas, frutas ricas em pectina e cereais integrais). Para facilitar a orientação populacional, sugerem-se utilizar, sempre que possível, cereais integrais e ao menos cinco porções diárias de frutas ou verduras (Grau de Recomendação: Iia; Nível de Evidência: B).356356 Bamba V. Update on screening, etiology, and treatment of dyslipidemia in children. J Clin Endocrinol Metab. 2014;99(9):3093-102.
O tratamento dietético nutricional nas crianças com hipercolesterolemia deve seguir os mesmos parâmetros dos adultos.
Nas crianças com altos níveis de triglicerídeos, recomendam-se a redução da ingestão de todos os tipos de gorduras (a menos de 20% do volume calórico total em alguns casos) e o aumento da ingestão de peixe e outros alimentos ricos em ômega 3. Quando a manifestação da hipertrigliceridemia grave se faz no recém-nascido, são necessárias fórmulas lácteas pobres em gorduras e enriquecidas com ômega 3 e TG de cadeia média − fórmulas estas ainda não comercializadas no Brasil. Recomenda-se, nestes casos, que este bebê seja referenciado a um especialista (Grau de Recomendação: IIa; Nível de Evidência: C)353353 Juonala M, Magnussen CG, Berenson GS, Venn A, Burns TL, Sabin MA, et al. Childhood adiposity, adult adiposity, and cardiovascular risk factors. N Engl J Med. 2011;365(20):1876-85.,357357 Descamps OS, Tenoutasse S, Stephenne X, Gies I, Beauloye V, Lebrethon MC, et al. Management of familial hypercholesterolemia in children and young adults: consensus paper developed by a panel of lipidologists, cardiologists, paediatricians, nutritionists, gastroenterologists, general practitioners and a patient organization. Atherosclerosis. 2011;218(2):272-80.
Quando há a necessidade de prescrição de dieta pobre em lipídios, a criança ou o adolescente deve idealmente ser acompanhado por um nutricionista ou nutrólogo, pelo risco de comprometimento do crescimento ou do desenvolvimento.
A atividade física deve ser estimulada, tanto buscando um dia a dia ativo, quanto com atividades programadas ou supervisionadas. Para tratamento de dislipidemia, recomendam-se 60 minutos de atividade vigorosa por dia e menos de 2 horas de atividades sedentárias de tela por dia. Em nível populacional, deve-se recomendar o estímulo da prática da atividade recreativa, não estruturada. Quanto mais variada e lúdica é esta atividade física, maior é a chance de que esta prática se mantenha durante a adolescência e a vida adulta (Grau de Recomendação: IIa; Nível de Evidência: B).356356 Bamba V. Update on screening, etiology, and treatment of dyslipidemia in children. J Clin Endocrinol Metab. 2014;99(9):3093-102.
O controle de peso é importante estratégia no controle da dislipidemia de crianças e adolescentes, em nível populacional. Em obesos, há frequentemente a associação de outras comorbidades, como hipertensão arterial sistêmica e baixos níveis de HDL-c, o que diminui ainda mais as metas sugeridas de LDL-c. Idealmente deve-se instituir intensiva modificação do estilo de vida, para atingir um índice de massa corporal abaixo do 85o percentil (Grau de Recomendação: I; Nível de Evidência: B).350350 Giuliano Ide C, Coutinho MS, Freitas SF, Pires MM, Zunino JN, Ribeiro RQ. [Serum lipids in school kids and adolescents from Florianopolis, SC, Brazil--Healthy Floripa 2040 study]. Arq BrasCardiol. 2005;85(2):85-91.
10.2.6. Terapia medicamentosa
A terapia hipolipemiante deve ser iniciada após pelo menos 6 meses de intensiva modificação de estilo de vida. O quadro 18 descreve as doses utilizadas na infância e na adolescência (Grau de Recomendação: I; Nível de Evidência: A).
Doses de hipolipemiantes utilizadas em crianças e adolescentes (Grau de Recomendação: IIa; Nível de Evidência: B)
Os medicamentos mais utilizados são:197197 Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; ESC Committee for Practice Guidelines (CPG) 2008-2010 and 2010-2012 Committees. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32(14):1769-818.
-
Estatinas: é o medicamento mais frequentemente utilizado. Antes de sua utilização, devem ser instituídos pelo menos 6 meses de intensivas mudanças de estilo de vida (Grau de Recomendação: I; Nível de Evidência: A). Deve ser iniciado idealmente acima de 10 anos (em casos especiais, acima de 7 anos), estádio II de Tanner em meninos ou menarca nas meninas. A meta de tratamento é abaixo de 135 mg/dL para crianças e adolescentes (Grau de Recomendação: IIa; Nível de Evidência: A).358358 Steiner MJ, Skinner AC, Perrin EM. Fasting might not be necessary before lipid screening: a nationally representative cross-sectional study. Pediatrics. 2011;218(3):463-70.,359359 Jellinger PS, Smith DA, Mehta AE, Ganda O, Handelsman Y, Rodbard HW, et al; AACE Task Force for Management of Dyslipidemia and Prevention of Atherosclerosis. American Association of Clinical Endocrinologists' Guidelines for Management of Dyslipidemia and Prevention of Atherosclerosis. Endocr Pract. 2012;18 Suppl 1:1-78. Os níveis de LDL para início da administração, assim como suas metas, variam segundo a gravidade das condições clínicas ou fatores de risco (Quadro 17). As doses usualmente utilizadas dos hipolipemiantes em crianças e adolescentes são descritas no quadro 18.
-
Inibidores da absorção do colesterol (ezetimiba): recomenda-se seu uso como monoterapia a partir dos 5 anos e, em associação com estatina, acima de 7 anos (Grau de Recomendação: IIa; Nível de Evidência: B).360360 Hauenschild A, Bretzel RG, Schnell-Kretschmer H, Kloer HU, Hardt PD, Ewald N. Successful treatment of severe hypertriglyceridemia with a formula diet rich in omega-3 fatty acids and medium-chain triglycerides. Ann Nutr Metab. 2010;56(3):170-5.
-
Sequestrantes dos ácidos biliares: podem ser utilizados em qualquer idade. Podem ser também utilizados de forma associada com estatinas, em horários diferentes. Pelo risco de desnutrição relacionado às vitaminas lipossolúveis, recomenda-se monitoração nutricional e suplementação, segundo critérios objetivos de deficiência (Grau de Recomendação: I; Nível de Evidência: A).197197 Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; ESC Committee for Practice Guidelines (CPG) 2008-2010 and 2010-2012 Committees. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32(14):1769-818.
-
Suplementos: a suplementação de 1,2 a 1,5 g de fitosteróis pode diminuir os níveis de CT e LDL-c. Podem ser utilizados na forma de alimentos fortificados e cápsulas (Grau de Recomendação: I; Nível de Evidência: A).361361 Vuorio A, Kuoppala J, Kovanen PT, Humphries SE, Tonstad S, Wiegman A, et al. Statins for children with familial hypercholesterolemia. Cochrane Database Syst Rev. 2014 Jul 23;(7):CD006401.
-
Óleos de peixe: a utilização de ômega 3 está indicada quando os níveis de triglicerídeos se mantiverem persistentemente aumentados entre 200 e 499 mg/dL, na dose de 2 a 4 g ao dia. Há poucos estudos antes da adolescência (Grau de Recomendação: IIa; Nível de Evidência: B).362362 Lebenthal Y, Horvath A, Dziechciarz P, Szajewska H, Shamir R. Are treatment targets for hypercholesterolemia evidence based? Systematic review and meta-analysis of randomised controlled trials. Arch Dis Child. 2010;95(9):673-80.
-
Fibratos: há poucos estudos sobre o uso de fibratos na infância. Porém, há necessidade de sua utilização, principalmente em subgrupos de pacientes, como os que vivem com Síndrome da Imunodeficiência Adquirida (HIV) ou com síndrome metabólica, após controle rigoroso da ingestão de lipídios, especialmente quando os seus níveis se mantiverem persistentemente acima de 500 mg/dL (Grau de Recomendação: IIa; Nível de Evidência: B).363363 Yeste D, Chacon P, Clemente M, Albisu MA, Gussinye M, Carrascosa A. Ezetimibe as monotherapy in the treatment of hypercholesterolemia in children and adolescents. J Pediatr Endocrinol Metab. 2009;22(6):487-92.
Crianças e adolescentes com dislipidemias e que não respondem adequadamente a mudanças de estilo de vida e doses habituais de hipolipemiantes devem ser encaminhados a centros especializados.
10.3. Mulheres na idade fértil e gestação, menopausa e climatério
Os benefícios da redução lipídica em mulheres são os mesmos observados em homens, portanto, para definição de metas lipídicas, não há distinção entre os sexos.2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.
10.3.1. Idade fértil e gestação
Mulheres dislipidêmicas em idade fértil e sem contracepção adequada devem seguir orientação dietética e adoção de estilo de vida saudável, incluindo controle de peso, atividade física e interrupção de tabagismo. A terapia com estatinas deve ser evitada em mulheres em idade fértil e sem contracepção adequada (Grau de Recomendação: IIa; Nível de Evidência: C).2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.
A principal modificação lipídica decorrente da gestação é a elevação das concentrações de TG e VLDL, que ocorre de forma progressiva, chegando a quadruplicar até o último trimestre. A hipertrigliceridemia gestacional ocorre para suprir demandas aumentadas de energia da mãe, como precursor de hormônios para a placenta, e para fornecer colesterol e ácidos graxos essenciais ao feto. Ocorre também aumento do colesterol no segundo e terceiro trimestres com valor máximo no termo. Em gestantes no segundo e terceiro trimestres e em lactantes, a terapia com estatina não deve ser indicada (Grau de Recomendação: III; Nível de Evidência: C).364364 Amundsen AL, Ntanios F, Put N, Ose L. Long-term compliance and changes in plasma lipids, plant sterols and carotenoids in children and parents with FH consuming plant sterol ester-enriched spread. Eur J Clin Nutr. 2004;58(12):1612-20.
A contraindicação deve-se a relatos de teratogenicidade, embora as informações disponíveis na literatura sejam inconclusivas.364364 Amundsen AL, Ntanios F, Put N, Ose L. Long-term compliance and changes in plasma lipids, plant sterols and carotenoids in children and parents with FH consuming plant sterol ester-enriched spread. Eur J Clin Nutr. 2004;58(12):1612-20. A colestiramina é o único fármaco com segurança definida. Da mesma forma, outros fármacos hipolipemiantes devem ser evitados na gestação. Os fibratos podem ser considerados nos casos de hipertrigliceridemia muito grave (TG > 1.000 mg/dL), sob a análise de risco/benefício para as gestantes (alta mortalidade para mãe e feto por pancreatite aguda durante a gravidez). Entretanto, o controle dietético deve ser o tratamento de eleição em gestantes (Grau de Recomendação: IIa; Nível de Evidência: C) e, em casos extremos, a aférese pode ser recomendada.
Quanto aos ácidos graxos ômega 3, mulheres grávidas e lactantes devem ser aconselhadas a introduzirem na dieta peixes ricos em ácidos graxos ômega 3, de águas profundas e com baixos níveis de mercúrio. Os peixes recomendados são salmão, cavala, arenque, sardinha, atum e truta. Nâo há estudos com a suplementação (cápsulas) durante a gestação.365365 Gidding SS, Prospero C, Hossain J, Zappalla F, Balagopal PB, Falkner B, et al. A double-blind randomized trial of fish oil to lower triglycerides and improve cardiometabolic risk in adolescents. J Pediatr. 2014;165(3):497-503 e2. Existem poucos estudos em gestantes ou lactantes com fitosteróis.
10.3.2. Menopausa
A associação entre a perda da função ovariana e o aumento do risco de DAC está bem estabelecida. A deficiência estrogênica, resultante tanto da menopausa natural quanto da cirúrgica, aumenta o risco de DAC em aproximadamente três a sete vezes, constituindo-se na maior causa de morte no sexo feminino após a menopausa.
Em relação aos efeitos sobre o metabolismo das lipoproteínas, a menopausa produz um perfil pró-aterogênico, caracterizado principalmente pela elevação do CT em aproximadamente 15%, associada ao aumento do LDL-c e da ApoB em 25%.366366 Kennedy MJ, Jellerson KD, Snow MZ, Zacchetti ML. Challenges in the pharmacologic management of obesity and secondary dyslipidemia in children and adolescents. Paediatr Drugs. 2013;15(5):335-42. A elevação da homocisteína, da PCR-us e da IL-6 também é descrita como decorrente da deficiência estrogênica. O mecanismo pelo qual a falência gonadal no climatério pós-menopausal eleva o CT e o LDL-c pode estar condicionada à diminuição do catabolismo das LDL pela diminuição do número de receptores hepáticos B/E. Na menopausa, ocorre diminuição da atividade hepática da 7-alfa-hidroxilase, reduzindo a síntese de ácidos biliares e, consequentemente, diminuindo a excreção de colesterol.
No período de climatério pós-menopausal, pode ocorrer elevação dos TG e VLDL-c, decorrente da menor atividade da LPL, com menor produção de VLDL remanescente. Esta situação frequentemente se associa a maior proporção das partículas LDL pequenas e densas, que são mais suscetíveis a sofrerem alterações oxidativas, sendo consequentemente mais facilmente reconhecidas e captadas pelos macrófagos, formando células espumosas, ponto inicial da formação do processo aterosclerótico.
Após a menopausa, ocorre redução dos níveis de HDL-c até 25%, representado principalmente pela subfração HDL2.
O estrogênio, utilizado por via oral, sofre a primeira passagem hepática, produzindo elevação dos TG. Assim, em mulheres que apresentam hipertrigliceridemia, a reposição estrogênica oral pode desencadear aumento importante da trigliceridemia, às vezes com níveis maiores que 1.000 mg/dL, aumentando o risco do aparecimento de crises de pancreatite aguda. Nestas pacientes, o uso de estrogênios transdérmicos deve ser considerado, os quais não apresentam primeira passagem hepática e, portanto, não elevam os TG.
A Terapia de Reposição Hormonal (TRH) após a menopausa pode reduzir o LDL-c em até 20 a 25% e aumentar o HDL-c em até 20%. Entretanto, esta terapêutica nunca está recomendada com a finalidade exclusiva de reduzir o risco cardiovascular em mulheres no período de transição menopáusica ou da pós-menopausa, seja em prevenção primária ou secundária (Grau de Recomendação: III; Nível de Evidência: A).366366 Kennedy MJ, Jellerson KD, Snow MZ, Zacchetti ML. Challenges in the pharmacologic management of obesity and secondary dyslipidemia in children and adolescents. Paediatr Drugs. 2013;15(5):335-42.,367367 Kasmin A, Garcia-Bournissen F, Koren G. Risks of statin use during pregnancy: a systematic review. J Obstet Gynaecol Can. 2007;29(11):906-8.
Nas mulheres em prevenção primária com indicações ginecológicas para a TRH (controle de sintomas vasomotores), pode haver benefício cardiovascular quando iniciada na transição menopáusica ou nos primeiros anos de pós-menopausa, na chamada "janela de oportunidade" (Grau de Recomendação: IIb; Nível de Evidência: B).367367 Kasmin A, Garcia-Bournissen F, Koren G. Risks of statin use during pregnancy: a systematic review. J Obstet Gynaecol Can. 2007;29(11):906-8. Ainda, na prevenção primária, pode haver aumento do risco quando a TRH é iniciada tardiamente. A TRH deve ser evitada nas mulheres de alto risco ou de prevenção secundária (Grau de Recomendação: III; Nível de Evidência: A). Naquelas em uso regular de TRH que apresentarem evento cardiovascular, a TRH deve ser interrompida imediatamente (Grau de Recomendação: III; Nível de Evidência: A).368368 Wenstrom KD. The FDA's new advice on fish: it's complicated. Am J Obstet Gynecol. 2014;211(5):475-8. e1.,369369 Stevenson JC, Crook D, Godsland IF. Influence of age and menopause on serum lipids and lipoproteins in healthy women. Atherosclerosis. 1993;98(1):83-90.
Quanto às estatinas, até o momento nenhum estudo foi realizado exclusivamente em mulheres. Os dados disponíveis são da análise de subgrupos participantes do sexo feminino em megaestudos. Assim, a análise dos subgrupos de mulheres nos estudos de prevenção primária (Air Force/Texas Coronary Atherosclerosis Prevention Study - AFCapsTexCaps)370370 Rossouw JE, Prentice RL, Manson JE, Wu L, Barad D, Barnabei VM, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-77. Erratum in: JAMA. 2008;299(12):1426. e secundária (Scandinavian Simvastatin Survival Study - 4S),371371 Hulley S, Grady D, Bush T, Furberg C, Herrington D, Riggs B, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA. 1998;280(7):605-13. o CARE (Cholesterol and Recurrent Events Trial investigators)372372 Grady D, Herrington D, Bittner V, Blumenthal R, Davidson M, Hlatky M, et al; HERS Research Group. Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). JAMA. 2002;288(1):49-57. e o LIPID (The Long-Term Intervention with Pravastatin in Ischaemic Disease)373373 Downs JR, Clearfield M, Weis S, Whitney E, Shapiro DR, Beere PA, et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA. 1998;279(20):1615-22. mostraram benefícios da redução lipídica sobre a morbidade e a mortalidade cardiovascular, até mesmo mais precocemente do que o observado entre os homens. Os resultados do estudo HPS,374374 Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet. 1994;344(8934):1383-9. no qual foram avaliadas mais de 5.000 mulheres de alto risco cardiovascular que receberam a sinvastatina, ocorreu nítida redução de eventos, mesmo naquelas que apresentavam concentrações séricas de LDL-c consideradas atualmente dentro dos padrões da normalidade (Grau de Recomendação: I; Nível de Evidência: A).
10.4. Síndrome coronária aguda
Tratamento hipolipemiante efetivo deve ser iniciado precocemente na presença de síndrome coronariana aguda e não deve ser descontinuado se o paciente estiver em uso de estatinas. O aumento de mortalidade foi descrito em registros de não prescrição ou descontinuidade de estatinas nas primeiras 24 horas do infarto agudo do miocárdio.375375 Sacks FM, Pfeffer MA, Moye LA, Rouleau JL, Rutherford JD, Cole TG, et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial investigators. N Engl J Med. 1996;335(14):1001-9.,376376 Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. N Engl J Med. 1998;339(19):1349-57. Outros estudos mostraram que o uso precoce de estatinas em dose alta diminui os marcadores de lesão miocárdica em intervenções percutâneas de síndrome coronariana aguda,377377 Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet. 2002;360(9326):7-22. e reduz nefropatia induzida por contraste378378 Spencer FA, Fonarow GC, Frederick PD, Wright RS, Every N, Goldberg RJ, et al; National Registry of Myocardial Infarction. Early withdrawal of statin therapy in patients with non-ST-segment elevation myocardial infarction: national registry of myocardial infarction. Arch Intern Med. 2004;164(19):2162-8.,379379 Fonarow GC, Wright RS, Spencer FA, Fredrick PD, Dong W, Every N, et al; National Registry of Myocardial Infarction 4 Investigators. Effect of statin use within the first 24 hours of admission for acute myocardial infarction on early morbidity and mortality. Am J Cardiol. 2005;96(5):611-6. e desfechos cardiovasculares pelo tratamento iniciado na fase aguda das síndromes com estatinas de alta efetividade,380380 Di Sciascio G, Patti G, Pasceri V, Gaspardone A, Colonna G, Montinaro A. Efficacy of atorvastatin reload in patients on chronic statin therapy undergoing percutaneous coronary intervention: results of the ARMYDA-RECAPTURE (Atorvastatin for Reduction of Myocardial Damage During Angioplasty) Randomized Trial. J Am Coll Cardiol. 2009;54(6):558-65.
381 Toso A, Leoncini M, Maioli M, Tropeano F, Di Vincenzo E, Villani S, et al. Relationship between inflammation and benefits of early high-dose rosuvastatin on contrast-induced nephropathy in patients with acute coronary syndrome: the pathophysiological link in the PRATO-ACS study (Protective Effect of Rosuvastatin and Antiplatelet Therapy on Contrast-Induced Nephropathy and Myocardial Damage in Patients With Acute Coronary Syndrome Undergoing Coronary Intervention). JACC Cardiovasc Interv. 2014;7(12):1421-9.-382382 Leoncini M, Toso A, Maioli M, Tropeano F, Villani S, Bellandi F. Early high-dose rosuvastatin for contrast-induced nephropathy prevention in acute coronary syndrome: Results from the PRATO-ACS Study (Protective Effect of Rosuvastatin and Antiplatelet Therapy On contrast-induced acute kidney injury and myocardial damage in patients with Acute Coronary Syndrome). J Am Coll Cardiol. 2014;63(1):71-9. ou pela combinação de estatina com ezetimiba.113113 Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al; IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372(25):2387-97. A diminuição da inflamação e não apenas da LDL-c está relacionada com melhor sobrevida livre de desfechos cardiovasculares.383383 Schwartz GG, Olsson AG, Ezekowitz MD, Ganz P, Oliver MF, Waters D, et al; Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) Study Investigators. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial. JAMA. 2001;285(13):1711-8.,384384 Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al; Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 Investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med. 2004;350(15):1495-504. Erratum in: N Engl J Med. 2006;354(7):778. O tratamento com estatinas deve ser iniciado precocemente, ou mantido naqueles que já as utilizam (Grau de Recomendação: I; Nível de Evidência: A) e as metas terapêuticas de LDL-c e não HDL-c devem ser, respectivamente, < 50 mg/dL e < 80 mg/dL (Grau de Recomendação: I; Nível de Evidência: B).
10.5. Doença renal crônica
10.5.1. Epidemiologia
A doença renal crônica é um problema de saúde pública, com prevalência global de 8 a 16%,385385 Nagashima M, Koyanagi R, Kasanuki H, Hagiwara N, Yamaguchi J, Atsuchi N, et al; Heart Institute of Japan, Department of Cardiology (HIJC) Investigators. Effect of early statin treatment at standard doses on long-term clinical outcomes in patients with acute myocardial infarction (the Heart Institute of Japan, Department of Cardiology Statin Evaluation Program). Am J Cardiol. 2007;99(11):1523-8. e representa mais de 10% (> 20 milhões) de prevalência na população adulta dos Estados Unidos, segundo o Centers for Disease Control and Prevention (CDC).386386 Ridker PM, Cannon CP, Morrow D, Rifai N, Rose LM, McCabe CH, et al; Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 (PROVE IT-TIMI 22) Investigators. C-reactive protein levels and outcomes after statin therapy. N Engl J Med. 2005;352(1):20-8.
As DCV permanecem como a principal causa de morte dentre os pacientes renais.387387 Bohula EA, Giugliano RP, Cannon CP, Zhou J, Murphy SA, White JA, et al. Achievement of dual low-density lipoprotein cholesterol and high-sensitivity C-reactive protein targets more frequent with the addition of ezetimibe to simvastatin and associated with better outcomes in IMPROVE-IT. Circulation. 2015;132(13):1224-33. O relatório anual de dados do US Renal Data System de 2013 indicou que pacientes com doença renal crônica têm maior frequência de insuficiência cardíaca congestiva, infarto agudo do miocárdio e AVC quando comparados aos pacientes sem doença renal crônica.387387 Bohula EA, Giugliano RP, Cannon CP, Zhou J, Murphy SA, White JA, et al. Achievement of dual low-density lipoprotein cholesterol and high-sensitivity C-reactive protein targets more frequent with the addition of ezetimibe to simvastatin and associated with better outcomes in IMPROVE-IT. Circulation. 2015;132(13):1224-33.
As dislipidemias são fator de risco estabelecido para DCV na população geral, mas esta relação não é linear na população com doença renal crônica. Estudos observacionais mostraram que, dentre os pacientes em tratamento dialítico, os que apresentavam índice de massa corporal mais elevado, obesidade e hipercolesterolemia evoluíam com maior sobrevida. Esse fenômeno foi denominado "reverso epidemiológico", em que colesterol elevado e obesidade foram marcadores de maior sobrevida nos pacientes dialíticos.388388 Jha V, Garcia-Garcia G, Iseki K, Li Z, Naicker S, Plattner B, et al. Chronic kidney disease: global dimension and perspectives. Lancet. 2013;382(9888):260-72. Erratum in: Lancet. 2013;382(9888):208. Subnutrição e inflamação, em doenças crônicas, reduzem em muito a sobrevida desta população.388388 Jha V, Garcia-Garcia G, Iseki K, Li Z, Naicker S, Plattner B, et al. Chronic kidney disease: global dimension and perspectives. Lancet. 2013;382(9888):260-72. Erratum in: Lancet. 2013;382(9888):208. Embora estes estudos tenham demonstrado que reduzir o colesterol, em pacientes em diálise, esteja associado a aumento na mortalidade,389389 National Chronic Kidney Disease Fact Sheet: General Information and National Estimates on Chronic Kidney Disease in the United States. Atlanta (GA): US Department of Health and Human Services, Centers for Disease Control and Prevention; 2014. [Accessed in 2016 Sep 10]. Available from: URL:http:/www.cdc.gov/diabetes/pubs/pdf/kidney_factsheet.pdf)
http:/www.cdc.gov/diabetes/pubs/pdf/kidn...
outros concluíram que, nesta população de dialíticos sem desnutrição e/ou inflamação, a hipercolesterolemia ainda é associada ao aumento da mortalidade cardiovascular.390390 US Renal Data System. USRDS 2013 Annual Data Report: Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda (MD): 2013.
10.5.2. Perfil lipídico na doença renal crônica
Os pacientes com doença renal crônica apresentam alterações qualitativas e quantitativas do perfil lipídico.253253 Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377(9784):2181-92. Com a redução da função renal e do clearance, a remoção anormal das lipoproteínas é um mecanismo que contribui para as alterações lipídicas. Inicialmente, observam-se hiertrigliceridemia e baixos níveis de HDL-c. A redução da lipólise pode ser atribuída a aumentos da concentração de ApoC-III391391 Kalantar-Zadeh K, Block G, Humphreys MH, Kopple JD. Reverse epidemiology of cardiovascular risk factors in maintenance dialysis patients. Kidney Int. 2003;63(3):793-808. e à redução da atividade da LPL. Nos pacientes em diálise, a hipercolesterolemia está presente e se associa a maior risco de mortalidade cardiovascular.253253 Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377(9784):2181-92.,392392 Iseki K, Yamazato M, Tozawa M, Takishita S. Hypocholesterolemia is a significant predictor of death in a cohort of chronic hemodialysis patients. Kidney Int. 2002;61(5):1887-93. As principais alterações lipídicas na doença renal crônica estão no quadro 19.
10.5.3. Pacientes com doença renal crônica não dialítica: uso de hipolipemiantes
10.5.3.1. Estatinas
A maioria dos dados sobre estatinas em pacientes com doença renal crônica não dialítica deriva de análise de subgrupos, análises post hoc e metanálises.392392 Iseki K, Yamazato M, Tozawa M, Takishita S. Hypocholesterolemia is a significant predictor of death in a cohort of chronic hemodialysis patients. Kidney Int. 2002;61(5):1887-93. Apenas um estudo randomizado, o SHARP (Study of Heart and Renal Protection), avaliou a terapia com estatinas e eventos cardiovasculares maiores. O estudo SHARP incluiu 6.247 pacientes com doença renal crônica não dialítica e TFG Média Estimada (TFGe) em 26,6 mL/min por 1,73 m2. Os pacientes foram randomizados para sinvastatina 20 mg e ezetimibe 10 mg por dia vs. placebo. O desfecho primário foi o primeiro evento aterosclerótico maior e o seguimento médio de 4,9 anos. Houve redução significativa no risco de eventos cardiovasculares maiores (risco relativo de 0,83; p = 0,0021), AVC não hemorrágico (risco relativo de 0,75; p = 0,01) e redução da necessidade de procedimentos de revascularização (risco relativo de 0,79; p = 0,0036) no grupo sinvastatina/ezetimibe. Não houve diferenças significativas quanto à ocorrência de eventos coronários maiores ou progressão para doença renal terminal em pacientes não dialíticos (Quadro 20).
Resumo dos principais estudos em pacientes com doença renal 393393 Keane WF, Tomassini JE, Neff DR. Lipid abnormalities in patients with chronic kidney disease: implications for the pathophysiology of atherosclerosis. J Atheroscler Thromb. 2013;20(2):123-33.
394 Arnadottir M, Thysell H, Dallongeville J, Fruchart JC, Nilsson-Ehle P. Evidence that reduced lipoprotein lipase activity is not a primary pathogenetic factor for hypertriglyceridemia in renal failure. Kidney Int. 1995;48(3):779-84.-395395 Hou W, Lv J, Perkovic V, Yang L, Zhao N, Jardine MJ, et al. Effect of statin therapy on cardiovascular and renal outcomes in patients with chronic kidney disease: a systematic review and meta-analysis. Eur Heart J. 2013;34(24):1807-17.
Recomendação de uso:Kidney Disease: Improving Global Outcomes (KDIGO) 2013 recomenda397397 Fellstrom BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, et al; AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009;360(14):1395-407. Erratum in: N Engl J Med. 2010;362(15):1450. tratamento com estatinas para pacientes com doença renal crônica (não dialítica ou pós transplante), ≥ 50 anos de idade que tenham TFG estimada abaixo ou acima de 60 mL/min por 1,73 m22 Raal FJ, Santos RD, Blom DJ, Marais AD, Charng MJ, Cromwell WC, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998-1006.. Para pacientes entre 18 e 49 anos, KDIGO recomenda terapia com estatina na presença de doença coronária, diabetes, antecedentes de AVC isquêmico e se o risco acumulado em 10 anos da morte coronária ou infarto não fatal for maior do que 10%. As estatinas são habitualmente bem toleradas, sendo os principais efeitos colaterais a hepatotoxicidade e a toxicidade muscular, incluindo miopatia, mialgia e rabdomiólise. A incidência destes efeitos colaterais não é maior na população com doença renal crônica em comparação com a população geral. Para pacientes com TFG ≥ 60 mL/minuto por 1,73 m22 Raal FJ, Santos RD, Blom DJ, Marais AD, Charng MJ, Cromwell WC, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998-1006., não é necessário ajuste de dose. KDIGO recomenda o uso das doses usadas em ensaios clínicos randomizados com estatinas, para pacientes com TFG abaixo de 60 mL/min por 1,73 m22 Raal FJ, Santos RD, Blom DJ, Marais AD, Charng MJ, Cromwell WC, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998-1006., as (Tabela 9).
Doses de estatinas usadas em ensaios clínicos randomizados para pacientes com taxa de filtração glomerular < 60 mL/minuto por 1,73 m2
10.5.3.2. Fibratos
Podem reduzir os níveis de triglicerídeos na ordem de 18 a 45% e aumentar o HDL-c em 10%. No entanto, em pacientes com doença renal crônica, não foi observada redução de risco cardiovascular consistente. As diretrizes KDIGO de 2003 recomendavam a utilização de fibratos na prevenção de pancreatite nos pacientes com hipertrigliceridemia, mas, nas diretrizes de 2013, esta recomendação foi removida.397397 Fellstrom BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, et al; AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009;360(14):1395-407. Erratum in: N Engl J Med. 2010;362(15):1450.
KDIGO recomenda mudanças no estilo de vida em pacientes com hipertrigliceridemia, embora as evidências sejam fracas. Estas medidas incluem redução de peso, modificação da dieta, aumento da atividade física, reduzido consumo de álcool e tratamento da hiperglicemia. KDIGO recomenda ainda que os fibratos podem ser considerados em pacientes com TG > 1.000 mg/dL.397397 Fellstrom BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, et al; AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009;360(14):1395-407. Erratum in: N Engl J Med. 2010;362(15):1450.
10.5.4. Pacientes com doença renal crônica dialítica
Recomendações de uso: a diretriz KDIGO 2013397397 Fellstrom BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, et al; AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009;360(14):1395-407. Erratum in: N Engl J Med. 2010;362(15):1450. recomenda não iniciar estatina ou estatina mais ezetimibe na população em diálise com base nos resultados dos ensaios clínicos anteriormente mencionados. Não há dados conclusivos disponíveis para os pacientes que já estão em uso de estatina ou estatina mais ezetimibe no início da diálise. No entanto, neste momento, a diretriz recomenda a continuação destes agentes e a realização de reavaliações periódicas (Quadro 21).
10.6. Hepatopatia
A ideia de que elevações das transaminases hepáticas acima de três vezes o valor de base seria um indicativo de lesão hepática quando do início de um tratamento medicamentoso partiu da Conferência de Fogarty em 1978, porém esta recomendação não foi baseada em grandes estudos clínicos. Estatinas têm demonstrado redução de eventos cardiovasculares maiores de cerca de 25 a 40%, de acordo com a população estudada. O Número Necessário para Tratar (NNT, do inglês Number Needed to Treat) para prevenir um evento acaba sendo muito baixo. Por outro lado, as estatísticas mostram que o Número Necessário para Causar Dano (NNH, do inglês number needed to harm) de hepatotoxicidade aguda é de 1:1 milhão.
Geralmente os pacientes que evoluem com elevação das enzimas hepáticas normalizam seus exames com a suspensão, ou mesmo com a redução da dose utilizada, provavelmente por mecanismo de adaptação, que faz com que as aminotransferases se estabilizem mesmo com a manutenção da medicação.
10.6.1. Doença hepática gordurosa não alcoólica
A doença hepática gordurosa não alcoólica é considerada uma manifestação comum da síndrome metabólica e ocorre em até 50% dos pacientes com diabetes melito 2. É sabido que até 25% dos pacientes com dislipidemia têm elevação de transaminases.398398 Wanner C, Krane V, Marz W, Olschewski M, Mann JF, Ruf G, et al; German Diabetes and Dialysis Study Investigators. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med. 2005;353(3):238-48. Erratum in: N Engl J Med. 2005;353(15):1640.
Afeta 15 a 30% da população ocidental e é caracterizada pela presença de gordura no fígado (> 5%), na ausência de excesso de consumo de álcool, hepatite crônica ou outras doenças hepáticas. A doença hepática gordurosa não alcoólica tem alta prevalência (75 a 100%) em populações com alterações metabólicas consequentes à resistência insulínica, tais como obesidade abdominal, síndrome metabólica e diabetes tipo 2. As manifestações histológicas da doença hepática gordurosa não alcoólica vão desde simples esteatose hepática, esteato-hepatite não alcoóloca, fibrose e até cirrose, que pode progredir, em alguns casos, para carcinoma hepatocelular. Estudos de seguimento de longo prazo observaram que a presença de doença hepática gordurosa não alcoólica confere risco elevado de eventos cardiovasculares, e este risco é proporcional ao grau de inflamação e fibrose hepáticas, independente de outros fatores associados. Historicamente, as estatinas foram contraindicadas em pacientes com enzimas hepáticas basais elevadas, situação frequente nestes pacientes. Atualmente, este conceito foi abandonado e recentes estudos têm demonstrado efeito hepatoprotetor nestes indivíduos. Melhora na histologia e diminuição das enzimas hepáticas foram descritas com diferentes estatinas neste caso.399399 Pandya V, Rao A, Chaudhary K. Lipid abnormalities in kidney disease and management strategies. World J Nephrol. 2015;4(1):83-91.,400400 Tonelli M, Wanner C, Kidney Disease: Improving Global Outcomes Lipid Guideline Development Work Group Members. Lipid management in chronic kidney disease: synopsis of the Kidney Disease: Improving Global Outcomes 2013 clinical practice guideline. Ann Intern Med. 2014;160(3):182.
Como estes pacientes também apresentam frequentemente dislipidemia e transaminases elevadas, e apesar do risco elevado, não há estudos clínicos que testaram o efeito das estatinas na redução de risco cardiovascular nesta população. Os dados disponíveis são análises post hoc de três ensaios clínicos randomizados: GREACE, ATTEMPT e IDEAL. Estes estudos avaliaram o uso de estatinas em pacientes em prevenção primária e secundária, com prevalência elevada de doença hepática gordurosa não alcoólica, esteato-hepatite não alcoólica e elevação de enzimas hepáticas (até três vezes o limite superior da normalidade), durante 3 a 5 anos. Foram utilizadas baixas doses de estatinas, tituladas até doses mais elevadas, de acordo com as transaminases hepáticas. A conclusão, confirmada nos três estudos, foi de que: as estatinas parecem ser seguras nos pacientes com doença hepática gordurosa não alcoólica e esteato-hepatite não alcoólica; podem contribuir para a normalizalçao da função hepática; reduzem o risco de morbimortalidade cardiovascular nessa população.397397 Fellstrom BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, et al; AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009;360(14):1395-407. Erratum in: N Engl J Med. 2010;362(15):1450.
398 Wanner C, Krane V, Marz W, Olschewski M, Mann JF, Ruf G, et al; German Diabetes and Dialysis Study Investigators. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med. 2005;353(3):238-48. Erratum in: N Engl J Med. 2005;353(15):1640.-399399 Pandya V, Rao A, Chaudhary K. Lipid abnormalities in kidney disease and management strategies. World J Nephrol. 2015;4(1):83-91.
10.6.2. Infecção pelo vírus da hepatite C
Está bem documentado que a esteatose hepática é um achado histopatológico comum em pacientes com Vírus da Hepatite C (HCV), o qual possui uma relação única de dependência de lipídios, lipoproteínas plasmáticas e cofatores do hospedeiro, facilitadores da replicação viral.
O HCV causa profundas alterações no hospedeiro infectado, resultando em esteatose hepática, hipocolesterolemia circulante e aterogênese. A infecção pelo HCV está associada à prevalência elevada de síndrome metabólica, que se sobrepõe ao observado na doença hepática gordurosa não alcoólica.
Estudos longitudinais em pacientes com infecção crônica pelo HCV e síndrome metabólica, comparados a pacientes não infectados,2929 Bansal S, Buring JE, Rifai N, Mora S, Sacks FM, Ridker PM. Fasting compared with nonfasting triglycerides and risk of cardiovascular events in women. JAMA. 2007;298(3):309-16. sugerem risco elevado de desenvolver aterosclerose precoce e DCV.
As estatinas têm demonstrado papel importante na modulação da esteatose hepática e metabolismo do colesterol, podendo representar potencial terapêutico para pacientes com hepatite C crônica.400400 Tonelli M, Wanner C, Kidney Disease: Improving Global Outcomes Lipid Guideline Development Work Group Members. Lipid management in chronic kidney disease: synopsis of the Kidney Disease: Improving Global Outcomes 2013 clinical practice guideline. Ann Intern Med. 2014;160(3):182.,401401 Targher G, Day CP, Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease. N Engl J Med. 2010;363(14):1341-50. O estudo longitudinal ERCHIVES (Electronically Retrived Cohort of HCV Infected Veterans), que é uma coorte bem estabelecida de veteranos com HCV, foi conduzido para se avaliar o impacto das estatinas nesta população. Os pacientes com infecção pelo HCV foram divididos em um grupo com e sem uso de estatinas. Foram avaliados mais de 3 mil pacientes em cada grupo e, em ambos, as transaminases eram em média duas a três vezes mais elevadas que o normal. Após 10 anos de seguimento, o uso de estatinas foi significativamente associado à redução da replicação viral, redução da progressão para cirrose e carcinoma hepatocelular.402402 Athyros VG, Tziomalos K, Gossios TD, Griva T, Anagnostis P, Kargiotis K, et al; GREACE Study Collaborative Group. Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation (GREACE) Study: a post-hoc analysis. Lancet. 2010;376(9756):1916-22.
10.6.3. Vírus da hepatite B e cirrose biliar primária
Relatos isolados têm demonstrado melhora histológica na infecção pelo Vírus da Hepatite B (HBV).403403 Calderon RM, Cubeddu LX, Goldberg RB, Schiff ER. Statins in the treatment of dyslipidemia in the presence of elevated liver aminotransferase levels: a therapeutic dilemma. Mayo Clin Proc. 2010;85(4):349-56. A sinvastatina pode contribuir para a diminuição da pressão portal em pacientes com cirrose.404404 Georgescu E, Catu D, Stoica RM, Ionescu RI. Fluvastatin as out-of-label enhancer for early and sustained virological response in chronic hepatitis C treated with peginterferon and ribavirin. J Hepatol. 2010;52(Suppl 1):5-110. Diferentes estatinas foram avaliadas no contexto do câncer de fígado secundárias a infecções crônica pelo HBV, mostrando clara diminuição na incidência.
A doença hepática crônica compensada não é considerada contraindicação absoluta para a iniciação e/ou manutenção da terapia com estatina (Grau de Recomendação: IIb; Nível de Evidência: C).
10.6.4. Recomendações atuais
10.6.4.1. Terapia com estatina e controle das enzimas hepáticas
O valor inicial de transaminases hepáticas deve ser determinado antes do início do tratamento com estatinas, bem como um breve histórico de alterações hepáticas com o uso de medicamentos. Deve-se também atentar para fármacos com potencial interação, o que potencializaria a chance de efeitos colaterais (Grau de Recomendação: IIb; Nível de Evidência: C).405405 Butt AA, Yan P, Bonilla H, Abou-Samra AB, Shaikh OS, Simon TG, et al; ERCHIVES (Electronically Retrieved Cohort of HCV Infected Veterans) Study Team. Effect of addition of statins to antiviral therapy in hepatitis C virus-infected persons: Results from ERCHIVES. Hepatology. 2015;62(2):365-74.
O controle periódico de enzimas hepáticas não é mais obrigatório, devendo ser realizado quando forem feitas novas dosagens de colesterol ou em caso de sintomas como letargia, icterícia e astenia. O aumento das bilirrubinas é o melhor marcador de lesão hepática por estatinas, devendo ser realizado sempre que a suspeita de alteração hepática for aventada.
10.7. Insuficiência cardíaca
Já foram documentados efeitos favoráveis das estatinas na prevenção e redução de desfechos nos pacientes com insuficiência cardíaca (Grau de Recomendação: I; Nível de Evidência: C), a partir de estudos observacionais, pequenos estudos e análises post hoc dos estudos randomizados com estatinas. Entretanto, os únicos dois estudos randomizados em pacientes com insuficiência cardíaca que utilizaram estatinas não demonstraram benefícios na redução de mortalidade em pacientes com classe funcional II a IV. No estudo CORONA406406 Tsan YT, Lee CH, Wang JD, Chen PC. Statins and the risk of hepatocellular carcinoma in patients with hepatitis B virus infection. J Clin Oncol. 2012;30(6):623-30. Erratum in: J Clin Oncol. 2013;31(24):3049. (The Controlled Rosuvastatin in Multinational Trial in Heart Failure), foram selecionados pacientes com 60 anos ou mais, portadores de cardiopatia isquêmica, fração de ejeção menor que 40% e LDL-c média de 137 mg/dL. Foram randomizados para rosuvastatina 10 mg por dia vs. placebo. Não houve redução de mortalidade cardiovascular ou por outras causas, nem redução de eventos cardiovasculares não fatais, sendo observada apenas redução de hospitalização no grupo que recebeu estatina. O GISSI-HF407407 Abraldes JG, Albillos A, Banares R, Turnes J, Gonzalez R, Garcia-Pagan JC, et al. Simvastatin lowers portal pressure in patients with cirrhosis and portal hypertension: a randomized controlled trial. Gastroenterology. 2009;136(5):1651-8. (Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardico Heart Failure) incluiu pacientes com insuficiência cardíaca de várias etiologias, com idade superior a 18 anos, sendo 40% portadores de cardiopatia isquêmica e LDL-c média de 122 mg/dL. Foram randomizados para rosuvastatina 10 mg/dia ou placebo. Não houve redução de mortalidade cardiovascular ou por todas as causas ou de eventos cardiovasculares não fatais no grupo tratado. Esses dois estudos concluíram que pacientes com insuficiência cardíaca que não utilizavam estatinas previamente não se beneficiaram com a introdução de rosuvastatina no tratamento da insuficiência cardíaca. Estes resultados surpreenderam principalmente pela prevalência de cardiopatia isquêmica, dada a eficácia das estatinas em reduzir eventos cardiovasculares em vários grupos de pacientes com doença aterosclerótica.
A insuficiência cardíaca, independentemente de sua etiologia, confere risco de mortalidade muito elevada por causas não aterotrombóticas. Assim, as populações com insuficiência cardíaca não teriam uma sobrevida suficientemente mais longa para experimentarem os benefícios das estatinas na redução de eventos aterotrombóticos, pois morreriam antes por outras causas não aterotrombóticas. Como a incidência de eventos aterotrombóticos foi muito baixa nesses dois estudos, foi realizada análise conjunta dos dados do CORONA e GISSI-HF, com objetivo de se obter maior poder estatístico para detecção de diferenças nos eventos aterotrombóticos nos grupos tratados. Foi demonstrada redução significativa de risco de infarto agudo do miocárdio, de pequena magnitude, nos pacientes com insuficiência cardíaca de origem isquêmica, tratados com rosuvastatina. A rosuvastatina pareceu ser efetiva na prevenção de infarto agudo do miocárdio, nos pacientes com insuficiência cardíaca isquêmica que não faziam uso prévio de estatinas.
10.8. HDL-c baixo e Hipertrigliceridemia
Hipertrigliceridemia e baixos níveis de HDL-c representam alterações lipídicas que compartilham etiologias e, assim, ocorrem em geral associadas. Essa interação acarreta o aumento do perfil de risco cardiovascular.408408 Lewis JH. Clinical perspective: statins and the liver--harmful or helpful? Dig Dis Sci. 2012;57(7):1754-63.
409 Kjekshus J, Apetrei E, Barrios V, Bohm M, Cleland JG, Cornel JH, et al; CORONA Group. Rosuvastatin in older patients with systolic heart failure. N Engl J Med. 2007;357(22):2248-61.-410410 Tavazzi L, Maggioni AP, Marchioli R, Barlera S, Franzosi MG, Latini R, et al; Gissi-HF Investigators. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet. 2008;372(9645):1231-9.
O mecanismo responsável por este perfil metabólico decorre do catabolismo aumentado de partículas de HDL ricas em TG.411411 Miller M, Seidler A, Moalemi A, Pearson TA. Normal triglyceride levels and coronary artery disease events: the Baltimore Coronary Observational Long-Term Study. J Am Coll Cardiol. 1998;31(6):1252-7. Em indivíduos com hipertigliceridemia, inclusive pós-prandial, CETP facilita a transferência de TG da VLDL para a HDL, resultando na formação de partículas de HDL enriquecidas de TG e depletadas de colesterol. Essas partículas têm sabidamente maior potencial aterogênico.412412 Gaziano JM, Hennekens CH, O'Donnell CJ, Breslow JL, Buring JE. Fasting triglycerides, high-density lipoprotein, and risk of myocardial infarction. Circulation. 1997;96(8):2520-5.
10.8.1. Hipertrigliceridemia
A hipertrigliceridemia é fator de risco independente para a DCV, em especial a DAC.413413 Manninen V, Tenkanen L, Koskinen P, Huttunen JK, Manttari M, Heinonen OP, et al. Joint effects of serum triglyceride and LDL cholesterol and HDL cholesterol concentrations on coronary heart disease risk in the Helsinki Heart Study. Implications for treatment. Circulation. 1992;85(1):37-45. Entretanto, não está claro se a hipertrigliceridemia é causa da aterosclerose, já que os TG pouco se acumulam nas paredes arteriais, ou se as anormalidades a ela associadas, como HDL-c baixa,414414 Horowitz BS, Goldberg IJ, Merab J, Vanni TM, Ramakrishnan R, Ginsberg HN. Increased plasma and renal clearance of an exchangeable pool of apolipoprotein A-I in subjects with low levels of high density lipoprotein cholesterol. J Clin Invest. 1993;91(4):1743-52.
415 Kontush A, de Faria EC, Chantepie S, Chapman MJ. Antioxidative activity of HDL particle subspecies is impaired in hyperalphalipoproteinemia: relevance of enzymatic and physicochemical properties. Arterioscler Thromb Vasc Biol. 2004;24(3):526-33.-416416 Thompson WG, Gau GT. Hypertriglyceridemia and its pharmacologic treatment among US adults--invited commentary. Arch Intern Med. 2009;169(6):578-9. partículas LDL pequenas e densas,417417 Wittrup HH, Tybjaerg-Hansen A, Nordestgaard BG. Lipoprotein lipase mutations, plasma lipids and lipoproteins, and risk of ischemic heart disease. A meta-analysis. Circulation. 1999;99(22):2901-7.,418418 Sprecher DL, Harris BV, Stein EA, Bellet PS, Keilson LM, Simbartl LA. Higher triglycerides, lower high-density lipoprotein cholesterol, and higher systolic blood pressure in lipoprotein lipase-deficient heterozygotes. A preliminary report. Circulation. 1996;94(12):3239-45. resistência insulínica419419 Hypertriglyceridaemia and vascular risk. Report of a meeting of physicians and scientists, University College London Medical School. Lancet. 1993;342(8874):781-7.,420420 Miller BD, Alderman EL, Haskell WL, Fair JM, Krauss RM. Predominance of dense low-density lipoprotein particles predicts angiographic benefit of therapy in the Stanford Coronary Risk Intervention Project. Circulation. 1996;94(9):2146-53. e aumento da coagulabilidade e hiperviscosidade sanguínea,421421 Brunzell JD. Clinical practice. Hypertriglyceridemia. N Engl J Med. 2007;357(10):1009-17.
422 DeFronzo RA, Ferrannini E. Insulin resistance: a multifaceted syndrome responsible for NIDDM, obesity, hypertension, dyslipidemia, and atherosclerotic cardiovascular disease. Diabetes Care. 1991;14(3):173-94.-423423 McLaughlin T, Abbasi F, Cheal K, Chu J, Lamendola C, Reaven G. Use of metabolic markers to identify overweight individuals who are insulin resistant. Ann Intern Med. 2003;139(10):802-9. predispuser à aterosclerose. Paralelamente, existem dúvidas se a diminuição dos TG reduz também o risco cardiovascular.
A associação entre hipertrigliceridemia e DCV foi avaliada em estudos angiográficos416416 Thompson WG, Gau GT. Hypertriglyceridemia and its pharmacologic treatment among US adults--invited commentary. Arch Intern Med. 2009;169(6):578-9.,424424 Simpson HC, Mann JI, Meade TW, Chakrabarti R, Stirling Y, Woolf L. Hypertriglyceridaemia and hypercoagulability. Lancet. 1983;1(8328):786-90.
425 Humphries SE, Lane A, Green FR, Cooper J, Miller GJ. Factor VII coagulant activity and antigen levels in healthy men are determined by interaction between factor VII genotype and plasma triglyceride concentration. Arterioscler Thromb. 1994;14(2):193-8.
426 Rosenson RS, Shott S, Lu L, Tangney CC. Hypertriglyceridemia and other factors associated with plasma viscosity. Am J Med. 2001;110(6):488-92.
427 Ballantyne CM, Grundy SM, Oberman A, Kreisberg RA, Havel RJ, Frost PH, et al. Hyperlipidemia: diagnostic and therapeutic perspectives. J Clin Endocrinol Metab. 2000;85(6):2089-112.
428 Hodis HN, Mack WJ. Triglyceride-rich lipoproteins and the progression of coronary artery disease. Curr Opin Lipidol. 1995;6(4):209-14.-429429 Mack WJ, Krauss RM, Hodis HN. Lipoprotein subclasses in the Monitored Atherosclerosis Regression Study (MARS). Treatment effects and relation to coronary angiographic progression. Arterioscler Thromb Vasc Biol. 1996;16(5):697-704. e em estudos de eventos clínicos. Em metanálise incluindo mais de 260 mil participantes, a odds ratio para DCV na comparação entre os indivíduos no terceiro tercil de TG e os no primeiro foi de 1,7 (IC95%: 1,6-1,9).430430 Hodis HN, Mack WJ, Dunn M, Liu C, Liu C, Selzer RH, et al. Intermediate-density lipoproteins and progression of carotid arterial wall intima-media thickness. Circulation. 1997;95(8):2022-6. Em estudo prospectivo incluindo 14 mil homens jovens cujos TG foram avaliados em intervalo de 5 anos, foi observado que os TG foram forte e independentemente associados a risco de DCV (odds ratio para DCV de 4,1 quando comparados indivíduos no quinto e primeiro e quintis de TG), e o aumento dos TG entre a primeira e segunda medidas foi associado ao maior risco cardiovascular.431431 Jukema JW, van Boven AJ, Groenemeijer B, Zwinderman AH, Reiber JH, Bruschke AV, et al. The Asp9 Asn mutation in the lipoprotein lipase gene is associated with increased progression of coronary atherosclerosis. REGRESS Study Group, Interuniversity Cardiology Institute, Utrecht, The Netherlands. Regression Growth Evaluation Statin Study. Circulation. 1996;94(8):1913-8.
Embora os TG sejam comumente dosados em jejum, estudos mostraram que valores dosados sem jejum estão associados ao maior risco de eventos cardiovasculares,2929 Bansal S, Buring JE, Rifai N, Mora S, Sacks FM, Ridker PM. Fasting compared with nonfasting triglycerides and risk of cardiovascular events in women. JAMA. 2007;298(3):309-16..4444 Nordestgaard BG, Benn M, Schnohr P, Tybjaerg-Hansen A. Nonfasting triglycerides and risk of myocardial infarction, ischemic heart disease, and death in men and women. JAMA. 2007;298(3):299-308.,432432 Stewart BF, Brown BG, Zhao XQ, Hillger LA, Sniderman AD, Dowdy A, et al. Benefits of lipid-lowering therapy in men with elevated apolipoprotein B are not confined to those with very high low density lipoprotein cholesterol. J Am Coll Cardiol. 1994;23(4):899-906. incluindo AVC isquêmico.
A hipertrigliceridemia pode ser de causa primária ou secundária, de acordo com o quadro 22.
10.8.2. Baixos níveis do HDL-c
Baixos níveis circulantes de HDL-c representam um problema que é prevalente e clinicamente desafiador, com dados atuais controversos e intrigantes. O HDL-c baixo é definido como um valor abaixo de 40 mg/dL para homens e abaixo de 50 mg/dL para mulheres, o que corresponde aproximadamente ao percentil 50.433433 Sarwar N, Danesh J, Eiriksdottir G, Sigurdsson G, Wareham N, Bingham S, et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation. 2007;115(4):450-8. Baixos níveis de HDL-c podem ocorrer como anormalidade isolada ou, mais frequentemente, em associação com hipertrigliceridemia e/ou com níveis aumentados de LDL-c ou de ApoB.434434 Tirosh A, Rudich A, Shochat T, Tekes-Manova D, Israeli E, Henkin Y, et al. Changes in triglyceride levels and risk for coronary heart disease in young men. Ann Intern Med. 2007;147(6):377-85.
HDL-c baixo é uma das anormalidades lipídicas mais comuns,435435 Freiberg JJ, Tybjaerg-Hansen A, Jensen JS, Nordestgaard BG. Nonfasting triglycerides and risk of ischemic stroke in the general population. JAMA. 2008;300(18):2142-52. especialmente em grupo de pacientes com diabetes ou com DAC. A prevalência de HDL-c baixo varia de 20% na população geral a até 60% em pacientes com doença coronária diagnosticada.436436 Schaefer EJ, Lamon-Fava S, Ordovas JM, Cohn SD, Schaefer MM, Castelli WP, et al. Factors associated with low and elevated plasma high density lipoprotein cholesterol and apolipoprotein A-I levels in the Framingham Offspring Study. J Lipid Res. 1994;35(5):871-82.
A concentração de HDL-c no plasma é determinada por herança complexa, sendo influenciada por fatores genéticos e ambientais. Sabe-se que peso corporal, tabagismo, consumo de álcool, hábitos alimentares e exercício físico respondem por cerca de 50% da variação interindividual da concentração de HDL-c na população geral. A hereditariedade contribui para os 50% restantes. Mutações em genes envolvidos na regulação do metabolismo da HDL, como ABCA1, ApoA-I e LCAT, estão implicadas em formas raras de hipoalfalipoproteinemia e explicam apenas uma pequena porcentagem destes casos. Por outro lado, polimorfismos genéticos localizados nestes genes são fonte importante de variação no HDL-c.437437 Genest JJ, Jr., Martin-Munley SS, McNamara JR, Ordovas JM, Jenner J, Myers RH, et al. Familial lipoprotein disorders in patients with premature coronary artery disease. Circulation. 1992;85(6):2025-33.
Vários estudos epidemiológicos, dados clínicos e estudos de intervenção114114 Gordon T, Castelli WP, Hjortland MC, Kannel WB, Dawber TR. High density lipoprotein as a protective factor against coronary heart disease. The Framingham Study. Am J Med. 1977;62(5):707-14.,115115 Assmann G, Schulte H. Relation of high-density lipoprotein cholesterol and triglycerides to incidence of atherosclerotic coronary artery disease (the PROCAM experience). Prospective Cardiovascular Münster study. Am J Cardiol. 1992;70(7):733-7.,438438 Hansel B, Kontush A, Giral P, Bonnefont-Rousselot D, Chapman MJ, Bruckert E. One third of the variability in HDL-cholesterol level in a large dyslipidaemic population is predicted by age, sex and triglyceridaemia: The Paris La Pitie Study. Curr Med Res Opin. 2006;22(6):1149-60.,439439 Franceschini G. Epidemiologic evidence for high-density lipoprotein cholesterol as a risk factor for coronary artery disease. Am J Cardiol. 2001;88(12A):9N-13N. demonstraram que baixos níveis circulantes de HDL-c constituem um preditor significativo e independente de DCV. É importante ressaltar que a relação inversa entre níveis de HDL-c e risco cardiovascular persiste em diversos grupos populacionais e com doenças específicas.
A partir da constatação da relação inversa entre HDL-c e risco de doença coronariana, a concentração de HDL-c passou a ser utilizada em larga escala como um importante indicador laboratorial de risco cardiovascular.
Apesar do grande conjunto de provas que evidenciam a relação inversa entre os níveis de HDL-c e risco cardiovascular, os baixos níveis de HDL-c não foram estabelecidos como causadores de aterosclerose. O argumento para a falta de nexo causal vem da análise de randomização mendeliana440440 Lu Y, Dolle ME, Imholz S, van 't Slot R, Verschuren WM, Wijmenga C, et al. Multiple genetic variants along candidate pathways influence plasma high-density lipoprotein cholesterol concentrations. J Lipid Res. 2008;49(12):2582-9. e da dificuldade em demonstrar melhores resultados com terapias para aumentar o HDL-c.1818 Mackman N. Triggers, targets and treatments for thrombosis. Nature. 2008;451(7181):914-8.,1919 Libby P, Theroux P. Pathophysiology of coronary artery disease. Circulation. 2005;111(25):3481-8.,261261 Haynes R, Jiang L, Hopewell JC, Li J, Chen F, Parish S, et al; HPS2-THRIVE Collaborative Group.. HPS2-THRIVE randomized placebo-controlled trial in 25 673 high-risk patients of ER niacin/laropiprant: trial design, pre-specified muscle and liver outcomes, and reasons for stopping study treatment. Eur Heart J. 2013;34(17):1279-91.
É preciso lembrar que o HDL-c reflete apenas o conteúdo de colesterol presente no total das partículas de HDL, e que estas formam um grupo bastante heterogêneo, com relação a tamanho, composição e funcionalidade. A existência de subpopulações distintas de HDL é consistente com o fato de estas partículas exercerem várias funções biológicas.441441 Gofman JW, Young W, Tandy R. Ischemic heart disease, atherosclerosis, and longevity. Circulation. 1966;34(4):679-97. O estudo destas subpopulações tem sido objeto de intensas pesquisas, para determinar o papel de cada uma delas no processo antiaterogênico. Com isto, seria possível estabelecer novos biomarcadores de risco cardiovascular mais precisos do que a concentração de HDL-c.
Assim, o conceito atual é que a funcionalidade da HDL (qualidade) é um indicador mais preciso para o risco de desenvolvimento de aterosclerose e também de gravidade da DCV, do que a concentração de HDL-c (quantidade).442442 Miller GJ, Miller NE. Plasma-high-density-lipoprotein concentration and development of ischaemic heart-disease. Lancet. 1975;1(7897):16-9.,443443 Voight BF, Peloso GM, Orho-Melander M, Frikke-Schmidt R, Barbalic M, Jensen MK, et al. Plasma HDL cholesterol and risk of myocardial infarction: a mendelian randomisation study. Lancet. 2012;380(9841):572-80. Erratum in: Lancet. 2012;380(9841):564. Esta hipótese tem levado à investigação de HDL tanto como um biomarcador de risco cardiovascular como alvo terapêutico para ser funcionalmente modulado.
Baixos níveis de HDL-c muitas vezes refletem uma anormalidade genética. Deve-se pensar em anormalidades genéticas quando se depara com muito baixos níveis de HDL-c (<10 mg/dL), embora também estes possam ser influenciados por um nível elevado de triglicerídeos ou por acompanhar tabagismo, sedentarismo, hipertensão arterial, bem como por alimentação com alta ingestão de carboidratos ou gorduras poli-insaturadas.
Devem ser solicitados testes para descartar causas secundárias de baixos níveis de HDL-c, algumas das quais reversíveis. Vários fármacos podem diminuir os níveis de HDL-c, entre eles os esteroides anabolizantes, os antipsicóticos atípicos, a terapia antirretroviral para o HIV/AIDS, betabloqueadores e agentes imunossupressores. Doenças hepáticas, incluindo cirrose, podem diminuir todas as subfrações de colesterol, por prejudicarem produção de Apo. Também, baixos níveis de HDL-c são frequentemente observados em estados inflamatórios agudos. Devemos pensar em anormalidades genéticas quando nos deparamos com muito baixos níveis de HDL-c (< 10 mg/dL).
10.8.3. Estratégia em pacientes com baixos níveis do colesterol da lipoproteína de alta densidade e hipertrigliceridemia
O tratamento tanto da hipertrigliceridemia como dos baixos níveis de HDL-c inclui medidas comportamentais e farmacológicas. O tratamento das dislipidemias secundárias deve ser voltado para o controle da doença de base ou a retirada do esquema terapêutico do medicamento implicado.
A indicação do tratamento das dislipidemias é a redução do risco cardiovascular. Assim, a decisão a respeito da terapia farmacológica deve ser baseada na estratificação do risco cardiovascular de cada indivíduo, na redução do risco esperado e nos possíveis efeitos colaterais. Até o momento, as estatinas permanecem como a primeira linha de terapia entre os indivíduos com baixos níveis de HDL-c, hipertrigliceridemia e com risco cardiovascular significativamente alto, que justifique intervenção, tal como definido por algoritmos de risco validados. Mudanças no estilo de vida oferecem benefícios de saúde em geral, incluindo a possibilidade de melhoria dos níveis de TG e de HDL-c, bem como de sua funcionalidade.
Para o tratamento com alvo específico na HDL, o fibrato pode ser uma opção razoável para pacientes com risco cardiovascular significativo, juntamente das estatinas, se os níveis de triglicéridos forem elevados (acima de 200 mg/dL) e os de HDL-c baixos. A niacina, se tolerada, continua a ser outra opção em pacientes com níveis substancialmente elevados de Lp(a), intolerantes à estatina, ou em associação com estatinas, em pacientes com HDL-c baixo isolado e eventos cardiovasculares progressivos. O tratamento para HDL-c baixo e TG altos inclui medidas comportamentais e farmacológicas.
Medidas comportamentais não farmacológicas que podem ser tomadas:
-
Exercício aeróbico: considerado fundamental para aumentar os níveis de HDL-c e diminuir os níveis de TG. No entanto, este deve ser de intensidade moderada e regular, para aumentar os níveis de HDL-c em 5 a 10%, e melhorar a funcionabilidade das particulas de HDL, além de reduzir em 33% os TG quando associado à dieta hipocalórica.444444 Rached FH, Chapman MJ, Kontush A. HDL particle subpopulations: Focus on biological function. Biofactors. 2015;41(2):67-77.
-
Perda de peso: o excesso de peso e a obesidade são fortemente associados tanto com níveis baixos de HDL-c, como elevados de triglicéridos. Alterações agudas na perda de peso podem inicialmente diminuir os níveis de HDL-c. No entanto, com a estabilização de peso, os níveis de HDL-c geralmente aumentam de 0,35 mg/dL por quilograma perdido, independentemente da estratégia de perda de peso utilizada.445445 Khera AV, Cuchel M, de la Llera-Moya M, Rodrigues A, Burke MF, Jafri K, et al. Cholesterol efflux capacity, high-density lipoprotein function, and atherosclerosis. N Engl J Med. 2011;364(2):127-35.
-
Nutrição: os pacientes que consomem muito baixo teor de gordura na dieta frequentemente têm níveis mais baixos de HDL-c mas também níveis baixos de LDL-c. As dietas ricas em gorduras saturadas ou gordura trans tendem a diminuírem os níveis de HDL-c, com possível detrimento da funcionalidade das particulas de HDL e adicionais aumentos no LDL-c. Carboidratos processados que aumentam rapidamente os níveis de glicose (ou seja, com alto índice glicêmico) podem diminuir níveis de HDL-c e aumentar os níveis de TG, além de elevar a inflamação e o risco cardiovascular. A ênfase em porções modestas de uma dieta rica em frutas e vegetais frescos, pobre em carboidratos processados e carnes, e rica em ácidos graxos poli-insaturados permanece aconselhável.
-
Cessar tabagismo: o estresse oxidativo e a inflamação induzidos pelo tabagismo levam à diminuição tanto da quantidade quanto da qualidade da HDL. Fumantes tendem a ter níveis de HDL-c 5% a 10% menores do que controles. É importante ressaltar que a cessação do tabagismo leva ao aumento do HDL-c de ~ 4 mg/dL com um impacto mínimo sobre outros lípidos.
-
Ingestão de álcool: o consumo de álcool pode aumentar HDL-c em aproximadamente 2 mg/dL por dose diária de alcool. No entanto, não há dados de ensaios clínicos disponíveis demonstrando qualquer papel positivo que elevando-se os níveis de HDL-c com álcool ocorra redução de eventos cardiovasculares em pacientes com DAC. O consumo de álcool deve ser evitado se houver hipertrigliceridemia associada.
As medidas farmacológicas incluem:
-
Estatinas: até o momento, continuam a ser a primeira linha terapêutica entre os indivíduos com baixos níveis de HDL-c e hipertigliceridemia associados a risco cardiovascular significativamente alto, que justifique intervenção, especialmente focando nos níveis de LDL-c, como definido por meio de algoritmos de risco validados.
-
Fibratos: para o tratamento com alvo específico no HDL-c, fibrato pode ser uma opção razoável para usar em pacientes com risco cardiovascular significativo, juntamente das estatinas, se os níveis de TG forem elevados (acima de 200 mg/dL) e de HDL-c, baixos (< 34 mg/dL). Com relação ao tratamento da hipertrigliceridemia, é incerto se a redução dos TG diminui o risco cardiovascular.446446 Rohatgi A, Khera A, Berry JD, Givens EG, Ayers CR, Wedin KE, et al. HDL cholesterol efflux capacity and incident cardiovascular events. N Engl J Med. 2014;371(25):2383-93. No braço Lipid do estudo ACCORD (Action to Control Cardiovascular Risk in Diabetes), a associação de fenofibrato à estatina não mostrou benefício em pacientes diabéticos, mas diminuiu a ocorrência de desfechos no subgrupo de pacientes com TG acima de 204 mg/dL e HDL-c abaixo de 34 mg/dL.319319 Hendry WG, Seed M. Homozygous familial hypercholesterolaemia with supravalvar aortic stenosis treated by surgery. J R Soc Med. 1985;78(4):334-5. Esta subanálise foi planejada baseada em observações similares de benefício no uso de fenofibrato nesse mesmo grupo de pacientes nos estudos Helsinki Heart Study, FIELD257257 Keech A, Simes RJ, Barter P, Best J, Scott R, Taskinen MR, et al; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet. 2005;366(9500):1849-61. (Fenofibrate Intervention and Event Lowering in Diabetes) e BIP (The Bezafibrate Infarction Prevention).447447 Wood PD, Stefanick ML, Williams PT, Haskell WL. The effects on plasma lipoproteins of a prudent weight-reducing diet, with or without exercise, in overweight men and women. N Engl J Med. 1991;325(7):461-6.
-
Niacina: se tolerada, continua a ser outra opção em pacientes com níveis substancialmente elevados de Lp(a), intolerantes às estatinas, ou em associação com estatinas, em pacientes com baixo níveis de HDL-c e altos níveis de TG.
-
Inibidores da CETP: um estudo envolvendo um inibidor de CETP, o torcetrapib, mostrou que a droga aumenta marcadamente os níveis de HDL-c e reduz os níveis de LDL-c, tanto quando usado isoladamente como também em combinação com uma estatina. Entretanto, apesar de importante aumento nos níveis de HDL-c, não se observou redução de mortalidade. Outros dois estudos com inibidores de CETP, o dalcetrapib e evacetrapib, também não mostraram eficácia na redução de mortalidade. O estudo com o anacetrapib, outra medicação da mesma classe, está previsto para ser finalizado no início de 2017. Até o momento, a terapia com inibidores de CETP ainda precisa ser testada em uma população maior e deve ser demonstrado por meio destes estudos que a droga não só aumenta os níveis de HDL-c, mas que também reduz eventos cardiovasculares.
-
Óleos de peixe: suplementos de óleo de peixe contendo ácidos graxos EPA e DHA em concentração ≥ 3 g ao dia podem reduzir as concentrações de TG em aproximadamente 50%.448448 Dattilo AM, Kris-Etherton PM. Effects of weight reduction on blood lipids and lipoproteins: a meta-analysis. Am J Clin Nutr. 1992;56(2):320-8.
-
Infusões de ApoA-I/HDL reconstituído: infusões venosas por um curto período de tempo de ApoA-I/HDL reconstituído têm sido seletivamente utilizadas em alguns pacientes, interferindo no processo de transporte reverso de colesterol, e com evidências de melhora de ateroma coronariano.449449 Ginsberg HN. Hypertriglyceridemia: new insights and new approaches to pharmacologic therapy. Am J Cardiol. 2001;87(10):1174-80; A4. Entretanto, este produto ainda não está disponível para uso clínico regular devido a algumas limitações pois, além do alto custo, é necessária uma administração endovenosa em altas doses para que bons resultados sejam obtidos.
-
Peptídeos mimeticos de ApoA-I: ApoA-I é uma proteína grande, o que restringe sua administração somente por via venosa. Investigações detalhadas das características físico-químicas da ApoA-I levaram à conclusão de que determinadas regiões da molécula são críticas na determinação da bioatividade. Um peptídeo potente, denominado D-4F, foi sintetizado a partir de D-aminoácidos da ApoA-I e pode ser administrado por via oral. O uso do D-4F, quando em combinação com uma estatina, reduziu o tamanho de lesão aterosclerótica, assim como o seu conteúdo de macrófagos em camundongos com aterosclerose.450450 Bezafibrate Infarction Prevention (BIP) study. Secondary prevention by raising HDL cholesterol and reducing triglycerides in patients with coronary artery disease. Circulation. 2000;102(1):21-7. Ensaios clínicos com a utilização do D-4F em humanos foram descontinuados por ausência de benefício.
-
HDL delipidado: estudos mostraram que a HDL pré-beta aumenta o efluxo de colesterol e é a forma mais eficaz de HDL para a remoção de lipídios de placa arterial via transporte reverso de colesterol. O processo de delipidação do plasma, por meio de aférese, converte HDL alfa para a HDL pré-beta. A infusão seriada de HDL delipidado autólogo mostrou-se eficaz em aumentar a quantidade de HDL pré-beta em alguns pacientes ateroscleróticos, determinando um importante avanço na abordagem de pacientes com síndrome coronária aguda.451451 Harris WS, Connor WE, Illingworth DR, Rothrock DW, Foster DM. Effects of fish oil on VLDL triglyceride kinetics in humans. J Lipid Res. 1990;31(9):1549-58.
Assim, baixos níveis de HDL-c e altos de TG em geral ocorrem de forma concomitante e devem ser interpretados como parte de um perfil metabólico aterogênico, e tratados de forma agressiva tanto por medidas farmacológicas, como não farmacológicas. Até o momento, novas terapêuticas para aumentar o HDL-c não estão estabelecidas.
10.9. HIV
O aumento da expectativa de vida dos indivíduos infectados pelo HIV após a introdução do Tratamento Antirretroviral (TARV) modificou completamente o perfil desta população.452452 Nissen SE, Tsunoda T, Tuzcu EM, Schoenhagen P, Cooper CJ, Yasin M, et al. Effect of recombinant ApoA-I Milano on coronary atherosclerosis in patients with acute coronary syndromes: a randomized controlled trial. JAMA. 2003;290(17):2292-300. De um lado, estes indivíduos ficaram expostos por mais tempo aos fatores de risco cardiovascular mais prevalentes neste grupo, como tabagismo, alcoolismo, dieta não saudável e sedentarismo. Do outro, a persistência da infecção pelo HIV mantém um estado crônico de agressão inflamatória comumente associado à gênese e à progressão da aterosclerose.453453 Navab M, Anantharamaiah GM, Hama S, Garber DW, Chaddha M, Hough G, et al. Oral administration of an Apo A-I mimetic Peptide synthesized from D-amino acids dramatically reduces atherosclerosis in mice independent of plasma cholesterol. Circulation. 2002;105(3):290-2. De fato, alguns estudos mostraram, nesta população, aumento relativo das mortes por causas não diretamente relacionadas à infecção, como diabetes e doença isquêmica do coração.454454 Waksman R, Torguson R, Kent KM, Pichard AD, Suddath WO, Satler LF, et al. A first-in-man, randomized, placebo-controlled study to evaluate the safety and feasibility of autologous delipidated high-density lipoprotein plasma infusions in patients with acute coronary syndrome. J Am Coll Cardiol. 2010;55(24):2727-35. Além disto, o próprio vírus parece ter uma ação direta sobre o sistema circulatório, incluindo a parede vascular arterial sistêmica, pulmonar e também o miocárdio.455455 Bhaskaran K, Hamouda O, Sannes M, Boufassa F, Johnson AM, Lambert PC, et al; CASCADE Collaboration. Changes in the risk of death after HIV seroconversion compared with mortality in the general population. JAMA. 2008;300(1):51-9.
O sinergismo aterogênico destas condições foi amplificado pelos efeitos da TARV, muitas vezes responsável pela modificação do perfil metabólico, com grande elevação de TG, redução de HDL-c, resistência à insulina e diabetes.456456 Grunfeld C, Pang M, Doerrler W, Shigenaga JK, Jensen P, Feingold KR. Lipids, lipoproteins, triglyceride clearance, and cytokines in human immunodeficiency virus infection and the acquired immunodeficiency syndrome. J Clin Endocrinol Metab. 1992;74(5):1045-52.,457457 Smith CJ, Ryom L, Weber R, Morlat P, Pradier C, Reiss P, et al; D:A:D Study Group. Trends in underlying causes of death in people with HIV from 1999 to 2011 (D:A:D): a multicohort collaboration. Lancet. 2014;384(9939):241-8. Os mecanismos envolvidos no desenvolvimento deste intenso desequilíbrio metabólico parecem residir na interferência no processo de diferenciação dos adipócitos e no funcionamento de proteínas envolvidas no metabolismo lipídico.458458 Hajjar LA, Calderaro D, Yu PC, Giuliano I, Lima EM, Barbaro G, et al. [Cardiovascular manifestations in patients infected with the human immunodeficiency virus]. Arq Bras Cardiol. 2005;85(5):363-77.,459459 Sposito AC, Caramelli B, Sartori AM, F Ramires JA. The Lipoprotein Profile in HIV Infected Patients. Braz J Infect Dis. 1997;1(6):275-83.
O primeiro passo na prevenção da aterosclerose neste grupo populacional está na avaliação do risco por meio do escore de Framingham, antes mesmo da instituição do TARV (Grau de Recomendação: I; Nível de Evidência: B).460460 Caramelli B, de Bernoche CY, Sartori AM, Sposito AC, Santos RD, Monachini MC, et al. Hyperlipidemia related to the use of HIV-protease inhibitors: natural history and results of treatment with fenofibrate. Braz J Infect Dis. 2001;5(6):332-8. Paralelamente, tendo em vista a importância de seu efeito no perfil inflamatório e metabólico, é fundamental buscar o controle da infecção por meio da redução da carga viral (Grau de Recomendação: I; Nível de Evidência: A).461461 Carr A, Samaras K, Chisholm DJ, Cooper DA. Pathogenesis of HIV-1-protease inhibitor-associated peripheral lipodystrophy, hyperlipidaemia, and insulin resistance. Lancet. 1998;351(9119):1881-3.
A exemplo do que é recomendado para a população geral, a modificação dos hábitos de vida, com adoção de dieta saudável, prática de atividade física e, em especial, cessação do tabagismo, deve ser estimulada durante todo o seguimento (Grau de Recomendação: I; Nível de Evidência: A).462462 Bastard JP, Caron M, Vidal H, Jan V, Auclair M, Vigouroux C, et al. Association between altered expression of adipogenic factor SREBP1 in lipoatrophic adipose tissue from HIV-1-infected patients and abnormal adipocyte differentiation and insulin resistance. Lancet. 2002;359(9311):1026-31.
O risco cardiovascular deve ser recalculado 1 mês após a introdução da TARV e, depois disto, a cada 6 meses, ou cada vez que o esquema da TARV for modificado, uma vez que cada medicamento influencia no perfil lipídico de maneira específica e em grau diferente (Grau de Recomendação: IIa; Nível de Evidência: C).462462 Bastard JP, Caron M, Vidal H, Jan V, Auclair M, Vigouroux C, et al. Association between altered expression of adipogenic factor SREBP1 in lipoatrophic adipose tissue from HIV-1-infected patients and abnormal adipocyte differentiation and insulin resistance. Lancet. 2002;359(9311):1026-31. O uso de medicamentos hipolipemiantes é frequentemente necessário, para o controle da dislipidemia e a redução do risco cardiovascular dos indivíduos vivendo com HIV.
Por outro lado, a monitorização clínica e laboratorial de eventuais efeitos adversos deve ser frequente, incluindo a pesquisa de toxicidade muscular por avaliação de sintomas de miopatia e dosagens de CK (Grau de Recomendação: IIa; Nível de Evidência: C).462462 Bastard JP, Caron M, Vidal H, Jan V, Auclair M, Vigouroux C, et al. Association between altered expression of adipogenic factor SREBP1 in lipoatrophic adipose tissue from HIV-1-infected patients and abnormal adipocyte differentiation and insulin resistance. Lancet. 2002;359(9311):1026-31. Os inibidores de protease, classe de medicamentos fundamental no esquema TARV, são preferencialmente metabolizados pelo CYP P450 3A4 e apresentam interações com estatinas, por compartilharem os mesmos sítios de metabolização hepática.463463 Lima EM, Gualandro DM, Yu PC, Giuliano Ide C, Marques AC, Calderaro D, et al. Cardiovascular prevention in HIV patients: results from a successful intervention program. Atherosclerosis. 2009;204(1):229-32.,464464 Group ISS, Lundgren JD, Babiker AG, Gordin F, Emery S, Grund B, et al; INSIGHT START Study Group. Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med. 2015;373(9):795-807. Portanto, deve ser dada preferência para estatinas que atuem em sítios de metabolização distintos, como a pitavastatina e pravastatina, evitando aquelas com metabolização exclusiva por esta via metabólica hepática, como a sinvastatina (Grau de Recomendação: III; Nível de Evidência: B).463463 Lima EM, Gualandro DM, Yu PC, Giuliano Ide C, Marques AC, Calderaro D, et al. Cardiovascular prevention in HIV patients: results from a successful intervention program. Atherosclerosis. 2009;204(1):229-32.
464 Group ISS, Lundgren JD, Babiker AG, Gordin F, Emery S, Grund B, et al; INSIGHT START Study Group. Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med. 2015;373(9):795-807.-465465 Sposito AC, Caramelli B, Fonseca FA, Bertolami MC, Afiune Neto A, Souza AD, et al; Sociedade Brasileira de Cardiologia. [IV Brazilian guideline for dyslipidemia and atherosclerosis prevention: Department of Atherosclerosis of Brazilian Society of Cardiology]. Arq Bras Cardiol. 2007;88 Suppl 1:2-19. Por outro lado, a rosuvastatina e a atorvastatina também foram utilizadas com segurança neste grupo populacional.466466 Chauvin B, Drouot S, Barrail-Tran A, Taburet AM. Drug-drug interactions between HMG-CoA reductase inhibitors (statins) and antiviral protease inhibitors. Clini Pharmacokinet. 2013;52(10):815-31.,467467 Advani A, Patel M, Pichardo RV, Whitty Y, Advani S. Use of HMG-CoA reductase inhibitors in the HIV population: implications for individualized treatment selection. J Manag Care Spec Pharm. 2014;20(3):262-72. Os fibratos (à exceção da genfibrozila) podem ser administrados em concomitância aos inibidores de protease e/ou em associação com estatinas, no caso de dislipidemias mistas graves (Grau de Recomendação: IIa; Nível de Evidência: B).465465 Sposito AC, Caramelli B, Fonseca FA, Bertolami MC, Afiune Neto A, Souza AD, et al; Sociedade Brasileira de Cardiologia. [IV Brazilian guideline for dyslipidemia and atherosclerosis prevention: Department of Atherosclerosis of Brazilian Society of Cardiology]. Arq Bras Cardiol. 2007;88 Suppl 1:2-19.
Algumas diretrizes, especificamente da infectologia, recomendam que a escolha do TARV seja guiada pelo risco cardiovascular do paciente.468468 Calza L, Manfredi R, Chiodo F. Statins and fibrates for the treatment of hyperlipidaemia in HIV-infected patients receiving HAART. AIDS. 2003;17(6):851-9. De maneira semelhante, alguns autores advogam que seja realizada a troca dos medicamentos componentes da TARV (switching) toda vez que for detectado risco cardiovascular elevado com base nos níveis lipídicos.468468 Calza L, Manfredi R, Chiodo F. Statins and fibrates for the treatment of hyperlipidaemia in HIV-infected patients receiving HAART. AIDS. 2003;17(6):851-9. Esta conduta não encontra suporte em estudos científicos com desfechos cardiovasculares duros e não são conhecidos seus efeitos, tanto no âmbito cardiovascular, como no tratamento da infecção. Por esta razão, a escolha de TARV e o switching terapêutico para pacientes com maior risco cardiovascular não devem, pelo menos até que surjam evidências em contrário, ser recomendadas (Grau de Recomendação: III; Nível de Evidência: C).
10.10. Diabetes melito
Várias são as evidências clínicas e epidemiológicas que sustentam o conceito de que indivíduos com diabetes melito tipo 2 apresentam risco cardiovascular aumentado. O fenótipo lipídico frequentemente encontrado nesta população consiste de hipertrigliceridemia e HDL-c baixo. A concentração média do LDL-c não apresenta diferenças quantitativas, distinguindo-se, entretanto, pelo perfil de alta aterogenicidade pela presença de partículas pequenas e densas.
Metanálise do CTT, de 2008,469469 Sponseller CA, Morgan RE, Kryzhanovski VA, Campbell SE, Davidson MH. Comparison of the lipid-lowering effects of pitavastatin 4 mg versus pravastatin 40 mg in adults with primary hyperlipidemia or mixed (combined) dyslipidemia: a Phase IV, prospective, US, multicenter, randomized, double-blind, superiority trial. Clin Ther. 2014;36(8):1211-22. com a inclusão de 14 ensaios clínicos randomizados envolvendo 18.686 participantes com diabetes melito tipo 2, evidenciou redução do risco relativo proporcional ao nível de redução de LDL-c. Para cada 1 mmol/L de redução do LDL-c, as estatinas reduziram a mortalidade global em 9% nos diabéticos e em 13% nos não diabéticos, com o mesmo benefício entre diabéticos e não diabéticos. Houve redução de 21% nos eventos cardiovasculares maiores em diabéticos e não diabéticos. Nos diabéticos, houve redução do infarto do miocárdio, da revascularização coronária e do AVC, concluindo-se que os efeitos das estatinas em diabéticos são semelhantes aos observados nos não diabéticos e independem da existência de eventos cardiovasculares prévios, ou de características basais destes pacientes. As estatinas devem ser indicadas a pacientes diabéticos por este ser um grupo de alto risco e com benefício inequívoco do tratamento medicamentoso com estatinas.
A classe dos fibratos é útil para a redução dos níveis de TG. Entretanto, os estudos sinalizados para objetivar desfechos cardiovasculares apresentaram resultados conflitantes. No estudo VA-HIT (Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial),470470 Eckard AR, Jiang Y, Debanne SM, Funderburg NT, McComsey GA. Effect of 24 weeks of statin therapy on systemic and vascular inflammation in HIV-infected subjects receiving antiretroviral therapy. J Infect Dis. 2014;209(8):1156-64. o uso de genfibrozila associou-se à significativa redução de 24% dos eventos macrovasculares em pacientes com diabetes melito tipo 2 sem DCV prévia, HDL-c baixo (< 40 mg/dL) e discreta hipertrigliceridemia. Em outro estudo com fenofibrato, o FIELD,257257 Keech A, Simes RJ, Barter P, Best J, Scott R, Taskinen MR, et al; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet. 2005;366(9500):1849-61. com 9.795 participantes, não foram evidenciados benefícios nos desfechos primários (infarto do miocárdio ou morte cardiovascular) quando comparados ao grupo placebo. Cumpre ressaltar que parcela significativa desta população era de prevenção primária. Entretanto, o uso deste fibrato demonstrou capacidade em redução nos desfechos microvasculares (redução da microalbuminúria, hemorragia vítrea e diminuição na progressão da retinopatia diabética).
O estudo ACCORD258258 Group AS, Ginsberg HN, Elam MB, Lovato LC, Crouse JR 3rd, Leiter LA, et al; ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med. 2010;362(17):1563-74. Erratum in: N Engl J Med. 2010;362(18):1748. foi projetado para determinar os efeitos do tratamento intensivo dos lípides plasmáticos (em seu braço ACCORD-LIPID) nos desfechos cardiovasculares, testando a hipótese de que adição de um fibrato (fenofibrato) ao tratamento prévio com estatinas poderia resultar em benefício incremental, quando comparada ao grupo de estatina isoladamente (sinvastatina). O desfecho primário foi a ocorrência pós-randomização de infarto do miocárdio não fatal, AVC não fatal ou morte cardiovascular. Embora com os resultados sem diferenças significativas, houve benefício no subgrupo de pacientes que apresentavam a dislipidemia diabética (hipetrigliceridemia e HDL-c < 34 mg/dL). Análises post hoc, realizadas em estudos prévios, como o Helsinki Heart Study,471471 Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, Benson CA, et al; International Antiviral Society-USA Panel. Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society-USA Panel. JAMA. 2014;312(4):410-25. o BIP447447 Wood PD, Stefanick ML, Williams PT, Haskell WL. The effects on plasma lipoproteins of a prudent weight-reducing diet, with or without exercise, in overweight men and women. N Engl J Med. 1991;325(7):461-6. e o FIELD,257257 Keech A, Simes RJ, Barter P, Best J, Scott R, Taskinen MR, et al; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet. 2005;366(9500):1849-61. encontram dados semelhantes aos do ACCORD.
Com relação à ezetimiba, conforme dados do estudo IMPROVE-IT113113 Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al; IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372(25):2387-97. em pacientes com síndrome coronariana aguda, o subgrupo pré-especificado de participantes com diabetes melito tipo 2 apresentou benefício adicional quando comparado ao grupo de participantes sem diabetes melito tipo 2, em relação aos desfechos primários compostos (morte cardiovascular, infarto do miocárdio, angina instável documentada requerendo nova hospitalização, revascularização coronária ≥ 30 dias ou AVC).
10.11. Pós-transplantados
As anormalidades lipídicas são frequentes nos pacientes pós-transplante cardíaco, acometendo cerca de 60 a 83% dos pacientes,472472 Kearney PM, Blackwell L, Collins R, Keech A, Simes J, Peto R, et al; Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet. 2008;371(9607):117-25.,473470 Rubins HB, Robins SJ, Collins D, Fye CL, Anderson JW, Elam MB, et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. N Engl J Med. 1999;341(6):410-8. e estão associadas à maior incidência de doença vascular do enxerto. As causas mais comuns da dislipidemia deste grupo se relacionam com diabetes melito, síndrome metabólica, obesidade e disfunção renal. As medicações imunossupressoras apresentam importantes alterações do metabolismo lipídico, como elevação de CT, VLDL-c, TG e, principalmente, do LDL-c, além de ganho de peso e da exacerbação da resistência à insulina.
A terapia da hiperlipidemia no paciente pós-transplante cardíaco tem a finalidade de prevenir a progressão da aterosclerose nos vasos nativos e reduzir a velocidade do desenvolvimento de vasculopatia de transplante.
Modificações do estilo de vida (dieta e exercício) e controle rigoroso do diabetes, quando presente, são recomendados no paciente pós-transplante.
O tratamento farmacológico destes pacientes é igual ao do paciente sem transplante, exceto pelo cuidado com as interações medicamentosas. Assim, a estatina é o tratamento de escolha para os indivíduos pós-transplante cardíaco e dislipidemia, devendo-se iniciar com baixas doses (Grau de Recomendação: IIa; Nível de Evidência: B).474474 Frick MH, Elo O, Haapa K, Heinonen OP, Heinsalmi P, Helo P, et al. Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med. 1987;317(20):1237-45.,475475 Ballantyne CM, Radovancevic B, Farmer JA, Frazier OH, Chandler L, Payton-Ross C, et al. Hyperlipidemia after heart transplantation: report of a 6-year experience, with treatment recommendations. J Am Coll Cardiol. 1992;19(6):1315-21. Nestes casos, deve-se monitorar o risco de toxicidade muscular, devido à interação das estatinas com a ciclosporina, principalmente as que utilizam a via CYP3A4.476476 Becker DM, Markakis M, Sension M, Vitalis S, Baughman K, Swank R, et al. Prevalence of hyperlipidemia in heart transplant recipients. Transplantation. 1987;44(2):323-5.,477477 Kobashigawa JA, Katznelson S, Laks H, Johnson JA, Yeatman L, Wang XM, et al. Effect of pravastatin on outcomes after cardiac transplantation. N Engl J Med. 1995;333(10):621-7.
O benefício das estatinas neste grupo de pacientes decorre da melhora do perfil lipídico e, possivelmente, dos efeitos pleiotrópicos das estatinas (inibição da atividade pró-inflamatória, melhora da função endotelial e diminuição do estado de hipercoagulabilidade).
Muitos pacientes evoluem com hipertrigliceridemia no pós-transplante. Estes pacientes podem ser tratados com derivados do ácido fíbrico, principalmente em situações de hipertrigliceridemia grave, na qual existe o risco de pancreatite aguda. Não existem estudos randomizados que analisaram os efeitos dos fibratos nesta população.
A ezetimiba não é recomendada no pós-transplante, por sua interação com a ciclosporina, que pode induzir um aumento de duas a 12 vezes nas concentrações séricas da ezetimiba.478478 Wenke K, Meiser B, Thiery J, Nagel D, von Scheidt W, Steinbeck G, et al. Simvastatin reduces graft vessel disease and mortality after heart transplantation: a four-year randomized trial. Circulation. 1997;96(5):1398-402.
10.12. Hipotireoidismo
A dislipidemia presente nos indivíduos com hipotireoidismo é caracterizada pelo aumento das concentrações plasmáticas do LDL-c, consequente ao decréscimo do número de receptores hepáticos para a remoção destas partículas e do aumento da absorção intestinal do colesterol, devido à ação do hormônio tireoidiano na proteína NPC1-L1.479479 Page RL 2nd, Miller GG, Lindenfeld J. Drug therapy in the heart transplant recipient: part IV: drug-drug interactions. Circulation. 2005;111(2):230-9. Já a hipertrigliceridemia aparece em decorrência do aumento da produção hepática das partículas de VLDL. Desta forma, o hipotireoidismo é uma causa secundária de dislipidemia, que deve ser sempre lembrada e afastada.
As alterações nos lípides plasmáticos ocorrem no hipotireoidismo clínico, porém sua ocorrência na forma subclínica é controversa e apresenta dados divergentes na literatura.480480 Navaneethan SD, Nigwekar SU, Perkovic V, Johnson DW, Craig JC, Strippoli GF. HMG CoA reductase inhibitors (statins) for dialysis patients. Cochrane Database Syst Rev. 2013 Sep 11;(9):CD004289. Mesmo o efeito da reposição hormonal sobre o perfil lipídico no hipotireoidismo subclínico apresenta resultados divergentes, com alguns trabalhos mostrando benefício e outros sem efeito.480480 Navaneethan SD, Nigwekar SU, Perkovic V, Johnson DW, Craig JC, Strippoli GF. HMG CoA reductase inhibitors (statins) for dialysis patients. Cochrane Database Syst Rev. 2013 Sep 11;(9):CD004289.
O tratamento com estatinas não está contraindicado para estes indivíduos, mas a estatina só deve ser iniciada após a regularização dos níveis hormonais, em função do risco aumentado de miosite nestes pacientes.481481 Bilchick KC, Henrikson CA, Skojec D, Kasper EK, Blumenthal RS. Treatment of hyperlipidemia in cardiac transplant recipients. Am Heart J. 2004;148(2):200-10. Existe uma maior prevalência de hipotireoidismo nos pacientes intolerantes à estatina. A simples reposição hormonal pode corrigir a dislipidemia induzida pelo hipotireoidismo. Mesmo assim, alguns indivíduos permanecem dislipidêmicos, demonstrando a coexistência da dislipidemia primária. No caso, o perfil lipídico pode ser avaliado para se estabelecer a necessidade do tratamento adicional.
10.13. Doenças autoimunes
Constituem doenças autoimunes reumáticas ou sistêmicas aquelas cuja etiopatogenia envolve resposta imunológica dirigida a antígenos próprios, levando a processo inflamatório sistêmico. São abordadas aqui, principalmente, duas doenças autoimunes reumáticas: o Lúpus Eritematoso Sistêmico (LES) e a artrite reumatoide.
10.13.1. Lúpus eritematoso sistêmico
É o protótipo de doença autoimune sistêmica, caracterizado por envolvimento de diversos órgãos ou sistemas, e por produção de grande variedade de autoanticorpos, dirigidos principalmente − mas, não exclusivamente −, contra antígenos do núcleo celular. Afeta principalmente mulheres jovens e tem evolução crônica, caracterizada por períodos de exacerbação e remissão da doença. Embora o prognóstico tenha melhorado nas últimas décadas, a sobrevida é menor que a da população geral, e as DCV têm sido uma das principais causas de mortalidade em estudos norte-americanos e europeus.
A incidência e a prevalência da doença são variáveis - têm influência da região geográfica, de critérios para definição de casos e da composição étnica da população estudada, sendo maior em estudos norte-americanos que nos europeus, e menos frequente em caucasianos que não caucasianos. Em único estudo realizado no Brasil, a incidência foi estimada em 8,7 casos por 100 mil habitantes/ano na cidade de Natal (RN),482482 Pearce EN. Update in lipid alterations in subclinical hypothyroidism. J Clin Endocrinol Metab. 2012;97(2):326-33. com prevalência de 98/100 mil habitantes em estudo realizado em Montes Claros (MG).483483 Cooper DS, Biondi B. Subclinical thyroid disease. Lancet. 2012;379(9821):1142-54.
A aterosclerose prematura em pacientes com LES foi inicialmente reconhecida em 1976 por Urowtz et al.,484484 Rallidis LS, Fountoulaki K, Anastasiou-Nana M. Managing the underestimated risk of statin-associated myopathy. Int J Cardiol. 2012;159(3):169-76. que descreveram padrão bimodal de mortalidade, com morte precoce atribuída a atividade da doença e mortalidade mais tardia associada a infarto agudo do miocárdio. Este padrão de mortalidade tem sido confirmado em estudos subsequentes, e a mortalidade por DCV parece ter se mantido constante, apesar da melhora da mortalidade em geral. No Brasil, em estudo avaliando múltiplas causas de morte em pacientes com LES, não foi observada significativa mortalidade por DCV em análise global, mas, avaliando subgrupo de óbitos abaixo dos 50 anos de idade, encontramos razão observado/esperado > 1, indicando maior risco de óbito por DCV em pacientes com LES e idade menor que 50 anos.485485 Vilar MJ, Sato EI. Estimating the incidence of systemic lupus erythematosus in a tropical region (Natal, Brazil). Lupus. 2002;11(8):528-32.
As DCV, definidas como doença isquêmica cardíaca, doença isquêmica cerebral (AVC idquêmico) e doença arterial periférica isquêmica, são mais frequentes e de ocorrência mais precoce em pacientes com LES do que na população geral. A prevalência da DCV clínica varia de 6 a 10%, com risco duas a dez vezes maior de DCV clínica, em comparação à população geral, pareada por sexo e idade.486486 Senna ER, De Barros AL, Silva EO, Costa IF, Pereira LV, Ciconelli RM, et al. Prevalence of rheumatic diseases in Brazil: a study using the COPCORD approach. J Rheumatol. 2004;31(3):594-7.
Diversos métodos podem ser utilizados para identificar aterosclerose subclínica, como a medida da IMT ou presença de placas em carótidas em exame ultrassonográfico; ultrassonografia da artéria braquial com medida da vasodilatação induzida pelo aumento de fluxo; a presença de calcificação em coronárias, avaliada pela tomografia computadorizada das coronárias; e alteração da perfusão miocárdica.486486 Senna ER, De Barros AL, Silva EO, Costa IF, Pereira LV, Ciconelli RM, et al. Prevalence of rheumatic diseases in Brazil: a study using the COPCORD approach. J Rheumatol. 2004;31(3):594-7. Utilizando diversos métodos, a frequência de aterosclerose subclínica tem sido significativamente maior em pacientes com LES, comparada a controles.
Conquanto diversos estudos tenham mostrado prevalência aumentada de fatores de risco tradicionais para DCV, como hipertensão arterial, hipercolesterolemia, diabetes melito e obesidade em pacientes com LES, e que se reconheça que os mesmos têm importante papel na aterogênese, os fatores de risco tradicionais para DCV não conseguem explicar totalmente o aumentado risco de DCV em pacientes com LES. O risco de DCV nestes pacientes é maior que a do grupo controle pareado para idade, sexo e fatores de risco, sugerindo que, em pacientes com LES, há complexa interação entre fatores de risco tradicionais e processo inflamatório próprio da doença.487487 Urowitz MB, Gladman D, Ibanez D, Bae SC, Sanchez-Guerrero J, Gordon C, et al; Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus. Arthritis Care Res (Hoboken). 2010;62(6):881-7.
Em estudo multinacional de coorte inicial com mais de 1.200 pacientes com LES e seguimento de até 8 anos, foram observados 97 eventos cardiovasculares em 72 pacientes, mas somente 31 eventos em 22 pacientes foram atribuídos à doença aterosclerótica. Em análise multivariada, sexo masculino e idade mais avançada por ocasião do diagnóstico foram os fatores independentemente associados a evento CV no seguimento a curto tempo.484484 Rallidis LS, Fountoulaki K, Anastasiou-Nana M. Managing the underestimated risk of statin-associated myopathy. Int J Cardiol. 2012;159(3):169-76.
Em revisão sistemática da literatura, Shoenfeld et al.487487 Urowitz MB, Gladman D, Ibanez D, Bae SC, Sanchez-Guerrero J, Gordon C, et al; Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus. Arthritis Care Res (Hoboken). 2010;62(6):881-7. concluíram que o risco de DCV em pacientes com LES é, no mínimo, duas vezes maior que o da população geral. Pacientes brancos e idosos parecem ter maior risco absoluto de DCV, mas mulheres jovens têm risco relativo alarmantemente alto, dada a raridade da DCV em jovens do sexo feminino na população geral. Ambos os fatores de risco, os tradicionais e os específicos do LES, são importantes, embora existam discrepâncias na literatura quanto à magnitude de efeito dos mesmos.487487 Urowitz MB, Gladman D, Ibanez D, Bae SC, Sanchez-Guerrero J, Gordon C, et al; Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus. Arthritis Care Res (Hoboken). 2010;62(6):881-7.
Os fatores de risco associados ao LES incluem atividade e duração da doença, e possivelmente alguma manifestação específica do lúpus, assim como o tratamento da doença. Embora o uso de prednisona em dose ≥ 7,5 mg ao dia tenha aumentado o risco de dano cardiovascular, a forte associação entre atividade de doença e uso de glicocorticoide dificulta avaliar o efeito de cada um dos fatores de forma independente.
Em revisão da literatura, a prevalência de dislipidemia, definida como elevadas taxas de CT, LDL-c e TG, e baixos níveis de HDL-c, variou de 36% no diagnóstico a 60% no seguimento de pacientes com LES. Diferentes frequências de alterações lipídicas são descritas: aumento de CT em 20 a 48%, de TG em 15 a 44% e de LDL-c em 18 a 43%, além de baixos níveis de HDL-c em 24 a 81%. Baixo nível de HDL-c foi a alteração encontrada mais frequentemente no estudo com a maior casuística.488488 Souza DC, Santo AH, Sato EI. Mortality profile related to systemic lupus erythematosus: a multiple cause-of-death analysis. J Rheumatol. 2012;39(3):496-503.
O perfil lipídico típico do LES é caracterizado por elevados níveis de VLDL e TG, além de baixos níveis de HDL, estando associado à atividade da doença.489489 Gustafsson JT, Svenungsson E. Definitions of and contributions to cardiovascular disease in systemic lupus erythematosus. Autoimmunity. 2014;47(2):67-76.
Anticorpos anti-LDL oxidado participam da formação inicial da placa aterogênica e estão aumentados em LES.488488 Souza DC, Santo AH, Sato EI. Mortality profile related to systemic lupus erythematosus: a multiple cause-of-death analysis. J Rheumatol. 2012;39(3):496-503. O papel antiaterogênico da HDL fica comprometido pelo microambiente inflamatório em pacientes com LES, originando HDL disfuncional, pró-inflamatória, que parece contribuir para o risco aumentado de doença aterosclerótica em pacientes com LES.490490 Schoenfeld SR, Kasturi S, Costenbader KH. The epidemiology of atherosclerotic cardiovascular disease among patients with SLE: a systematic review. Semin Arthritis Rheum. 2013;43(1):77-95. Anticorpos anticardiolipina e anti-β2GP1, assim como citocinas inflamatórias, como o TNF-α e IL-6, também parecem estar envolvidos na dislipidemia do LES, com elevados níveis de TG e baixos níveis de HDL-c. A nefrite, que ocorre em cerca de metade dos pacientes com LES, também está associada a maior frequência de distúrbios do metabolismo lipídico.488488 Souza DC, Santo AH, Sato EI. Mortality profile related to systemic lupus erythematosus: a multiple cause-of-death analysis. J Rheumatol. 2012;39(3):496-503.
O padrão de dislipidemia do lúpus não tem fisiopatogenia totalmente esclarecida, mas menor atividade da LPL e anticorpos anti-LPL parecem estar implicados.488488 Souza DC, Santo AH, Sato EI. Mortality profile related to systemic lupus erythematosus: a multiple cause-of-death analysis. J Rheumatol. 2012;39(3):496-503.
Com relação ao distúrbio do metabolismo lipídico, vários estudos mostram risco aumentado de DCV associado ao aumento de CT. Na coorte de lúpus de Toronto, pacientes com aumento persistente de CT sofreram infarto agudo do miocárdio, AVC ou morte súbita em 27,8% dos casos, nos primeiros 3 anos de seguimento, enquanto pacientes sem dislipidemia tiveram apenas 3% destes eventos. Observou-se também que 79% dos pacientes com DCV apresentavam persistente aumento de níveis séricos de CT.491491 Tselios K, Koumaras C, Gladman DD, Urowitz MB. Dyslipidemia in systemic lupus erythematosus: just another comorbidity? Semin Arthritis Rheum. 2016;45(5):604-10.
Inesperadamente, LDL não se confirmou ser um fator independente para evento CV em pacientes com LES, mas está relacionada ao aumento da IMT e à presença de placas em carótidas. Baixo níveis de HDL têm sido implicados em evento CV, disfunção endotelial e aumento de IMT. A elevação de TG também se mostrou preditor independente para evento CV e calcificação coronária.
A dislipidemia é uma comorbidade importante para pacientes com lúpus, com múltiplos efeitos negativos ao longo do tempo. Espera-se que o tratamento precoce e adequado da dislipidemia possa reduzir os números referentes à hospitalização e à morbimortalidade em geral.488488 Souza DC, Santo AH, Sato EI. Mortality profile related to systemic lupus erythematosus: a multiple cause-of-death analysis. J Rheumatol. 2012;39(3):496-503.
A dislipidemia deve ser tratada agressivamente, para minimizar o risco cardiovascular e proteger os órgãos de danos permanentes. Entretanto, vários estudos controlados com estatinas não conseguiram demonstrar claro benefício em termos de impedir a progressão da aterosclerose.488488 Souza DC, Santo AH, Sato EI. Mortality profile related to systemic lupus erythematosus: a multiple cause-of-death analysis. J Rheumatol. 2012;39(3):496-503.
A melhora significativa da função endotelial foi encontrada em estudo controlado e randomizado de pacientes com LES recebendo 20 mg de atorvastatina ao dia, por 8 semanas.492492 Borba EF, Bonfa E. Dyslipoproteinemias in systemic lupus erythematosus: influence of disease, activity, and anticardiolipin antibodies. Lupus. 1997;6(6):533-9. Este resultado não foi confirmado em estudos avaliando IMT de carótidas em pacientes com lúpus infanto-juvenil, que receberam 10 a 20 mg/dia de atorvastatina por 3 anos.493493 McMahon M, Grossman J, Skaggs B, Fitzgerald J, Sahakian L, Ragavendra N, et al. Dysfunctional proinflammatory high-density lipoproteins confer increased risk of atherosclerosis in women with systemic lupus erythematosus. Arthritis Rheum. 2009;60(8):2428-37.
Em outro estudo, rosuvastatina 10 mg ao dia diminuiu o IMT em 2 anos, além de melhorar o perfil lipídico. Petri et al.,494494 Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med. 1999;340(6):448-54. Erratum in: N Engl J Med. 1999;340(17):1376. usando atorvastatina 40 mg ao dia por 2 anos, não encontraram redução significativa de calcificação coronária ou de IMT. Por outro lado, fluvastatina reduziu evento CV em pacientes com LES e transplante renal.495495 Ferreira GA, Navarro TP, Telles RW, Andrade LE, Sato EI. Atorvastatin therapy improves endothelial-dependent vasodilation in patients with systemic lupus erythematosus: an 8 weeks controlled trial. Rheumatology (Oxford). 2007;46(10):1560-5.
Conquanto tenha havido redução de CT e dos níveis de LDL-c, metaanálise não mostrou beneficio do uso das estatinas na progressão de IMT em carótidas de pacientes com LES.496496 Schanberg LE, Sandborg C, Barnhart HX, Ardoin SP, Yow E, Evans GW, et al; Atherosclerosis Prevention in Pediatric Lupus Erythematosus Investigators. Use of atorvastatin in systemic lupus erythematosus in children and adolescents. Arthritis Rheum. 2012;64(1):285-96. Uma crítica para estes estudos é que o período de 2 a 3 anos pode ser insuficiente para detectar alterações arteriais estruturais.
Apesar disso, é sugerido que todos os pacientes com LES realizem controle do perfil lipídico anual, e que medicamentos hipolipemiantes sejam prescritos para se alcançar as metas lipídicas recomendadas para o LDL-c e o não HDL-c para prevenção primária e secundária de evento cardiovascular.497497 Petri MA, Kiani AN, Post W, Christopher-Stine L, Magder LS. Lupus Atherosclerosis Prevention Study (LAPS). Ann Rheum Dis. 2011;70(5):760-5.
Além do efeito hipolipemiante, efeitos pleiotrópicos das estatinas incluem efeitos anti-inflamatórios e imunomoduladores, que poderiam auxiliar no controle do processo inflamatório vascular e da atividade da doença. Em um estudo, a atorvastatina mostrou ser capaz de reduzir CXCL9, uma quimiocina regulada por Interferon (IFN), o que poderia também influenciar em fatores envolvidos na patogênese do LES.498498 Norby GE, Holme I, Fellstrom B, Jardine A, Cole E, Abedini S, et al; Assessment of Lescol in Renal Transplantation Study Group. Effect of fluvastatin on cardiac outcomes in kidney transplant patients with systemic lupus erythematosus: a randomized placebo-controlled study. Arthritis Rheum. 2009;60(4):1060-4.
Em crianças e adolescentes com lúpus, dieta e exercícios por 6 meses são sugeridos como terapia de primeira linha e, posteriormente, hidroxicloroquina, estatina e sequestrantes de ácidos biliares, niacina e fibratos, em uma abordagem multidisciplinar.499499 Ye Y, Zhao X, Xie H, Tian Z, Zhang S. Efficacy and safety of statins in the prevention of atherosclerosis in patients with systemic lupus erythematosus--a meta-analysis of randomized controlled trials. Int J Cardiol. 2013;167(1):301-3.
10.13.2. Artrite reumatoide
A artrite reumatoide é uma doença inflamatória sistêmica crônica, caracterizada pelo comprometimento inflamatório e destrutivo de articulações sinoviais, que cursa com fator reumatoide e/ou anti-CPP (do inglês Cytric Citrullinated Peptide) positivos em cerca de 60 a 70% dos casos. O comprometimento articular é sua maior característica, mas ela também pode comprometer outros órgãos e sistemas.
Em países desenvolvidos, a causa mais comum de mortalidade em pacientes com artrite reumatoide são as DCV, e o processo inflamatório sistêmico parece contribuir para o risco aumentado de DCV nestes pacientes. Em estudo avaliando atestados de óbito e múltiplas causas de óbito, foi observado que doenças do sistema cardiovascular foram a causa mais frequente de óbito em pacientes com artrite reumatoide.
Na população geral, o rastreamento e o tratamento de risco cardiovascular são baseados em escores, como o de Framinghan104104 Wilson PW, D'Agostino RB, Levy D, Belanger AM, Silbershatz H, Kannel WB. Prediction of coronary heart disease using risk factor categories. Circulation. 1998;97(18):1837-47. e o Systematic Coronary Risk Evaluation.500500 Soubrier M, Mathieu S, Hermet M, Makarawiez C, Bruckert E. Do all lupus patients need statins? Joint Bone Spine. 2013;80(3):244-9. Pressão arterial, dislipidemia (CT e HDL-c), idade e sexo compõem os fatores de risco tradicionais nestes modelos de escores e são baseados em informações da população geral, mas a acurácia destes modelos não fora devidamente estudada em pacientes com artrite reumatoide. Para melhor estratificar o risco de evento CV em pacientes com artrite reumatoide, após revisão da literatura, o grupo de estudo da European League Against Rheumatism (EULAR) publicou dez recomendações para pacientes com AR: 501501 Ferreira GA, Teixeira AL, Sato EI. Atorvastatin therapy reduces interferon-regulated chemokine CXCL9 plasma levels in patients with systemic lupus erythematosus. Lupus. 2010;19(8):927-34.
-
A artrite reumatoide deve ser considerada como condição associada a alto risco de DCV. O aumento do risco parece ser devido a ambos, à aumentada prevalência de fatores de risco tradicionais e ao processo inflamatório.
-
É necessário adequado controle da atividade da doença, para redução de risco cardiovascular.
-
A avaliação de risco cardiovascular usando diretrizes nacionais é recomendada para todos os pacientes com artrite reumatoide anualmente e deve ser repetida quando drogas antirreumáticas forem trocadas.
-
Modelos de cálculo de escores de risco devem ser adaptados para pacientes com artrite reumatoide, multiplicando o fator por 1,5, quando o paciente apresentar dois dos três critérios (duração de doença > 10 anos, fator reumatoide ou anti-CPP (do inglês Cytric Citrullinated Peptide) positivo, presença de certas manifestações extra-articulares).
-
A relação CT/HDL-c deve ser usada, quando aplicado o modelo de estratificação de risco europeu usando o SCORE.
-
As intervenções devem ser indicadas de acordo com as diretrizes nacionais.
-
Estatinas, inibidores da enzima conversora da angiotensina e/ou bloqueadores do receptor da angiotensina II são opções terapêuticas preferidas.
-
O papel dos coxibes e da maioria dos anti-inflamatórios não hormonais no risco cardiovascular não está bem estabelecido e necessita investigação futura. Devemos ser cautelosos ao prescrevê-los, especialmente em pacientes com comprovada DCV ou fatores de risco.
-
Corticoesteroides: usar na menor dose possível.
-
Recomendado parar de fumar.
Neste estudo não foram incluídas modificações de hábitos de vida, como controle de peso e atividade física, e estilo de vida inadequado, que devem ser considerados fatores de risco para DCV. Redução modesta no peso ou melhora da atividade física podem reduzir significativamente o risco cardiovascular. Também não estão estabelecidas as influências de outros fatores de risco, como estresse, nível educacional e social em pacientes com doença reumática inflamatória.501501 Ferreira GA, Teixeira AL, Sato EI. Atorvastatin therapy reduces interferon-regulated chemokine CXCL9 plasma levels in patients with systemic lupus erythematosus. Lupus. 2010;19(8):927-34.
O Consortium of Rheumatology Researchers of North America (CORRONA) desenvolveu um escore expandido para predizer risco cardiovascular em artrite reumatoide. Além dos fatores de risco tradicionais (idade, sexo, diabetes, hipertensão, hiperlipidemia e fumo), a adição de fatores relacionados à artrite reumatoide, como atividade de doença (moderada ou alta atividade vs. baixa ou remissão), incapacidade (moderada vs. baixa ou nenhuma), uso de prednisona (uso vs. não uso), duração da doença (≤ 10 anos vs. > 10 anos), contribuiu significativamente para a melhora do modelo de predição de evento CV.502502 Ardoin SP, Sandborg C, Schanberg LE. Management of dyslipidemia in children and adolescents with systemic lupus erythematosus. Lupus. 2007;16(8):618-26.
O modelo denominado Extended Risk Score - Rheumatoid Arthritis (ERS-RA), existente na página web502502 Ardoin SP, Sandborg C, Schanberg LE. Management of dyslipidemia in children and adolescents with systemic lupus erythematosus. Lupus. 2007;16(8):618-26., foi desenvolvido para facilitar o uso na prática clínica. Este modelo foi testado em uma grande coorte de pacientes com artrite reumatoide e conseguiu acurada estratificação de risco de pacientes com a doença,502502 Ardoin SP, Sandborg C, Schanberg LE. Management of dyslipidemia in children and adolescents with systemic lupus erythematosus. Lupus. 2007;16(8):618-26. permitindo estratégia mais agressiva de prevenção em pacientes com moderado a alto risco de evento CV, de acordo com as recomendações do American College of Cardiology.106106 Stone NJ, Robinson J, Lichtenstein AH, Goff DC Jr, Lloyd-Jones DM, Smith SC Jr, et al; 2013 ACC/AHA Cholesterol Guideline Panel. Treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: synopsis of the 2013 ACC/AHA cholesterol guideline. Ann Intern Med. 2014;160(5):339-43.
Vários fatores de risco no ERS-RA são alvos potencialmente modificáveis no programa de prevenção, como cessar o fumo, reduzir atividade da doença e incapacidade devido à artrite reumatoide e, se possível, suspender uso de corticoesteroides. O ERS-RA parece ser um modelo melhor para predição de risco cardiovascular do que aqueles baseados exclusivamente em fatores de risco tradicionais.501501 Ferreira GA, Teixeira AL, Sato EI. Atorvastatin therapy reduces interferon-regulated chemokine CXCL9 plasma levels in patients with systemic lupus erythematosus. Lupus. 2010;19(8):927-34.
Em conclusão, embora não haja estudos controlados randomizados para orientar guias para pacientes com doenças reumáticas sistêmicas, podemos concluir que pacientes com LES e artrite reumatoide devem ser considerados com risco aumentado de DCV. Além de controle adequado dos fatores de risco tradicionais, é muito importante se alcançar a supressão do processo inflamatório, ou das alterações imunológicas, e utilizar a menor dose possível de corticosteroide.
10.14. Sintomas musculares relacionados às estatinas
A interrupção do uso de estatinas tem sido motivada, em parte, pelo desconhecimento sobre seus efeitos colaterais, particularmente os Sintomas Musculares Relacionados ao uso de Estatinas (SMRE). Embora subjetivas, as queixas musculoesqueléticas respondem por 65% dos casos de perda de adesão − uma taxa de suspensão dez vezes superior à frequência destes sintomas em estudos clínicos controlados e mesmo cinco vezes superior ao relatado em estudos observacionais não controlados.503503 Conroy RM, Pyorala K, Fitzgerald AP, Sans S, Menotti A, De Backer G, et al; SCORE project group. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur Heart J. 2003;24(11):987-1003.,504504 Peters MJ, Symmons DP, McCarey D, Dijkmans BA, Nicola P, Kvien TK, et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis. 2010;69(2):325-31.
No conjunto de 26 ensaios clínicos aleatorizados e mais de 170 mil pacientes incluídos na colaboração CTT, uma leve elevação da CK após tratamento com estatinas ocorreu em média em 1 a cada mil pacientes tratados ao ano, sendo que o risco de lesão grave com aumento da CK >10x o Limite Superior da Normalidade (LSN) ocorreu em 1 para cada 10 mil pacientes-ano (1). Queixas musculares seguidas de descontinuação da terapia com estatina em ensaios clínicos, porém, têm ocorrido em 0,1 a 1% dos pacientes; em estudos observacionais e estudos clínicos não controlados, a frequência de sintomas musculares que levaram à interrupção da estatina se eleva para 7 a 29%.2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.,112112 Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170?000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81.,503503 Conroy RM, Pyorala K, Fitzgerald AP, Sans S, Menotti A, De Backer G, et al; SCORE project group. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur Heart J. 2003;24(11):987-1003.
504 Peters MJ, Symmons DP, McCarey D, Dijkmans BA, Nicola P, Kvien TK, et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis. 2010;69(2):325-31.-505505 Solomon DH, Greenberg J, Curtis JR, Liu M, Farkouh ME, Tsao P, et al. Derivation and internal validation of an expanded cardiovascular risk prediction score for rheumatoid arthritis: a Consortium of Rheumatology Researchers of North America Registry Study. Arthritis Rheumatol. 2015;67(8):1995-2003.
A ausência de grupo controle nos registros e estudos observacionais já antecipa que grande parte deste excesso de efeitos colaterais ocorre sem o estabelecimento correto de uma relação causal entre as queixas musculares e o tratamento com estatinas. Enquanto em trabalhos retrospectivos, apenas 15 a 40% dos pacientes foram capazes de tolerar a reexposição a estatinas após um efeito colateral inicial, em estudos prospectivos com protocolos de controle, até 90% dos pacientes que desenvolveram SMRE foram capazes de tolerar outras estatinas durante pelo menos 1 ano. Este fato indica que, quando há protocolos adequados de definição da intolerância, a adesão a estatinas tende a aumentar.
Apesar de a maioria dos consensos internacionais de tratamento das dislipidemias alertar para o risco de grandes elevações da CK após tratamento com estatinas, os critérios para diagnóstico de SMRE e para manejo de sintomas musculares menores ainda não foram claramente estabelecidos.
A forma mais comumente relatada de SMRE é a mialgia, cujo padrão dificilmente a distingue de outras etiologias. Como forma de aumentar a acurácia, recentemente, a National Lipid Association (NLA) propôs uma ferramenta de caracterização de sintomas musculares, com base nos estudos PRIMO (Prediction of Muscular Risk in Observational conditions) e STOMP (The Effect of Statins on Skeletal Muscle Function and Performance) (Quadro 23).504504 Peters MJ, Symmons DP, McCarey D, Dijkmans BA, Nicola P, Kvien TK, et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis. 2010;69(2):325-31.,506506 Cohen JD, Brinton EA, Ito MK, Jacobson TA. Understanding Statin Use in America and Gaps in Patient Education (USAGE): an internet-based survey of 10,138 current and former statin users. J Clin Lipidol. 2012;6(3):208-15.,507507 Bruckert E, Hayem G, Dejager S, Yau C, Begaud B. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients--the PRIMO study. Cardiovasc Drugs Ther. 2005;19(6):403-14. Embora prático, o algoritmo não foi testado em seu valor preditivo e deve ser usado com cautela. Outras organizações também desenvolveram ferramentas e conceitos próprios, mas sem nenhum consenso entre elas.508508 El-Salem K, Ababneh B, Rudnicki S, Malkawi A, Alrefai A, Khader Y, et al. Prevalence and risk factors of muscle complications secondary to statins. Muscle Nerve. 2011;44(6):877-81.
Avaliação da probabilidade de associação dos sintomas musculares ao tratamento com estatinas
10.14.1. Definição
O manejo clínico da SMRE deve ser baseado tanto na presença de sintomas musculares como na elevação da CK, tendo como princípio os sete padrões de SMRE adotados por esta diretriz (Quadro 24): elevação de CK assintomática (SMRE 0), mialgia tolerável (SMRE 1) e intolerável (SMRE 2), miopatia moderada (SMRE 3) e grave (SMRE 4) até rabdomiólise (SMRE 5) e miosite necrotizante autoimune (SMRE 6). O reconhecimento dos distintos fenótipos e dos graus de gravidade ajuda a tornar o manejo clínico mais prático.
Ao ponderar sobre um caso potencial de SMRE, faz-se importante: (i) valorizar todas as queixas musculares (dor, fraqueza ou câimbras), não apenas dor muscular, e levar em conta o histórico de queixas musculares prévias, comorbidades e uso de outros fármacos (para uma lista dos fatores contribuintes para a miopatia por estatinas, ver quadros 25 e 26); (ii) reconhecer a temporalidade usual entre o início da terapia com estatina e o início dos sintomas musculares, que é habitualmente até 4 a 12 semanas, mas que também pode raramente ocorrer após mais de 1 ano ou se instalar abruptamente após aumento da dose de estatina ou administração de fármaco ou alimento que induza competição farmacocinética.506506 Cohen JD, Brinton EA, Ito MK, Jacobson TA. Understanding Statin Use in America and Gaps in Patient Education (USAGE): an internet-based survey of 10,138 current and former statin users. J Clin Lipidol. 2012;6(3):208-15. Em geral, (iii) o padrão de dor muscular e fraqueza ocorre em forma simétrica e proximal e afeta grandes grupos musculares, como nádegas, coxas, panturrilhas e musculatura dorsal. As queixas musculares tendem a ser mais frequentes em pacientes que praticam atividades físicas.
Comorbidades que podem contribuir com os sintomas musculares relacionados às estatinas (SMRE)
Interações medicamentosas com os inibidores da hidroximetilglutaril coenzima A (HMG-CoA) redutase
*Os inibidores de protease nunca devem ser utilizados em combinação com sinvastatina ou lovastatina; atorvastatina, rosuvastatina e pravastatina devem ser utilizadas com cautela (iniciar com doses baixas e monitorar os efeitos) com os inibidores de protease em geral (exceções: atorvastatina é contraindicada com tipranavir, rosuvastatina é contraindicada com atazanavir e lopinavir/ritonavir); pitavastatina pode ser usada com segurança com atazanavir, darunavir/ritonavir ou lopinavir/ritonavir.
Na presença de dor muscular intolerável, deve-se sempre medir a CK sérica imediatamente. Havendo níveis de CK mais que sete vezes o LSN ou persistentemente mais que três vezes o LSN, devem-se também avaliar os níveis de hormônios tireoidianos (Hormônio Estimulante da Tireoide − TSH, T4 livre), a Velocidade de Hemossedimentação (VHS) e Fator Antinuclear (FAN). Na presença de sintomas intoleráveis, deve-se sempre pedir em conjunto a dosagem sérica de ureia, creatinina e mioglobinúria. Havendo causa secundária que possa explicar os SMRE por estatinas, deve-se tentar corrigir a causa, bem como reiniciar a estatina em doses baixas, com aumento progressivo de dose.
Mais frequentemente, as queixas musculares ocorrem sem elevação substancial da CK.106106 Stone NJ, Robinson J, Lichtenstein AH, Goff DC Jr, Lloyd-Jones DM, Smith SC Jr, et al; 2013 ACC/AHA Cholesterol Guideline Panel. Treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: synopsis of the 2013 ACC/AHA cholesterol guideline. Ann Intern Med. 2014;160(5):339-43. O passo mais importante na presença de tais sintomas é diferenciar sua tolerabilidade, pois seu impacto pode variar muito entre indivíduos, especialmente naqueles com comorbidades como hipotireoidismo, doenças do colágeno, fibromialgia e outras.
Nos casos de dor muscular tolerável sem/com elevação de CK (SMRE 0) ou de até três vezes o LSN (SMRE 1), pode-se considerar uma redução temporária de dose ou mudança da estatina, mas sem maiores preocupações adicionais. Caso haja elevação da CK > 3 a 7 vezes o LSN com sintomas toleráveis, é necessária a redução de dose seguida de uma monitorização mais cautelosa da CK. Na presença de sintomas intoleráveis e elevação da CK (SMRE 2), a suspensão da estatina passa a ser necessária e deve motivar uma investigação mais ampla. Queixas musculares novas que atinjam a suspeição clínica para SMRE devem, portanto, motivar a solicitação da CK sérica. Em geral, os casos menos graves de SMRE por estatinas (SMRE 0 a SMRE 4) cursam de forma autolimitada e não deixam sequelas permanentes.
10.14.2. Elevação da creatinoquinase
Durante a terapia com estatinas, elevações transitórias de CK podem ocorrer, mesmo em pacientes assintomáticos, mas sem significado clínico. Por esta razão, no curso da terapia com estatinas, a dosagem rotineira de CK não é recomendada, exceto quando se introduz nova droga ou se eleva a dose de uma estatina (Grau de Recomendação: IIa; Nível de Evidência: B)2525 Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20. (ver quadro 27 para definições do Grau de Recomendação e Nível de Evidência). Dentre os pacientes que necessitam nova dosagem, aqueles assintomáticos com pequenas elevações de CK (menos que três vezes o LSN) (SMRE 0) não necessitam suspender a estatina ou mudar sua posologia (Grau de Recomendação: IIa; Nível de Evidência: C). Naqueles assintomáticos que tiverem elevação de CK de três a sete vezes o LSN (SMRE 1), o período de suspensão não se faz necessário, podendo-se reiniciar a mesma estatina ou uma nova em baixa dose, com ajuste de dose a cada 4 a 6 semanas (Grau de Recomendação: IIa; Nível de Evidência: C).509509 Parker BA, Capizzi JA, Grimaldi AS, Clarkson PM, Cole SM, Keadle J, et al. Effect of statins on skeletal muscle function. Circulation. 2013;127(1):96-103.
Com base na opinião de especialistas, as diretrizes da NLA507507 Bruckert E, Hayem G, Dejager S, Yau C, Begaud B. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients--the PRIMO study. Cardiovasc Drugs Ther. 2005;19(6):403-14. e a EAS508508 El-Salem K, Ababneh B, Rudnicki S, Malkawi A, Alrefai A, Khader Y, et al. Prevalence and risk factors of muscle complications secondary to statins. Muscle Nerve. 2011;44(6):877-81. sugerem que pacientes com sintomas musculares leves a moderados associados à elevação de CK podem estar sob maior risco de rabdomiólise. Aprofundando sobre este mesmo ponto de vista e de outras evidências,507507 Bruckert E, Hayem G, Dejager S, Yau C, Begaud B. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients--the PRIMO study. Cardiovasc Drugs Ther. 2005;19(6):403-14.
508 El-Salem K, Ababneh B, Rudnicki S, Malkawi A, Alrefai A, Khader Y, et al. Prevalence and risk factors of muscle complications secondary to statins. Muscle Nerve. 2011;44(6):877-81.
509 Parker BA, Capizzi JA, Grimaldi AS, Clarkson PM, Cole SM, Keadle J, et al. Effect of statins on skeletal muscle function. Circulation. 2013;127(1):96-103.-510510 Rosenson RS, Baker SK, Jacobson TA, Kopecky SL, Parker BA; The National Lipid Association's Muscle Safety Expert Panel. An assessment by the Statin Muscle Safety Task Force: 2014 update. J Clin Lipidol. 2014;8(3 Suppl):S58-71. o presente posicionamento da SBC recomenda a suspensão transitória da estatina e a monitorização periódica dos níveis de CK a cada 4 a 6 semanas, caso haja elevação da CK entre três a sete vezes o LSN na presença de sintomas musculares intoleráveis (SMRE 2) (Grau de Recomendação: IIa; Nível de Evidência: C). Naqueles que apresentarem CK entre três a sete vezes o LSN na presença de sintomas toleráveis ou na ausência de sintomas (SMRE 1), recomendam-se a troca para regime de baixa intensidade e a monitorização mais cuidadosa da CK a cada 4 a 6 semanas (Grau de Recomendação: IIa; Nível de Evidência: C).
Entretanto, independente da presença de sintomas, se níveis de CK maiores que sete vezes o LSN forem observados, a suspensão da estatina deve ser realizada por 4 a 6 semanas, seguida de nova dosagem de CK e reavaliação (Grau de Recomendação: IIa; Nível de Evidência: C). Caso não haja redução da CK para níveis abaixo de sete vezes o LSN em até 6 semanas sem estatinas (SMRE 4 ou SMRE 6), o paciente deve ser avaliado quanto à presença de causa secundária, por meio de avaliação clínica e laboratorial mais minuciosa, incluindo investigação de função renal, hormônios tireoidianos (TSH, T4 livre), VHS, FAN (Grau de Recomendação: IIa; Nível de Evidência: C). Caso não haja melhora da dor com a suspensão da estatina e não sejam encontradas causas associadas, deve-se considerar o diagnóstico diferencial entre miopatia autoimune (SMRE 6) e miopatia não relacionada a estatinas. A avaliação dos anticorpos anti-HMG CoA Redutase (HMGCR) tem alto poder preditivo para esta diferenciação,509509 Parker BA, Capizzi JA, Grimaldi AS, Clarkson PM, Cole SM, Keadle J, et al. Effect of statins on skeletal muscle function. Circulation. 2013;127(1):96-103. mas, em alguns casos, pode ser necessária a pesquisa da expressão da HMGCR no tecido muscular. A pesquisa de anticorpos anti-HMGCR por ELISA tem sensibilidade de 94% e especificidade de 99% para a identificação de anti-HMGCR por imunoprecipitação.511511 Stroes ES, Thompson PD, Corsini A, Vladutiu GD, Raal FJ, Ray KK, et al; European Atherosclerosis Society Consensus Panel. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J. 2015;36(17):1012-22.
Naqueles que reduzirem os níveis de CK após suspensão, mas durante a reintrodução e/ou titulação da dose de estatina houver nova elevação da CK acima de sete vezes o LSN (sendo excluídas causas secundárias como exercício, hipotireoidismo ou doença muscular metabólica), deve-se usar a mesma estatina em dose menor OU estatina alternativa (Grau de Recomendação: IIa; Nível de Evidência: C). Em seguida, adiciona-se terapia não estatínica, com a finalidade de atingir o valor de colesterol do LDL-c mais próximo possível da meta (Grau de Recomendação: IIa; Nível de Evidência: C).
A rabdomiólise (SMRE 5) é o evento muscular adverso mais grave durante a terapia com estatinas, podendo gerar necrose muscular, distúrbios hidroeletrolíticos graves, lesão renal aguda, coagulopatia, choque e morte. Sua incidência é rara com a monoterapia com estatinas (em torno de 0,44 por 10 mil pacientes-ano), porém o risco pode aumentar em dez a 12 vezes na presença de outros fármacos (Quadro 25).512512 Alfirevic A, Neely D, Armitage J, Chinoy H, Cooper RG, Laaksonen R, et al. Phenotype standardization for statin-induced myotoxicity. Clin Pharm Ther. 2014;96(4):470-6. De fato, em 60% dos casos reportados de rabdomiólise por estatinas, houve relato de uso concomitante de fármacos competidores pela CYP3A4, como inibidores de protease, ciclosporina, amiodarona, macrolídeos e antifúngicos azólicos. Outros 19% dos casos ocorreram diante de associação de estatinas com fibratos.513513 Pasternak RC, Smith SC, Jr., Bairey-Merz CN, Grundy SM, Cleeman JI, Lenfant C, et al; American College of Cardiology; American Heart Association; National Heart, Lung and Blood Institute. ACC/AHA/NHLBI Clinical Advisory on the Use and Safety of Statins. Circulation. 2002;106(8):1024-8. Desta forma, o uso concomitante destes fármacos com estatinas deve motivar um rastreamento mais cuidadoso da elevação de CK.
Embora a rabdomiólise possa cursar com sintomas menos intensos, ela também pode evoluir de forma fulminante com insuficiência múltipla de órgãos. Em geral, a morbidade e as mortes ocorrem como resultado de hipercalemia, acidose metabólica e lesão renal aguda. O risco de lesão renal aguda gira em torno de 30 a 40%, e a mortalidade é de 5%.514514 Mohassel P, Mammen AL. Statin-associated autoimmune myopathy and anti-HMGCR autoantibodies. Muscle Nerve. 2013;48(4):477-83.
O critério mais comumente verificado é a dor muscular acompanhada de aumento abrupto da CK em mais de dez vezes, embora mais raramente a rabdomiólise pode se manifestar com perda de força muscular ou sintomas musculares discretos associada a um aumento de mais de 50 vezes o LSN da CK. Assim, para efeito de critério diagnóstico, considera-se rabdomiólise quando há aumento assintomático de CK > 50 vezes LSN, ou quando há dor muscular associada a CK dez vezes maior que o LSN, disfunção renal (elevação da creatinina sérica ≥ 0,5 mg/dL) e mioglobinúria.
A miopatia necrotizante autoimune (SMRE 6) está relacionada ao aparecimento de autoanticorpos séricos dirigidos contra a HMCGR, o alvo farmacológico das estatinas. Ao contrário das outras formas de SMRE, os sintomas na SMRE 6 não melhoram após a suspensão da estatina. Porém, por se tratar do mecanismo causal, a exposição ao fármaco deve ser logo evitada.
Todas as séries de casos publicadas de miopatia autoimune associada a estatinas têm demonstrado que os pacientes recuperam a força muscular e apresentam queda nos níveis de CK (às vezes normalizando) com a terapia imunossupressora. A remissão do quadro de SMRE 6 em geral ocorre com prednisona e mais um agente imunossupressor, mais comumente o metotrexato, com ou sem imunoglobulina intravenosa. Porém, respostas parciais são verificadas em 36 a 46%.515515 Graham DJ, Staffa JA, Shatin D, Andrade SE, Schech SD, La Grenade L, et al. Incidence of hospitalized rhabdomyolysis in patients treated with lipid-lowering drugs. JAMA. 2004;292(21):2585-90.,516516 Law M, Rudnicka AR. Statin safety: a systematic review. Am J Cardiol. 2006;97(8A):52C-60C. Além disso, risco de recaída com a interrupção da terapia está em torno de 50 a 60%.516516 Law M, Rudnicka AR. Statin safety: a systematic review. Am J Cardiol. 2006;97(8A):52C-60C.,517517 Ward MM. Factors predictive of acute renal failure in rhabdomyolysis. Arch Intern Med. 1988;148(7):1553-7.
10.14.3. Fatores de risco para sintomas musculares relacionados à estatina
São descritas diversas anormalidade metabólicas musculares de pacientes com miotoxicidade induzida por estatina, sugerindo que alguns indivíduos têm predisposição para queixas musculares maiores ou menores.518518 Christopher-Stine L, Casciola-Rosen LA, Hong G, Chung T, Corse AM, Mammen AL. A novel autoantibody recognizing 200-kd and 100-kd proteins is associated with an immune-mediated necrotizing myopathy. Arthritis Rheum. 2010;62(9):2757-66. Paralelamente, outras características do paciente e as próprias da estatina podem aumentar o risco de SMRE, incluindo a administração de altas doses de estatina, a lipofilicidade, o metabolismo do citocromo P450 e as interações medicamemtosas.519519 Grable-Esposito P, Katzberg HD, Greenberg SA, Srinivasan J, Katz J, Amato AA. Immune-mediated necrotizing myopathy associated with statins. Muscle Nerve. 2010;41(2):185-90.
Estatinas lipofílicas, como a sinvastatina e a lovastatina, têm maior potencial de difusão pelas membranas celulares, com maior concentração intracelular em tecidos periféricos quando comparadas a estatinas hidrofílicas como a pravastatina. Hipoteticamente, esta poderia ser a justificativa do maior risco de miopatia em pacientes em uso de estatinas lipofílicas.520520 Needham M, Fabian V, Knezevic W, Panegyres P, Zilko P, Mastaglia FL. Progressive myopathy with up-regulation of MHC-I associated with statin therapy. Neuromuscul Disord. 2007;17(2):194-200. Entretanto, o SMRE foi similarmente descrito com o uso de estatinas hidrofílicas, como a rosuvastatina, quanto com as lipofílicas, como a atorvastatina.521521 Vladutiu GD, Simmons Z, Isackson PJ, Tarnopolsky M, Peltier WL, Barboi AC, et al. Genetic risk factors associated with lipid-lowering drug-induced myopathies. Muscle Nerve. 2006;34(2):153-62. Existe variação da biodisponibilidade das estatinas, o que é parcialmente explicado pela variação de genótipos de transportadores celulares e do citocromo P450 (CYP).522522 Ahmad Z. Statin intolerance. Am J Cardiol. 2014;113(10):1765-71. O uso concomitante de outras drogas e até mesmo a ingestão de determinados alimentos que podem competir com as vias catabólicas das estatinas, elevando sua biodisponibilidade, podem ser associados a variações farmacogenéticas.
Dentre os fatores de risco para a SMRE estão a síndrome de fragilidade, o baixo índice de massa corporal, o sexo feminino, o hipotireoidismo, o etilismo, o consumo de cocaína e a disfunção renal ou hepática. O quadro 25 mostra as principais condições clínicas e o quadro 26, as interações medicamentosas relacionadas à ocorrência de SMRE.
10.14.4. Definição de intolerância a estatinas
Conforme exposto no quadro 27 e com base em conceitos descritos em ensaios clínicos, recomendações de outras sociedades médicas e conselhos regulatórios,106106 Stone NJ, Robinson J, Lichtenstein AH, Goff DC Jr, Lloyd-Jones DM, Smith SC Jr, et al; 2013 ACC/AHA Cholesterol Guideline Panel. Treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: synopsis of the 2013 ACC/AHA cholesterol guideline. Ann Intern Med. 2014;160(5):339-43.,523523 Mosshammer D, Schaeffeler E, Schwab M, Morike K. Mechanisms and Assessment of Statin-related Muscular Adverse Effects. Br J Clin Pharmacol. 2014;78(3):454-66.
524 Shepherd J, Vidt DG, Miller E, Harris S, Blasetto J. Safety of rosuvastatin: update on 16,876 rosuvastatin-treated patients in a multinational clinical trial program. Cardiology. 2007;107(4):433-43.-525525 DeGorter MK, Tirona RG, Schwarz UI, Choi YH, Dresser GK, Suskin N, et al. Clinical and pharmacogenetic predictors of circulating atorvastatin and rosuvastatin concentrations in routine clinical care. Circ Cardiovasc Genet. 2013;6(4):400-8. esta comissão define o critério de intolerância a estatina como: (Ia) a incapacidade em tolerar pelo menos duas estatinas em qualquer dose, OU (Ib) a incapacidade em tolerar aumento da dose acima dos máximos diários de rosuvastatina 5 mg; atorvastatina 10 mg; sinvastatina 20 mg; pravastatina 20 mg; lovastatina 20 mg; ou fluvastatina 40 mg; devido a (IIa) sintomas musculares intoleráveis (dor muscular, fraqueza ou cãimbras, mesmo com CK normal ou pouco alterada) OU (IIb) miopatia grave (sintomas musculares com elevação da CK superior a sete vezes o LSN); e cuja etiologia pode ser atribuída a estatina por apresentar (IIIa) relação temporal plausível (zero a 12 semanas) com a introdução da estatina, aumento de dose ou introdução de droga competidora pela via de metabolização, E/OU (IIIb) melhora dos sintomas ou resolução com a descontinuação da estatina (habitualmente em 2 a 4 semanas), E (IIIc) com piora em menos de 4 semanas conseguinte à nova exposição (rechallenge) (Grau de Recomendação: IIa; Nível de Evidência: C). Nos casos de pacientes que atendam aos critérios anteriormente listados, devem-se manter a maior dose tolerada de estatinas e a terapia complementar, caso não se tenha atingido a meta lipídica (Quadro 28). Havendo história de rabdomiólise (SMRE 5) secundária ao uso de qualquer estatina ou história de miosite necrotizante autoimune (SMRE 6), o paciente fica inelegível para o uso de outras estatinas. Outras estratégias farmacológicas devem ser tentadas nestes pacientes até a meta de LDL-c ser atingida. Nos casos em que houver durante o tratamento com estatinas história de rabdomiólise (SMRE 5) ou miopatia necrotizante autoimune (SMRE 6) ou que preencha ao menos um critério de incapacidade (I), um critério de mialgia/miopatia (II) e dois critérios de prova de causalidade (III), o paciente é considerado intolerante às estatinas.
Nível de Evidência e Grau de Recomendação das diversas opções terapêuticas em pacientes com intolerância a estatinas
10.14.5. Opções terapêuticas na presença de sintomas musculares relacionados ao uso de estatinas
10.14.5.1. Terapia suplementar voltada ao aumento da tolerância à estatina
Embora haja plausibilidade no aumento do risco de SMRE por estatinas quando há hipovitaminose D, não há evidência de benefício na suplementação com vitamina D mesmo em pacientes com níveis insuficientes para evitar ou atenuar a SMRE. Além disso, existem sérias limitações quanto à reprodutibilidade das dosagens de vitamina D, e não há evidência de benefício cardiovascular que faça desta indicação um ganho secundário526526 Sullivan D, Olsson AG, Scott R, Kim JB, Xue A, Gebski V, et al. Effect of a monoclonal antibody to PCSK9 on low-density lipoprotein cholesterol levels in statin-intolerant patients: the GAUSS randomized trial. JAMA. 2012;308(23):2497-506. (Grau de Recomendação: III; Nível de Evidência: C).
Da mesma forma, apesar dos indícios iniciais, a suplementação de coenzima Q foi demonstrada como não benéfica em termos de prevenção ou tratamento da SMRE 527527 Link E, Parish S, Armitage J, Bowman L, Heath S, Matsuda F, et al; SEARCH Collaborative Group. SLCO1B1 variants and statin-induced myopathy--a genomewide study. N Engl J Med. 2008;359(8):789-99. (Grau de Recomendação: III; Nível de Evidência: B).
10.14.5.2. Terapia hipolipemiante alternativa
A maioria das terapias alternativas não foi testada em associação com estatinas, não possui evidência de benefício em monoterapia ou não foi testada em indivíduos intolerantes à estatina. Assim, a adição de ezetimiba à maior dose tolerada de estatina é a primeira opção terapêutica (Grau de Recomendação: I; Nível de Evidência: A). A adição de colestiramina, fibrato ou fitosteróis pode ser considerada, caso a terapia com estatina mais ezetimiba não seja suficiente (Grau de Recomendação: IIa; Nível de Evidência: C). A adição de niacina ao tratamento com estatina não se mostrou benéfica em dois estudos clínicos e não deve ser considerada, exceto em casos especiais, como dislipidemia graves (Grau de Recomendação: IIb; Nível de Evidência: C).
O uso intermitente de estatina tem sido relatado em pequenos ensaios clínicos, cujo desfecho é a redução do LDL-c.528528 Mancini GB, Baker S, Bergeron J, Fitchett D, Frohlich J, Genest J, et al. Diagnosis, prevention, and management of statin adverse effects and intolerance: proceedings of a Canadian Working Group Consensus Conference. Can J Cardiol. 2011;27(5):635-62. Baseando-se no aumento da tolerância, algumas diretrizes têm recomendado esta posologia. No entanto, dois argumentos sugerem cautela em sua indicação: (i) seu benefício em redução de eventos cardiovasculares não foi demonstrado e (ii) a variabilidade do LDL-c em pacientes tratados com estatinas foi associada ao aumento de mortalidade cardiovascular.529529 Carvalho LS, Sposito AC. Vitamin D for the prevention of cardiovascular disease: Are we ready for that? Atherosclerosis. 2015;241(2):729-40. De fato, uma adesão entre 10 a 20%, que equivaleria a uma dose semanal, foi relacionada ao aumento de mortalidade quando comparada a adesão inferior a 10%.530530 Banach M, Serban C, Sahebkar A, Ursoniu S, Rysz J, Muntner P, et al; Lipid and Blood Pressure Meta-analysis Collaboration Group. Effects of coenzyme Q10 on statin-induced myopathy: a meta-analysis of randomized controlled trials. Mayo Clin Proc. 2015;90(1):24-34. Portanto, a presente comissão julga inadequada esta indicação pelo risco potencial (Grau de Recomendação III; Nível de Evidência: C).
Oryza sativa fermentado por Monascus purpureus (arroz vermelho) tem em sua composição valores variáveis de monacolinas cuja ação inibe a HMGCR de forma semelhante às estatinas. Há alguns outros componentes identificados no extrato que podem contribuir para redução da colesterolemia, mas a confirmação e o detalhamento deste efeito são ainda necessários para a conclusão sobre seu papel relativo à inibição da HMGCR pelas monacolinas.
Apesar de haver estudos em intolerantes a estatinas531531 Backes JM, Gibson CA, Ruisinger JF, Moriarty PM. The high-dose rosuvastatin once weekly study (the HD-ROWS). J Clin Lipidol. 2012;6(4):362-7.,532532 Bangalore S, Breazna A, DeMicco DA, Wun CC, Messerli FH; TNT Steering Committee and Investigators. Visit-to-visit low-density lipoprotein cholesterol variability and risk of cardiovascular outcomes: insights from the TNT trial. J Am Coll Cardiol. 2015;65(15):1539-48. seu pequeno tamanho amostral (n = 60) e delineamento retrospectivo não são suficientes para garantir maior tolerância ou segurança nos casos mais graves de SMRE com a utilização deste fitoterápico.
Estudo clínico com o inibidor da CETP, anacetrapib, encontram-se em andamento, com a finalidade de testar o benefício cardiovascular. Não há estudo com inibidores da CETP em intolerantes a estatina, e não há comprovação do benefício cardiovascular com seu uso. Em individuos com intolerância à estatina, o uso de evolocumabe533533 Shalev V, Chodick G, Silber H, Kokia E, Jan J, Heymann AD. Continuation of statin treatment and all-cause mortality: a population-based cohort study. Arch Intern Med. 2009;169(3):260-8. e alirocumabe534534 Becker DJ, Gordon RY, Halbert SC, French B, Morris PB, Rader DJ. Red yeast rice for dyslipidemia in statin-intolerant patients: a randomized trial. Ann Intern Med. 2009;150(12):830-9, W147-9. demonstrou segurança e eficácia na redução do LDL-c. O estudo FOURIER,274274 Sabatine MS, Giugliano RP, Keech A, Honarpour N, Wiviott SD, Murphy SA, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;Mar 16. [Epub ahead of print] em pacientes de muito alto risco, demonstrou redução do desfecho primário (1.550 e do secundário chave (20%) com o evolocumabe, sem excesso de sintomas musculares ou elevação de CK. Recentemente publicado o estudo GAUSS-3 com evolocumabe em pacientes intolerantes demonstrou ser uma opção eficaz e segura nesta população.535535 Venero CV, Venero JV, Wortham DC, Thompson PD. Lipid-lowering efficacy of red yeast rice in a population intolerant to statins. Am J Cardiol. 2010;105(5):664-6.,536536 Stroes E, Colquhoun D, Sullivan D, Civeira F, Rosenson RS, Watts GF, et al; GAUSS-2 Investigators. Anti-PCSK9 antibody effectively lowers cholesterol in patients with statin intolerance: the GAUSS-2 randomized, placebo-controlled phase 3 clinical trial of evolocumab. J Am Coll Cardiol. 2014;63(23):2541-8.
-
Nota: estas Diretrizes se prestam a informar e não a substituir o julgamento clínico do médico que, em última análise, deve determinar o tratamento apropriado para seus pacientes.
-
ErrataNa "Atualização da Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose – 2017", publicada como suplemento dos Arquivos Brasileiros de Cardiologia [Arq Bras Cardiol 2017; 109(2Supl.1):1-76], considerar as seguintes correções:- Na pág. 35, primeiro parágrafo, foi acrescentada a seguinte frase e as referências 311 e 312: "Inibidores de PCSK-9 podem ser considerados em associação a outros agentes hipolipemiantes ou, de forma isolada, nos intolerantes às estatinas, quando não forem atingidas as metas preconizadas para o risco cardiovascular.311,312"- Ref. 311: Kastelein JJ, Ginsberg HN, Langslet G, et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with het- erozygous familial hypercholesterolaemia. Eur Heart J. 2015;36: 2996–3003. Ref. 312: Raal FJ, Stein EA, Dufour R, Turner T, Civeira F, Burgess L, Langslet G, Scott R, Olsson AG, Sullivan D, Hovingh GK, Cariou B, Gouni-Berthold I, Somaratne R, Bridges I, Scott R, Wasserman SM, Gaudet D; RUTHERFORD-2 Investigators. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. Lancet. 2015 Jan 24;385(9965):331-40. Ambas as referências foram acrescentadas na listagem final. Com o acréscimo delas, as referências 311 a 315 foram alteradas para 313 a 317 ao longo do texto e na lista final.- Na pág. 35, item 9.2.2.4., primeiro parágrafo, foi substituído o trecho "para tratamento da HF, podendo ser usados em homozigotos, desde que não seja um defeito causado por "receptor negativo" por "para tratamento da HF. O medicamento evolocumabe foi testado na HFHo no estudo Tesla B, com redução adicional de LDL-c de 21,3%, não sendo efetivo nas formas homozigóticas, em que o receptor é negativo ou nulo.318", com acréscimo da referência 318.- Ref. 318: Raal FJ, Honarpour N, Blom DJ, Hovingh GK, Xu F, Scott R, Wasserman SM, Stein EA; TESLA Investigators. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B): a randomised, doubleblind, placebo-controlled trial. Lancet. 2015 Jan 24;385(9965):341-50. A referência 318 foi acrescentada na listagem final. Com o acréscimo dela, as referências 316 a 554 foram alteradas para 319 a 557 ao longo do texto e na lista final.- Na página 38, item 9.2.4.2., considerar "Tangier", em maiúscula.
Referências
-
1Altmann SW, Davis HR Jr, Zhu LJ, Yao X, Hoos LM, Tetzloff G, et al. Niemann-Pick C1 like 1 protein is critical for intestinal cholesterol absorption. Science. 2004;303(5661):1201-4.
-
2Raal FJ, Santos RD, Blom DJ, Marais AD, Charng MJ, Cromwell WC, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375(9719):998-1006.
-
3Cuchel M, Bloedon LT, Szapary PO, Kolansky DM, Wolfe ML, Sarkis A, et al. Inhibition of microsomal triglyceride transfer protein in familial hypercholesterolemia. N Engl J Med. 2007;356(2):148-56.
-
4Tall AR. CETP inhibitors to increase HDL cholesterol levels. N Engl J Med. 2007;356(13):1364-6.
-
5Horton JD, Cohen JC, Hobbs HH. PCSK9: a convertase that coordinates LDL catabolism. J Lipid Res. 2009;50 Suppl:S172-7.
-
6Steinberg D1, Witztum JL.Inhibition of PCSK9: a powerful weapon for achieving ideal LDL cholesterol levels. Proc Natl Acad Sci USA. 2009;106(24):9546-7.
-
7Ross R. Atherosclerosis--an inflammatory disease. N Engl J Med. 1999;340(2):115-26.
-
8Berenson GS, Wattigney WA, Tracy RE, Newman WP 3rd, Srinivasan SR, Webber LS, et al. Atherosclerosis of the aorta and coronary arteries and cardiovascular risk factors in persons aged 6 to 30 years and studied at necropsy (The Bogalusa Heart Study). Am J Cardiol. 1992;70(9):851-8.
-
9Libby P. Mechanisms of acute coronary syndromes and their implications for therapy. N Engl J Med. 2013;368(21):2004-13.
-
10Quillard T, Araújo HA, Franck G, Shvartz E, Sukhova G, Libby P. TLR2 and neutrophils potentiate endothelial stress, apoptosis and detachment: implications for superficial erosion. Eur Heart J. 2015;36(22):1394-404.
-
11Ammirati E, Moroni F, Magnoni M, Camici PG. The role of T and B cells in human atherosclerosis and atherothrombosis. Clin Exp Immunol. 2015;179(2):173-87.
-
12Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005;352(16):1685-95.
-
13Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauernfeind FG, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature 2010;464(7293):1357-61. Erratum in: Nature. 2010;466(7306):652.
-
14Tsiantoulas D, Diehl CJ, Witztum JL, Binder CJ. B cells and humoral immunity in atherosclerosis. Circ Res. 2014;114(11):1743-56.
-
15Izar MC, Fonseca HA, Pinheiro LF, Monteiro CM, Póvoa RM, Monteiro AM, et al. Adaptive immunity is related to coronary artery disease severity after acute coronary syndrome in subjects with metabolic syndrome. Diab Vasc Dis Res. 2013;10(1):32-9.
-
16Ridker PM. From C-reactive protein to interleukin-6 to interleukin-1: moving upstream to identify novel targets for atheroprotection. Circ Res. 2016;118(1):145-56.
-
17Coughlin SR. Thrombin signalling and protease-activated receptors. Nature. 2000;407(6801):258-64.
-
18Mackman N. Triggers, targets and treatments for thrombosis. Nature. 2008;451(7181):914-8.
-
19Libby P, Theroux P. Pathophysiology of coronary artery disease. Circulation. 2005;111(25):3481-8.
-
20Lusis AJ, Pajukanta P. A treasure trove for lipoprotein biology. Nat Genet. 2008;40(2):129-30.
-
21Report from the Laboratory Standardization PaneI of the National Cholesterol Education Program - Recommendations for Improving Cholesterol Measurement. 1993. (NIH Publication N° 93-2964).
-
22Hegsted DM, Nicolosi RJ. Individual variation in serum cholesterol levels. Proc Natl Acad Sci USA. 1987;84(17):6259-61.
-
23Guder WG, Narayanan S, Wisser H, Zawta B. Samples: from the patient to the laboratory. The impact of pre-analytical variables on the quality of laboratory results. 2nd ed. Darmstadt, Germany: Git Verlag GmbH; 2011.
-
24Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001;285(19):2486-97.
-
25Xavier HT, Izar MC, Faria Neto JR, Assad MH, Rocha VZ, Sposito AC, et al; Sociedade Brasileira de Cardiologia. [V Brazilian Guidelines on Dyslipidemias and Prevention of Atherosclerosis]. Arq Bras Cardiol. 2013;101(4 Suppl 1):1-20.
-
26Langsted A, Nordestgaard BG. Nonfasting Lipid Profiles: the way of the future. Clin Chem. 2015;61(9):1123-5.
-
27Nordestgaard BG, Varbo A. Triglycerides and cardiovascular disease. Lancet. 2014;384(9943):626-35.
-
28Langsted A, Freiberg JJ, Nordestgaard BG. Fasting and nonfasting lipid levels: influence of normal food intake on lipids, lipoproteins, apolipoproteins, and cardiovascular risk prediction. Circulation. 2008;118(20):2047-56.
-
29Bansal S, Buring JE, Rifai N, Mora S, Sacks FM, Ridker PM. Fasting compared with nonfasting triglycerides and risk of cardiovascular events in women. JAMA. 2007;298(3):309-16.
-
30Rifai N, Young IS, Nordestgaard BG, Wierzbicki AS, Vesper H, Mora S, et al. Nonfasting sample for the determination of routine lipid profile: is it an idea whose time has come? Clin Chem. 2016;62(3):428-35.
-
31Nordestgaard BG, Langsted A, Mora S, Kolovou G, Baum H, Bruckert E, et al; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) joint consensus initiative. Fasting is not routinely required for determination of a lipid profile: clinical and laboratory implications including flagging at desirable concentration cut-points-a joint consensus statement from the European Atherosclerosis Society and European Federation of Clinical Chemistry and Laboratory Medicine. Eur. Heart J. 2016,37(25):1944-58.
-
32Driver SL, Martin SS, Gluckman TJ, Clary JM, Blumenthal RS, Stone NJ. Fasting or nonfasting lipid measurements. it depends on the question. J Am Coll Cardiol. 2016;67(10):1227-34.
-
33Chapman MJ, Goldstein S, Lagrange D, Laplaud PM. A density gradient ultracentrifugal procedure for the isolation of the major lipoprotein classes from human serum. Lipid Res. 1981;22(2):339-58.
-
34Otvos JD, Jeyarajah EJ, Bennett DW, Krauss RM. Development of a proton nuclear magnetic resonance spectroscopic method for determining plasma lipoprotein concentrations and subspecies distributions from a single, rapid measurement. Clin Chem. 1992;38(9):1632-8.
-
35Serna J, García-Seisdedos D, Alcázar A, Lasunción MÁ, Busto R, Pastor Ó. Quantitative lipidomic analysis of plasma and plasma lipoproteins using MALDI-TOF mass spectrometry. Chem Phys Lipids. 2015;189:7-18.
-
36Warnick GR, McNamara JR, Boggess CN, Clendenen F, Williams PT, Landolt CC. Polyacrylamide gradient gel electrophoresis of lipoprotein subclasses. Clin Lab Med. 2006;26(4):803-46.
-
37Friedewald WT, Lavy RI, Fredrickson DS. Estimation to density lipoprotein without use of the preparative ultracentrifuge. Clin Chem. 1972;18(6):499-502.
-
38Martin SS, Blaha MJ, Elshazly MB, Toth PP, Kwiterovich PO, Blumenthal RS, et al. Comparison of a novel method vs the Friedewald equation for estimating low-density lipoprotein cholesterol levels from the standard lipid profile. JAMA. 2013;310(19):2061-8.
-
39Virani SS. Non-HDL cholesterol as a metric of good quality of care: opportunities and challenges. Tex Heart Inst J. 2011;38(2):160-2.
-
40Price CP, St John A. Point-of-care testing. In: Curtis C, Ashwood E, Bruns D. Tietz textbook of clinical chemistry and molecular diagnosis. Deutscher Biosensor Symposium, Heilbad Heiligenstadt. Germany, 03-06 April 2011. p. 487-505.
-
41Diretrizes para gestão e garantia da qualidade de testes laboratoriais remotos (TLR) da Sociedade Brasileira de Patologia Clínica e Medicina Laboratorial (SBPC/ML). 2ª ed. Barueri (SP): Minha Editora; 2016.
-
42Ferreira CE, França CN, Correr CJ, Zucker ML, Andriolo A, Scartezini M. Clinical correlation between a point-of-care testing system and laboratory automation for lipid profile. Clin Chim Acta. 2015;446:263-6.
-
43Nordestgaard BG, Chapman MJ, Humphries SE, Ginsberg HN, Masana L, Descamps OS, et al; European Atherosclerosis Society Consensus Panel. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: Consensus Statement of the European Atherosclerosis Society. Eur Heart J. 2013;34(45):3478-90.
-
44Nordestgaard BG, Benn M, Schnohr P, Tybjaerg-Hansen A. Nonfasting triglycerides and risk of myocardial infarction, ischemic heart disease, and death in men and women. JAMA. 2007;298(3):299-308.
-
45Catapano AL, Reiner Z, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; European Society of Cardiology (ESC).; European Atherosclerosis Society (EAS). ESC/EAS guidelines for the management of dyslipidaemias the task force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis. 2011;217(1):3-46.
-
46Schaefer EJ, Lamon-Fava S, Ordovas JM, Cohn SD, Schaefer MM, Castelli WP, et al. Effects of age, gender, and menopausal status on plasma low density lipoprotein cholesterol and apolipoprotein B levels in the Framingham Offspring Study. J. Lipid Res. 1994;35(5):779-92.
-
47Kastelein JJ, van der Steeg WA, Holme I, Gaffney M, Cater NB, Barter P, et al. TNT Study Group; IDEAL Study Group. Lipids, apolipoproteins, and their ratios in relation to cardiovascular events with statin treatment. Circulation. 2008;117(23):3002-9.
-
48Ramjee V, Sperling LS, Jacobson TA. Non-high-density lipoprotein cholesterol versus apolipoprotein B in cardiovascular risk stratification: do the math. J Am Coll Cardiol. 2011;58(5):457-63.
-
49Virani SS, Catellier DJ, Pompeii LA, Nambi V, Hoogeveen RC, Wasserman BA, et al. Relation of cholesterol and lipoprotein parameters with carotid artery plaque characteristics: the Atherosclerosis Risk in Communities (ARIC) carotid MRI study. Atherosclerosis. 2011;219(2):596-602.
-
50Expert Dyslipidemia Panel of the International Atherosclerosis Society Panel members. An International Atherosclerosis Society Position Paper. Global recommendations for the management of dyslipidemia-Full report. J Clin Lipidol. 2014;8(1):29-60.
-
51Di Angelantonio E, Sarwar N, Perry P, Kaptoge S, Ray KK, Thompson A, et al; Emerging Risk Factors Collaboration, Major lipids, apolipoproteins, and risk of vascular disease. JAMA. 2009;302(18):1993-2000.
-
52Parish S, Offer A, Clarke R, Hopewell JC, Hill MR, Otvos JD, Armitage J, et al; Heart Protection Study Collaborative Group. Lipids and lipoproteins and risk of different vascular events in the MRC/BHF Heart Protection Study. Circulation. 2012;125(20):2469-78.
-
53Sniderman AD, Williams K, Contois JH, Monroe HM, McQueen MJ, de Graaf J, et al. A meta-analysis of low-density lipoprotein cholesterol, non-high-density lipoprotein cholesterol, and apolipoprotein B as markers of cardiovascular risk. Circ Cardiovasc Qual Outcomes. 2011;4(3):337-45.
-
54Nordestgaard BG, Chapman MJ, Ray K, Borén J, Andreotti F, Watts GF, et al. European Atherosclerosis Society Consensus Panel. Lipoprotein(a) as cardiovascular risk factor: current status. Eur Heart J. 2010;31(23):2844-53.
-
55Fisher WR, Hammond MG, Warmke GL. Measurements of the molecular weight variability of plasma low density lipoproteins among normals and subjects with hyper-lipoproteinemia: demonstration of macromolecular heterogeneity. Biochemistry. 1972;11(4):519-25.
-
56Kathiresan S, Otvos JD, Sullivan LM, Keyes MJ, Schaefer EJ, Wilson PW, et al. Increased small low-density lipoprotein particle number: a prominent feature of the metabolic syndrome in the Framingham Heart Study. Circulation. 2006;113(1):20-9.
-
57Cromwell WC, Otvos JD. Heterogeneity of low-density lipoprotein particle number in patients with type 2 diabetes mellitus and low-density lipoprotein cholesterol <100 mg/dl. Am J Cardiol. 2006;98(12):1599-602.
-
58Kuller L, Arnold A, Tracy R, Otvos J, Burke G, Psaty B, et al. Nuclear magnetic resonance spectroscopy of lipoproteins and risk of coronary heart disease in the Cardiovascular Health Study. Arterioscler Thromb Vasc Biol 2002;22(7):1175-80.
-
59Mora S, Szklo M, Otvos JD, Greenland P, Psaty BM, Goff DC Jr, et al. LDL particle subclasses, LDL particle size, and carotid atherosclerosis in the Multi-Ethnic Study of Atherosclerosis (MESA). Atherosclerosis. 2007;192(1):211-7.
-
60Ito Y, Fujimura M, Ohta M, Hirano T. Development of a homogeneous assay for measurement of small dense LDL cholesterol. Clin Chem. 2011;57(1):57-65.
-
61Tsai MY, Steffen BT, Guan W, McClelland RL, Warnick R, McConnell J, et al. New automated assay of small dense low-density lipoprotein cholesterol identifies risk of coronary heart disease: the Multi-ethnic Study of Atherosclerosis. Arterioscler Thromb Vasc Biol. 2014;34(1):196-201.
-
62Hoogeveen RC, Gaubatz JW, Sun W, Dodge RC, Crosby JR, Jiang J, et al. Small dense low-density lipoprotein-cholesterol concentrations predict risk for coronary heart Disease: The Atherosclerosis Risk in Communities (ARIC) Study. Arterioscler Thromb Vasc Biol. 2014;34(5):1069-77.
-
63Khachadurian AK. The inheritance of essential familial hypercholesterolemia. Am J Med. 1964;37:402-7.
-
64Abifadel M, Varret M, Rabès JP, Allard D, Ouguerram K, Devillers M, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003;34(2):154-6.
-
65Seidah NG, Awan Z, Chrétien M, Mbikay M. PCSK9: a key modulator of cardiovascular health. Circ Res. 2014;114(6):1022-36.
-
66Civeira F; International Panel on Management of Familial Hypercholesterolemia. Guidelines for the diagnosis and management of heterozygous familial hypercholesterolemia. Atherosclerosis. 2004;173(1):55-68.
-
67Tada H, Kawashiri M, Ohtani R, Noguchi T, Nakanishi C, Konno T, et al. A novel type of familial hypercholesterolemia: double heterozygous mutations in LDL receptor and LDL receptor adaptor protein 1 gene. Atherosclerosis. 2011;219(2):663-6.
-
68Benlian P, de Gennes J, Dairou F, Hermelin B, Ginon I, Villain E, et al. Phenotypic expression in double heterozygotes for familial hypercholesterolemia and familial defective apolipoprotein B-100. Hum Mutat. 1996;7(4):340-5.
-
69Cuchel M, Bruckert E, Ginsberg H, Raal FJ, Santos RD, Hegele RA, et al; European Atherosclerosis Society Consensus Panel on Familial Hypercholesterolaemia. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J. 2014;35(32):2146-57.
-
70Garcia-Garcia A, Ivorra C, Martinez-Hervas S, Blesa S, Fuentes MJ, Puig O, et al. Reduced penetrance of autosomal dominant hypercholesterolemia in a high percentage of families: importance of genetic testing in the entire family. Atherosclerosis. 2011;218(2):423-30.
-
71Soutar AK, Naoumova RP. Mechanisms of disease: genetic causes of familial hypercholesterolemia. Nat Clin Pract Cardiovasc Med. 2007;4(4):214-25.
-
72Usifo E, Leigh S, Whittall R, Lench N, Taylor A, Yeats C, et al. Low-density lipoprotein receptor gene familial hypercholesterolemia variant database: update and pathological assessment. Ann Hum Genet. 2012;76(5):387-401.
-
73Gudnason V, Day I, Humphries S. Effect on plasma lipid levels of different classes of mutation in the low-density lipoprotein receptor gene in patients with familial hypercholesterolemia. Arterioscler Thromb. 1994;14(11):1717-22.
-
74Hobbs H, Brown M, Goldstein J. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992;1(6):445-66.
-
75Pisciotta L, Cantafora A, De Stefano F, Langheim S, Calandra S, Bertolini S. A "de novo" mutation of the LDL-receptor gene as the cause of familial hypercholesterolemia. Biochim Biophys Acta. 2002;1587(1):7-11.
-
76Goldstein JL, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL, Sly WS, Valle D. (editors). The metabolic bases of inherited diseases. New York: McGraw-Hill; 1989. p. 1215-50.
-
77Human Gene Mutation Database. [Internet]. [Accessed in 2016 July 10]. Available from: http://www.hgmd.cf.ac.uk/ac/gene.php?gene5LDLR
» http://www.hgmd.cf.ac.uk/ac/gene.php?gene5LDLR -
78Horsthemke B, Dunning A, Humphries S. Identification of deletions in the human low density lipoprotein receptor gene. J Med Genet. 1987;24(3):144-7.
-
79Hobbs HH, Brown MS, Russell DW, Davignon J, Goldstein JL. Deletion in the gene for the low-density-lipoprotein receptor in a majority of French Canadians with familial hypercholesterolemia. N Engl J Med. 1987;317(12):734-7.
-
80Hobbs HH, Leitersdorf E, Goldstein JL, Brown MS, Russell DW. Multiple CRM-mutations in familial hypercholesterolemia: evidence for 13 alleles, including four deletions. J Clin Invest. 1988;81(3):909-17.
-
81Hobbs HH, Russell DW, Brown MS, Goldstein JL. The LDL receptor locus in familial hypercholesterolemia: mutational analysis of a membrane protein. Annu Rev Genet. 1990;24:133-70.
-
82Langlois S, Kastelein JJ, Hayden MR. Characterization of six partial deletions in the low-density-lipoprotein (LDL) receptor gene causing familial hypercholesterolemia (FH). Am J Hum Genet. 1988;43(1):60-8.
-
83Innerarity TL, Mahley RW, Weisgraber KH, Bersot TP, Krauss RM, Vega GL, et al. Familial defective apolipoprotein B-100: a mutation of apolipoprotein B that causes hypercholesterolemia. J Lipid Res. 1990; 31(8):1337-49.
-
84Whitfield AJ, Barrett PH, van Bockxmeer FM, Burnett JR. Lipid disorders and mutations in the APOB gene. Clin Chem. 2004;50(10):1725-32.
-
85Varret M, Abifadel M, Rabès JP, Boileau C. Genetic heterogeneity of autosomal dominant hypercholesterolemia. Clin Genet. 2008;73(1):1-13.
-
86Horton JD, Cohen JC, Hobbs HH. Molecular biology of PCSK9: its role in LDL metabolism. Trends Biochem Sci. 2007;32(2):71-7.
-
87Garcia CK, Wilund K, Arca M, Zuliani G, Fellin R, Maioli M, et al. Autosomal recessive hypercholesterolemia caused by mutations in a putative LDL receptor adaptor protein. Science. 2001;292(5520):1394-8.
-
88He G, Gupta S, Yi M, Michaely P, Hobbs HH, Cohen JC. ARH is a modular adaptor protein that interacts with the LDL receptor, clathrin, and AP-2. J Biol Chem. 2002;277(46):44044-9.
-
89Pisciotta L, Priore Oliva C, Pes GM, Di Scala L, Bellocchio A, Fresa R, et al. Autosomal recessive hypercholesterolemia (ARH) and homozygous familial hypercholesterolemia (FH): a phenotypic comparison. Atherosclerosis. 2006;188(2):398-405.
-
90Brautbar A, Leary E, Rasmussen K, Wilson DP, Steiner RD, Virani S. Genetics of familial hypercholesterolemia. Curr Atheroscler Rep. 2015;17(4):491.
-
91Wang J, Joy T, Mymin D, Frohlich J, Hegele RA. Phenotypic heterogeneity of sitosterolemia. J Lipid Res. 2004;45(12):2361-7.
-
92Graham CA, McIlhatton BP, Kirk CW, Beattie ED, Lyttle K, Hart P, et al. Genetic screening protocol for familial hypercholesterolemia which includes splicing defects gives an improved mutation detection rate. Atherosclerosis. 2005;182(2):331-40.
-
93Ose L. An update on familial hypercholesterolaemia. Ann Med. 1999;31 Suppl 1:13-8.
-
94Pollex RL, Hegele RA. Genomic copy number variation and its potential role in lipoprotein and metabolic phenotypes. Curr Opin Lipidol. 2007;18(2):174-80.
-
95Marks D, Wonderling D, Thorogood M, Lambert H, Humphries SE, Neil HA. Screening for hypercholesterolaemia versus case finding for familial hypercholesterolaemia: a systematic review and cost effectiveness analysis. Health Technol Assess. 2000;4(29):1-123.
-
96Watts GF, van Bockxmeer FM, Bates T, Burnett JR, Juniper A, O'Leary P. A new model of care for familial hypercholesterolaemia from Western Australia: closing a major gap in preventive cardiology. Heart Lung Circ. 2010;19(7):419-22.
-
97Leren TP, Manshaus T, Skovholt U, Skodje T, Nossen IE, Teie C, et al. Application of molecular genetics for diagnosing familial hypercholesterolemia in Norway: results from a family-based screening program. Semin Vasc Med. 2004;4(1):75-85.
-
98Wonderling D, Umans-Eckenhausen MA, Marks D, Defesche JC, Kastelein JJ, Thorogood M. Cost-effectiveness analysis of the genetic screening program for familial hypercholesterolemia in The Netherlands. Semin Vasc Med. 2004;4(1):97-104.
-
99Johannesson M, Jönsson B, Kjekshus J, Olsson AG, Pedersen TR, Wedel H. Cost effectiveness of simvastatin treatment to lower cholesterol levels in patients with coronary heart disease. Scandinavian Simvastatin Survival Study Group. N Engl J Med. 1997;336(5):332-6.
-
100Pearson TA, Mensah GA, Alexander RW, Anderson JL, Cannon RO 3rd, Criqui M, et al; Centers for Disease Control and Prevention; American Heart Association. Markers of inflammation and cardiovascular disease: application to clinical and public health pratice: a statement from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107(3):499-511.
-
101CRP CHD Genetics Collaboration. Collaborative pooled analysis of data on C-reactive protein gene variants and coronary disease: judging causality by Mendelian randomisation. Eur J Epidemiol. 2008;23(8):531-40.
-
102Santos RD; Sociedade Brasileira de Cardiologia. [III Brazilian Guidelines on Dyslipidemias and Guideline of Atherosclerosis Prevention from Atherosclerosis Department of Sociedade Brasileira de Cardiologia]. Arq Bras Cardiol. 2001;77 Suppl 3:1-48.
-
103Fredrickson DS, Levy RI, Lees RS. Fat transport in lipoproteins - an integrated approach to mechanisms and disorders. N Engl J Med. 1967;276(5):273-81.
-
104Wilson PW, D'Agostino RB, Levy D, Belanger AM, Silbershatz H, Kannel WB. Prediction of coronary heart disease using risk factor categories. Circulation. 1998;97(18):1837-47.
-
105D'Agostino RB Sr, Vasan RS, Pencina MJ, Wolf PA, Cobain M, Massaro JM, et al. General cardiovascular risk profile for use in primary care the Framingham Heart Study. Circulation. 2008;117(6):743-53.
-
106Stone NJ, Robinson J, Lichtenstein AH, Goff DC Jr, Lloyd-Jones DM, Smith SC Jr, et al; 2013 ACC/AHA Cholesterol Guideline Panel. Treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: synopsis of the 2013 ACC/AHA cholesterol guideline. Ann Intern Med. 2014;160(5):339-43.
-
107Mosca L, Benjamin EJ, Berra K, Bezanson JL, Dolor RJ, Lloyd-Jones DM, et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women - 2010 update. A guideline from the American Heart Association. Circulation. 2011;123(11):1243-62. Erratum in: Circulation. 2011;123(22):e624. Circulation. 2011;124(16):e427.
-
108Baigent C, Keech A, Kearney PM, Blackwell L, Buck G, Pollicino C, et al. Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy and safety of cholesterol lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 2005;366(9493):1267-78. Erratum in: Lancet. 2005;366(9494):1358; Lancet. 2008;371(9630):2084.
-
109Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al; INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004;364(9438):937-52.
-
110Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J, et al; Prospective Studies Collaboration. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet. 2007;370(9602):1829-39. Erratum in: Lancet. 2008;372(9635):292.
-
111Ference BA, Yoo W, Alesh I, Mahajan N, Mirowska KK, Mewada A, et al. Effect of long-term exposure to lower low-density lipoprotein cholesterol beginning early in life on the risk of coronary heart disease: a Mendelian randomization analysis. J Am Coll Cardiol. 2012;60(25):2631-9.
-
112Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170?000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81.
-
113Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al; IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372(25):2387-97.
-
114Gordon T, Castelli WP, Hjortland MC, Kannel WB, Dawber TR. High density lipoprotein as a protective factor against coronary heart disease. The Framingham Study. Am J Med. 1977;62(5):707-14.
-
115Assmann G, Schulte H. Relation of high-density lipoprotein cholesterol and triglycerides to incidence of atherosclerotic coronary artery disease (the PROCAM experience). Prospective Cardiovascular Münster study. Am J Cardiol. 1992;70(7):733-7.
-
116Barter PJ, Caulfield M, Eriksson M, Grundy SM, Kastelein JJ, Komajda M, et al; ILLUMINATE Investigators. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med. 2007;357(21):2109-2122.
-
117Schwartz GG, Olsson AG, Abt M, Ballantyne CM, Barter PJ, Brumm J, et al; dal-OUTCOMES Investigators. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N Engl J Med. 2012;367(22):2089-99.
-
118Lederle FA, Bloomfield HE. Drug treatment of asymptomatic hypertriglyceridemia to prevent pancreatitis: where is the evidence? Ann Intern Med. 2012;157(9):662-4.
-
119Chien KL, Hsu HC, Su TC, Chen MF, Lee YT, Hu FB. Apolipoprotein B and non-high density lipoprotein cholesterol and the risk of coronary heart disease in Chinese. J Lipid Res. 2007;48(11):2499-505.
-
120Helgadottir A, Gretarsdottir S, Thorleifsson G, Holm H, Patel RS, Gudnason T, et al. Apolipoprotein(a) genetic sequence variants associated with systemic atherosclerosis and coronary atherosclerotic burden but not with venous thromboembolism. J Am Coll Cardiol. 2012;60(8):722-9.
-
121Sacks FM, Appel LJ, Moore TJ, Obarzanek E, Vollmer WM, Svetkey LP, et al. A dietary approach to prevent hypertension: a review of the Dietary Approaches to Stop Hypertension (DASH) Study. Clin Cardiol. 1999;22(7 Suppl):III6-10.
-
122Estruch R, Martínez-González MA, Corella D, Salas-Salvadó J, Ruiz-Gutiérrez V, Covas MI, et al; PREDIMED Study Investigators. Effects of a Mediterranean-style diet on cardiovascular risk factors: a randomized trial. Ann Intern Med. 2006;145(1):1-11.
-
123Eckel RH, Jakicic JM, Ard JD, de Jesus JM, Houston Miller N, Hubbard VS, et al; American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;129(25 Suppl 2):S76-99. Erratum in: Circulation. 2014;129(25 Suppl 2):S100-1. Circulation. 2015;131(4):e326.
-
124Haag M, Dippenaar NG. Dietary fats, fatty acids and insulin resistance: short review of a multifaceted connection. Med Sci Monit. 2005;11(12):RA359-67.
-
125Tanasescu M, Cho E, Manson JE, Hu FB. Dietary fat and cholesterol and the risk of cardiovascular disease among women with type 2 diabetes. Am J Clin Nutr. 2004;79(6):999-1005.
-
126Astrup A, Dyerberg J, Elwood P, Hermansen K, Hu FB, Jakobsen MU, et al. The role of reducing intakes of saturated fat in the prevention of cardiovascular disease: where does the evidence stand in 2010? Am J Clin Nutr. 2011;93(4):684-8.
-
127Nicolosi RJ, Stucchi AF, Kowala MC, Hennessy LK, Hegsted DM, Schaefer EJ. Effect of dietary fat saturation and cholesterol on LDL composition and metabolism. In vivo studies of receptor and nonreceptor-mediated catabolism of LDL in cebus monkeys. Arteriosclerosis. 1990;10(1):119-28.
-
128de Lima-Salgado TM, Alba-Loureiro TC, do Nascimento CS, Nunes MT, Curi R. Molecular mechanisms by which saturated fatty acids modulate TNF-a expression in mouse macrophage lineage. Cell Biochem Biophys. 2011;59(2):89-97.
-
129Hooper L, Martin N, Abdelhamid A, Davey Smith G. Reduction in saturated fat intake for cardiovascular disease. Cochrane Database Syst Rev. 2015 Jun 10;(6):CD011737.
-
130Howard BV, Van Horn L, Hsia J, Manson JE, Stefanick ML, Wassertheil-Smoller S, et al. Low-fat dietary pattern and risk of cardiovascular disease: the Women's Health Initiative Randomized Controlled Dietary Modification Trial. JAMA. 2006;295(6):655-66.
-
131Siri-Tarino PW, Chiu S, Bergeron N, Krauss RM. Saturated fats versus polyunsaturated fats versus carbohydrates for cardiovascular disease prevention and treatment. Annu Rev Nutr. 2015;35:517-43.
-
132Food and Agriculture Organization, World Health Organization. Ann Nutr Metab. 2009;91:502-9.
-
133Wang Q, Afshin A, Yakoob MY, Singh GM, Rehm CD, Khatibzadeh S, et al; Global Burden of Diseases Nutrition and Chronic Diseases Expert Group (NutriCoDE). Impact of nonoptimal intakes of saturated, polyunsaturated, and trans fat on global burdens of coronary heart disease. J Am Heart Assoc. 2016;5(1).pii: e002891.
-
134de Oliveira Otto MC, Afshin A, Micha R, Khatibzadeh S, Fahimi S, Singh G, et al; Global Burden of Diseases, Injuries, and Risk Factors Metabolic Risk Factors of Chronic Diseases Expert Group and Nutrition and Chronic Diseases Expert Group (NutriCoDE). The impact of dietary and metabolic risk factors on cardiovascular diseases and type 2 diabetes mortality in Brazil. PLoS One. 2016;11(3):e0151503.
-
135Berger S, Raman G, Vishwanathan R, Jacques PF, Johnson EJ. Dietary cholesterol and cardiovascular disease: a systematic review and meta-analysis. Am J Clin Nutr. 2015;102(2):276-94.
-
136U.S. Department of Health and Human Services and U.S. Department of Agriculture. 2015-2020 Dietary Guidelines for Americans. 8th ed. 2015. [Accessed in 2016 Oct 10]. Available from: http://health.gov.dietaryguidelines/2015/guidelines/
» http://health.gov.dietaryguidelines/2015/guidelines/ -
137Willians CM, Salter A. Saturated fatty acids and coronary heart disease risk: the debate goes on. Curr Opin Clin Nutr Metab Care. 2016;19(2):97-102.
-
138Al Khudary L, Hartley L, Clar C, Flowers N, Hooper L, Rees K. Omega 6 fatty acids for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2015 Nov 16;(11):CD011094.
-
139Scherr C, Figueredo VN, Moura FA, Sposito AC. Not simply a matter of fish intake. Cur Vasc. Pharmacol. 2015;13(5):676-8.
-
140Scherr C, Gagliardi AC, Miname MH, Santos RD. Fatty acid cholesterol concentrations in usually consumed fish in Brazil. Arq Bras Cardiol. 2015;104(2):152-8.
-
141Machado RM, Nakandakare ER, Quintao EC, Cazita PM, Koike MK, Nunes VS, et al. Omega-6 polyunsaturated fatty acids prevent atherosclerosis development in LDLr-KO mice, in spite of displaying a pro-inflammatory profile similar to trans fatty acids. Atherosclerosis. 2012;224(1):66-74.
-
142Mutungi G, Ratliff J, Puglisi M, Torres-Gonzalez M, Vaishnav U, Leite JO, et al. Dietary cholesterol from eggs increases plasma HDL cholesterol in overweight men consuming a carbohydrate-restricted diet. J Nutr. 2008;138(2):272-6.
-
143Miller M, Stone NJ, Ballantyne C, Bittner V, Criqui MH, Ginsberg HN, et al. American Heart Association Clinical Lipidology, Thrombosis, and Prevention Committee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Cardiovascular Nursing; Council on the Kidney in Cardiovascular Disease. Triglycerides and cardiovascular disease: a scientific statement from the American Heart Association. Circulation. 2011;123(20):2292-333.
-
144Santos RD, Gagliardi AC, Xavier HT, Magnoni CD, Cassani R, Lottenberg AM, et al; Sociedade Brasileira de Cardiologia. [First guidelines on fat consumption and cardiovascular health]. Arq Bras Cardiol. 2013;100(1 Suppl 3):1-40.
-
145Capell WH, Eckel RH. Severe hypertriglyceridemia with a history of treatment failure. Nat Clin Pract Endocrinol Metab. 2005;1(1):53-8.
-
146Mente A, de Koning L, Shannon HS, Anand SS. A systematic review of the evidence supporting a causal link between dietary factors and coronary heart disease. Arch Intern Med. 2009;169(7):659-69.
-
147Godoy-Matos AF, Oliveira J, Guedes EP, Carraro L, Lopes AC, Mancini MC, et al; Associação Brasileira para o Estudo da Obesidade e da Síndrome Metabólica (ABESO). Diretrizes Brasileiras de Obesidade. Associação Brasileira para Estudos da Obesidade e Síndrome Metabólica. (ABESO). 2009/2010. 3ª ed. Itapevi (SP): AC Farmacêutica; 2009. p. 1-85.
-
148Mozaffarian D. Dietary and policy priorities for cardiovascular disease, diabetes and obesity: a comprehensive review. Circulation. 2016;133(2):187-225.
-
149Ford ES, Li C, Zhao G, Pearson WS, Mokdad AH. Hypertriglyceridemia and its pharmacologic treatment among US adults. Arch Intern Med. 2009;169(6):572-8.
-
150Spruss A, Bergheim I. Dietary fructose and intestinal barrier: potential risk factor in the pathogenesis of nonalcoholic fatty liver disease. J Nutr Biochem. 2009;20(9):657-62.
-
151Livesey G, Taylor R. Fructose consumption and consequences for glycation, plasma triacylglycerol, and body weight: meta-analyses and meta-regression models of intervention studies. Am J Clin Nutr. 2008;88(5):1419-37.
-
152Cassani R. O que é uma dieta saudável para prevenção da doença cardiovascular: o papel dos nutrientes sobre lípides, sobrepeso, hipertensão arterial e inflamação subclínica. Rev Soc Cardiol Estado de São Paulo. 2012;22(2):9-13.
-
153Lottenberg AM, Afonso Mda S, Lavrador MS, Machado RM, Nakandakare ER. The role of dietary fatty acids in the pathology of metabolic syndrome. J Nutr Biochem. 2012;23(9):1027-40.
-
154Din JN, Sarma J, Harding SA, Lyall K, Newby DE, Flapan AD. Effect of w-3 fatty acid supplementation on endothelial function, endogenous fibrinolysis and platelet activation in patients with a previous myocardial infarction: a randomised controlled trial. BMJ Open. 2013;3(9):e003054.
-
155Wang C, Harris WS, Chung M, Lichtenstein AH, Balk EM, Kupelnick B, et al. n-3 Fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr. 2006;84(1):5-17.
-
156Lottemberg AM. Importance of the dietary fat on the prevention and control of metabolic disturbances and cardiovascular disease. Arq Bras Endocrinol Metab. 2009;53(5):595-607.
-
157Augustine AH, Lowenstein LM, Harris WS, Shearer GC, Block RC. Treatment with omega-3 fatty acid ethyl-ester alters fatty acid composition of lipoproteins in overweight or obese adults with insulin resistance. Prostaglandins Leukot Essent Fatty Acids 2014; 90(2-3):69-75.
-
158Bosch J, Gerstein HC, Dagenais GR, Díaz R, Dyal L, Jung H, et al; ORIGIN Trial Investigators. n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia. N Engl J Med 2012;367(4):309-18.
-
159Flock MR, Skulas-Ray AC, Harris WS, Gaugler TL, Fleming JA, Kris-Etherton PM. Effects of supplemental long-chain omega-3 fatty acids and erythrocyte membrane fatty acid content on circulating inflammatory markers in a randomized controlled trial of healthy adults. Prostaglandins Leukot Essent Fatty Acids 2014; 91(4):161-8.
-
160Ito MK. Long-chain omega-3 fatty acids, fibrates and niacin as therapeutic options in the treatment of hypertriglyceridemia: a review of the literature. Atherosclerosis. 2015;242(2):647-56.
-
161Zhang J, Wang C, Li L, Man Q, Song P, Meng L, et al. Inclusion of Atlantic salmon in the Chinese diet reduces cardiovascular disease risk markers in dyslipidemic adult men. Nutr Res. 2010;30(7):447-54.
-
162Erkkilä AT, Lichtenstein AH, Mozaffarian D, Herrington DM. Fish intake is associated with a reduced progression of coronary artery atherosclerosis in postmenopausal women with coronary artery disease. Am J Clin Nutr. 2004;80(3):626-32.
-
163Kris-Etherton PM, Harris WS, Appel LJ; AHA Nutrition Committee. American Heart Association. Omega-3 fatty acids and cardiovascular disease: new recommendations from the American Heart Association. Arterioscler Thromb Vasc Biol. 2003;23(2):151-2.
-
164Sala-Vila A, Guasch-Ferré M, Hu FB, Sánchez-Tainta A, Bulló M, Serra-Mir M, et al; PREDIMED Investigators. Dietary α-linolenic acid, marine ω-3 fatty acids, and mortality in a population with high fish consumption: findings from the PREvención con DIeta MEDiterránea (PREDIMED) Study. J Am Heart Assoc. 2016;5(1). pii: e002543. Erratum in: J Am Heart Assoc. 2016;5(2). pii: e002077
-
165Chowdhury R, Stevens S, Gorman D, Pan A, Warnakula S, Chowdhury S, et al. Association between fish consumption, long chain omega 3 fatty acids, and risk of cerebrovascular disease: systematic review and meta-analysis. BMJ. 2012;345:e6698.
-
166Musa-Veloso K, Binns MA, Kocenas A, Chung C, Rice H, Oppedal-Olsen H, et al. Impact of low v. moderate intakes of long-chain n-3 fatty acids on risk of coronary heart disease. Br J Nutr. 2011;106(8):1129-41.
-
167de Oliveira Otto MC, Wu JH, Baylin A, Vaidya D, Rich SS, Tsai MY, et al. Circulating and dietary omega-3 and omega-6 polyunsaturated fatty acids and incidence of CVD in the Multi-Ethnic Study of Atherosclerosis. J Am Heart Assoc. 2013;2(6):e000506.
-
168Bonds DE, Harrington M, Worrall BB, Bertoni AG, Eaton CB, Hsia J, et al; Writing Group for the AREDS2 Research Group. Effect of long-chain ω-3 fatty acids and lutein + zeaxanthin supplements on cardiovascular outcomes: results of the Age-Related Eye Disease Study 2 (AREDS2) randomized clinical trial. JAMA Intern Med. 2014;174(5):763-71.
-
169Galan P, Kesse-Guyot E, Czernichow S, Briancon S, Blacher J, Hercberg S; SU.FOL.OM3 Collaborative Group. Effects of B vitamins and omega 3 fatty acids on cardiovascular diseases: a randomised placebo controlled trial. BMJ. 2010;341:c6273.
-
170Kromhout D, Giltay EJ, Geleijnse JM; Alpha Omega Trial Group. n-3 fatty acids and cardiovascular events after myocardial infarction. N Engl J Med. 2010;363(21):2015-26.
-
171Eussen SR, Geleijnse JM, Giltay EJ, Rompelberg CJ, Klungel OH, Kromhout D. Effects of n-3 fatty acids on major cardiovascular events in statin users and non-users with a history of myocardial infarction. Eur Heart J. 2012;33(13):1582-8.
-
172Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997;65(5 Suppl):1645S-54S.
-
173Leslie MA, Cohen DJ, Liddle DM, Robinson LE, Ma DW. A review of the effect of omega-3 polyunsaturated fatty acids on blood triacylglycerol levels in normolipidemic and borderline hyperlipidemic individuals. Lipids Health Dis. 2015;14:53.
-
174Amundsen ǺL, Ose L, Nenseter MS, Ntanios FY. Plant sterol ester-enriched spread lowers plasma total and LDL cholesterol in children with familial hypercholesterolemia. Am J Clin Nutr. 2002;76(2):338-44.
-
175Valsta LM, Lemström A, Ovaskainen ML, Lampi AM, Toivo J, Korhonen T, et al. Estimation of plant sterol and cholesterol intake in Finland: quality of new values and their effect on intake. Br J Nutr. 2004;92(4):671-8.
-
176Piironen V, Lampi AM. Occurrence and levels of phytosterols in foods. In: Dutta PC. (editor). Phytosterols as functional food components and nutra- ceuticals. New York: Marcel Dekker, Inc; 2004. p. 1-32.
-
177Martins CM, Fonseca FA, Ballus CA, Figueiredo-Neto AM, Meinhart AD, de Godoy HT, et al. Common sources and composition of phytosterols and their estimated intake by the population in the city of Sao Paulo, Brazil. Nutrition. 2013;29(6):865-71.
-
178Vuoristo M, Miettinen TA. Absorption, metabolism, and serum concentrations of cholesterol in vegetarians: effects of cholesterol feeding. Am J Clin Nutr. 1994;59:1325-31.
-
179Ostlund RE Jr. Phytosterols in human nutrition. Annu Rev Nutr. 2002;22:533-49.
-
180Björkhem I, Boberg KM, Leitersdorf E. Inborn errors in bile acid biosynthesis and storage of sterols other than cholesterol. In: Scriver CR, Beaudet AL, Sly WS, Valle D. (editors). The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2001. p. 2961-88.
-
181Nguyen TM, Sawyer JK, Kelley KL, Davis MA, Rudel LL. Cholesterol esterification by ACAT2 is essential for efficient intestinal cholesterol absorption: evidence from thoracic lymph duct cannulation. J Lipid Res. 2012;53(1):95-104.
-
182Gylling HK, Hallikainen M, Vidgren H, Agren J, Miettinen TA. Ester percentages of plant sterols and cholesterol in chylomicrons and VLDL of humans with low and high sterol absorption. Atherosclerosis. 2006;187(1):150-2.
-
183Calandra S, Tarugi P, Speedy HE, Dean AF, Bertolini S, Shoulders CC. Mechanisms and genetic determinants regulating sterol absorption, circulating LDL levels, and sterol elimination: implications for classification and disease risk. J Lipid Res. 2011;52(11):1885-926.
-
184Lee S, Gershkovich P, Darlington JW, Wasan KM. Inhibition of cholesterol absorption: targeting the intestine. Pharm Res. 2012;29(12):3235-50.
-
185Nissinen M, Gylling H, Vuoristo M, Miettinen TA. Micellar distribution of cholesterol and phytosterols after duodenal plant stanol ester infusion. Am J Physiol Gastrointest Liver Physiol. 2002;282(6):G1009-15.
-
186De Smet E, Mensink RP, Plat J. Effects of plant sterols and stanols on intestinal cholesterol metabolism: suggested mechanisms from past to present. Mol Nutr Food Res. 2012;56(7):1058-72.
-
187Katan MB, Grundy SM, Jones P, Law M, Miettinen T, Paoletti R; Stresa Workshop Participants Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc. 2003;78(8):965-78.
-
188Ostlund RE Jr, McGill JB, Zeng CM, Covey DF, Stearns J, Stenson WF, et al. Gastro-intestinal absorption and plasma kinetics of soy D5-phytosterols and phytostanols in humans. Am J Physiol Endocrinol Metab. 2002;282(4):E911-6.
-
189Demonty I, Ras RT, van der Knaap HC, Duchateau GS, Meijer L, Zock PL, et al. Continuous dose-response relationship of the LDL-cholesterol-lowering effect of phytosterol intake. J Nutr. 2009;139(2):271-84.
-
190Williams CL, Bollella MC, Strobino BA, Boccia L, Campanaro L. Plant stanol ester and bran fiber in childhood: effects on lipids, stool weight and stool frequency in preschool children. J Am Coll Nutr. 1999;18(6):572-81.
-
191Plat J, Mensink RP. Plant stanol esters lower serum triacylglycerol concentrations via a reduced hepatic VLDL-1 production. Lipids. 2009;44(12):1149-53.
-
192Demonty I, Ras RT, van der Knaap HC, Meijer L, Zock PL, Geleijnse JM, et al. The effect of plant sterols on serum triglyceride concentrations is dependent on baseline concentrations: a pooled analysis of 12 randomised controlled trials. Eur J Nutr. 2013;52(1):153-60.
-
193Blair SN, Capuzzi DM, Gottlieb SO, Nguyen T, Morgan JM, Cater NB. Incremental reduction of serum total cholesterol and low-density lipoprotein cholesterol with the addition of plant stanol ester-containing spread to statin therapy. Am J Cardiol. 2000;86(1):46-52.
-
194Scholle JM, Baker WL, Talati R, Coleman CI. The effect of adding plant sterols or stanols to statin therapy in hypercholesterolemic patients: systematic review and meta-analysis. J Am Coll Nutr. 2009; 28(5):517-24.
-
195Castro Cabezas M, de Vries JH, Van Oostrom AJ, Iestra J, van Staveren WA. Effects of a stanol-enriched diet on plasma cholesterol and triglycerides in patients treated with statins. J Am Diet Assoc 2006;106(10):1564-9.
-
196Lin X, Racette SB, Lefevre M, Ma L, Spearie CA, Steger-May K, et al. Combined effects of ezetimibe and phytosterols on cholesterol metabolism: a randomized, controlled feeding study in humans. Circulation. 2011;124(5):596-601.
-
197Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; ESC Committee for Practice Guidelines (CPG) 2008-2010 and 2010-2012 Committees. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32(14):1769-818.
-
198Gylling H, Plat J, Turley S, Ginsberg HN, Ellegård L, Jessup W, et al; European Atherosclerosis Society Consensus Panel on Phytosterols. Plant sterols and plant stanols in the management of dyslipidaemia and prevention of cardiovascular disease. Atherosclerosis. 2014;232(2):346-60.
-
199Santos RD, Gagliardi AC, Xavier HT, Casella Filho A, Araújo DB, Cesena FY, et al. Sociedade Brasileira de Cardiologia. I Diretriz Brasileira de Hipercolesterolemia Familiar (HF). Arq Bras Cardiol. 2012;99(2 Supl. 2):1-28.
-
200Noakes M, Clifton P, Ntanios F, Shrapnel W, Record I, McInerney J. An increase in dietary carotenoids when consuming plant sterols or stanols is effective in maintaining plasma carotenoid concentrations. Am J Clin Nutr. 2002;75(1):79-86.
-
201Gylling H, Siimes MA, Miettinen TA. Sitostanol ester margarine in dietary treatment of children with familial hypercholesterolemia. J Lipd Res. 1995;36(8):1807-12.
-
202De Jongh S, Vissers MN, Rol P, Bakker HD, Kastelein JJ, Stroes ES. Plant sterols lower LDL cholesterol without improving endothelial function in prepubertal children with familial hypercholesterolaemia. J Inherit Metab Dis. 2003;26(4):343-51.
-
203Guardamagna O, Abello F, Baracco V, Federici G, Bertucci P, Mozzi A, et al. Primary hyperlipidemias in children: effect of plant sterol supplementation on plasma lipids and markers of cholesterol synthesis and absorption. Acta Diabetol. 2011;48(2):127-33.
-
204Moruisi KG, Oosthuizen W, Opperman AM. Phytosterols/stanols lower cholesterol concentrations in familial hypercholesterolemic subjects: a systematic review with meta-analysis. J Am Coll Nutr. 2006;25(1):41-8.
-
205Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents; National Heart, Lung, and Blood Institute. Expert panel on integrated guidelines for cardiovascular health and risk reduction in children and adolescents: summary report. Pediatrics. 2011;128 Suppl 5:S213-56.
-
206Ras RT, Hiemstra H, Lin Y, Vermeer MA, Duchateau GS, Trautwein EA. Consumption of plant sterol-enriched foods and effects on plasma plant sterol concentrations--a meta-analysis of randomized controlled studies. Atherosclerosis. 2013;230(2):336-46.
-
207Laitinen K, Isolauri E, Kaipiainen L, Gylling H, Miettinen TA. Plant stanol ester spreads as components of a balanced diet for pregnant and breast-feeding women: evaluation of clinical safety. Br J Nutr. 2009;101(12):1797-804.
-
208Anderson JW, Bush HM. Soy protein effects on serum lipoproteins: a quality assessment and meta-analysis of randomized, controlled studies. J Am Coll Nutr. 2011;30(2):79-91.
-
209Castellanos-Jankiewicz A, Bosque-Plata L, Tejero ME. Combined effect of plant sterols and dietary fiber for treatment of hypercholesterolemia. Plant Foods Hum Nutr. 2014;69(2):93-100.
-
210Chutkan R, Fahey G, Wright WL, McRorie J. Viscous versus nonviscous soluble fiber supplements mechanisms and evidence for fiber specific health benefits. J Am Acad Nurse Pract. 2012;24(8):476-87.
-
211Ministério da Saúde. Coordenação Geral da Política de Alimentação e Nutrição, Departamento de Atenção Básica, Secretaria de Assistência à Saúde. Guia alimentar para a população brasileira: promovendo a alimentação saudável. Brasília; 2006.
-
212Kim Y, Je Y. Dietary fibre intake and mortality from cardiovascular disease and all cancers: a meta-analysis of prospective cohort studies. Arch Cardiovasc Dis. 2016;109(1):39-54.
-
213Guo Z, Liu XM, Zhang QX, Shen Z, Tian FW, Zhang H, et al. Influence of consumption of probiotics on the plasma lipid profile: a meta-analysis of randomised controlled trials. Nutr Metab Cardiovasc Dis. 2011;21(11):844-50.
-
214Cho YA, Kim J. Effect of probiotics on blood lipid concentrations: a meta-analysis of randomized controlled trials. Medicine (Baltimore). 2015;94(43):e1714.
-
215DiRienzo DB. Effect of probiotics on biomarkers of cardiovascular disease: implications for heart-healthy diets. Nutr Rev. 2014;72(1):18-29.
-
216Campbell TC, Jacobson H. Whole-rethinking the science of nutrition. Dallas (Texas): Benbella Books; 2014.
-
217Esselstyn CB Jr. Updating a 12-year experience with arrest and reversal therapy for coronary heart disease (an overdue requiem for palliative cardiology). Am J Cardiol. 1999;84(3):339-41.
-
218Diehl HA. Coronary risk reduction through intensive community-based lifestyle intervention: the Coronary Health Improvement Project (CHIP) experience. Am J Cardiol. 1998;82(10B):83T-87T.
-
219Merrill RM, Aldana SG. Cardiovascular risk reduction and factors influencing loss to follow-up in the coronary health improvement project. Med Sci Monit. 2008;14(4):PH17-25.
-
220Aldana SG, Greenlaw R, Diehl HA, Englert H, Jackson R. Impact of the coronary health improvement project (CHIP) on several employee populations. J Occup Environ Med. 2002;44(9):831-9.
-
221Rankin P, Morton DP, Diehl H, Gobble J, Morey P, Chang E. Effectiveness of a volunteer- delivered lifestyle modification program for reducing cardiovascular disease risk factors. Am J Cardiol. 2012;109(1):82-6.
-
222Maeda S, Miyauchi T, Kakiyama T, Sugawara J, Iemitsu M, Irukayama-Tomobe Y, et al. Effects of exercise training of 8 weeks and detraining on plasma levels of endothelium-derived factors, endothelin-1 and nitric oxide, in healthy young humans. Life Sci. 2001;69(9):1005-16.
-
223Green DJ, Spence A, Halliwill JR, Cable NT, Thijssen DH. Exercise and vascular adaptation in asymptomatic humans. Exp Physiol. 2011;96(2):57-70.
-
224Laufs U, Werner N, Link A, Endres M, Wassmann S, Jürgens K, et al. Physical training increases endothelial progenitor cells, inhibits neointima formation, and enhances angiogenesis. Circulation. 2004;109(2):220-6.
-
225Möbius-Winkler S, Uhlemann M, Adams V, Sandri M, Erbs S, Lenk K, et al. Coronary collateral growth induced by physical exercise: results of the Leipzig EXerCIse Training versus mEdical management in patients with stable coronary artery disease (EXCITE) Trial. Circulation. 2016;133(15):1438-48.
-
226Iborra RT, Ribeiro IC, Neves MQ, Charf AM, Lottenberg SA, Negrão CE, et al. Aerobic exercise training improves the role of high-density lipoprotein antioxidant and reduces plasma lipid peroxidation in type 2 diabetes mellitus. Scand J Med Sci Sports. 2008;18(6):742-50.
-
227Vinagre CG, Ficker ES, Finazzo C, Alves MJ, de Angelis K, Irigoyen MC, et al. Enhanced removal from the plasma of LDL-like nanoemulsion cholesteryl ester in trained men compared with sedentary healthy men. J Appl Physiol (1985). 2007;103(4):1166-71.
-
228Ribeiro IC, Iborra RT, Neves MQ, Lottenberg SA, Charf AM, Nunes VS, et al. HDL atheroprotection by aerobic exercise training in type 2 diabetes mellitus. Med Sci Sports Exerc. 2008;40(5):779-86.
-
229Trombetta IC, Batalha LT, Rondon MU, Laterza MC, Kuniyoshi FH, Gowdak MM, et al. Weight loss improves neurovascular and muscle metaboreflex control in obesity. Am J Physiol Heart Circ Physiol. 2003;285(3):H974-82.
-
230Negrão CE, Barretto AC. Cardiologia do exercício: do atleta ao cardiopata. 3ª. ed. Barueri (SP): Editora Manole; 2010.
-
231Yugar-Toledo JC, Tanus-Santos JE, Sabha M, Sousa MG, Cittadino M, Tácito LH, et al Uncontrolled hypertension, uncompensated type II diabetes, and smoking have different patterns of vascular dysfunction. Chest. 2004;125(3):823-30.
-
232Ijzerman RG, Serne EH, van Weissenbruch MM, de Jongh RT, Stehouwer CD. Cigarette smoking is associated with an acute impairment of microvascular function in humans. Clin Sci (Lond). 2003;104(3):247-52.
-
233Fiore MC, Jaén CR, Baker TB, Bailey WC, Benowitz NL, Curry SJ, et al; 2008 PHS Guideline Update Panel, Liaisons, and Staff. Treating Tobacco Use and Dependence: 2008 update U.S. Public Health Service Clinical Practice Guideline executive summary. Respir Care. 2008;53(9):1217-22.
-
234Mills EJ, Thorlund K, Eapen S, Wu P, Prochaska JJ. Cardiovascular events associated with smoking cessation pharmacotherapies: a network metaanalysis. Circulation. 2014;129(1):28-41.
-
235Silva AP, Scholz J, Abe TO, Pinheiro GG, Gaya PV, Pereira AC, et al. Influence of smoking cessation drugs on blood pressure and heart rate in patients with cardiovascular disease or high risk score: real life setting. BMC Cardiovasc Disord. 2016;16:2.
-
236World Health Organization. (WHO). Global recommendations on physical activity for health. Geneva; 2010.
-
237Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren WM, et al; Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice; European Association for Cardiovascular Prevention and Rehabilitation. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012): The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Atherosclerosis. 2012;223(1):1-68.
-
238Franklin BA, Lavie CJ, Squires RW, Milani RV. Exercise-based cardiac rehabilitation and improvements in cardiorespiratory fitness: implications regarding patient benefit. Mayo Clin Proc. 2013;88(5):431-7.
-
239Hambrecht R, Niebauer J, Marburger C, Grunze M, Kälberer B, Hauer K, et al. Various intensities of leisure time physical activity in patients with coronary artery disease: effects on cardiorespiratory fitness and progression of coronary atherosclerotic lesions. J Am Coll Cardiol. 1993;22(2):468-77.
-
240Taylor RS, Brown A, Ebrahim S, Jolliffe J, Noorani H, Rees K, et al. Exercise-based rehabilitation for patients with coronary heart disease: systematic review and meta-analysis of randomized controlled trials. Am J Med. 2004;116(10):682-92.
-
241Duffy D, Rader DJ. Update on strategies to increase HDL quantity and function. Nat Rev Cardiol. 2009;6(7):455-63.
-
242Leon AS, Sanchez OA. Response of blood lipids to exercise training alone or combined with dietary intervention. Med Sci Sports Exerc. 2001;33(6Suppl):S502-15.
-
243Casella-Filho A, Chagas AC, Maranhão RC, Trombetta IC, Cesena FH, Silva VM, et al. Effect of exercise training on plasma levels and functional properties of high-density lipoprotein cholesterol in the metabolic syndrome. Am J Cardiol. 2011;107(8):1168-72.
-
244Yu HH, Ginsburg GS, O'Toole ML, Otvos JD, Douglas PS, Rifai N. Acute changes in serum lipids and lipoprotein subclasses in triathletes as assessed by proton nuclear magnetic resonance spectroscopy. Arterioscler Thromb Vasc Biol. 1999;19(8):1945-9.
-
245Kodama S, Tanaka S, Saito K, Shu M, Sone Y, Onitake F, et al. Effect of Aerobic exercise training on serum levels of high-density lipoprotein cholesterol: a meta-analysis. Arch Intern Med. 2007;167(10):999-1008.
-
246Vaisberg M, Bachi AL, Latrilha C, Dioguardi GS, Bydlowski SP, Maranhão RC. Lipid Transfer to HDL is higher in marathon runners than in sedentary subjects, but is acutely inhibited during the run. Lipids. 2012;47(7):679-86.
-
247Kokkinos PF, Faselis C, Myers J, Panagiotakos D, Doumas M. Interactive effects of fitness and statin treatment on mortality risk in veterans with dyslipidaemia: a cohort study. Lancet. 2013;381(9864):394-9.
-
248Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Lee IM, et al; American College of Sports Medicine. American College of Sports Medicine position stand. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011;43(7):1334-59.
-
249Herdy AH, López-Jiménez F, Terzic CP, Milani M, Stein R, Carvalho T, et al; Sociedade Brasileira de Cardiologia. South American Guidelines for Cardiovascular Disease Prevention and Rehabilitation. Arq Bras Cardiol. 2014;103(2Supl.1):1-31.
-
250Fletcher GF, Balady GJ, Amsterdam EA, Chaitman B, Eckel R, Fleg J, et al. Exercise standards for testing and training: a statement for healthcare professionals from the American Heart Association. Circulation. 2001;104(14):1694-740.
-
251Carvalho T, Benetti M, Mara LS. Teste cardiopulmonar: visão para o clinico. Procardiol. Programa de Atualização. 2012;8:31-51.
-
252Rossebo AB, Pedersen TR, Boman K, Brudi P, Chambers JB, Egstrup K, et al; SEAS Investigators. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med. 2008;359(13):1343-56.
-
253Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377(9784):2181-92.
-
254Park H, Shima T, Yamaguchi K, Mitsuyoshi H, Minami M, Yasui K, et al. Efficacy of long-term ezetimibe therapy in patients with nonalcoholic fatty liver disease. J Gastroenterol. 2011;46(1):101-7.
-
255The Lipid Research Clinics Coronary Primary Prevention Trial results. I. Reduction in incidence of coronary heart disease. JAMA. 1984;251(3):351-64.
-
256Jun M, Foote C, Lv J, Neal B, Patel A, Nicholls SJ, et al. Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet. 2010;375(9729):1875-84.
-
257Keech A, Simes RJ, Barter P, Best J, Scott R, Taskinen MR, et al; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet. 2005;366(9500):1849-61.
-
258Group AS, Ginsberg HN, Elam MB, Lovato LC, Crouse JR 3rd, Leiter LA, et al; ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med. 2010;362(17):1563-74. Erratum in: N Engl J Med. 2010;362(18):1748.
-
259Clofibrate and niacin in coronary heart disease. JAMA. 1975;231(4):360-81.
-
260Boden WE, Probstfield JL, Anderson T, Chaitman BR, Desvignes-Nickens P, Koprowicz K, et al; AIM-HIGH Investigators. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011;365(24):2255-67.
-
261Haynes R, Jiang L, Hopewell JC, Li J, Chen F, Parish S, et al; HPS2-THRIVE Collaborative Group.. HPS2-THRIVE randomized placebo-controlled trial in 25 673 high-risk patients of ER niacin/laropiprant: trial design, pre-specified muscle and liver outcomes, and reasons for stopping study treatment. Eur Heart J. 2013;34(17):1279-91.
-
262Harris WS, Miller M, Tighe AP, Davidson MH, Schaefer EJ. Omega-3 fatty acids and coronary heart disease risk: clinical and mechanistic perspectives. Atherosclerosis. 2008;197(1):12-24.
-
263Marchioli R, Barzi F, Bomba E, Chieffo C, Di Gregorio D, Di Mascio R, et al; GISSI-Prevenzione Investigators. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardico (GISSI)-Prevenzione. Circulation. 2002;105(16):1897-903.
-
264Yokoyama M, Origasa H, Matsuzaki M, Matsuzawa Y, Saito Y, Ishikawa Y, et al; Japan EPA lipid intervention study (JELIS) Investigators. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open-label, blinded endpoint analysis. Lancet. 2007;369(9567):1090-8.
-
265Berge K, Musa-Veloso K, Harwood M, Hoem N, Burri L. Krill oil supplementation lowers triglycerides without increasing low-density lipoprotein cholesterol in adults with borderline high or high triglyceride levels. Nutr Res. 2014;34(2):126-33.
-
266Barter P. Lessons learned from the Investigation of Lipid Level Management to Understand its Impact in Atherosclerotic Events (ILLUMINATE) trial. Am J Cardiol. 2009;104(10 Suppl):10E-5E.
-
267Vergeer M, Bots ML, van Leuven SI, Basart DC, Sijbrands EJ, Evans GW, et al. Cholesteryl ester transfer protein inhibitor torcetrapib and off-target toxicity: a pooled analysis of the rating atherosclerotic disease change by imaging with a new CETP inhibitor (RADIANCE) trials. Circulation. 2008;118(24):2515-22. Erratum in: Circulation. 2009;119(5):e197.
-
268Nicholls SJ, Lincoff AM, Barter PJ, Brewer HB, Fox KA, Gibson CM, et al. Assessment of the clinical effects of cholesteryl ester transfer protein inhibition with evacetrapib in patients at high-risk for vascular outcomes: Rationale and design of the ACCELERATE trial. Am Heart J. 2015;170(6):1061-9.
-
269Barter P, Rye KA. Cholesteryl ester transfer protein inhibition is not yet dead--Pro. Arteriosclerosis Thromb Vasc Biol. 2016;36(3):439-41.
-
270Lambert G, Sjouke B, Choque B, Kastelein JJ, Hovingh GK. The PCSK9 decade. J Lipid Res. 2012;53(12):2515-24.
-
271Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J, et al; Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372(16):1500-9.
-
272Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna M, et al; ODYSSEY LONG TERM Investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372(16):1489-99.
-
273Sabatine MS, Giugliano RP, Keech A, Honarpour N, Wang H, Liu T, et al. Rationale and design of the Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk trial. Am Heart J. 2016;173:94-101.
-
274Sabatine MS, Giugliano RP, Keech A, Honarpour N, Wiviott SD, Murphy SA, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;Mar 16. [Epub ahead of print]
-
275Schwartz GG, Bessac L, Berdan LG, Bhatt DL, Bittner V, Diaz R, et al. Effect of alirocumab, a monoclonal antibody to PCSK9 on long-term cardiovascular outcomes following acute coronary syndromes rationale and design of the ODISSEY outcomes trial. Am Heart J. 2014;168(5):682-9.
-
276Hussain MM, Rava P, Walsh M, Rana M, Iqbal J. Multiple functions of microsomal triglyceride transfer protein. Nutr Metab (Lond). 2012;9:14.
-
277Cuchel M, Meagher EA, du Toit Theron H, Blom DJ, Marais AD, Hegele RA, et al; Phase 3 HoFH Lomitapide Study investigators. Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolaemia: a single-arm, open-label, phase 3 study. Lancet. 2013;381(9860):40-6.
-
278Chandler CE, Wilder DE, Pettini JL, Savoy YE, Petras SF, Chang G, et al. CP-346086: an MTP inhibitor that lowers plasma cholesterol and triglycerides in experimental animals and in humans. J Lipid Res. 2003;44(10):1887-901.
-
279Tuteja S, Duffy D, Dunbar RL, Movva R, Gadi R, Bloedon LT, et al. Pharmacokinetic interactions of the microsomal triglyceride transfer protein inhibitor, lomitapide, with drugs commonly used in the management of hypercholesterolemia. Pharmacotherapy. 2014;34(3):227-39.
-
280Goldberg AC. Novel therapies and new targets of treatment for familial hypercholesterolemia. J Clin Lipidol. 2010;4(5):350-6.
-
281Santos RD, Raal FJ, Catapano AL, Witztum JL, Steinhagen-Thiessen E, Tsimikas S. Mipomersen, an antisense oligonucleotide to apolipoprotein B-100, reduces lipoprotein(a) in various populations with hypercholesterolemia: results of 4 phase III trials. Arterioscler Thromb Vasc Biol. 2015;35(3):689-99.
-
282Ooi EM, Barrett PH, Chan DC, Watts GF. Apolipoprotein C-III: understanding an emerging cardiovascular risk factor. Clin Sci (Lond). 2008;114(10):611-24.
-
283Ginsberg HN, Le NA, Goldberg IJ, Gibson JC, Rubinstein A, Wang-Iverson P, et al. Apolipoprotein B metabolism in subjects with deficiency of apolipoproteins CIII and AI. Evidence that apolipoprotein CIII inhibits catabolism of triglyceride-rich lipoproteins by lipoprotein lipase in vivo. J Clin Invest. 1986;78(5):1287-95.
-
284Mendivil CO, Zheng C, Furtado J, Lel J, Sacks FM. Metabolism of very-low-density lipoprotein and low-density lipoprotein containing apolipoprotein C-III and not other small apolipoproteins. Arterioscler Thromb Vasc Biol. 2010;30(2):239-45. Erratum in: Arterioscler Thromb Vasc Biol. 2010;30(9):e171.
-
285Jorgensen AB, Frikke-Schmidt R, Nordestgaard BG, Tybjaerg-Hansen A. Loss-of-function mutations in APOC3 and risk of ischemic vascular disease. N Engl J Med. 2014;371(1):32-41.
-
286Pollin TI, Damcott CM, Shen H, Ott SH, Shelton J, Horenstein RB, et al. A null mutation in human APOC3 confers a favorable plasma lipid profile and apparent cardioprotection. Science. 2008;322(5908):1702-5.
-
287Crosby J, Peloso GM, Auer PL, Crosslin DR, Stitziel NO, Lange LA, et al; TG and HDL Working Group of the Exome Sequencing Project NHL, Blood Institute. Loss-of-function mutations in APOC3, triglycerides, and coronary disease. N Engl J Med. 2014;371(1):22-31.
-
288Graham MJ, Lee RG, Bell TA 3rd, Fu W, Mullick AE, Alexander VJ, et al. Antisense oligonucleotide inhibition of apolipoprotein C-III reduces plasma triglycerides in rodents, nonhuman primates, and humans. Circ Res. 2013;112(11):1479-90.
-
289Gaudet D, Alexander VJ, Baker BF, Brisson D, Tremblay K, Singleton W, et al. Antisense inhibition of Apolipoprotein C-III in patients with hypertriglyceridemia. N Engl J Med. 2015;373(5):438-47.
-
290Gaudet D, Brisson D, Tremblay K, Alexander VJ, Singleton W, Hughes SG, et al. Targeting APOC3 in the familial chylomicronemia syndrome. N Engl J Med. 2014;371(23):2200-6.
-
291Bernstein DL, Hulkova H, Bialer MG, Desnick RJ. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol. 2013;58(6):1230-43.
-
292Balwani M, Breen C, Enns GM, Deegan PB, Honzik T, Jones S, et al. Clinical effect and safety profile of recombinant human lysosomal acid lipase in patients with cholesteryl ester storage disease. Hepatology. 2013;58(3):950-7.
-
293Reiner Z, Guardamagna O, Nair D, Soran H, Hovingh K, Bertolini S, et al. Lysosomal acid lipase deficiency--an under-recognized cause of dyslipidaemia and liver dysfunction. Atherosclerosis. 2014;235(1):21-30.
-
294Thelwall PE, Smith FE, Leavitt MC, Canty D, Hu W, Hollingsworth KG, et al. Hepatic cholesteryl ester accumulation in lysosomal acid lipase deficiency: non-invasive identification and treatment monitoring by magnetic resonance. J Hepatol. 2013;59(3):543-9.
-
295Creider JC, Hegele RA. Clinical evaluation for genetic and secondary causes of dyslipidemia. In: Ballantyne CM. Clinical lipidology: a companion to Braunwald's heart disease. 2nd ed. Philadelphia: Saunder Elsevier; 2015. p. 128-34.
-
296Stone NJ. Secondary causes of hyperlipidemia. Med Clin North Am. 1994;78(1):117-41.
-
297Anderson TJ, Gregoire J, Hegele RA, Couture P, Mancini GB, McPherson R, et al. 2012 update of the Canadian Cardiovascular Society guidelines for the diagnosis and treatment of dyslipidemia for the prevention of cardiovascular disease in the adult. Can J Cardiol. 2013;29(2):151-67.
-
298Johansen CT, Hegele RA. Allelic and phenotypic spectrum of plasma triglycerides. Biochim Biophys Acta. 2012;1821(5):833-42.
-
299Talmud PJ, Shah S, Whittall R, Futema M, Howard P, Cooper JA, et al. Use of low-density lipoprotein cholesterol gene score to distinguish patients with polygenic and monogenic familial hypercholesterolaemia: a case-control study. Lancet. 2013;381(9874):1293-301.
-
300Teslovich TM, Musunuru K, Smith AV, Edmondson AC, Stylianou IM, Koseki M, et al. Biological, clinical and population relevance of 95 loci for blood lipids. Nature. 2010;466(7307):707-13.
-
301Marks D, Thorogood M, Neil HA, Humphries SE. A review on the diagnosis, natural history, and treatment of familial hypercholesterolaemia. Atherosclerosis. 2003;168(1):1-14.
-
302Fouchier SW, Defesche JC, Umans-Eckenhausen MW, Kastelein JP. The molecular basis of familial hypercholesterolemia in The Netherlands. Hum Genet. 2001;109(6):602-15.
-
303Goldstein JL HH, Brown MS. The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2000. p. 2863-913.
-
304Benn M, Watts GF, Tybjaerg-Hansen A, Nordestgaard BG. Familial hypercholesterolemia in the danish general population: prevalence, coronary artery disease, and cholesterol-lowering medication. J Clin Endocrinol Metab. 2012;97(11):3956-64. Erratum in: J Clin Endocrinol Metab. 2014;99(12):4758-9.
-
305Neefjes LA, Ten Kate GJ, Alexia R, Nieman K, Galema-Boers AJ, Langendonk JG, et al. Accelerated subclinical coronary atherosclerosis in patients with familial hypercholesterolemia. Atherosclerosis. 2011;219(2):721-7.
-
306Gidding SS, Champagne MA, de Ferranti SD, Defesche J, Ito MK, Knowles JW, et al; American Heart Association Atherosclerosis, Hypertension, and Obesity in Young Committee of Council on Cardiovascular Disease in Young, Council on Cardiovascular and Stroke Nursing, Council on Functional Genomics and Translational Biology, and Council on Lifestyle and Cardiometabolic Health. The agenda for familial hypercholesterolemia: a scientific statement from the American Heart Association. Circulation. 2015;132(22):2167-92.
-
307O'Brien EC, Roe MT, Fraulo ES, Peterson ED, Ballantyne CM, Genest J, et al. Rationale and design of the familial hypercholesterolemia foundation CAscade SCreening for Awareness and DEtection of Familial Hypercholesterolemia registry. Am Heart J. 2014;167(3):342-9 e17.
-
308Besseling J, Sjouke B, Kastelein JJ. Screening and treatment of familial hypercholesterolemia - Lessons from the past and opportunities for the future (based on the Anitschkow Lecture 2014). Atherosclerosis. 2015;241(2):597-606.
-
309Allard MD, Saeedi R, Yousefi M, Frohlich J. Risk stratification of patients with familial hypercholesterolemia in a multi-ethnic cohort. Lipids Health Dis. 2014;13:65.
-
310Santos RD, Gidding SS, Hegele RA, Cuchel MA, Barter PJ, Watts GF, et al; International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Defining severe familial hypercholesterolaemia and the implications for clinical management: a consensus statement from the International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Lancet Diabetes Endocrinol. 2016;4(10):850-61.
-
311Kastelein JJ, Ginsberg HN, Langslet G, et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with het- erozygous familial hypercholesterolaemia. Eur Heart J. 2015;36: 2996–3003.
-
312Raal FJ, Stein EA, Dufour R, Turner T, Civeira F, Burgess L, Langslet G, Scott R, Olsson AG, Sullivan D, Hovingh GK, Cariou B, Gouni-Berthold I, Somaratne R, Bridges I, Scott R, Wasserman SM, Gaudet D; RUTHERFORD-2 Investigators. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. Lancet. 2015 Jan 24;385(9965):331-40.
-
313Khachadurian AK, Uthman SM. Experiences with the homozygous cases of familial hypercholesterolemia: a report of 52 patients. Nutrition and metabolism. 1973;15(1):132-40.
-
314Stanbury JB, Wyngaarden JB, Fredrickson DS (eds.). The metabolic basis of inherited disease. 3rd ed. New York: McGraw-Hill;1972.
-
315Haitas B, Baker SG, Meyer TE, Joffe BI, Seftel HC. Natural history and cardiac manifestations of homozygous familial hypercholesterolaemia. Q J Med. 1990;76(279):731-40.
-
316Santos RD, Miname MH, Martinez LR, Rochitte CE, Chacra AP, Nakandakare ER, et al. Non-invasive detection of aortic and coronary atherosclerosis in homozygous familial hypercholesterolemia by 64 slice multi-detector row computed tomography angiography. Atherosclerosis. 2008;197(2):910-5.
-
317Raal FJ, Pilcher GJ, Panz VR, van Deventer HE, Brice BC, Blom DJ, et al. Reduction in mortality in subjects with homozygous familial hypercholesterolemia associated with advances in lipid-lowering therapy. Circulation. 2011;124(20):2202-7.
-
318Raal FJ, Honarpour N, Blom DJ, Hovingh GK, Xu F, Scott R, Wasserman SM, Stein EA; TESLA Investigators. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B): a randomised, double-blind, placebo-controlled trial. Lancet. 2015 Jan 24;385(9965):341-50.
-
319Hendry WG, Seed M. Homozygous familial hypercholesterolaemia with supravalvar aortic stenosis treated by surgery. J R Soc Med. 1985;78(4):334-5.
-
320Hegele RA, Ginsberg HN, Chapman MJ, Nordestgaard BG, Kuivenhoven JA, Averna M, et al; European Atherosclerosis Society Consensus Panel. The polygenic nature of hypertriglyceridaemia: implications for definition, diagnosis, and management. Lancet Diabetes Endocrinol. 2014;2(8):655-66.
-
321Brahm A, Hegele RA. Hypertriglyceridemia. Nutrients. 2013;5(3):981-1001.
-
322Sacks FM, Carey VJ, Fruchart JC. Combination lipid therapy in type 2 diabetes. N Engl J Med. 2010;363(7):692-4.
-
323van den Bogaard B, Holleboom AG, Duivenvoorden R, Hutten BA, Kastelein JJ, Hovingh GK, et al. Patients with low HDL-cholesterol caused by mutations in LCAT have increased arterial stiffness. Atherosclerosis. 2012;225(2):481-5.
-
324Uehara Y, Tsuboi Y, Zhang B, Miura S, Baba Y, Higuchi MA, et al. POPC/apoA-I discs as a potent lipoprotein modulator in Tangier disease. Atherosclerosis. 2008;197(1):283-9.
-
325Santamarina-Fojo S, Hoegt JM, Assmann G, Brewer B Jr. Lecithin cholesterol acyltransferase deficiency and fish eye disease. In: Metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2001. p. 2817-33.
-
326Jones SA, Valayannopoulos V, Schneider E, Eckert S, Banikazemi M, Bialer M, et al. Rapid progression and mortality of lysosomal acid lipase deficiency presenting in infants. Genet Med. 2016;18(5):452-8.
-
327Quinn AG, Burton B, Deegan P, Di Rocco M, Enns G, Guardamagna O. Sustained elevations in LDL cholesterol and serum transaminases from early childhood are common in lysosomal acid lipase deficiency. Mol Genet Metab. 2014;111(2):589.
-
328Hulkova H, Elleder M. Distinctive histopathological features that support a diagnosis of cholesterol ester storage disease in liver biopsy specimens. Histopathology. 2012;60(7):1107-13.
-
329Gasche C, Aslanidis C, Kain R, Exner M, Helbich T, Dejaco C, et al. A novel variant of lysosomal acid lipase in cholesteryl ester storage disease associated with mild phenotype and improvement on lovastatin. J Hepatol. 1997;27(4):744-50.
-
330Chatrath H, Keilin S, Attar BM. Cholesterol ester storage disease (CESD) diagnosed in an asymptomatic adult. Dig Dis Sci. 2009;54(1):168-73.
-
331Scott SA, Liu B, Nazarenko I, Martis S, Kozlitina J, Yang Y, et al. Frequency of the cholesteryl ester storage disease common LIPA E8SJM mutation (c.894G>A) in various racial and ethnic groups. Hepatology. 2013;58(3):958-65.
-
332Aslanidis C, Ries S, Fehringer P, Buchler C, Klima H, Schmitz G. Genetic and biochemical evidence that CESD and Wolman disease are distinguished by residual lysosomal acid lipase activity. Genomics. 1996;33(1):85-93.
-
333Pagani F, Pariyarath R, Garcia R, Stuani C, Burlina AB, Ruotolo G, et al. New lysosomal acid lipase gene mutants explain the phenotype of Wolman disease and cholesteryl ester storage disease. J Lipid Res. 1998;39(7):1382-8.
-
334Ginsberg HN, Le NA, Short MP, Ramakrishnan R, Desnick RJ. Suppression of apolipoprotein B production during treatment of cholesteryl ester storage disease with lovastatin. Implications for regulation of apolipoprotein B synthesis. J Clin Invest. 1987;80(6):1692-7.
-
335Burke JA, Schubert WK. Deficient activity of hepatic acid lipase in cholesterol ester storage disease. Science. 1972;176(4032):309-10.
-
336Patrick AD, Lake BD. Deficiency of an acid lipase in Wolman's disease. Nature. 1969;222(5198):1067-8.
-
337Hamilton J, Jones I, Srivastava R, Galloway P. A new method for the measurement of lysosomal acid lipase in dried blood spots using the inhibitor Lalistat 2. Clin Chim Acta. 2012;413(15-16):1207-10.
-
338Roberts EA, Schilsky ML; American Association for Study of Liver Diseases (AASLD). Diagnosis and treatment of Wilson disease: an update. Hepatology. 2008;47(6):2089-111.
-
339Manolaki N, Nikolopoulou G, Daikos GL, Panagiotakaki E, Tzetis M, Roma E, et al. Wilson disease in children: analysis of 57 cases. J Pediatr Gastroenterol Nutr. 2009;48(1):72-7.
-
340Kuller L, Borhani N, Furberg C, Gardin J, Manolio T, O'Leary D, et al. Prevalence of subclinical atherosclerosis and cardiovascular disease and association with risk factors in the Cardiovascular Health Study. Am J Epidemiol. 1994;139(12):1164-79.
-
341Moran A, Gu D, Zhao D, Coxson P, Wang YC, Chen CS, et al. Future cardiovascular disease in china: markov model and risk factor scenario projections from the coronary heart disease policy model-china. Circ Cardiovasc Qual Outcomes. 2010;3(3):243-52.
-
342Corti MC, Barbato GM, Baggio G. Lipoprotein alterations and atherosclerosis in the elderly. Curr Opin Lipidol. 1997;8(4):236-41.
-
343Krumholz HM, Seeman TE, Merrill SS, Mendes de Leon CF, Vaccarino V, Silverman DI, et al. Lack of association between cholesterol and coronary heart disease mortality and morbidity and all-cause mortality in persons older than 70 years. JAMA. 1994;272(17):1335-40.
-
344Schatz IJ, Masaki K, Yano K, Chen R, Rodriguez BL, Curb JD. Cholesterol and all-cause mortality in elderly people from the Honolulu Heart Program: a cohort study. Lancet. 2001;358(9279):351-5.
-
345Fontana L, Addante F, Copetti M, Paroni G, Fontana A, Sancarlo D, et al. Identification of a metabolic signature for multidimensional impairment and mortality risk in hospitalized older patients. Aging Cell. 2013;12(3):459-66.
-
346Corti MC, Guralnik JM, Salive ME, Harris T, Ferrucci L, Glynn RJ, et al. Clarifying the direct relation between total cholesterol levels and death from coronary heart disease in older persons. Ann Intern Med. 1997;126(10):753-60.
-
347Lemaitre RN, Psaty BM, Heckbert SR, Kronmal RA, Newman AB, Burke GL. Therapy with hydroxymethylglutaryl coenzyme a reductase inhibitors (statins) and associated risk of incident cardiovascular events in older adults: evidence from the Cardiovascular Health Study. Arch Intern Med. 2002;162(12):1395-400.
-
348Shepherd J, Blauw GJ, Murphy MB, Bollen EL, Buckley BM, Cobbe SM, et al; PROSPER study group. PROspective Study of Pravastatin in the Elderly at Risk. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet. 2002;360(9346):1623-30.
-
349Collins R, Armitage J, Parish S, Sleight P, Peto R, Heart Protection Study Collaborative Group. Effects of cholesterol-lowering with simvastatin on stroke and other major vascular events in 20536 people with cerebrovascular disease or other high-risk conditions. Lancet. 2004;363(9411):757-67.
-
350Giuliano Ide C, Coutinho MS, Freitas SF, Pires MM, Zunino JN, Ribeiro RQ. [Serum lipids in school kids and adolescents from Florianopolis, SC, Brazil--Healthy Floripa 2040 study]. Arq BrasCardiol. 2005;85(2):85-91.
-
351Gama SR, Carvalho MS, Chaves CR. [Childhood prevalence of cardiovascular risk factors]. Cad Saude Publica. 2007;23(9):2239-45.
-
352de Franca E, Alves JG. Dyslipidemia among adolescents and children from Pernambuco. Arq Bras Cardiol. 2006;87(6):722-7.
-
353Juonala M, Magnussen CG, Berenson GS, Venn A, Burns TL, Sabin MA, et al. Childhood adiposity, adult adiposity, and cardiovascular risk factors. N Engl J Med. 2011;365(20):1876-85.
-
354Juonala M, Viikari JS, Raitakari OT. Main findings from the prospective Cardiovascular Risk in Young Finns Study. Curr Opin Lipidol. 2013;24(1):57-64.
-
355Daniels SR, Greer FR; Committee on Nutrition. Lipid screening and cardiovascular health in childhood. Pediatrics. 2008;122(1):198-208.
-
356Bamba V. Update on screening, etiology, and treatment of dyslipidemia in children. J Clin Endocrinol Metab. 2014;99(9):3093-102.
-
357Descamps OS, Tenoutasse S, Stephenne X, Gies I, Beauloye V, Lebrethon MC, et al. Management of familial hypercholesterolemia in children and young adults: consensus paper developed by a panel of lipidologists, cardiologists, paediatricians, nutritionists, gastroenterologists, general practitioners and a patient organization. Atherosclerosis. 2011;218(2):272-80.
-
358Steiner MJ, Skinner AC, Perrin EM. Fasting might not be necessary before lipid screening: a nationally representative cross-sectional study. Pediatrics. 2011;218(3):463-70.
-
359Jellinger PS, Smith DA, Mehta AE, Ganda O, Handelsman Y, Rodbard HW, et al; AACE Task Force for Management of Dyslipidemia and Prevention of Atherosclerosis. American Association of Clinical Endocrinologists' Guidelines for Management of Dyslipidemia and Prevention of Atherosclerosis. Endocr Pract. 2012;18 Suppl 1:1-78.
-
360Hauenschild A, Bretzel RG, Schnell-Kretschmer H, Kloer HU, Hardt PD, Ewald N. Successful treatment of severe hypertriglyceridemia with a formula diet rich in omega-3 fatty acids and medium-chain triglycerides. Ann Nutr Metab. 2010;56(3):170-5.
-
361Vuorio A, Kuoppala J, Kovanen PT, Humphries SE, Tonstad S, Wiegman A, et al. Statins for children with familial hypercholesterolemia. Cochrane Database Syst Rev. 2014 Jul 23;(7):CD006401.
-
362Lebenthal Y, Horvath A, Dziechciarz P, Szajewska H, Shamir R. Are treatment targets for hypercholesterolemia evidence based? Systematic review and meta-analysis of randomised controlled trials. Arch Dis Child. 2010;95(9):673-80.
-
363Yeste D, Chacon P, Clemente M, Albisu MA, Gussinye M, Carrascosa A. Ezetimibe as monotherapy in the treatment of hypercholesterolemia in children and adolescents. J Pediatr Endocrinol Metab. 2009;22(6):487-92.
-
364Amundsen AL, Ntanios F, Put N, Ose L. Long-term compliance and changes in plasma lipids, plant sterols and carotenoids in children and parents with FH consuming plant sterol ester-enriched spread. Eur J Clin Nutr. 2004;58(12):1612-20.
-
365Gidding SS, Prospero C, Hossain J, Zappalla F, Balagopal PB, Falkner B, et al. A double-blind randomized trial of fish oil to lower triglycerides and improve cardiometabolic risk in adolescents. J Pediatr. 2014;165(3):497-503 e2.
-
366Kennedy MJ, Jellerson KD, Snow MZ, Zacchetti ML. Challenges in the pharmacologic management of obesity and secondary dyslipidemia in children and adolescents. Paediatr Drugs. 2013;15(5):335-42.
-
367Kasmin A, Garcia-Bournissen F, Koren G. Risks of statin use during pregnancy: a systematic review. J Obstet Gynaecol Can. 2007;29(11):906-8.
-
368Wenstrom KD. The FDA's new advice on fish: it's complicated. Am J Obstet Gynecol. 2014;211(5):475-8. e1.
-
369Stevenson JC, Crook D, Godsland IF. Influence of age and menopause on serum lipids and lipoproteins in healthy women. Atherosclerosis. 1993;98(1):83-90.
-
370Rossouw JE, Prentice RL, Manson JE, Wu L, Barad D, Barnabei VM, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-77. Erratum in: JAMA. 2008;299(12):1426.
-
371Hulley S, Grady D, Bush T, Furberg C, Herrington D, Riggs B, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA. 1998;280(7):605-13.
-
372Grady D, Herrington D, Bittner V, Blumenthal R, Davidson M, Hlatky M, et al; HERS Research Group. Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). JAMA. 2002;288(1):49-57.
-
373Downs JR, Clearfield M, Weis S, Whitney E, Shapiro DR, Beere PA, et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA. 1998;279(20):1615-22.
-
374Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet. 1994;344(8934):1383-9.
-
375Sacks FM, Pfeffer MA, Moye LA, Rouleau JL, Rutherford JD, Cole TG, et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial investigators. N Engl J Med. 1996;335(14):1001-9.
-
376Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. N Engl J Med. 1998;339(19):1349-57.
-
377Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet. 2002;360(9326):7-22.
-
378Spencer FA, Fonarow GC, Frederick PD, Wright RS, Every N, Goldberg RJ, et al; National Registry of Myocardial Infarction. Early withdrawal of statin therapy in patients with non-ST-segment elevation myocardial infarction: national registry of myocardial infarction. Arch Intern Med. 2004;164(19):2162-8.
-
379Fonarow GC, Wright RS, Spencer FA, Fredrick PD, Dong W, Every N, et al; National Registry of Myocardial Infarction 4 Investigators. Effect of statin use within the first 24 hours of admission for acute myocardial infarction on early morbidity and mortality. Am J Cardiol. 2005;96(5):611-6.
-
380Di Sciascio G, Patti G, Pasceri V, Gaspardone A, Colonna G, Montinaro A. Efficacy of atorvastatin reload in patients on chronic statin therapy undergoing percutaneous coronary intervention: results of the ARMYDA-RECAPTURE (Atorvastatin for Reduction of Myocardial Damage During Angioplasty) Randomized Trial. J Am Coll Cardiol. 2009;54(6):558-65.
-
381Toso A, Leoncini M, Maioli M, Tropeano F, Di Vincenzo E, Villani S, et al. Relationship between inflammation and benefits of early high-dose rosuvastatin on contrast-induced nephropathy in patients with acute coronary syndrome: the pathophysiological link in the PRATO-ACS study (Protective Effect of Rosuvastatin and Antiplatelet Therapy on Contrast-Induced Nephropathy and Myocardial Damage in Patients With Acute Coronary Syndrome Undergoing Coronary Intervention). JACC Cardiovasc Interv. 2014;7(12):1421-9.
-
382Leoncini M, Toso A, Maioli M, Tropeano F, Villani S, Bellandi F. Early high-dose rosuvastatin for contrast-induced nephropathy prevention in acute coronary syndrome: Results from the PRATO-ACS Study (Protective Effect of Rosuvastatin and Antiplatelet Therapy On contrast-induced acute kidney injury and myocardial damage in patients with Acute Coronary Syndrome). J Am Coll Cardiol. 2014;63(1):71-9.
-
383Schwartz GG, Olsson AG, Ezekowitz MD, Ganz P, Oliver MF, Waters D, et al; Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) Study Investigators. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial. JAMA. 2001;285(13):1711-8.
-
384Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al; Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 Investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med. 2004;350(15):1495-504. Erratum in: N Engl J Med. 2006;354(7):778.
-
385Nagashima M, Koyanagi R, Kasanuki H, Hagiwara N, Yamaguchi J, Atsuchi N, et al; Heart Institute of Japan, Department of Cardiology (HIJC) Investigators. Effect of early statin treatment at standard doses on long-term clinical outcomes in patients with acute myocardial infarction (the Heart Institute of Japan, Department of Cardiology Statin Evaluation Program). Am J Cardiol. 2007;99(11):1523-8.
-
386Ridker PM, Cannon CP, Morrow D, Rifai N, Rose LM, McCabe CH, et al; Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 (PROVE IT-TIMI 22) Investigators. C-reactive protein levels and outcomes after statin therapy. N Engl J Med. 2005;352(1):20-8.
-
387Bohula EA, Giugliano RP, Cannon CP, Zhou J, Murphy SA, White JA, et al. Achievement of dual low-density lipoprotein cholesterol and high-sensitivity C-reactive protein targets more frequent with the addition of ezetimibe to simvastatin and associated with better outcomes in IMPROVE-IT. Circulation. 2015;132(13):1224-33.
-
388Jha V, Garcia-Garcia G, Iseki K, Li Z, Naicker S, Plattner B, et al. Chronic kidney disease: global dimension and perspectives. Lancet. 2013;382(9888):260-72. Erratum in: Lancet. 2013;382(9888):208.
-
389National Chronic Kidney Disease Fact Sheet: General Information and National Estimates on Chronic Kidney Disease in the United States. Atlanta (GA): US Department of Health and Human Services, Centers for Disease Control and Prevention; 2014. [Accessed in 2016 Sep 10]. Available from: URL:http:/www.cdc.gov/diabetes/pubs/pdf/kidney_factsheet.pdf)
» http:/www.cdc.gov/diabetes/pubs/pdf/kidney_factsheet.pdf -
390US Renal Data System. USRDS 2013 Annual Data Report: Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda (MD): 2013.
-
391Kalantar-Zadeh K, Block G, Humphreys MH, Kopple JD. Reverse epidemiology of cardiovascular risk factors in maintenance dialysis patients. Kidney Int. 2003;63(3):793-808.
-
392Iseki K, Yamazato M, Tozawa M, Takishita S. Hypocholesterolemia is a significant predictor of death in a cohort of chronic hemodialysis patients. Kidney Int. 2002;61(5):1887-93.
-
393Keane WF, Tomassini JE, Neff DR. Lipid abnormalities in patients with chronic kidney disease: implications for the pathophysiology of atherosclerosis. J Atheroscler Thromb. 2013;20(2):123-33.
-
394Arnadottir M, Thysell H, Dallongeville J, Fruchart JC, Nilsson-Ehle P. Evidence that reduced lipoprotein lipase activity is not a primary pathogenetic factor for hypertriglyceridemia in renal failure. Kidney Int. 1995;48(3):779-84.
-
395Hou W, Lv J, Perkovic V, Yang L, Zhao N, Jardine MJ, et al. Effect of statin therapy on cardiovascular and renal outcomes in patients with chronic kidney disease: a systematic review and meta-analysis. Eur Heart J. 2013;34(24):1807-17.
-
396Holdaas H, Fellstrom B, Jardine AG, Holme I, Nyberg G, Fauchald P, et al; Assessment of LEscol in Renal Transplantation (ALERT) Study Investigators. Effect of fluvastatin on cardiac outcomes in renal transplant recipients: a multicentre, randomised, placebo-controlled trial. Lancet. 2003;361(9374):2024-31.
-
397Fellstrom BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, et al; AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009;360(14):1395-407. Erratum in: N Engl J Med. 2010;362(15):1450.
-
398Wanner C, Krane V, Marz W, Olschewski M, Mann JF, Ruf G, et al; German Diabetes and Dialysis Study Investigators. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med. 2005;353(3):238-48. Erratum in: N Engl J Med. 2005;353(15):1640.
-
399Pandya V, Rao A, Chaudhary K. Lipid abnormalities in kidney disease and management strategies. World J Nephrol. 2015;4(1):83-91.
-
400Tonelli M, Wanner C, Kidney Disease: Improving Global Outcomes Lipid Guideline Development Work Group Members. Lipid management in chronic kidney disease: synopsis of the Kidney Disease: Improving Global Outcomes 2013 clinical practice guideline. Ann Intern Med. 2014;160(3):182.
-
401Targher G, Day CP, Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease. N Engl J Med. 2010;363(14):1341-50.
-
402Athyros VG, Tziomalos K, Gossios TD, Griva T, Anagnostis P, Kargiotis K, et al; GREACE Study Collaborative Group. Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation (GREACE) Study: a post-hoc analysis. Lancet. 2010;376(9756):1916-22.
-
403Calderon RM, Cubeddu LX, Goldberg RB, Schiff ER. Statins in the treatment of dyslipidemia in the presence of elevated liver aminotransferase levels: a therapeutic dilemma. Mayo Clin Proc. 2010;85(4):349-56.
-
404Georgescu E, Catu D, Stoica RM, Ionescu RI. Fluvastatin as out-of-label enhancer for early and sustained virological response in chronic hepatitis C treated with peginterferon and ribavirin. J Hepatol. 2010;52(Suppl 1):5-110.
-
405Butt AA, Yan P, Bonilla H, Abou-Samra AB, Shaikh OS, Simon TG, et al; ERCHIVES (Electronically Retrieved Cohort of HCV Infected Veterans) Study Team. Effect of addition of statins to antiviral therapy in hepatitis C virus-infected persons: Results from ERCHIVES. Hepatology. 2015;62(2):365-74.
-
406Tsan YT, Lee CH, Wang JD, Chen PC. Statins and the risk of hepatocellular carcinoma in patients with hepatitis B virus infection. J Clin Oncol. 2012;30(6):623-30. Erratum in: J Clin Oncol. 2013;31(24):3049.
-
407Abraldes JG, Albillos A, Banares R, Turnes J, Gonzalez R, Garcia-Pagan JC, et al. Simvastatin lowers portal pressure in patients with cirrhosis and portal hypertension: a randomized controlled trial. Gastroenterology. 2009;136(5):1651-8.
-
408Lewis JH. Clinical perspective: statins and the liver--harmful or helpful? Dig Dis Sci. 2012;57(7):1754-63.
-
409Kjekshus J, Apetrei E, Barrios V, Bohm M, Cleland JG, Cornel JH, et al; CORONA Group. Rosuvastatin in older patients with systolic heart failure. N Engl J Med. 2007;357(22):2248-61.
-
410Tavazzi L, Maggioni AP, Marchioli R, Barlera S, Franzosi MG, Latini R, et al; Gissi-HF Investigators. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet. 2008;372(9645):1231-9.
-
411Miller M, Seidler A, Moalemi A, Pearson TA. Normal triglyceride levels and coronary artery disease events: the Baltimore Coronary Observational Long-Term Study. J Am Coll Cardiol. 1998;31(6):1252-7.
-
412Gaziano JM, Hennekens CH, O'Donnell CJ, Breslow JL, Buring JE. Fasting triglycerides, high-density lipoprotein, and risk of myocardial infarction. Circulation. 1997;96(8):2520-5.
-
413Manninen V, Tenkanen L, Koskinen P, Huttunen JK, Manttari M, Heinonen OP, et al. Joint effects of serum triglyceride and LDL cholesterol and HDL cholesterol concentrations on coronary heart disease risk in the Helsinki Heart Study. Implications for treatment. Circulation. 1992;85(1):37-45.
-
414Horowitz BS, Goldberg IJ, Merab J, Vanni TM, Ramakrishnan R, Ginsberg HN. Increased plasma and renal clearance of an exchangeable pool of apolipoprotein A-I in subjects with low levels of high density lipoprotein cholesterol. J Clin Invest. 1993;91(4):1743-52.
-
415Kontush A, de Faria EC, Chantepie S, Chapman MJ. Antioxidative activity of HDL particle subspecies is impaired in hyperalphalipoproteinemia: relevance of enzymatic and physicochemical properties. Arterioscler Thromb Vasc Biol. 2004;24(3):526-33.
-
416Thompson WG, Gau GT. Hypertriglyceridemia and its pharmacologic treatment among US adults--invited commentary. Arch Intern Med. 2009;169(6):578-9.
-
417Wittrup HH, Tybjaerg-Hansen A, Nordestgaard BG. Lipoprotein lipase mutations, plasma lipids and lipoproteins, and risk of ischemic heart disease. A meta-analysis. Circulation. 1999;99(22):2901-7.
-
418Sprecher DL, Harris BV, Stein EA, Bellet PS, Keilson LM, Simbartl LA. Higher triglycerides, lower high-density lipoprotein cholesterol, and higher systolic blood pressure in lipoprotein lipase-deficient heterozygotes. A preliminary report. Circulation. 1996;94(12):3239-45.
-
419Hypertriglyceridaemia and vascular risk. Report of a meeting of physicians and scientists, University College London Medical School. Lancet. 1993;342(8874):781-7.
-
420Miller BD, Alderman EL, Haskell WL, Fair JM, Krauss RM. Predominance of dense low-density lipoprotein particles predicts angiographic benefit of therapy in the Stanford Coronary Risk Intervention Project. Circulation. 1996;94(9):2146-53.
-
421Brunzell JD. Clinical practice. Hypertriglyceridemia. N Engl J Med. 2007;357(10):1009-17.
-
422DeFronzo RA, Ferrannini E. Insulin resistance: a multifaceted syndrome responsible for NIDDM, obesity, hypertension, dyslipidemia, and atherosclerotic cardiovascular disease. Diabetes Care. 1991;14(3):173-94.
-
423McLaughlin T, Abbasi F, Cheal K, Chu J, Lamendola C, Reaven G. Use of metabolic markers to identify overweight individuals who are insulin resistant. Ann Intern Med. 2003;139(10):802-9.
-
424Simpson HC, Mann JI, Meade TW, Chakrabarti R, Stirling Y, Woolf L. Hypertriglyceridaemia and hypercoagulability. Lancet. 1983;1(8328):786-90.
-
425Humphries SE, Lane A, Green FR, Cooper J, Miller GJ. Factor VII coagulant activity and antigen levels in healthy men are determined by interaction between factor VII genotype and plasma triglyceride concentration. Arterioscler Thromb. 1994;14(2):193-8.
-
426Rosenson RS, Shott S, Lu L, Tangney CC. Hypertriglyceridemia and other factors associated with plasma viscosity. Am J Med. 2001;110(6):488-92.
-
427Ballantyne CM, Grundy SM, Oberman A, Kreisberg RA, Havel RJ, Frost PH, et al. Hyperlipidemia: diagnostic and therapeutic perspectives. J Clin Endocrinol Metab. 2000;85(6):2089-112.
-
428Hodis HN, Mack WJ. Triglyceride-rich lipoproteins and the progression of coronary artery disease. Curr Opin Lipidol. 1995;6(4):209-14.
-
429Mack WJ, Krauss RM, Hodis HN. Lipoprotein subclasses in the Monitored Atherosclerosis Regression Study (MARS). Treatment effects and relation to coronary angiographic progression. Arterioscler Thromb Vasc Biol. 1996;16(5):697-704.
-
430Hodis HN, Mack WJ, Dunn M, Liu C, Liu C, Selzer RH, et al. Intermediate-density lipoproteins and progression of carotid arterial wall intima-media thickness. Circulation. 1997;95(8):2022-6.
-
431Jukema JW, van Boven AJ, Groenemeijer B, Zwinderman AH, Reiber JH, Bruschke AV, et al. The Asp9 Asn mutation in the lipoprotein lipase gene is associated with increased progression of coronary atherosclerosis. REGRESS Study Group, Interuniversity Cardiology Institute, Utrecht, The Netherlands. Regression Growth Evaluation Statin Study. Circulation. 1996;94(8):1913-8.
-
432Stewart BF, Brown BG, Zhao XQ, Hillger LA, Sniderman AD, Dowdy A, et al. Benefits of lipid-lowering therapy in men with elevated apolipoprotein B are not confined to those with very high low density lipoprotein cholesterol. J Am Coll Cardiol. 1994;23(4):899-906.
-
433Sarwar N, Danesh J, Eiriksdottir G, Sigurdsson G, Wareham N, Bingham S, et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation. 2007;115(4):450-8.
-
434Tirosh A, Rudich A, Shochat T, Tekes-Manova D, Israeli E, Henkin Y, et al. Changes in triglyceride levels and risk for coronary heart disease in young men. Ann Intern Med. 2007;147(6):377-85.
-
435Freiberg JJ, Tybjaerg-Hansen A, Jensen JS, Nordestgaard BG. Nonfasting triglycerides and risk of ischemic stroke in the general population. JAMA. 2008;300(18):2142-52.
-
436Schaefer EJ, Lamon-Fava S, Ordovas JM, Cohn SD, Schaefer MM, Castelli WP, et al. Factors associated with low and elevated plasma high density lipoprotein cholesterol and apolipoprotein A-I levels in the Framingham Offspring Study. J Lipid Res. 1994;35(5):871-82.
-
437Genest JJ, Jr., Martin-Munley SS, McNamara JR, Ordovas JM, Jenner J, Myers RH, et al. Familial lipoprotein disorders in patients with premature coronary artery disease. Circulation. 1992;85(6):2025-33.
-
438Hansel B, Kontush A, Giral P, Bonnefont-Rousselot D, Chapman MJ, Bruckert E. One third of the variability in HDL-cholesterol level in a large dyslipidaemic population is predicted by age, sex and triglyceridaemia: The Paris La Pitie Study. Curr Med Res Opin. 2006;22(6):1149-60.
-
439Franceschini G. Epidemiologic evidence for high-density lipoprotein cholesterol as a risk factor for coronary artery disease. Am J Cardiol. 2001;88(12A):9N-13N.
-
440Lu Y, Dolle ME, Imholz S, van 't Slot R, Verschuren WM, Wijmenga C, et al. Multiple genetic variants along candidate pathways influence plasma high-density lipoprotein cholesterol concentrations. J Lipid Res. 2008;49(12):2582-9.
-
441Gofman JW, Young W, Tandy R. Ischemic heart disease, atherosclerosis, and longevity. Circulation. 1966;34(4):679-97.
-
442Miller GJ, Miller NE. Plasma-high-density-lipoprotein concentration and development of ischaemic heart-disease. Lancet. 1975;1(7897):16-9.
-
443Voight BF, Peloso GM, Orho-Melander M, Frikke-Schmidt R, Barbalic M, Jensen MK, et al. Plasma HDL cholesterol and risk of myocardial infarction: a mendelian randomisation study. Lancet. 2012;380(9841):572-80. Erratum in: Lancet. 2012;380(9841):564.
-
444Rached FH, Chapman MJ, Kontush A. HDL particle subpopulations: Focus on biological function. Biofactors. 2015;41(2):67-77.
-
445Khera AV, Cuchel M, de la Llera-Moya M, Rodrigues A, Burke MF, Jafri K, et al. Cholesterol efflux capacity, high-density lipoprotein function, and atherosclerosis. N Engl J Med. 2011;364(2):127-35.
-
446Rohatgi A, Khera A, Berry JD, Givens EG, Ayers CR, Wedin KE, et al. HDL cholesterol efflux capacity and incident cardiovascular events. N Engl J Med. 2014;371(25):2383-93.
-
447Wood PD, Stefanick ML, Williams PT, Haskell WL. The effects on plasma lipoproteins of a prudent weight-reducing diet, with or without exercise, in overweight men and women. N Engl J Med. 1991;325(7):461-6.
-
448Dattilo AM, Kris-Etherton PM. Effects of weight reduction on blood lipids and lipoproteins: a meta-analysis. Am J Clin Nutr. 1992;56(2):320-8.
-
449Ginsberg HN. Hypertriglyceridemia: new insights and new approaches to pharmacologic therapy. Am J Cardiol. 2001;87(10):1174-80; A4.
-
450Bezafibrate Infarction Prevention (BIP) study. Secondary prevention by raising HDL cholesterol and reducing triglycerides in patients with coronary artery disease. Circulation. 2000;102(1):21-7.
-
451Harris WS, Connor WE, Illingworth DR, Rothrock DW, Foster DM. Effects of fish oil on VLDL triglyceride kinetics in humans. J Lipid Res. 1990;31(9):1549-58.
-
452Nissen SE, Tsunoda T, Tuzcu EM, Schoenhagen P, Cooper CJ, Yasin M, et al. Effect of recombinant ApoA-I Milano on coronary atherosclerosis in patients with acute coronary syndromes: a randomized controlled trial. JAMA. 2003;290(17):2292-300.
-
453Navab M, Anantharamaiah GM, Hama S, Garber DW, Chaddha M, Hough G, et al. Oral administration of an Apo A-I mimetic Peptide synthesized from D-amino acids dramatically reduces atherosclerosis in mice independent of plasma cholesterol. Circulation. 2002;105(3):290-2.
-
454Waksman R, Torguson R, Kent KM, Pichard AD, Suddath WO, Satler LF, et al. A first-in-man, randomized, placebo-controlled study to evaluate the safety and feasibility of autologous delipidated high-density lipoprotein plasma infusions in patients with acute coronary syndrome. J Am Coll Cardiol. 2010;55(24):2727-35.
-
455Bhaskaran K, Hamouda O, Sannes M, Boufassa F, Johnson AM, Lambert PC, et al; CASCADE Collaboration. Changes in the risk of death after HIV seroconversion compared with mortality in the general population. JAMA. 2008;300(1):51-9.
-
456Grunfeld C, Pang M, Doerrler W, Shigenaga JK, Jensen P, Feingold KR. Lipids, lipoproteins, triglyceride clearance, and cytokines in human immunodeficiency virus infection and the acquired immunodeficiency syndrome. J Clin Endocrinol Metab. 1992;74(5):1045-52.
-
457Smith CJ, Ryom L, Weber R, Morlat P, Pradier C, Reiss P, et al; D:A:D Study Group. Trends in underlying causes of death in people with HIV from 1999 to 2011 (D:A:D): a multicohort collaboration. Lancet. 2014;384(9939):241-8.
-
458Hajjar LA, Calderaro D, Yu PC, Giuliano I, Lima EM, Barbaro G, et al. [Cardiovascular manifestations in patients infected with the human immunodeficiency virus]. Arq Bras Cardiol. 2005;85(5):363-77.
-
459Sposito AC, Caramelli B, Sartori AM, F Ramires JA. The Lipoprotein Profile in HIV Infected Patients. Braz J Infect Dis. 1997;1(6):275-83.
-
460Caramelli B, de Bernoche CY, Sartori AM, Sposito AC, Santos RD, Monachini MC, et al. Hyperlipidemia related to the use of HIV-protease inhibitors: natural history and results of treatment with fenofibrate. Braz J Infect Dis. 2001;5(6):332-8.
-
461Carr A, Samaras K, Chisholm DJ, Cooper DA. Pathogenesis of HIV-1-protease inhibitor-associated peripheral lipodystrophy, hyperlipidaemia, and insulin resistance. Lancet. 1998;351(9119):1881-3.
-
462Bastard JP, Caron M, Vidal H, Jan V, Auclair M, Vigouroux C, et al. Association between altered expression of adipogenic factor SREBP1 in lipoatrophic adipose tissue from HIV-1-infected patients and abnormal adipocyte differentiation and insulin resistance. Lancet. 2002;359(9311):1026-31.
-
463Lima EM, Gualandro DM, Yu PC, Giuliano Ide C, Marques AC, Calderaro D, et al. Cardiovascular prevention in HIV patients: results from a successful intervention program. Atherosclerosis. 2009;204(1):229-32.
-
464Group ISS, Lundgren JD, Babiker AG, Gordin F, Emery S, Grund B, et al; INSIGHT START Study Group. Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med. 2015;373(9):795-807.
-
465Sposito AC, Caramelli B, Fonseca FA, Bertolami MC, Afiune Neto A, Souza AD, et al; Sociedade Brasileira de Cardiologia. [IV Brazilian guideline for dyslipidemia and atherosclerosis prevention: Department of Atherosclerosis of Brazilian Society of Cardiology]. Arq Bras Cardiol. 2007;88 Suppl 1:2-19.
-
466Chauvin B, Drouot S, Barrail-Tran A, Taburet AM. Drug-drug interactions between HMG-CoA reductase inhibitors (statins) and antiviral protease inhibitors. Clini Pharmacokinet. 2013;52(10):815-31.
-
467Advani A, Patel M, Pichardo RV, Whitty Y, Advani S. Use of HMG-CoA reductase inhibitors in the HIV population: implications for individualized treatment selection. J Manag Care Spec Pharm. 2014;20(3):262-72.
-
468Calza L, Manfredi R, Chiodo F. Statins and fibrates for the treatment of hyperlipidaemia in HIV-infected patients receiving HAART. AIDS. 2003;17(6):851-9.
-
469Sponseller CA, Morgan RE, Kryzhanovski VA, Campbell SE, Davidson MH. Comparison of the lipid-lowering effects of pitavastatin 4 mg versus pravastatin 40 mg in adults with primary hyperlipidemia or mixed (combined) dyslipidemia: a Phase IV, prospective, US, multicenter, randomized, double-blind, superiority trial. Clin Ther. 2014;36(8):1211-22.
-
470Eckard AR, Jiang Y, Debanne SM, Funderburg NT, McComsey GA. Effect of 24 weeks of statin therapy on systemic and vascular inflammation in HIV-infected subjects receiving antiretroviral therapy. J Infect Dis. 2014;209(8):1156-64.
-
471Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, Benson CA, et al; International Antiviral Society-USA Panel. Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society-USA Panel. JAMA. 2014;312(4):410-25.
-
472Kearney PM, Blackwell L, Collins R, Keech A, Simes J, Peto R, et al; Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet. 2008;371(9607):117-25.
-
470Rubins HB, Robins SJ, Collins D, Fye CL, Anderson JW, Elam MB, et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. N Engl J Med. 1999;341(6):410-8.
-
474Frick MH, Elo O, Haapa K, Heinonen OP, Heinsalmi P, Helo P, et al. Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med. 1987;317(20):1237-45.
-
475Ballantyne CM, Radovancevic B, Farmer JA, Frazier OH, Chandler L, Payton-Ross C, et al. Hyperlipidemia after heart transplantation: report of a 6-year experience, with treatment recommendations. J Am Coll Cardiol. 1992;19(6):1315-21.
-
476Becker DM, Markakis M, Sension M, Vitalis S, Baughman K, Swank R, et al. Prevalence of hyperlipidemia in heart transplant recipients. Transplantation. 1987;44(2):323-5.
-
477Kobashigawa JA, Katznelson S, Laks H, Johnson JA, Yeatman L, Wang XM, et al. Effect of pravastatin on outcomes after cardiac transplantation. N Engl J Med. 1995;333(10):621-7.
-
478Wenke K, Meiser B, Thiery J, Nagel D, von Scheidt W, Steinbeck G, et al. Simvastatin reduces graft vessel disease and mortality after heart transplantation: a four-year randomized trial. Circulation. 1997;96(5):1398-402.
-
479Page RL 2nd, Miller GG, Lindenfeld J. Drug therapy in the heart transplant recipient: part IV: drug-drug interactions. Circulation. 2005;111(2):230-9.
-
480Navaneethan SD, Nigwekar SU, Perkovic V, Johnson DW, Craig JC, Strippoli GF. HMG CoA reductase inhibitors (statins) for dialysis patients. Cochrane Database Syst Rev. 2013 Sep 11;(9):CD004289.
-
481Bilchick KC, Henrikson CA, Skojec D, Kasper EK, Blumenthal RS. Treatment of hyperlipidemia in cardiac transplant recipients. Am Heart J. 2004;148(2):200-10.
-
482Pearce EN. Update in lipid alterations in subclinical hypothyroidism. J Clin Endocrinol Metab. 2012;97(2):326-33.
-
483Cooper DS, Biondi B. Subclinical thyroid disease. Lancet. 2012;379(9821):1142-54.
-
484Rallidis LS, Fountoulaki K, Anastasiou-Nana M. Managing the underestimated risk of statin-associated myopathy. Int J Cardiol. 2012;159(3):169-76.
-
485Vilar MJ, Sato EI. Estimating the incidence of systemic lupus erythematosus in a tropical region (Natal, Brazil). Lupus. 2002;11(8):528-32.
-
486Senna ER, De Barros AL, Silva EO, Costa IF, Pereira LV, Ciconelli RM, et al. Prevalence of rheumatic diseases in Brazil: a study using the COPCORD approach. J Rheumatol. 2004;31(3):594-7.
-
487Urowitz MB, Gladman D, Ibanez D, Bae SC, Sanchez-Guerrero J, Gordon C, et al; Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus. Arthritis Care Res (Hoboken). 2010;62(6):881-7.
-
488Souza DC, Santo AH, Sato EI. Mortality profile related to systemic lupus erythematosus: a multiple cause-of-death analysis. J Rheumatol. 2012;39(3):496-503.
-
489Gustafsson JT, Svenungsson E. Definitions of and contributions to cardiovascular disease in systemic lupus erythematosus. Autoimmunity. 2014;47(2):67-76.
-
490Schoenfeld SR, Kasturi S, Costenbader KH. The epidemiology of atherosclerotic cardiovascular disease among patients with SLE: a systematic review. Semin Arthritis Rheum. 2013;43(1):77-95.
-
491Tselios K, Koumaras C, Gladman DD, Urowitz MB. Dyslipidemia in systemic lupus erythematosus: just another comorbidity? Semin Arthritis Rheum. 2016;45(5):604-10.
-
492Borba EF, Bonfa E. Dyslipoproteinemias in systemic lupus erythematosus: influence of disease, activity, and anticardiolipin antibodies. Lupus. 1997;6(6):533-9.
-
493McMahon M, Grossman J, Skaggs B, Fitzgerald J, Sahakian L, Ragavendra N, et al. Dysfunctional proinflammatory high-density lipoproteins confer increased risk of atherosclerosis in women with systemic lupus erythematosus. Arthritis Rheum. 2009;60(8):2428-37.
-
494Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med. 1999;340(6):448-54. Erratum in: N Engl J Med. 1999;340(17):1376.
-
495Ferreira GA, Navarro TP, Telles RW, Andrade LE, Sato EI. Atorvastatin therapy improves endothelial-dependent vasodilation in patients with systemic lupus erythematosus: an 8 weeks controlled trial. Rheumatology (Oxford). 2007;46(10):1560-5.
-
496Schanberg LE, Sandborg C, Barnhart HX, Ardoin SP, Yow E, Evans GW, et al; Atherosclerosis Prevention in Pediatric Lupus Erythematosus Investigators. Use of atorvastatin in systemic lupus erythematosus in children and adolescents. Arthritis Rheum. 2012;64(1):285-96.
-
497Petri MA, Kiani AN, Post W, Christopher-Stine L, Magder LS. Lupus Atherosclerosis Prevention Study (LAPS). Ann Rheum Dis. 2011;70(5):760-5.
-
498Norby GE, Holme I, Fellstrom B, Jardine A, Cole E, Abedini S, et al; Assessment of Lescol in Renal Transplantation Study Group. Effect of fluvastatin on cardiac outcomes in kidney transplant patients with systemic lupus erythematosus: a randomized placebo-controlled study. Arthritis Rheum. 2009;60(4):1060-4.
-
499Ye Y, Zhao X, Xie H, Tian Z, Zhang S. Efficacy and safety of statins in the prevention of atherosclerosis in patients with systemic lupus erythematosus--a meta-analysis of randomized controlled trials. Int J Cardiol. 2013;167(1):301-3.
-
500Soubrier M, Mathieu S, Hermet M, Makarawiez C, Bruckert E. Do all lupus patients need statins? Joint Bone Spine. 2013;80(3):244-9.
-
501Ferreira GA, Teixeira AL, Sato EI. Atorvastatin therapy reduces interferon-regulated chemokine CXCL9 plasma levels in patients with systemic lupus erythematosus. Lupus. 2010;19(8):927-34.
-
502Ardoin SP, Sandborg C, Schanberg LE. Management of dyslipidemia in children and adolescents with systemic lupus erythematosus. Lupus. 2007;16(8):618-26.
-
503Conroy RM, Pyorala K, Fitzgerald AP, Sans S, Menotti A, De Backer G, et al; SCORE project group. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur Heart J. 2003;24(11):987-1003.
-
504Peters MJ, Symmons DP, McCarey D, Dijkmans BA, Nicola P, Kvien TK, et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis. 2010;69(2):325-31.
-
505Solomon DH, Greenberg J, Curtis JR, Liu M, Farkouh ME, Tsao P, et al. Derivation and internal validation of an expanded cardiovascular risk prediction score for rheumatoid arthritis: a Consortium of Rheumatology Researchers of North America Registry Study. Arthritis Rheumatol. 2015;67(8):1995-2003.
-
506Cohen JD, Brinton EA, Ito MK, Jacobson TA. Understanding Statin Use in America and Gaps in Patient Education (USAGE): an internet-based survey of 10,138 current and former statin users. J Clin Lipidol. 2012;6(3):208-15.
-
507Bruckert E, Hayem G, Dejager S, Yau C, Begaud B. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients--the PRIMO study. Cardiovasc Drugs Ther. 2005;19(6):403-14.
-
508El-Salem K, Ababneh B, Rudnicki S, Malkawi A, Alrefai A, Khader Y, et al. Prevalence and risk factors of muscle complications secondary to statins. Muscle Nerve. 2011;44(6):877-81.
-
509Parker BA, Capizzi JA, Grimaldi AS, Clarkson PM, Cole SM, Keadle J, et al. Effect of statins on skeletal muscle function. Circulation. 2013;127(1):96-103.
-
510Rosenson RS, Baker SK, Jacobson TA, Kopecky SL, Parker BA; The National Lipid Association's Muscle Safety Expert Panel. An assessment by the Statin Muscle Safety Task Force: 2014 update. J Clin Lipidol. 2014;8(3 Suppl):S58-71.
-
511Stroes ES, Thompson PD, Corsini A, Vladutiu GD, Raal FJ, Ray KK, et al; European Atherosclerosis Society Consensus Panel. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J. 2015;36(17):1012-22.
-
512Alfirevic A, Neely D, Armitage J, Chinoy H, Cooper RG, Laaksonen R, et al. Phenotype standardization for statin-induced myotoxicity. Clin Pharm Ther. 2014;96(4):470-6.
-
513Pasternak RC, Smith SC, Jr., Bairey-Merz CN, Grundy SM, Cleeman JI, Lenfant C, et al; American College of Cardiology; American Heart Association; National Heart, Lung and Blood Institute. ACC/AHA/NHLBI Clinical Advisory on the Use and Safety of Statins. Circulation. 2002;106(8):1024-8.
-
514Mohassel P, Mammen AL. Statin-associated autoimmune myopathy and anti-HMGCR autoantibodies. Muscle Nerve. 2013;48(4):477-83.
-
515Graham DJ, Staffa JA, Shatin D, Andrade SE, Schech SD, La Grenade L, et al. Incidence of hospitalized rhabdomyolysis in patients treated with lipid-lowering drugs. JAMA. 2004;292(21):2585-90.
-
516Law M, Rudnicka AR. Statin safety: a systematic review. Am J Cardiol. 2006;97(8A):52C-60C.
-
517Ward MM. Factors predictive of acute renal failure in rhabdomyolysis. Arch Intern Med. 1988;148(7):1553-7.
-
518Christopher-Stine L, Casciola-Rosen LA, Hong G, Chung T, Corse AM, Mammen AL. A novel autoantibody recognizing 200-kd and 100-kd proteins is associated with an immune-mediated necrotizing myopathy. Arthritis Rheum. 2010;62(9):2757-66.
-
519Grable-Esposito P, Katzberg HD, Greenberg SA, Srinivasan J, Katz J, Amato AA. Immune-mediated necrotizing myopathy associated with statins. Muscle Nerve. 2010;41(2):185-90.
-
520Needham M, Fabian V, Knezevic W, Panegyres P, Zilko P, Mastaglia FL. Progressive myopathy with up-regulation of MHC-I associated with statin therapy. Neuromuscul Disord. 2007;17(2):194-200.
-
521Vladutiu GD, Simmons Z, Isackson PJ, Tarnopolsky M, Peltier WL, Barboi AC, et al. Genetic risk factors associated with lipid-lowering drug-induced myopathies. Muscle Nerve. 2006;34(2):153-62.
-
522Ahmad Z. Statin intolerance. Am J Cardiol. 2014;113(10):1765-71.
-
523Mosshammer D, Schaeffeler E, Schwab M, Morike K. Mechanisms and Assessment of Statin-related Muscular Adverse Effects. Br J Clin Pharmacol. 2014;78(3):454-66.
-
524Shepherd J, Vidt DG, Miller E, Harris S, Blasetto J. Safety of rosuvastatin: update on 16,876 rosuvastatin-treated patients in a multinational clinical trial program. Cardiology. 2007;107(4):433-43.
-
525DeGorter MK, Tirona RG, Schwarz UI, Choi YH, Dresser GK, Suskin N, et al. Clinical and pharmacogenetic predictors of circulating atorvastatin and rosuvastatin concentrations in routine clinical care. Circ Cardiovasc Genet. 2013;6(4):400-8.
-
526Sullivan D, Olsson AG, Scott R, Kim JB, Xue A, Gebski V, et al. Effect of a monoclonal antibody to PCSK9 on low-density lipoprotein cholesterol levels in statin-intolerant patients: the GAUSS randomized trial. JAMA. 2012;308(23):2497-506.
-
527Link E, Parish S, Armitage J, Bowman L, Heath S, Matsuda F, et al; SEARCH Collaborative Group. SLCO1B1 variants and statin-induced myopathy--a genomewide study. N Engl J Med. 2008;359(8):789-99.
-
528Mancini GB, Baker S, Bergeron J, Fitchett D, Frohlich J, Genest J, et al. Diagnosis, prevention, and management of statin adverse effects and intolerance: proceedings of a Canadian Working Group Consensus Conference. Can J Cardiol. 2011;27(5):635-62.
-
529Carvalho LS, Sposito AC. Vitamin D for the prevention of cardiovascular disease: Are we ready for that? Atherosclerosis. 2015;241(2):729-40.
-
530Banach M, Serban C, Sahebkar A, Ursoniu S, Rysz J, Muntner P, et al; Lipid and Blood Pressure Meta-analysis Collaboration Group. Effects of coenzyme Q10 on statin-induced myopathy: a meta-analysis of randomized controlled trials. Mayo Clin Proc. 2015;90(1):24-34.
-
531Backes JM, Gibson CA, Ruisinger JF, Moriarty PM. The high-dose rosuvastatin once weekly study (the HD-ROWS). J Clin Lipidol. 2012;6(4):362-7.
-
532Bangalore S, Breazna A, DeMicco DA, Wun CC, Messerli FH; TNT Steering Committee and Investigators. Visit-to-visit low-density lipoprotein cholesterol variability and risk of cardiovascular outcomes: insights from the TNT trial. J Am Coll Cardiol. 2015;65(15):1539-48.
-
533Shalev V, Chodick G, Silber H, Kokia E, Jan J, Heymann AD. Continuation of statin treatment and all-cause mortality: a population-based cohort study. Arch Intern Med. 2009;169(3):260-8.
-
534Becker DJ, Gordon RY, Halbert SC, French B, Morris PB, Rader DJ. Red yeast rice for dyslipidemia in statin-intolerant patients: a randomized trial. Ann Intern Med. 2009;150(12):830-9, W147-9.
-
535Venero CV, Venero JV, Wortham DC, Thompson PD. Lipid-lowering efficacy of red yeast rice in a population intolerant to statins. Am J Cardiol. 2010;105(5):664-6.
-
536Stroes E, Colquhoun D, Sullivan D, Civeira F, Rosenson RS, Watts GF, et al; GAUSS-2 Investigators. Anti-PCSK9 antibody effectively lowers cholesterol in patients with statin intolerance: the GAUSS-2 randomized, placebo-controlled phase 3 clinical trial of evolocumab. J Am Coll Cardiol. 2014;63(23):2541-8.
-
537Moriarty PM, Cannon CP, Guyton JR, Bergeron J, Zieve FJ, Bruckert E, et al; Odyssey Alternative: Efficacy and safety of the proprotein convertase subtilisin/kexin type 9 monoclonal antibody, alirocumab, versus ezetimibe, in patients with statin intolerance as defined by a placebo run-in and statin rechallenge arm. Circulation. 2014;130(23):1474-82.
-
538Waters DD, Hsue PY, Bangalore S. PCSK9 Inhibitors for statin intolerance? JAMA. 2016;315(15):1571-2.
-
539Nissen SE, Stroes E, Dent-Acosta RE, Rosenson RS, Lehman SJ, Sattar N, et al; GAUSS-3 Investigators. Efficacy and tolerability of evolocumab vs ezetimibe in patients with muscle-related statin intolerance: the GAUSS-3 Randomized Clinical Trial. JAMA. 2016;315(15):1580-90.
-
540Bays H. Statin safety: an overview and assessment of the data--2005. Am J Cardiol. 2006;97(8A):6C-26C.
-
541Blaier O, Lishner M, Elis A. Managing statin-induced muscle toxicity in a lipid clinic. J Clin Pharm Ther. 2011;36(3):336-41.
-
542Kashani A, Phillips CO, Foody JM, Wang Y, Mangalmurti S, Ko DT, et al. Risks associated with statin therapy: a systematic overview of randomized clinical trials. Circulation. 2006;114(25):2788-97.
-
543Hansen KE, Hildebrand JP, Ferguson EE, Stein JH. Outcomes in 45 patients with statin-associated myopathy. Arch Intern Med. 2005;165(22):2671-6.
-
544Molokhia M, McKeigue P, Curcin V, Majeed A. Statin induced myopathy and myalgia: time trend analysis and comparison of risk associated with statin class from 1991-2006. PloS One. 2008;3(6):e2522.
-
545Moghadasian MH, Mancini GB, Frohlich JJ. Pharmacotherapy of hypercholesterolaemia: statins in clinical practice. Exp Opin Pharmacother. 2000;1(4):683-95.
-
546Antons KA, Williams CD, Baker SK, Phillips PS. Clinical perspectives of statin-induced rhabdomyolysis. Am J Med. 2006;119(5):400-9.
-
547Black C, Jick H. Etiology and frequency of rhabdomyolysis. Pharmacotherapy. 2002;22(12):1524-6.
-
548Cziraky MJ, Willey VJ, McKenney JM, Kamat SA, Fisher MD, Guyton JR, et al. Risk of hospitalized rhabdomyolysis associated with lipid-lowering drugs in a real-world clinical setting. J Clin Lipidol. 2013;7(2):102-8.
-
549Floyd JS, Heckbert SR, Weiss NS, Carrell DS, Psaty BM. Use of administrative data to estimate the incidence of statin-related rhabdomyolysis. JAMA. 2012;307(15):1580-2.
-
550Ara R, Pandor A, Tumur I, Paisley S, Duenas A, Williams R, et al. Cost effectiveness of ezetimibe in patients with cardiovascular disease and statin intolerance or contraindications: a Markov model. Am J Cardiovasc Drugs. 2008;8(6):419-27.
-
551Group HTC, Landray MJ, Haynes R, Hopewell JC, Parish S, Aung T, et al; HPS2-THRIVE Collaborative Group. Effects of extended-release niacin with laropiprant in high-risk patients. N Engl J Med. 2014;371(3):203-12.
-
552Genser B, Silbernagel G, De Backer G, Bruckert E, Carmena R, Chapman MJ, et al. Plant sterols and cardiovascular disease: a systematic review and meta-analysis. Eur Heart J. 2012;33(4):444-51.
-
553The Lipid Research Clinics Coronary Primary Prevention Trial results. II. The relationship of reduction in incidence of coronary heart disease to cholesterol lowering. JAMA. 1984;251(3):365-74.
-
554Lu Z, Kou W, Du B, Wu Y, Zhao S, Brusco OA, et al; Chinese Coronary Secondary Prevention Study Group. Effect of Xuezhikang, an extract from red yeast Chinese rice, on coronary events in a Chinese population with previous myocardial infarction. Am J Cardiol. 2008;101(12):1689-93.
-
555Shang Q, Liu Z, Chen K, Xu H, Liu J. A systematic review of xuezhikang, an extract from red yeast rice, for coronary heart disease complicated by dyslipidemia. Evid Based Complement Alternat Med. 2012;2012:636547.
-
556Lee P, Greenfield JR, Campbell LV. Vitamin D insufficiency--a novel mechanism of statin-induced myalgia? Clin Endocrinol (Oxf). 2009;71(1):154-5.
-
557Schwartz JB. Effects of vitamin D supplementation in atorvastatin-treated patients: a new drug interaction with an unexpected consequence. Clin Pharmacol Ther. 2009;85(2):198-203
Datas de Publicação
-
Publicação nesta coleção
Ago 2017