Introdução
A indicação da intervenção cirúrgica ou percutânea no paciente com doença valvar está atrelada ao preciso diagnóstico anatômico e funcional, além do conhecimento da história natural da doença.
Nesta atualização da Diretriz Brasileira de Valvopatias de 2011, são contemplados apenas pacientes com valvopatia anatomicamente importante (estágios C e D da Diretriz da American College of Cardiology (ACC)/ American Heart Association (AHA), de 2014). As tabelas e fluxogramas que aqui constam demonstram passos sequenciais que norteiam o diagnóstico anatômico, etiológico e funcional, definindo a conduta alinhada às melhores práticas, com uso racional de recursos.
A avaliação clínica continua absolutamente fundamental, destacando-se a grande especificidade do exame físico para o diagnóstico anatômico e a anamnese como principais recursos para avaliação funcional e indicação para intervenção.
Além da proposta dos passos, esta Diretriz indica, para efeito de comparação, as recomendações das duas principais diretrizes internacionais - ACC/AHA 2017 e European Society of Cardiology (ESC)/European Association for Cardio-Thoracic Surgery (EACTS) 2017.
Vale ressaltar que a profilaxia de febre reumática, profilaxia da endocardite infecciosa, assim como indicações de intervenção na valvopatia pulmonar, mantém exatamente os mesmos princípios, conforme publicado na Diretriz brasileira de 2011 e descrito a seguir:
-
Primeiro passo: certificar-se de que a valvopatia é anatomicamente importante;
-
Segundo passo: avaliar a etiologia, incluindo história clínica e antecedentes pessoais, em conjunção com exames complementares;
-
Terceiro passo: avaliar os sintomas - uma vez definida a valvopatia anatomicamente importante, a avaliação dos sintomas secundários é fundamental na decisão de intervenção. O tratamento farmacológico está indicado para alívio dos sintomas até o tratamento intervencionista da doença valvar;
-
Quarto passo: avaliação de complicadores - na ausência de sintomas, a identificação de complicadores anatômicos e/ou funcionais (especialmente hipertensão pulmonar, remodelamento ventricular, disfunção sistólica, dilatação aneurismática de aorta, fibrilação atrial) pode ser determinante para intervenção nos pacientes assintomáticos;
-
Quinto passo: tipo de intervenção - o procedimento de correção da doença valvar pode ser cirúrgico ou transcateter, com indicação individualizada dependendo do risco operatório, das comorbidades e da decisão do Heart Team.
Heart Team
O Heart Team é um conceito no qual um conjunto de diferentes profissionais com experiência em doenças valvares compartilha a decisão sobre o melhor tratamento para um determinado paciente. Com a introdução de diferentes tipos de abordagem para o tratamento de pacientes com valvopatias, o Heart Team tem sido cada vez mais utilizado em seu manejo. É composto por diversas subespecialidades cardiológicas, com especialistas que exercem papéis diferentes e fundamentais em cada passo do cuidado: do cardiologista clínico (a quem cabe a seleção e a indicação de pacientes, além do acompanhamento pré e pós-intervenção), ao cirurgião cardíaco e ao hemodinamicista, responsáveis pela concretização dos procedimentos indicados pelo Heart Team. Além deles, o radiologista é importante na análise de dados para avaliar a possibilidade técnica de realização de cada tipo de intervenção; e o ecocardiografista, além de avaliar os dados pré-operatórios, pode também acompanhar o procedimento, colaborando para um melhor resultado.
Estenose mitral
Enquanto no Brasil e demais países em desenvolvimento a principal causa da estenose mitral (EM) é a febre reumática, nos países desenvolvidos observa-se aumento da incidência de EM degenerativa, associada à calcificação do anel mitral e que se desenvolve em pacientes idosos.
Nesta Diretriz, a EM é classificada como anatomicamente importante quando a área valvar mitral for menor do que 1,5 cm2.
Para os pacientes reumáticos, a valvuloplastia mitral por cateter-balão (VMCB) continua sendo o tratamento de escolha, seguido pela cirurgia valvar.
No caso dos pacientes com EM degenerativa, o tratamento inicial de quem se apresenta sintomático é farmacológico, reservando-se intervenção para casos refratários. Nos pacientes com alto risco cirúrgico, o implante valvar mitral transcateter foi, até o momento, realizado em um número limitado de casos. Para a sua ampla indicação e realização, ainda são requeridos estudos que validem os seus resultados em maior escala.
Algoritmo para avaliação da estenose mitral importante. CF: classe funcional; FA: fibrilação atrial; VMBC: valvuloplastia mitral por cateter-balão.
Insuficiência mitral primária crônica
A insuficiência mitral (IM) primária crônica é uma das valvopatias mais prevalentes mundialmente. A etiologia reumática ainda é predominante no Brasil, embora o prolapso da valva mitral tenha aumentado em frequência. Diferentemente das Diretrizes europeia e americana, dividimos as indicações de tratamento cirúrgico com base na etiologia reumática e não reumática. A plástica valvar mitral é o tratamento cirúrgico preferencial nos casos com anatomia favorável. Os pacientes de etiologia reumática têm menos probabilidade de plástica valvar com bons resultados, sendo necessária a troca valvar, na maioria dos casos.
Algoritmo para avaliação da insuficiência mitral primária importante. CF: classe funcional; FE: fração de ejeção; DSVE: diâmetro sistólico de ventrículo esquerdo; PSAS: pressão sistólica da artéria pulmonar; FA: fibrilação atrial.
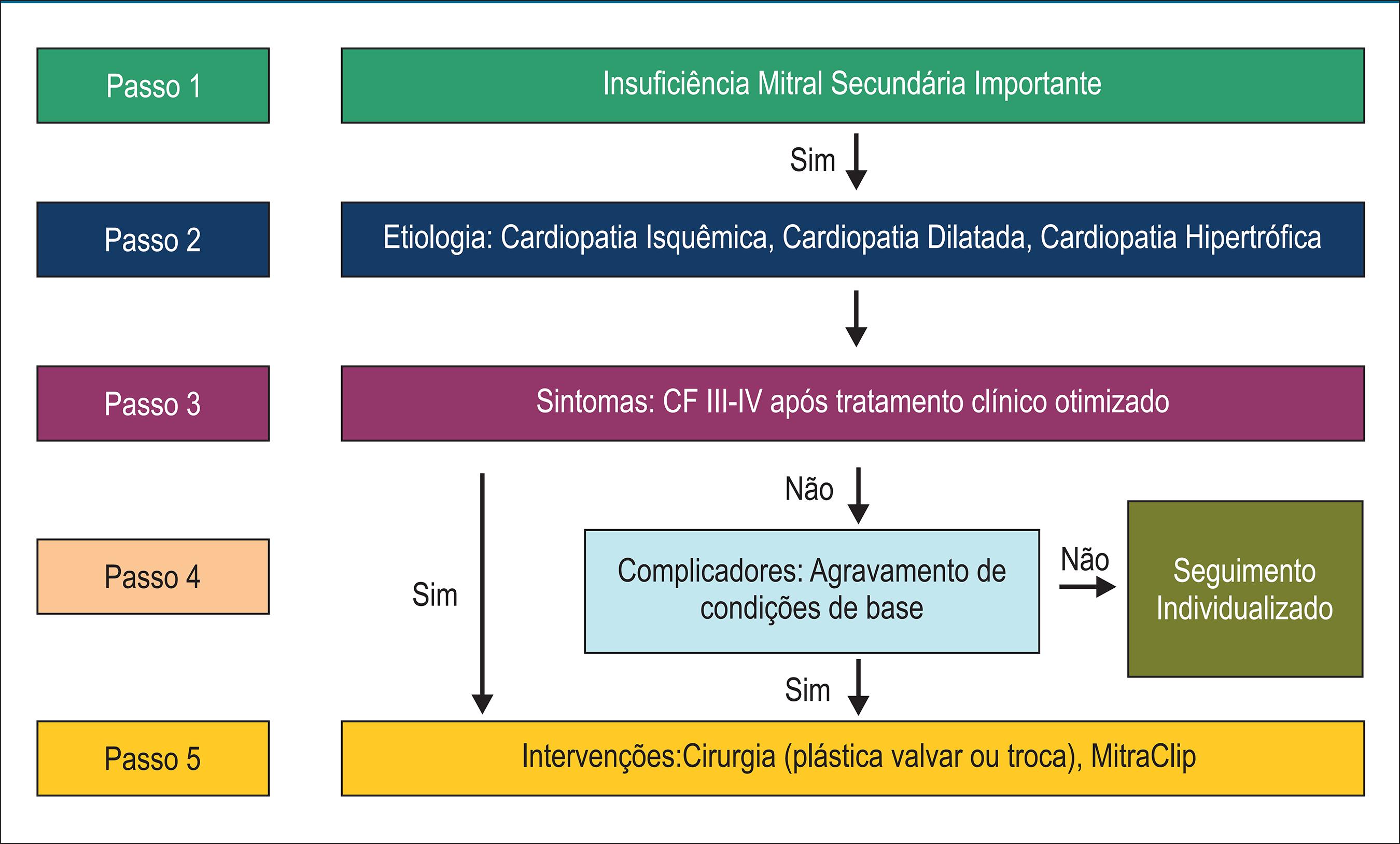
Insuficiência mitral secundária
A IM crônica secundária, ou funcional, deve-se a alterações na geometria ventricular, resultando em má coaptação das cúspides valvares e aparecimento de refluxo valvar. Habitualmente é causada por doença isquêmica cardíaca ou por outras cardiopatias dilatadas, de diversas etiologias. As indicações de tratamento são distintas da IM primária, uma vez que o problema básico não está nas cúspides valvares. A indicação de intervenção na IM secundária deve ser restrita a casos refratários ao tratamento clínico convencional.
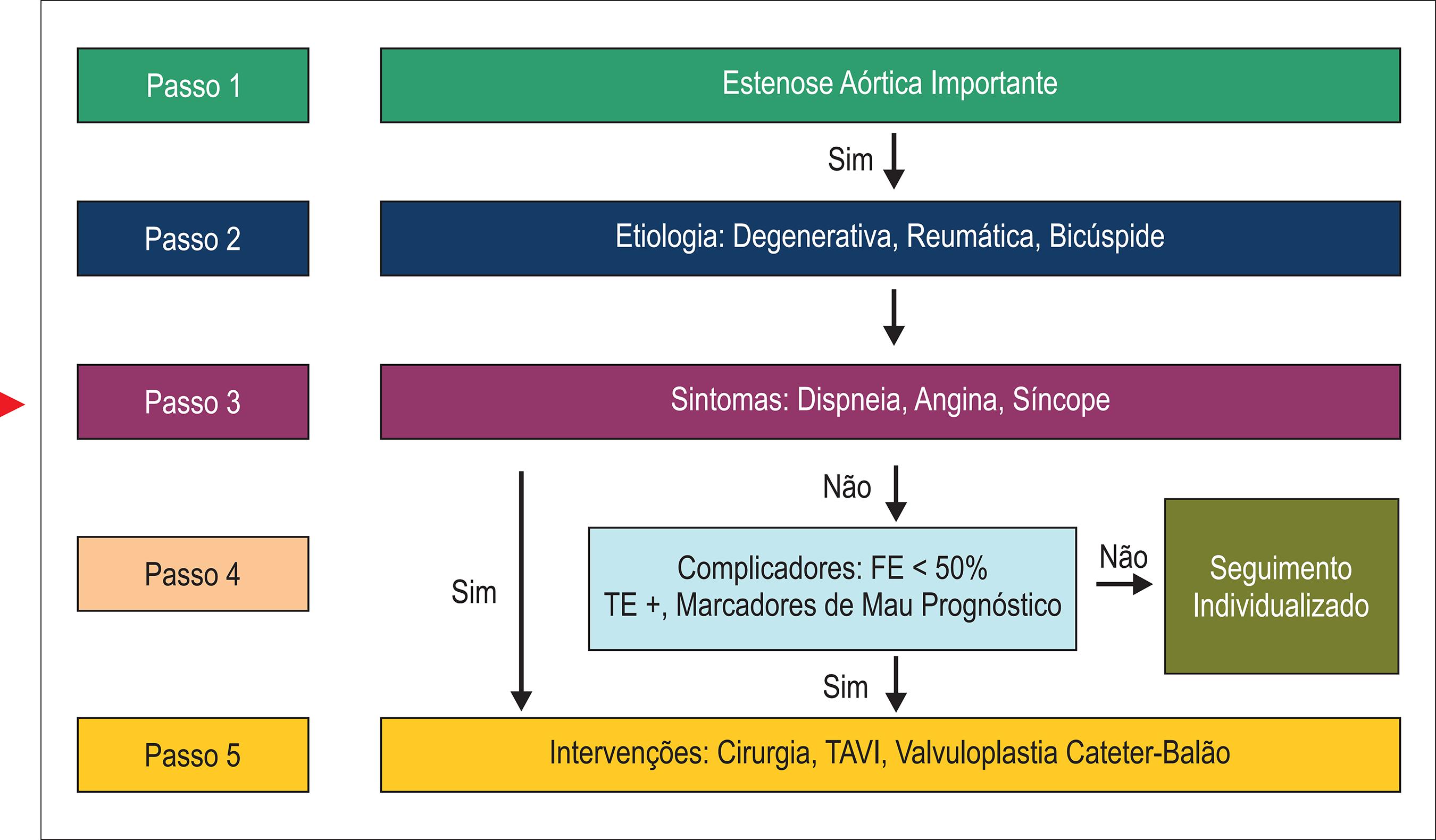
Estenose aórtica
A estenose aórtica (EAo) apresenta prevalência crescente na atualidade em razão do aumento da expectativa de vida e do consequente envelhecimento da população. Atualmente, a causa mais comum de EAo é a calcificação aórtica, que acomete principalmente pacientes idosos. O tratamento transcateter tornou-se uma opção à troca valvar cirúrgica em casos selecionados após avaliação cuidadosa da expectativa de vida, do grau de fragilidade e da anatomia valvar aórtica.
Algoritmo para avaliação da estenose aórtica importante. FE: fração de ejeção; TE: teste ergométrico; TAVI: implante de bioprótese aórtica transcateter (da sigla em inglês, transcatheter aortic valve implantation).
Algoritmo para avaliação da estenose aórtica baixo-fluxo e baixo-gradiente com fração de ejeção reduzida. FE: fração de ejeção.
Algoritmo para avaliação da estenose aórtica paradoxal. AVA: área valvar aórtica; FE: fração de ejeção; TAVI: implante de bioprótese aórtica transcateter (da sigla em inglês, transcatheter aortic valve implantation).
Insuficiência aórtica crônica
A insuficiência aórtica (IAo) crônica pode decorrer de alterações das cúspides valvares e/ou alterações do ânulo da valva aórtica. Destacamos a manutenção do tratamento clínico em pacientes reumáticos assintomáticos e com função ventricular normal que apresentam dilatação ventricular.
Algoritmo para avaliação da insuficiência aórtica importante. FE: fração de ejeção; DDVE: diâmetro diastólico de ventrículo esquerdo; DSVE: diâmetro sistólico de ventrículo esquerdo; TAVI: implante de bioprótese aórtica transcateter (da sigla em inglês, transcatheter aortic valve implantation).
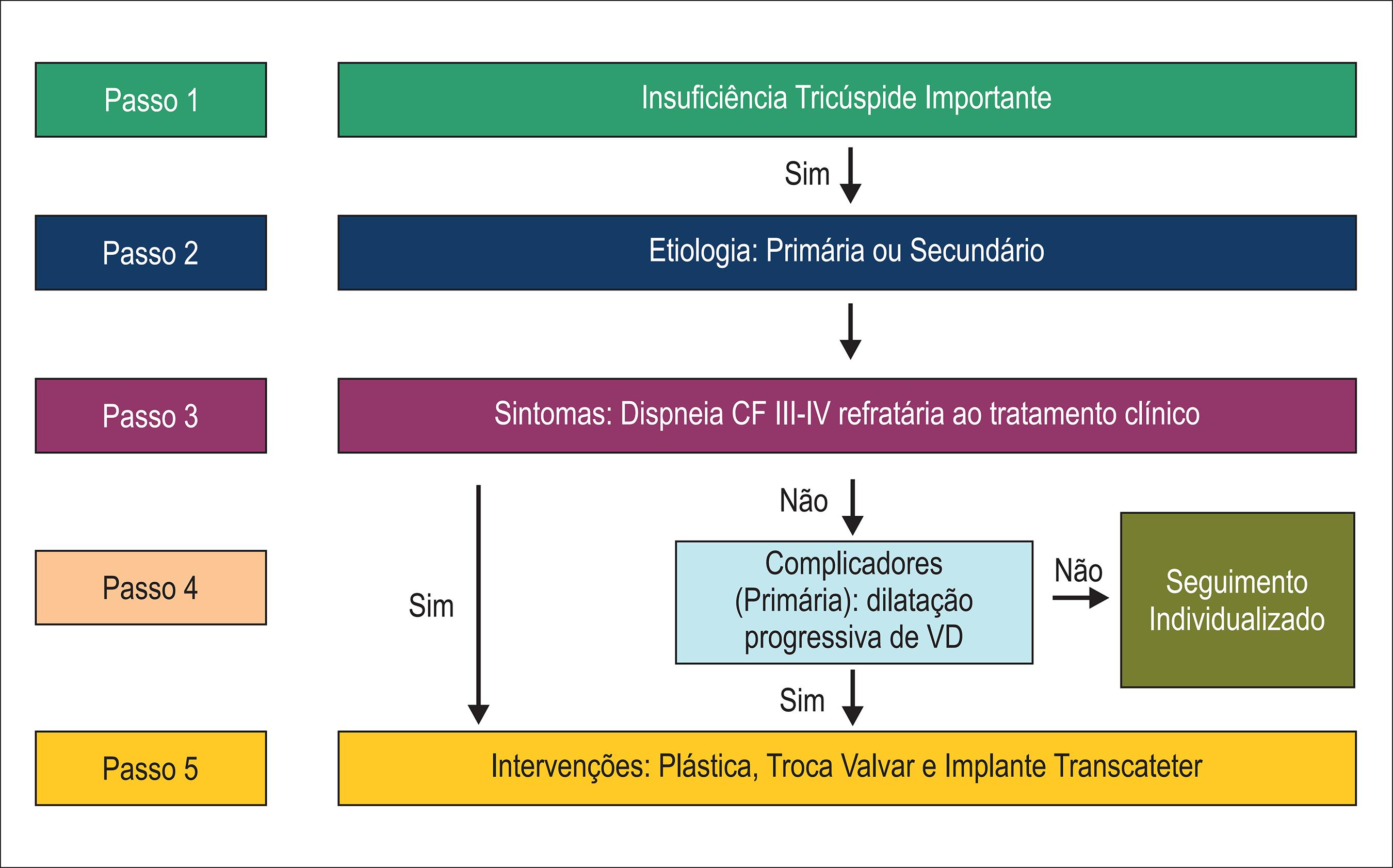
Insuficiência tricúspide importante
A maioria dos casos de insuficiência tricúspide (IT) é funcional/secundária e ocorre pela dilatação progressiva do anel valvar tricúspide. Dentre as causas primárias, destacamos a febre reumática. A correção de valvopatias do lado esquerdo do coração não necessariamente corrige a IT ou impede a sua progressão, principalmente quando o anel valvar é maior do que 40 mm e/ou a regurgitação é de moderada a importante. Nos casos de IT secundária e isolada, o tratamento medicamentoso é preferível e a cirurgia deve ser indicada em casos refratários.
Estenose tricúspide
A estenose tricúspide (ET) é uma complicação infrequente da cardiopatia reumática; quando presente, está associada à doença mitral da mesma etiologia. O tratamento medicamentoso deve ser instituído no paciente sintomático enquanto aguarda procedimento cirúrgico.
Anticoagulação em valvopatia
Desde as Diretrizes Brasileiras de Valvopatias de 2011, foram publicados dados embasando o uso dos novos anticoagulantes orais (NOACs), inibidores diretos da trombina ou antifator X, em pacientes valvopatas.
Devido ao alto risco de fenômenos embólicos, esses pacientes continuam a apresentar indicação de anticoagulação em diversas situações clínicas. A varfarina segue sendo a principal medicação a ser utilizada. Com relação aos NOACs, é importante ressaltar que não houve trabalhos delineados especificamente para essa população que demonstraram benefício do seu uso para valvopatas. Assim, mantém-se a contraindicação à sua utilização nos grupos de maior risco: EM reumática e prótese mecânica.
Também não se recomenda a aplicação do escore CHA2DS2-VASc em pacientes com valvopatia anatomicamente importante; isso porque essa avaliação subestima o risco em pacientes com escore ≤ 1.
Doença multivalvar
Consideramos doença multivalvar o acometimento primário de duas ou mais valvas. Portanto, são excluídas dessa classificação valvopatias consequentes à valvopatia primária, como é o caso da IT funcional, consequente à doença mitral.
No Brasil, a doença multivalvar é resultado do acometimento reumático na maioria das vezes. Em idosos, pode acontecer quando há extensa calcificação do aparelho mitral acompanhando doença valvar aórtica degenerativa.
Disfunção de prótese valvar
Após cirurgia de troca valvar, os seguimentos clínico e ecocardiográfico periódicos devem ser realizados para a detecção precoce de disfunção de prótese, assim como para a identificação de sintomas e complicadores anatômicos e funcionais secundários.
Novos procedimentos, como tratamento percutâneo de regurgitação paravalvar e valve-in-valve, já são realidade e estão incluídos nas novas Diretrizes.
Trombose de prótese valvar
A trombose de prótese valvar é evento incomum, sendo mais frequente em próteses mecânicas, principalmente em posição mitral, e cursa com alta morbimortalidade. A manifestação clássica é a insuficiência cardíaca aguda/exacerbada em paciente com anticoagulação ineficaz. As recomendações das Diretrizes internacionais são distintas em relação à conduta e há carência de estudos randomizados. Recentemente, há tendência de priorização da trombólise frente à cirurgia, com base em dados de metanálise fornecidos por 48 estudos. Em geral, procedimento cirúrgico é indicado em casos de trombose de prótese em câmaras esquerdas, com grave repercussão clínica e alto risco de sangramento.
-
Nota: estas Diretrizes se prestam a informar e não a substituir o julgamento clínico do médico que, em última análise, deve determinar o tratamento apropriado para seus pacientes.
Referências
Referências-
1Tarasoutchi F, Montera MW, Grinberg M, Barbosa MR, Piñeiro DJ, Sánchez CR, et al. [Brazilian Guidelines for Valve Disease - SBC 2011 / I Guideline Inter- American Valve Disease - 2011 SIAC]. Arq Bras Cardiol. 2011;97(5 supl. 3):1-67. doi: http://dx.doi.org/10.1590/50066-782X2011002000001
» http://dx.doi.org/10.1590/50066-782X2011002000001 -
2Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, et al; 2017 ESC/EACTS Guidelines for the management of valvular heart disease. The Task Force for the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2017;38(36):2739-91. doi: 10.1093/eurheartj/ehx391.
» https://doi.org/10.1093/eurheartj/ehx391 -
3Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP 3rd, Guyton RA, et al; ACC/AHA Task Force Members. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines. Circulation. 2014;129(23):e521-e643. doi: 10.1161/CIR.0000000000000031. Erratum in: Circulation. 2014;130(13):e120.
» https://doi.org/10.1161/CIR.0000000000000031 -
4Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP 3rd, Fleisher LA, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2017;11;70(2):252-289. doi: 10.1016/j.jacc.2017.03.011.
» https://doi.org/10.1016/j.jacc.2017.03.011
-
5Rosa VE, Lopes AS, Accorsi TA, Lemos Neto PA, Pomerantzeff PM, Tarasoutchi F. Is heart team fundamental to aortic stenosis transcatheter treatment? Arq Bras Cardiol. 2014;102(5):e55-6. doi: hhtp://dx.doi.org./10.5935/abc.20140060
» hhtp://dx.doi.org./10.5935/abc.20140060
-
6Bilge M, Alsancak Y, Ali S, Yasar AS. Concurrent transcatheter aortic valve implantation and percutaneous transvenous mitral commissurotomy for totally percutaneous treatment of combined severe rheumatic aortic and mitral stenosis. J Heart Valve Dis. 2015;24(3):286-9. PMID: 26901896.
-
7Carabello BA. Modern management of mitral stenosis. Circulation. 2005;112(3):432-7. doi: 10.1161/CIRCULATIONAHA.104.532498.
» https://doi.org/10.1161/CIRCULATIONAHA.104.532498 -
8Coutinho GF, Bihun V, Correia PE, Antunes PE, Antunes MJ. Preservation of the subvalvular apparatus during mitral valve replacement of rheumatic valves does not affect long-term survival. Eur J Cardiothorac Surg. 2015;48(6):861-7. doi: 10.1093/ejcts/ezu537.
» https://doi.org/10.1093/ejcts/ezu537 -
9Guerrero M, Greenbaum A, O'Neill W. First in human percutaneous implantation of a balloon expandable transcatheter heart valve in a severely stenosed native mitral valve. Catheter Cardiovasc Interv. 2014;83(7):E287-91. doi: 10.1002/ccd.25441.
» https://doi.org/10.1002/ccd.25441 -
10Hasan R, Mahadevan VS, Schneider H, Clarke B. First in human transapical implantation of an inverted transcatheter aortic valve prosthesis to treat native mitral valve stenosis. Circulation. 2013;128(6):e74-6. doi: 10.1161/CIRCULATIONAHA.113.001466.
» https://doi.org/10.1161/CIRCULATIONAHA.113.001466 -
11Jain R, Algahim MF, Bajwa TK, Khandheria BK, O'Hair DP. Native mitral stenosis treated with transcatheter mitral valve replacement. Ann Thorac Surg. 2016;101(3):e75-7. doi: 10.1016/j.athoracsur.2015.09.020.
» https://doi.org/10.1016/j.athoracsur.2015.09.020 -
12Knapper JT, Hartlage GR, Clements SD. Transfemoral balloon mitral valvuloplasty for severe nonrheumatic mitral stenosis. JACC Cardiovasc Interv. 2014;7(11):e167-8. doi: 10.1016/j.jcin.2014.04.029.
» https://doi.org/10.1016/j.jcin.2014.04.029 -
13Mahadevan VS, Manoly I, Hasan R. 2-year follow-up of the first in human transapical implantation of transcatheter inverted aortic valve to treat native mitral valve stenosis. JACC Cardiovasc Interv. 2015;8(15):e247-9. doi: 10.1016/j.jcin.2015.07.037.
» https://doi.org/10.1016/j.jcin.2015.07.037 -
14Nishimura RA, Vahanian A, Eleid MF, Mack MJ. Mitral valve disease - current management and future challenges. Lancet. 2016;387(10025):1324-34. doi: 10.1016/S0140-6736(16)00558-4.
» https://doi.org/10.1016/S0140-6736(16)00558-4 -
15Puri R, Abdul-Jawad Altisent O, del Trigo M, Campelo-Parada F, Regueiro A, Barbosa Ribeiro H, et al. Transcatheter mitral valve implantation for inoperable severely calcified native mitral valve disease: A systematic review. Catheter Cardiovasc Interv. 2016;87(3):540-8. doi: 10.1002/ccd.26262.
» https://doi.org/10.1002/ccd.26262 -
16Sud K, Agarwal S, Parashar A, Raza MQ, Patel K, Min D, et al. Degenerative Mitral Stenosis: Unmet Need for Percutaneous Interventions. Circulation. 2016;133(16):1594-604. doi: 10.1161/CIRCULATIONAHA.115.020185.
» https://doi.org/10.1161/CIRCULATIONAHA.115.020185 -
17Unger P, Lancellotti P, de Cannière D. The clinical challenge of concomitant aortic and mitral valve stenosis. Acta Cardiol. 2016;71(1):3-6. doi: 10.2143/AC.71.1.3132091.
» https://doi.org/10.2143/AC.71.1.3132091 -
18Vincens JJ, Temizer D, Post JR, Edmunds LH, Herrmann HC. Long-term outcome of cardiac surgery in patients with mitral stenosis and severe pulmonary hypertension. Circulation. 1995;92(9 Suppl):II137-42. PMID: 7586397.
-
19Reis G, Motta MS, Barbosa MM, Esteves WA, Souza SF, Bocchi EA. Dobutamine stress echocardiography for noninvasive assessment and risk stratification of patients with rheumatic mitral stenosis. J Am Coll Cardiol. 2004;43(3):393-401. doi: 10.1016/j.jacc.2003.09.037.
» https://doi.org/10.1016/j.jacc.2003.09.037. Insuficiência
-
20Rosa VE, Fernandes JR, Lopes AS, Accorsi TA, Tarasoutchi F. Recommendation of early surgery in primary mitral regurgitation: pros and cons. Arq Bras Cardiol. 2016;107(2):173-5. doi 10.5935/abc.20160107.
» https://doi.org/10.5935/abc.20160107 -
21Avierinos JF, Gersh BJ, Melton LJ 3rd, Bailey KR, Shub C, Nishimura RA, et al. Natural history of asymptomatic mitral valve prolapse in the community. Circulation. 2002;106(11):1355-61. doi: https://doi.org/10.1161/01;CIR.0000028933.34260.09
» https://doi.org/10.1161/01;CIR.0000028933.34260.09 -
22Krivokapich J, Child JS, Dadourian BJ, Perloff JK. Reassessment of echocardiographic criteria for diagnosis of mitral valve prolapse. Am J Cardiol. 1988;61(1):131-5. doi: http://dx.doi.org/10.1016/0002-9149(88)91318-5
» http://dx.doi.org/10.1016/0002-9149(88)91318-5 -
23Marks AR, Choong CY, Sanfilippo AJ, Ferre M, Weyman AE. Identification of high-risk and low-risk subgroups of patients with mitral-valve prolapse. N Engl J Med. 1989;320(16):1031-6. doi: 10.1056/NEJM198904203201602.
» https://doi.org/10.1056/NEJM198904203201602 -
24Shah PM. Echocardiographic diagnosis of mitral valve prolapse. J Am Soc Echocardiogr. 1994;7(3 Pt 1):286-93. PMID: 8060645.
-
25Fontana ME, Sparks EA, Boudoulas H, Wooley CF. Mitral valve prolapse and the mitral valve prolapse syndrome. Curr Probl Cardiol. 1991;16(5):309-75. PMID: 2055093.
-
26Fuchs RM, Heuser RR, Yin FC, Brinker JA. Limitations of pulmonary wedge V waves in diagnosing mitral regurgitation. Am J Cardiol. 1982;49(4):849-54. doi: http://dx.doi.org/10.1016/0002-9149(82)91968-3
» http://dx.doi.org/10.1016/0002-9149(82)91968-3 -
27Moss RR, Humphries KH, Gao M, Thompson CR, Abel JG, Fradet G, et al. Outcome of mitral valve repair or replacement: a comparison by propensity score analysis. Circulation. 2003 Sep 9;108 Suppl 1:II90-7. doi: 10.1161/01.cir.0000089182.44963.bb.
» https://doi.org/10.1161/01.cir.0000089182.44963.bb -
28Flameng W, Herijgers P, Bogaerts K. Recurrence of mitral valve regurgitation after mitral valve repair in degenerative valve disease. Circulation. 2003;107(12):1609-13. doi: 10.1161/01.CIR.0000058703.26715.9D.
» https://doi.org/10.1161/01.CIR.0000058703.26715.9D -
29Ling LH, Enriquez-Sarano M, Seward JB, Orszulak TA, Schaff HV, Bailey KR, et al. Early surgery in patients with mitral regurgitation due to flail leaflets: a long-term outcome study. Circulation. 1997;96(6):1819-25. doi: https://doi.org/10.1161/01.CIR.96.6.1819
» https://doi.org/10.1161/01.CIR.96.6.1819 -
30Thourani VH, Weintraub WS, Guyton RA, Jones EL, Williams WH, Elkabbani S, et al. Outcomes and long-term survival for patients undergoing mitral valve repair versus replacement: effect of age and concomitant coronary artery bypass grafting. Circulation. 2003;108(3):298-304. doi: 10.1161/01.CIR.0000079169.15862.13.
» https://doi.org/10.1161/01.CIR.0000079169.15862.13 -
31Enriquez-Sarano M, Schaff HV, Orszulak TA, Tajik AJ, Bailey KR, Frye RL. Valve repair improves the outcome of surgery for mitral regurgitation: a multivariate analysis. Circulation. 1995;91(4):1022-8. doi: https://doi.org/10.1161/01.CIR.91.4.1022
» https://doi.org/10.1161/01.CIR.91.4.1022 -
32Enriquez-Sarano M, Freeman WK, Tribouilloy CM, Orszulak TA, Khandheria BK, Seward JB, et al. Functional anatomy of mitral regurgitation: accuracy and outcome implications of transesophageal echocardiography. J Am Coll Cardiol. 1999;34(3):1129-36. doi: https://doi.org/10.1016/S0735-1097(99)00314-9
» https://doi.org/10.1016/S0735-1097(99)00314-9 -
33David TE, Ivanov J, Armstrong S, Christie D, Rakowski H. A comparison of outcomes of mitral valve repair for degenerative disease with posterior, anterior, and bileaflet prolapse. J Thorac Cardiovasc Surg. 2005;130(5):1242-9. doi: 10.1016/j.jtcvs.2005.06.046.
» https://doi.org/10.1016/j.jtcvs.2005.06.046 -
34Suri RM, Schaff HV, Dearani JA, Sundt TM 3rd, Daly RC, Mullany CJ, et al. Survival advantage and improved durability of mitral repair for leaflet prolapse subsets in the current era. Ann Thorac Surg. 2006;82(3):819-26. doi: 10.1016/j.athoracsur.2006.03.091.
» https://doi.org/10.1016/j.athoracsur.2006.03.091 -
35Enriquez-Sarano M, Tajik AJ, Schaff HV, Orszulak TA, Bailey KR, Frye RL. Echocardiographic prediction of survival after surgical correction of organic mitral regurgitation. Circulation. 1994;90(2):830-7. doi: https://doi.org/10.1161/01.CIR.90.2.830
» https://doi.org/10.1161/01.CIR.90.2.830 -
36Le Tourneau T, Richardson M, Juthier F, Modine T, Fayad G, Polge AS, et al. Echocardiography predictors and prognostic value of pulmonary artery systolic pressure in chronic organic mitral regurgitation. Heart. 2010;96(16):1311-7. doi: 10.1136/hrt.2009.186486.
» https://doi.org/10.1136/hrt.2009.186486 -
37Grigioni F, Avierinos JF, Ling LH, Scott CG, Bailey KR, Tajik AJ, et al. Atrial fibrillation complicating the course of degenerative mitral regurgitation: determinants and long-term outcome. J Am Coll Cardiol. 2002;40(1):84-92. doi: https://doi.org/10.1016/S0735-1097(02)01922-8
» https://doi.org/10.1016/S0735-1097(02)01922-8 -
38Rosenhek R, Rader F, Klaar U, Gabriel H, Krejc M, Kalbeck D, et al. Outcome of watchful waiting in asymptomatic severe mitral regurgitation. Circulation. 2006;113(18):2238-44. doi: 10.1161/CIRCULATIONAHA.105.599175.
» https://doi.org/10.1161/CIRCULATIONAHA.105.599175 -
39Kang DH, Kim JH, Rim JH, Kim MJ, Yun SC, Song JM, et al. Comparison of early surgery versus conventional treatment in asymptomatic severe mitral regurgitation. Circulation. 2009;119(6):797-804. doi: 10.1161/CIRCULATIONAHA.108.802314.
» https://doi.org/10.1161/CIRCULATIONAHA.108.802314 -
40Grigioni F, Enriquez-Sarano M, Zehr KJ, Bailey KR, Tajik AJ. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation. 2001;103(13):1759-64. doi: https://doi.org/10.1161/01.CIR.103.13.1759
» https://doi.org/10.1161/01.CIR.103.13.1759 -
41Grossi EA, Goldberg JD, LaPietra A, Ye X, Zakow P, Sussman M, et al. Ischemic mitral valve reconstruction and replacement: comparison of long-term survival and complications. J Thorac Cardiovasc Surg. 2001;122(6):1107-24. doi: 10.1067/mtc.2001.116945.
» https://doi.org/10.1067/mtc.2001.116945 -
42Gillinov AM, Wierup PN, Blackstone EH, Bishay ES, Cosgrove DM, White J, et al. Is repair preferable to replacement for ischemic mitral regurgitation? J Thorac Cardiovasc Surg. 2001;122(6):1125-41. doi: 10.1067/mtc.2001.116557.
» https://doi.org/10.1067/mtc.2001.116557 -
43Kim YH, Czer LS, Soukiasian HJ, De Robertis M, Magliato KE, Blanche C, et al. Ischemic mitral regurgitation: revascularization alone versus revascularization and mitral valve repair. Ann Thorac Surg. 2005;79(6):1895-901. doi: 10.1016/j.athoracsur.2004.11.005.
» https://doi.org/10.1016/j.athoracsur.2004.11.005 -
44Webb JG, Harnek J, Munt BI, Kimblad PO, Chandavimol M, Thompson CR, et al. Percutaneous transvenous mitral annuloplasty: initial human experience with device implantation in the coronary sinus. Circulation. 2006;113(6):851-5. doi: 10.1161/CIRCULATIONAHA.105.591602.
» https://doi.org/10.1161/CIRCULATIONAHA.105.591602 -
45Daimon M, Shiota T, Gillinov AM, Hayase M, Ruel M, Cohn WE, et al. Percutaneous mitral valve repair for chronic ischemic mitral regurgitation: a real-time three-dimensional echocardiographic study in an ovine model. Circulation. 2005;111(17):2183-9. doi: 10.1161/01.CIR.0000163547.03188.AC.
» https://doi.org/10.1161/01.CIR.0000163547.03188.AC -
46Alfieri O, Maisano F, De Bonis M, Stefano PL, Torracca L, Oppizzi M, et al. The double-orifice technique in mitral valve repair: a simple solution for complex problems. J Thorac Cardiovasc Surg. 2001;122(4):674-81. doi: 10.1067/mtc.2001.117277.
» https://doi.org/10.1067/mtc.2001.117277 -
47Feldman T, Kar S, Rinaldi M, Fail P, Hermiller J, Smalling R, et al; EVEREST Investigators. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. J Am Coll Cardiol. 2009;54(8):686-94. doi: 10.1016/j.jacc.2009.03.077.
» https://doi.org/10.1016/j.jacc.2009.03.077 -
48Feldman T, Foster E, Glower DD, Kar S, Rinaldi MJ, Fail PS, et al; EVEREST II Investigators. Percutaneous repair or surgery for mitral regurgitation. N Engl J Med. 2011;364(15):1395-406. doi: 10.1056/NEJMoa1009355.
» https://doi.org/10.1056/NEJMoa1009355 -
49Agricola E, Oppizzi M, Pisani M, Meris A, Maisano F, Margonato A. Ischemic mitral regurgitation: mechanisms and echocardiographic classification. Eur J Echocardiogr. 2008;9(2):207-21. doi: 10.1016/j.euje.2007.03.034.
» https://doi.org/10.1016/j.euje.2007.03.034 -
50Asgar AW, Mack MJ, Stone GW. Secondary mitral regurgitation in heart failure.: pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol. 2015;65(12):1231-48. doi: 10.1016/j.jacc.2015.02.009. Erratum in: J Am Coll Cardiol. 2015;65(20):2265.
» https://doi.org/10.1016/j.jacc.2015.02.009 -
51Obadia JF, Armoiry X, Iung B, Lefèvre T, Mewton N, Messika-Zeitoun D, et al. The MITRA-FR study: design and rationale of a randomised study of percutaneous mitral valve repair compared with optimal medical management alone for severe secondary mitral regurgitation. Eurointervation. 2015;10(11):1354-60. doi: 10.4244/EIJV10I11A232.
» https://doi.org/10.4244/EIJV10I11A232 -
52Enriquez-Sarano M, Akins CW, Vahanian A. Mitral regurgitation. Lancet. 2009;18:373 (9672):1382-94. doi: 10.1016/S0140-6736(09)60692-9.
» https://doi.org/10.1016/S0140-6736(09)60692-9 -
53Kamperidis V, van Wijngaarden SE, van Rosendael PJ, Kong WK, Regeer MV, van der Kley F, et al. Mitral valve repair for secondary mitral regurgitation in non-ischaemic dilated cardiomyopathy is associated with left ventricular reverse remodelling and increase of forward flow. Eur Heart J Cardiovasc Imaging. 2017 Feb 23. doi: 10.1093/ehjci/jex011. [Epub ahead of print]
» https://doi.org/10.1093/ehjci/jex011 -
54Grasso C, Buccheri S, Capodanno D, Popolo Rubbio A, Di Salvo ME, Scandura S, et al. Strategies and outcomes of repeat mitral valve interventions after failed MitraClip therapy. Cardiology. 2017;137(2):114-120. doi: 10.1159/000460240.
» https://doi.org/10.1159/000460240 -
55Naoum C, Blanke P, Cavalcante JL, Leipsic J. Cardiac computed tomography and magnetic resonance imaging in the evaluation of mitral and tricuspid valve disease: implications for transcatheter interventions. Circ Cardiovasc Imaging. 2017;10(3). pii: e005331. doi: 10.1161/CIRCIMAGING.116.005331.
» https://doi.org/10.1161/CIRCIMAGING.116.005331. -
56Zamorano JL, Manuel Monteagudo J, Mesa D, Gonzalez-Alujas T, Sitges M, Carrasco-Chinchilla F, et al. Frequency, mechanism and severity of mitral regurgitation: are there any differences between primary and secondary mitral regurgitation? J Heart Valve Dis. 2016;25(6):724-9. PMID: 28290172.
-
57Tatum JM, Bowdish ME, Mack WJ, Quinn AM, Cohen RG, Hackmann AE, et al. Outcomes after mitral valve repair: a single-center 16-year experience. J Thorac Cardiovasc Surg. 2017;154(3):822-830.e2. doi: 10.1016/j.jtcvs.2017.01.047.
» https://doi.org/10.1016/j.jtcvs.2017.01.047 -
58Alkhouli M, Wolfe S, Alqahtani F, Aljohani S, Mills J, Gnegy S, et al. The feasibility of transcatheter edge-to-edge repair in the management of acute severe ischemic mitral regurgitation. JACC Cardiovasc Interv. 2017;10(5):529-31. doi: 10.1016/j.jcin.2016.11.056.
» https://doi.org/10.1016/j.jcin.2016.11.056 -
59Kron IL, LaPar DJ, Acker MA, Adams DH, Ailawadi G, Bolling SF, et al; American Association For Thoracic Surgery Ischemic Mitral Regurgitation Consensus Guidelines Writing Committee. 2016 update to The American Association for Thoracic Surgery consensus guidelines: Ischemic mitral valve regurgitation. J Thorac Cardiovasc Surg. 2017;153(5):1076-1079. https://doi.org/10.1016/j.jtcvs.2017.01.031
» https://doi.org/10.1016/j.jtcvs.2017.01.031
-
60Iung B, Baron G, Butchart EG, Delahaye F, Gohlke-Barwolf C, Levang OW, et al. A prospective survey of patients with valvular heart disease in Europe: the Euro Heart Survey on Valvular Heart Disease. Eur Heart J. 2003;24(13):1231-43. PMID: 12831818.
-
61Rosenhek R, Binder T, Porenta G, Lang I, Christ G, Schemper M, et al. Predictors of outcome in severe, asymptomatic aortic stenosis. N Engl J Med. 2000;343(9):611-7. doi: 10.1056/NEJM200008313430903.
» https://doi.org/10.1056/NEJM200008313430903 -
62Otto CM, Burwash IG, Legget ME, Munt BI, Fujioka M, Healy NL, et al. Prospective study of asymptomatic valvular aortic stenosis. Clinical, echocardiographic, and exercise predictors of outcome. Circulation. 1997;95(9):2262-70. doi: https://doi.org/10.1161/01.CIR.95.9.2262
» https://doi.org/10.1161/01.CIR.95.9.2262 -
63Cueff C, Serfaty JM, Cimadevilla C, Laissy JP, Himbert D, Tubach F, et al. Measurement of aortic valve calcification using multislice computed tomography: correlation with haemodynamic severity of aortic stenosis and clinical implication for patients with low ejection fraction. Heart. 2011;97(9):721-6. doi: 10.1136/hrt.2010.198853.
» https://doi.org/10.1136/hrt.2010.198853 -
64Clavel MA, Pibarot P, Messika-Zeitoun D, Capoulade R, Malouf J, Aggarval S, et al. Impact of aortic valve calcification, as measured by MDCT, on survival in patients with aortic stenosis: results of an international registry study. J Am Coll Cardiol. 2014;64(12):1202-13. doi: 10.1016/j.jacc.2014.05.066.
» https://doi.org/10.1016/j.jacc.2014.05.066 -
65Pellikka PA, Sarano ME, Nishimura RA, Malouf JF, Bailey KR, Scott CG, et al. Outcome of 622 adults with asymptomatic, hemodynamically significant aortic stenosis during prolonged follow-up. Circulation. 2005;111(24):3290-5. doi: https://doi.org/10.1161/CIRCULATIONAHA.104.495903
» https://doi.org/10.1161/CIRCULATIONAHA.104.495903 -
66Cowell SJ, Newby DE, Burton J, White A, Northridge DB, Boon NA, et al. Aortic valve calcification on computed tomography predicts the severity of aortic stenosis. Clin Radiol. 2003;58(9):712-6. doi: https://doi.org/10.1016/S0009-9260(03)00184-3
» https://doi.org/10.1016/S0009-9260(03)00184-3 -
67Messika-Zeitoun D, Aubry MC, Detaint D, Bielak LF, Peyser PA, Sheedy PF, et al. Evaluation and clinical implications of aortic valve calcification measured by electron-beam computed tomography. Circulation. 2004;110(3):356-62. doi: https://doi.org/10.1161/01.CIR.0000135469.82545.D0
» https://doi.org/10.1161/01.CIR.0000135469.82545.D0 -
68Kaden JJ, Freyer S, Weisser G, Willingstorfer W, Bilbal A, Pfleger S, et al. Correlation of degree of aortic valve stenosis by Doppler echocardiogram to quantity of calcium in the valve by electron beam tomography. Am J Cardiol. 2002;90(5):554-7. doi: https://doi.org/10.1016/S0002-9149(02)02537-7
» https://doi.org/10.1016/S0002-9149(02)02537-7 -
69Buellesfeld L, Stortecky S, Heg D, Gloekler S, Meier B, Wenaweser P, et al. Extent and distribution of calcification of both the aortic annulus and the left ventricular outflow tract predict aortic regurgitation after transcatheter aortic valve replacement. EuroIntervention. 2014;10(6):732-8. doi: 10.4244/EIJV10I6A126.
» https://doi.org/10.4244/EIJV10I6A126 -
70Gurvitch R, Webb JG, Yuan R, Johnson M, Hague C, Willson AB, et al. Aortic annulus diameter determination by multidetector computed tomography: reproducibility, applicability, and implications for transcatheter aortic valve implantation. JACC Cardiovasc Interv. 2011;4(11):1235-45. doi: 10.1016/j.jcin.2011.07.014.
» https://doi.org/10.1016/j.jcin.2011.07.014 -
71Clavel MA, Magne J, Pibarot P. Low-gradient aortic stenosis. Eur Heart J. 2016;37(34):2645-57. doi: 10.1093/eurheartj/ehw096.
» https://doi.org/10.1093/eurheartj/ehw096 -
72Dumesnil JG and Pibarot P. Low-flow, low-gradient severe aortic stenosis in patients with normal ejection fraction. Curr Opin Cardiol. 2013;28(5):524-30. doi: 10.1097/HCO.0b013e32836245e0.
» https://doi.org/10.1097/HCO.0b013e32836245e0 -
73Rosa VE, Lopes AS, Accorsi TA, Lemos Neto PA, Pomerantzeff PM, Tarasoutchi F. Is heart team fundamental to aortic stenosis transcatheter treatment? Arq Bras Cardiol. 2014;102(5):e55-6. doi: hhtp://dx.doi.org./10.5935/abc.20140060
» hhtp://dx.doi.org./10.5935/abc.20140060 -
74Rosa VE, Accorsi TA, Fernandes JR, Lopes AS, Sampaio RO, Tarasoutchi F. Low-flow aortic stenosis and reduced ejection fraction: new insights. Arq Bras Cardiol. 2015;105(1):82-5. doi: http://dx.doi.org/10.5935/abc.20150080
» http://dx.doi.org/10.5935/abc.20150080 -
75Monin JL, Lancellotti P, Monchi M, Lim P, Weiss E, Pierard L, et al. Risk score for predicting outcome in patients with asymptomatic aortic stenosis. Circulation. 2009;120(1):69-75. doi: 10.1161/CIRCULATIONAHA.108.808857.
» https://doi.org/10.1161/CIRCULATIONAHA.108.808857 -
76Pellikka PA, Nishimura RA, Bailey KR, Tajik AJ. The natural history of adults with asymptomatic, hemodynamically significant aortic stenosis. J Am Coll Cardiol. 1990;15(5):1012-7. doi: https://doi.org/10.1016/0735-1097(90)90234-G
» https://doi.org/10.1016/0735-1097(90)90234-G -
77Amato MC, Moffa PJ. Prognosis of asymptomatic aortic valve stenosis evaluated with exercise test. Arq Bras Cardiol. 1998;70(4):251-5. PMID: 9687624.
-
78Maréchaux S, Hachicha Z, Bellouin A, Dumesnil JG, Meimoun P, Pasquet A, et al. Usefulness of exercise-stress echocardiography for risk stratification of true asymptomatic patients with aortic valve stenosis. Eur Heart J. 2010;31(11):1390-7. doi: 10.1093/eurheartj/ehq076.
» https://doi.org/10.1093/eurheartj/ehq076 -
79Hachicha Z, Dumesnil JG, Bogaty P, Pibarot P. Paradoxical low-flow, low-gradient severe aortic stenosis despite preserved ejection fraction is associated with higher afterload and reduced survival. Circulation. 2007;115(22):2856-64. doi: https://doi.org/10.1161/CIRCULATIONAHA.106.668681
» https://doi.org/10.1161/CIRCULATIONAHA.106.668681 -
80Barasch E, Fan D, Chukwu EO, Han J, Passick M, Petillo F, et al. Severe isolated aortic stenosis with normal left ventricular systolic function and low transvalvular gradients: pathophysiologic and prognostic insights. J Heart Valve Dis. 2008;17(1):81-8. PMID: 18365573.
-
81Jander N, Minners J, Holme I, Gerdts E, Boman K, Brudi P, et al. Outcome of patients with low-gradient "severe" aortic stenosis and preserved ejection fraction. Circulation. 2011;123(8):887-95. doi: https://doi.org/10.1161/CIRCULATIONAHA.110.983510 Erratum in: Circulation. 2011;124(12):e336.
» https://doi.org/10.1161/CIRCULATIONAHA.110.983510 -
82Delgado V, Tops LF, van Bommel RJ, van der Kley F, Marsan NA, Klautz RJ, et al. Strain analysis in patients with severe aortic stenosis and preserved left ventricular ejection fraction undergoing surgical valve replacement. Eur Heart J. 2009;30(24):3037-47. doi:1093/eurheartz/ehp351.
» https://doi.org/1093/eurheartz/ehp351 -
83Oe H, Hozumi T, Arai K, Matsumura Y, Negishi K, Sugioka K, et al. Comparison of accurate measurement of left ventricular mass in patients with hypertrophied hearts by real-time three-dimensional echocardiography versus magnetic resonance imaging. Am J Cardiol. 2005;95(10):1263-7. doi: 10.1016/j.amjcard.2005.01.065.
» https://doi.org/10.1016/j.amjcard.2005.01.065 -
84Gorlin R, Gorlin SG. Hydraulic formula for calculation of the area of the stenotic mitral valve, other cardiac valves, and central circulatory shunts. I. Am Heart J. 1951;41(1):1-29. PMID: 14799435.
-
85deFilippi CR, Willett DL, Brickner ME, Appleton CP, Yancy CW, Eichhorn EJ, et al. Usefulness of dobutamine echocardiography in distinguishing severe from nonsevere valvular aortic stenosis in patients with depressed left ventricular function and low transvalvular gradients. Am J Cardiol. 1995;75(2):191-4. doi: https://dx.doi.org/10.1016/S0002-9149(00)80078-8
» https://dx.doi.org/10.1016/S0002-9149(00)80078-8 -
86Minners J, Allgeier M, Gohlke-Baerwolf C, Kienzle RP, Neumann FJ, Jander N. Inconsistent grading of aortic valve stenosis by current guidelines: haemodynamic studies in patients with apparently normal left ventricular function. Heart. 2010;96(18):1463-8. doi: 10.1136/hrt.2009.181982.
» https://doi.org/10.1136/hrt.2009.181982 -
87Freed BH, Sugeng L, Furlong K, Mor-Avi V, Raman J, Jeevanandam V, et al. Reasons for nonadherence to guidelines for aortic valve replacement in patients with severe aortic stenosis and potential solutions. Am J Cardiol. 2010;105(9):1339-42. doi: 10.1016/j.amjcard.2009.12.056.
» https://doi.org/10.1016/j.amjcard.2009.12.056 -
88Lund O. Preoperative risk evaluation and stratification of long-term survival after valve replacement for aortic stenosis. Reasons for earlier operative intervention. Circulation. 1990;82(1):124-39. doi: https://dx.doi.org/10.1161/01.CIR.82.1.124
» https://dx.doi.org/10.1161/01.CIR.82.1.124 -
89Kouchoukos NT, Davila-Roman VG, Spray TL, Murphy SF, Perrillo JB. Replacement of the aortic root with a pulmonary autograft in children and young adults with aortic-valve disease. N Engl J Med. 1994;330(1):1-6. doi: 10.1056/NEJM199401063300101
» https://doi.org/10.1056/NEJM199401063300101 -
90Connolly HM, Oh JK, Orszulak TA, Osborn SL, Roger VL, Hodge DO, et al. Aortic valve replacement for aortic stenosis with severe left ventricular dysfunction. Prognostic indicators. Circulation. 1997;95(10):2395-400. doi: https://dx.doi.org/10.1161/01.CIR.95.10.2395
» https://dx.doi.org/10.1161/01.CIR.95.10.2395 -
91Kvidal P, Bergstrom R, Horte LG, Stahle E. Observed and relative survival after aortic valve replacement. J Am Coll Cardiol. 2000;35(3):747-56. doi: https://dx.doi.org/10.1016/S0735.1097(99)00584-7
» https://dx.doi.org/10.1016/S0735.1097(99)00584-7 -
92Brown JM, O'Brien SM, Wu C, Sikora JA, Griffith BP, Gammie JS. Isolated aortic valve replacement in North America comprising 108,687 patients in 10 years: changes in risks, valve types, and outcomes in the Society of Thoracic Surgeons National Database. J Thorac Cardiovasc Surg. 2009;137(1):82-90. doi: 10.1016/j.jtcvs.2008.08.015.
» https://doi.org/10.1016/j.jtcvs.2008.08.015 -
93Thourani VH, Ailawadi G, Szeto WY, Dewey TM, Guyton RA, Mack MJ, et al. Outcomes of surgical aortic valve replacement in high-risk patients: a multiinstitutional study. Ann Thorac Surg. 2011;91(1):49-55. doi: 10.1016/j.athoracsur.2010.09.040.
» https://doi.org/10.1016/j.athoracsur.2010.09.040 -
94Nashef SA, Roques F, Michel P, Gauducheau E, Lemeshow S, Salamon R. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg. 1999;16(1):9-13. PMID:10456395.
-
95Nashef SA, Roques F, Hammill BG, Peterson ED, Michel P, Grover FL, et al. Validation of European System for Cardiac Operative Risk Evaluation (EuroSCORE) in North American cardiac surgery. Eur J Cardiothorac Surg. 2002;22(1):101-5. PMID:12103381.
-
96Shroyer AL, Coombs LP, Peterson ED, Eiken MC, DeLong ER, Chen A, et al. The Society of Thoracic Surgeons: 30-day operative mortality and morbidity risk models. Ann Thorac Surg. 2003;75(6):1856-64. doi: https://dx.doi.org/10.1016/S0003-4975(03)00179-6
» https://dx.doi.org/10.1016/S0003-4975(03)00179-6 -
97Carabello BA. Evaluation and management of patients with aortic stenosis. Circulation. 2002;105(15):1746-50. doi: https://dx.doi.org/10.1161/01.CIR.0000015343
» https://dx.doi.org/10.1161/01.CIR.0000015343 -
98Carabello BA. Timing of valve replacement in aortic stenosis. Moving closer to perfection. Circulation. 1997;95(9):2241-3. doi: https://dx.doi.org/10.1161/01.CIR.95.9.2241
» https://dx.doi.org/10.1161/01.CIR.95.9.2241 -
99Carabello BA. Clinical practice: aortic stenosis. N Engl J Med. 2002;346(9):677-82. doi: 10.1056/NEJMcp010846.
» https://doi.org/10.1056/NEJMcp010846 -
100Das P, Rimington H, Chambers J. Exercise testing to stratify risk in aortic stenosis. Eur Heart J. 2005;26(13):1309-13. doi: 10.1093/eurheartj/ehi250.
» https://doi.org/10.1093/eurheartj/ehi250 -
101Rahimtoola SH. Valvular heart disease: a perspective on the asymptomatic patient with severe valvular aortic stenosis. Eur Heart J. 2008;29(14):1783-90. doi: 10.1093/eurheartj/ehn272.
» https://doi.org/10.1093/eurheartj/ehn272 -
102Dal-Bianco JP, Khandheria BK, Mookadam F, Gentile F, Sengupta PP. Management of asymptomatic severe aortic stenosis. J Am Coll Cardiol. 2008;52(16):1279-92. doi: https://dx.doi.org/10.1016/j.jacc.2008.07.020
» https://dx.doi.org/10.1016/j.jacc.2008.07.020 -
103Iung B, Cachier A, Baron G, Messika-Zeitoun D, Delahaye F, Tornos P, et al. Decision-making in elderly patients with severe aortic stenosis: why are so many denied surgery? Eur Heart J. 2005;26(24):2714-20. doi: 10.1093/eurheartj/ehj471.
» https://doi.org/10.1093/eurheartj/ehj471 -
104Likosky DS, Sorensen MJ, Dacey LJ, Barribeau YR, Leavitt BJ, DiScipio AW, et al. Long-term survival of the very elderly undergoing aortic valve surgery. Circulation. 2009;120(11 Suppl):S127-33. doi: 10.1161/CIRCULATIONAHA.108842641.
» https://doi.org/10.1161/CIRCULATIONAHA.108842641 -
105Brinkman WT, Hoffman W, Dewey TM, Culica D, Prince SL, Herbert MA, et al. Aortic valve replacement surgery: comparison of outcomes in matched sternotomy and PORT ACCESS groups. Ann Thorac Surg. 2010;90(1):131-5. doi: 10.1016/j.athoracsur.2010.03.055.
» https://doi.org/10.1016/j.athoracsur.2010.03.055 -
106David TE, Woo A, Armstrong S, Maganti M. When is the Ross operation a good option to treat aortic valve disease? J Thorac Cardiovasc Surg. 2010;139(1):68-73. doi: 10.1016/jtcvs.2009.09.053.
» https://doi.org/10.1016/jtcvs.2009.09.053 -
107Kuntz RE, Tosteson AN, Berman AD, Goldman L, Gordon PC, Leonard BM, et al. Predictors of event-free survival after balloon aortic valvuloplasty. N Engl J Med. 1991;325(1):17-23. doi: 10.1056/NEJM199107043250104.
» https://doi.org/10.1056/NEJM199107043250104 -
108Piazza N, Grube E, Gerckens U, den Heijer P, Linke A, Luha O, et al. Procedural and 30-day outcomes following transcatheter aortic valve implantation using the third generation (18 Fr) corevalve revalving system: results from the multicentre, expanded evaluation registry 1-year following CE mark approval. EuroIntervention. 2008;4(2):242-9. PMID:19110790.
-
109Webb JG, Pasupati S, Humphries K, Thompson C, Altwegg L, Moss R, et al. Percutaneous transarterial aortic valve replacement in selected high-risk patients with aortic stenosis. Circulation. 2007;116(7):755-63. doi: https://doi.org/10.1161/CIRCULATIONAHA.107.698258
» https://doi.org/10.1161/CIRCULATIONAHA.107.698258 -
110Tamburino C, Capodanno D, Ramondo A, Petronio AS, Ettori F, Santoro G, et al. Incidence and predictors of early and late mortality after transcatheter aortic valve implantation in 663 patients with severe aortic stenosis. Circulation. 2011;123(3):299-308. doi: 10.1161/CIRCULATIONAHA.110.946533.
» https://doi.org/10.1161/CIRCULATIONAHA.110.946533 -
111Zahn R, Gerckens U, Grube E, Linke A, Sievert H, Eggebrecht H, et al. Transcatheter aortic valve implantation: first results from a multi-centre real-world registry. Eur Heart J. 2011;32(2):198-204. doi: 10.1093/eurheartj/ehg339.
» https://doi.org/10.1093/eurheartj/ehg339 -
112Smith CR, Leon MB, Mack MJ, Miller DC, Moses JW, Svensson LG, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364(23):2187-98. doi: 10.1056/NEJMos1103510.
» https://doi.org/10.1056/NEJMos1103510 -
113Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363(17):1597-607. doi: 10.1056/NEJMoa1008232.
» https://doi.org/10.1056/NEJMoa1008232 -
114Walther T, Simon P, Dewey T, Wimmer-Greinecker G, Falk V, Kasimir MT, et al. Transapical minimally invasive aortic valve implantation: multicenter experience. Circulation. 2007;116(11 Suppl):I240-5. doi: 10.1161/CIRCULATIONAHA.106.677237.
» https://doi.org/10.1161/CIRCULATIONAHA.106.677237 -
115Tchetche D, Dumonteil N, Sauguet A, Descoutures F, Luz A, Garcia O, et al. Thirty-day outcome and vascular complications after transarterial aortic valve implantation using both Edwards Sapien and Medtronic CoreValve bioprostheses in a mixed population. EuroIntervention. 2010;5(6):659-65. PMID: 20142215.
-
116Abdel-Wahab M, Zahn R, Horack M, Gerckens U, Schuler G, Sievert H, et al. Aortic regurgitation after transcatheter aortic valve implantation: incidence and early outcome. Results from the German transcatheter aortic valve interventions registry. Heart. 2011;97(11):899-906. doi: 10.1136/hrt.2010.217158.
» https://doi.org/10.1136/hrt.2010.217158 -
117Cheung AW, Gurvitch R, Ye J, Wood D, Lichtenstein SV, Thompson C, et al. Transcatheter transapical mitral valve-in-valve implantations for a failed bioprosthesis: a case series. J Thorac Cardiovasc Surg. 2011;141(3):711-5. doi: 10.1016/j.jtcvs.2010.11.026.
» https://doi.org/10.1016/j.jtcvs.2010.11.026 -
118Gotzmann M, Mugge A, Bojara W. Transcatheter aortic valve implantation for treatment of patients with degenerated aortic bioprostheses-valve-in-valve technique. Catheter Cardiovasc Interv. 2010;76(7):1000-6. doi: 10.1002/ccd.22738.
» https://doi.org/10.1002/ccd.22738 -
119Webb JG, Wood DA, Ye J, Gurvitch R, Masson JB, Rodés-Cabau J, et al. Transcatheter valve-in-valve implantation for failed bioprosthetic heart valves. Circulation. 2010;121(16):1848-57. doi: https://doi.org/10.1161/CIRCULATIONAHA.109.924613
» https://doi.org/10.1161/CIRCULATIONAHA.109.924613 -
120Cribier A, Savin T, Saoudi N, Rocha P, Berland J, Letac B. Percutaneous transluminal valvuloplasty of acquired aortic stenosis in elderly patients: an alternative to valve replacement? Lancet. 1986;1(8472):63-7. doi: http://dx.doi.org/10.1016/S01-40-6736(86)90716-6
» http://dx.doi.org/10.1016/S01-40-6736(86)90716-6 -
121Block PC, Palacios IF. Clinical and hemodynamic follow-up after percutaneous aortic valvuloplasty in the elderly. Am J Cardiol. 1988;62(10 Pt 1):760-3. doi: http://dx.doi.org/10.1016/0002-9149(88)91218-0
» http://dx.doi.org/10.1016/0002-9149(88)91218-0 -
122Webb J, Cribier A. Percutaneous transarterial aortic valve implantation: what do we know? Eur Heart J. 2011;32(2):140-7. doi: 10.1093/eurheartj/ehg453.
» https://doi.org/10.1093/eurheartj/ehg453 -
123Kapadia SR, Goel SS, Yuksel U, Agarwal S, Pettersson G, Svensson LG, et al. Lessons learned from balloon aortic valvuloplasty experience from the pre-transcatheter aortic valve implantation era. J Interv Cardiol. 2010;23(5):499-508. doi: 10.1111/j.1540-8183.2010.00577x.
» https://doi.org/10.1111/j.1540-8183.2010.00577x -
124Reardon MJ, Van Mieghem NM, Popma JJ, Kleiman NS, Søndergaard L, Mumtaz M, et al; SURTAVI Investigators. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2017;376(14):1321-31. doi: 10.1056/NEJMoa1700456.
» https://doi.org/10.1056/NEJMoa1700456 -
125Leon MB, Smith CR, Mack MJ, Makkar RR, Svensson LG, Kodali SK, et al; PARTNER 2 Investigators. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374(17):1609-20. doi: 10.1056/NEJMoa1514616.
» https://doi.org/10.1056/NEJMoa1514616 -
126Reardon MJ, Kleiman NS, Adams DH, Yakubov SJ, Coselli JS, Deeb GM, et al. Outcomes in the randomized CoreValve US pivotal high risk trial in patients with a Society of Thoracic Surgeons Risk Score of 7% or less. JAMA Cardiol. 2016;1(8):945-9. doi: 10.1001/jamacardio.2016.2257.
» https://doi.org/10.1001/jamacardio.2016.2257 -
127Reardon MJ, Adams DH, Coselli JS, Deeb GM, Kleiman NS, Chetcuti S, et al; CoreValve US Clinical Investigators. Self-expanding transcatheter aortic valve replacement using alternative access sites in symptomatic patients with severe aortic stenosis deemed extreme risk of surgery. J Thorac Cardiovasc Surg. 2014;148(6):2869-76.e1-7. doi: 10.1016/j.jtcvs.2014.07.020.
» https://doi.org/10.1016/j.jtcvs.2014.07.020 -
128Popma JJ, Adams DH, Reardon MJ, Yakubov SJ, Kleiman NS, Heimansohn D, et al; CoreValve United States Clinical Investigators.. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll Cardiol. 2014;63(19):1972-81. doi: 10.1016/j.jacc.2014.02.556.
» https://doi.org/10.1016/j.jacc.2014.02.556 -
129Reardon MJ, Adams DH, Kleiman NS, Yakubov SJ, Coselli JS, Deeb GM, et al. 2-year outcomes in patients undergoing surgical or self-expanding transcatheter aortic valve replacement. J Am Coll Cardiol. 2015;66(2):113-21. doi: 10.1016/j.jacc.2015.05.017.
» https://doi.org/10.1016/j.jacc.2015.05.017 -
130Souza AL, Salgado CG, Mourilhe-Rocha R, Mesquita ET, Lima LC, Mattos ND, et al. Transcatheter aortic valve implantation and morbidity and mortality-related factors: a 5-year experience in Brazil. Arq Bras Cardiol. 2016;106(6):519-27. doi: http://dx.doi.org/10.5935/abc.20160072
» http://dx.doi.org/10.5935/abc.20160072
-
131Tarasoutchi F, Grinberg M, Spina GS, Sampaio RO, Cardoso LF, Rossi EG, et al. Ten-year clinical laboratory follow-up after application of a symptom-based therapeutic strategy to patients with severe chronic aortic regurgitation of predominant rheumatic etiology. J Am Coll Cardiol. 2003;41(8):1316-24. doi: https://doi.org/10.1016/S0735-1097(03)00129-3
» https://doi.org/10.1016/S0735-1097(03)00129-3 -
132Bonow RO, Rosing DR, McIntosh CL, Jones M, Maron BJ, Lan KK, et al. The natural history of asymptomatic patients with aortic regurgitation and normal left ventricular function. Circulation. 1983;68(3):509-17. doi: https://doi.org/10.1161/01.CIR68-3.509
» https://doi.org/10.1161/01.CIR68-3.509 -
133Scognamiglio R, Fasoli G, Dalla Volta S. Progression of myocardial dysfunction in asymptomatic patients with severe aortic insufficiency. Clin Cardiol. 1986;9(4):151-6. doi: 10.1002/clc.4960090404.
» https://doi.org/10.1002/clc.4960090404 -
134Siemienczuk D, Greenberg B, Morris C, Massie B, Wilson RA, Topic N, et al. Chronic aortic insufficiency: factors associated with progression to aortic valve replacement. Ann Intern Med. 1989;110(8):587-92. doi: 10.7326/0003-4819-110-8-587.
» https://doi.org/10.7326/0003-4819-110-8-587 -
135Bonow RO, Lakatos E, Maron BJ, Epstein SE. Serial long-term assessment of the natural history of asymptomatic patients with chronic aortic regurgitation and normal left ventricular systolic function. Circulation. 1991;84(4):1625-35. PMID: 1914102.
-
136Tornos MP, Olona M, Permanyer-Miralda G, Herrejon MP, Camprecios M, Evangelista A, et al. Clinical outcome of severe asymptomatic chronic aortic regurgitation: a long-term prospective follow-up study. Am Heart J. 1995;130(2):333-9. PMID: 7631617.
-
137Ishii K, Hirota Y, Suwa M, Kita Y, Onaka H, Kawamura K. Natural history and left ventricular response in chronic aortic regurgitation. Am J Cardiol. 1996;78(3):357-61. PMID: 8759822.
-
138Borer JS, Hochreiter C, Herrold EM, Supino P, Aschermann M, Wencker D, et al. Prediction of indications for valve replacement among asymptomatic or minimally symptomatic patients with chronic aortic regurgitation and normal left ventricular performance. Circulation. 1998;97(6):525-34. PMID: 9494022.
-
139Evangelista A, Tornos P, Sambola A, Permanyer-Miralda G, Soler-Soler J. Long-term vasodilator therapy in patients with severe aortic regurgitation. N Engl J Med. 2005;353(13):1342-9. doi: 10.1056/NEJMoa050666.
» https://doi.org/10.1056/NEJMoa050666 -
140Tribouilloy CM, Enriquez-Sarano M, Bailey KR, Seward JB, Tajik AJ. Assessment of severity of aortic regurgitation using the width of the vena contracta: A clinical color Doppler imaging study. Circulation. 2000;102(5):558-64. PMID: 10920069.
-
141Pomerantzeff PM, Barbosa GV, de Sousa Filho BS, Brandão CM, Ribeiro EJ, Costa FD, et al. [Guidelines for surgery in heart valve diseases]. Arq Bras Cardiol. 2004;82(Suppl 5):22-33. PMID: 15122461.
-
142Roy DA, Schaefer U, Guetta V, Hildick-Smith D, Möllmann H, Dumonteil N, et al. Transcatheter aortic valve implantation for pure severe native aortic valve regurgitation. J Am Coll Cardiol. 2013;61(15):1577-84. doi: 10.1016/j.jacc.2013.01.018.
» https://doi.org/10.1016/j.jacc.2013.01.018 -
143Seiffert M, Bader R, Kappert U, Rastan A, Krapf S, Bleiziffer S, et al. Initial German experience with transapical implantation of a second-generation transcatheter heart valve for the treatment of aortic regurgitation. JACC Cardiovasc Interv. 2014;7(10):1168-74. doi: 10.1016/j.jcin.2014.05.014.
» https://doi.org/10.1016/j.jcin.2014.05.014. Insuficiência
-
144Van de Veire NR, Braun J, Delgado V, Versteegh MI, Dion RA, Klautz RJ, et al. Tricuspid annuloplasty prevents right ventricular dilatation and progression of tricuspid regurgitation in patients with tricuspid annular dilatation undergoing mitral valve repair. J Thorac Cardiovasc Surg. 2011;141(6):1431-9. doi: 10.1016/j.jtcvs.2010.05.050.
» https://doi.org/10.1016/j.jtcvs.2010.05.050 -
145Yilmaz O, Suri RM, Dearani JA, Sundt TM 3rd, Daly RC, Burkhart HM, et al. Functional tricuspid regurgitation at the time of mitral valve repair for degenerative leaflet prolapse: the case for a selective approach. J Thorac Cardiovasc Surg. 2011;142(3):608-13. doi: 10.1016/j.jtcvs.2010.10.042.
» https://doi.org/10.1016/j.jtcvs.2010.10.042 -
146Calafiore AM, Iaco AL, Romeo A, Scandura S, Meduri R, Varone E, et al. Echocardiographic-based treatment of functional tricuspid regurgitation. J Thorac Cardiovasc Surg. 2011;142(2):308-13. doi: 10.1016/j.jtcvs.2010.04.047.
» https://doi.org/10.1016/j.jtcvs.2010.04.047 -
147Benedetto U, Melina G, Angeloni E, Refice S, Roscitano A, Comito C, et al. Prophylactic tricuspid annuloplasty in patients with dilated tricuspid annulus undergoing mitral valve surgery. J Thorac Cardiovasc Surg. 2012;143(3):632-8. doi: 10.1016/j.jtcvs.2011.12.006.
» https://doi.org/10.1016/j.jtcvs.2011.12.006 -
148Fukuda S, Gillinov AM, McCarthy PM, Stewart WJ, Song JM, Kihara T, et al. Determinants of recurrent or residual functional tricuspid regurgitation after tricuspid annuloplasty. Circulation. 2006;114(1 Suppl):I582-7. doi: 10.1161/CIRCULATIONAHA.105.001305.
» https://doi.org/10.1161/CIRCULATIONAHA.105.001305 -
149Nath J, Foster E, Heidenreich PA. Impact of tricuspid regurgitation on long-term survival. J Am Coll Cardiol. 2004;43(3):405-9. doi: 10.1016/j.jacc.2003.09.036.
» https://doi.org/10.1016/j.jacc.2003.09.036 -
150Navia JL, Nowicki ER, Blackstone EH, Brozzi NA, Nento DE, Atik FA, et al. Surgical management of secondary tricuspid valve regurgitation: annulus, commissure, or leaflet procedure? J Thorac Cardiovasc Surg. 2010;139(6):1473-1482.e5. doi: 10.1016/j.jtcvs.2010.02.046.
» https://doi.org/10.1016/j.jtcvs.2010.02.046 -
151Rodés-Cabau J, Taramasso M, O'Gara PT. Diagnosis and treatment of tricuspid valve disease: current and future perspectives. Lancet. 2016;388(10058):2431-42. doi: 10.1016/S0140-6736(16)00740-6.
» https://doi.org/10.1016/S0140-6736(16)00740-6 -
152Godart F, Baruteau AE, Petit J, Riou JY, Sassolas F, Lusson JR, et al. Transcatheter tricuspid valve implantation: a multicentre French study. Arch Cardiovasc Dis. 2014;107(11):583-91. doi: 10.1016/j.acvd.2014.07.051.
» https://doi.org/10.1016/j.acvd.2014.07.051 -
153Schofer J, Bijuklic K, Tiburtius C, Hansen L, Groothuis A, Hahn RT. First-in-human transcatheter tricuspid valve repair in a patient with severely regurgitant tricuspid valve. J Am Coll Cardiol. 2015;65(12):1190-5. doi: 10.1016/j.jacc.2015.01.025.
» https://doi.org/10.1016/j.jacc.2015.01.025 -
154Bouleti C, Juliard JM, Himbert D, Iung B, Brochet E, Urena M, et al. Tricuspid valve and percutaneous approach: No longer the forgotten valve! Arch Cardiovasc Dis. 2016;109(1):55-66. doi: 10.1016/j.acvd.2015.08.002.
» https://doi.org/10.1016/j.acvd.2015.08.002 -
155Liu P, Qiao WH, Sun FQ, Ruan XL, Al Shirbini M, Hu D, et al. Should a mechanical or biological prosthesis be used for a tricuspid valve replacement? A meta-analysis. J Card Surg. 2016;31(5):294-302. doi: 10.1111/jocs.12730.
» https://doi.org/10.1111/jocs.12730 -
156Gatti G, Dell'Angela L, Morosin M, Maschietto L, Pinamonti B, Benussi B, et al. Flexible band versus rigid ring annuloplasty for functional tricuspid regurgitation: two different patterns of right heart reverse remodelling. Interact Cardiovasc Thorac Surg. 2016;23(1):79-89. doi: 10.1093/icvts/ivw047.
» https://doi.org/10.1093/icvts/ivw047 -
157Bevan PJ, Haydock DA, Kang N. Long-term survival after isolated tricuspid valve replacement. Heart Lung Circ. 2014;23(8):697-702. doi: 10.1016/j.hlc.2014.02.011.
» https://doi.org/10.1016/j.hlc.2014.02.011 -
158Raikhelkar J, Lin HM, Neckman D, Afonso A, Scurlock C. Isolated tricuspid valve surgery: predictors of adverse outcome and survival. Heart Lung Circ. 2013;22(3):211-20. doi: 10.1016/j.hlc.2012.09.006.
» https://doi.org/10.1016/j.hlc.2012.09.006. Estenose
-
159Chang BC, Lim SH, Yi G, Hong YS, Lee S, Yoo KJ, et al. Long-term clinical results of tricuspid valve replacement. Ann Thorac Surg. 2006;81(4):1317-23. doi: 10.1016/j.athoracsur.2005.11.005.
» https://doi.org/10.1016/j.athoracsur.2005.11.005 -
160Filsoufi F, Anyanwu AC, Salzberg SP, Frankel T, Cohn LH, Adams DH. Long-term outcomes of tricuspid valve replacement in the current era. Ann Thorac Surg. 2005;80(3):845-50. doi: 10.1016/j.athoracsur.2004.12.019.
» https://doi.org/10.1016/j.athoracsur.2004.12.019 -
161Yeter E, Ozlem K, Kiliç H, Ramazan A, Acikel S. Tricuspid balloon valvuloplasty to treat tricuspid stenosis. J Heart Valve Dis. 2010;19(1):159-60. PMID: 20329507.
-
162Tiede DJ, Nishimura RA, Gastineau DA, Mullany CJ, Orszulak TA, Schaff HV. Modern management of prosthetic valve anticoagulation. Mayo Clin Proc. 1998;73(7):665-80. doi: 10.1016/S0025-6196(11)64893-3.
» https://doi.org/10.1016/S0025-6196(11)64893-3 -
163Aziz F, Corder M, Wolffe J, Comerota AJ. Anticoagulation monitoring by an anticoagulation service is more costeffective than routine physician care. J Vasc Surg. 2011;54(5):1404-7. doi: 10.1016/j.jvs.2011.05.021.
» https://doi.org/10.1016/j.jvs.2011.05.021 -
164Chiquette E, Amato MG, Bussey HI. Comparison of an anticoagulation clinic with usual medical care: anticoagulation control, patient outcomes, and health care costs. Arch Intern Med. 1998;158(15):1641-7. PMID: 9701098.
-
165Wittkowsky AK, Nutescu EA, Blackburn J, Mullins J, Hardman J, Mitchell J, et al. Outcomes of oral anticoagulant therapy managed by telephone vs in-office visits in an anticoagulation clinic setting. Chest. 2006;130(5):1385-9. doi: 10.1378/chest.130.5.1385.
» https://doi.org/10.1378/chest.130.5.1385 -
166Lalonde L, Martineau J, Blais N, Montigny M, Ginsberg J, Fournier M, et al. Is long-term pharmacist-managed anticoagulation service efficient? A pragmatic randomized controlled trial. Am Heart J. 2008;156(1):148-54. doi: 10.1016/j.ahj.2008.02.009.
» https://doi.org/10.1016/j.ahj.2008.02.009 -
167Witt DM, Sadler MA, Shanahan RL, Mazzoli G, Tillman DJ. Effect of a centralized clinical pharmacy anticoagulation service on the outcomes of anticoagulation therapy. Chest. 2005;127(5):1515-22. doi: 10.1378/chest.127.5.1515
» https://doi.org/10.1378/chest.127.5.1515 -
168Locke C, Ravnan SL, Patel R, Uchizono JA. Reduction in warfarin adverse events requiring patient hospitalization after implementation of a pharmacist-managed anticoagulation service. Pharmacotherapy. 2005;25(5):685-9. PMID: 15899730.
-
169Whitlock RP, Sun JC, Fremes SE, Rubens FD, Teoh KH. Antithrombotic and thrombolytic therapy for valvular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e576S-e600S. doi: 10.1378/chest.11-2305.
» https://doi.org/10.1378/chest.11-2305 -
170Cannegieter SC, Rosendaal FR, Briët E. Thromboembolic and bleeding complications in patients with mechanical heart valve prostheses. Circulation. 1994;89(2):635-41. PMID: 8313552.
-
171Cannegieter SC, Rosendaal FR, Wintzen AR, van der Meer FJ, Vandenbroucke JP, Briet E. Optimal oral anticoagulant therapy in patients with mechanical heart valves. N Engl J Med. 1995;333(1):11-7. doi: 10.1056/NEJM199507063330103.
» https://doi.org/10.1056/NEJM199507063330103 -
172Schlitt A, von Bardeleben RS, Ehrlich A, Eimermacher A, Peetz D, Dahm M, et al. Clopidogrel and aspirin in the prevention of thromboembolic complications after mechanical aortic valve replacement (CAPTA). Thromb Res. 2003;109(2-3):131-5. PMID: 12706642.
-
173Stein PD, Alpert JS, Bussey HI, Dalen JE, Turpie AG. Antithrombotic therapy in patients with mechanical and biological prosthetic heart valves. Chest. 2001;119(1 Suppl):220S-7S. PMID: 11157651. Erratum in: Chest. 2001;120(3):1044.
-
174Sun JC, Davidson MJ, Lamy A, Eikelboom JW. Antithrombotic management of patients with prosthetic heart valves: current evidence and future trends. Lancet. 2009;374(9689):565-76. doi: 10.1016/S0140-6736(09)60780-7.
» https://doi.org/10.1016/S0140-6736(09)60780-7 -
175Acar J, Iung B, Boissel JP, Samama MM, Michel PL, Teppe JP, et al. AREVA: multicenter randomized comparison of low-dose versus standard-dose anticoagulation in patients with mechanical prosthetic heart valves. Circulation. 1996;94(9):2107-12. PMID: 8901659.
-
176Hering D, Piper C, Bergemann R, Hillenbach C, Dahm M, Huth C, et al. Thromboembolic and bleeding complications following St. Jude Medical valve replacement: results of the German Experience With Low-Intensity Anticoagulation Study. Chest. 2005;127(1):53-9. doi: 10.1378/chest.127.1.53.
» https://doi.org/10.1378/chest.127.1.53 -
177Torella M, Torella D, Chiodini P, Franciulli M, Romano G, De Santo L, et al. LOWERing the INtensity of oral anticoaGulant Therapy in patients with bileaflet mechanical aortic valve replacement: results from the "LOWERING-IT" Trial. Am Heart J. 2010;160(1):171-8. doi: 10.1016/j.ahj.2010.05.005.
» https://doi.org/10.1016/j.ahj.2010.05.005 -
178Horstkotte D, Scharf RE, Schultheiss HP. Intracardiac thrombosis: patient-related and device-related factors. J Heart Valve Dis. 1995;4(2):114-20. PMID: 8556170.
-
179Pruefer D, Dahm M, Dohmen G, Horstkotte D, Bergemann R, Oelert H. Intensity of oral anticoagulation after implantation of St. Jude Medical mitral or multiple valve replacement: lessons learned from GELIA (GELIA 5). Eur Heart J Suppl. 2001;3(Suppl Q):Q39-43.
-
180Meschengieser SS, Fondevila CG, Frontroth J, Santarelli MT, Lazzari MA. Low-intensity oral anticoagulation plus low-dose aspirin versus high-intensity oral anticoagulation alone: a randomized trial in patients with mechanical prosthetic heart valves. J Thorac Cardiovasc Surg. 1997;113(5):910-6. doi: 10.1016/S0022-5223(97)70264-2.
» https://doi.org/10.1016/S0022-5223(97)70264-2 -
181Turpie AG, Gent M, Laupacis A, Latour Y, Gunstensen J, Basile F, et al. A comparison of aspirin with placebo in patients treated with warfarin after heart-valve replacement. N Engl J Med. 1993;329(8):524-9. doi: 10.1056/NEJM199308193290802.
» https://doi.org/10.1056/NEJM199308193290802 -
182Aramendi JI, Mestres CA, Campos V, Martinez-Leon J, Munoz G, Navas C. Triflusal versus oral anticoagulation for primary prevention of thromboembolism after bioprosthetic valve replacement (trac): prospective, randomized, co-operative trial. Eur J Cardiothorac Surg. 2005;27(5):854-60. doi: 10.1016/j.ejcts.2004.12.064
» https://doi.org/10.1016/j.ejcts.2004.12.064 -
183Colli A, Mestres CA, Castella M, Gherli T. Comparing warfarin to aspirin (WoA) after aortic valve replacement with the St. Jude Medical Epic heart valve bioprosthesis: results of the WoA Epic pilot trial. J Heart Valve Dis. 2007;16(6):667-71. PMID: 18095518.
-
184Heras M, Chesebro JH, Fuster V, Penny WJ, Grill DE, Bailey KR, et al. High risk of thromboemboli early after bioprosthetic cardiac valve replacement. J Am Coll Cardiol. 1995;25(5):1111-9. PMID: 7897124.
-
185Nuñez L, Gil Aguado M, Larrea JL, Celemin D, Oliver J. Prevention of thromboembolism using aspirin after mitral valve replacement with porcine bioprosthesis. Ann Thorac Surg. 1984;37(1):84-7. PMID: 6691742.
-
186Brennan JM, Edwards FH, Zhao Y, O'Brien S, Booth ME, Dokholyan RS, et al; DEcIDE AVR Research Team. Early anticoagulation of bioprosthetic aortic valves in older patients: results from the Society of Thoracic Surgeons Adult Cardiac Surgery National Database. J Am Coll Cardiol. 2012;60(11):971-7. doi: 10.1016/j.jacc.2012.05.029.
» https://doi.org/10.1016/j.jacc.2012.05.029 -
187Egbe AC, Pislaru SV, Pellikka PA, Poterucha JT, Schaff HV, Maleszewski JJ, et al. Bioprosthetic valve thrombosis versus structural failure: clinical and echocardiographic predictors. J Am Coll Cardiol. 2015;66(21):2285-94. doi: 10.1016/j.jacc.2015.09.022.
» https://doi.org/10.1016/j.jacc.2015.09.022 -
188Mérie C, Køber L, Skov Olsen P, Andersson C, Gislason G, Skov Jensen J, et al. Association of warfarin therapy duration after bioprosthetic aortic valve replacement with risk of mortality, thromboembolic complications, and bleeding. JAMA. 2012;308(20):2118-25. doi: 10.1001/jama.2012.54506.
» https://doi.org/10.1001/jama.2012.54506 -
189Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al; RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-51. doi: 10.1056/NEJMoa0905561. Erratum in: N Engl J Med. 2010;363(19):1877.
» https://doi.org/10.1056/NEJMoa0905561 -
190Douketis JD, Spyropoulos AC, Kaatz S, Becker RC, Caprini JA, Dunn AS, et al; BRIDGE Investigators. Perioperative bridging anticoagulation in patients with atrial fibrillation. N Engl J Med. 2015;373(9):823-33. doi: 10.1056/NEJMoa1501035.
» https://doi.org/10.1056/NEJMoa1501035 -
191Eikelboom JW, Connolly SJ, Brueckmann M, Granger CB, Kappetein AP, Mack MJ, et al; RE-ALIGN Investigators. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med. 2013;369(13):1206-14. doi: 10.1056/NEJMoa1300615.
» https://doi.org/10.1056/NEJMoa1300615 -
192Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al; ENGAGE AF-TIMI 48 Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013;369(22):2093-104. doi: 10.1056/NEJMoa1310907.
» https://doi.org/10.1056/NEJMoa1310907 -
193Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al; ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981-92. doi: 10.1056/NEJMoa1107039.
» https://doi.org/10.1056/NEJMoa1107039 -
194Makkar RR, Fontana G, Jilaihawi H, Chakravarty T, Kofoed KF, de Backer O, et al. Possible subclinical leaflet thrombosis in bioprosthetic aortic valves. N Engl J Med. 2015;373(21):2015-24. doi: 10.1056/NEJMoa1509233.
» https://doi.org/10.1056/NEJMoa1509233 -
195Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365(10):883-91. doi: 10.1056/NEJMoa1009638.
» https://doi.org/10.1056/NEJMoa1009638 -
196Sundt TM, Zehr KJ, Dearani JA, Daly RC, Mullany CJ, McGregor CG, et al. Is early anticoagulation with warfarin necessary after bioprosthetic aortic valve replacement? J Thorac Cardiovasc Surg. 2005;129(5):1024-31. doi: 10.1016/j.jtcvs.2004.11.028.
» https://doi.org/10.1016/j.jtcvs.2004.11.028 -
197Russo A, Grigioni F, Avierinos JF, Freeman WK, Suri R, Michelena H, et al. Thromboembolic complications after surgical correction of mitral regurgitation incidence, predictors, and clinical implications. J Am Coll Cardiol. 2008;51(12):1203-11. doi: 10.1016/j.jacc.2007.10.058.
» https://doi.org/10.1016/j.jacc.2007.10.058 -
198ElBardissi AW, DiBardino DJ, Chen FY, Yamashita MH, Cohn LH. Is early antithrombotic therapy necessary in patients with bioprosthetic aortic valves in normal sinus rhythm? J Thorac Cardiovasc Surg. 2010;139(5):1137-45. doi: 10.1016/j.jtcvs.2009.10.064.
» https://doi.org/10.1016/j.jtcvs.2009.10.064 -
199Hansson NC, Grove EL, Andersen HR, Leipsic J, Mathiassen ON, Jensen JM, et al. Transcatheter aortic valve thrombosis: incidence, predisposing factors, and clinical implications. J Am Coll Cardiol. 2016;68(19):2059-2069. doi: 10.1016/j.jacc.2016.08.010.
» https://doi.org/10.1016/j.jacc.2016.08.010 -
200Pache G, Schoechlin S, Blanke P, Dorfs S, Jander N, Arepalli CD, et al. Early hypo-attenuated leaflet thickening in balloon-expandable transcatheter aortic heart valves. Eur Heart J. 2016;37(28):2263-71. doi: 10.1093/eurheartj/ehv526.
» https://doi.org/10.1093/eurheartj/ehv526 -
201Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest. 2010;137(2):263-72. doi: 10.1378/chest.09-1584.
» https://doi.org/10.1378/chest.09-1584 -
202Lavitola P de L, Sampaio RO, Oliveira WA, Bôer BN, Tarasoutchi F, Spina GS, et al. Warfarin or aspirin in embolism prevention in patients with mitral valvulopathy and atrial fibrillation. Arq Bras Cardiol. 2010;95(6):749-55. doi: http://dx.doi.org/10.1590/S0066-782X2010005000140
» http://dx.doi.org/10.1590/S0066-782X2010005000140 -
203Higashi MK, Veenstra DL, Kondo LM, Wittkowsky AK, Srinouanprachanh SL, Farin FM, et al. Association between CYP2C9 genetic variants and anticoagulation-related outcomes during warfarin therapy. JAMA. 2002;287(13):1690-8. PMID: 11926893.
-
204Landefeld CS, Beyth RJ. Anticoagulant-related bleeding: clinical epidemiology, prediction, and prevention. Am J Med. 1993;95(3):315-28. PMID: 8368229.
-
205Arom KV, Emery RW, Nicoloff DM, Petersen RJ. Anticoagulant related complications in elderly patients with St. Jude mechanical valve prostheses. J Heart Valve Dis. 1996;5(5):505-10. PMID: 8894990.
-
206Cappelleri JC, Fiore LD, Brophy MT, Deykin D, Lau J. Efficacy and safety of combined anticoagulant and antiplatelet therapy versus anticoagulant monotherapy after mechanical heart-valve replacement: a metaanalysis. Am Heart J. 1995;130(3 Pt 1):547-52. PMID: 7661074.
-
207Turpie AG, Gunstensen J, Hirsh J, Nelson H, Gent M. Randomised comparison of two intensities of oral anticoagulant therapy after tissue heart valve replacement. Lancet. 1988;1(8597):1242-5. PMID: 2897516.
-
208Hughes M, Lip GY; Guideline Development Group for the NICE national clinical guideline for management of atrial fibrillation in primary and secondary care. Risk factors for anticoagulation-related bleeding complications in patients with atrial fibrillation: a systematic review. QJM. 2007;100(10):599-607. doi: 10.1093/qjmed/hcm076.
» https://doi.org/10.1093/qjmed/hcm076 -
209Ezekowitz MD, Nagarakanti R, Noack H, Brueckmann M, Litherland C, Jacobs M, et al. Comparison of dabigatran and warfarin in patients with atrial fibrillation and valvular heart disease: The RE-LY Trial (Randomized Evaluation of Long-Term Anticoagulant Therapy). Circulation. 2016;134(8):589-98. doi: 10.1161/CIRCULATIONAHA.115.020950.
» https://doi.org/10.1161/CIRCULATIONAHA.115.020950 -
210Breithardt G, Baumgartner H, Berkowitz SD, Hellkamp AS, Piccini JP, Stevens SR, et al; ROCKET AF Steering Committee & Investigators. Clinical characteristics and outcomes with rivaroxaban vs. warfarin in patients with non-valvular atrial fibrillation but underlying native mitral and aortic valve disease participating in the ROCKET AF trial. Eur Heart J. 2014;35(47):3377-85. doi: 10.1093/eurheartj/ehu305.
» https://doi.org/10.1093/eurheartj/ehu305 -
211Avezum A, Lopes RD, Schulte PJ, Lanas F, Gersh BJ, Hanna M, et al. Apixaban in comparison with warfarin in patients with atrial fibrillation and valvular heart disease: findings from the apixaban for reduction in stroke and other thromboembolic events in atrial fibrillation (ARISTOTLE) Trial. Circulation. 2015;132(8):624-32. doi: 10.1161/CIRCULATIONAHA.114.014807.
» https://doi.org/10.1161/CIRCULATIONAHA.114.014807. Doença
-
212Catovic S, Popovic ZB, Tasic N, Nezic D, Milojevic P, Djukanovic B, et al. Impact of concomitant aortic regurgitation on long-term outcome after surgical aortic valve replacement in patients with severe aortic stenosis. J Cardiothorac Surg. 2011 Apr 13;6:51. doi: 10.1186/1749-8090-6-51.
» https://doi.org/10.1186/1749-8090-6-51 -
213Hwang MH, Hammermeister KE, Oprian C, Henderson W, Bousvaros G, Wong M, et al. Preoperative identification of patients likely to have left ventricular dysfunction after aortic valve replacement. Participants in the Veterans Administration Cooperative Study on Valvular Heart Disease. Circulation. 1989;80(3 Pt 1):I65-76. PMID: 2670330.
-
214Zilberszac R, Gabriel H, Schemper M, Zahler D, Czerny M, Maurer G, et al. Outcome of combined stenotic and regurgitant aortic valve disease. J Am Coll Cardiol. 2013;61(14):1489-95. doi: 10.1016/j.jacc.2012.11.070.
» https://doi.org/10.1016/j.jacc.2012.11.070 -
215Topal AE, Eren MN, Celik Y. Left ventricle and left atrium remodeling after mitral valve replacement in case of mixed mitral valve disease of rheumatic origin. J Card Surg. 2010;25(4):367-72. doi: 10.1111/j.1540-8191.2010.01062.x.
» https://doi.org/10.1111/j.1540-8191.2010.01062.x -
216Unger P, Clavel MA, Lindman BR, Mathieu P, Pibarot P. Pathophysiology and management of multivalvular disease. Nat Rev Cardiol. 2016;13(7):429-40. doi: 10.1038/nrcardio.2016.57.
» https://doi.org/10.1038/nrcardio.2016.57. Disfunção
-
217Sorajja P, Cabalka AK, Hagler DJ, Rihal CS. Percutaneous repair of paravalvular prosthetic regurgitation: acute and 30-day outcomes in 115 patients. Circ Cardiovasc Interv 2011;4(4):314-21. doi: 10.1161/CIRCINTERVENTIONS.110.960955.
» https://doi.org/10.1161/CIRCINTERVENTIONS.110.960955 -
218Webb JG, Wood DA, Ye J, Gurvitch R, Masson JB, Rodés-Cabau J, et al. Transcatheter valve-in-valve implantation for failed bioprosthetic heart valves. Circulation. 2010;121(16):1848-57. doi: 10.1161/CIRCULATIONAHA.109.924613.
» https://doi.org/10.1161/CIRCULATIONAHA.109.924613 -
219Piazza N, Bleiziffer S, Brockmann G, Hendrick R, Deutsch MA, Opitz A, et al. Transcatheter aortic valve implantation for failing surgical aortic bioprosthetic valve: from concept to clinical application and evaluation (Part 1). JACC Cardiovasc Interv. 2011;4(7):721-32. doi: 10.1016/j.jcin.2011.03.016.
» https://doi.org/10.1016/j.jcin.2011.03.016 -
220Pibarot P, Dumesnil JG. Doppler echocardiographic evaluation of prosthetic valve function. Heart. 2012;98(1):69-78. doi: 10.1136/heartjnl-2011-300351.
» https://doi.org/10.1136/heartjnl-2011-300351 -
221Pibarot P, Dumesnil JG. Prosthesis-patient mismatch: definition, clinical impact, and prevention. Heart. 2006;92(8):1022-9. doi: 10.1136/hrt.2005.067363.
» https://doi.org/10.1136/hrt.2005.067363 -
222Head SJ, Mokhles MM, Osnabrugge RL, Pibarot P, Mack MJ, Takkenberg JJ, et al. The impact of prosthesis-patient mismatch on long-term survival after aortic valve replacement: a systematic review and meta-analysis of 34 observational studies comprising 27186 patients with 133141 patient-years. Eur Heart J. 2012;33(12):1518-29. doi: 10.1093/eurheartj/ehs003.
» https://doi.org/10.1093/eurheartj/ehs003 -
223Genoni M, Franzen D, Vogt P, Seifert B, Jenni R, Künzli A, et al. Paravalvular leakage after mitral valve replacement: improved long-term survival with aggressive surgery? Eur J Cardiothorac Surg. 2000;17(1):14-9. PMID: 10735406.
-
224Ruiz CE, Jelnin V, Kronzon I, Dudiy Y, Del Valle-Fernandez R, Einhorn BN, et al. Clinical outcomes in patients undergoing percutaneous closure of periprosthetic paravalvular leaks. J Am Coll Cardiol. 2011;58(21):2210-7. doi: 10.1016/j.jacc.2011.03.074.
» https://doi.org/10.1016/j.jacc.2011.03.074 -
225Sorajja P, Cabalka AK, Hagler DJ, Rihal CS. Long-term follow-up of percutaneous repair of paravalvular prosthetic regurgitation. J Am Coll Cardiol. 2011;58(21):2218-24. doi: 10.1016/j.jacc.2011.07.041.
» https://doi.org/10.1016/j.jacc.2011.07.041 -
226Côté N, Pibarot P, Clavel MA. Incidence, risk factors, clinical impact, and management of bioprosthesis structural valve degeneration. Curr Opin Cardiol. 2017;32(2):123-129. doi: 10.1097/HCO.0000000000000372.
» https://doi.org/10.1097/HCO.0000000000000372 -
227Panaich SS, Eleid MF. Tricuspid valve-in-valve implantation for failing bioprosthetic valves: an evolving standard of care. Ann Transl Med. 2016;4(20):410. doi: 10.21037/atm.2016.10.44.
» https://doi.org/10.21037/atm.2016.10.44 -
228Condado JF, Kaebnick B, Babaliaros V. Transcatheter mitral valve-in-valve therapy. Interv Cardiol Clin. 2016;5(1):117-123. doi: 10.1016/j.iccl.2015.08.011.
» https://doi.org/10.1016/j.iccl.2015.08.011 -
229Ando T, Takagi H; ALICE (All-Literature Investigation of Cardiovascular Evidence) Group. Percutaneous closure of paravalvular regurgitation after transcatheter aortic valve implantation: a systematic review. Clin Cardiol. 2016;39(10):608-14. doi: 10.1002/clc.22569.
» https://doi.org/10.1002/clc.22569 -
230Ejiofor JI, Yammine M, Harloff MT, McGurk S, Muehlschlegel JD, Shekar PS, et al. Reoperative surgical aortic valve replacement versus transcatheter valve-in-valve replacement for degenerated bioprosthetic aortic valves. Ann Thorac Surg. 2016;102(5):1452-8. doi: 10.1016/j.athoracsur.2016.05.086.
» https://doi.org/10.1016/j.athoracsur.2016.05.086 -
231García E, Arzamendi D, Jimenez-Quevedo P, Sarnago F, Martí G, Sanchez-Recalde A, et al. Outcomes and predictors of success and complications for paravalvular leak closure. An analysis of the SpanisH real-wOrld paravalvular Leaks closure registry (HOLE registry). EuroIntervention. 2017;12(16):1962-1968. doi: 10.4244/EIJ-D-16-00581.
» https://doi.org/10.4244/EIJ-D-16-00581 -
232Sorajja P. Mitral paravalvular leak closure. Interv Cardiol Clin. 2016;5(1):45-54. doi: 10.1016/j.iccl.2015.08.004.
» https://doi.org/10.1016/j.iccl.2015.08.004 -
233Cruz-Gonzalez I, Rama-Merchan JC, Calvert PA, Rodríguez-Collado J, Barreiro-Pérez M, Martín-Moreiras J, et al. Percutaneous closure of paravalvular leaks: a systematic review. J Interv Cardiol. 2016;29(4):382-92. doi: 10.1111/joic.12295.
» https://doi.org/10.1111/joic.12295.
-
234Luluaga IT, Carrera D, D'Oliveira J, Cantaluppi CG, Santin H, Molteni L, et al. Successful thrombolytic therapy after acute tricuspid-valve obstruction. Lancet. 1971;1(7708):1067-8. PMID: 4102990.
-
235Sakr SA, Abdel-Shakour H, Ramadan MM. Successful fibrinolytic treatment of prosthetic heart valve thrombosis using streptokinase. Acta Clin Belg. 2015;70(3):159-66. doi: 10.1179/2295333714Y.0000000107.
» https://doi.org/10.1179/2295333714Y.0000000107 -
236Keuleers S, Herijgers P, Herregods MC, Budts W, Dubois C, Meuris B, et al. Comparison of thrombolysis versus surgery as a first line therapy for prosthetic heart valve thrombosis. Am J Cardiol. 2011;107(2):275-9. doi: 10.1016/j.amjcard.2010.09.013.
» https://doi.org/10.1016/j.amjcard.2010.09.013 -
237Castilho FM, Sousa MR, Mendonca AL, Ribeiro AL, Caceres-Loriga FM. Thrombolytic therapy or surgery for valve prosthesis thrombosis: systematic review and metanalysis. J Thromb Haemost. 2014;12(8):1218-28. doi: 10.1111/jth.12577.
» https://doi.org/10.1111/jth.12577 -
238Jeffrey RR. Clots and cardiac valve prostheses. J Thromb Haemost. 2014;12(8):1216-7. doi: 10.1111/jth.12640.
» https://doi.org/10.1111/jth.12640 -
239Lengyel M, Horstkotte D, Voller H, Mistiaen WP; Working Group Infection, Thrombosis, Embolism and Bleeding of the Society for Heart Valve Disease. Recommendations for the management of prosthetic valve thrombosis. J Heart Valve Dis. 2005;14(5):567-75. PMID: 16245493.
-
240Salem DN, O'Gara PT, Madias C, Pauker SG. Valvular and structural heart disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008;133(6 Suppl):593S-629S. doi: 10.1378/chest.08-0724.
» https://doi.org/10.1378/chest.08-0724 -
241Biteker M, Altun I, Basaran O, Dogan V, Yildirim B, Ergun G. Treatment of Prosthetic Valve Thrombosis: Current Evidence and Future Directions. J Clin Med Res 2015;7(12):932-6. doi: 10.14740/jocmr2392w.
» https://doi.org/10.14740/jocmr2392w -
242Seabra Garcez JD, Rosa VE, Lopes AS, Accorsi TA, Fernandes JR, Pomerantzeff PM, et al. Patient management with metallic valve prosthesis during pregnancy and postpartum period. Arq Bras Cardiol. 2015;105(4):426-9. doi: 10.5935/abc.20150130.
» https://doi.org/10.5935/abc.20150130 -
243Maria Alberto Pomerantzeff P, Padovani Steffen S, Manuel de Almeida Brandão C, Aparecida Lapenna G, Tarasoutchi F, Biscegli Jatene F. Surgical thrombectomy of mechanical valve thrombosis. J Heart Valve Dis. 2015;24(6):780-4. PMID: 27997787.
Datas de Publicação
-
Publicação nesta coleção
2017