Resumen
The trophic spectrum of the Brown brocket deer, Mazama gouazoubira Fischer, 1814, was analyzed between September 1993 to February 1994, in a secondary environment of Yungas, Argentina and in semicaptivity conditions. Seventy three vegetable species and two fungi species were recorded. It was registered also the consumption of ticks, salt, land, bricks and scats of another animals. The main vegetable parts consumed in order of importance were young leaves and outbreaks (green parts), fruit and flowers.
Cervidae; diet; geophagia; osteophagia; Mammalia
Cervidae; diet; geophagia; osteophagia; Mammalia
DIETA DE MAZAMA GOUAZOUBIRA (MAMMALIA, CERVIDAE) EN UN AMBIENTE SECUNDARIO DE YUNGAS, ARGENTINA1 1 . Contribución n o 9 del Proyecto Corzuelas, LaCEVeN, FCN e IML (Res. 0699/90); realizado parcialmente en el marco del Proyecto CIUNT 26G130 (Res. 216/98).
Enrique Richard2 1 . Contribución n o 9 del Proyecto Corzuelas, LaCEVeN, FCN e IML (Res. 0699/90); realizado parcialmente en el marco del Proyecto CIUNT 26G130 (Res. 216/98).
Juan Pablo Juliá2 1 . Contribución n o 9 del Proyecto Corzuelas, LaCEVeN, FCN e IML (Res. 0699/90); realizado parcialmente en el marco del Proyecto CIUNT 26G130 (Res. 216/98).
ABSTRACT
DIET OF MAZAMA GOUAZOUBIRA (MAMMALIA, CERVIDAE) IN A SECONDARY ENVIRONMENT OF YUNGAS, ARGENTINA. The trophic spectrum of the Brown brocket deer, Mazama gouazoubira Fischer, 1814, was analyzed between September 1993 to February 1994, in a secondary environment of Yungas, Argentina and in semicaptivity conditions. Seventy three vegetable species and two fungi species were recorded. It was registered also the consumption of ticks, salt, land, bricks and scats of another animals. The main vegetable parts consumed in order of importance were young leaves and outbreaks (green parts), fruit and flowers.
KEYWORDS. Cervidae, diet, geophagia, osteophagia, Mammalia.
INTRODUCCIÓN
La corzuela parda (Mazama gouazoubira Fischer, 1814) está ampliamente distribuida en distintos ambientes de bosques, claros de bosques y sabanas arboladas del Neotrópico ((RICHARD et al., 1995; PINDER & LEEWENBERG, 1997). La dieta de la especie es poco conocida (CHÉBEZ & JOHNSON, 1984; REDFORD & EISEMBERG, 1992; Richard et al., 1995) y sólo existe información fragmentaria de la composición de la misma para el Chaco Boreal Paraguayo (STALLINGS, 1984) y registros aislados para Surinam (BRANAN et al., 1985), las Yungas (RICHARD, JULIÁ & ACEÑOLAZA, 1995) y la Amazonía peruana (BODMER, 1991). De tales datos se desprende que los frutos constituyen una parte importante de la dieta, aunque el grado de frugivoría varía según las áreas consideradas (BODMER, 1991; RICHARD, JULIÁ & ACEÑOLAZA,1995).
El objetivo fue lograr un relevamiento, no sólo de las especies que componen el espectro trófico de M. gouazoubira, sino también de las partes aprovechadas de cada una de ellas.
MATERIAL Y MÉTODOS
La Reserva Experimental de Horco Molle (REHM), de la Facultad de Ciencias Naturales e Instituto Miguel Lillo de la Universidad Nacional de Tucumán, se encuentra localizada en Horco Molle (entre 26º 48' S y 65º 19' O), Dpto. Yerba Buena, Tucumán, Argentina. Consta de unas 200 ha, dentro de las cuales existe un área con cercado olímpico perimetral de unas 20 ha. La vegetación original de la zona corresponde al Distrito de las Selvas Montanas de la Provincia Fitogeográfica de las Yungas (sensu CABRERA, 1971) y hasta hace unos quince años, fue un área sometida a explotación agrícola. Los variados tipos de explotación llevados a cabo en el área, su abandono en períodos diferentes y la topografía de la zona, determinan la presencia de distintos estadíos sucesionales de la Selva Montana, los cuales fueron categorizados en asociaciones con predominio de distintas especies vegetales (ACEÑOLAZA, 1989): a) Pastizal: asociación vegetal con predominio de gramíneas y otras herbáceas, destacándose entre las primeras Bromus y Schyzachirium (Poaceae), además de Oxalis (Oxalidaceae), Ambrosia (Asteraceae) y Cyperus (Ciperaceae) entre otras; b) Bosque Secundario Bajo: es la asociación más ampliamente distribuida, se caracteriza por la presencia de un estrato arbóreo bajo constituido principalmente por Tecoma stans (Bignoneaceae), Heliocarpus popayanensis (Tiliaceae) y concentraciones de Psidium guayaba (Mirtaceae) y Morus nigra (Moraceae) en algunos sectores; c) Bosque Secundario Alto: formado por una asociación de Anadenanthera colubrina (Fabaceae) que forma además un bosque monoespecífico dentro del Bosque Secundario Alto, Phoebe porphyria (Griseb.) Mez (Lauraceae) y árboles de menor porte como Jacaranda mimosifolia (Bignoneaceae) entre otros.
Para la determinación de los componentes de la dieta se utilizaron técnicas de observación directa en el seguimiento de 8 ejemplares (3 machos, 4 hembras y una cría) identificados por marcas particulares. Se trabajó con animales focales, seguidos a distancias de entre cuatro a diez metros. El tiempo de observación fue variable (el 90% de las observaciones se ubicaron en el rango de entre cinco minutos a una hora por animal y por día) dependiendo del animal y de la factibilidad de su seguimiento. Los datos obtenidos incluían entre otros, la identificación específica de las plantas consumidas (siempre que fuera posible), su estado fenológico y la parte depredada. La nomenclatura científica de las especies botánicas se basó en ZULOAGA & MORRONE (1999). Las partes consideradas fueron flores, frutos, porciones verdes (diferenciándose brotes, hojas y tallos) y hongos (cuerpo fructífero). Para cada una de las especies y partes depredadas, se calculó el Porcentual de Tiempo Invertido (PTI) en su consumo según la fórmula: PTI (parte)= TIC parte / TIC total . 100 (RICHARD, JULIÁ & ACEÑOLAZA, 1995). En donde TIC es el Tiempo Invertido en el Consumo de una parte vegetal, medido en segundos (tiempo durante el cual se observan movimientos masticatorios inmediatamente después de tomar un bocado) y a lo largo de un mes (acumulativo). El valor del PTI, si bien no es un indicador absoluto, permite estimar la importancia relativa de las partes y especies que conforman la dieta de la corzuela (tab. I).
Se discriminó, para facilitar análisis posteriores, a las distintas especies vegetales (entre las que incluimos los hongos) en seis grupos diferentes (modificado de Whittaker apud ,MATTEUCCI & COLMA, 1982): a) árboles (leñosas de más de tres metros de altura), b) arbustos y matas (leñosas de menos de tres metros de altura), c) herbáceas (anuales o bianuales sin estructura leñosa, no graminoideas), d) graminoideas (Poáceas y Ciperáceas), e) lianas y enredaderas (trepadoras y apoyantes leñosas o no), f) frutos; g) hongos. Dada la importancia de los frutos en la dieta (RICHARD, JULIÁ & ACEÑOLAZA, 1995), los mismos se discriminaron como un grupo aparte. El registro de los componentes no vegetales de la dieta, no incluyó su PTI.
Dada la importancia que tiene el consumo de distintas partes vegetales para cada especie, en la determinación de la riqueza de la dieta se contabilizaron, el número de especies que aportaba a la dieta cualquiera de las partes consideradas: porciones verdes, flores, frutos y hongos (cuerpo fructífero). Como consecuencia, cada especie vegetal (no así los hongos que en todos los casos son consumidos íntegros) puede sumar hasta tres puntos a la riqueza (uno para cada una de las partes vegetales consumida).
El período de estudio comprende, en forma acumulativa, los meses de Setiembre de 1993 a Febrero de 1994, cubriéndose la dieta de la corzuela durante la temporada de lluvias en el área de estudio.
RESULTADOS Y DISCUSIÓN
Se observó el consumo de 73 especies vegetales y 2 de hongos (no identificados del orden Basidiomicete) que conforman el espectro trófico acumulado para el período de estudio (tab. I). A pesar de la gran riqueza observada en la dieta, que representó un consumo promedio mensual de 31,83 especies vegetales y de hongos, la corzuela depredó en forma significativa (PTI > o = al 1%), solo un promedio de 9 especies por mes. Solo 27 especies vegetales y una de hongo, el 36,99 % del total observado en la dieta, representaron una porción significativa de la dieta en alguno de los meses considerados (tab. I). Las especies significativas representaron, en promedio, el 93,67 % del PTI de la dieta, para el período de estudio. Sin embargo y en desmedro de la aparente escasa importancia de las especies de consumo no significativo, en este trabajo seguiremos el criterio expuesto por NUDDS (1980), quien sostiene que son necesarias listas muy largas para describir adecuadamente los hábitos alimenticios de los cérvidos, por lo que incluimos en el listado a todas las especies observadas, aún cundo en algunos casos por observaciones casuales no pudo ser determinado su PTI (tab. I). Ninguna especie fue consumida en forma significativa a lo largo de todo el período de estudio (tab. I), lo que confirma la hipótesis de que no existe una especialización en la dieta hacia determinadas especies.
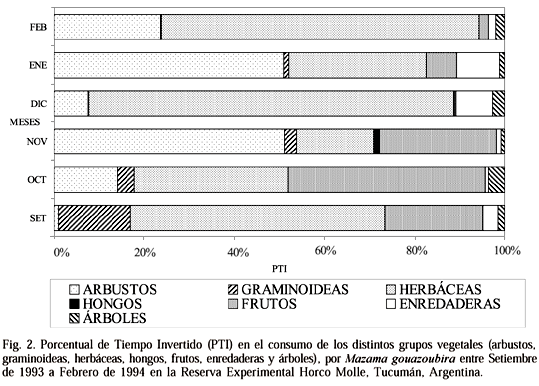
El consumo de las distintas partes vegetales mostró variaciones a lo largo del período de estudio, las cuales estuvieron correlacionadas con la disponibilidad de frutos (RICHARD, JULIÁ & ACEÑOLAZA, 1995). El PTI de los frutos depredados por las corzuelas corresponde en un 94,12 % a especies arbóreas, por lo que la importancia de estas en la dieta se debe, fundamentalmente, al consumo de sus frutos. Las corzuelas, se comportan de manera predominantemente frugívora cuando este recurso está disponible, oportunidad en que los frutos son consumidos en desmedro de las otras partes vegetales (RICHARD, JULIÁ & ACEÑOLAZA, 1995). La riqueza de la dieta varió de acuerdo a la disponibilidad de frutos, siendo mínima cuando había abundancia de frutos y máxima cuando estos escaseaban. La baja disponibilidad de frutos aumenta el consumo de porciones verdes tiernas sobre un mayor número de especies (fig. 1). BODMER (1990) observó, en forma similar, un aumento en la importancia en la dieta Mazama americana (Erxleben, 1777) de otras especies vegetales, especialmente gramíneas, durante los períodos de escasez de frutos.
En general y en promedio, a lo largo del período de estudio, las porciones verdes fueron la parte más importante de la dieta representando el 69,04 % del PTI de la dieta para dicho período, mientras que los frutos correspondieron al 16,71 % del PTI, las flores al 13,98 % y los hongos al 0,27 %. Las porciones verdes depredadas fueron, en su mayor parte, hojas jóvenes, tallos tiernos y brotes, mientras que en el caso de los frutos se trató, en su mayor parte, de frutos caídos.
Las herbáceas, los arbustos y los frutos (principalmente de árboles), se alternaron durante el período de estudio como principales componentes de la dieta (fig. 2). Las graminoideas conformaron, salvo en el mes de Setiembre (fig. 2), junto a enredaderas y hongos una parte relativamente minoritaria de la misma. Dado que se consideró a los frutos en forma aparte, la importancia de los distintos grupos vegetales está referida al consumo de sus porciones verdes y flores (fig. 2). La estrategia trófica de la corzuela parda parece dirigida más hacia determinadas partes vegetales que a las especies (figs. 1, 2), la preferencia por algunas especies solo se manifiestaría cuando las mismas presentan disponibilidad de partes palatables para la corzuela (brotes y porciones reproductivas).
Dentro de los requerimientos nutritivos de los cérvidos, BRAZA et al. (1994) consideran como los más importantes a: la energía, las proteínas, el agua y el sodio. La digestibilidad del alimento, condiciona en buena medida el acceso a la energía y las proteínas, por lo que la misma resulta de suma importancia en la selección del nutriente. Las partes jóvenes (brotes, hojas y tallos tiernos) y las partes reproductoras de las plantas (flores, frutos y semillas) son consideradas de gran valor nutricional (alto contenido de proteínas, carbohidratos y agua) y fácil digestión (bajo contenido de fibras) (GWYNNE & BELL, 1968; BELL, 1971; HOFFMAN, 1973; LU, 1988; PUTMAN, 1988; ERMEST, 1989; SORIGUER et al. 1994). El tipo de partes vegetales seleccionadas por la corzuela la ubicarían, acorde a nuestras observaciones, dentro del gradiente propuesto por HOFFMAN (1973), en la categoría de selectores concentrados; es decir consumidores de brotes, renuevos, flores y frutos. Es importante destacar que, si bien numerosas especies de rumiantes de pequeño tamaño y hábitat boscoso encajan en esta categoría (BARRETTE, 1987), la misma no es absoluta y existen ejemplos de grandes rumiantes que son selectores concentrados y pequeños rumiantes con estrategias tróficas intermedias (KAY, 1987; PUTMAN,1988). Dada la escasez de conocimientos sobre la dieta de la corzuela en ambientes secundarios la determinación de su estrategia trófica, permitirá determinar una parte importante de sus requerimientos de hábitat.
Los datos obtenidos para la corzuela parda coinciden con otras investigaciones según las cuales los pequeños rumiantes seleccionan partes vegetales con una mayor concentración de energía digerible (frutos, semillas, flores y brotes), en relación a animales más grandes (BELL, 1971; HOBBS et al., 1983). Esto se debe, en parte, a los mayores requerimientos de energía basal de mamíferos pequeños (HOBBS et al., 1983; GRODZINSKI & WEINER, 1984) y la menor capacidad de digerir alimentos fibrosos (hojas maduras y tallos entre otros) que caracteriza a estos rumiantes lo que los condiciona a una dieta altamente selectiva (BELL, 1971; HOBBS et al., 1983; PUTMAN, 1988).
Los selectores concentrados se comportan de manera oportunista respecto de las especies consumidas y por otro lado, son especialistas en el consumo de las porciones más nutritivas de las plantas (brotes, renuevos y frutos) (PUTMAN, 1988). En este sentido, sin bien la corzuela muestra preferencia por algunas especies, esta es marcadamente estacional (tab. I) y estaría en función de la oferta de frutos, flores, brotes y renuevos de dichas especies. La baja incidencia de las graminoideas dentro de la dieta (tab. I, fig. 2) podría deberse a su alto contenido de fibras y su relativa baja digestibilidad. El relativamente alto consumo de graminoideas en Setiembre (comienzos de primavera), estuvo centrado fundamentalmente en dos especies (Sorghum sp. y Cynodon dactylon). Esto podría deberse a que esta época corresponde a la estación de crecimiento para la mayoría de las plantas del área de estudio, condiciones estas en la que las plantas en general tienen una mayor digestibilidad (PUTMAN, 1988; ERMEST, 1989; Rodríguez Berrocal, 1979 apud ALVAREZ & RAMOS, 1992). Consumidores selectivos que viven en hábitats abiertos como el ciervo acuático chino Hydropotes inermis Swinhoe, 1870 pastan de igual modo sobre partes jóvenes de herbáceas y gramíneas (PUTMAN, 1988).
Los hongos son parte importante de la dieta de la corzuela colorada (Mazama americana) en Surinam (BRANAN et al., 1985) y en Yungas, observamos su consumo cada vez que una corzuela se encontraba con ellos. La baja ocurrencia de estos en el área de estudio sería la razón de su escasa representación en el espectro observado (fig. 2).
La dieta de las corzuelas incluyó también el aporte de elementos no vegetales de origen inorgánico (geofagia) y animal (fundamentalmente ectoparásitos), además de osteofagia y coprofagia. El consumo de garrapatas, (Ixodida, Ixodidae) de la especie Haemaphysalis kohlsi Aragão & Fonseca, 1951, forma parte de un comportamiento de limpieza entre congéneres o aloaseo (JULIÁ & RICHARD, 1995). Este comportamiento fue observado en los meses de Octubre, Noviembre y Enero y tendría implicancias etológicas vinculadas a funciones principalmente antiparasitarias y de apaciguamiento del comportamiento agresivo intraespecífico (JULIÁ & RICHARD, 1995).
El valor nutricional del consumo de artrópodos no está claro, ya que si bien se trata de un comportamiento fundamentalmente social, se observó también la depredación de un pequeño lepidóptero no identificado, de una garrapata sobre un arbusto (ambos fuera del período de estudio) y de garrapatas en otros animales como el tapir (Tapirus terrestris Linnaeus, 1758). La ingesta de pequeños artrópodos, podría ser una fuente complementaria, de nutrientes en la dieta de la corzuela y no solo formar parte de un comportamiento social, dado que no se restringe al aseo de congéneres. Vinculado al consumo de proteínas de origen animal BODMER (1989) encontró pequeños restos de carne no identificada en un 12 % de los estómagos de corzuela parda analizados en la Amazonía peruana. Pequeños rumiantes o ungulados tipo rumiante de bosques tropicales, consumen habitualmente animales como fuente extra de proteínas (BODMER, 1989).
La geofagia consistió en el consumo de ladrillos de una pequeña construcción durante el mes de Enero y sal y barro en Febrero. En los lugares donde se realizaron estas observaciones había evidencia de que este comportamiento era relativamente común (desgaste de ladrillos y panes de sal). Este y el consumo de huesos de ave (observado durante el mes de Diciembre), estaría dirigido a incorporar minerales escasos en la dieta o cubrir deficiencias en la misma, sobre todo sodio (sal) y fósforo (huesos). El análisis químico de las muestras de ladrillos (los más consumidos entre las observaciones de geofagia) muestra altos porcentajes de fósforo, calcio, hierro, sodio, potasio, magnesio y manganeso (tab. II). En zonas húmedas y barrosas del Norte de Argentina es común observar a las corzuelas en "barreros" o "lambederos", en donde consumen bocados de barro ricos en minerales y sal (CHÉBEZ & JOHNSON, 1984; RICHARD et al., 1995). El consumo de arcillas (ladrillos en este caso) podría tener asimismo la función de absorber los productos secundarios tóxicos de las plantas, acorde a observaciones realizadas en primates (OATES, 1978) y rumiantes (SMITH, 1992). Los comportamientos de geofagia, osteofagia y carnivoría en el ganado vacuno han sido asociados a deficiencias de nutrientes, principalmente sodio y fósforo, como consecuencia de su crianza en hábitats con suelos de baja fertilidad (WALLISDEVRIES, 1996).
La osteofagia ha sido registrada en numerosos rumiantes (SEKULIC & ESTES, 1977; BARRETTE, 1985; SCHMIDT-NIELSEN, 1994) y tendría por finalidad suplir deficiencias de fosfatos en la dieta (SCHMIDT-NIELSEN, 1994). BARRETTE (1985) consideró que dado que el metabolismo del fósforo y del calcio (otro constituyente fundamental del hueso) están estrechamente ligados, resulta razonable pensar también que este comportamiento está destinado a mantener el balance de estos elementos en el organismo. En este sentido, el consumo de volteos viejos y de suelos ricos en minerales es común en ciervos con cornamentas en crecimiento (BARRETTE, 1985; PUTMAN, 1988). En el caso de las corzuelas estudiadas, la osteofagia fue observada en una hembra preñada, en tanto que la geofagia fue más frecuente en hembras que en machos. Ambos comportamientos como un síntoma claro de falta de minerales en la dieta y en especies como el ciervo axis Axis axis (Erxleben, 1777), su ocurrencia ha sido correlacionada con la baja disponibilidad de minerales en los distintos hábitats (BARRETTE, 1985). Esto nos permite interpretar preliminarmente que, en el área de estudio, la osteofagia y geofagia, posiblemente estén más vinculadas con las necesidades nutricionales propias de la gestación y/o detoxificación, que con el desarrollo de las pequeñas astas de los machos.
La interpretación de los resultados muestra a la corzuela como un herbívoro altamente selectivo en cuanto a las partes vegetales de mayor contenido energético y fácil digestibilidad, con una marcada tendencia hacia la frugivoría cuando el recurso está disponible. Los ambientes secundarios parecen favorecer a las corzuelas por la elevada disponibilidad de partes vegetales jóvenes, especialmente en la época en que escasean los frutos. Las técnicas de observación directa permitieron identificar componentes de la dieta que por su baja frecuencia o composición no podrían ser identificados por otros medios, pero cuya importancia en el correcto balance nutricional de la especie aparenta ser significativa.
Agradecimientos. Deseamos expresar nuestro agradecimiento a la Dra. María Rosa Figueroa Romero, Jefa del Laboratorio de Taxonomía Vegetal Fanerogámica del Area Botánica de la Fundación Miguel Lillo, por su colaboración en la corrección de los nombres científicos botánicos empleados en la tabla I.
Recebido em 08.07.2000; aceito em 04.10.2000
2. Laboratorio de Campo para el Estudio de Vertebrados Neotropicales, Facultad de Ciencias Naturales e Instituto Miguel Lillo, casilla de correo 454; 4000, Tucumán, Argentina. (enrique.richard@tucbbs.com.ar)
- ACEŃOLAZA, P. G. 1989. Flora fanerogámica de la Reserva de Flora y Fauna de Horco Molle, Provincia de Tucumán. Serie Monográfica y Didáctica, Tucumán, 4:7-20.
- ALVAREZ, G. & RAMOS, J. 1992. Dieta del corzo (Capreolus capreolus) en una localidad mediterránea (Quintos de Mora, Montes de Toledo). Doñana, Acta Vertebrata, Sevilla, 19:107-114.
- BARRETTE, C. 1985. Antler eating and antler growth in wild Axis deer. Mammalia, Paris, 49:491-499.
- __. 1987. The comparative behaviour and ecology of chevrotains, musk deer, and morphologically conservative deer. In: WEMMER C. M. ed. Biology and Management of the Cervidae,Washington, DC, Smithsonian Institution. p. 200-213.
- BELL, R. H. V. 1971. A grazing ecosystem in the Serengeti. Scient. Am., New York, 225:86-93.
- BODMER, R. E. 1989. Ungulate biomas in relation to feeding strategy within Amazonian forest. Oecologia, Berlin, 81:547-550.
- __. 1990. Responses of ungulates to seasonal inundations in the Amazonan floodplain. J. Trop. Ecology, Cambridge, 6:191-201.
- __. 1991. Strategies of seed dispersal and seed predation in amazonian ungulates. Biotropica, Washington, DC, 23:255-261.
- BRANAN, W. V.; WEKHOVEN, M. C. & MARCHINTON, R. L. 1985. Food habits of brocket and white - tailed deer in Suriname. J. Wild. Manage., Maryland, 49:972-976.
- BRAZA, F.; SAN JOSÉ, C. et al. 1994. El corzo Andaluz Sevilla, Junta de Andalucía. Consejería de Agricultura y Pesca. Dirección General de Desarrollo Forestal. Serie Monografía. 156 p.
- CABRERA, A. L. 1971. Fitogeografía de República Argentina. Bol. Soc. Argen. Bot., Buenos Aires, 14 (12):1-42.
- CHÉBEZ, C. & JOHNSON, A. 1984. Las corzuelas. CEAL Fauna Argentina, Buenos Aires, 77:1-33.
- ERMEST, K. A. 1989. Insect herbivory on a tropical understory tree: effects of leaf age and habitat. Biotropica, Washington, DC, 21:194-199.
- GRODZINSKI, W. & WEINER, J. 1984. Energetics of small and large mammals. Act. Zool. fenn., Helsinforsiae, 172:7-10.
- GWYNNE, M. D. & BELL, R. H. 1968. Selection of vegetation components by grazing ungulates in the Serengeti National Park. Nature, London, 220:390-393.
- HOBBS, N. T.; BAKER, D. L. & GILL, R. B. 1983. Comparative nutritional ecology of montane ungulates during winter. J. Wild. Manage., Maryland, 47 (1):116.
- HOFFMAN, R. R. 1973. The ruminant stomach Nairobi, East African Literature Bureau. 350 p.
- JULIÁ, J. P. & RICHARD, E. 1995. The cleanliness behavior in brown brocket deer (Mazama gouazoupira) (Mammalia - Cervidae). Com. Biol., Buenos Aires, 13 (3):308.
- KAY, R. N. B. 1987. The comparative anatomy and physiology of digestion in Tragulids and Cervids and its relation to food intake. In: WEMMER C. M. ed. Biology and Management of the Cervidae. Washington, DC, Smithsonian Institution. p. 214-222.
- LU, C. D. 1988. Grazing behavior and diet selection of goats. Small Rumin. Res., Amsterdan, 1:205-216.
- MATTEUCCI, S. D. & COLMA, A. 1982. Metodología para el estudio de la vegetación Washington, DC, Secretaría General de la OEA, Programa Regional de Desarrollo Científico y Tecnológico. 163 p.
- NUDDS, T. D. 1980. Forage «preference»: Theoretical consideration of diet selection by deer. J. Wildl. Manage., Maryland, 44:735-740.
- OATES, J. F. 1978. Water-plant and soil consumption by Guereza Monkeys (Colobus guereza) a relationship with minerals and toxins in the diet? Biotropica, Washington, DC, 10:241-253.
- PINDER, L. & LEEUWENBERG, F. 1997. Veado-catingueiro (Mazama gouazoubira Fisher, 1814). In:Duarte, J. M. B. ed. Biologia e Conservação de Cervídeos Sul - Americanos: Blastoceros, Ozotoceros e Mazama Jaboticabal, FUNEP. p. 60-68.
- PUTMAN, R. 1988. The natural history of deer Ithaca, Comstock. 191 p.
- REDFORD, K. H. & EISEMBERG, J. F. 1992. Mammals of the neotropics. The southern cone. Chicago, University of Chicago. v. 2, 430 p.
- RICHARD, E.; JULIÁ, J. P. & ACEŃOLAZA, P. 1995. Hábitos frugívoros de la corzuela parda (Mazama gouazoubira Fischer, 1814) (Mammalia Cervidae), en un ambiente secundario de Yungas. Doñana Acta Vertebrata, Sevilla, 22 (1-2):19-28.
- RICHARD, E.; JULIÁ, J. P. et al. 1995. La corzuela parda. Serie Monográfica y Didáctica, Tucumán, 22:1-35.
- SCHMIDT-NIELSEN, K. 1994. How are control systems controlled ? Am. Scient., New Haven, 82:38-44.
- SMITH, G. S. 1992. Toxification and detoxification of plant compounds by ruminant: an overview. J. Range Mgmt., Portland, 45:25-30.
- SEKULIC, R. & ESTES, J. R. D. 1977. A note on bone chewing in the sable antelope in Kenya. Mammalia, Paris, 41:537-539.
- SORIGUER, R. C.; FANDOS, P. et al. 1994. El ciervo en Andalucía Andalucía, Ed. Junta de Andalucía. 244 p.
- STALLINGS, J. R. 1984. Notes on feeding habits of Mazama gouazoubira in the Chaco Boreal of Paraguay. Biotropica, Washington, DC, 16:155-157.
- WALLISDEVRIES, M. F. 1996. Nutritional limitations of free-ranging cattle: the importance of habitat quality. J. appl. Ecol., Oxford, 33 (4):688-702.
- ZULOAGA, F. O. & MORRONE,O. 1999. Catálogo de las plantas vasculares de la República Argentina II Monographs in systematic botanic from the Misouri Botanical Garden, Misouri. 1269p.
Fechas de Publicación
-
Publicación en esta colección
05 Dic 2006 -
Fecha del número
Mayo 2001
Histórico
-
Acepto
04 Oct 2000 -
Recibido
08 Jul 2000