Resumos
Utilizando-se da microscopia de luz e de varredura, são descritos e ilustrados os ovos dos seguintes Heliconiini (Lepidoptera, Nymphalidae) do Rio Grande do Sul (Brasil): Agraulis vanillae maculosa (Stichel, 1907), Dione juno juno (Cramer, 1779), Dione moneta moneta Hübner, 1825, Dryadula phaetusa (Linnaeus, 1758), Dryas iulia alcionea (Cramer, 1779), Philaethria wernickei (Röber, 1906), Eueides isabella dianasa (Hübner, 1806), Eueides aliphera aliphera (Godart, 1819), Heliconius ethilla narcaea Godart, 1819, Heliconius besckei Ménétriés, 1857 e Heliconius erato phyllis (Fabricius, 1775). Com base em diferenças morfológicas genéricas e ultraestruturais, associadas aos padrões de uso das plantas hospedeiras, elaborou-se uma chave dicotômica para a identificação das espécies.
Heliconíneos; imaturos; plantas hospedeiras; ultraestrutura coriônica
Based upon light and scanning electron microscopy, the external morphology of the egg stage is described and illustrated for the following Heliconiini (Lepidoptera, Nymphalidae) from Rio Grande do Sul State, Brazil: Agraulis vanillae maculosa (Stichel, 1907), Dione juno juno (Cramer, 1779), Dione moneta moneta Hübner, 1825, Dryadula phaetusa (Linnaeus, 1758), Dryas iulia alcionea (Cramer, 1779), Philaethria wernickei (Röber, 1906), Eueides isabella dianasa (Hübner, 1806), Eueides aliphera aliphera (Godart, 1819), Heliconius ethilla narcaea Godart, 1819, Heliconius besckei Ménétriés, 1857, and Heliconius erato phyllis (Fabricius, 1775). A dichotomic key is provided for their identification, based upon differences at the levels of generic and ultrastructural morphology, and variation in host-plant use.
Chorionic ultrastructure; egg morphology; heliconian butterflies; host-plants
O estágio de ovo dos Heliconiini (Lepidoptera, Nymphalidae) do Rio Grande do Sul, Brasil1 1 Contribuição nº 453 do Departamento de Zoologia da Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil.
The egg stage of Heliconiini (Lepidoptera, Nymphalidae) from Rio Grande do Sul, Brazil
Rafael Dell'ErbaI, II; Lucas A. KaminskiIII; Gilson R. P. MoreiraIII
IPPG Entomologia, Departamento de Zoologia, Universidade Federal do Paraná, Caixa Postal 19020, 81531-990 Curitiba, PR, Brasil
IIDepartamento de Ciências Biológicas, Universidade do Estado de Mato Grosso, Caixa Postal 08, 78690-000 Nova Xavantina, MT, Brasil. (rafaeldellerba@yahoo.com.br)
IIIDepartamento de Zoologia, Instituto de Biociências, Universidade Federal do Rio Grande do Sul, Av. Bento Gonçalves, 9500, 91501-970 Porto Alegre, RS, Brasil. (lucaskaminski@yahoo.com.br, gilson.moreira@ufrgs.br)
RESUMO
Utilizando-se da microscopia de luz e de varredura, são descritos e ilustrados os ovos dos seguintes Heliconiini (Lepidoptera, Nymphalidae) do Rio Grande do Sul (Brasil): Agraulis vanillae maculosa (Stichel, 1907), Dione juno juno (Cramer, 1779), Dione moneta moneta Hübner, 1825, Dryadula phaetusa (Linnaeus, 1758), Dryas iulia alcionea (Cramer, 1779), Philaethria wernickei (Röber, 1906), Eueides isabella dianasa (Hübner, 1806), Eueides aliphera aliphera (Godart, 1819), Heliconius ethilla narcaea Godart, 1819, Heliconius besckei Ménétriés, 1857 e Heliconius erato phyllis (Fabricius, 1775). Com base em diferenças morfológicas genéricas e ultraestruturais, associadas aos padrões de uso das plantas hospedeiras, elaborou-se uma chave dicotômica para a identificação das espécies.
Palavras-chave: Heliconíneos, imaturos, plantas hospedeiras, ultraestrutura coriônica.
ABSTRACT
Based upon light and scanning electron microscopy, the external morphology of the egg stage is described and illustrated for the following Heliconiini (Lepidoptera, Nymphalidae) from Rio Grande do Sul State, Brazil: Agraulis vanillae maculosa (Stichel, 1907), Dione juno juno (Cramer, 1779), Dione moneta moneta Hübner, 1825, Dryadula phaetusa (Linnaeus, 1758), Dryas iulia alcionea (Cramer, 1779), Philaethria wernickei (Röber, 1906), Eueides isabella dianasa (Hübner, 1806), Eueides aliphera aliphera (Godart, 1819), Heliconius ethilla narcaea Godart, 1819, Heliconius besckei Ménétriés, 1857, and Heliconius erato phyllis (Fabricius, 1775). A dichotomic key is provided for their identification, based upon differences at the levels of generic and ultrastructural morphology, and variation in host-plant use.
Keywords: Chorionic ultrastructure, egg morphology, heliconian butterflies, host-plants.
As espécies de Heliconiini (Lepidoptera, Nymphalidae) se distribuem do sul dos Estados Unidos até o Uruguai (DEVRIES, 1987). Atualmente o grupo possui cerca de 70 espécies (BROWN, 1981), distribuídas em 10 gêneros (PENZ, 1999). As espécies são multivoltinas (BROWN, 1992), com a maior diversidade na bacia Amazônica (DEVRIES, 1987).
Os adultos são impalatáveis à maioria dos predadores potenciais (HOLZINGER & HOLZINGER, 1994), vivem de 90 a 180 dias (BROWN, 1992) e muitas espécies possuem características peculiares como alimentação à base de pólen (GILBERT, 1972) e agrupamento noturno (CRANE, 1957). A oviposição é feita em diversas partes da planta hospedeira (Passifloraceae), podendo ser isolada ou agregada (BEEBE et al., 1960; BROWN, 1981). As larvas são crípticas nos ínstares iniciais e apresentam coloração destacada no último instar (BROWN, 1981). As pupas possuem coloração variável, entre as espécies (BEEBE et al., 1960; TURNER, 1968) e/ou durante a ontogênese (BROWN, 1972; BROWN & BENSON, 1977; ANTUNES et al., 2002).
Devido à sua destacada coloração no estágio adulto, participação em anéis miméticos e variabilidade geográfica, esses organismos têm chamado a atenção para diversos estudos dentro da biologia e hoje são considerados um dos grupos de insetos mais bem estudados (BENSON et al., 1976; TURNER, 1977; BROWN, 1981; GILBERT, 1991; PENZ, 1999). No entanto, os estágios imaturos permanecem pouco estudados em relação à morfologia genérica e ultraestrutural, cujas informações se restringem basicamente aos trabalhos de BEEBE et al. (1960) e BROWN (1981). Nesse sentido, os primeiros estudos detalhados em microscopia eletrônica de varredura foram concluídos recentemente por ANTUNES et al. (2002), TAVARES et al. (2002), KAMINSKI et al. (2002) e PAIM et al. (2004).
Pela facilidade de criação dos adultos e cultivo das plantas hospedeiras, as espécies de Heliconiini têm sido também utilizadas em diversos estudos de interação inseto-planta, principalmente no Rio Grande do Sul (RS) (ex. MENNA-BARRETO & ARAÚJO, 1985; PÉRICO o & ARAÚJO, 1991; RODRIGUES & MOREIRA, 1999; KERPEL & MOREIRA, 2005). A identificação correta dos estágios imaturos de cada espécie, seja em condições de campo ou laboratório, bem como a caracterização da ultraestrutura correspondente, são pré-requisitos essenciais para estudos futuros, principalmente de caráter comportamental e ecológico. Objetiva-se: caracterizar a morfologia externa do ovo baseada em microscopia óptica e de varredura, elaborar chave dicotômica para as 11 espécies encontradas no RS e fornecer informações gerais sobre a biologia referente a este estágio.
MATERIAL E MÉTODOS
Das 44 espécies de Heliconiini que ocorrem no Brasil (BROWN, 1992), 12 são assinaladas para o RS (tab. I), sendo 11 analisadas no presente trabalho.
Heliconius melpomene nanna Stichel, 1899 é citada por BROWN (1979) e HOLZINGER & HOLZINGER (1994) para o RS, supostamente com base em material existente no exterior (Zoologische Sammlung des bayrischen Staates, Munique) e no Brasil (Departamento de Zoologia, Universidade Federal do Paraná, Curitiba), coletado em meados do século passado por Ceslau M. de Biezanko, da Faculdade de Agronomia Eliseu Maciel, Pelotas, RS. Os espécimes citados por BROWN (1979) não foram localizados na coleção do Departamento de Zoologia da Universidade Federal do Paraná. Também não foi encontrado na coleção C.M. Biezanko material adicional de H. melpomene nanna, a qual jamais foi coletada por nossa equipe em exaustivos estudos realizados no RS nos últimos dez anos. Tal subespécie é de reconhecida ocorrência do estado do Rio Grande do Norte ao Espírito Santo, raramente no Rio de Janeiro e ocasionalmente até Santa Catarina (BROWN & MIELKE, 1972; K.S. Brown Jr; comunic. pess.). Dessa forma, consideramos duvidosa a presença atual de H. melpomene nanna no estado, razão pela qual não foi incluída na análise. Da mesma forma procedeu-se em relação às outras espécies [ex. Eueides pavana Ménétriés, 1857 e Heliconius sara apseudes (Hübner, 1809)] que ocorrem na Mata Atlântica, no sul do estado de Santa Catarina, e assim poderiam ser eventualmente coletadas no limite nordeste do RS (A. M. Araújo, comunic. pess.).
Os espécimes utilizados foram provenientes de diversas localidades do RS. Os adultos foram coletados no campo e trazidos para oviposição no insetário do Departamento de Zoologia da UFRGS, sendo mantidos conforme método descrito por MUGRABI-OLIVEIRA & MOREIRA (1996b). Algumas coletas de ovos foram feitas diretamente nas plantas hospedeiras, na ausência dos adultos. Nesses casos, alguns ovos eram fixados e outros levados para criação no laboratório e posterior confirmação da espécie. Utilizou-se fluído de Dietrich para a fixação do material e etanol a 70% para a preservação. As fotografias referentes ao padrão de coloração foram efetuadas sobre os ovos mantidos em placas de Petri contendo papel filtro umedecido, para o desenvolvimento embrionário.
O material examinado encontra-se depositado no Laboratório de Morfologia e Comportamento de Insetos da UFRGS (LMCI-UFRGS), Porto Alegre, Brasil, sob os seguintes códigos: 108-1, Agraulis vanillae maculosa, Porto Alegre, RS, 14.II.2002, Kaminski, L. A.; 109-1, Dione juno juno, Porto Alegre, RS, 2000, Tavares, M.; 110-1, Dione moneta moneta, Porto Alegre, RS, 12.VI.2001, Kaminski, L. A.; 103-1, Dryadula phaetusa, Eldorado do Sul, RS, 14.V.2002, Dell'Erba, R. & Kaminski, L. A.; 113-1, Dryas iulia alcionea, Porto Alegre, RS, 1997, Paim, A. C.; 104-1, Philaethria wernickei, Barra do Ouro, RS, 12.V.2002, Kaminski, L. A. et al. e 115-1, Barra do Ouro, RS, 21.XII.2002, Kaminski, L. A. & Dell'Erba, R.; 103-6, Eueides isabella dianasa, Eldorado do Sul, RS, 14.V.2002, Dell'Erba, R. & Kaminski, L. A.; 107-1, Eueides aliphera aliphera, Derrubadas, RS, 20.VI.2002, Moreira, G. R. P. et al.; 105-1, Heliconius ethilla narcaea, Barra do Ouro, RS, 04.II.2002, Kaminski, L. A. e 116-1, Alvorada, RS, 08.I.2003, Kaminski, L. A.; 106-3, Heliconius besckei, Barra do Ouro, RS, 14.XII.2001, Kaminski, L. A. e 127-1, Curitiba, PR, 27.II.2003, Kaminski, L. A. & Dell'Erba, R.; 117-1, Heliconius erato phyllis, Porto Alegre, RS, 30.I.2003, Dell'Erba, R.
As medidas referentes ao diâmetro, altura, número de carenas verticais e horizontais foram feitas em estereomicroscópio, acoplado com escala micrométrica. O desenho esquemático dos caracteres gerais foi feito de forma similar, substituindo-se a escala por uma grade micrométrica e as fotos do padrão de coloração realizadas com câmera fotográfica digital acoplada a estereomicroscópio. As observações ultraestruturais de microscopia eletrônica de varredura foram feitas a partir de, no mínimo, cinco exemplares. Para isso, primeiramente o material foi desidratado em ponto crítico, montado sobre fita dupla-face em stubs metálicos, metalizado com ouro e observado/fotografado em um microscópio eletrônico de varredura JEOL JSM-5800.
A nomenclatura para as espécies de Passifloraceae segue o trabalho de SACCO (1980). Para o estágio de ovo adotou-se a terminologia usada por ANTUNES et al. (2002). Para a apresentação das espécies utilizou-se a ordem filogenética segundo PENZ (1999).
RESULTADOS E DISCUSSÃO
Conforme já conhecido para outras espécies de Heliconiini (BEEBE et al., 1960), os ovos das espécies que ocorrem no Rio Grande do Sul são em geral subcilíndricos (fig. 1), achatados na base e raramente subesféricos. A coloração é branco-esverdeada a vermelha e em algumas espécies, próximo à eclosão, aparecem, por transparência, manchas devido ao desenvolvimento de pigmentos no embrião (figs. 2-17).
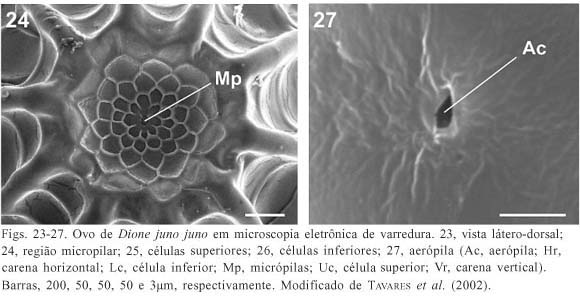
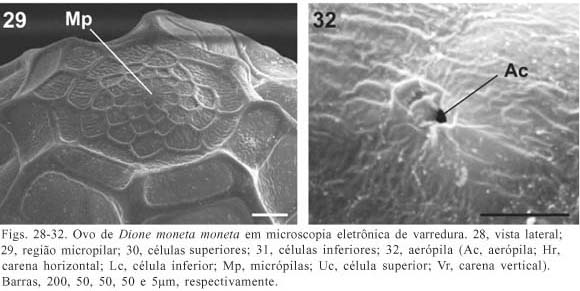
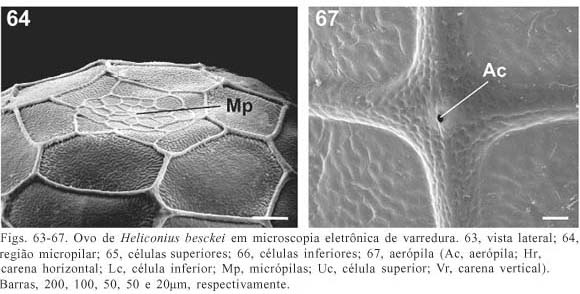
O eixo micropilar (linha imaginária entre os pólos anterior e posterior) dos ovos de Heliconiini situa-se em posição perpendicular ao substrato, assim como observado em Papilionoidea e Noctuoidea (HINTON, 1981). Após a oviposição, os pólos anterior (Ap, fig. 1) e posterior (Pp, fig. 1) assumem posição superior (ápice) e inferior (base), respectivamente (ANTUNES et. al., 2002). Seguindo o padrão para Lepidoptera, a região micropilar (Mp, fig. 19) situa-se no pólo anterior (HINTON, 1981) e subdivide-se em ânulo (uma ou mais fileiras de células em volta das micrópilas) e roseta (primeira fileira de células ao redor das micrópilas) (DOWNEY & ALLYN, 1981).
O cório é ornamentado por carenas verticais (Vr, fig. 1) e horizontais (Hr, fig.1) (BEEBE et al., 1960). Algumas carenas verticais são menores e não atingem o topo do ovo (MUYSHONDT et al., 1973; TAVARES et al., 2002). As carenas delimitam as células que, de acordo com sua posição, podem ser superiores (Uc, fig. 1) ou inferiores (Lc, fig. 1) quando localizadas nestas regiões do ovo respectivamente (KAMINSKI et al., 2002).
Nas intersecções das carenas, situam-se as aerópilas (Ac, fig. 22), que são pequenas aberturas no cório, em geral circulares, responsáveis pelas trocas gasosas do ovo (HINTON, 1969, 1970, 1981; DOWNEY & ALLYN, 1981).
Chave para identificação de ovos de Heliconiini do RS
Ovos com altura maior que o diâmetro; coloração em geral amarela (com ou sem manchas marrons) ou vermelha ............................................................. 3
2(1). Carenas verticais mais largas que as horizontais na metade inferior do ovo
(figs. 48, 51); superfície das carenas na metade superior coberta por rugosidades no centro, seguidas de uma crista em linha (fig. 52); células com ângulos internos arredondados (figs. 50, 51) ............. Eueides isabella dianasa
Carenas verticais e horizontais com a mesma largura na metade inferior do ovo (fig. 56); carenas da metade superior com superfície lisa (fig. 55); células com ângulos internos agudos (figs. 55, 56) ............. Eueides aliphera aliphera
3(1). Carenas horizontais desalinhadas em todo cório (figs. 43, 46); região micropilar pouco definida (fig. 44); diâmetro geralmente maior que 1mm ...................... ............................................................................ Philaethria wernickei
Carenas horizontais não como acima ....................................................... 4
4(3). Ovos com as carenas verticais mais largas que as horizontais (fig. 21) (em geral o dobro ou mais), dispostas em todo ovo ou parcialmente .......................... 5
Ovos com carenas verticais e horizontais de mesma largura......................... 7
5(4). Carenas verticais mais largas que as horizontais em todo o ovo (figs. 23, 28 ); depressões acentuadas entre as carenas verticais (fig. 24) ...................... 6
Carenas verticais e horizontais com largura subigual na porção superior do ovo (fig. 20); ausência de depressões acentuadas entre as carenas verticais ....... ..................................................................... Agraulis vanillae maculosa
6(5). Ovos depositados geralmente em pequenos grupos (até 20), de forma aleatória (fig. 12) sobre Passiflora warmingii; diâmetro em torno de 0,9 mm; carenas horizontais bem evidentes (figs. 30 , 31 )..................... Dione moneta moneta
Ovos depositados em grande número (60 a 140), de forma eqüidistante
(fig. 10), diâmetro do ovo em torno de 0,55 mm; carenas horizontais pouco pronunciadas, principalmente na metade inferior (fig. 26) ....... Dione juno juno
7(4). Superfície das carenas lisa (fig. 37) ....................................................... 8
Superfície das carenas coberta por rugosidades (fig. 72) ............................ 9
8(7). Altura geralmente acima de 1,5 mm; região micropilar côncava, com nítidas carenas no entorno (fig. 34) ....................................... Dryadula phaetusa
Altura abaixo de 1,3 mm, região micropilar não como acima; ovos geralmente depositados sobre gavinhas secas. Pólo posterior geralmente mais estreito que o anterior (fig. 38) .............................................. Dryas iulia alcionea
9(7). Presença de carenas elevadas circundando a região micropilar (figs. 68, 69); rugosidades nas carenas seguidas de crista suave no centro, só observada próximo das aerópilas (fig. 72); oviposição sempre isolada ..........................
........................................................................ Heliconius erato phyllis
Ausência de carenas elevadas circundando a região micropilar (figs. 58, 63 ); rugosidades nas carenas seguidas de crista em linha (fig. 61); oviposição variando de um a cinco ovos ................................................................
....................................... Heliconius ethilla narcaea ou Heliconius besckei.
Agraulis vanillae maculosa (Stichel, 1907)
Descrição. Coloração amarela (fig. 2) e próximo à eclosão aparecem manchas marrons (fig. 3) (BEEBE et al., 1960; BROWN, 1981). Possui a base plana e o ápice levemente afilado (fig. 18). A região micropilar (fig. 19) é plana e composta por células pentagonais a heptagonais. As células maiores do ânulo tendem à superfície lisa, enquanto que as menores têm rugosidades em toda superfície, incluindo as células da roseta. No centro da roseta localizam-se as micrópilas (Mp, fig. 19).
Dimensões (média + erro padrão, n = 10): 0,907 + 0,016 mm e 1,084 + 0,014 mm para diâmetro e altura, respectivamente. Tais valores encontram-se próximos aos relatados por BEEBE et al. (1960) e BROWN (1981) para Agraulis vanillae (Linnaeus, 1758).
Carenas (verticais, Vr; horizontais, Hr) (fig. 18) com superfície lisa. O número de Vr varia de 15 a 19, as Hr de 9 a 12 (n = 10) e a moda correspondente para Vr foi de 17, valores semelhantes aos de BEEBE et al. (1960) e BROWN (1981) e maiores que os encontrados por PETERSON (1970) para Agraulis vanillae incarnata (Riley, 1926). Para Hr, os valores são semelhantes aos dos autores citados. Na porção inferior do ovo, as Vr têm em geral o dobro da largura das Hr (figs. 18, 21). No terço superior as carenas possuem largura subigual (figs. 18, 20). Algumas Vr são menores e se interrompem a uma ou duas células próximo à região micropilar (fig. 18).
As células (superiores, Uc; inferiores, Lc) possuem a superfície lisa e ângulos internos arredondados. As Uc (fig. 20) são retangulares, tetragonais irregulares, pentagonais ou hexagonais e as Lc (fig. 21) retangulares. As aerópilas (Ac, fig. 22) são circulares, sem elevações no peritrema.
Diagnose diferencial. Os ovos de A. vanillae maculosa se assemelham aos de Dryadula phaetusa (Linnaeus, 1758) e Dryas iulia alcionea (Cramer, 1779) por serem depositados isoladamente, apresentarem coloração amarela (com ou sem manchas marrons), Hr alinhadas e superfície das carenas e das células lisa. Em relação a D. iulia alcionea, os ovos de A. vanillae maculosa se diferenciam por serem quase tão largos quanto longos e pela presença de Vr com o dobro ou mais da largura das Hr na metade inferior do ovo (fig. 21). Além dessas características, os ovos de A. vanillae maculosa se diferenciam de D. phaetusa pela ausência de Vr elevadas circundando a região micropilar.
Dados biológicos. A. vanillae maculosa deposita ovos individualmente, sendo generalista quanto ao local de oviposição, que pode ser na superfície adaxial das folhas, gavinhas verdes, secas, meristema apical ou fora da planta (BROWN, 1981; G. L. Garcias, dados não publicados). Não foi observada a oviposição em grupo relatada por TOLEDO (1991b). É a espécie que têm um dos maiores números de plantas hospedeiras no RS (tab. II) (PÉRICO, 1995).
Dione juno juno (Cramer, 1779)
(Figs. 10-11, 23-27)
Descrição. Coloração amarela (fig. 10), tornando-se vermelho ao final do desenvolvimento embrionário (fig. 11) (BEEBE et al., 1960; MUYSHONDT et al., 1973; BROWN, 1981; TOLEDO, 1991a; TAVARES et al., 2002). Segundo TAVARES et al. (2002), possui a base plana e o ápice afilado (fig. 23). A região micropilar pode ser côncava (fig. 24), plana ou convexa. Possui a superfície levemente lisa e, de acordo com os mesmos autores, é composta por células arredondadas a poligonais no ânulo e por células tetragonais a hexagonais na roseta, onde se situam as micrópilas (Mp, fig. 24).
Dimensões (média + erro padrão, n = 10): 0,54 + 0,010 mm e 0,9 + 0,003 mm para diâmetro e altura, respectivamente. Tais valores são menores que relatados por BEEBE et al. (1960) e BROWN (1981), para Dione juno.
Carenas (fig. 23) com superfície lisa. O número de Vr varia de 13 a 15 e Hr de 15 a 16 (n = 10) (TAVARES et al., 2002). Esses valores são maiores que os relatados por BEEBE et al. (1960) para as Vr e menores para as Hr. Comparados com BROWN (1981), que relatou 12 Vr e 5 Hr, os valores obtidos por TAVARES et al. (2002) são maiores, principalmente em relação às Hr. As Vr têm em geral o dobro da largura das Hr (figs. 23, 26). As Hr, além de serem mais finas, são menos pronunciadas (fig. 26) e, em vista dorsal do ovo, assumem um perfil côncavo entre as Vr (fig. 24). Conforme observado por TAVARES et al. (2002), algumas Vr são menores e se interrompem cerca de três a cinco células próximo à região micropilar (fig. 23).
As células possuem a superfície lisa e os ângulos internos arredondados. As Uc (fig. 25) são retangulares ou pentagonais, e as Lc (fig. 26) retangulares (TAVARES et al., 2002). As aerópilas (Ac, fig. 27) são circulares, sem elevações no peritrema (TAVARES et al., 2002).
Diagnose diferencial. Os ovos de D. juno juno se diferenciam das outras espécies analisadas por serem depositados em formas de clusters típicos (fig. 10), de modo que permaneça a mesma distância entre os ovos (G. L. Garcias, dados não publicados). Ao nível de microscopia eletrônica, os ovos D. juno juno apresentam as Hr menos pronunciadas (fig. 26), se comparados com Dione moneta moneta Hübner, 1825 (fig. 31 ).
Dados biológicos. A postura varia de 60 a 140 ovos, que são depositados preferencialmente na extremidade da face abaxial das folhas (BROWN, 1981; G. L. Garcias, dados não publicados), podendo ser encontrada em pecíolos ou caules (DEVRIES, 1987). Utiliza diversas espécies de Passifloraceae no RS (tab. II), sendo os ovos encontrados com mais freqüência em Passiflora edulis (G. L. Garcias, dados não publicados).
Dione moneta moneta Hübner, 1825
(Figs. 12-13, 28-32 )
Descrição. Coloração amarela (BROWN, 1944) e próximo à eclosão da larva aparecem manchas marrons (figs. 12, 13). Não foi observada a coloração branca, relatada por BROWN (1981). Possui a base plana e o ápice afilado (fig. 28 ). A região micropilar pode ser convexa (figs. 28 , 29), plana ou côncava. As células do ânulo são poligonais e as da roseta tendem a ser pentagonais ou hexagonais, todas com suaves rugosidades.
Dimensões (média + erro padrão, n = 10): 0,932 + 0,009 mm e 1,129 + 0,008 mm para diâmetro e altura, respectivamente. Os valores são maiores em relação aos relatados por BROWN (1944) e similares aos de BROWN (1981), ambos para Dione moneta.
Carenas (fig. 28 ) com superfície lisa. O número de Vr varia de 15 a 16 e Hr de 16 a 18 (n = 10). Comparados com BROWN (1981), que obteve 14 Vr e 7 Hr, os valores aqui observados são maiores, principalmente em relação às Hr. As Vr têm em geral o dobro da largura das Hr (figs. 28 , 31 ) e algumas se interrompem de duas a três células próximo à região micropilar (fig. 28 ).
Em geral, as células possuem os ângulos internos arredondados, tendendo ao padrão liso, mas podem apresentar-se com suaves rugosidades, semelhante às observadas na região micropilar. As Uc (fig. 30 ) variam de retangulares a pentagonais e as Lc (fig. 31 ) são retangulares. As aerópilas (Ac, fig. 32) são circulares, sem elevações no peritrema.
Diagnose diferencial. Os ovos de D. moneta moneta se distinguem das outras espécies por serem depositados em Passiflora warmingii, geralmente em pequenos grupos e de maneira não ordenada (fig. 12). Em microscopia eletrônica, se diferenciam de D. juno juno por apresentarem as Hr mais evidentes (fig. 31 ).
Dados biológicos. Os ovos de D. moneta são depositados individualmente (BROWN, 1944; BROWN, 1981; DEVRIES, 1987) ou em pequenos grupos (fig. 12) de até 20 ovos, na face abaxial das folhas jovens, gavinhas, caules, ou brotos (BROWN, 1944; BROWN, 1981; G. L. Garcias, dados não publicados). D. moneta moneta é seletiva quanto à espécie de Passiflora (BENSON et al., 1976), com registro de apenas uma planta hospedeira no Estado (tab. II).
Dryadula phaetusa (Linnaeus, 1758)
(Figs. 4-5, 33-37)
Descrição. Coloração amarela (fig. 4), apresentando-se com manchas marrons (fig. 5) ao final do desenvolvimento embrionário (BEEBE et al., 1960; BROWN, 1981). Possui a base plana e o ápice levemente afilado (fig. 33). A região micropilar é côncava, com nítidas Vr elevadas (fig. 34). As células do ânulo e roseta possuem suaves rugosidades e variam do formato tetragonal ao hexagonal.
Dimensões (média + erro padrão, n = 10): 1,121 + 0,015 mm e 1,606 + 0,015 mm para diâmetro e altura, respectivamente. Os valores são similares aos encontrados por BEEBE et al. (1960) e BROWN (1981).
Carenas (fig. 33) com superfície lisa. O número de Vr varia de 17 a 19 e Hr de 15 a 16 (n = 10). Os valores são similares aos encontrados por BEEBE et al. (1960); comparados com os obtidos por BROWN (1981), os valores encontrados são semelhantes para as Vr e menores para as Hr. As carenas possuem larguras aproximadamente iguais (figs. 33, 36). As Vr menores se interrompem de uma a três células próximo à região micropilar (fig. 33).
As células possuem a superfície lisa, com os ângulos internos arredondados. As Uc (fig. 35) são retangulares, tetragonais irregulares ou pentagonais e as Lc (fig. 36) retangulares. As aerópilas (Ac, fig. 37) são circulares, sem elevações no peritrema.
Diagnose diferencial. O ovo de D. phaetusa se assemelha ao de A. vanillae maculosa e D. iulia alcionea por ser depositado de maneira isolada, apresentar coloração amarela (com ou sem manchas marrons), Hr alinhadas e superfície das carenas e das células lisa. Comparado com D. iulia alcionea, se diferencia por possuir altura maior e pela presença de nítidas Vr circundando a região micropilar (fig. 34). Além dessas características, pode ser diferenciado do ovo de A. vanillae maculosa por possuir Vr e Hr de larguras aproximadamente iguais na metade inferior do ovo (fig. 36).
Dados biológicos. Os ovos são depositados individualmente sobre diversas partes da planta, como na base do caule (BROWN, 1981), superfície adaxial das folhas, gavinhas secas ou verdes. Há registros de apenas uma planta hospedeira para o estado do RS (tab. II).
Dryas iulia alcionea (Cramer, 1779)
Descrição. Coloração amarela (fig. 6), com manchas marrons (fig. 7) ao final do desenvolvimento embrionário (BEEBE et al., 1960; BROWN, 1981; PAIM et al., 2004). Possui a base plana e o ápice achatado, sendo o pólo anterior geralmente mais largo que o posterior (fig. 38). A região micropilar (fig. 39) é levemente côncava e possui suaves rugosidades. No ânulo, as células são tetragonais a hexagonais e na roseta, poligonais, dispostas de forma irregular (PAIM et al., 2004).
Dimensões (média + erro padrão, n = 10): 0,873 + 0,012 mm e 1,19 + 0,018 mm para diâmetro e altura, respectivamente (Paim et al., 2004). Estes valores são similares aos encontrados por BEEBE et al. (1960) e BROWN (1981) para Dryas iulia (Fabricius, 1775).
Carenas (fig. 38) com superfície lisa. O número de Vr varia de 17 a 19 e Hr de 10 a 12 (n = 10) (PAIM et al., 2004). Os valores são menores que os relatados por BEEBE et al. (1960) e BROWN (1981). As carenas possuem larguras aproximadamente iguais (figs. 38, 41). As Vr menores se interrompem de duas a três células próximo à região micropilar (fig. 38).
As células têm a superfície ligeiramente lisa e os ângulos internos arredondados. As Uc (fig. 40) podem variar de retangulares a hexagonais e as Lc (fig. 41) tendem a ser retangulares (PAIM et al., 2004). As aerópilas (Ac, fig. 42) são circulares e geralmente estão situadas sob protuberâncias, denominadas por PAIM et al. (2004) de tampa da aerópila (Ta, fig. 42).
Diagnose diferencial. Conforme já mencionado, o ovo de D. iulia alcionea se assemelha ao de D. phaetusa e de A. vanillae maculosa por ser depositado de maneira isolada, apresentar coloração amarela (com ou sem manchas marrons), Hr alinhadas e superfície das carenas e das células lisa. Diferencia-se de A. vanillae maculosa por possuir Vr e Hr com largura semelhante (fig. 41). Comparado com D. phaetusa, diferencia-se pela altura menor e ausência de Vr pronunciadas circundando a região micropilar.
Dados biológicos. Os ovos, podendo ser encontrados mais de um na mesma planta, são depositados individualmente na região apical, nas folhas ou fora da planta hospedeira, mas geralmente em gavinhas secas (BROWN, 1981; PÉRICO, 1995; G. L. Garcias, dados não publicados). É uma das espécies com maior número de plantas hospedeiras no RS (tab. II); os ovos são encontrados com maior freqüência sobre Passiflora suberosa, P. misera e P. capsularis (PÉRICO & ARAÚJO, 1991; PÉRICO, 1995; G. L. Garcias, dados não publicados).
Philaethria wernickei (Röber, 1906)
Descrição. Coloração amarela (fig. 14) (BROWN, 1981), permanecendo assim até a eclosão. Diferentemente do observado por BEEBE et al. (1960) para Philaethria dido (Clerck, 1764), não se observaram manchas marrons. Possui a base plana e o ápice levemente afilado (fig. 43). A região micropilar, pouco definida se comparada com as outras espécies estudadas (fig. 44), é plana, com a superfície lisa. As células do ânulo e da roseta são tetragonais a hexagonais.
Dimensões (média + erro padrão, n = 10): 1,208 + 0,023 mm e 1,39 + 0,016 mm, para diâmetro e altura, respectivamente. Os valores são menores para a altura e maiores para o diâmetro, se comparados com os relatados por BROWN (1981).
Carenas (fig. 43) com superfície lisa. O número de Vr varia de 19 a 22 e, o de Hr, de 10 a 11 (n = 10). Quando comparados com os dados apresentados por BROWN (1981), os valores são similares para as Vr e maiores para as Hr. As carenas possuem largura aproximada (figs. 43, 46). As Hr são desalinhadas (figs. 43, 46), característica também observada para P. dido por BEEBE et al. (1960). As carenas apresentam suave depressão em linha no centro, entre uma aerópila e outra. As Vr menores se interrompem de duas a cinco células próximo à região micropilar (fig. 43).
As células têm superfície lisa e ângulos internos arredondados. As Uc (fig. 45) variam de tetragonais a hexagonais e as Lc (fig. 46) são tetragonais. As aerópilas (Ac, fig. 47) são circulares, sem elevações no peritrema.
Diagnose diferencial. Os ovos de P. wernickei diferem das outras espécies analisadas pelas Hr desalinhadas (figs. 43, 46).
Dados biológicos. Os ovos são depositados individualmente sobre folhas velhas (BROWN, 1981), gavinhas secas ou verdes. Na maioria das coletas os ovos foram encontrados na superfície adaxial de folhas velhas. Possui cinco plantas hospedeiras assinaladas para o estado (tab. II).
Eueides isabella dianasa (Hübner, 1806)
Descrição. Coloração creme, com tonalidades variando do verde (fig. 8) ao amarelo-pálido, dependendo do estágio de desenvolvimento embrionário (BEEBE et al., 1960; BROWN, 1981; ANTUNES et al., 2002). Tem forma de cúpula, com a base alargada e o ápice levemente afilado (fig. 48). A região micropilar é plana, pentagonal, com suaves rugosidades na superfície (ANTUNES et al., 2002). No material aqui utilizado, também foram observadas regiões levemente côncavas e situadas em células heptagonais (fig. 49). As células do ânulo tendem a ser arredondadas e as da roseta triangulares (ANTUNES et al., 2002).
Dimensões (média + erro padrão, n = 10): 0,82 + 0,01 mm e 0,76 + 0,01 mm para diâmetro e altura, respectivamente (ANTUNES et al., 2002). Os valores são menores que os relatados por BEEBE et al. (1960) e BROWN (1981) para Eueides isabella (Cramer, 1782). Além disso, os respectivos trabalhos apontam altura maior que o diâmetro.
O número de Vr e Hr (fig. 48) varia de 17 a 19, e de 8 a 9 (n = 10), respectivamente (ANTUNES et al., 2002). Tais valores são maiores para as Vr e semelhantes para as Hr, se comparados com os encontrados por BEEBE et al. (1960) e BROWN (1981). As carenas do terço superior têm a superfície lisa nas bordas e rugosa no centro (fig. 52). No meio destas rugosidades, encontra-se uma crista delineada, principalmente próximo às aerópilas (figs. 50, 52) (ANTUNES et al., 2002). A superfície das carenas da metade inferior tende a um padrão ligeiramente rugoso, com suaves linhas no centro (fig. 51). As Vr da metade inferior são mais largas que as Hr (fig. 51), característica não observada para a metade superior (fig. 50). As Vr menores se interrompem de uma a duas células próximo à região micropilar (fig. 48).
As células têm a superfície lisa e possuem os ângulos internos arredondados. As Uc (fig. 50) variam de tetragonais irregulares a hexagonais e as Lc (fig. 51) possuem formato retangular (ANTUNES et al., 2002). As aerópilas (Ac, fig. 52) são arredondadas, com peritrema elevado (ANTUNES et al., 2002). Na superfície das Uc, os mesmos autores observaram algumas aerópilas com peritrema evidentemente delineado, de formato oval e dividido medianamente, sugerindo a existência de uma câmara de ar localizada internamente ao cório.
Diagnose diferencial. Os ovos das espécies de Eueides Hübner, 1816 diferem dos de outras espécies analisadas por possuir diâmetro maior que altura, número de Vr em geral o dobro ou mais que as Hr e pela coloração creme. Os ovos de E. isabella dianasa se distinguem de Eueides aliphera aliphera (Godart, 1819) por apresentar altura maior, Vr da metade inferior mais largas que as Hr (fig. 51), presença de rugosidades nas carenas superiores (fig. 52) e células com ângulos internos arredondados.
Dados biológicos. São depositados um a três ovos na superfície abaxial das folhas (BROWN, 1981) ou fora da planta hospedeira (DEVRIES, 1987). Há apenas uma planta hospedeira registrada para o estado (tab. II).
Eueides aliphera aliphera (Godart, 1819)
Descrição. Coloração creme (fig. 9), variando em diferentes tonalidades (BEEBE et al., 1960; BROWN, 1981). Possui formato de cúpula, com a base plana e o ápice levemente afilado (fig. 53). A região micropilar, de formato heptagonal, pode ser côncava (fig. 54) ou plana. As células do ânulo e da roseta são poligonais e sua superfície tende ao padrão ligeiramente rugoso.
Dimensões (média + erro padrão, n = 10): 0,711 + 0,011 mm e 0,583 + 0,011 mm, para diâmetro e altura, respectivamente. Os valores são similares aos encontrados por BEEBE et al. (1960) e BROWN (1981), para Eueides aliphera.
Carenas (fig. 53) com superfície lisa. O número de Vr varia de 20 a 24, e Hr de 7 a 9 (n = 10). Os valores são maiores que os relatados por BEEBE et al. (1960) e BROWN (1981) para as Vr e semelhantes para as Hr. As Vr e Hr têm a mesma largura (fig. 56); as Hr aparentemente menos pronunciadas quando comparadas com as Vr, dada a convexidade da superfície entre as últimas. As Vr menores se interrompem em uma a duas células próximo à região micropilar (fig. 53).
As células têm a superfície lisa, com os ângulos internos agudos, tendendo ao quadrado. As Uc (fig. 55) são retangulares, quadradas, pentagonais ou hexagonais e as Lc (fig. 56) retangulares ou quadradas. As aerópilas (Ac, fig. 57) são arredondadas, sem elevações no peritrema.
Diagnose diferencial. Conforme já mencionado, os ovos das espécies de Eueides se diferenciam das outras espécies analisadas por possuírem diâmetro maior que altura, pelo número de Vr em geral o dobro ou mais que as Hr e pela coloração creme. Comparados com E. isabella dianasa, os ovos de E. aliphera aliphera diferem por apresentar altura menor, Vr e Hr da metade inferior de largura semelhante (fig. 56), ausência de cristas e rugosidades nas carenas do terço superior do ovo e pelas células com ângulos internos agudos (figs. 55, 56).
Dados biológicos. Os ovos são depositados isoladamente ou em grupos juntos ou separados de quatro a seis, na face abaxial das folhas jovens ou maduras (BROWN, 1981; DEVRIES, 1987; G. L. Garcias, dados não publicados). Utiliza cinco espécies de plantas hospedeiras no estado (tab. II).
Heliconius ethilla narcaea Godart, 1819
Descrição. Coloração amarela (fig. 15) (BROWN, 1981) até a eclosão. Possui a base plana e o ápice levemente afilado (fig. 58). Região micropilar (fig. 59) plana ou levemente côncava. As células do ânulo e da roseta são poligonais, com suaves rugosidades.
Dimensões (média + erro padrão, n = 10): 0,961 + 0,014 mm e 1,442 + 0,033 mm, para diâmetro e altura, respectivamente. Para o diâmetro, os valores são similares aos relatados por BEEBE et al. (1960) - descrito como Heliconius numata (Cramer, 1780) - e por BROWN (1981) para Heliconius ethilla narcaea. Na altura, ambos autores encontraram valores menores.
Carenas (fig. 58) com superfície rugosa, e uma crista em linha no centro (fig. 61). O número de Vr varia de 13 a 16 e, o de Hr, de 11 a 13 (n = 10). Os valores são similares aos relatados por BEEBE et al. (1960) e BROWN (1981). As carenas possuem largura semelhante (fig. 61). As Vr menores se interrompem a uma ou duas células próximo à região micropilar (fig. 58).
As células são cobertas por rugosidades e possuem os ângulos internos arredondados. Estas rugosidades se concentram nas bordas, em menor quantidade se comparadas com as carenas. As Uc (fig. 60) variam de quadrangulares a pentagonais e as Lc (fig. 61) são quadrangulares. As aerópilas (Ac, fig. 62) são arredondadas e possuem peritrema elevado.
Diagnose diferencial. Os ovos das espécies de Heliconius Kluk, 1802 analisadas se diferenciam das outras espécies pela presença de rugosidades nas carenas e nas células. Comparados com Heliconius erato phyllis (Fabricius, 1775), os ovos de H. ethilla narcaea se diferenciam pela ausência de carenas elevadas circundando a região micropilar (fig. 58), pela presença de uma crista fortemente delineada nas carenas (fig. 61) e pela menor concentração de rugosidades nas células.
Não encontramos diferenças morfológicas significativas suficientes para distinguir os ovos de H. ethilla narcaea de Heliconius besckei Ménétriés, 1857. No entanto, as duas espécies possuem plantas hospedeiras distintas no RS (tab. II).
Dados biológicos. São depositados um a quatro ovos nos brotos, gavinhas ou folhas jovens (BROWN, 1981), sendo a preferência em folhas jovens (PÉRICO, 1995). Há registros de oviposição em seis espécies de Passifloraceae no RS (tab. II), sendo Passiflora alata a espécie onde mais se encontram ovos (PÉRICO, 1995; G. B. Miranda, dados não publicados).
Heliconius besckei Ménétriés, 1857
(Figs. 16, 63-67 )
Descrição. Coloração amarela (fig. 16) (BROWN, 1981) até a eclosão. Possui a base plana e o ápice levemente afilado (fig. 63 ). A região micropilar (fig. 64) é plana. As células do ânulo e da roseta são poligonais e sua superfície coberta por rugosidades.
Dimensões (média + erro padrão, n = 6): 1,135 + 0,028 mm e 1,387 + 0,015 mm, para diâmetro e altura, respectivamente. Os valores são maiores que os obtidos por BROWN (1981).
Carenas (fig. 63 ) com superfície rugosa. O número de Vr varia de 17 a 20 e, o de Hr, de 12 a 14 (n = 6). Os valores são maiores que os relatados por BROWN (1981). As carenas possuem larguras semelhantes (fig. 66 ). As Vr menores se interrompem a uma ou quatro células próximo à região micropilar (fig. 63 ).
As células são cobertas por rugosidades (em menor quantidade se comparada com as carenas) e possuem os ângulos internos arredondados. As Uc (fig. 65 ) são quadrangulares a heptagonais e as Lc (fig. 66 ) retangulares. As aerópilas (Ac, fig. 67) são arredondadas e possuem peritrema elevado.
Diagnose diferencial. Conforme citado anteriormente para H. ethilla narcaea, os ovos de Heliconius analisados se diferenciam das outras espécies pelas rugosidades nas células e nas carenas. O ovo de H. besckei diferencia-se de H. erato phyllis pela ausência de carenas elevadas circundando a região micropilar.
Da mesma forma que em H. ethilla narcaea, não encontramos diferenças morfológicas consistentes para distinguir os ovos de H. besckei de H. ethilla narcaea. Até o momento, ovos de H. besckei no RS só foram encontrados sob Passiflora organensis; por outro lado, posturas de H. ethilla narcaea nunca foram observados nessa planta hospedeira (tab. II). A dificuldade na diferenciação morfológica dos ovos dessas espécies possivelmente seja uma extensão dos problemas encontrados com a sistemática dos adultos (Brown, 1976), pois H. ethilla narcaea e H. besckei pertencem ao grupo Silvaniformes, incluído em Heliconiini.
Dados biológicos. Um a cinco ovos de H. besckei são colocados geralmente na porção terminal dos ramos (BROWN, 1981). É conhecida apenas uma planta hospedeira no Rio Grande do Sul (tab. II).
Heliconius erato phyllis (Fabricius, 1775)
Descrição. Coloração amarela (fig. 17) (BEEBE et al., 1960; BROWN, 1981; KAMINSKI et al., 2002) até a eclosão. Possui a base plana e o ápice afilado (fig. 68). A região micropilar pode ser côncava (fig. 68) ou plana (fig. 69). As células do ânulo e da roseta são poligonais e a superfície pode apresentar suaves rugosidades (KAMINSKI et al., 2002).
Dimensões (média + erro padrão, n = 10): 0,803 + 0,007 mm e 1,487 + 0,016 mm, para diâmetro e altura, respectivamente (KAMINSKI et al., 2002). Os valores são similares aos encontrados para Heliconius erato (Linnaeus, 1758) por BEEBE et al. (1960) e BROWN (1981).
Carenas (fig. 68) com superfície rugosa e uma suave crista em linha no centro. Esta linha é mais evidente próximo das aerópilas (fig. 72). O número de Vr varia de 14 a 15 e as Hr de 10 a 12 (n = 10) (KAMINSKI et al., 2002). Os valores são menores que os relatados por BEEBE et al. (1960) e BROWN (1981) para as Vr e semelhantes para as Hr. As Vr menores se interrompem a uma ou duas células próximo à região micropilar (fig. 68).
As células possuem os ângulos internos arredondados e a superfície coberta por rugosidades. Estas estão em menor quantidade se comparadas com as carenas (fig. 72). As Uc (fig. 70) variam de retangulares a hexagonais e as Lc (fig. 71) são retangulares ou quadradas (KAMINSKI et al., 2002). As aerópilas (Ac, fig. 72) são arredondadas e possuem peritrema elevado (KAMINSKI et al., 2002).
Diagnose diferencial. À semelhança do observado para H. ethilla narcaea e H. besckei, os ovos de H. erato phyllis se diferenciam das outras espécies analisadas pela rugosidade nas carenas e nas células. O ovo de H. erato phyllis se diferencia de H. ethilla narcaea e H. besckei por apresentar carenas elevadas circundando a região micropilar (figs. 68, 69).
Dados biológicos. Os ovos são depositados individualmente na porção apical do ramo, gavinhas ou nas folhas jovens (BROWN, 1981; PÉRICO, 1995), sendo preferencialmente na porção apical do ramo (PÉRICO, 1995; MUGRABI-OLIVEIRA & MOREIRA, 1996a). Os ovos são encontrados em oito espécies de Passifloraceae (tab. II), sendo Passiflora misera a espécie preferida para oviposição (KERPEL & MOREIRA, 2005).
Agradecimentos. Ao Departamento de Florestas e Áreas Protegidas do Estado do Rio Grande do Sul (DEFAP), pela autorização de efetuar coletas em unidades de conservação (Proj. No. 125). Ao Cristiano Iserhard e Marco Perotto, que nos possibilitaram coletas na Mata Atlântica e ao Instituto de Biociências (UFRGS) que disponibilizou viagem para o Parque Estadual do Turvo. A José Felipe Amato e Cristiano Schwertner (UFRGS) pelas fotos obtidos com câmera digital. A Marcelo Duarte (MZUSP), Aldo Araújo (UFRGS) e Olaf Mielke (UFPR), pela disponibilização de bibliografia. A Eduardo Ely, por permitir a análise de Heliconiini depositados na coleção C.M. Biezanko (UFPEL) e a Olaf Mielke, na coleção do Departamento de Zoologia (UFPR). A Antônio Carlos Paim (UFRGS), pelo desenho esquemático do ovo. Ao Centro de Microscopia Eletrônica da UFRGS, em especial à Moema Queiroz Vieira, Miriam Souza dos Santos e Francis Farret Darsie, pela preparação das amostras e realização das fotografias. A CAPES e CNPq pela concessão de bolsas para R. Dell'Erba e L. A. Kaminski, respectivamente. Este trabalho foi parcialmente financiado pelo CNPq (Proc. nº 478787/2001-4).
Recebido em março de 2004. Aceito em janeiro de 2005.
- ANTUNES, F. F.; MENEZES, A. O., Jr.; TAVARES, M. & MOREIRA, G. R. P. 2002. Morfologia externa dos estágios imaturos de heliconíneos neotropicais: I. Eueides isabella dianasa (Hübner, 1806). Revista Brasileira de Entomologia, 46(4):601-610.
- BEEBE, W.; CRANE, J. & FLEMING, H. 1960. A comparison of eggs, larvae and pupae in fourteen species of heliconiine butterflies from Trinidad, W.I. Zoologica, 45:111-154.
- BENSON, W. W.; BROWN, K. S., Jr. & GILBERT, L. E. 1976. Coevolution of plants and herbivores: passion flower butterflies. Evolution, 29:659-680.
- BIANCHI, V. & MOREIRA, G. R. P. 2005. Preferência alimentar, efeito da planta hospedeira e da densidade larval na sobrevivência e desenvolvimento de Dione juno juno (Cramer) (Lepidoptera, Nymphalidae). Revista Brasileira de Zoologia, 22(1):43-50.
- BIEZANKO, C. M. 1949. Acraeidae, Heliconiidae e Nymphalidae de Pelotas e seus arredores (Contribuição ao conhecimento da fisiografia do Rio Grande do Sul) Pelotas, Livraria Globo. 16p.
- BROWN, F. M. 1944. The egg, larva and chrysalis of Dione moneta Huebner. Bulletin of the Brooklyn Entomological Society, 39:132-134.
- BROWN, K. S., Jr. 1972. The heliconians of Brazil (Lepidoptera: Nymphalidae). Part III. Ecology and biology of Heliconius nattereri, a key primitive species near extinction, and comments on the evolutionary development of Heliconius and Eueides Zoologica, 57:41-69.
- ___. 1976. An illustrated key to the silvaniform Heliconius (Lepidoptera: Nymphalidae) with description of new subspecies. Transactions of the American Entomological Society, 102:373-484.
- ___. 1979. Ecologia geográfica e evolução nas florestas neotropicais Campinas, Universidade Estadual de Campinas. 265p.
- ___. 1981. The biology of Heliconius and related genera. Annual Review of Entomology, 26:427-456.
- ___. 1992. Borboletas da Serra do Japi: diversidade, hábitats, recursos alimentares e variação temporal. In: MORELLATO, L. P. C. org. História Natural da Serra do Japi: ecologia e preservação de uma área florestal no sudeste do Brasil Campinas, Unicamp/ Fapesp. p.142-187.
- BROWN, K. S., Jr. & BENSON, W. W. 1977. Evolution in modern amazonian non-forest islands: Heliconius hermathena Biotropica, 9:95-117.
- BROWN, K. S., Jr. & MIELKE, O. H. H. 1972. The heliconians of Brazil (Lepidoptera: Nymphalidae). Part II. Introduction and general comments, with a supplementary revision of the tribe. Zoologica, 57:1-40.
- CRANE, J. 1957. Imaginal behavior in butterflies of the family Heliconiidae: changing social patterns and irrelevant actions. Zoologica, 42:135-145.
- DEVRIES, P. J. 1987. The butterflies of Costa Rica and their natural history: Papilionidae, Pieridae, Nymphalidae Princeton, Princeton University. 327p.
- DOWNEY, J. C. & ALLYN, A. C. 1981. Chorionic sculpturing in eggs of Lycaenidae. Part. I. Bulletin of the Allyn Museum, 61:1-29.
- EMSLEY, M. G. 1963. A morphological study of imagine Heliconiinae (Lepidoptera: Nymphalidae) with a consideration of the evolutionary relationships within the group. Zoologica, 48:85-130.
- GILBERT, L. E. 1972. Pollen feeding and reproductive biology of Heliconius butterflies. Proceedings of the National Academy of the Sciences of the United States of America, 69:1403-1407.
- ___. 1991. Biodiversity of a Central American Heliconius community: patterns, process, and problems. In: PRICE, P. W.; LEWINSOHN, T. M.; FERNANDES, G. W. & BENSON, W. W. eds. Plant-animal interactions: evolutionary ecology in tropical and temperate regions. New York, John Wiley & Sons. p. 403-427.
- HINTON, H. E. 1969. Respiratory systems of insect egg shells. Annual Review of Entomology, 14:343-368.
- ___. 1970. Insect egg shells. Scientific American, 223:84-91.
- ___. 1981. Biology of Insect Eggs London, Pergamon. v.1, 473p.
- HOLZINGER, H. & HOLZINGER, R. 1994. Heliconius and related genera Venette, Sciences Nat. 328p.
- KAMINSKI, L. A.; TAVARES, M.; FERRO, V. G. & MOREIRA, G. R. P. 2002. Morfologia externa dos estágios imaturos de heliconíneos neotropicais. III. Heliconius erato phyllis (Fabricius) (Lepidoptera, Nymphalidae, Heliconiinae). Revista Brasileira de Zoologia, 19(4):977-993.
- KERPEL, S. M. & MOREIRA, G. R. P. 2005. Absence of learning and local specialization on plant selection by Heliconius erato Journal of Insect Behavior, 18:433-453.
- MENNA-BARRETO, Y. & ARAÚJO, A. M. 1985. Evidence for host preferences in Heliconius erato phyllis from Southern Brazil (Nymphalidae). Journal of Research on the Lepidoptera, 24:41-46.
- MUGRABI-OLIVEIRA, E. &. MOREIRA, G. R. P. 1996a. Conspecific mimics and low host plant availability reduce egg laying by Heliconius erato phyllis (Fabricius) (Lepidoptera, Nymphalidae). Revista Brasileira de Zoologia, 13(4):929-937.
- ___. 1996b. Size of and damage on shoots of Passiflora suberosa (Passifloraceae) influence oviposition site selection of Heliconius erato phyllis (Fabricius) (Lepidoptera, Nymphalidae). Revista Brasileira de Zoologia, 13(4):939-953.
- MUYSHONDT, A.; YOUNG, A. M. & MUYSHONDT, A., Jr. 1973. The biology of butterfly Dione juno huascama (Nymphalidae: Heliconiinae) in El Salvador. Journal of New York Entomological Society, 81:137-151.
- PAIM, A. C.; KAMINSKI, L. A. & MOREIRA, G. R. P. 2004. Morfologia externa dos estágios imaturos de heliconíneos neotropicais. IV. Dryas iulia alcionea (Cramer) (Lepidoptera, Nymphalidae, Heliconiinae). Iheringia, Série Zoologia, 94(1):25-36.
- PENZ, C. M. 1999. Higher level phylogeny for the passion-vine butterflies (Nymphalidae, Heliconiinae) based on early stage and adult morphology. Zoological Journal of the Linnean Society, 127:277-344.
- PÉRICO, E. 1995. Interação entre quatro espécies de Heliconiini (Lepidoptera: Nymphalidae) e suas plantas hospedeiras (Passifloraceae) em uma floresta secundária do Rio Grande do Sul, Brasil. Biociências, 3(2):3-18.
- PÉRICO, E. & ARAÚJO, A. M. 1991. Suitability of host plants (Passifloraceae) and their acceptableness by Heliconius erato and Dryas iulia (Lepidoptera: Nymphalidae). Evolución Biológica, 5:59-74.
- PETERSON, A. 1970. Eggs from miscellaneous species of Rhopalocera Lepidoptera. The Florida Entomologist, 53:65-72.
- RODRIGUES, D. &. MOREIRA, G. R. P. 1999. Feeding preference of Heliconius erato (Lep.: Nymphalidae) in relation to leaf age and consequences for larval performance. Journal of the Lepidopterists' Society, 53:108-113.
- ___. 2002. Geographical variation in larval host-plant use by Heliconius erato (Lepidoptera: Nymphalidae) and consequences for adult life history. Brazilian Journal of Biology, 62:321-332.
- ROMANOWSKY, H. P.; GUS, R. & ARAÚJO, A. M. 1985. Studies on the genetics and ecology of Heliconius erato (Lepid.; Nymph.). III. Population size, preadult mortality, adult resources and polymorphism in natural populations. Revista Brasileira de Biologia, 45(4):563-569.
- SACCO, J. C. 1980. Passifloráceas. In: REITZ, R. org. Flora ilustrada catarinense Itajaí, Herbário Barbosa Rodrigues. 132p.
- TAVARES, M.; KAMINSKI, L. A. & MOREIRA, G. R. P. 2002. Morfologia externa dos estágios imaturos de heliconíneos neotropicais. II. Dione juno juno (Cramer) (Lepidoptera: Nymphalidae: Heliconiinae). Revista Brasileira de Zoologia, 19(4):961-976.
- TOLEDO, Z. D. A. 1991a. Fauna del noroeste argentino. Contribucion al conocimiento de los lepidopteros argentinos. IX. Dione juno (Cramer) (Lepidoptera, Rhopalocera, Heliconiidae). Acta Zoologica Lilloana, 40(1):109-117.
- ___. 1991b. Fauna del noroeste argentino. Contribucion al conocimiento de los lepidopteros argentinos. X. Agraulis vanilla [sic] maculosa (Stichel) (Lepidoptera, Rhopalocera, Heliconiidae). Acta Zoologica Lilloana, 40(2):21-31.
- TURNER, J. R. G. 1968. Some new Heliconius pupae: their taxonomic and evolutionary significance in relation to mimicry (Lepidoptera: Nymphalidae). Journal of Zoology, 155:311-325.
- ___. 1977. A bibliography of Heliconius and related genera New York, Stony Brook. 21p.
Datas de Publicação
-
Publicação nesta coleção
28 Jul 2005 -
Data do Fascículo
Mar 2005
Histórico
-
Aceito
Jan 2005 -
Recebido
Mar 2004