Resumos
As atividades antrópicas têm alterado profundamente os ambientes naturais e muitas vezes afetado a diversidade e distribuição dos anuros. O objetivo deste estudo foi investigar as seguintes questões: (1) qual a composição da anurofauna em uma região de pastagem com clima marcadamente sazonal no extremo noroeste paulista? (2) como adultos e girinos das espécies se distribuem temporal e espacialmente? (3) a riqueza de espécies está correlacionada com descritores da heterogeneidade dos hábitats de reprodução? Na área estudada foram registradas 20 espécies de anuros, distribuídas em 11 gêneros de quatro famílias: Leptodactylidae (9), Hylidae (8), Microhylidae (2) e Bufonidae (1). Destas, Chaunus schneideri (Werner, 1894), Physalaemus centralis Bokermann, 1962 e Physalaemus fuscomaculatus (Steindachner, 1864) foram registradas apenas por coleta de girinos, enquanto Dendropsophus minutus (Peters, 1872) e Leptodactylus labyrinthicus (Spix, 1824) ocorreram somente em corpos d'água próximos aos selecionados. As espécies registradas são conhecidas por sua ampla distribuição geográfica e por colonizarem áreas alteradas em outras localidades. Não houve correlação entre a riqueza de espécies e a complexidade estrutural dos corpos d'água. Entretanto, a maior riqueza de espécies foi registrada nos corpos d'água de longa duração. As poças temporárias de hidroperíodo instável foram colonizadas inicialmente por leptodactilídeos, enquanto que as poças permanentes ou temporárias estáveis foram colonizadas por hilídeos. A atividade de vocalização e de reprodução da maioria das espécies foi restrita ao período quente e chuvoso do ano, um padrão típico de ambientes tropicais sazonais. Cinco espécies [Chaunus schneideri, Dendropsophus nanus (Boulenger, 1889), Hypsiboas albopunctatus Spix, 1824, Leptodactylus podicipinus (Cope, 1862) e Pseudopaludicola aff. saltica (Cope, 1887)] vocalizaram durante a estação seca e chuvosa, mas apenas C. schneideri e H. albopunctatus se reproduziram durante o período seco. A fraca partilha espacial e temporal, registrada para adultos e girinos, não foi suficiente para explicar o isolamento reprodutivo entre as espécies. Outros fatores, como a partilha acústica e a segregação dos sítios de vocalização, podem ter maior importância para explicar a coexistência das espécies. A severidade climática (extensa e pronunciada estação seca, imprevisibilidade e inconstância das chuvas no início da estação chuvosa), juntamente com o elevado grau de conversão do hábitat natural em áreas de cultivo são, provavelmente, os fatores responsáveis pelo predomínio de espécies conhecidas por colonizar com sucesso áreas antrópicas em outras regiões do país.
Ecologia de comunidades; heterogeneidade ambiental; amplitude de nicho; sazonalidade; área alterada
Anthropic activities have deeply changed natural environments and constantly affected the diversity and distribution of anurans. This study aimed to investigate the following questions: (1) What is the frogs composition in a pasture region with a pronounced seasonal climate in extreme northwest of the state of São Paulo? (2) How are adults and tadpoles of the species distributed temporally and spatially? (3) Is species richness correlated to descriptors of reproductive habitats heterogeneity? In the study site 20 anuran species were recorded, distributed in 11 genus of four families: Leptodactylidae (9), Hylidae (8), Microhylidae (2) and Bufonidae (1). From these, Chaunus schneideri (Werner, 1894), Physalaemus centralis Bokermann, 1962 and Physalaemus fuscomaculatus (Steindachner, 1864) were recorded only by tadpoles collection, whereas Dendropsophus minutus (Peters, 1872) and Leptodactylus labyrinthicus (Spix, 1824) occurred only in water bodies next to the studied ones. The recorded species are known by their ample geographic distribution and for colonizing disturbed areas in other localities. There was no correlation between species richness and structural complexity of water bodies. However, the greater richness was recorded in temporary water bodies that kept water more than six months throughout the year. The temporary ponds of unstable hydroperiod were colonized initially by leptodactylids, while the permanent or temporary ponds were colonized by hylids. The vocalization and reproductive activity of most species were restricted to the warm and rainy period of the year, a typical pattern of communities in the tropical seasonal regions. Five species [Chaunus schneideri, Dendropsophus nanus (Boulenger, 1889), Hypsiboas albopunctatus Spix, 1824, Leptodactylus podicipinus (Cope, 1862) and Pseudopaludicola aff. saltica (Cope, 1887)] vocalized during the dry and rainy seasons, but only C. schneideri and H. albopunctatus reproduced during the dry season. The weak spatial and temporal segregation, recorded to adults and tadpoles, is not enough to explain reproductive isolation among species. Other factors, like acoustic segregation and calling site segregation, may have major importance to explain species coexistence. Climatic severity (wide and pronounced dry season, unpredictability and inconstancy of rains in the beginning of the rainy season), along with the high level of natural habitat being converted in cultivated areas are, probably, the factors responsible for the predominance of species typical from disturbed areas.
Community ecology; environmental heterogeneity; niche breadth; seasonality; disturbed area
Diversidade e distribuição espaço-temporal de anuros em região com pronunciada estação seca no sudeste do Brasil1 1 . Parte do Programa BIOTA/FAPESP O Instituto Virtual da Biodiversidade, http://www.biota.org.br.
Temporal and spatial distribution and diversity of anurans in a region with pronounced dry season in southeastern Brazil
Tiago Gomes dos SantosI,II; Denise de C. Rossa-FeresIII; Lilian CasattiIV
IPós-Graduação em Biologia Animal, UNESP, 15054-000 São José do Rio Preto, São Paulo, Brasil. (frogomes@yahoo.com.br)
IIPós-Graduação em Ciências Biológicas (Zoologia), Departamento de Zoologia, Instituto de Biociências, Universidade Estadual Paulista, Caixa Postal 199, 13506-900 Rio Claro, São Paulo, Brasil
IIILaboratório de Ecologia Animal, Departamento de Zoologia e Botânica, UNESP, 15054-000 São José do Rio Preto, São Paulo, Brasil. (denise@ibilce.unesp.br)
IVLaboratório de Ictiologia, Departamento de Zoologia e Botânica, UNESP, 15054-000 São José do Rio Preto, São Paulo, Brasil. (lcasatti@ibilce.unesp.br)
RESUMO
As atividades antrópicas têm alterado profundamente os ambientes naturais e muitas vezes afetado a diversidade e distribuição dos anuros. O objetivo deste estudo foi investigar as seguintes questões: (1) qual a composição da anurofauna em uma região de pastagem com clima marcadamente sazonal no extremo noroeste paulista? (2) como adultos e girinos das espécies se distribuem temporal e espacialmente? (3) a riqueza de espécies está correlacionada com descritores da heterogeneidade dos hábitats de reprodução? Na área estudada foram registradas 20 espécies de anuros, distribuídas em 11 gêneros de quatro famílias: Leptodactylidae (9), Hylidae (8), Microhylidae (2) e Bufonidae (1). Destas, Chaunus schneideri (Werner, 1894), Physalaemus centralis Bokermann, 1962 e Physalaemus fuscomaculatus (Steindachner, 1864) foram registradas apenas por coleta de girinos, enquanto Dendropsophus minutus (Peters, 1872) e Leptodactylus labyrinthicus (Spix, 1824) ocorreram somente em corpos d'água próximos aos selecionados. As espécies registradas são conhecidas por sua ampla distribuição geográfica e por colonizarem áreas alteradas em outras localidades. Não houve correlação entre a riqueza de espécies e a complexidade estrutural dos corpos d'água. Entretanto, a maior riqueza de espécies foi registrada nos corpos d'água de longa duração. As poças temporárias de hidroperíodo instável foram colonizadas inicialmente por leptodactilídeos, enquanto que as poças permanentes ou temporárias estáveis foram colonizadas por hilídeos. A atividade de vocalização e de reprodução da maioria das espécies foi restrita ao período quente e chuvoso do ano, um padrão típico de ambientes tropicais sazonais. Cinco espécies [Chaunus schneideri, Dendropsophus nanus (Boulenger, 1889), Hypsiboas albopunctatus Spix, 1824, Leptodactylus podicipinus (Cope, 1862) e Pseudopaludicola aff. saltica (Cope, 1887)] vocalizaram durante a estação seca e chuvosa, mas apenas C. schneideri e H. albopunctatus se reproduziram durante o período seco. A fraca partilha espacial e temporal, registrada para adultos e girinos, não foi suficiente para explicar o isolamento reprodutivo entre as espécies. Outros fatores, como a partilha acústica e a segregação dos sítios de vocalização, podem ter maior importância para explicar a coexistência das espécies. A severidade climática (extensa e pronunciada estação seca, imprevisibilidade e inconstância das chuvas no início da estação chuvosa), juntamente com o elevado grau de conversão do hábitat natural em áreas de cultivo são, provavelmente, os fatores responsáveis pelo predomínio de espécies conhecidas por colonizar com sucesso áreas antrópicas em outras regiões do país.
Palavras-chave: Ecologia de comunidades, heterogeneidade ambiental, amplitude de nicho, sazonalidade, área alterada.
ABSTRACT
Anthropic activities have deeply changed natural environments and constantly affected the diversity and distribution of anurans. This study aimed to investigate the following questions: (1) What is the frogs composition in a pasture region with a pronounced seasonal climate in extreme northwest of the state of São Paulo? (2) How are adults and tadpoles of the species distributed temporally and spatially? (3) Is species richness correlated to descriptors of reproductive habitats heterogeneity? In the study site 20 anuran species were recorded, distributed in 11 genus of four families: Leptodactylidae (9), Hylidae (8), Microhylidae (2) and Bufonidae (1). From these, Chaunus schneideri (Werner, 1894), Physalaemus centralis Bokermann, 1962 and Physalaemus fuscomaculatus (Steindachner, 1864) were recorded only by tadpoles collection, whereas Dendropsophus minutus (Peters, 1872) and Leptodactylus labyrinthicus (Spix, 1824) occurred only in water bodies next to the studied ones. The recorded species are known by their ample geographic distribution and for colonizing disturbed areas in other localities. There was no correlation between species richness and structural complexity of water bodies. However, the greater richness was recorded in temporary water bodies that kept water more than six months throughout the year. The temporary ponds of unstable hydroperiod were colonized initially by leptodactylids, while the permanent or temporary ponds were colonized by hylids. The vocalization and reproductive activity of most species were restricted to the warm and rainy period of the year, a typical pattern of communities in the tropical seasonal regions. Five species [Chaunus schneideri, Dendropsophus nanus (Boulenger, 1889), Hypsiboas albopunctatus Spix, 1824, Leptodactylus podicipinus (Cope, 1862) and Pseudopaludicola aff. saltica (Cope, 1887)] vocalized during the dry and rainy seasons, but only C. schneideri and H. albopunctatus reproduced during the dry season. The weak spatial and temporal segregation, recorded to adults and tadpoles, is not enough to explain reproductive isolation among species. Other factors, like acoustic segregation and calling site segregation, may have major importance to explain species coexistence. Climatic severity (wide and pronounced dry season, unpredictability and inconstancy of rains in the beginning of the rainy season), along with the high level of natural habitat being converted in cultivated areas are, probably, the factors responsible for the predominance of species typical from disturbed areas.
Keywords: Community ecology, environmental heterogeneity, niche breadth, seasonality, disturbed area.
Em território brasileiro são encontradas 748 espécies de anuros (SBH, 2006), o que torna o país um dos mais diversos do mundo para o grupo. Entretanto, o conhecimento sobre a biologia e ecologia da maioria das espécies é escasso, principalmente nas regiões interioranas, pois, historicamente, os estudos têm se desenvolvido principalmente na zona litorânea e ao longo dos grandes rios (HADDAD et al., 1988).
A heterogeneidade ambiental tem sido reconhecida como uma das melhores explicações para a variação na diversidade de espécies (HUSTON, 1994). Diversos estudos desenvolvidos no Brasil (e.g. CARDOSO et al., 1989; POMBAL, 1997; BRANDÃO & ARAÚJO, 1998; BERNARDE & KOKUBUM, 1999) apontaram que ambientes complexos permitem a coexistência de um número maior de espécies de anuros que ambientes homogêneos, por disponibilizar maior número de microambientes. Entretanto, poucos realmente testaram esta correlação (GASCON, 1991; ETEROVICK, 2003).
O noroeste do estado de São Paulo representa uma das últimas áreas de ocupação do território paulista e experimentou uma rápida e desordenada expansão urbana e agrícola, com grave comprometimento ambiental, sendo atualmente considerada uma das áreas mais impactadas do estado (Ipt, 2000). Nessa região foram desenvolvidos poucos estudos sobre biologia (MARTINS, 2001) e ecologia de anuros (BERNARDE & KOKUBUM, 1999; ROSSA-FERES & JIM, 2001; ROSSA-FERES et al., 2004).
O presente estudo teve como objetivos (a) determinar a composição e a estrutura das comunidades de anuros, (b) avaliar como girinos e adultos se distribuem temporal e espacialmente e (c) investigar se a riqueza de espécies está correlacionada com descritores da heterogeneidade dos corpos d'água.
MATERIAL E MÉTODOS
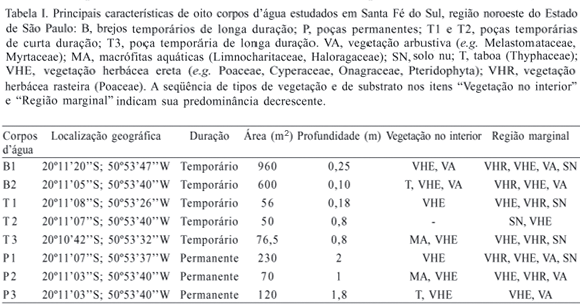
O estudo foi realizado no município de Santa Fé do Sul (20º11'S; 50º53'W), extremo noroeste do Estado de São Paulo, distante cerca de 20 Km da divisa com o Estado do Mato Grosso do Sul. Essa região apresenta o menor volume pluviométrico anual (entre 1.100 e 1.500 mm) e as mais elevadas temperaturas médias anuais de São Paulo (entre 22ºC e 23ºC) (Ipt, 2000). O clima da região é do tipo Tropical Quente e Úmido (Aw de Köppen), caracterizado pela pronunciada estação seca, que recebe apenas 15% da precipitação total anual (BARCHA & ARID, 1971) e pela imprevisibilidade do início da estação chuvosa (ROSSA-FERES & JIM, 2001). A formação vegetal original era constituída por Floresta Estacional Semidecidual, praticamente substituída por áreas de pastagem (PROJETO BRA, 1995; PROBIO, 1998; IPT, 2000). Nessa região foram amostrados oito corpos d'água, com diferentes hidroperíodos e tamanhos (Tab. I). Os corpos d'água temporários foram categorizados em "de longa duração" (com água acumulada por mais de seis meses) e "de curta duração" (com água acumulada por até seis meses).
Os corpos d'água foram amostrados entre setembro de 2003 e agosto de 2004, quinzenalmente durante o período chuvoso e mensalmente durante o período seco, totalizando 18 amostragens. Cada amostragem teve duração de um dia e as atividades de campo foram desenvolvidas por quatro pessoas.
Os girinos foram amostrados no período diurno, com puçá de tela de arame (malha de 3 mm2), aplicando-se esforço padronizado de coleta, que consistiu em passar o puçá ao longo de toda a área de cada corpo d'água. Os espécimes coletados foram conservados em formalina a 5%, identificados no laboratório com base no estudo de ROSSA-FERES & NOMURA (2006) e depositados na Coleção Científica de Anfíbios do Departamento de Zoologia e Botânica da UNESP, Campus de São José do Rio Preto, SP (DZSJRP: lotes 368 a 460).
A estimativa de abundância foi realizada pelo método de busca em sítio de reprodução (SCOTT & WOODWARD, 1994). O número de machos em vocalização foi contabilizado durante o percurso do perímetro dos corpos d'água.
Sete descritores ambientais foram utilizados para avaliar a complexidade estrutural dos corpos d'água: 1) número de tipos de perfil das margens (plana ou inclinada); 2) número de tipos de plantas nas margens do corpo d'água (herbáceas rasteiras ou eretas, arbustivas ou arbóreas); 3) porcentagem de vegetação recobrindo a superfície do corpo d'água (baixa, entre 0 e 30%; intermediária, entre 31 e 60% ou alta, acima de 60%); 4) número de tipos de margem (seca, com ou sem vegetação ou alagada, com ou sem vegetação); 5) hidroperíodo (temporário de curta duração, até seis meses com água; temporário de longa duração, mais de seis meses com água ou permanente); 6) tamanho (pequeno, até 100 m2 ou grande, com mais de 100 m2); 7) profundidade (raso, inferior a 50 cm; intermediário, entre 51 cm e 100 cm ou profundo, acima de 100 cm).
Os valores de umidade relativa do ar, temperatura média e de precipitação pluviométrica foram obtidos junto à Secretaria de Agricultura do município, cujo posto meteorológico está localizado a aproximadamente 6 km da área estudada.
Como método de avaliação da eficiência de coleta, foi construída a curva do coletor e a curva de riqueza estimada para a área, pelo estimador não-paramétrico Boostrap (SMITH & VAN BELLLE, 1984), considerando os registros efetuados nos corpos d'água selecionados e adjacentes. As curvas foram geradas a partir de 50 adições aleatórias das amostras, utilizando o programa EstimateS 7.0 (COLWELL, 2004).
A diversidade em cada corpo d'água (diversidade a) foi calculada pelo índice de Shannon-Wiener (log base e) (Krebs, 1999), utilizando o programa BioDiversity Professional 2.0 (MCALECEE et al., 1997). Para a análise, foi considerada a maior abundância dos machos de cada espécie (BERTOLUCI & RODRIGUES, 2002a) nas 18 amostragens. Esse procedimento foi adotado para evitar a super estimativa de abundância, promovida pela recontagem dos indivíduos em amostragens repetidas ao longo de uma estação.
O uso de ambientes foi determinado pela amplitude de nicho, calculada pelo índice de Levins (B) para adultos e girinos, com base na abundância de cada espécie em cada corpo d'água (KREBS, 1999). A mudança na composição faunística entre os corpos d'água ou diversidade b (MAGURRAN, 1988) foi determinada pelo Índice de Similaridade de Jaccard (Cj; KREBS, 1999). Valores de Cj < 0,50 foram considerados como indicativos de alta substituição de espécies entre os pares de ambientes comparados, ou seja, alta diversidade b. A influência da distância entre os corpos d'água sobre a diversidade b foi avaliada através do teste de Mantel (MANLY, 1994), utilizando o programa NTSYS 2.1 (ROHLF, 2000), com 5.000 permutações.
A influência dos parâmetros climáticos sobre a riqueza e abundância das espécies foi verificada pelo teste de correlação de Spearman (ZAR, 1999), com base nos valores de umidade relativa do ar, temperatura média e precipitação da semana anterior a cada coleta, utilizando o programa BioEstat 3.0 (AYRES et al., 2003).
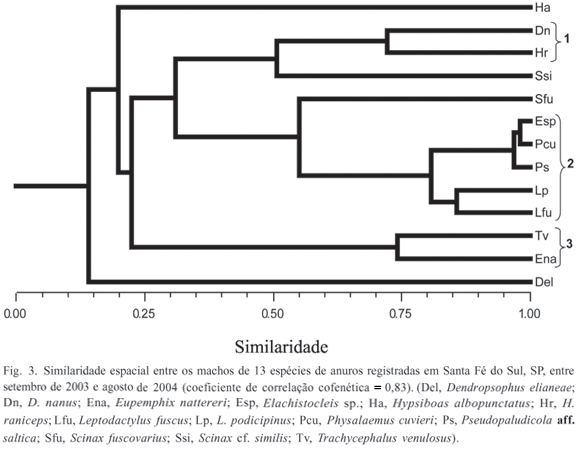
A distribuição temporal (em escala mensal) e espacial dos adultos e dos girinos foi analisada pelo Índice de Similaridade de Morisita-Horn (CH), com posterior análise de agrupamento por média não ponderada (KREBS, 1999). Foram considerados como agrupamentos válidos todos os arranjos com CH > 0,70. Para avaliar a perda de informações na construção dos dendrogramas, foi calculado o Coeficiente de Correlação Cofenética (r) (ROMESBURG, 1984), obtido correlacionando a matriz de similaridade original com a matriz obtida a partir do dendrograma, sendo valor de r > 0,9 considerado um ajuste muito bom; 0,8 < r < 0,9 considerado um ajuste bom, 0,7 < r < 0,8 considerado como ajuste pobre e r < 0,7 considerado um ajuste muito pobre (ROHLF, 2000). Quando os dendrogramas não representaram adequadamente as matrizes originais (r < 0,8), estas foram representadas pelo método de ordenação por Escalonamento Multidimensional Não-Métrico (NMDS) (MANLY, 1994). A distorção da ordenação pelo NMDS, em relação à matriz de similaridade original, foi determinada pela estatística chamada "stress" (S), cujos valores indicam, segundo ROHLF (2000): 0,40 = ajuste fraco; 0,20 = ajuste regular; 0,10 = ajuste bom; 0,05 = ajuste excelente e 0,0 = ajuste perfeito. As análises foram realizadas no programa NTSYS 2.1 (ROHLF, 2000).
A influência da complexidade estrutural dos ambientes sobre a riqueza de espécies foi testada pelo teste de Mantel (MANLY, 1994) no programa NTSYS 2.1 (ROHLF, 2000), com 5.000 permutações. Os descritores ambientais foram ordenados por postos (ranks) e para cada um deles foi construída uma matriz de dissimilaridade (Distância Euclidiana) entre os corpos d'água. Considerando que a matriz de tamanho dos corpos d'água não teve influência sobre as matrizes dos descritores ambientais (p > 0,05), o teste de Mantel foi utilizado para verificar a correlação das matrizes dos descritores ambientais com a matriz de similaridade na composição faunística (Jaccard) entre os corpos d'água. Como as comparações foram realizadas entre matrizes de dissimilaridade e similaridade, um coeficiente "r" negativo resultante foi interpretado como correlação positiva e um coeficiente positivo, como correlação negativa entre as matrizes comparadas.
RESULTADOS
Riqueza e diversidade de espécies. Foram registradas 20 espécies de anuros, pertencentes a 11 gêneros de 4 famílias: Bufonidae (1), Hylidae (8), Leptodactylidae (9) e Microhylidae (2) (Fig. 1). Chaunus schneideri (Werner, 1894), Physalaemus centralis Bokermann, 1962 e Physalaemus fuscomaculatus (Steindachner, 1864) foram registrados apenas por coleta de girinos. Dermatonotus muelleri (Boettger, 1885) e Leptodactylus chaquensis Cei, 1950 foram registradas visualmente nos corpos d'água estudados, mas nunca vocalizando, embora girinos da primeira espécie tenham sido coletados. Adultos de três espécies, C. schneideri, Dendropsophus minutus (Peters, 1872) e Leptodactylus labyrinthicus (Spix, 1824) foram registrados somente em corpos d'água próximos aos selecionados.
A curva do coletor, construída com base no registro das espécies por coleta de girinos e em registros visuais e auditivos na área estudada, apresentou forte tendência à estabilização (Fig. 2). O índice Bootstrap estimou uma riqueza total de 20,61 ± 0 espécies para a área e não houve diferença significativa entre a curva de riqueza estimada e a curva de riqueza observada.
Foram coletados girinos de 15 espécies nos corpos d'água selecionados (Fig. 1), sendo que as três mais abundantes [D. muelleri, Eupemphix nattereri (Steindachner, 1963) e Scinax fuscovarius (A. Lutz, 1925)] representaram 62,7% da abundância total de girinos (n = 11.164). Das 13 espécies registradas na fase adulta (Fig. 1), as três mais abundantes foram Dendropsophus nanus (Boulenger, 1889), Pseudopaludicola aff. saltica (Cope, 1887) e Elachistocleis sp. que, juntas, representaram 62,3% da abundância total registrada (n = 417 indivíduos). A diversidade total foi alta (H' = 2,11), como conseqüência da alta eqüitabilidade (e = 0,82), representando aproximadamente 82% da diversidade teórica máxima (H'max. = 2,57) (Fig. 1).
Distribuição espacial e diversidade beta. As maiores riqueza e diversidade de espécies foram registradas em três corpos d'água temporários de longa duração (B1, T3 e B2), sendo que 11 espécies se reproduziram exclusivamente nestes ambientes (Fig. 1). A riqueza e a abundância (98% do total) de girinos também foi maior nos corpos d'água temporários que nos permanentes (riqueza: U = 2,246; p = 0,025) e foram registradas desovas comunais, como as de Eupemphix nattereri. Nos corpos d'água permanentes, poucas espécies tiveram reprodução confirmada pela presença de girinos e, apesar de nenhuma espécie ter sido exclusiva, D. nanus e Hypsiboas raniceps (Cope, 1862) se reproduziram preponderantemente neste tipo de ambiente (Fig. 1).
A diversidade b foi considerada alta (Cj < 0,5) para 25 (89,3%) das 28 combinações de pares de corpos d'água (Tab. II) e não houve correlação da matriz de distância entre os corpos d'água com a matriz de diversidade b (r = 0,41; p > 0,05). A maior similaridade na composição de espécies ocorreu entre os corpos d'água permanentes (P1 e P3) e temporários (B1 e B2; B1 e T3) (Tab. II).
A análise da distribuição espacial dos machos das 13 espécies registradas evidenciou segregação entre grupos de espécies. Três agrupamentos com similaridade superior a 70% foram distinguidos (Fig. 3): 1. Dendropsophus nanus e Hypsiboas raniceps, que apresentaram maior abundância em corpos d'água permanentes (P1, P2 e P3); 2. Elachistocleis sp., Leptodactylus fuscus (Schneider, 1799), L. podicipinus (Cope, 1862), Physalaemus cuvieri Fitzinger, 1826 e Pseudopaludicola aff. saltica, que apresentaram maior abundância no brejo B1; 3. Eupemphix nattereri e Trachycephalus venulosus (Laurenti, 1768), que ocorreram em maior abundância em uma das poças temporárias (T2). Dendropsophus elianeae (Napoli & Caramaschi, 2000), Hypsiboas albopunctatus Spix, 1824, Scinax cf. similis (Cochran, 1952) e S. fuscovarius não foram incluídas em nenhum dos agrupamentos. Da primeira espécie apenas um indivíduo foi encontrado na poça T3 e a segunda, ocorreu preponderantemente no brejo B2. Já as duas últimas espécies, apesar de ocorrerem preferencialmente em corpos d'água temporários, co-ocorreram em poucos destes corpos d'água (40%, n = 2) e com abundâncias diferentes.
Para os girinos, a análise da distribuição espacial mostrou segregação no uso do ambiente. Quatro agrupamentos de espécies com similaridade superior a 70% foram identificados (Fig. 4): 1. Dendropsophus nanus e Hypsiboas raniceps, que ocorreram em maior abundância em um dos corpos d'água permanentes (P3); 2. Dermatonotus muelleri, Eupemphix nattereri e Trachycephalus venulosus, que ocorreram em maior abundância em uma das poças temporárias (T2); 3. Leptodactylus fuscus e Scinax fuscovarius, que apresentaram maior abundância na poça temporária T1; 4. Elachistocleis sp., Physalaemus centralis, P. cuvieri, P. fuscomaculatus e Scinax cf. similis, que ocorreram em maior abundância no brejo B1. Chaunus schneideri, Hypsiboas albopunctatus e Leptodactylus podicipinus não foram incluídas em nenhum dos agrupamentos. A primeira espécie ocorreu com maior abundância no brejo B2 e a segunda foi exclusiva da poça T3. Leptodactylus podicipinus ocorreu com a mesma abundância em dois corpos d'água temporários (B2 e T3).
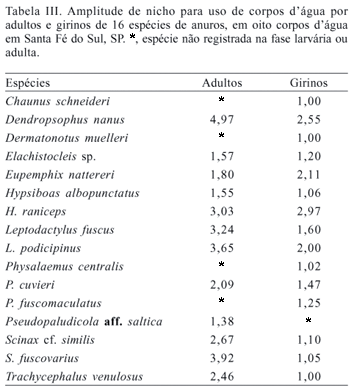
O uso do ambiente foi analisado separadamente para adultos e girinos. Os girinos apresentaram menor amplitude de nicho que os adultos, ocorrendo em menor número de corpos d'água (Tab. III).
Apesar do uso diferencial dos corpos d'água entre grupos de espécies e da alta diversidade b, apenas a duração e a profundidade dos corpos d'água foram positivamente correlacionadas com a matriz de riqueza de espécies (Tab. IV).
Distribuição temporal. Das 17 espécies que utilizaram os corpos d'água estudados, quatro (23,5%) vocalizaram por poucas noites, apresentando padrão reprodutivo explosivo, nove (53%) vocalizaram por até cinco meses, sendo consideradas reprodutoras intermediárias e as quatro espécies restantes (23,5%) vocalizaram por mais de cinco meses, sendo consideradas reprodutoras prolongadas (sensu WELLS, 1977; TOLEDO et al., 2003) (Fig. 5). Machos de Chaunus schneideri, Dendropsophus minutus e Leptodactylus labyrinthicus foram registrados vocalizando apenas em corpos d'água próximos aos selecionados (Fig. 5).
O período de reprodução da maioria das espécies (n = 14 espécies, 74%), determinado pela presença de girinos e/ou de machos vocalizando, foi restrito à estação quente e chuvosa (outubro a abril) (Fig. 5). Machos de cinco espécies (Chaunus schneideri, Dendropsophus nanus, Hypsiboas albopunctatus, Leptodactylus podicipinus e Pseudopaludicola aff. saltica) vocalizaram tanto na estação seca quanto na chuvosa, mas somente Chaunus schneideri e Hypsiboas albopunctatus tiveram reprodução confirmada pela presença de girinos em estágios iniciais de desenvolvimento durante o período seco.
O registro da atividade de canto em corpos d'água próximos aos selecionados indica que machos de sete (Dendropsophus nanus, Elachistocleis sp., Eupemphix nattereri, Hypsiboas albopunctatus, H. raniceps, Physalaemus cuvieri e Pseudopaludicola aff. saltica) das 13 espécies que vocalizaram nos corpos d'água selecionados apresentaram temporada de vocalização mais ampla do que a registrada somente nesses corpos d'água (Fig. 5). A atividade de vocalização dos machos de Chaunus schneideri, Dermatonotus muelleri, Physalaemus centralis e P. fuscomaculatus foi pouco freqüente, pois nenhum adulto foi registrado, apesar da coleta de girinos evidenciar que as espécies se reproduziram nos corpos d'água estudados.
Houve correlação positiva e significativa da riqueza e abundância de girinos com a precipitação (rs = 0,84; p < 0,001; rs = 0,81; p = 0,001, respectivamente) e da riqueza e abundância de machos em atividade de vocalização nos oito corpos d'água com a precipitação (rs = 0,66; p = 0,02; rs = 0,77; p = 0,004, respectivamente). Houve, ainda, correlação positiva e significativa da riqueza e abundância de machos em vocalização com a temperatura média (rs = 0,73; p = 0,007; rs = 0,71; p = 0,001, respectivamente), mas não com a umidade relativa do ar (rs = 0,28; p = 0,39; rs = 0,38; p = 0,23, respectivamente).
De maneira geral, na região estudada não houve sucessão de espécies durante a estação chuvosa (Fig. 5). No entanto, quando os corpos d'água foram analisados separadamente, evidenciou-se que os leptodactilídeos (Eupemphix nattereri, Leptodactylus fuscus, L. podicipinus e Physalaemus cuvieri) vocalizaram e se reproduziram primeiro que os hilídeos em três dos cinco corpos d'água temporários estudados (B1, T1 e T2). Os dois corpos d'água temporários que fugiram ao padrão acima descrito foram o brejo B2 e a poça T3. No B2, os hilídeos foram os primeiros anuros que se reproduziram e na T3, apesar dos leptodactilídeos serem os primeiros observados em atividade de vocalização, Chaunus schneideri foi a primeira espécie que se reproduziu, seguida pelos hilídeos. Os corpos d'água permanentes foram ocupados primariamente pelos hilídeos (e.g. Dendropsophus nanus, Hypsiboas albopunctatus e H. raniceps) e depois pelos leptodactilídeos.
Embora tenha havido grande sobreposição na temporada de vocalização dos machos das 13 espécies, a análise da similaridade temporal evidenciou uma sutil segregação no pico de abundância ao longo dos meses estudados (Fig. 6): 1, Dendropsophus nanus, Hypsiboas albopunctatus e Leptodactylus podicipinus apresentaram alta abundância por um período mais prolongado na estação chuvosa (novembro a janeiro/ fevereiro); 2, Scinax cf. similis e Scinax fuscovarius apresentaram pico de abundância restrito ao mês de outubro; 3, Elachistocleis sp., Leptodactylus fuscus, Physalaemus cuvieri, Pseudopaludicola aff. saltica e Trachycephalus venulosus apresentaram pico de abundância restrito ao mês de novembro. Dendropsophus elianeae, Eupemphix nattereri e Hypsiboas raniceps não foram associadas a nenhum dos agrupamentos. As duas primeiras espécies foram consideradas intermediárias em relação aos demais agrupamentos, pois E. nattereri apresentou pico de abundância em outubro e novembro e H. raniceps em novembro e dezembro. Dendropsophus elianeae foi rara nos ambientes amostrados, com apenas um indivíduo registrado em atividade de vocalização, em novembro.
Para os girinos, a análise de similaridade temporal evidenciou segregação no pico de abundância mensal entre grupos de espécies (Fig. 7), mas com sobreposição dentro de cada grupo: 1, Dendropsophus nanus e Hypsiboas albopunctatus, que foram mais abundantes de janeiro a março; 2, Elachistocleis sp., Eupemphix nattereri, Leptodactylus fuscus, L. podicipinus, Scinax cf. similis e Trachycephalus venulosus que apresentaram pico de abundância em janeiro; 3, Dermatonotus muelleri, Hypsiboas raniceps, Physalaemus centralis, P. cuvieri e P. fuscomaculatus, que apresentaram pico de abundância em fevereiro e março. Girinos de Chaunus schneideri foram mais abundantes em outubro, antes do início das chuvas, enquanto que os de S. fuscovarius foram mais abundantes em janeiro e fevereiro.
DISCUSSÃO
Riqueza e diversidade de espécies. Ambos, estimador de riqueza e curva de acumulação de espécies, indicam que a metodologia e o esforço de amostragem empregados foram adequados e que o inventário de espécies reflete a riqueza da área estudada. Desta forma, consideramos pouco provável o incremento no número de espécies nessa área.
As espécies registradas no presente estudo representam 71% das 28 listadas para a região noroeste do estado (BERNARDE & KOKUBUM, 1999; ROSSA-FERES & JIM, 2001; VASCONCELOS & ROSSA-FERES, 2005). A anurofauna estudada é constituída, em proporções iguais, por espécies com dois padrões de distribuição: aquelas cuja área de ocorrência está relacionada a formações abertas sul americanas (Complexo Caatinga-Cerrado-Chaco e/ou Pampa) e aquelas com ampla área de ocorrência, incluindo tanto formações abertas quanto florestais (domínio Atlântico e/ou Amazônico) (sensu DUELLMAN, 1999). Praticamente a totalidade das espécies registradas em Santa Fé do Sul é conhecida por colonizar com sucesso áreas antrópicas em outras regiões do país, incluindo pastagens (ver BRANDÃO & ARAÚJO, 1998; STRÜSSMANN, 2000; BRANDÃO, 2002). Segundo HADDAD & ABE (1999), em conseqüência dos desmatamentos, espécies de anuros de áreas abertas (e.g. Chaunus schneideri, Hypsiboas albopunctatus, Leptodactylus fuscus, Physalaemus cuvieri e Scinax fuscovarius) têm expandido geograficamente os seus limites.
Como o primeiro estudo com anuros na região foi desenvolvido na década de 60 (L. D. Vizotto, comun. pes.) e as profundas intervenções antrópicas que transformaram a paisagem remontam à década de 20 (IPT, 2000), não existem dados comparativos seguros para a avaliação de uma possível perda e/ou substituição de espécies. Desta forma, estudos em áreas de Floresta Estacional Semidecidual ainda preservadas, como a Floresta Estacional do Parque Estadual do Morro do Diabo, poderão fornecer dados para futuras comparações.
A alta diversidade de espécies deve ser interpretada com ressalva, pois decorre da alta equitabilidade e não da riqueza de espécies, já que a espécie mais abundante representou menos de 30% do total registrado. A alta equitabilidade registrada na área estudada provavelmente resulta da baixa abundância da maioria das espécies. Regiões tropicais sazonalmente secas na Tailândia apresentaram menor abundância de anuros que regiões tropicais não sazonais em Borneo e na Malásia (ver referências em DUELLMAN & TRUEB, 1986). Assim, a baixa abundância de anuros registrada pode ser uma conseqüência do rigor climático da região, que apresenta estação seca prolongada e imprevisibilidade no mês de início das chuvas (ROSSA-FERES & JIM, 2001).
De modo geral, as comunidades de corpos d'água temporários apresentaram maior riqueza e maior equitabilidade que as de corpos d'água permanentes. Estes resultados reforçam a importância dos corpos d'água temporários na manutenção das populações de anuros da região e podem servir de base para futuras ações de manejo e conservação da anurofauna.
Distribuição espacial. A partilha espacial no uso de corpos d'água, encontrada no presente estudo, tem sido registrada para adultos (e.g. COLLINS & WILBUR, 1979; BERNARDE & ANJOS, 1999; BERTOLUCI & RODRIGUES, 2002b) e girinos (GASCON, 1991; ROSSA-FERES & JIM, 1996; ETEROVICK & SAZIMA, 2000). As espécies podem ocorrer e se reproduzir em ambientes com grau variável de permanência (hidroperíodo) (COLLINS & WILBUR, 1979), de acordo com suas adaptações ecológicas e fisiológicas (HEYER et al., 1975) ou restrições evolutivas (ETEROVICK & SAZIMA, 2000). A alta diversidade b registrada indica segregação de espécies e/ou de grupos de espécies por determinados corpos d'água, o que pode minimizar possíveis interações entre estas e promover sua coexistência na região.
Os corpos d'água temporários foram utilizados preponderantemente por espécies com padrão de reprodução intermediário e explosivo (sensu WELLS, 1977), que possuem maior investimento em reprodução que as espécies de reprodução prolongada. Em ambientes sazonais prevalece a seleção "r", que favorece as espécies com alto potencial reprodutivo e crescimento populacional exponencial (seguido por declínios catastróficos), que conseguem explorar rapidamente recursos recentemente acumulados e apresentam grande plasticidade face às perturbações periódicas (ODUM, 2001). Alguns eventos de mortalidade catastrófica, típicos de ambientes onde prevalece a seleção "r", foram registrados na área estudada (T. G. dos Santos, obs. pes.): (1) quando o volume de água da poça temporária T2 regrediu pela segunda vez, devido à inconstância das chuvas no início da estação chuvosa, houve perda total de pelo menos quatro desovas comunais de E. nattereri e de milhares de girinos de Dermatonotus muelleri; (2) na poça temporária T1, centenas girinos de Scinax fuscovarius em estágio inicial de desenvolvimento foram coletados na primeira quinzena de janeiro, mas nenhum na quinzena seguinte, quando o corpo d'água quase secou. Esses eventos caracterizam a instabilidade dos corpos d'água temporários da região estudada, resultante da pronunciada estação seca e da inconstância das chuvas no início da estação chuvosa, que favorecem as espécies com grande investimento em reprodução, as quais representaram 76% da anurofauna local.
Outro fator que pode explicar o uso preponderante dos corpos d'água temporários é a ausência ou menor abundância de predadores aquáticos (insetos e peixes) nesses ambientes, em comparação com os corpos d'água permanentes (HEYER et al., 1975; WOODWARD, 1983; SMITH, 1983). Em sistemas lênticos, a estrutura da comunidade de predadores varia através de um gradiente crescente de hidroperíodo: poças efêmeras - temporárias - permanentes (Welborn et al., 1996, apud GUNZBURGER & TRAVIS, 2004). Desta forma, pode existir um conflito ecológico com respeito à efemeridade dos corpos d'água, pois minimizar o risco de predação significa aumentar o risco de morte por dessecação (BEEBEE, 1996). Embora os predadores aquáticos não tenham sido amostrados de modo quantitativo, foi possível, durante as coletas, perceber um gradiente de riqueza e/ou abundância de predadores ao longo de um gradiente de hidroperíodo. Nos corpos d'água permanentes, os insetos (e.g. Heteroptera e Odonata) e peixes (Laetacara sp. Cichlidae, Rivulus pictus Rivulidae) potencialmente predadores foram mais abundantes que nos corpos d'água temporários com hidroperíodo longo (superior a seis meses: B1, B2 e T3). Já nos corpos d'água temporários com hidroperíodo curto (até seis meses: T1 e T2), apenas insetos predadores (Odonata e Heteroptera) foram encontrados e somente no final da estação chuvosa. Desta forma, para a maioria das espécies, ocupar corpos d'água temporários de longa duração, onde ocorrem poucos predadores, parece ser mais vantajoso que ocupar corpos d'água livres de predadores, mas com alto risco de dessecação (temporários de curta duração) ou ainda corpos d'água permanentes, mas com grande abundância de predadores.
O fato dos adultos da maioria das espécies terem ocorrido em maior número de corpos d'água, enquanto os girinos foram mais restritos indica que, apesar dos machos terem vocalizado em vários corpos d'água, o sucesso reprodutivo foi alcançado em poucos corpos d'água. Algumas hipóteses não excludentes podem ser levantadas para tentar explicar esse resultado: 1) como sugerido por ARZABE (1999), populações localizadas podem vocalizar mas não se reproduzir quando as condições climáticas são adversas; 2) a ausência de sítios de desova adequados poderia inviabilizar a reprodução em alguns corpos d'água; 3) a mortalidade de ovos ou girinos devido a fatores bióticos e/ou abióticos poderia ser a responsável pelo baixo sucesso reprodutivo. Nossos dados não são suficientes para apoiar ou refutar qualquer uma das três hipóteses, mas consideramos as duas primeiras menos plausíveis. Os machos da maioria das espécies vocalizaram durante a estação chuvosa, quando as condições climáticas (precipitação e temperatura) são favoráveis à reprodução. Além disso, os modos reprodutivos das espécies presentemente estudadas são generalizados (modos 1, 2, 3 e 4, sensu HADDAD & PRADO, 2005) e desta forma a baixa heterogeneidade de áreas agropastoris dificilmente limitaria a ocorrência de sítios de desova adequados. Por outro lado, a terceira hipótese, de mortalidade diferencial ao longo de um gradiente de hidroperíodo, é reforçada pelas observações de grande mortalidade de desovas e girinos por dessecação nos corpos d'água temporários e pela maior abundância de predadores nos corpos d'água permanentes.
Apesar da alta riqueza de espécies de anuros, registrada em várias regiões brasileiras, ser comumente atribuída à heterogeneidade dos ambientes (CARDOSO et al., 1989; POMBAL, 1997; ARZABE, 1999; BERNARDE & KOKUBUM, 1999), esta correlação tem sido escassamente testada (e.g. GASCON, 1991; ETEROVICK, 2003). Dos sete descritores ambientais da complexidade estrutural dos corpos d'água amostrados, apenas o hidroperíodo e a profundidade foram positivamente correlacionados com a riqueza de espécies. Entretanto, as matrizes de duração e profundidade são autocorrelacionadas, pois os corpos d'água profundos foram os permanentes e os rasos foram temporários, o que indica a importância do hidroperíodo na composição da anurofauna.
Os poucos estudos que testaram a influência da complexidade ambiental sobre a riqueza de anfíbios não apontam um padrão geral para anuros. LEE (1980), ao estudar o padrão de distribuição e o gradiente de riqueza de espécies na Península de Yucatãn, registrou que a diversidade de espécies de anuros e cecílias foi melhor explicada pelo volume e sazonalidade das chuvas do que pela estrutura do ambiente (diversidade, volume, altura e porcentagem de cobertura da vegetação). Por outro lado, correlações positivas da complexidade estrutural com a riqueza e diversidade de espécies foram encontradas em outros locais. PARRIS & MCCARTHY (1999) registraram correlação positiva da riqueza de anuros com a composição da vegetação ripária e com a altitude, largura e volume dos rios em área de floresta australiana. Em açudes estudados em paisagens agrícolas australianas, a extensão da cobertura do dossel nativo e a quantidade de vegetação emergente nas margens foram as duas principais variáveis estruturais positivamente associadas com o incremento no número de espécies (HAZELL et al., 2001). VALLAN (2002) e KRISHNAMURTHY (2003), comparando corpos d'água alterados e não alterados em Madagascar e na Índia, respectivamente, encontraram correlação positiva entre riqueza e diversidade de espécies com a complexidade estrutural (cobertura do dossel) dos corpos d'água não alterados.
No presente estudo, o hidroperíodo foi considerado como o descritor ambiental que melhor representou a riqueza registrada nos hábitats estudados. A ausência de correlação entre a riqueza de espécies e a complexidade estrutural dos corpos d'água pode ser explicada pela grande homogeneidade destes, pois todos estão localizados em área com longo histórico de uso para pastagem e possuem vegetação marginal baixa, de composição muito semelhante.
Distribuição temporal. Numerosos estudos têm destacado a importância da chuva e/ou temperatura na ocorrência e riqueza de espécies de anfíbios anuros (e.g. DUELLMAN & TRUEB, 1986; AICHINGER, 1987; GASCON, 1991; TOLEDO et al., 2003). Em regiões tropicais sazonais, a maior parte das espécies se reproduz na estação úmida (e.g. ROSSA-FERES & JIM, 1994; ARZABE, 1999; ETEROVICK & SAZIMA, 2000; PRADO et al., 2005). Apesar da temperatura possuir importância secundária na regulação da atividade reprodutiva de anuros em regiões tropicais (HEYER, 1973), baixas temperaturas talvez possam ser utilizadas pelos mesmos como indicativo do final da estação chuvosa e, conseqüentemente, do período de atividade de vocalização (ETEROVICK & SAZIMA, 2000).
No presente estudo, a maioria das espécies apresentou atividade reprodutiva fortemente associada ao período quente e chuvoso, corroborando o padrão encontrado em ambientes tropicais sazonais e evidenciando a forte influência do período seco como fator restritivo à atividade e reprodução da maior parte das espécies. A temperatura tem pequena variação ao longo do ano na região noroeste do estado de São Paulo (BARCHA & ARID, 1971), mas na estação seca do período estudado, foram registrados valores anormalmente baixos, que contribuíram para a correlação encontrada entre a temperatura e a riqueza e abundância das espécies.
A seqüência de colonização diferiu entre os corpos d'água temporários e permanentes, provavelmente como conseqüência da estabilidade dos corpos d'água. Corpos d'água instáveis, que secaram ou apresentaram acentuada retração do nível d'água no início da estação chuvosa, foram colonizados primeiramente pelos leptodactilídeos, reforçando o padrão registrado em outros estudos realizados em áreas marcadamente sazonais (ARZABE, 1999). Por outro lado, os corpos d'água com hidroperíodo estável (permanentes ou temporários de longa duração), que não apresentaram grande oscilação do nível d'água, foram ocupados primeiramente pelos hilídeos, como registrado por ARZABE (1999). Oito (cerca de 90%) das espécies de leptodactilídeos registradas apresentam desova em ninhos de espuma, o que é considerado uma proteção contra a dessecação, principalmente em ambientes sazonais (DOWNIE, 1988). Já os hilídeos registrados em Santa Fé do Sul dependem de hidroperíodo estável, pois seus ovos não têm proteção contra dessecação e são depositados diretamente na água.
Apesar das espécies terem sido restritas à estação chuvosa, com distribuição quase contínua, percebeu-se uma segregação de grupos de espécies (de acordo com o pico de abundância dos girinos ou de atividade de vocalização dos machos), mas ocorreu sobreposição do pico de abundância dentro de cada grupo. Estudos sobre temporada reprodutiva de anuros em regiões sazonais não evidenciam um padrão único. Em Botucatu, SP, ROSSA-FERES & JIM (1994) encontraram forte sobreposição na temporada de vocalização e na ocorrência dos girinos, mas segregação quanto ao mês de maior abundância das larvas dentro dos agrupamentos de espécies. Por outro lado, foi registrada segregação quanto à temporada de vocalização e quanto ao período de ocorrência dos girinos no Pantanal e na Serra do Cipó (ETEROVICK & SAZIMA, 2000; PRADO et al., 2005).
Os dados obtidos indicam que a homogeneidade estrutural dos corpos d'água, a severidade climática da região (extensa e pronunciada estação seca, imprevisibilidade e inconstância das chuvas no início da estação chuvosa), juntamente com o elevado grau de conversão do ambiente natural em áreas de cultivo, limitam as possibilidades de partilha espacial e temporal e são, provavelmente, os fatores responsáveis pelo predomínio de espécies generalistas quanto ao uso do ambiente na área estudada. Desta forma, outros fatores, como partilha acústica e segregação dos sítios de vocalização, podem ter maior importância para explicar a coexistência das mesmas.
Agradecimentos. Este estudo foi realizado com financiamento do programa BIOTA/FAPESP O Instituto Virtual da Biodiversidade (www.biota.org.br) - da Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), através do Projeto Temático "Diversidade de Anuros do Estado de São Paulo" (FAPESP processo nº 01/13341-3). Os autores agradecem à FAPESP pela bolsa de Mestrado concedida a T. G. S. (processo nº 02/11389-1); ao Prof. Dr. Célio F. B. Haddad (UNESP/Rio Claro), ao Prof. Dr. Rogério P. Bastos (UFG/Goiânia) e aos dois revisores anônimos pelos comentários e sugestões; ao Prof. Dr. Pitágoras O. Bispo (UNESP/Assis) pelo auxílio nas análises estatísticas; à Profª Drª Neusa Taroda Ranga (UNESP/São José do Rio Preto) e Drª Andréia Rezende pela identificação das plantas e à equipe do Laboratório de Ecologia Animal, pelo auxílio nas coletas, em especial aos biólogos Rodrigo A. Silva, Carolina P. Candeira e Fernando R. da Silva, que participaram da maioria delas.
Recebido em agosto de 2005. Aceito em agosto de 2006.
- AICHINGER, M. 1987. Annual activity patterns of anurans in a seasonal neotropical environment. Oecologia 71:583-592.
- ARZABE, C. 1999. Reproductive activity patterns of anurans in two different altitudinal sites within the Brazilian Caatinga. Revista Brasileira de Zoologia 16(3):851-864.
- AYRES, M.; AYRES, M. JR.; AYRES, D. L. & SANTOS, A. S. 2003. BioEstat 3.0. Aplicaçőes estatísticas nas áreas das cięncias biológicas e médicas. Belém, Sociedade Civil de Mamirauá. 291p.
- BARCHA, S. F. & ARID, F. M. 1971. Estudo da evapotranspiraçăo na regiăo norte-ocidental do estado de Săo Paulo. Revista de Cięncias da Faculdade de Cięncias e Letras 1:94-122.
- BEEBEE, T. J. C. 1996. Ecology and conservation of amphibians London, Chapman & Hall. 213p.
- BERNARDE, P. S. & ANJOS, L. 1999. Distribuiçăo espacial e temporal da anurofauna no Parque Estadual Mata dos Godoy, Londrina, Paraná, Brasil (Amphibia, Anura). Comunicaçőes do Museu de Cięncias e Tecnologia PUCRS, Série Zoologia, 12:111-140.
- BERNARDE, P. S. & KOKUBUM, M. N. C. 1999. Anurofauna do Município de Guararapes, estado de Săo Paulo, Brasil (Amphibia, Anura). Acta Biologia Leopoldensia 21:89-97.
- BERTOLUCI, J. & RODRIGUES, M. T. 2002a. Seasonal patterns of breeding activity of Atlantic Rainforest anurans at Boracéia, Southeastern Brazil. Amphibia-Reptilia 23:161-167.
- ___. 2002b. Utilizaçăo de hábitats reprodutivos e micro-hábitats de vocalizaçăo em uma taxocenose de anuros (Amphibia) da Mata Atlântica do Sudeste do Brasil. Papéis Avulsos de Zoologia 42(11):287-297.
- BRANDĂO, R. A. 2002. Avaliaçăo ecológica rápida da herpetofauna nas Reservas Extrativistas de Pedras Negras e Curralinho, Costa Marques, RO. Brasil Florestal 21(74):61-73.
- BRANDĂO, R. A. & ARAÚJO, A. F. B. 1998. A herpetofauna da Estaçăo Ecológica de Águas Emendadas. In: MARINHO-FILHO, J.; RODRIGUES, F. & GUIMARĂES, M. eds. Vertebrados da Estaçăo Ecológica de Águas Emendadas. História natural e ecologia em um fragmento de cerrado do Brasil Central Brasília, SEMATEC/IEMA. p.9-21
- CARDOSO, A. J.; ANDRADE, G. V. & HADDAD, C. F. B. 1989. Distribuiçăo espacial em comunidades de anfíbios (Anura) no sudeste do Brasil. Revista Brasileira de Biologia 49(1):241-249.
- COLLINS, J. P. & WILBUR, H. 1979. Breeding habits and habitats of the amphibians of the Edwin S. George Reserve, Michigan, with notes on the local distribution of fishes. Occasional Papers of the Museum of Zoology University of Michigan 686:1-34.
- COLWELL, R.K. 2004. EstimateS 7.0: Statistical estimation of species richness and shared species from samples. Users guide and application. Disponível em: <http://viceroy.eeb.unconn.edu/estimates>. Acesso em: 08.2005.
- DOWNIE, J. R. 1988. Functions of the foam in the foam-nesting leptodactylid Physalaemus pustulosus Herpetological Journal 1:302-307.
- DUELLMAN, W. E. 1999. Distribution patterns of amphibians in the South America. In: DUELLMAN, W. E. ed. Patterns of distribution of amphibians a global perspective. Baltimore, London, Johns Hopkins University. p.255-328.
- DUELLMAN, W. E. & TRUEB, L. 1986. Biology of Amphibians Baltimore, London, McGraw-Hill. 670p.
- ETEROVICK, P. C. 2003. Distribution of anuran species among montane streams in south-eastern Brazil. Jounal of Tropical Ecology 19:219-228.
- ETEROVICK, P. C. & SAZIMA, I. 2000. Structure of an anuran community in a montane meadow in southeastern Brazil: effects of seasonality, habitat, and predation. Amphibia-Reptilia 21:439-461.
- GASCON, C. 1991. Population and community - level analysis of species occurrences of central Amazonian rain forest tadpoles. Ecology 72(5):1731-1746.
- GUNZBURGER, M. S. & TRAVIS, J. 2004. Evaluating predation pressure on green treefrog larvae across a habitat gradient. Oecologia 140:422-429.
- HADDAD, C. F. B. & ABE, A. S. 1999. Anfíbios e Répteis. In: Workshop Mata Atlântica e Campos Sulinos. Disponível em: <http://www.bdt.fat. org.br/workshop/mata.atlantica/BR/rfinais/rt_anfibios>. Acesso em: 15.09.2004.
- HADDAD, C. F. B. & PRADO, C. P. A. 2005. Reproductive modes in frogs and their unexpected diversity in the Atlantic Forest of Brazil. Bioscience 55(3):207-217.
- HADDAD, C. F. B; ANDRADE, G. V. & CARDOSO, A. J. 1988. Anfíbios Anuros do Parque Nacional da Serra da Canastra, estado de Minas Gerais. Brasil Florestal 64:9-20.
- HAZELL, D.; CUNNNINGHAM, R.; LINDENMAYER, D.; MACKEY, B. & OSBORNE, W. 2001. Use of farm dams as frog habitat in an Australian agricultural landscape: factors affecting species richness and distribution. Biological Conservation 102:155-169.
- HEYER, W. R. 1973. Ecological interactions of frog larvae at a seasonal tropical location in Thailand. Journal of Herpetology 7(4):337-361.
- HEYER, W. R.; MCDIARMID, R. W. & WEIGMANN, D. L. 1975. Tadpoles, predation and pond habitats in the tropics. Biotropica 7:100-111.
- HUSTON, M. A. 1994. Biological diversity: the coexistence of species on changing landscapes Cambridge, Cambridge University. 681p.
- IPT (Instituto de Pesquisas Tecnológicas do estado de São Paulo). 2000. Diagnóstico da situação atual dos recursos hídricos e estabelecimento de diretrizes técnicas para a elaboração do Plano da Bacia São José dos Dourados Relatório nº 40675 Minuta. CD-Rom.
- KREBS, C. J. 1999. Ecological methodology Menlo Park, Addison Wesley Educational Publishers. 620p.
- KRISHNAMURTHY, S. V. 2003. Amphibian assemblages in undisturbed and disturbed areas of Kudremukh National Park, Central Western Ghats, India. Environmental Conservation 30(3):274-282.
- LEE, J. C. 1980. An ecogeographic analysis of the herpetofauna of Yucatan Peninsula. Miscellaneous Publication 67:1-48.
- MAGURRAN, A. E. 1988. Ecological diversity and its measurement New Jersey, Princeton University. 179p.
- MANLY, B. F. G. 1994. A Primer of Multivariate Statistics London, Chapman & Hall. 179p.
- MARTINS, I. A. 2001. Parental care behaviour in Leptodactylus podicipinus (Cope, 1862) (Anura, Leptodactylidae). Herpetological Journal 11:29-32.
- MCALECEE, N.; LAMBSHEAH, P. J. D.; PATERSON, G. L. J. & GAGE, J. G. 1997. Bio Diversity Professional Beta-Version. London, The Natural History Museum and The Scottish Association for Marine Sciences.
- ODUM, E. P. 2001. Fundamentos de Ecologia Lisboa, Fundaçăo Calouste Golbenkian. 927p.
- PARRIS, K. M. & MCCARTHY, M. 1999. What influences the structure of frog assemblages at forest streams? Australian Journal of Ecology 24:495-502.
- POMBAL, J. P., JR. 1997. Distribuiçăo espacial e temporal de anuros (Amphibia) em uma poça permanente na Serra de Paranapiacaba, sudeste do Brasil. Revista Brasileira de Zoologia 57(4):583-594.
- PRADO, C. P. A.; UETANABARO, M. & HADDAD, C. F. B. 2005. Breeding activity patterns, reproductive modes, and habitat use by anurans (Amphibia) in a seasonal environment in the Pantanal, Brazil. Amphibia-Reptilia 26(2):211-221.
- PROBIO. 1998. Áreas de domínio do cerrado no estado de São Paulo. São Paulo, Imprensa Oficial da Secretaria do Meio Ambiente de São Paulo. 84p.
- PROJETO BRA/90/010. 1995. Os ecossistemas brasileiros e os principais macrovetores de desenvolvimento: subsídios ao planejamento da gestão ambiental Brasília, Ministério do Meio Ambiente. 108p.
- ROHLF, F. J. 2000. NTSYS 2.1: Numerical Taxonomic and Multivariate Analysis System New York, Exeter Software.
- ROMESBURG, H. C. 1984. Cluster Analysis for researchers Malabar, Robert E. Krieger Publishing Company. 334p.
- ROSSA-FERES, D. C. & JIM, J. 1994. Distribuiçăo sazonal em comunidades de anfíbios anuros na regiăo de Botucatu, Săo Paulo. Revista Brasileira de Biologia 54(2):323-334.
- ___. 1996. Distribuição espacial em comunidade de girinos na região de Botucatu, São Paulo (Amphibia, Anura). Revista Brasileira de Biologia 56(2):309-316.
- ___. 2001. Similaridade no sítio de vocalizaçăo em uma comunidade de anfíbios anuros na regiăo noroeste do estado de Săo Paulo, Brasil. Revista Brasileira de Zoologia 18(2):439-454.
- ROSSA-FERES, D. C. & NOMURA, F. 2006. Caracterizaçăo e chave taxonômica para girinos (Amphibia: Anura) da regiăo noroeste do estado de Săo Paulo, Brasil. Biota Neotropica 6(1):http://www.biotaneotropica.org.br/v6n1/ pt/abstract?identification-key+bn00706012006 ISSN 1676-0611.
- ROSSA-FERES, D. C.; JIM, J. & FONSECA, M. G. 2004. Diets of tadpoles from a temporary pond in southeastern Brazil (Amphibia, Anura). Revista Brasileira de Zoologia 21(4):745-754.
- SBH (Sociedade Brasileira de Herpetologia). 2006. Lista de espécies de anfíbios do Brasil. Disponível em: <http://www.sbherpetologia.org.br/ checklist/anfíbios.htm>. Acesso em: 12.07.2006.
- SCOTT, N. J. & WOODWARD, B. D. 1994. Inventory and monitoring. In: HEYER, W. R.; DONNELLY, M. A.; MCDIARMID, R. W.; HAYEK, L. A. C. & FOSTER, M. S. eds. Measuring and monitoring biological diversity Standard methods for amphibians Washington, Smithsonian Institution. p.118-125.
- SMITH, D. C. 1983. Factors controlling tadpole populations of the chorus frog (Pseudacris triseriata) on Isle Royale, Michigan. Ecology 64:501-510.
- SMITH, E. P. & VAN BELLLE, G. 1984. Nonparametric estimation of species richness. Biometrics 40:119-129.
- STRÜSSMANN, C. 2000. Herpetofauna. In: ALHO, C. ed. Fauna silvestre da regiăo do rio Manso, MT Brasília, MMA/ IBAMA. p.153-189.
- TOLEDO, L. F.; ZINA, J. & HADDAD, C. F. B. 2003. Distribuiçăo espacial e temporal de uma comunidade de anfíbios Anuros do município de Rio Claro, Săo Paulo, Brasil. Holos Environment 3(2):136-149.
- VALLAN, D. 2002. Effects of anthropogenic environmental changes on amphibian diversity in the rain forests of eastern Madagascar. Journal of Tropical Ecology 18:725742.
- VASCONCELOS, T. S. & ROSSA-FERES, D. C. 2005. Diversidade, distribuiçăo espacial e temporal de anfíbios anuros (Amphibia, Anura) na regiăo noroeste do estado de Săo Paulo, Brasil. Biota Neotropica 5(2): http://www.biotaneotropica.org.br/ v5n2/pt/abstract?article+BN01705022005
- WELLS, K. D. 1977. The courtship of frogs. In: TAYLOR, D. H. & GUTTMAN, S. I. eds. The reproductive biology of amphibians New York, Plenum. 475p.
- WOODWARD, B. D. 1983. Predator-prey interactions and breeding-pond use of temporary-pond species in a desert anuran community. Ecology 64(6):1549-1555.
- ZAR, J. H. 1999. Biostatistical analysis. New Jersey, Prentice Hall. 929p.
Datas de Publicação
-
Publicação nesta coleção
14 Maio 2007 -
Data do Fascículo
Mar 2007
Histórico
-
Recebido
Ago 2005 -
Aceito
Ago 2006