Resumos
The structure of the male reproductive tract was described in Uca uruguayensis Nobili, 1901, by using histological methods, scanning electron microscopy techniques, and stereoscopic observations of fresh material. The aim of this work was to establish the functional changes associated with sexual maturation. The morphology of the first (G1) and second (G2) pair of gonopods was described. The male reproductive tract consists of paired organs: testes, and tubular and convoluted vas deferens (VD) ending with a terminal ampoule (TA).The (VD) is composed of three parts: anterior (AVD), medial (MVD) and posterior (PVD). The AVD and MVD are lined by a single layer of cubical cells. The PVD epithelial cells are columnar with elongated nuclei. The terminal ampoule comprises four interconnecting chambers and is externally surrounded by connective tissue. The study of testes and vas deferens at different times along the year suggests that U. uruguayensis has a single and continuous reproductive season from December to March. The TA has not been described in other brachyurans and this structure is novel to Brachyura.
Male reproductive tract; functional morphology; Crustacea; Brachyura
El objetivo de este trabajo es describir las estructuras del sistema reproductor de machos de Uca uruguayensis Nobili, 1901 y estudiar los cambios relacionados con la madurez sexual. Se trabajó con observación estereoscópica de material fresco, técnica histológica de rutina y observaciones en Microscopio Electrónico de Barrido. Se incluyó la caracterización de los gonopodos 1 (G1) y 2 (G2). El tracto reproductor del macho se compone de un par de testículos (T), un vaso deferente (VD) tubular y sinuoso y una ampolla terminal (AT). El VD tiene tres secciones, la anterior (VDA), la media (VDM) y la posterior (VDP). El VDA y VDM están conformadas por un epitelio simple de células cúbicas. El epitelio del VDP es columnar y con núcleos basales y alongados. El diseño tubular se modifica al ocuparse el lumen del VDP con líquido espermático durante el verano y la musculatura circular se hace más evidente. La porción terminal del VDP se ensancha formando una ampolla (AT) que comprende cuatro cámaras interconectadas. Todas las estructuras están rodeadas de una capa de tejido conectivo de poco espesor. Se identifican las modificaciones observadas en la histología de T y VD, definiendo como mas relevantes las observadas desde el mes de noviembre hasta marzo. Estas modificaciones sugieren que U. uruguayensis tiene, en la localidad estudiada, una única estación reproductiva durante el verano en esta latitud. La AT, tal como es descripta, es una estructura que hasta el momento no ha sido mencionada para los Brachyura.
Tracto reproductor masculino; morfología funcional; Crustacea; Brachyura
Male reproductive tract; functional morphology; Crustacea; Brachyura
Tracto reproductor masculino; morfología funcional; Crustacea; Brachyura
Estructura del aparato reproductor masculino de Uca uruguayensis (Decapoda, Ocypodidae)
Structure of the male reproductive tract of Uca uruguayensis (Decapoda, Ocypodidae)
Elena Irene CuartasI; Ana María PetriellaII
IDepartamento de Biología, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata, Funes 3250, 7600, Mar del Plata, Argentina. (ecuartas@mdp.edu.ar)
IIDepartamento de Ciencias Marinas, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata, Consejo Nacional de Investigaciones Científicas y Técnicas, Argentina
ABSTRACT
The structure of the male reproductive tract was described in Uca uruguayensis Nobili, 1901, by using histological methods, scanning electron microscopy techniques, and stereoscopic observations of fresh material. The aim of this work was to establish the functional changes associated with sexual maturation. The morphology of the first (G1) and second (G2) pair of gonopods was described. The male reproductive tract consists of paired organs: testes, and tubular and convoluted vas deferens (VD) ending with a terminal ampoule (TA).The (VD) is composed of three parts: anterior (AVD), medial (MVD) and posterior (PVD). The AVD and MVD are lined by a single layer of cubical cells. The PVD epithelial cells are columnar with elongated nuclei. The terminal ampoule comprises four interconnecting chambers and is externally surrounded by connective tissue. The study of testes and vas deferens at different times along the year suggests that U. uruguayensis has a single and continuous reproductive season from December to March. The TA has not been described in other brachyurans and this structure is novel to Brachyura.
Keywords: Male reproductive tract, functional morphology, Crustacea, Brachyura.
RESUMEN
El objetivo de este trabajo es describir las estructuras del sistema reproductor de machos de Uca uruguayensis Nobili, 1901 y estudiar los cambios relacionados con la madurez sexual. Se trabajó con observación estereoscópica de material fresco, técnica histológica de rutina y observaciones en Microscopio Electrónico de Barrido. Se incluyó la caracterización de los gonopodos 1 (G1) y 2 (G2). El tracto reproductor del macho se compone de un par de testículos (T), un vaso deferente (VD) tubular y sinuoso y una ampolla terminal (AT). El VD tiene tres secciones, la anterior (VDA), la media (VDM) y la posterior (VDP). El VDA y VDM están conformadas por un epitelio simple de células cúbicas. El epitelio del VDP es columnar y con núcleos basales y alongados. El diseño tubular se modifica al ocuparse el lumen del VDP con líquido espermático durante el verano y la musculatura circular se hace más evidente. La porción terminal del VDP se ensancha formando una ampolla (AT) que comprende cuatro cámaras interconectadas. Todas las estructuras están rodeadas de una capa de tejido conectivo de poco espesor. Se identifican las modificaciones observadas en la histología de T y VD, definiendo como mas relevantes las observadas desde el mes de noviembre hasta marzo. Estas modificaciones sugieren que U. uruguayensis tiene, en la localidad estudiada, una única estación reproductiva durante el verano en esta latitud. La AT, tal como es descripta, es una estructura que hasta el momento no ha sido mencionada para los Brachyura.
Palabras clave: Tracto reproductor masculino, morfología funcional, Crustacea, Brachyura.
Uca uruguayensis Nobili 1901, es un cangrejo braquiuro que se distribuye en ambientes estuariales desde Rio de Janeiro hasta la desembocadura del rio Quequén en la Provincia de Buenos Aires (SPIVAK et al.,1991; BOSCHI, 2000). En la laguna Mar Chiquita, Argentina (37º 45'S 57º 26'W) vive en el supralitoral en el margen externo de los cangrejales donde cava galerías y cuevas en el barro.
A pesar de los trabajos realizados sobre la ecología (SPIVAK et al., 1991), la distribución (BOGAZZI et al., 1999) y su adaptación a la vida terrestre (LUQUET et al., 1992), no hay trabajos, hasta el momento, sobre las modificaciones morfológico-funcionales del aparato reproductor de esta especie, durante la estación productiva.
SPIVAK et al. (1991), trabajando en la laguna de mar Chiquita, registraron hembras ovígeras de U. uruguayensis sólo en el mes de febrero.
En algunas especies de cangrejos la actividad reproductiva es continua durante todo el año (FEDOSEYEB, 1988); tal es el caso de Goniopsis cruentata (Latreille, 1803) en Brasil (COBO & FRANSOZO, 2003). En otras, como Ucides cordatus (Linnaeus, 1763) la reproducción se desarrolla en períodos anuales que pueden variar en duración (DALABONA & LOYOLA & SILVA, 2005).
El carácter adaptativo de la actividad cíclica en la reproducción fue sugerido por CHRISTY (1978). HARTNOLL (2006) sugiere que reproducirse, en brachiuros, involucra patrones de comportamiento o procesos fisiológicos que impactarán en el rendimiento de los individuos; uno de estos patrones sería la coordinación fisiológica entre los sexos.
En los crustáceos el dimorfismo sexual es frecuente, manifestándose en el mayor tamaño del cuerpo y de las pinzas de los quelípedos en los machos (CONLAN, 1991; LEE, 1995), y a veces en el largo de las antenas (THIEL & DUFFY, 2007). En algunos grupos los pleópodos anteriores se modifican con función reproductora (KROL et al., 1992).
Son los Brachyura los que, en general, presentan las estructuras diferenciales más complejas (BAUER, 1986). En el caparazón de algunos Ocypodidae macho y hembra difieren en las crenulaciones suborbitales y en la forma de la base orbital (CRANE, 1975; SHIH et al., 1999). También es característica en los machos de cangrejos la diferenciación de los pleópodos, el primero es tubular y armado y el segundo, en general menor, actúa de pistón impulsando la masa de espermatóforos hacia el interior de la espermateca (MCLAUGHLIN, 1983; BAUER, 1986; KRONENBERGER et al., 2004).
En el estudio del ciclo reproductivo de una especie no solo es importante reconocer la morfología de las gónadas sino también sus variaciones morfo-funcionales (LEME, 2005). Estas variaciones han sido estudiadas en otros Brachyura con relación a la madurez sexual (HARTNOLL, 1974; LOPEZ et al., 1997) y a la duración del ciclo reproductor (HINSCH, 1988).
En los machos de Brachyura el aparato reproductor está compuesto por un par de testículos simétricos que se conectan vía colectores con los vasos deferentes que comunican con el exterior a través de un conducto eyaculatorio (HARTNOLL, 1968). Dependiendo de la especie, el vaso deferente (VD) presenta entre tres y diez secciones (MCLAUGHLIN, 1983). En un trabajo previo sobre la formación y funcionalidad de los espermatóforos de U. uruguayensis, se describió someramente la estructura e histología de los testículos y un análisis preliminar de la zonación del VD (CUARTAS & PETRIELLA, 2007).
En la revisión bibliográfica, se advierte que la nomenclatura empleada para las descripciones varía según los autores. Así, las agrupaciones de células germinales rodeadas por un epitelio escamoso han sido designadas como "acinos" (BURTON, 1995), "acini" (HINSCH, 1988), "lóbulos" (JOHNSON, 1980) o "conductos seminíferos" (MORIYASU et al., 2002) y cistos testiculares (GARCIA & SILVA, 2006). Las células somáticas del testículo han sido denominadas "células acompañantes" (HALEY, 1984), "células epiteliales" (HINSCH, 1988), células "nurse" (KROL et al., 1992), "epitelio escamoso" (GARCIA & SILVA, 2006).
El objetivo de este trabajo es avanzar en el conocimiento de la biología reproductiva de U. uruguayensis; se retoma el estudio de la estructura de las distintas partes del tracto reproductor de los machos y se analiza la relación con los cambios funcionales asociados al proceso de maduración sexual en el ciclo reproductivo anual.
MATERIAL Y MÉTODOS
Ejemplares machos adultos de U. uruguayensis, de 09-14 mm de ancho de caparazón (AC) fueron muestreados en la orilla de la laguna de Mar Chiquita durante los años 2001-2002. La colecta se realizó en un cangrejal ubicado a 500 m de la boca de la laguna. Para la observación macroscópica del tracto reproductor se accedió a la cavidad general del cuerpo por un corte circular en el caparazón dorsal, observando con un estereomicroscopio. El estado de la gónada se determinó de acuerdo con lo descrito para otros braquiuros (WENNER, 1989; FLORES et al., 2002). Los ejemplares se agruparon en sexualmente activos e inactivos según BENETTI et al. (2007).
Para realizar el análisis histológico, se disecaron los órganos reproductores, el material se fijó en mezcla de Davidson (BELL & LIGHTNER, 1988). El vaso deferente (VD) y el testículo se deshidrataron en serie creciente de alcohol etílico y se incluyeron en parafina. Los cortes (4-5 µm) se tiñeron con técnica de hematoxylina-eosina (H&E). El material destinado a la observación con Microscopio Electrónico de Barrido se fijó a 4 ºC en glutaraldehido al 2,5 % en 0,1 M buffer cacodilato a pH 7. La deshidratación se realizó en serie creciente de alcoholes y para el secado se utilizó HMDS (Hexamethyldisilazane, Fluka®), en reemplazo del punto crítico. Las muestras se montaron en tacos de aluminio, y se metalizaron con AU/ PL (oro-paladio), usando para la observación un ultramicroscopio JEOL 6460.
En este trabajo optamos por emplear la terminología usada por (GARCIA & SILVA, 2006) en su trabajo sobre el tracto reproductivo del cangrejo G. cruentata. El término "lóbulo" se aplica a la descripción macroscópica; en la microscópica, denominamos cistos a la estructura que encierra células germinales en distinto estado de maduración.
RESULTADOS
Se consideraron adultos los ejemplares de tamaño superior a los 9 mm en los que se identifican claramente los dos primeros pleópodos transformados en gonopodos (G) y las diferencias morfológicas entre G1 y G2. En general, los machos activos sexualmente recolectados eran mayores o iguales a 11 mm.
El primer pleopodo (G1) está formado por un protopodito basal y un endopodito que se extiende hasta el primer segmento torácico (Fig. 1). Este apéndice es rígido y calcáreo, de corte triangular; el extremo distal, con forma de gancho, se curva hacia fuera y presenta un conjunto de setas apicales cerca del poro y setas subapicales en la base (Fig. 2). El G2 está reducido a una estructura membranosa bilobulada (Fig. 3).
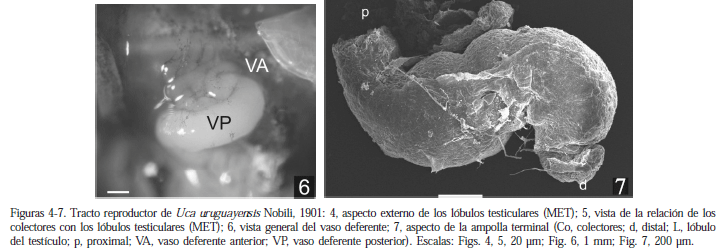
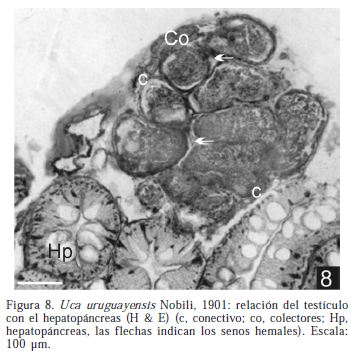
Los machos presentan un par de testículos con sus VD desembocando en los gonoporos pares. Macroscópicamente, el testículo es sacular, grisáceo y se localiza en la zona anterodorsal de la cavidad general del cuerpo; esta formado por numerosos lóbulos que conectan con el VD por conductos colectores cortos (Fig. 4, 5). En los ejemplares sexualmente inactivos (junio-julio) el VD es un conducto tubular, tortuoso en algunos segmentos, que se localiza al costado del aparato digestivo. La porción anterior del vaso deferente (VDA) es delgada y transparente, la posterior (VDP) se observa dilatada y de color blanquecino. En los ejemplares sexualmente activos (enero-marzo) el VDA se ve largo y contorneado y el VDP se dilata (Fig. 6), terminando en una ampolla que desemboca en la coxa del quinto par de pereiopodos (Fig. 7). El vaso deferente medio (VDM), por su longitud, no es fácilmente observable. Los testículos están rodeados por una pared epitelial cubierta externamente por una lámina de conectivo; este conectivo separa al testículo en subunidades o lóbulos, relacionados espacialmente con el hepatopáncreas (Fig. 8).
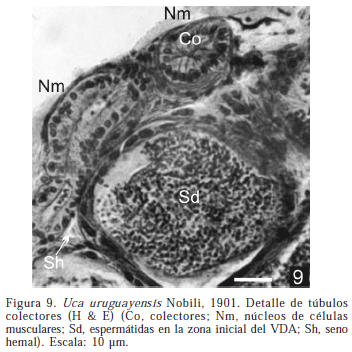
Histológicamente, cada lóbulo está compuesto por numerosos cistos (que miden entre 60 y 110 µ de diámetro); desembocan en los tubos colectores. Los cistos están delimitados por una fina lámina de conectivo, entre los que se ubican los senos hemales (Fig. 9). En los cistos se observan las células germinales compactadas en los bordes denominándose a esta estructura área germinativa, (ZG); durante la espermatogénesis se genera en cada cisto un espacio lateral rodeado por epitelio escamoso, que se continua del que bordea exteriormente el cisto; esta zona se considera un área de diferenciación y maduración (ZM). En los machos inactivos las ZM son escasas y estrechas (Fig. 10).
En los machos sexualmente activos, en los cistos el arreglo de la zona germinal es laxo sin embargo un grupo de células se mantienen siempre como espermatogonias (Figs. 11, 12). En una etapa posterior la ZM está totalmente ocupada por espermatozoides. Las células nurse rodean los cistos de machos activos, cuyo diámetro alcanza entre 250 y 380 µ (Fig. 13).
Los conductos colectores del testículo relacionan a los lóbulos con el VDA y están revestidos por un epitelio cúbico simple (Fig. 9). El VD está rodeado por tejido conectivo que incluye a los núcleos de las fibras musculares. Las células epiteliales que forman el VDA y el VDM son cúbicas con núcleos basales (Fig. 14).
En los ejemplares del mes de agosto, en reposo sexual, las células epiteliales del VDP son columnares, con núcleos dispuestos en distinto nivel y el lumen está revestido por una membrana apical amorfa (Fig. 15). El VDP termina en una estructura ampular (AT), con epitelio glandular plegado que limita espacios separados por un septo (Fig. 16). El lumen del VD, en machos inactivos, en sus tres secciones está vacío y la ampolla se observa libre de espermatóforos. Sólo en algunos ejemplares la región posterior de la misma presenta secreción hialina.
El cambio más evidente en los individuos sexualmente activos es el aumento del diámetro del VD, destacándose la sinuosidad del VDA y del VDP; la musculatura circular lisa del VDP delimita sectores dilatados que sugieren una mayor cantidad de fluido seminal (Fig. 17). Esta característica coincide con la aparición de espermatóforos en el interior del tracto genital a partir de diciembre; desde este mes hasta marzo los testículos están constituídos por cistos que presentan predominio de ZM con células en el mismo estadio de espermatogénsis. Sin embargo, coexisten cistos adyacentes en diferentes fases de maduración (Fig. 11). La repleción del VDM, con células epiteliales aplanadas y los espermatozoides rodeados por la sustancia amorfa, indica la formación incipiente de los espermatóforos (Fig. 18).
DISCUSIÓN
La estructura diferencial del sistema reproductor de los machos de Brachyura son los apéndices del pleon que intervienen en el proceso de la transferencia de esperma. El primer par de pleópodos (gonopodo=G1) es tubular y dirige la corriente de esperma hacia el gonoporo femenino; el (G2) actúa como pistón que impulsa la masa de espermatóforos hacia la espermateca (BAUER, 1986; KRONENBERGER et al., 2004). En algunas familias como Cancridae y Majiidae (BENINGER et al., 1988; SQUIRES, 1990) ambos gonopodos son apéndices largos de diferente robustez según el grupo.
DIESEL (1991) hipotetiza que el largo de los G1 en cangrejos cancridos y portunidos permiten la penetración del apex en la espermateca, desplazando ventralmente el eyaculado previo. BENINGER et al. (1988) sugiere que el G1 del cangrejo majido Chionoecetes opilio (Fabricius, 1788), debido a su forma recurvada hacia afuera, removería el contenido de una cópula anterior depositado en la espermateca.
En ocipodidos el G1 es conspicuo, el poro varía de tamaño, el borde apical se curva según las especies. En Uca formosensis Rathbun, 1921, esta rodeado de setas espesas (SHIH et al., 1999). En el cangrejo centinela, Macrophthalmus telescopicus (Owen, 1839) la proyección distal está abruptamente curvada y las setas son escasas (NAGAI et al., 2006).
En U. uruguayensis el G1 tiene forma tubular con un surco ventral. Tanto la forma levemente recurvada del extremo apical como el largo y la orientación de las setas apicales, no parece sugerir una función similar en la renovación del contenido de la espermateca. Esta estructura tendría participación en la apertura del gonoporo femenino durante la cópula (ORENZANS et al., 1995).
El G2 en U. uruguayensis es reducido y membranoso, tiene dos lóbulos. El interior es de tamaño reducido. Se diferencia de otras especies de la familia como Macrophthalmus microfylacas Nagai, Watanabe & Naruse, 2006 en la que el lóbulo membranoso es único y muy pequeño; o Uca subcylindrica (Stimpson, 1859) con G1 y G2 muy largos (THURMAN, 1985).
JENNINGS et al. (2000), trabajando con Macrophthalmus hirtipes (Jacquinot, 1853), mencionan que "el diámetro y el largo del G1 es un determinante importante de la forma en que un macho es capaz de copular con una hembra", aun cuando el gonopodo no se inserte en el gonoporo femenino. Para HARTNOLL (1974) la morfología del G2 se relaciona con la importancia de su función: impulsar la secreción del VD fuera de la abertura apical del G1 y bombearlo a la espermateca femenina, donde se deposita hasta la ovulación. THURMAN (1985), sugiere que el largo de los gonopodos de U. subcylindrica es un carácter seleccionado para producir una eficiente intromisión. La estructura bilobulada del G2 de U. uruguayensis sugiere una funcionalidad mas eficiente para impulso del esperma, ya que el lóbulo interior no alcanza longitud como para asistir a la apertura del gonoporo femenino.
La morfología del tracto reproductor masculino de U. uruguayensis es similar a la de los sistemas reproductivos descriptos para Decapoda en general (KROL et al., 1992) como por HINSCH (1988) para Brachyura en particular. Respecto de los testículos, estos son dos estructuras lobulares adheridas a la cara ventral del caparazón dorsal, que no presentan comisura, tal como se cita para Brachyura (JOHNSON 1980; GARCIA & SILVA, 2006). MANTELATTO & FRANSOZO (1999) analizando el desarrollo del testículo de Callinectes ornatus Ordway, 1863 observaron una gran proporción de cistos desarrollados o maduros en el testículo durante todo el año. Estas observaciones permiten considerar que la especie tiene un ciclo anual reproductivo continuo. También en el cangrejo C. opilio la espermatogénesis es un proceso continuo a lo largo del año (FEDOSEYEV, 1988).
La observación de los ejemplares analizados permitió identificar distintos estados del tracto reproductor masculino: en invierno el testículo está retraído, histológicamente los cistos son de menor tamaño, y con predominio de las células germinales indiferenciadas. Entre enero y marzo el testículo aumenta de volumen y es visible macroscópicamente; la estructura histológica de los cistos presenta distintos estadios de la espermatogénesis. Estas modificaciones son sincrónicas en ambos testículos, y aparecen en todos los machos mayores de 11mm en la muestra estudiada. Este fenómeno sugiere la estacionalidad del ciclo reproductivo de esta especie en la laguna de Mar Chiquita.
Otros elementos que tienen una dinámica correlacionada con la estacionalidad son las "células nurse". HALEY (1984) propuso el nombre de "células acompañantes" debido a lo desconocido de su rol fisiológico. Según KROL et al. (1992), son las únicas células no germinativas dentro del testículo; tienen escaso desarrollo en los meses de invierno y en verano forman el epitelio escamoso que recubre al cisto espermático y limita al "tubo seminífero" durante los últimos estadios de la espermatogénesis. Las "células nurse" nacen de las paredes del testículo y ayudan a sostener a las células germinales durante su desarrollo (PILLAI, 1960; POCHON-MASSON, 1968). CHOW et al. (1991) sugieren que esta células somáticas varían morfo-funcionalmente con el estado de la espermatogénesis. Coincidentemente, en U. uruguayensis las "células nurse" se visualizan fácilmente en los cistos del testículo de los ejemplares maduros; en los machos inactivos se asocian visualmente al epitelio escamoso.
La división del VD de los decápodos en zonas morfofuncionales distintas ha sido descripta por varios autores (MCLAUGHLIN, 1983; BENHALIMA & MORIYASU, 2000). HINSCH (1988) trabajando con Geryon fenneri Manning & Holthuis, 1984 indica que el aumento del diámetro de las distintas regiones del VD se relaciona con el incremento de esperma maduro en los testículos. GARCIA & SILVA (2006) interpretan que, en parte, la expansión del diámetro de este conducto es un signo de actividad secretoria en G. cruentata. Por otra parte, SAINT MARIE et al. (1999) mencionan que las fibras de los músculos longitudinales que circundan las paredes del VD de C. opilio contribuyen a modelar a los espermatóforos y a su vez los músculos circulares favorecen el avance del fluido seminal.
El VDA y el VDM de U. uruguyensis tienen una citología similar a la descripta por HINSCH (1988) para G. fenneri. El hecho de que se observen pocas fibras musculares puede deberse a que no participen activamente en el transporte del fluido seminal; éste sería impulsado por la propia secreción de la matriz primaria producida en los cistos, (GONZALES & CERIZOLA, 1997; CUARTAS & PETRIELLA, 2007). BENHALIMA & MORIYASU, (2000) reportan que diferentes tipos de fluidos se generan en la porción intermedia del VD de C. opilio. Para MORIYASU et al. (2002), el VDM tiene en Cancer borealis Stimpson, 1859 la función de reabsorción de productos de secreción del VDA. En machos activos de U. uruguyensis los espermatóforos se observan densamente agrupados en este segmento (CUARTAS & PETRIELLA, 2007), por lo que puede pensarse en un función de secreción para facilitar el avance de los mismos hacia el VDP.
Para DIESEL (1991) el PVD produce y almacena el plasma seminal, y su porción final está particularmente desarrollado en cangrejos araña y en otros braquiuros. GARCIA & SILVA (2006) describen en el cangrejo G. cruentata, la presencia de una pequeña papila en la base de la última pata torácica.
BENHALIMA & MORIYASU (2000) describen en la parte final del VDP de C. opilio estructuras ciegas, que están rodeadas de tejido muscular. Estas estructuras permitirían la transferencia del fluido seminal en forma independiente desde diferentes regiones del VDP. En un trabajo anterior BENINGER et al. (1988) les asignan a los ciegos del VDP función exclusivamente secretora, por no haber encontrado espermatóforos en ninguno de los ejemplares estudiados.
En U. uruguayensis el VDP termina en una estructura dilatada que, internamente, presenta una zona epitelial muy desarrollada que aportaría secreciones a la formación de la sustancia amorfa del fluido seminal. En esta especie la formación de los espermatóforos se inicia en el VDA(CUARTAS & PETRIELLA, 2007). Por lo tanto la AT no tendría la función de estructuración de los mismos como proponen (DIAZ et al., 2002) para el langostino Pleoticus muelleri Bate, 1832. La existencia de cuatro cámaras aseguraría el almacenamiento del esperma y la transferencia espermática en sucesivas inseminaciones.
Las variaciones morfo-funcionales en el tracto reproductor de U. uruguayensis fueron observadas en machos activos en su mayoría recolectados entre los meses de noviembre y marzo. Esta observación permite establecer estos meses como período de actividad reproductiva de la especie en esta latitud, ampliando la propuesta de SPIVAK et al. (2001). El hecho de que la actividad de "waving" se inicie tempranamente en la primavera, en machos de todos los tamaños (obs. pers.), estimula al estudios fisio-ecológicos sobre esta problemática. Para tener un conocimiento acabado de su biología reproductiva, es necesario concluir trabajos sobre el tamaño de madurez sexual y la simultaneidad de los procesos madurativos en ambos sexos.
Recebido em outubro de 2008.
Aceito em outubro de 2009.
- BAUER, R. T. 1986. Phylogenetic trends in sperm transfer and storage complexity in decapod crustaceans. Journal of Crustacean Biology 6:313-325.
- BELL, T. A. & LIGHTNER, D. V. 1988. A handbook of normal penaeid shrimp histology. Kansas, Allen. 144p.
- BENETTI, A. S.; NEGREIROS-FRANSOZO, M. L. & COSTA, T. M. 2007. Population and reproductive biology of the crab Uca burgersi (Crustacea: Ocypodidae) in three subtropical mangrove forests. Revista de Biología Tropical 55(Suppl.1):55-70.
- BENHALIMA, K. & MORIYASU, M. 2000. Structure and function or the posterior vas defferent of the snow crab, Chionoecetes opilio (Brachyura, Majidae). Invertebrate Reproduction and Development 37(1):11-23.
- BENINGER, P. G.; ELNER, R. W.; FOYLE, T. P. & ODENSE, P. H. 1988. Functional anatomy of the male reproductive system and female spermatheca in the snoaw crab Chionoecetes opilio (O. Fabricius) (Decapoda: Majidae) and a hypothesis for fertilization. Journal of Crustacean Biology 8(3):322-332.
- BOGGAZI, E.; IRIBARNE, O.; GUERRERO, R. & SPIVAK, E. 1999. Wind pattern may explain the southern limit of distributionof a sourhwestern Atlantic fidder crab. Journal of Shellfish Research 59:483-500.
- BOSCHI, E. E. 2000. Species of decapod crustaceans and their distribution in the american marine zoogeographic provinces. Revista de Investigación y Desarrollo Pesquero 13:7-136.
- BURTON, T. E. 1995. The spermatid parhway and associated reproductive structures of squat lobster Thenus orientalis (Lund, 1793). Invertebrate Reproduction and Development 28(1):1-23.
- CHOW, S; DOUGHERTY, M. M.; DOUGHERTY, W. J. & SANDIFER, P. A. 1991. Spermatophore formation in the white shrimps Penaeus setiferus and P. vannamei Journal of Crustacean Biology 11:1-216.
- COBO, V. J. & FRANSOZO, A. 2003. External factors determining breeding season in the red mangrove crab Goniopsis cruentata (Latreille) (Crustacea, Brachyura, Grapsidae) on the São Paulo State northern coast, Brazil. Revista Brasileira de Zoologia 20(2):213-217.
- CONLAN, K. E. 1991. Precopulatory mating behavior and sexual dimorphism on the amphipod Crustacea. Hydrobiologia 223:255-282.
- CRANE, J. 1975. Fiddler crabs of the World (Ocypodidae: genus Uca) New Jersey, Princeton Unversity. 736p.
- CHRISTY, J. H. 1978. Adaptive significance of reproductive cycles in the fiddler crab Uca pugilator: a hypothesis. Science 199:453-455.
- CUARTAS, E. I. & PETRIELLA, A. M. 2007. Formación inicial de los espermatofóros en el testículo de Uca uruguayensis (Brachyura, Ocypodidae). Revista de Biología Tropical 55(Suppl.1):9-14.
- DALABONA, G. & LOYOLA E SILVA, J. 2005. Período reprodutivo de Ucides cordatus (Linnaeus) (Brachyura, Ocypodidae) na Baia das Laranjeiras, sul do Brasil. Acta Biologica Paranaense 34(1,2,3,4):115-126.
- DIAZ, A. C.; FERNANDEZ GIMENEZ, A. V.; PETRIELLA, A. M. & FENUCCI, J. L. 2002. Morphological and functional study of the male reproductive tract in the shrimp Pleoticus mulleri Bate (Decapode, Penaeoidea). Invertebrate Reproduction and Development 42(1):69-74.
- DIESEL, R. 1991. Sperm competitionand the evolution of mating Behavior in Brachyura, with special referente to spider crabs (Decapoda, Majidae). In: BAUER, R. & MARTIN, J. eds. Crustacean Sexual Biology. New York, Columbia University. p.145-165.
- FEDOSEYEV, V. Y. 1988. Duration and productivity of spermatogenesis in the snow crab, Chionoecetes opilio (wave of the spermatogenesis epithelium) In: IVANOV, B. G. ed. Morskie promyslovye bespozvonochnye. Moscow, Vses. Nauchno-Issled. Inst. Morsk. Rybn. Khoz. Okeanogr. p.36-44. (English translation: Can. Transl. Fish. Aquat. Sci. 5601).
- FLORES, A. V.; SARAIVA, J. & PAULA, J. 2002. Sexual maturity, reproductive cycles, and juvenile recruitment of Perisesarma guttatum (Brachyura, Sesarmidae) at Ponta Rasa mangrove swamp, Inhaca Island, Mozambique. Journal of Crustacean Biology 22(1):142-156.
- GARCIA, T. M. & SILVA, J. R. F. 2006. Testis and vas deferens morphology of the red-clawed mangrove tree crab (Goniopsis cruentata) (Latreille, 1803). Brazilian Archives of Biology and Technology 49(2):339-345.
- GONZALEZ, M. & CERISOLA, H. 1997. Descripción histológica del aparato reproductor masculino y formación del espermatóforo em Emerita analoga (Stimpson, 1857) (Decapoda Anomura). Revista de Biología Marina y Oceanografía 32(2):215-225.
- HALEY, S. R. 1984. Ultrastructure of spermatogenesis in de Hawaiian red lobster, Henoplometopus occidentalis (Randall). Journal of Morphology 190:81-92.
- HARTNOLL, R. G. 1968. Mating in Brachyura. Crustaceana 16:161-181.
- ______. 1974. Variation in growth pattern between some secondary sexual characters in crabs (Decapada Brachyura). Crustaceana 27(2):131-136
- ______. 2006. Reproductive investment in Brachyura. Hydrobiolgia 577:31-40.
- HINSCH, G. H. 1988. Morphology of the reproductive tract and seasonality of reproduction in the goleen crab Geryon fenneri from the eastern Gulf of Mexico. Journal of Crustacean Biology 8(2):254-261.
- JENNINGS, A. C.; MCLAY, C. L. &. BROCKERHOFF, A. M. 2000. Mating behaviour of Macrophthalmus hirtipes (Brachyura: Ocypodidae). Marine Biology 137:267-278.
- JOHNSON, P. T. 1980. Histology of the blue crab, Callinectes sapidusNew York, Praeger Publishers. 440p.
- KROL, R. M.; HAWKINS, W. E. & OVERSTREET, R. M. 1992. Reproductive components, Decapod Crustacea. In: HARRISON, F. W. ed. Microscopic Anatomy of Invertebrates New York, Wiley-Liss. v.10, p.295-343.
- KRONENBERGER, K.; BRANDIS, D.; TURKAY, M. & STORCH, V. 2004. Functional morphology of the reproductive system of Galatea intermedia (Decapoda: Anomura). Journal of Morphology 262:500-516.
- LEE, S. Y. 1995. Cheliped size and structure: the evolution of a multifunctional decapod organ. Journal of Experimental Marine Biology and Ecology 193:161-173.
- LEME, M. H. A. 2005. Size at sexual maturity of female crabs Sesarma rectum Randall (Crustacea, Brachyura) and ontogenetic variations in the abdomen relative growth. Revista Brasileira de Zoologia 22(2):1-7.
- LOPEZ, L. S.; STELLA, V. & RODRIGUEZ, E. 1997. Size at the onset of sexual maturity in Chasmagnathus granulata (Decapoda, Brachyura). Nauplius 5:65-75.
- LUQUET, C. M.; FORD, P.; RODRIGUEZ, E.; ANSALDO, M. & STELLA, V. 1992. Ionic regulation patterns in two species of stuarine crabs. Comunicaciones Biologicas 10:315-325.
- MCLAUGHLIN, P. A. 1983. Comparative Morphology of Recent Crustacea New York, W. H. Freeman. 177p.
- MANTELATTO, F. L. M. & FRANSOZO, A. 1999. Reproductive biology and moulting cycle of the crab Callinectes ornatus (Decapoda: Portunidae) from the Ubatuba region, São Paulo, Brazil. Crustaceana 72(1):63-76.
- MORIYASU, M.; BENHALIMA, K; DUGGAN, D; LAWTON, P. & ROBICHAUD, D. 2002. Reproductive biology of male jonah crab, Cancer borealis Stimpson, 1859 (Decapoda, Cancridae) on the scotian shelf, northwestern Atlantic. Crustaceana 75(7):891-913.
- NAGAI, T.; WATANABE, T. & NARUSE, T. 2006. Macrophthalmus (Macrophthalmus) microfylacas, a new species of sentinel crab (Decapoda: Brachyura: Ocypodidae) from western Japan. Zootaxa 1171:1-16.
- ORENZANS, J. A.; PARMA, A. M.; ARMSTRONG, A.; ARMSTRONG, J. & WARDRUP, P. 1995. The breeding ecology of Cancer gracilis (Crustacea: Decapoda: Cancridae) and the mating systems of cancrid crabs. Journal of Zoology 235:411-437.
- PILLAI, R. S. 1960. Studies on the shrimp Caridina laevis (Heller). Journal of Marine Biology Association 2:57-74.
- POCHON-MASSON, J. 1968. L'ultrasturcture des espermatozoïdes vésiculares chez les crustacés décapodes avant au cours de leur dévagination expérimentale. I. Brachyoures et anomoures. Annales des Sciences Naturelles. Zoologie et Biologie animale, Sér. 12, 10:1-100.
- SAINTE MARIE, B.; RAIMONT, S. & BRETHES, J. C. 1999. Growth and maduration of the bentic stages of the male snow crab Chionoecetes opilio (Brachyura: Majidae). Canadian Journal Fisheries Aquatic Science 52:903-924.
- SHIH, H; MOK, H.; CHANG, H. & LEE, S. 1999. Morphology of Uca formosensis Rathbun, 1921 (Crustacea: Decapoda: Ocypodidae), an endemic fiddler crab from Taiwan, with notes on its ecology. Zoological Studies 38(2):164-177.
- SPIVAK, E. D.; GAVIO, M. A. & NAVARRO, C. E. 1991. Life history and structure of the world's southernmost Uca populations: Uca uruguayensis (Crustacea:Brachyura) in Mar Chiquita lagoon (Argentina). Bulletin of Marine Science 48:679-688.
- SPIVAK, E. D.; LUPPI, T. & BAS, C. 2001. Cangrejos y camarones: las relaciones organismo ambiente en las distintas fases del ciclo de vida. In: IRIBARNE, O. ed. Reserva de Biosfera Mar Chiquita: Características físicas, biológicas y ecológicas Mar del Plata, Editorial Martín. p.129-151.
- SQUIRES, H. J. 1990. Decapod Crustacea of the Atlantic coast of Canada. Canadian Bulletin of Fisheries and Aquatic Sciences 221:1-532.
- THIEL, M. & DUFFY, J. E. 2007. The behavioural ecology of crustaceans: a primer in taxonomy, morphology, and biology. In: THIEL, M. & DUFFY, J. E. eds. Evolutionary Ecology of Social and Sexual Systems. New York, Oxford University. p.3-27.
- THURMAN, C. L. 1985. Reproductive biology and population structure of the fiddler crab Uca subcylindrica (Stimpson). Biological Bulletin 169:215-229.
- WENNER, A. M. 1989. Incidence of insemination in female of blue crabs, Callinectes sapidus. Journal of Crustacean Biology 9:587-594.
Datas de Publicação
-
Publicação nesta coleção
23 Jul 2010 -
Data do Fascículo
Mar 2010
Histórico
-
Aceito
Out 2009 -
Recebido
Out 2008