RESUMO
Este estudo teve por objetivo caracterizar a diversidade carcinológica de dois manguezais (igarapés Buenos Aires e Tronco) da Baía de São Marcos, na costa amazônica maranhense, Brasil. Foram realizadas quatro coletas trimestrais entre setembro de 2011 a junho de 2012. Em cada coleta foram analisados três pontos por área (zona 1, zona 2 e zona 3), totalizando 24 amostras. O material biológico foi coletado por meio de arrastos com rede do tipo puçá, catação manual e técnica de braceamento. Paralelamente à coleta do material biológico, foram verificados a salinidade, temperatura e oxigênio dissolvido de cada área analisada. Para avaliar a similaridade de agrupamento entre as zonas dos manguezais foi aplicada a análise de cluster e consecutiva elaboração de dendrogramas. Foi coletado um total de 873 indivíduos, representando nove famílias e 21 espécies, das quais Ocypodidae e Penaeidae foram as mais abundantes. Em relação à distribuição espacial, percebe-se que Clibanarius vittatus (Bosc, 1802), Clibanarius tricolor (Gibbes, 1850), Clibanarius foresti Holthuis, 1959 e Uca maracoani (Latreille, 1802) se restringiram à primeira zona dos dois manguezais, enquanto outras dez espécies foram observadas por todo o manguezal, o que pode estar intimamente relacionado ao seu hábito de vida. De um modo geral, o igarapé Buenos Aires apresentou maior número de espécies em relação ao igarapé Tronco, no entanto, existe grande similaridade faunística de crustáceos decápodes entre as duas áreas amostradas.
PALAVRAS- CHAVE
Decapoda; diversidade; carcinofauna; Amazônia
ABSTRACT
This study aimed to characterize the diversity of crustaceans in two mangroves (Buenos Aires and Tronco) in the Bay of São Marcos, Maranhão Amazon coast, Brazil. Four samples were taken quarterly between September 2011 to June 2012. In each survey, three regions were analyzed (zone 1, zone 2 and zone 3), yielding 24 samples. The biological material was collected manually. Environmental parameters such as salinity, temperature and dissolved oxygen were collected in each sampling area. In order to evaluate the similarity between the mangrove zones, a cluster analysis and consecutive development of dendrograms were used. A total of 873 individuals were collected, representing nine families and 21 species, of which the Ocypodidae and Penaeidae had the largest number of individuals. It was observed that Clibanarius vittatus (Bosc, 1802), Clibanarius tricolor (Gibbes, 1850), Clibanarius foresti Holthuis, 1959 and Uca maracoani (Latreille, 1802) were restricted to the first zone of the two mangroves, while other 10 species were observed throughout the mangroves, which may be closely related to their life habit. In general, the Buenos Aires stream recorded the greatest number of species in relation to the Tronco stream. However, a great similarity of the number of species and individuals of decapod crustaceans was found between the two sampled areas.
KEYWORDS
Decapoda; diversity; carcinofauna; Amazon
Os manguezais formam uma comunidade biológica de extrema relevância ecológica e comercial para toda a zona costeira (Ferreira & Sankarankutty, 2002Ferreira, A. C. & Sankarankutty, C. 2002. Estuarine carcinofauna (Decapoda) of Rio Grande do Norte, Brazil. Nauplius 10:121-129.; Bezerra et al., 2006Bezerra, L. E. A.; Dias, C. B.; Santana, G. X. & Matthews-Cascon, H. 2006. Spatial distribution of fiddler crabs (genus Uca) in a tropical mangrove of northeast Brazil. Scientia Marina 70:759-766. ), sendo considerados os ambientes naturais mais produtivos do mundo (Castiglioni & Negreiros-Fransozo, 2006_____. 2006. Ciclo reprodutivo do caranguejo violinista Uca rapax (Crustacea: Decapoda: Ocypodidae) habitante de um estuário degradado em Paraty, Rio de janeiro, Brasil. Revista Brasileira de Zoologia 23:331-339.). Oferecem condições favoráveis para a alimentação, proteção e reprodução de muitos organismos, o que os torna um ecossistema diverso (Fernandes, 2003Fernandes, M. E. B. 2003. Os manguezais da costa norte brasileira, Maranhão. São Luís, Fundação Rio Bacanga. 142p.).
Os manguezais amazônicos representam cerca de 50% dos manguezais da costa brasileira, entretanto a fauna bêntica local ainda é pouco conhecida em relação às regiões Sul e Sudeste do país. Alguns estudos têm sido realizados com o intuito de melhor conhecer a macrofauna bêntica desses manguezais, no entanto o conhecimento acerca da composição, estrutura e o funcionamento de algumas comunidades bênticas ainda não é satisfatório (Silva & Almeida, 2002Silva J. R. R. & Almeida Z. S. 2002. Zoneamento vertical dos crustáceos bentônicos em substratos inconsolidados do manguezal do quebra-pote na Ilha de São Luís, Maranhão - Brasil. Boletim Técnico-Científico CEPENE 10: 125-143.; Amaral & Jablonski, 2005Amaral, A. C. Z. & Jablonski, S. 2005. Conservação da biodiversidade marinha e costeira no Brasil. Megadiversidade 1:43-51.; Diele et al., 2005Diele, K.; Koch, V. & Saint-Paul, U. 2005. Population structure, catch composition and CPUE of the artisanally harvested mangrove crab Ucides cordatus (Ocypodidae) in the Caeté estuary, North Brazil: Indications for overfishing? Aquatic Living Resources 18:169-178., 2010Diele, K.; Koch, V. Abrunhosa, F. A; Lima, J. F. & Simith, D. J. B. 2010. The Brachyuran crab community of the Caeté estuary, North Brazil: Species richness, zonation and abundance. Mangrove Dynamics and Management in North Brazil. Ecological Studies 211:251-263.; Rosa Filho et al., 2006Rosa Filho, J. S.; Busman, D. V.; Viana, A. P.; Gregório, A. M. & Oliveira, D. M. 2006. Macrofauna bentônica de zonas entre-marés não vegetadas do estuário do rio Caeté, Bragança, Pará. Boletim do Museu Paraense Emílio Goeldi 1:85-96.; Nordhaus et al., 2009Nordhaus,I; Diele, K. & Wolff, M. 2009. Activity patterns, feeding and burrowing behaviour of the crab Ucides cordatus (Ucididae) in a high intertidal mangrove forest in North Brazil. Journal of Experimental Marine Biology and Ecology 374:104-112.; Ribeiro & Almeida, 2014Ribeiro, R. P. & Almeida, Z. S.2014. Anelídeos Poliquetas do estado do Maranhão, Brasil: síntese do conhecimento. Bioikos 28:45-55.; Amaral et al., 2014Amaral, K. D. S.; Vieira, I. M.; Osório, F. M.; Rocha, J. D. M. & Lima. J. F. 2014. Bioecology of the crab Ucides cordatus (Crustacea, Decapoda) in mangroves influenced by the Amazon River, Brazil. Acta Amazonica 44:213-222.).
Dentre os organismos que habitam esse ecossistema, encontram-se os crustáceos como um dos grupos mais diversos, tanto em padrões morfológicos (Dornellas et al., 2011Dornellas, E. J.; Silva, F. M.; Motta, D. G.; Simões, C. B. & Sá, F. S. 2011. Ocorrência de Macrobrachium olfersii (CRUSTACEA, DECAPODA, PALAEMONIDAE) em um afluente do Rio Santa Maria da Vitória, em Santa Leopoldina, ES, sudeste do Brasil. Natureza on line 9:19-26.), quanto em hábitos de vida. São encontrados em ambientes marinhos, dulcícolas e terrestres, desempenhando diversas funções existentes na cadeia trófica (Rocha, 2010Rocha, S. S. 2010. Diferença entre dois métodos de coleta utilizados na captura de crustáceos decápodes em um rio da Estação Ecológica Juréia-Itatins, São Paulo, Iheringia, Série Zoologia 100:116-122.), bem como na aceleração da decomposição da matéria orgânica, renovação e aeração do solo (Oshiro et al., 1998Oshiro, L. M. Y.; Silva, R. & Silva, Z. S. 1998. Composição da fauna de Braquiúros (Crustacea: Decapoda) dos manguezais da Baía de Sepetiba, RJ. Nauplius 6:31-40.). Além de importância ecológica, algumas espécies também possuem significância econômica, como os camarões peneídeos, o caranguejo-uçá, Ucides cordatus (Linnaeus, 1763), os siris Callinectes Stimpson, 1860, entre outros.
Os crustáceos decápodes têm sido estudados em vários manguezais do Brasil sob aspectos distintos, abordando sua diversidade e distribuição (Silva & Almeida, 2002Silva J. R. R. & Almeida Z. S. 2002. Zoneamento vertical dos crustáceos bentônicos em substratos inconsolidados do manguezal do quebra-pote na Ilha de São Luís, Maranhão - Brasil. Boletim Técnico-Científico CEPENE 10: 125-143.; Almeida et al., 2006Almeida, A. O.; Coelho, J. T. A. S. & Ferraz, N. R. 2006. Crustáceos decápodos estuarinos de Ilhéus, Bahia, Brasil. Biota Neotropica 6:1-24. ; Nicolau & Oshiro, 2007Nicolau, C. F. & Oshiro, L. M. Y. 2007. Distribuição espacial, sazonal e estrutura populacional do caranguejo Aratus pisonii (H. Milne Edwards) (Crustacea, Decapoda, Sesarmidae) do manguezal de Itacuruçá, Rio de Janeiro, Brasil. 2007. Revista Brasileira de Zoologia24:463-469.; Nabout et al., 2009Nabout, J. C.; Marco Júnior, P.; Bini, L. M. & Diniz-Filho, J. A. F. 2009. Distribuição geográfica potencial de espécies americanas do caranguejo "violinista" (Uca spp.) (Crustacea, Decapoda) com base em modelagem de nicho ecológico., Iheringia Série Zoologia 99:92-98.; Moreira et al., 2010Moreira, R. P. G.; Ramos, R. J. & Freitas Netto, R. 2010. Composição faunística dos crustáceos do gênero Uca (Ocypodidae) em manguezal do município de Serra, ES. Natureza on line8:46-50.; Negromonte et al., 2012Negromonte, A. O.; Araújo, M. S. L. C.& Coelho, P. A. 2012. Decapod crustaceans from a marine tropical mangrove ecosystem on the Southern Western Atlantic, Brazil. Nauplius 20:247-256., Araújo et al., 2014Araújo, M. S. L. C.; Tenório, D. O. & Castiglioni, D. S. 2014. Diversidade e distribuição dos Crustacea Brachyura dos manguezais dos rios Ariquindá e Mamucabas, litoral sul de Pernambuco, Brasil. Revista de Gestão Costeira Integrada14:483-499.), bioecologia (Castiglioni et al., 2006_____. 2006. Ciclo reprodutivo do caranguejo violinista Uca rapax (Crustacea: Decapoda: Ocypodidae) habitante de um estuário degradado em Paraty, Rio de janeiro, Brasil. Revista Brasileira de Zoologia 23:331-339.; Araújo & Calado, 2008Araújo, M. S. L. C. & Calado, T. C. S. 2008. Bioecologia do Caranguejo-uçá Ucides cordatus (Linnaeus 1763) no Complexo Estuarino Lagunar Mundáu/Manguaba (CELMM), Alagoas, Brasil. Revista de Gestão Costeira Integrada 8:169-181.; Castro et al., 2008Castro, A. C. L.; Correia, M. M. F.; Nascimento, A. R.; Piedade Júnior, R. N.; Gama, L. R. M.; Sousa, M. M.; Sena, A. C. S. & Sousa, R. C. C. 2008. Aspectos bioecológicos do caranguejo-uçá (Ucides cordatus cordatus, l.1763) (Decapoda, Brachyura) nos manguezais da ilha de São Luís e litoral oriental do estado do Maranhão, Brasil. Amazônia: Ciência & Desenvolvimento 3:17-36. ; Lima et al., 2010aLima, M. N. B.; Mochel, F. R. & Castro, A. C. L. 2010a. Bioecologia do caranguejo-uçá Ucides cordatus (Linnaeus, 1763) (Decapoda: Brachyura) na área de proteção ambiental das reentrâncias maranhenses, Brasil. Boletim do Laboratório de Hidrobiologia 23:1-10.; Menezes et al., 2012Menezes, A. P. D.; Araújo, M. S. L. C.& Calado, T. C. S.2012. Bioecologia de Goniopsis cruentata (Latreille, 1803) (Decapoda, Grapsidae) do complexo estuarino‐lagunar Mundaú/Manguaba, Alagoas, Brasil. Natural Resources 2:37-49.), reprodução (Baptista-Metri et al., 2005Baptista-Metri, C; Pinheiro, M. A. A.; Blankensteyn, A. & Borzone, C. A. 2005. Biologia populacional e reprodutiva de Callinectes danae Smith (Crustacea, Portunidae), no Balneário Shangri-lá, Pontal do Paraná, Brasil. Revista Brasileira de Zoologia 22:446-53.; Castiglioni & Negreiros-Fransozo, 2006_____. 2006. Ciclo reprodutivo do caranguejo violinista Uca rapax (Crustacea: Decapoda: Ocypodidae) habitante de um estuário degradado em Paraty, Rio de janeiro, Brasil. Revista Brasileira de Zoologia 23:331-339.; Castiglioni & Coelho, 2011Castiglioni, D. S. & Coelho, P. A. 2011. Determinação da maturidade sexual de Ucides cordatus (Crustacea, Brachyura, Ucididae) em duas áreas de manguezal do litoral sul de Pernambuco, Brasil. Iheringia, Série Zoologia 101:138-144.; Castiglioni et al., 2013Castiglioni, D. S.; Silva-Castiglioni, D. & Oliveira, P. J. A. 2013. Biologia reprodutiva de Ucides cordatus (Linnaeus, 1763) (Crustacea, Brachyura, Ucididae) em duas áreas de manguezal do litoral sul do Estado de Pernambuco, Brasil. Revista de Gestão Costeira Integrada13:433-444.; Santos et al., 2008Santos, J. L.; Severino-Rodrigues, E. & Vaz-Dos-Santos, A. M. 2008. Estrutura populacional do camarão-branco Litopenaeus schmitti nas regiões estuarina e marinha da baixada santista, São Paulo, Brasil. Boletim do Instituto de Pesca34:375-389.; Cobo & Fransozo, 2005Cobo, V. J. & Fransozo, A. 2005. Physiological maturity and relationships of growth and reproduction in the red mangrove crab Goniopsis cruentata (Latreille) (Brachyura, Grapsidae) on the coast of São Paulo, Brazil. Revista Brasileira de Zoologia22:219-223.; Martins et al., 2013Martins, A. S.; Pinheiro, H. T. & Leite Júnior, N. O. 2013. Biologia reprodutiva do camarão sete-barbas no litoral centro sul e sul do Espírito Santo, Brasil. Boletim do Instituto de Pesca 39:205-215.) e até mesmo técnicas de industrialização de sua carne (Ogawa et al., 2008Ogawa, M.; Silva, A. I. M.; Ogawa, N. B. P.; Maia, E. L. & Nunes, M. L. 2008. Adequações tecnológicas no processamento da carne de caranguejo. Ciência e Tecnologia de Alimentos 28:78-82.; Silva et al., 2013Silva, F. E. R.; Bichara, C. M. G.; Mársico, E. T.; Taxi, C. M. A. D.; Ferreira, M. S. & Santos, W. F. 2013. Parâmetros de qualidade da carne de caranguejo-uçá (Ucides cordatus - Linnaeus, 1763) obtida pelos métodos experimental e artesanal. Boletim do Centro de Pesquisa de Processamento de Alimentos 31:255-262.; Pinheiro et al., 2015Pinheiro, M. A. A.; Souza, C. A. & Borba, H. 2015.Meat yield of the mangrove crab, Ucides cordatus (Linnaeus, 1763) (Crustacea, Brachyura, Ucididae). Boletim do Instituto de Pesca 41:43-56.).
No Maranhão, o levantamento mais completo sobre decápodes foi realizado por Coelho & Ramos-Porto (1980Coelho, P. A & Ramos-Porto, M. 1980. Crustáceos decápodos da costa do Maranhão, Brasil. Boletim do Instituto Oceanográfico 29:135-138.), onde foram elencadas 149 espécies de crustáceos continentais e costeiros. A fauna de decápodes da costa maranhense apresenta importância especial, visto que se encontra em área de transição entre as províncias biogeográficas do Brasil e da Guiana (Coelho & Ramos-Porto 1980Coelho, P. A & Ramos-Porto, M. 1980. Crustáceos decápodos da costa do Maranhão, Brasil. Boletim do Instituto Oceanográfico 29:135-138.).
Apesar da grande importância deste grupo, estudos envolvendo estes crustáceos no Maranhão ainda são incipientes. Podemos destacar Silva & Almeida (2002)Silva J. R. R. & Almeida Z. S. 2002. Zoneamento vertical dos crustáceos bentônicos em substratos inconsolidados do manguezal do quebra-pote na Ilha de São Luís, Maranhão - Brasil. Boletim Técnico-Científico CEPENE 10: 125-143., Castro et al. (2008Castro, A. C. L.; Correia, M. M. F.; Nascimento, A. R.; Piedade Júnior, R. N.; Gama, L. R. M.; Sousa, M. M.; Sena, A. C. S. & Sousa, R. C. C. 2008. Aspectos bioecológicos do caranguejo-uçá (Ucides cordatus cordatus, l.1763) (Decapoda, Brachyura) nos manguezais da ilha de São Luís e litoral oriental do estado do Maranhão, Brasil. Amazônia: Ciência & Desenvolvimento 3:17-36. ), Lima et al. (2010aLima, M. N. B.; Mochel, F. R. & Castro, A. C. L. 2010a. Bioecologia do caranguejo-uçá Ucides cordatus (Linnaeus, 1763) (Decapoda: Brachyura) na área de proteção ambiental das reentrâncias maranhenses, Brasil. Boletim do Laboratório de Hidrobiologia 23:1-10.,b) e Cavalcante et al. (2011Cavalcante, A. N.; Almeida, Z. S.; Paz, A. C. & Isaac Nahum, V. J. 2011. Análise multidimensional do sistema de produção pesqueira caranguejo-uçá, Ucides cordatus, no município de Araioses, Maranhão - Brasil. Arquivos de Ciência do Mar 44:87-98. ). Nos manguezais da Baía de São Marcos, em especial, ainda não se tem contribuições acerca da composição e ecologia da carcinofauna bêntica local. Sendo assim, Objetiva-se caracterizar a composição faunística de crustáceos decápodes dos manguezais dos igarapés Buenos Aires e Tronco, costa amazônica maranhense, bem como analisar a distribuição espacial das espécies encontradas em ambos os manguezais amostrados.
MATERIAL E MÉTODOS
Área de estudo. Os manguezais da Baia de São Marcos, juntamente com os manguezais do Pará, constituem a Costa de Manguezais de Macromaré da Amazônia-CMMA. Esses manguezais estão sujeitos a um regime de macromarés semidiurnas, com variações em torno de 4 metros na Baía de Guajará, Belém e 7,5 metros na Baia de São Marcos, Maranhão (Souza-Filho, 2005Souza-Filho, P. W. M. 2005. Costa de manguezais de macromaré da Amazônia: cenários morfológicos, mapeamento e quantificação de áreas usando dados de sensores remotos. Revista Brasileira de Geofísica 23:427-435.). Neste estudo foram amostradas duas áreas distintas da Baía de São Marcos (Fig. 1), o igarapé Tronco (2°49ʼ56,24"S; 44°29ʼ41,92"O), situado na Ilha dos Caranguejos e o igarapé Buenos Aires (2°35ʼ57,7"S; 44°21ʼ09,4"O), localizado próximo ao Porto do Itaqui.
O igarapé Tronco é um dos mais extensos da Ilha dos Caranguejos, é também bastante explorado por pescadores artesanais da cidade de Cajapió e da Ilha de São Luís. Na região são observados manguezais em franja margeando os lavados, onde predomina a vegetais dos gêneros Avicennia L. e Rhizophora L. (Carvalho-Neta & Castro, 2008Castro, A. C. L.; Correia, M. M. F.; Nascimento, A. R.; Piedade Júnior, R. N.; Gama, L. R. M.; Sousa, M. M.; Sena, A. C. S. & Sousa, R. C. C. 2008. Aspectos bioecológicos do caranguejo-uçá (Ucides cordatus cordatus, l.1763) (Decapoda, Brachyura) nos manguezais da ilha de São Luís e litoral oriental do estado do Maranhão, Brasil. Amazônia: Ciência & Desenvolvimento 3:17-36. )A Ilha dos Caranguejos, por sua vez, é classificada como de pequena amplitude, com a maior faixa contínua de manguezal do Maranhão (Ribeiro et al., 2012Ribeiro, E. B.; Almeida, Z. S. & Carvalho-Neta, R. N. F. 2012. Hábito alimentar do bagre Sciades herzbergii (Siluriformes, Ariidae) da Ilha dos Caranguejos, Maranhão, Brasil. Arquivo Brasileiro de Medicina Veterinária e Zootecnia 64:1761-1765.).
Mapa com a localização da área de estudo, Baía de São Marcos, Maranhão, Brasil. Em destaque os dois pontos de coleta e o transecto estabelecido nos manguezais analisados.
O igarapé Buenos Aires destaca-se pela interferência antrópica acentuada e pelas atividades desenvolvidas na região portuária do Itaqui; localiza-se na costa ocidental da Ilha de São Luís, interior da Baía de São Marcos (Amaral & Alfredine, 2010Amaral, R. F. & Alfredine, P. 2010. Modelação Hidrossedimentológica no Canal de Acesso do Complexo Portuário do Maranhão. Revista Brasileira de Recursos Hídricos 15:5-14.). A vegetação neste manguezal é composta por Avicennia e Rhizophora, sendo esta última predominante na área estudada.
Coleta do material e parâmetros ambientais. As coletas do material biológico ocorreram trimestralmente, entre os meses de setembro de 2011 a junho de 2012. Em cada coleta foram analisados três pontos por área (zona 1, zona 2 e zona 3), os quais foram delimitados por meio de um transecto de 100 m de comprimento por 20 m de largura ao longo do mesolitoral. Em cada zona, as amostras foram obtidas de forma aleatória, percorrendo-se uma distância de 10 metros a cada lado do ponto principal, correspondendo à largura total do transecto. A zona 1 (0 m) é a mais próxima ao infralitoral, é caracterizada por possuir solo mais lamacento, pouca vegetação e influência mais direta da maré. Em ambos os manguezais, as zonas 2 (50 m) e 3 (100 m) apresentam maior cobertura vegetal, dominada em grande parte por Rhizophora mangle L.
A coleta dos organismos de sedimento foi realizada por meio das técnicas de catação manual e braceamento. Na região do infralitoral foram realizados dois arrastos com rede do tipo puçá, durante um período estimado de 20 minutos cada arrasto. Paralelamente à coleta dos organismos, também foram verificados a salinidade, temperatura e oxigênio dissolvido de cada igarapé. Tais parâmetros ambientais foram obtidos no momento da amostragem, durante a maré baixa, com o auxílio de um equipamento multiparâmetro. Adicionalmente, também foi coletado uma amostra de sedimento do ponto intermediário de cada manguezal (zona 2), a fim de determinar a granulometria e teor de matéria orgânica de cada área.
Todos os exemplares coletados foram devidamente acondicionados em potes plásticos, anestesiados em cloreto de magnésio a 10% e posteriormente fixados em solução formalina a 10%. Em seguida as amostras foram transportadas para o Laboratório de Pesca e Ecologia Aquática (LabPEA), da Universidade Estadual do Maranhão (UEMA), onde foram identificados a nível específico segundo Melo (1996Melo, G. A. S. 1996. Manual de identificação dos Brachyura (caranguejos e siris) do litoral brasileiro São Paulo, Editora Plêiade. 603p., 1999) e Pérez-Farfantes & Kensley (1997Pérez-Farfante, I. & Kensley, B. 1997. Penaeoid and Sergestoid Shrimps and Prawns of the World: Keys and diagnoses for the families and genera. Mémoires du Muséum National d'Histoire Naturelle 175:1-233.).
Análise de dados. A abundância total (AT) foi calculada por área de coleta e a abundância relativa (AR) para cada espécie analisada. Com base na abundância relativa, o táxon foi classificado em dominante (≥ 70%), abundante (40 a 70%), pouco abundante (10 a 40 %) e raro (≤10%) (Negromonte et al., 2012Negromonte, A. O.; Araújo, M. S. L. C.& Coelho, P. A. 2012. Decapod crustaceans from a marine tropical mangrove ecosystem on the Southern Western Atlantic, Brazil. Nauplius 20:247-256.). Considerando-se o número de coletas (n=4) e a classificação proposta por Negromonte et al. (2012)Negromonte, A. O.; Araújo, M. S. L. C.& Coelho, P. A. 2012. Decapod crustaceans from a marine tropical mangrove ecosystem on the Southern Western Atlantic, Brazil. Nauplius 20:247-256., a análise de frequência de ocorrência passou por algumas adaptações: as espécies foram classificadas como muito frequente (≥75%), frequente (50%>Fo<75%), pouco frequente (25%>Fo< 50 %) e esporádica (≤ 25%).
Foi verificada a distribuição espacial das espécies pelas zonas dos manguezais analisados, bem como a distribuição sazonal das famílias observadas. Para avaliar as possíveis similaridades nas abundâncias das zonas de cada manguezal, foi utilizada a análise de Cluster e consecutiva elaboração de dendrogramas.
RESULTADOS
Parâmetros ambientais. Durante o período amostral, a temperatura da água permaneceu relativamente uniforme nas duas áreas analisadas. O igarapé Tronco apresentou variação de 29,7 a 31,2°C, e o igarapé Buenos Aires apresentou temperaturas entre 28 a 30°C. A salinidade variou entre 12,8 e 37 no igarapé Tronco e 28,6 e 36 no igarapé Buenos Aires. O oxigênio dissolvido apresentou variação de 1,5 mg/L a 4,8 mg/L no igarapé Buenos Aires e 1,2 mg/L a 5,1 mg/L no igarapé Tronco. É válido ressaltar que os valores de salinidade e oxigênio dissolvido foram mais elevados nas coletas realizadas no período de estiagem. (Figs 2, 3).
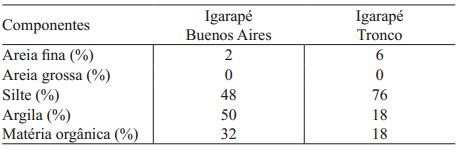
O sedimento do manguezal do igarapé Buenos Aires, localizado em área mais exposta à ação de ondas e correntes, foi caracterizado pela maior porcentagem de argila e matéria orgânica. O igarapé Tronco, localizado em área mais abrigada, apresentou maior teor de silte e areia fina, bem como redução de matéria orgânica (Tab. I).
Variação da salinidade, temperatura e oxigênio dissolvido nos igarapés Buenos Aires (2) e Tronco (3) no período de setembro de 2011 a junho de 2012.
Composição granulométrica e teor de matéria orgânica dos sedimentos dos igarapés Buenos Aires e Tronco, Maranhão, Brasil, no período de setembro de 2011 a junho de 2012.
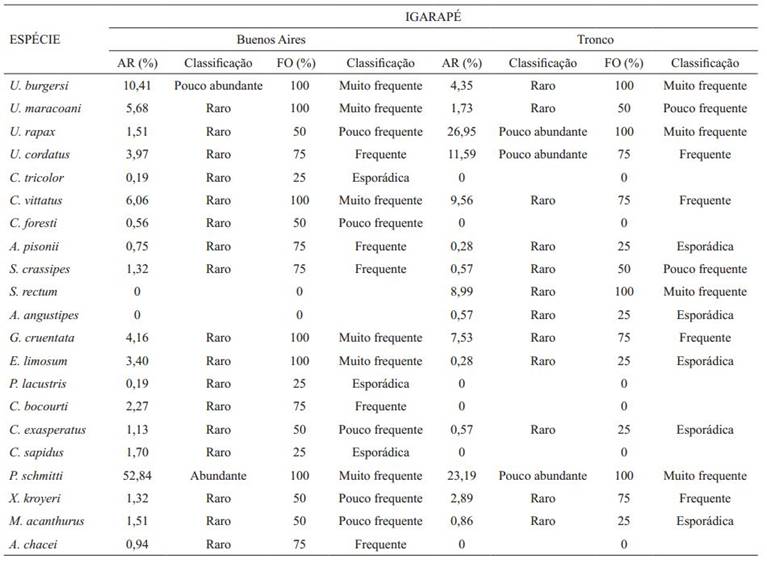
Riqueza de espécies de crustáceos decápodes. Foi identificado um total de 873 indivíduos no sedimento e na região do infralitoral dos dois manguezais, sendo 528 coletados no igarapé Buenos Aires e 345 no Tronco. Esses indivíduos representam nove famílias e 21 espécies, tendo os Ocypodidae e os Penaeidae como os grupos mais abundantes, com o maior número de indivíduos nos dois manguezais (Tab. II).
Relação das famílias e espécies de crustáceos decápodes encontradas nos manguezais dos igarapés Buenos Aires e Tronco, Maranhão, Brasil, no período de setembro de 2011 a junho de 2012.
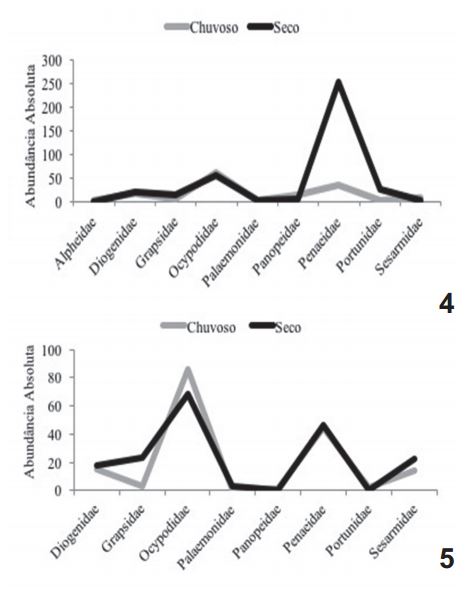
Essas duas famílias tiveram ainda suas abundâncias acompanhadas pelas flutuações dos valores de salinidade. Penaeidae foi mais abundante durante o período de estiagem, representando 66,4% do total analisado no igarapé Buenos Aires (Fig. 4). Nesta ocasião os valores de salinidade encontravam-se mais elevados nos dois igarapés. Ao contrário dos Penaeidae, a família Ocypodidae foi mais abundante durante o período chuvoso, representando 52,1% das amostras analisadas no igarapé Tronco (Fig. 5).
Abundância das famílias em função da estação (período seco e chuvoso) nos igarapés Buenos Aires (4) e Tronco (5), Maranhão, Brasil, no período de setembro de 2011 a junho de 2012.
O igarapé Buenos Aires apresentou um total de 19 espécies, ao passo que no Tronco foram registradas 15. A composição nas duas áreas analisadas foi semelhante, entretanto, diferindo-se ocorrência de algumas espécies como Alpheus chacei Carvacho, 1979; Callinectes bocourti A. Milne Edwards, 1879; Callinectes sapidus Rathbun, 1896; Panopeus lacustris Desbonne & Schramm, 1867; Clibanarius tricolor (Gibbes, 1850) e Clibanarius foresti Holthuis, 1959, que foram registrados apenas em Buenos Aires. Armases angustipes (Dana, 1852) e Sesarma rectum Randall, 1840, ocorreram somente no igarapé Tronco.
Diversidade e distribuição espacial dos crustáceos nos manguezais. As localidades amostradas foram representadas, em sua maioria, por espécies raras, sendo Penaeus schmitti Burkenroad, 1936, a única espécie abundante no igarapé Buenos Aires. Foram observadas também seis espécies "muito frequentes" nesse igarapé: Goniopsis cruentata (Latreille, 1803), Clibanarius vittatus (Bosc, 1802), Eurytium limosum (Say, 1818), P. schmitti, Uca burgersi Holthuis, 1967 e Uca maracoani (Latreille, 1802), enquanto no igarapé Tronco constatou-se cinco espécies na mesma categoria: P. schmitti, Sesarma rectum, U. burgersi, U. maracoani e Uca rapax (Smith, 1870) (Tab. III).
Abundância relativa (AR) e frequência de ocorrência (FO) das espécies de crustáceos decápodes ocorrentes nos manguezais dos igarapés Buenos Aires e Tronco, Maranhão, Brasil, no período de setembro de 2011 a junho de 2012.
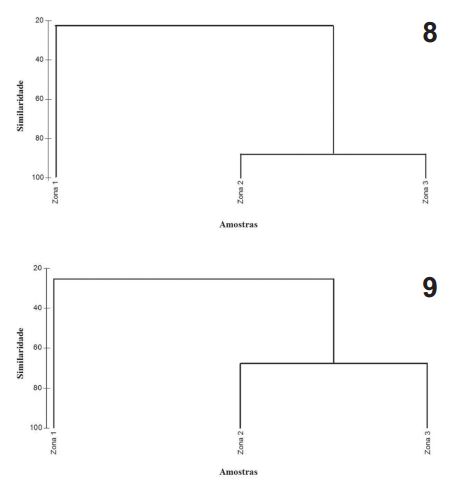
Com relação à distribuição espacial dos organismos, observou-se que nas duas áreas amostradas houve espécies que se restringiram a uma zona, enquanto outras se distribuíram por todo o manguezal. Clibanarius vittatus, C. foresti, C. tricolor e Uca maracoani foram observadas exclusivamente na primeira zona dos dois manguezais, caracterizada por possuir sedimento menos consolidado, com influência mais direta da maré e escassez de vegetação. Ucides cordatus (Linnaeus, 1763), Uca burgersi e Eurytium limosum apresentaram ampla distribuição, encontradas nas três zonas dos manguezais analisados. Goniopsis cruentata, Sesarma rectum e Aratus pisonii (H. Milne Edwards, 1837) foram registradas em maior abundância nas zonas 2 e 3, as quais possuem maior cobertura vegetal (Figs 6, 7). A similaridade por zona demonstrou que há uma semelhança faunística bastante acentuada entre as zonas 2 e 3 de ambos os manguezais, com 66,6% de similaridade no igarapé Tronco e 88,1% no igarapé Buenos Aires (Figs 8, 9).
Distribuição espacial das espécies de crustáceos decápodes encontradas nos igarapés Buenos Aires (6) e Tronco (7), Maranhão, Brasil, no período de setembro de 2011 a junho de 2012.
Dendograma da similaridade de Bray-Curtis nos igarapés Buenos Aires (8) e Tronco (9), Maranhão, Brasil, no período de setembro de 2011 a junho de 2012.
DISCUSSÃO
Salinidade com variações extremas, como as observadas para o igarapé Tronco (de 12,8 a 37), já havia sido registrada para os manguezais da Ilha dos Caranguejos, onde se observou variações de 5 a 25 nesta mesma região (Brasil, 2003Brasil. 2003. Zoneamento costeiro do Estado do Maranhão. São Luís, Departamento de Oceanografia e Limnologia/Laboratório de Hidrobiologia, Universidade Federal do Maranhão. CD Room.). Tal variação ocorre devido à influência bastante acentuada do rio Mearim nestes manguezais, que são considerados como região de médio estuário (Carvalho-Neta & Castro, 2008Castro, A. C. L.; Correia, M. M. F.; Nascimento, A. R.; Piedade Júnior, R. N.; Gama, L. R. M.; Sousa, M. M.; Sena, A. C. S. & Sousa, R. C. C. 2008. Aspectos bioecológicos do caranguejo-uçá (Ucides cordatus cordatus, l.1763) (Decapoda, Brachyura) nos manguezais da ilha de São Luís e litoral oriental do estado do Maranhão, Brasil. Amazônia: Ciência & Desenvolvimento 3:17-36. ). No período chuvoso, o aporte de água provinda deste rio é acrescido do volume de chuvas no próprio corpo de água do estuário, contribuindo para a diminuição dos níveis de salinidade nesta região.
Essa variável ambiental é de extrema relevância, uma vez que influencia diretamente na frequência, abundância e distribuição de crustáceos decápodes (Frusher et al., 1994Frusher, S. D.; Giddins, R. L. & Smith I, T. J. 1994. Distribution and abundance of Grapsid crabs (Grapsidae) in a mangrove estuary: Effects of sediment characteristics, salinity, tolerance and osmoregulatory ability. Estuaries 17:647-654.), bem como na fecundidade, recrutamento e crescimento das populações destes organismos e dos demais invertebrados locais (Gillanders & Kingsford, 2002Gillanders, B. M. & Kingsford, M. J. 2002. Impact of changes in flow of freshwater on estuarine and open coastal habitats and the associated organisms. Oceanography and Marine Biology an Annual Review 40:233-309.).
No entanto, apesar das flutuações de abundâncias de Penaeidae e Ocypodidae terem acompanhado as variações de salinidade, tal fator, dentro da variação observada no presente estudo, não atua como fator limitante para suas ocorrências. Na Venezuela, juvenis de Penaeus schmitti foram observados em um estuário, cuja salinidade atinge até 50 (Scelzo, 1982Scelzo, M. A. 1982. Crecimiento y migracion del camarón Penaeus brasiliensis Latreille (Decapoda, Penaeidae ) en la laguna de manglar la Restinga Isla Margarita, Venezuela. Atlântica 5:104-112.). Situação similar ocorre com Xiphopenaeus kroyeri (Heller, 1862), que pode ser encontrado tanto em estuário com baixa salinidade, como em ambientes marinhos com salinidade mais elevada (Santos et al., 2006Santos, M. C. F.; Coelho, P. A. & Ramos-Porto, M. 2006 Sinopse das informações sobre a biologia e pesca do camarão-Sete-Barbas, Xiphopenaeus kroyeri (Heller, 1862) (Decapoda, Penaeidae), no Nordeste do Brasil. Boletim Técnico Científico CEPENE 14:141-178.). Ocypodidae, por sua vez, possui espécies com grande capacidade adaptativa, as quais resistem a amplas variações de salinidade, como Ucides cordatus que tolera de 2 a 33 (Martinez et al., 1998Martinez, C. B. R.; Harris, R. R. & Santos, M. C. F. 1998. Transepithelial potential differences and sodium fluxes in isolated perfused gills of the mangrove crab Ucides cordatus. Comparative Biochemistry and Physiology - Part A 120:227-236.).
No presente estudo a salinidade também não foi fator limitante para a C. vittatus, diferentemente do que foi observado para o estuário de São Vicente, São Paulo, Brasil, onde variações extremas de salinidade ocasionaram a ausência de juvenis, tendo como consequência a redução na densidade dessa espécie (SantʼAnna et al., 2006Sant'Anna, B. S.; Zangrande, C. M.; Reigada, A. L. L. D.; Marcelo, A. A. & Pinheiro, M. A. A. 2006. Shell utilization pattern of the hermit crab Clibanarius vittatus (Crustacea, Anomura) in an estuary at São Vicente, State of São Paulo, Brazil., Iheringia Série Zoologia 96:261-266.). As larvas de C. vittatus não toleram baixas salinidades e por esse motivo as fêmeas ovígeras migram para regiões mais estáveis e com maior teor de salinidade (Sampaio et al., 2009Sampaio, S. R.; Masunari, S. & Haseyama, K. L. F. 2009. Distribuição temporal do ermitão Clibanarius vittatus (Anomura, Diogenidae) no litoral do Paraná., Iheringia Série Zoologia 99:276-280.). Por outro lado, em indivíduos adultos a tolerância a variações desse parâmetro ambiental gira em torno de 10 a 38, onde esses organismos são normalmente encontrados em estuários, associados ao fundo de lama e areia (Almeida et al., 2010Almeida, A. O.; Souza, G. B. G.; Boehs, G. & Bezerra, L. E. A. 2010. Shallow-water anomuran and brachyuran crabs (Crustacea: Decapoda) from southern Bahia, Brazil. Latin American Journal of Aquatic Research 38:329-376.). No litoral da Bahia, C. vittatus foi registrada também associada a ambientes dominados por R. mangle, com salinidade variando de levemente elevadas a salobras (Almeida et al., 2006Almeida, A. O.; Coelho, J. T. A. S. & Ferraz, N. R. 2006. Crustáceos decápodos estuarinos de Ilhéus, Bahia, Brasil. Biota Neotropica 6:1-24. ; Almeida & Guerrazz, 2007Almeida, A. O. & Guerrazz, M. C. 2007. Stomatopod and decapod crustaceans from Camamu Bay, state of Bahia, Brazil. Zootaxa 1553:1-45.).
Em ambas as áreas analisadas, Ocypodidae e Penaeidae foram as mais abundantes. A maior representatividade dos Ocypodidae em manguezais maranhenses foi registrada também por Silva & Almeida (2002)Silva J. R. R. & Almeida Z. S. 2002. Zoneamento vertical dos crustáceos bentônicos em substratos inconsolidados do manguezal do quebra-pote na Ilha de São Luís, Maranhão - Brasil. Boletim Técnico-Científico CEPENE 10: 125-143. no manguezal do Quebra Pote, Maranhão, Brasil, onde aproximadamente 53% das amostras analisadas, pertenciam à referida família. Esse manguezal apresentou 26 espécies, sendo que dessas, 14 também foram registradas no presente estudo.
De um modo geral, o igarapé Buenos Aires apresentou o maior número de espécies em relação ao igarapé Tronco. Essa diversidade específica mais elevada provavelmente está relacionada à maior quantidade de matéria orgânica disponível nesse local, uma vez que esse item é considerado importante na alimentação de crustáceos decápodes, favorecendo a maior riqueza e abundância de espécies. Resultados semelhantes foram observados em outros estudos, onde a alta diversidade e abundância de espécies estiveram diretamente relacionadas ao alto teor de matéria orgânica disponível no local (Negreiros-Fransozo et al., 1991Negreiros-Fransozo, M. L.; Fransozo, A.; Pinheiro, M. A. A.; Mantelatto, F. L. M. & Santos, S. 1991. Caracterização física e química da enseada de Fortaleza, Ubatuba, SP. Revista Brasileira de Geociências 21:114-120.; Branco, 1993Branco, J. O. 1993. Aspectos bioecológicos do caranguejo Ucides cordatus (Linnaeus 1763) (Crustacea, Decapoda) do manguezal do Itacorubi, Santa Catarina, BR. Arquivos de Biologia e Tecnologia 36:133-148.; Castiglioni & Negreiros-Fransozo, 2004Castiglioni , D. S. & Negreiros-Fransozo, M. L. 2004. Comparative analysis of the relative growth of Uca rapax (Smith) (Crustacea, Ocypodidae) from two mangroves in São Paulo, Brazil. Revista Brasileira de Zoologia21:137-144; Castiglioni, et al., 2006Castiglioni, D. S.; Negreiros-Fransozo, M. L. & Mortari, R. C. 2006. Biologia populacional do caranguejo violinista Uca rapax (smith, 1870) (Crustacea, Ocypodoidea), proveniente de uma área de manguezal degradado em Paraty, RJ, Brasil. Atlântica 28:73-86.; Masunari, 2006Masunari, S. 2006. Distribuição e abundância dos caranguejos Uca Leach (Crustacea, Decapoda, Ocypodidae) na Baía de Guaratuba, Paraná, Brasil. Revista Brasileira de Zoologia23:901-914.).
Além de matéria orgânica, o sedimento do manguezal de Buenos Aires foi caracterizado também pela maior porcentagem de argila, ao contrário do igarapé do Tronco que apresenta maior teor de silte e areia fina, bem como redução de matéria orgânica. O tamanho médio das partículas sedimentares de uma determinada região reflete, em parte, a sua exposição ao hidrodinamismo e à história geológica da área, a qual determina a disponibilidade e tamanho dos sedimentos (Soares-Gomes & Figueiredo 2009Soares-Gomes, A. & Figueiredo, A. G. 2009. O ambiente marinho. 2ed. In: Pereira, R. C. & Soares-Gomes, A. org. Biologia Marinha. Interciência, Rio de Janeiro, p, 1-34.).
Tais características sedimentológicas influenciam também na distribuição dos organismos pelo manguezal. Segundo Dall et al. (1990Dall, W.; Hill, B. J.; Rothlisberg, P. C. & Sharples, D.J. 1990. The biology of the Penaeidae. In: Blaxter, J. H. S & Southward, A. J. eds. Advances in Marine Biology. San Diego, Academic Press. 489p. ), a maioria dos camarões peneídeos seleciona substratos compostos por sedimento fino, principalmente com maior conteúdo de silte e argila, provavelmente por tal fração sedimentar facilitar o comportamento de se enterrar dos camarões, sendo essa uma das características responsáveis pela distribuição espacial desses organismos.
A restrição de Uca maracoani à primeira zona dos dois manguezais analisados provavelmente ocorreu devido à preferência por substratos menos consolidados, bem como à anatomia de seus apêndices bucais, o que lhe possibilita maior facilidade na escavação de suas galerias e captura de alimento nesta zona (L. E. A. Bezerra, dados inéditos). Tal preferência também foi registrada em outros estudos sobre a distribuição espacial dessa espécie, que sempre é observada às margens dos manguezais, mas dificilmente dentro deles ou associados diretamente à vegetação (Bezerra et al., 2006Bezerra, L. E. A.; Dias, C. B.; Santana, G. X. & Matthews-Cascon, H. 2006. Spatial distribution of fiddler crabs (genus Uca) in a tropical mangrove of northeast Brazil. Scientia Marina 70:759-766. ; Masunari, 2006Masunari, S. 2006. Distribuição e abundância dos caranguejos Uca Leach (Crustacea, Decapoda, Ocypodidae) na Baía de Guaratuba, Paraná, Brasil. Revista Brasileira de Zoologia23:901-914.).
Goniopsis cruentata, Sesarma rectum e Aratus pisonii foram encontradas em maior expressividade nas zonas 2 e 3 dos dois manguezais, as quais possuem maior cobertura vegetal. Resultados semelhantes foram observados em outros estudos, onde A. pisonii encontrava-se sempre entre troncos e raízes de árvores. Goniopsis cruentata foi comumente encontrada em florestas de mangue, deslocando-se ativamente sobre o substrato e sobre árvores (Oshiro et al., 1998Oshiro, L. M. Y.; Silva, R. & Silva, Z. S. 1998. Composição da fauna de Braquiúros (Crustacea: Decapoda) dos manguezais da Baía de Sepetiba, RJ. Nauplius 6:31-40.; Lira et al., 2012Lira, J. J. P. R.; Calado, T. C. S. & Araújo, M. S. L. C. 2012. Condition factor of Goniopsis cruentata (Crustacea, Brachyura, Grapsidae) from Mundaú/Manguaba estuarine complex, Alagoas, Brazil., Iheringia Série Zoologia 102:285-291.). A preferência destas espécies por áreas mais arborizadas reflete claramente seus hábitos arborícolas (Warner, 1967Warner, G. F. 1967. The life history of the mangrove tree crab Aratus pisonii. Journal of Zoology 153:321-335.; Melo, 1996Melo, G. A. S. 1996. Manual de identificação dos Brachyura (caranguejos e siris) do litoral brasileiro São Paulo, Editora Plêiade. 603p.; Menezes et al., 2012Menezes, A. P. D.; Araújo, M. S. L. C.& Calado, T. C. S.2012. Bioecologia de Goniopsis cruentata (Latreille, 1803) (Decapoda, Grapsidae) do complexo estuarino‐lagunar Mundaú/Manguaba, Alagoas, Brasil. Natural Resources 2:37-49.).
A ampla distribuição de algumas espécies como Ucides cordatus, Uca burgersi e Eurytium limosum pelas três zonas dos manguezais também está diretamente relacionada à biologia de cada uma delas. Eurytium limossum sobrevive bem em galerias relativamente cheias de água e em regiões entre-marés. No entanto, também foi observada dentro de troncos caídos, bem como em bosques de mangues, ambientes similares àqueles analisados por Marochi & Massunari (2011Marochi, M. Z. & Masunari, S. 2011. Os caranguejos Eriphiidae, Menippidae, Panopeidae e Pilumnidae (Crustacea Brachyura) de águas rasas do litoral do Paraná, com chave pictórica de identificação para as espécies. Biota Neotropica11:21-33.).
A dieta detritívora de Uca burgersi lhe proporciona maior estabilidade, uma vez que este tipo de alimento encontra-se disponível em todas as zonas, possibilitando a sua observação por todo o manguezal. Essa espécie vive ao longo das praias de estuários, onde são encontradas em galerias construídas na zona entre-marés e perto de árvores de mangue (Mendes & Couto, 2001Mendes. M. T. & Couto, E. C. G. A. 2001. Família Ocypodidae Rafinesque 1815 (Crustacea: Decapoda: Brachyura) na Costa Sergipana. Revista Nordestina de Biologia 15:27-40. ).
Das espécies amostradas no presente estudo, Ucides cordatus é a mais característica do manguezal. Este é completamente dependente das árvores do mangue, uma vez que a base de sua dieta alimentar é composta por folhas mortas, que são carregadas pelo próprio caranguejo até sua galeria. Através da escavação e limpeza de suas tocas, promove o revolvimento do substrato, contribuindo no processo de aeração do sedimento, trazendo à superfície a matéria orgânica dos estratos inferiores (Rodrigues et al., 2000Rodrigues, A. M. T.; Branco, E. J.; Saccardo, S. A. & Blankensteyn, A.2000. A explotação do caranguejo Ucides cordatus (Decapoda: Ocypodidae) e o processo de gestão participativa para normatização da atividade na região sudeste-sul do Brasil. Boletim do Instituto de Pesca26:63-78.; Jankowsky et al., 2006Jankowsky, M.; José Pires, J. S. R. & Nordin, N. 2006. Contribuição ao manejo participativo do caranguejo-uçá, Ucides cordatus (l., 1763), em Cananéia - SP. Boletim Instituto de Pesca 32:221-228.). Essa espécie tem uma ampla distribuição no litoral brasileiro e destaca-se como importante recurso pesqueiro na região Nordeste do Brasil, sendo essa região, juntamente com o Norte do país, responsável por aproximadamente 70% da produção nacional (Lima et al., 2010b_____. 2010b. O sistema de produção do caranguejo-uçá Ucides cordatus (Decapoda: Brachyura) (Linnaeus, 1763) na área de proteção ambiental das reentrâncias maranhenses, Brasil. Boletim do Laboratório de Hidrobiologia 23:57-64.). No Maranhão, onde a captura desse organismo tem se mantido constante, são observados indícios de sobrepesca em alguns pontos do estado, tais como, redução do peso e do tamanho médio dos espécimes capturados, aumento do esforço de pesca sem o aumento da captura e maior dificuldade na captura desses organismos (Legat & Legat, 2009Legat, J. F. A. & Legat, A. P. 2009. Metodologia para o transporte de caranguejo vivo com baixos índices de desperdícios. Boletim técnico-científico do CEPENE 17:115-121.).
Os resultados apresentados são de grande importância para a compreensão, não somente da composição, mas também de alguns aspectos ecológicos da comunidade de crustáceos decápodes de manguezais da costa amazônica maranhense, uma vez que há escassez de estudos dirigidos à fauna caranguejos das áreas analisadas. Futuramente, esse trabalho poderá também constituir uma base útil para a realização de estudos sobre diversidade carcinológica e elaboração de planos de manejo e conservação para essas espécies, bem como para as áreas analisadas.
Agradecimentos
Agradecemos à Fundação de Amparo à Pesquisa e ao Desenvolvimento Científico e Tecnológico do Maranhão - FAPEMA, pelo apoio financeiro prestado por meio de bolsas de iniciação científica à primeira autora, as quais auxiliaram na execução deste trabalho.
REFERÊNCIAS BIBLIOGRÁFICAS
- Almeida, A. O.; Souza, G. B. G.; Boehs, G. & Bezerra, L. E. A. 2010. Shallow-water anomuran and brachyuran crabs (Crustacea: Decapoda) from southern Bahia, Brazil. Latin American Journal of Aquatic Research 38:329-376.
- Almeida, A. O.; Coelho, J. T. A. S. & Ferraz, N. R. 2006. Crustáceos decápodos estuarinos de Ilhéus, Bahia, Brasil. Biota Neotropica 6:1-24.
- Almeida, A. O. & Guerrazz, M. C. 2007. Stomatopod and decapod crustaceans from Camamu Bay, state of Bahia, Brazil. Zootaxa 1553:1-45.
- Amaral, A. C. Z. & Jablonski, S. 2005. Conservação da biodiversidade marinha e costeira no Brasil. Megadiversidade 1:43-51.
- Amaral, K. D. S.; Vieira, I. M.; Osório, F. M.; Rocha, J. D. M. & Lima. J. F. 2014. Bioecology of the crab Ucides cordatus (Crustacea, Decapoda) in mangroves influenced by the Amazon River, Brazil. Acta Amazonica 44:213-222.
- Amaral, R. F. & Alfredine, P. 2010. Modelação Hidrossedimentológica no Canal de Acesso do Complexo Portuário do Maranhão. Revista Brasileira de Recursos Hídricos 15:5-14.
- Araújo, M. S. L. C. & Calado, T. C. S. 2008. Bioecologia do Caranguejo-uçá Ucides cordatus (Linnaeus 1763) no Complexo Estuarino Lagunar Mundáu/Manguaba (CELMM), Alagoas, Brasil. Revista de Gestão Costeira Integrada 8:169-181.
- Araújo, M. S. L. C.; Tenório, D. O. & Castiglioni, D. S. 2014. Diversidade e distribuição dos Crustacea Brachyura dos manguezais dos rios Ariquindá e Mamucabas, litoral sul de Pernambuco, Brasil. Revista de Gestão Costeira Integrada14:483-499.
- Baptista-Metri, C; Pinheiro, M. A. A.; Blankensteyn, A. & Borzone, C. A. 2005. Biologia populacional e reprodutiva de Callinectes danae Smith (Crustacea, Portunidae), no Balneário Shangri-lá, Pontal do Paraná, Brasil. Revista Brasileira de Zoologia 22:446-53.
- Bezerra, L. E. A.; Dias, C. B.; Santana, G. X. & Matthews-Cascon, H. 2006. Spatial distribution of fiddler crabs (genus Uca) in a tropical mangrove of northeast Brazil. Scientia Marina 70:759-766.
- Branco, J. O. 1993. Aspectos bioecológicos do caranguejo Ucides cordatus (Linnaeus 1763) (Crustacea, Decapoda) do manguezal do Itacorubi, Santa Catarina, BR. Arquivos de Biologia e Tecnologia 36:133-148.
- Brasil. 2003. Zoneamento costeiro do Estado do Maranhão. São Luís, Departamento de Oceanografia e Limnologia/Laboratório de Hidrobiologia, Universidade Federal do Maranhão. CD Room.
- Carvalho-Neta, R. N. F. & Castro, A. C. L. 2008. Diversidade das Assembleias de Peixes Estuarinos da Ilha dos Caranguejos, Maranhão. Arquivos de Ciências do Mar 41:48-57.
- Castiglioni, D. S. & Coelho, P. A. 2011. Determinação da maturidade sexual de Ucides cordatus (Crustacea, Brachyura, Ucididae) em duas áreas de manguezal do litoral sul de Pernambuco, Brasil. Iheringia, Série Zoologia 101:138-144.
- Castiglioni , D. S. & Negreiros-Fransozo, M. L. 2004. Comparative analysis of the relative growth of Uca rapax (Smith) (Crustacea, Ocypodidae) from two mangroves in São Paulo, Brazil. Revista Brasileira de Zoologia21:137-144
- _____. 2006. Ciclo reprodutivo do caranguejo violinista Uca rapax (Crustacea: Decapoda: Ocypodidae) habitante de um estuário degradado em Paraty, Rio de janeiro, Brasil. Revista Brasileira de Zoologia 23:331-339.
- Castiglioni, D. S.; Negreiros-Fransozo, M. L. & Mortari, R. C. 2006. Biologia populacional do caranguejo violinista Uca rapax (smith, 1870) (Crustacea, Ocypodoidea), proveniente de uma área de manguezal degradado em Paraty, RJ, Brasil. Atlântica 28:73-86.
- Castiglioni, D. S.; Silva-Castiglioni, D. & Oliveira, P. J. A. 2013. Biologia reprodutiva de Ucides cordatus (Linnaeus, 1763) (Crustacea, Brachyura, Ucididae) em duas áreas de manguezal do litoral sul do Estado de Pernambuco, Brasil. Revista de Gestão Costeira Integrada13:433-444.
- Castro, A. C. L.; Correia, M. M. F.; Nascimento, A. R.; Piedade Júnior, R. N.; Gama, L. R. M.; Sousa, M. M.; Sena, A. C. S. & Sousa, R. C. C. 2008. Aspectos bioecológicos do caranguejo-uçá (Ucides cordatus cordatus, l.1763) (Decapoda, Brachyura) nos manguezais da ilha de São Luís e litoral oriental do estado do Maranhão, Brasil. Amazônia: Ciência & Desenvolvimento 3:17-36.
- Cavalcante, A. N.; Almeida, Z. S.; Paz, A. C. & Isaac Nahum, V. J. 2011. Análise multidimensional do sistema de produção pesqueira caranguejo-uçá, Ucides cordatus, no município de Araioses, Maranhão - Brasil. Arquivos de Ciência do Mar 44:87-98.
- Cobo, V. J. & Fransozo, A. 2005. Physiological maturity and relationships of growth and reproduction in the red mangrove crab Goniopsis cruentata (Latreille) (Brachyura, Grapsidae) on the coast of São Paulo, Brazil. Revista Brasileira de Zoologia22:219-223.
- Coelho, P. A & Ramos-Porto, M. 1980. Crustáceos decápodos da costa do Maranhão, Brasil. Boletim do Instituto Oceanográfico 29:135-138.
- Dall, W.; Hill, B. J.; Rothlisberg, P. C. & Sharples, D.J. 1990. The biology of the Penaeidae. In: Blaxter, J. H. S & Southward, A. J. eds. Advances in Marine Biology. San Diego, Academic Press. 489p.
- Diele, K.; Koch, V. & Saint-Paul, U. 2005. Population structure, catch composition and CPUE of the artisanally harvested mangrove crab Ucides cordatus (Ocypodidae) in the Caeté estuary, North Brazil: Indications for overfishing? Aquatic Living Resources 18:169-178.
- Diele, K.; Koch, V. Abrunhosa, F. A; Lima, J. F. & Simith, D. J. B. 2010. The Brachyuran crab community of the Caeté estuary, North Brazil: Species richness, zonation and abundance. Mangrove Dynamics and Management in North Brazil. Ecological Studies 211:251-263.
- Dornellas, E. J.; Silva, F. M.; Motta, D. G.; Simões, C. B. & Sá, F. S. 2011. Ocorrência de Macrobrachium olfersii (CRUSTACEA, DECAPODA, PALAEMONIDAE) em um afluente do Rio Santa Maria da Vitória, em Santa Leopoldina, ES, sudeste do Brasil. Natureza on line 9:19-26.
- Fernandes, M. E. B. 2003. Os manguezais da costa norte brasileira, Maranhão. São Luís, Fundação Rio Bacanga. 142p.
- Ferreira, A. C. & Sankarankutty, C. 2002. Estuarine carcinofauna (Decapoda) of Rio Grande do Norte, Brazil. Nauplius 10:121-129.
- Frusher, S. D.; Giddins, R. L. & Smith I, T. J. 1994. Distribution and abundance of Grapsid crabs (Grapsidae) in a mangrove estuary: Effects of sediment characteristics, salinity, tolerance and osmoregulatory ability. Estuaries 17:647-654.
- Gillanders, B. M. & Kingsford, M. J. 2002. Impact of changes in flow of freshwater on estuarine and open coastal habitats and the associated organisms. Oceanography and Marine Biology an Annual Review 40:233-309.
- Jankowsky, M.; José Pires, J. S. R. & Nordin, N. 2006. Contribuição ao manejo participativo do caranguejo-uçá, Ucides cordatus (l., 1763), em Cananéia - SP. Boletim Instituto de Pesca 32:221-228.
- Legat, J. F. A. & Legat, A. P. 2009. Metodologia para o transporte de caranguejo vivo com baixos índices de desperdícios. Boletim técnico-científico do CEPENE 17:115-121.
- Lima, M. N. B.; Mochel, F. R. & Castro, A. C. L. 2010a. Bioecologia do caranguejo-uçá Ucides cordatus (Linnaeus, 1763) (Decapoda: Brachyura) na área de proteção ambiental das reentrâncias maranhenses, Brasil. Boletim do Laboratório de Hidrobiologia 23:1-10.
- _____. 2010b. O sistema de produção do caranguejo-uçá Ucides cordatus (Decapoda: Brachyura) (Linnaeus, 1763) na área de proteção ambiental das reentrâncias maranhenses, Brasil. Boletim do Laboratório de Hidrobiologia 23:57-64.
- Lira, J. J. P. R.; Calado, T. C. S. & Araújo, M. S. L. C. 2012. Condition factor of Goniopsis cruentata (Crustacea, Brachyura, Grapsidae) from Mundaú/Manguaba estuarine complex, Alagoas, Brazil., Iheringia Série Zoologia 102:285-291.
- Marochi, M. Z. & Masunari, S. 2011. Os caranguejos Eriphiidae, Menippidae, Panopeidae e Pilumnidae (Crustacea Brachyura) de águas rasas do litoral do Paraná, com chave pictórica de identificação para as espécies. Biota Neotropica11:21-33.
- Martinez, C. B. R.; Harris, R. R. & Santos, M. C. F. 1998. Transepithelial potential differences and sodium fluxes in isolated perfused gills of the mangrove crab Ucides cordatus Comparative Biochemistry and Physiology - Part A 120:227-236.
- Martins, A. S.; Pinheiro, H. T. & Leite Júnior, N. O. 2013. Biologia reprodutiva do camarão sete-barbas no litoral centro sul e sul do Espírito Santo, Brasil. Boletim do Instituto de Pesca 39:205-215.
- Masunari, S. 2006. Distribuição e abundância dos caranguejos Uca Leach (Crustacea, Decapoda, Ocypodidae) na Baía de Guaratuba, Paraná, Brasil. Revista Brasileira de Zoologia23:901-914.
- Melo, G. A. S. 1996. Manual de identificação dos Brachyura (caranguejos e siris) do litoral brasileiro São Paulo, Editora Plêiade. 603p.
- _____. 1999. Manual de identificação dos Crustacea Decapoda do litoral brasileiro: anomura, thalassinidea, palinuridea e astacidea. São Paulo, Pleiade/FAPESP. 551p.
- Mendes. M. T. & Couto, E. C. G. A. 2001. Família Ocypodidae Rafinesque 1815 (Crustacea: Decapoda: Brachyura) na Costa Sergipana. Revista Nordestina de Biologia 15:27-40.
- Menezes, A. P. D.; Araújo, M. S. L. C.& Calado, T. C. S.2012. Bioecologia de Goniopsis cruentata (Latreille, 1803) (Decapoda, Grapsidae) do complexo estuarino‐lagunar Mundaú/Manguaba, Alagoas, Brasil. Natural Resources 2:37-49.
- Moreira, R. P. G.; Ramos, R. J. & Freitas Netto, R. 2010. Composição faunística dos crustáceos do gênero Uca (Ocypodidae) em manguezal do município de Serra, ES. Natureza on line8:46-50.
- Nabout, J. C.; Marco Júnior, P.; Bini, L. M. & Diniz-Filho, J. A. F. 2009. Distribuição geográfica potencial de espécies americanas do caranguejo "violinista" (Uca spp.) (Crustacea, Decapoda) com base em modelagem de nicho ecológico., Iheringia Série Zoologia 99:92-98.
- Negreiros-Fransozo, M. L.; Fransozo, A.; Pinheiro, M. A. A.; Mantelatto, F. L. M. & Santos, S. 1991. Caracterização física e química da enseada de Fortaleza, Ubatuba, SP. Revista Brasileira de Geociências 21:114-120.
- Negromonte, A. O.; Araújo, M. S. L. C.& Coelho, P. A. 2012. Decapod crustaceans from a marine tropical mangrove ecosystem on the Southern Western Atlantic, Brazil. Nauplius 20:247-256.
- Nicolau, C. F. & Oshiro, L. M. Y. 2007. Distribuição espacial, sazonal e estrutura populacional do caranguejo Aratus pisonii (H. Milne Edwards) (Crustacea, Decapoda, Sesarmidae) do manguezal de Itacuruçá, Rio de Janeiro, Brasil. 2007. Revista Brasileira de Zoologia24:463-469.
- Nordhaus,I; Diele, K. & Wolff, M. 2009. Activity patterns, feeding and burrowing behaviour of the crab Ucides cordatus (Ucididae) in a high intertidal mangrove forest in North Brazil. Journal of Experimental Marine Biology and Ecology 374:104-112.
- Ogawa, M.; Silva, A. I. M.; Ogawa, N. B. P.; Maia, E. L. & Nunes, M. L. 2008. Adequações tecnológicas no processamento da carne de caranguejo. Ciência e Tecnologia de Alimentos 28:78-82.
- Oshiro, L. M. Y.; Silva, R. & Silva, Z. S. 1998. Composição da fauna de Braquiúros (Crustacea: Decapoda) dos manguezais da Baía de Sepetiba, RJ. Nauplius 6:31-40.
- Pérez-Farfante, I. & Kensley, B. 1997. Penaeoid and Sergestoid Shrimps and Prawns of the World: Keys and diagnoses for the families and genera. Mémoires du Muséum National d'Histoire Naturelle 175:1-233.
- Pinheiro, M. A. A.; Souza, C. A. & Borba, H. 2015.Meat yield of the mangrove crab, Ucides cordatus (Linnaeus, 1763) (Crustacea, Brachyura, Ucididae). Boletim do Instituto de Pesca 41:43-56.
- Ribeiro, E. B.; Almeida, Z. S. & Carvalho-Neta, R. N. F. 2012. Hábito alimentar do bagre Sciades herzbergii (Siluriformes, Ariidae) da Ilha dos Caranguejos, Maranhão, Brasil. Arquivo Brasileiro de Medicina Veterinária e Zootecnia 64:1761-1765.
- Ribeiro, R. P. & Almeida, Z. S.2014. Anelídeos Poliquetas do estado do Maranhão, Brasil: síntese do conhecimento. Bioikos 28:45-55.
- Rocha, S. S. 2010. Diferença entre dois métodos de coleta utilizados na captura de crustáceos decápodes em um rio da Estação Ecológica Juréia-Itatins, São Paulo, Iheringia, Série Zoologia 100:116-122.
- Rodrigues, A. M. T.; Branco, E. J.; Saccardo, S. A. & Blankensteyn, A.2000. A explotação do caranguejo Ucides cordatus (Decapoda: Ocypodidae) e o processo de gestão participativa para normatização da atividade na região sudeste-sul do Brasil. Boletim do Instituto de Pesca26:63-78.
- Rosa Filho, J. S.; Busman, D. V.; Viana, A. P.; Gregório, A. M. & Oliveira, D. M. 2006. Macrofauna bentônica de zonas entre-marés não vegetadas do estuário do rio Caeté, Bragança, Pará. Boletim do Museu Paraense Emílio Goeldi 1:85-96.
- Sampaio, S. R.; Masunari, S. & Haseyama, K. L. F. 2009. Distribuição temporal do ermitão Clibanarius vittatus (Anomura, Diogenidae) no litoral do Paraná., Iheringia Série Zoologia 99:276-280.
- Sant'Anna, B. S.; Zangrande, C. M.; Reigada, A. L. L. D.; Marcelo, A. A. & Pinheiro, M. A. A. 2006. Shell utilization pattern of the hermit crab Clibanarius vittatus (Crustacea, Anomura) in an estuary at São Vicente, State of São Paulo, Brazil., Iheringia Série Zoologia 96:261-266.
- Santos, J. L.; Severino-Rodrigues, E. & Vaz-Dos-Santos, A. M. 2008. Estrutura populacional do camarão-branco Litopenaeus schmitti nas regiões estuarina e marinha da baixada santista, São Paulo, Brasil. Boletim do Instituto de Pesca34:375-389.
- Santos, M. C. F.; Coelho, P. A. & Ramos-Porto, M. 2006 Sinopse das informações sobre a biologia e pesca do camarão-Sete-Barbas, Xiphopenaeus kroyeri (Heller, 1862) (Decapoda, Penaeidae), no Nordeste do Brasil. Boletim Técnico Científico CEPENE 14:141-178.
- Scelzo, M. A. 1982. Crecimiento y migracion del camarón Penaeus brasiliensis Latreille (Decapoda, Penaeidae ) en la laguna de manglar la Restinga Isla Margarita, Venezuela. Atlântica 5:104-112.
- Silva, F. E. R.; Bichara, C. M. G.; Mársico, E. T.; Taxi, C. M. A. D.; Ferreira, M. S. & Santos, W. F. 2013. Parâmetros de qualidade da carne de caranguejo-uçá (Ucides cordatus - Linnaeus, 1763) obtida pelos métodos experimental e artesanal. Boletim do Centro de Pesquisa de Processamento de Alimentos 31:255-262.
- Silva J. R. R. & Almeida Z. S. 2002. Zoneamento vertical dos crustáceos bentônicos em substratos inconsolidados do manguezal do quebra-pote na Ilha de São Luís, Maranhão - Brasil. Boletim Técnico-Científico CEPENE 10: 125-143.
- Soares-Gomes, A. & Figueiredo, A. G. 2009. O ambiente marinho. 2ed. In: Pereira, R. C. & Soares-Gomes, A. org. Biologia Marinha. Interciência, Rio de Janeiro, p, 1-34.
- Souza-Filho, P. W. M. 2005. Costa de manguezais de macromaré da Amazônia: cenários morfológicos, mapeamento e quantificação de áreas usando dados de sensores remotos. Revista Brasileira de Geofísica 23:427-435.
- Warner, G. F. 1967. The life history of the mangrove tree crab Aratus pisonii Journal of Zoology 153:321-335.
Datas de Publicação
-
Publicação nesta coleção
30 Set 2015
Histórico
-
Recebido
26 Fev 2015 -
Aceito
15 Set 2015