ABSTRACT
Tropical streams feature high variety of habitats and environmental gradients, which reflect on the greater richness of aquatic insects. In this way, we evaluate if the diversity of aquatic insects of prey and predator categories is influenced by the type of substrates or by longitudinal portions in Cerrado streams. Our hypothesis is that prey and predator diversity will be determined by the type of substrate, assuming that the substrate serves as a source for foraging and / or refuge. In addition, the folhiço substrate will present greater abundance and richness due to the availability of shelter and food provided by this type of substrate. There will be differences in prey and predator composition among substrates, since some species have associations with the substrate type. The portions of the stream will have no effect on the diversity of prey and predator, since in streams of up to third order does not present considerable changes in physical characteristics. The study was carried out in nascent (1st order), intermediate (2nd) and estuary (3rd), in two streams, during dry and rainy periods. Five subsamples of sand, gravel, rocks or boulders were collected, backwaters, rapids and roots (substrate). The substrate influenced all prey and predator responses (abundance, richness and composition), but the environment (longitudinal portions) did not influence the abundance and predator composition. The influence of substrates on the diversity of prey and predators evidences the importance of riparian vegetation as a source of allochthonous material in bedside streams.
KEYWORDS
Conservation; aquatic insects; substrate; Cerrado
RESUMO
Córregos tropicais apresentam alta variedade de hábitats e gradientes ambientais, que refletem na maior riqueza de insetos aquáticos. Dessa forma, avaliamos se a diversidade de insetos aquáticos das categorias presa e predador é influenciada pelo tipo de substratos ou por porções longitudinais em córregos de Cerrado. Nossa hipótese é que a diversidade de presa e predador será determinada pelo tipo de substrato, partindo do pressuposto de que o substrato serve como fonte para forrageamento e/ou refúgio. Ademais, o substrato folhiço apresentará maior abundância e riqueza devido à disponibilidade de abrigo e alimento provida por esse tipo de substrato. Haverá diferença na composição de presa e predador entre substratos, pois algumas espécies apresentam associações com o tipo de substrato. As porções do córrego não exercerão efeito sobre a diversidade de presa e predador, uma vez que, em córregos de até terceira ordem não apresenta mudanças consideráveis nas características físicas. O estudo foi realizado nas porções nascente (1ª ordem), intermediário (2ª) e foz (3ª), em dois córregos, nos períodos seco e chuvoso. Foram coletadas cinco subamostras de areia, cascalho, rochas ou matacões, folhiço de remanso, de corredeira e raízes (substrato). O substrato influenciou todas as variáveis respostas de presa e predador (abundância, riqueza e composição), porém, o ambiente (porções longitudinais) não influenciou a abundância e composição de predador. A influência de substratos para a diversidade de presas e predadores evidencia a importância da vegetação ripária como fonte de material alóctone em córregos de cabeceira.
PALAVRAS-CHAVE
Conservação; insetos aquáticos; substrato; Cerrado
Os insetos aquáticos desempenham papel fundamental nas teias tróficas de córrego, promovendo a transferência de energia nesses sistemas. Esses organismos são geralmente classificados conforme o hábito alimentar que incluem os que possuem hábito fragmentador, detritívoro, raspador de perifiton ou filtrador de partículas (consideradas neste estudo como presas) e os predadores (Cummins et al., 2005Cummins, K. W.; Merritt, R. W. & Rade, P. C. 2005. The use of invertebrate functional groups to characterize ecosystem attributes in selected streams and rivers in southeast Brazil. Studies on Neotropical Fauna and Environmental 40(1):71-90.; Santos & Rodrigues, 2015Santos, I. G. A. & Rodrigues, G. G. 2015. Colonização de macroinvertebrados bentônicos em detritos foliares em um córrego de primeira ordem na Floresta Atlântica do nordeste brasileiro. Iheringia, Série Zoologia 105(1):84-93.; Castro et al., 2018Castro, D.M.P, Dolédec, S. & Callisto, M. 2018. Land cover disturbance homogenizes aquatic insect functional structure in neotropical savanna streams. Ecological Indicators 84:573-582.).
Os córregos em ecossistemas tropicais apresentam alta heterogeneidade de habitats que refletem na alta riqueza taxonômica (Hepp & Melo, 2013Hepp, L. U. & Melo, A. S. 2013. Dissimilarity of stream insect assemblages: effects of multiple scales and spatial distances. Hydrobiologia 703(1):239-246. ; Milesi et al., 2016Milesi, S.V.; Dolédec, S. & Melo, A.S. 2016. Substrate heterogeneity influences the trait composition of stream insect communities: an experimental in situ study. Freshwater Science 35(4): 1321-1329.) e funcional de insetos aquáticos (Ferreira et al., 2017Ferreira, W.R., Hepp, L.U., Ligeiro, R., Macedo, D.R., Hughes, R.M., Kaufmann, P.R. & Callisto, M. 2017. Partitioning taxonomic diversity of aquatic insect assemblages and functional feeding groups in neotropical savanna headwater streams. Ecological Indicators 72, 365-373.). Esses habitats podem ser formados por manchas sistematizadas ao nível de mesohabitat (corredeira e remanso), que incluem a dominância de tipos específicos de substratos (e.g. folhiço, raízes, areia, cascalho ou matacões) (Thorp et al., 2006Thorp, J. H.; Thoms, M. C. & Delong, M. D. 2006. The riverine ecosystem synthesis: biocomplexity in river networks across space and time. River Research and Applications 147(2):123-147.; Brasil et al., 2014Brasil, L. S.; Juen, L.; Batista, J. D.; Pavan, M. G. & Cabette, H. S. R. 2014. Longitudinal Distribution of the Functional Feeding Groups of Aquatic Insects in Streams of the Brazilian Cerrado Savanna. Neotropical Entomology 43(5):421-428.). Os tipos de substratos influenciam a distribuição das comunidades de macroinvertebrados aquáticos (Fidelis et al., 2008Fidelis, L.; Nessimian, J. L. & Hamada, N. 2008. Distribuição espacial de insetos aquáticos em igarapés de pequena ordem na Amazônia Central. Acta Amazonica 38(1):127-134. ), influenciando na disponibilidade de alimento e /ou abrigo (Shimano et al., 2012Shimano, Y.; Salles, F. F.; Faria, L. R. R.; Cabette, H. S. R. & Nogueira, D. S. 2012. Distribuição espacial das guildas tróficas e estruturação da comunidade de Ephemeroptera (Insecta) em córregos do Cerrado de Mato Grosso, Brasil. Iheringia, Série Zoologia 102(2):187-196.; Milesi, et al., 2016Milesi, S.V.; Dolédec, S. & Melo, A.S. 2016. Substrate heterogeneity influences the trait composition of stream insect communities: an experimental in situ study. Freshwater Science 35(4): 1321-1329.). Portanto, a Teoria Hierárquica de manchas estabelece que os grupos tróficos se distribuam em manchas conforme a disponibilidade de recursos e a estrutura do córrego (Thorp et al., 2006Thorp, J. H.; Thoms, M. C. & Delong, M. D. 2006. The riverine ecosystem synthesis: biocomplexity in river networks across space and time. River Research and Applications 147(2):123-147.). Segundo essa teoria, as manchas são locais com características ambientais e funcionais específicas que são distribuídos de forma descontínua no tempo e no espaço no sistema lótico (Thorp et al., 2006Thorp, J. H.; Thoms, M. C. & Delong, M. D. 2006. The riverine ecosystem synthesis: biocomplexity in river networks across space and time. River Research and Applications 147(2):123-147.; Brasil et al., 2014Brasil, L. S.; Juen, L.; Batista, J. D.; Pavan, M. G. & Cabette, H. S. R. 2014. Longitudinal Distribution of the Functional Feeding Groups of Aquatic Insects in Streams of the Brazilian Cerrado Savanna. Neotropical Entomology 43(5):421-428.).
De acordo com a Teoria do Rio Contínuo, os grupos tróficos - presas - se distribuem de forma diferencial ao longo do contínuo, com contribuição na biomassa e energia conforme a produção autóctone e alóctone do córrego. Enquanto que predadores contribuem de forma uniforme na parcela de biomassa ao longo do córrego e tendem a estar relacionada à disponibilidade de presas (Vannote et al., 1980Vannote, R. L.; Minshall, G. W.; Cummins, K. W.; Sedell, J. R. & Cushing, C. E. 1980. The river continuum concept. Canadian Journal of Fisheries and Aquatic Science 37(1):130-137.). No entanto, segundo Hepp & Melo (2013Hepp, L. U. & Melo, A. S. 2013. Dissimilarity of stream insect assemblages: effects of multiple scales and spatial distances. Hydrobiologia 703(1):239-246. ) quando há apenas um efeito espacial, a tendência na composição da assembleia é similar em diferentes porções do mesmo riacho devido às características de dispersão de insetos.
Desse modo, avaliamos se a diversidade de insetos aquáticos da categoria presa (todas guildas tróficas com exceção de predadores) e predador é influenciada pelo tipo de substrato ou por porções no córrego (longitudinalmente). Nossa hipótese é de que a diversidade de presas e predadores será influenciada pelo tipo de substrato, ao invés das porções longitudinais do córrego. Assim, haverá maior abundância e riqueza de presas e predadores no folhiço, devido à disponibilidade de abrigo e alimentação provida por esse tipo de substrato. E ocorrerá diferença na composição de presa e predador entre substratos, pois algumas espécies apresentam associações com o tipo de substrato. As porções longitudinais do córrego não exercerão efeito sobre a diversidade, pois em córregos de até terceira ordem não ocorrem mudanças consideráveis nas características físicas (ex. largura). Portanto, não modifica a entrada de luz e produção de energia autóctone que promovem mudança na diversidade das comunidades.
MATERIAL E MÉTODOS
Área de estudo. O estudo foi realizado em dois córregos (Córregos Santo Antônio e Colher) afluentes da margem esquerda do médio Rio das Mortes, no leste do Mato Grosso (Fig. 1), localizados à aproximadamente 20 km de Nova Xavantina, em região de Cerrado. O clima da região é Aw, savana tropical, no sistema de classificação de Köppen (Peel et al., 2007Peel, M. C.; Finlayson, B. L. & Mcmahon, T. A. 2007. Updated world map of the Köppen-Geiger climate classification. Hydrology and Earth System Sciences 11(1):1633-1644.), com temperatura média anual em torno de 24° C e a precipitação de 1.500 mm (INMET, 2016). Em cada córrego foram amostrados três sítios/porções, nascente (Nasc - fluxo de 1ª ordem), intermediário (Inter - 2ª ordem) e foz (Foz - 3ª ordem) (conforme Strahler, 1957Strahler, H. N. 1957. Quantitative analysis of watershed geomorphology. American Geophysical Union Transactions, 38(6):913-920. ).
No Córrego Santo Antônio a nascente (1ª ordem) possui vegetação monodominante de palmeiras (bacuri) que indica área em regeneração; sem presença de barrancos e canal de substrato arenoso e grandes rochas e lajedos, com profundidade e largura média de 0,18 e 2,43 m, respectivamente; trecho intermediário (2ª ordem) com mata de galeria bem preservada e canal com blocos de rocha entremeados com areia e cascalho com profundidade e largura média de 0,26 e 3,27 m, respectivamente; enquanto que a foz (3ª ordem) apresenta áreas de pastagem e está sob regeneração de garimpo de ouro (finalizado em 1993), com canal com substrato predominante de areia e cascalho e com profundidade média de 0,20 e largura média de 5,21 m. O Córrego da Colher, por sua vez, tem nascente (1ª ordem) com vegetação monodominante de palmeiras (bacuri), o que indica ser uma área de regeneração avançada, margens com presença de barrancos e substrato do canal predominantemente areno-argiloso, apresentando profundidade média de 0,24 e largura média de 1,55 m; na porção intermediária (2ª ordem) em área de pastagens com presença de palmeiras (babaçu e bacuri), canal com substrato de areia e cascalho e com profundidade média de 0,28 e largura média de 3,07m; na foz (3ª ordem e a 800 metros da foz do Santo Antônio) apresenta mata de galeria em regeneração, com algum impacto de gado no período da seca, presença de blocos de rocha com predominância de substrato arenoso com profundidade média de 0,36 e largura média de 5,17 m.
Os córregos são próximos, mas diferem pelo tipo de atividade em suas margens, assim, o Córrego Colher tem uma antiga pastagem em processo de regeneração, onde predomina a espécie pioneira Scheelea phalerata Mart. (bacuri), enquanto que o córrego Santo Antônio, que apesar de ter sofrido impacto do garimpo não teve sua flora completamente retirada, exceto na região da foz.
Localização dos sítios amostrais na Nascente, Intermediário e Foz dos Córregos Santo Antônio e Córrego da Colher, Nova Xavantina-MT, Brasil. [Fonte: Dias-Silva et al., 2013Dias-Silva, K.; Cabette, H. S. R.; Giehl, N. F. S. & Juen, L. 2013. Distribuição de Heteroptera Aquáticos (Insecta) em Diferentes Tipos de Substratos de Córregos do Cerrado Matogrossense. EntomoBrasilis 6(2):132-140. ].
Amostragens. As coletas foram realizadas em dois períodos do ano, chuvoso (dezembro/2004) e seco (julho/2005). Em cada sítio (córrego/ordem) e estação (seca e chuva), foram tomadas cinco amostras para cada substrato: raízes submersas (R), areia (A), cascalho fino (C), folhiço de remanso (FR), folhiço de corredeira (FC), rochas grandes ou matacões (P, anotados aqui como pedras) (Dias-Silva et al., 2013Dias-Silva, K.; Cabette, H. S. R.; Giehl, N. F. S. & Juen, L. 2013. Distribuição de Heteroptera Aquáticos (Insecta) em Diferentes Tipos de Substratos de Córregos do Cerrado Matogrossense. EntomoBrasilis 6(2):132-140. ), compondo 10 amostras por substrato/local. As amostragens nos substratos areia, raiz e folhiços (remanso e corredeira), foram realizadas com coador manual com rede de 18 cm de diâmetro, 15 cm de profundidade e malha fina. Em cascalho (substrato inorgânico menores que 5 cm), utilizou-se rede "surber”. Em coletas de pedras/matacões, foram escovadas delicadamente 15 rochas de cerca de 20 cm de diâmetro, sobre bandeja branca. Em todas as coletas dos substratos buscamos expressar volume/áreas amostrais similares.
O material biológico foi separado em duas categorias, presa e predador, a partir dos grupos tróficos estabelecidos em Cummins et al. (2005Cummins, K. W.; Merritt, R. W. & Rade, P. C. 2005. The use of invertebrate functional groups to characterize ecosystem attributes in selected streams and rivers in southeast Brazil. Studies on Neotropical Fauna and Environmental 40(1):71-90.), Baptista et al. (2006Baptista, D. F.; Buss, D. F. L.; Dias, G.; Nessimian, J. L.; Silva, E. R.; Moraes, A. H. A.; Carvalho, N. S. N.; Oliveira, M. A. & Andrade, L. R. 2006. Functional feeding groups of Brazilian Ephemeroptera nymphs: ultrastructure of mouthparts. Annales de Limnologie 429(2):87-96.) e Merritt et al. (2008Merritt, R. W.; Cummins, K. W. & Berg, M. B. 2008. An introduction to the aquatic insects of North America. Dubuque, Kendall Hunt Publishing Company. 1158p.) (Apêndice 1Apêndice 1. Ocorrência dos gêneros ou morfoespécies de insetos aquáticos presa ou predador (Pred) nos substratos (A, areia; C, cascalho; FC, folhiço de corredeira; FR, folhiço de remanso; P, pedra; R, raiz) e nos ambientes (N, Nascente; I, Intermediário; F, foz). (a numeração das espécies/morfoespécies seguem o padrão anotado na CZNX)Gênero e/ou MorfoespécieCategoria Ambiente Substrato PredPresaNIFACFCFRPREPHEMEROPTERA Americabaetis sp.1 xxxx xxxxxAmericabaetis sp. 2 xxxx xxxxxAskola sp. 1 x x xx Aturbina sp. 1 x xx xxx xBaetodes sp. 1 xxxx xx x Brasilocaenis sp. 1 xxxxxxxxxxCaenis sp. 1 xxxxxxxxxxCallibaetis sp. 1 x xxxx x xCamelobaetidius sp. 1 x x x x Campsurus sp. 1 x x xCampylocia sp. 1 x xxxx x Cloeodes sp. 1 xxxxxx xxxCloeodes sp. 2 xxxxxxxxxxFarrodes sp. 1 xxxxxxxxxxHagenulopsis sp. 1 xxxxxx xxxLeptohyphes sp. 1 x xx x xMiroculis sp. 1 xxxxxxxxxxParacloeodes sp. 1 x xx x Paracloeodes sp. 2 x x x Tricorythodes barbus Allen 1967 x xx x xT. mirca Molineri, 2002 xxxxxx xxxTerpides sp. 1 xxxxxxxxxxThraulodes sp. 1 xxxxxxxxxxTraverhyphes sp. 1 xxxxxxxxxxTraverhyphes sp. 2 xxxxxxxxxxTricorythopsis sp. 1 x x x Ulmeritoides sp. 1 xxxxxxxxxxWaltzoyphius sp. 1 x x xZelusia sp. 1 xxx xxx xHETEROPTERA Ambrysus bifidus La Rivers, 1952x x xx xA. stali La Rivers, 1962x xxx xxx xA. teutonius La Rivers, 1951x xxx xxxxxBelostoma costalimai De Carlo, 1938x x xBelostoma sp. 2x x xBrachymetra sp. 1x x x Buenoa sp. 2x x xCryphocricos sp. 1x x x Limnocoris burmeisteri De Carlo, 1967x xx xxx xL maculicepscf. Montandon, 1897x x xx Limnocoris minutus De Carlo, 1951x x x Limnocoris pusillus Montandon, 1897x xxx x xLimnogonus aduncus Drake & Harris, 1932x x x Martarega chinai Hynes, 1948x x xNeogerris lubricus (White, 1879)x x x Nerthracf. buenoi Todd, 1955x x x Ochterus sp. 1x x x Paravelia indet.x x xRanatra sp. 1x x xRanatra sp. 2x x x xRhagovelia elegans Uhler, 1894x x x Rhagovelia robusta Gould, 1931x x x Rhagovelia tenuipes Champion, 1898x x x Stridulivelia sp. 2x x xStridulivelia tersa (Drake & Harris, 1941)x xxx x xTenagobia sp. 1 x x xTenagobia sp. 2 x x xODONATA Acanthagrionx xxx x x xArchaeogomphusx xx Argiax xxxxxxxxxBrechmorhogax xxxxxxxxxElasmothemisx xx x xxElgax xxx xxx xEpipleoneurax xxx x xxxErythemisx x xGynothemisx x x xHetaerina_Mnesaretex xx xxx xMacrothemisx xxx x xxxOligocladax xxxxxx xxPantalax x x x xPhyllocyclax x x xxxProgomphusx xxxxx xx Tibiagomphusx xx x x xPLECOPTERA Anacroneuriax xxx xxxxxTRICHOPTERA Cernotina sp. 1x xxxxxxxxxChimarra sp. 1 xxxx xxxxxChimarra sp. 2 xxxx xxxx Chimarra sp. 3 xxxx xxxxxHelicopsyche sp. 1 xxxx xxxxxHelicopsyche sp. 2 xxxx xx xxLeptonema sp. 1 xxxx xxxxxLeptonema sp. 2 x x x Macronema sp. 1 xxxx xxxxxMacronema sp. 2 xxxx xxMarilia sp. 1x x x xMarilia sp. 2x x x Nectopsyche sp. 1 x xx xx xOecetis sp. 1x x x Phylloicus sp. 1 xxxx xx xPhylloicus sp. 2 x x x xPolyplectropus sp. 4x x x Polyplectropus sp. 5x x xx Protoptila sp. 1 x x x Protoptila sp. 2 x x x xSmicridea (R.) sp. 1 x xx xx x Smicridea (R.) sp. 2 xxxx xx x Smicridea (R.) sp. 3 xx x x x Smicridea (R.) sp. 4 x x xx xSmicridea (R.) sp. 5 xxxx xxxxxSmicridea (R.) sp. 6 x x x Smicridea (S.) sp. 1 x x x Triplectides sp. 2 x x x, Tab. I). Consideramos na categoria presa os gêneros com hábito alimentar coletor-catador, coletor-filtrador, raspador e fragmentador, nesta categoria foram incluídos todos representantes da ordem Ephemeroptera, a maioria dos Trichoptera e um gênero de Heteroptera. Na categoria predador permaneceram quatro gêneros de Trichoptera (Oecetis, Marilia, Cernotina e Polyplectropus), todos os Odonata, Plecoptera e os Heteroptera (com exceção do gênero Tenagobia).
A maioria dos representantes da ordem Heteroptera foi identificado em nível específico e os Ephemeroptera, Trichoptera e Plecoptera foram morfoespeciados, entretanto os Odonata foram identificados até o nível de gênero (devido às variações taxonômicas entre os instares (Neiss & Hamada, 2014Neiss , U.G. & Hamada, N. 2014. Ordem Odonata. In: Hamada, N.; Nessimian, J.G. & Querino, R.B. eds. Insetos aquáticos na Amazônia brasileira: taxonomia, biologia e ecologia. Manaus, Editora da Universidade Federal do Amazonas. p. 217-284. ). Os espécimes foram preservados em álcool 85% e estão depositados na Coleção Zoobotânica "James Alexander Ratter”, Universidade do Estado do Mato Grosso - UNEMAT/Nova Xavantina (CZNX).
Análise de dados. Para minimizar o efeito da variação sazonal sobre a abundância de espécies nós calculamos a média dos dados do período seco e chuvoso e dos dois córregos analisados (ex. abundância total no ambiente das nascentes dividido por quatro). Assim, a abundância e riqueza de presas e predadores entre os substratos e entre ambientes foram analisadas através de modelos lineares generalizados (Generalized Linear Models - GLM), essa análise é flexível e permite a construção de modelos que controlam a não normalidade das variáveis. Para abundância de predador foi utilizado a família de distribuição Poisson e corrigimos o erro de dispersão usando o modelo Quasi-GLM, onde a variância é dada por f × µ, onde µ é a média e f é o parâmetro de dispersão. Já para abundância de presa foi utilizada a família de distribuição Gaussian (distribuição normal), e para a riqueza de presa e predador foi utilizada a família de distribuição Poisson. Após o GLM foi realizada uma análise de contraste ortogonal (Crawley, 2007Crawley, M. J. 2007. The R Book. Chichester, John Wiley & Sons Ltd. p. 942.) para verificar a diferença na abundância e riqueza de presas e predadores entre os tipos de substratos e as porções do córrego. Nessa análise as variáveis dependentes para as diferentes porções (N, I, F) e substratos (FC, FR, R, C, P e A) foram ordenadas (várias vezes) e testadas em pares.
Para verificar a variação da composição de presas e predadores entre os substratos estudados e entre porções do córrego foi realizada Análise de Variância Multivariada Permutacional (PERMANOVA). A diferença entre a composição de cada tipo de substratos e cada tipo de ambiente (longitudinalmente) foi verificada com teste a posteriori "Pairwise tests”, utilizando 9999 permutações aleatórias com matriz de Bray-Curtis e correções de Bonferroni (Legendre & Legendre, 2012Legendre, P. & Legendre, L. 2012. Numerical Ecology. Amsterdam, The Netherlands: Elsevier Science BV. 853p.). Todas as análises de GLM e PERMANOVA foram realizadas no programa R (R Development Core Team, 2016R Core Team. 2016. R: A Language and Environment for Statistical Computing. Vienna, R Foundation for Statistical Computing.).
RESULTADOS
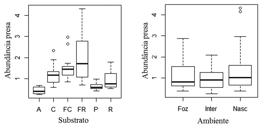
Nós amostramos 53 tipos de presas e 52 de predadores, correspondentes a 105 gêneros/morfoespécies/espécies das ordens Ephemeroptera, Plecoptera, Trichoptera, Odonata e Heteroptera (EPTOH, Apêndice 1Apêndice 1. Ocorrência dos gêneros ou morfoespécies de insetos aquáticos presa ou predador (Pred) nos substratos (A, areia; C, cascalho; FC, folhiço de corredeira; FR, folhiço de remanso; P, pedra; R, raiz) e nos ambientes (N, Nascente; I, Intermediário; F, foz). (a numeração das espécies/morfoespécies seguem o padrão anotado na CZNX)Gênero e/ou MorfoespécieCategoria Ambiente Substrato PredPresaNIFACFCFRPREPHEMEROPTERA Americabaetis sp.1 xxxx xxxxxAmericabaetis sp. 2 xxxx xxxxxAskola sp. 1 x x xx Aturbina sp. 1 x xx xxx xBaetodes sp. 1 xxxx xx x Brasilocaenis sp. 1 xxxxxxxxxxCaenis sp. 1 xxxxxxxxxxCallibaetis sp. 1 x xxxx x xCamelobaetidius sp. 1 x x x x Campsurus sp. 1 x x xCampylocia sp. 1 x xxxx x Cloeodes sp. 1 xxxxxx xxxCloeodes sp. 2 xxxxxxxxxxFarrodes sp. 1 xxxxxxxxxxHagenulopsis sp. 1 xxxxxx xxxLeptohyphes sp. 1 x xx x xMiroculis sp. 1 xxxxxxxxxxParacloeodes sp. 1 x xx x Paracloeodes sp. 2 x x x Tricorythodes barbus Allen 1967 x xx x xT. mirca Molineri, 2002 xxxxxx xxxTerpides sp. 1 xxxxxxxxxxThraulodes sp. 1 xxxxxxxxxxTraverhyphes sp. 1 xxxxxxxxxxTraverhyphes sp. 2 xxxxxxxxxxTricorythopsis sp. 1 x x x Ulmeritoides sp. 1 xxxxxxxxxxWaltzoyphius sp. 1 x x xZelusia sp. 1 xxx xxx xHETEROPTERA Ambrysus bifidus La Rivers, 1952x x xx xA. stali La Rivers, 1962x xxx xxx xA. teutonius La Rivers, 1951x xxx xxxxxBelostoma costalimai De Carlo, 1938x x xBelostoma sp. 2x x xBrachymetra sp. 1x x x Buenoa sp. 2x x xCryphocricos sp. 1x x x Limnocoris burmeisteri De Carlo, 1967x xx xxx xL maculicepscf. Montandon, 1897x x xx Limnocoris minutus De Carlo, 1951x x x Limnocoris pusillus Montandon, 1897x xxx x xLimnogonus aduncus Drake & Harris, 1932x x x Martarega chinai Hynes, 1948x x xNeogerris lubricus (White, 1879)x x x Nerthracf. buenoi Todd, 1955x x x Ochterus sp. 1x x x Paravelia indet.x x xRanatra sp. 1x x xRanatra sp. 2x x x xRhagovelia elegans Uhler, 1894x x x Rhagovelia robusta Gould, 1931x x x Rhagovelia tenuipes Champion, 1898x x x Stridulivelia sp. 2x x xStridulivelia tersa (Drake & Harris, 1941)x xxx x xTenagobia sp. 1 x x xTenagobia sp. 2 x x xODONATA Acanthagrionx xxx x x xArchaeogomphusx xx Argiax xxxxxxxxxBrechmorhogax xxxxxxxxxElasmothemisx xx x xxElgax xxx xxx xEpipleoneurax xxx x xxxErythemisx x xGynothemisx x x xHetaerina_Mnesaretex xx xxx xMacrothemisx xxx x xxxOligocladax xxxxxx xxPantalax x x x xPhyllocyclax x x xxxProgomphusx xxxxx xx Tibiagomphusx xx x x xPLECOPTERA Anacroneuriax xxx xxxxxTRICHOPTERA Cernotina sp. 1x xxxxxxxxxChimarra sp. 1 xxxx xxxxxChimarra sp. 2 xxxx xxxx Chimarra sp. 3 xxxx xxxxxHelicopsyche sp. 1 xxxx xxxxxHelicopsyche sp. 2 xxxx xx xxLeptonema sp. 1 xxxx xxxxxLeptonema sp. 2 x x x Macronema sp. 1 xxxx xxxxxMacronema sp. 2 xxxx xxMarilia sp. 1x x x xMarilia sp. 2x x x Nectopsyche sp. 1 x xx xx xOecetis sp. 1x x x Phylloicus sp. 1 xxxx xx xPhylloicus sp. 2 x x x xPolyplectropus sp. 4x x x Polyplectropus sp. 5x x xx Protoptila sp. 1 x x x Protoptila sp. 2 x x x xSmicridea (R.) sp. 1 x xx xx x Smicridea (R.) sp. 2 xxxx xx x Smicridea (R.) sp. 3 xx x x x Smicridea (R.) sp. 4 x x xx xSmicridea (R.) sp. 5 xxxx xxxxxSmicridea (R.) sp. 6 x x x Smicridea (S.) sp. 1 x x x Triplectides sp. 2 x x x). O preditor substrato influenciou a abundância de ambas as categorias (presa: F= 16,6, df= 5, p< 0,001; predador: F= 11,2, df= 5, p< 0,001). Entretanto o ambiente influenciou somente a abundância de presas (presas: F=4,4, df= 2, p= 0,015), sendo maior em folhiço de remanso e na nascente (Tab. I e Fig. 2). Para predador a maior abundância foi em folhiço de corredeira, não diferindo entre porções do córrego (predador: F= 1,2, df= 2, p= 0,309, Tab. I, Fig. 3).
Análise de contraste para abundância (Abund) e riqueza (Riq.) das categorias presa e predador (pred) entre tipos de substratos (A, areia; C, cascalho; FC, folhiço de corredeira; FR, folhiço de remanso; P, pedra; R, raiz) e entre ambientes (Nasc, Nascente; Inter, Intermediário; Foz, foz), Desv. Resid., Desvio residual.
Abundância de presa de insetos aquáticos (EPTOH) nos substratos (A= areia, C= cascalho, FC= folhiço de corredeira, FR= folhiço de remanso, P= pedra, R= raiz) e nos ambientes (Nasc= Nascente, Inter= Intermediário e Foz= foz).
Abundância de predadores de insetos aquáticos (EPTOH) nos substratos (A= areia, C= cascalho, FC= folhiço de corredeira, FR= folhiço de remanso, P= pedra, R= raiz) e nos ambientes (Nasc= Nascente, Inter= Intermediário e Foz= foz).
A riqueza de presa e predador foi influenciada pelo tipo do substrato do leito e pelo ambiente longitudinal (presa-substrato: χ²= 98, df= 5, p <0,001, presa-ambiente: χ²= 41, df= 2, p< 0,001, predador-substrato χ²= 46, df= 5, p <0,001, predador-ambiente: χ²= 6, df= 2, p= 0,038). Para ambas as categorias a menor riqueza foi registrada no substrato areia e para predadores houve maior riqueza no substrato raiz. Houve menor riqueza de presas na porção nascente (Tab. I, Fig. 4), e para predadores a maior riqueza foi na porção intermediária (Tab. I, Fig. 5). A composição de presa diferiu entre os tipos de substratos e ambientes (Substrato: Pseudo-F= 5,7, p<0,001; Ambiente: Pseudo-F= 3,75, p<0,001), sendo similar, apenas entre cascalho versus raiz, e entre os ambientes foz versus intermediário (Apêndice 2Apêndice 2. Composição de gêneros, espécie ou morfoespécie de insetos aquáticos da categoria presa em relação aos substratos e ambiente longitudinal. Resultado do Pairwise test (valor calculado par a par entre variáveis categóricas).ParesF. ModelR2pp. ajustadoSubstrato A vs C4,1720,1300,0010,015A vs FC9,4200,2520,0010,015A vs FR5,9490,1750,0010,015A vs P5,5140,1650,0010,015A vs R5,4220,1620,0010,015C vs FC6,4790,1880,0010,015C vs FR3,3150,1060,0010,015C vs P4,1990,1300,0010,015C vs R2,8220,0920,0050,075FC vs FR5,6680,1680,0010,015FC vs P7,0610,2010,0010,015FC vs R6,8670,1970,0010,015FR vs P8,6330,2360,0010,015FR vs R3,0960,1000,0010,015P vs R8,1640,2260,0010,015Ambiente Foz vs Inter1,4820,0250,1230,369Foz vs Nasc5,3320,0840,0010,003Inter vs Nasc4,4530,0710,0010,003). No entanto, a composição de predador diferiu apenas entre substratos (Substrato: Pseudo-F= 5,1, p<0,001; Ambiente: Pseudo-F= 1,4, p=0,069, Tab. II, Apêndice 3Apêndice 3. Composição de gêneros, espécie ou morfoespécie de insetos aquáticos da categoria predador em relação aos substratos e ambiente longitudinal. Resultado do Pairwise test (valor calculado em pares entre variáveis categóricas).ParesF. ModelR2pp. ajustadoSubstrato A vs C2,1180,0880,0130,195A vs FC11,9470,3320,0010,015A vs FR3,8110,1370,0010,015A vs P6,7000,2180,0010,015A vs R4,8110,1670,0010,015C vs FC6,3630,1970,0010,015C vs FR2,3590,0830,0020,03C vs P3,6310,1230,0020,03C vs R3,0630,1050,0010,015FC vs FR10,5100,2730,0010,015FC vs P5,8150,1720,0010,015FC vs R10,1460,2660,0010,015FR vs P4,8020,1460,0010,015FR vs R1,8730,0630,0260,39P vs R4,7300,1450,0010,015Ambiente Foz vs Inter1,5090,0260,0860,258Foz vs Nasc1,2400,0230,2280,684Inter vs Nasc1,5580,0290,0940,282), com composição semelhante entre cascalho versus areia e, folhiço de remanso versus raiz.
Composição dos gêneros ou morfoespécies/ espécies de insetos aquáticos na categoria presa ou predador entre os substratos e entre ambiente longitudinal. [Pseudo-F = valor calculado usando PERMANOVA, * diferenças significativas das assembleias].
Riqueza de presa nos substratos de insetos aquáticos (EPTOH) (A, areia; C, cascalho; FC, folhiço de corredeira; FR, folhiço de remanso; P, pedra; R, raiz) e nos ambientes (Nasc, nascente; Inter, intermediário; Foz, foz).
Riqueza de predadores nos substratos de insetos aquáticos (EPTOH) (A, areia; C, cascalho; FC, folhiço de corredeira; FR, folhiço de remanso; P, pedra; R, raiz) e nos ambientes (Nasc, nascente; Inter, intermediário; Foz, foz).
DISCUSSÃO
As ordens Ephemeroptera, Trichoptera, Odonata, Heteroptera são amplamente distribuídas e diversas na região de Cerrado (e.g. Dias- Silva et al., 2010Crawley, M. J. 2007. The R Book. Chichester, John Wiley & Sons Ltd. p. 942.; Godoy et al., 2016; Calvão et al., 2018Calvão, L. B.; Juen, L.; Oliveira-Junior, J.M.B. Batista, J.D & De Marco JR, P. 2018. Land use modifies Odonata diversity in streams of the Brazilian Cerrado. Journal of Insect Conservation. Doi: 10.1007/s10841-018-0093-5
https://doi.org/10.1007/s10841-018-0093-...
), e são afetadas por variações ambientais (e.g. retirada da vegetação ciliar, tipo de substrato, variáveis físico-químicas, etc). De acordo com a Teoria do Rio Contínuo (Vannote et al., 1980Vannote, R. L.; Minshall, G. W.; Cummins, K. W.; Sedell, J. R. & Cushing, C. E. 1980. The river continuum concept. Canadian Journal of Fisheries and Aquatic Science 37(1):130-137.), as presas em ambientes aquáticos se distribuem de forma diferenciada ao longo do contínuo do córrego, variando conforme a energia autóctone e alóctone, principalmente devido variações impostas pela entrada de energia solar, que se diferem em ambientes de menores a maiores ordem de fluxo devido variação da largura. Enquanto que predadores se distribuem uniformemente ao longo do córrego e tendem a estar relacionados à disponibilidade de presas. Por outro lado, a teoria de manchas (Thorp et al., 2006Thorp, J. H.; Thoms, M. C. & Delong, M. D. 2006. The riverine ecosystem synthesis: biocomplexity in river networks across space and time. River Research and Applications 147(2):123-147.) estabelece que os grupos tróficos se distribuam em manchas conforme a disponibilidade de recursos e a estrutura do córrego. Nesse estudo, o tipo de substrato influenciou todas as variáveis respostas analisadas (abundância, riqueza e composição de presa e predador), porém, o ambiente (porções longitudinais) não influenciou a abundância e composição de predador. Assim, a diversidade de insetos aquáticos de córregos (incluindo presas e predadores de EPTOH) foi melhor influenciada pelo tipo de substrato, corroborando nossa hipótese. Ademais, abundância de presas e predadores foi maior no substrato folhiço, enquanto para a riqueza de ambas as categorias este padrão não foi observado.
A importância do substrato na estruturação das comunidades de insetos aquáticos é algo bem reportado em outros trabalhos (Fidelis et al., 2008Fidelis, L.; Nessimian, J. L. & Hamada, N. 2008. Distribuição espacial de insetos aquáticos em igarapés de pequena ordem na Amazônia Central. Acta Amazonica 38(1):127-134. ; Milesi et al., 2016Milesi, S.V.; Dolédec, S. & Melo, A.S. 2016. Substrate heterogeneity influences the trait composition of stream insect communities: an experimental in situ study. Freshwater Science 35(4): 1321-1329.). Portanto, a Teoria Hierárquica de Manchas parece funcionar melhor em córregos tropicais do que a Teoria do Rio Contínuo, ao explicar a diversidade de presas e predadores da fauna de EPTOH em riachos de cabeceiras. Esses resultados são condizentes com as observações de Oliveira & Nessimian (2010Oliveira, A. L. H. & Nessimian, J. L. 2010. Spatial distribution and functional feeding groups of aquatic insect communities in Serra da Bocaina streams, southeastern Brazil. Acta Limnologica Brasiliensia 22(4):424-441.), Shimano et al., (2012Shimano, Y.; Salles, F. F.; Faria, L. R. R.; Cabette, H. S. R. & Nogueira, D. S. 2012. Distribuição espacial das guildas tróficas e estruturação da comunidade de Ephemeroptera (Insecta) em córregos do Cerrado de Mato Grosso, Brasil. Iheringia, Série Zoologia 102(2):187-196.) e Baptista et al., (2014Baptista, V. A; Antunes, M. B.; Martello, A. R.; Figueiredo, N. S. B.; Amaral, A. M. B.; Secretti, E. & Braun, B. 2014. Influência de fatores ambientais na distribuição de famílias de insetos aquáticos em rios no sul do Brasil. Ambiente & Sociedade 17(3):155-176.), onde os tipos de substratos são preditores da abundância e riqueza de macroinvertebrados bentônicos (incluindo presas e predadores), pois influenciam a estrutura dos habitats, podendo determinar a ocorrência e a diversidade das espécies. O modelo hierárquico de manchas também explicou a distribuição de grupos de alimentação funcionais em ambientes lóticos menores (cachoeiras) (Brasil et al., 2014Brasil, L. S.; Juen, L.; Batista, J. D.; Pavan, M. G. & Cabette, H. S. R. 2014. Longitudinal Distribution of the Functional Feeding Groups of Aquatic Insects in Streams of the Brazilian Cerrado Savanna. Neotropical Entomology 43(5):421-428.).
A maior abundância de presas nos folhiços, especialmente de remanso, é devido à maior quantidade de material orgânico disponível (folhas e gravetos alóctones, leveduras e bactérias aderidas, etc), essa alta disponibilidade de nutrientes possibilita também o compartilhamento de nichos (Winegardner et al., 2012Winegardner, A. K.; Jones, B. K.; Siqueira, T. & Cottenie, K. 2012. The terminology of metacommunity ecology. Trends Ecology Evolution 27(5):3-4.; Shimano et al., 2012Shimano, Y.; Salles, F. F.; Faria, L. R. R.; Cabette, H. S. R. & Nogueira, D. S. 2012. Distribuição espacial das guildas tróficas e estruturação da comunidade de Ephemeroptera (Insecta) em córregos do Cerrado de Mato Grosso, Brasil. Iheringia, Série Zoologia 102(2):187-196.) e o material orgânico depositado é abrigo para a maioria dos insetos aquáticos (Rezende, 2007Rezende, C. F. 2007. Estrutura da comunidade de macroinvertebrados associados ao folhiço submerso de remanso e correnteza em igarapés da Amazônia Central. Biota Neotropica 7(2):301-305.). A maior abundância de predador em folhiço de corredeira pode ser devido às adaptações morfológicas presentes em vários táxons (e.g. garras modificadas, corpos achatados), que permitem viver em ambientes com fluxos de água rápidos e bem oxigenados (Giller & Malmqvist, 1998Giller, P. I. & Malmqvist, B. 1998. The Biology of Streams and Rivers. Oxford, Oxford University Press. 296p.; Ruegg & Robinson, 2004Ruegg, J. & Robinson, C. T. 2004. Comparison of macroinvertebrate assemblages of permanent and temporary streams in an Alpine flood plain, Switzerland. Archiv für Hydrobiologie 161(4):489-510.; Roque et al., 2008Roque, F. O.; Lecci, L. S.; Siqueira, T. & Froehlich, C. G. 2008. Using environmental and spatial filters to explain stonefly occurrences in southeastern Brazilian streams: implications for biomonitoring. Acta Limnologica Brasiliensis 20(1):35-44.). Entre os grupos com adaptações, por exemplo, a ambientes bem oxigenados, registramos alta abundância de Anacroneuria Klapálek, 1909 em substrato de folhiço de corredeira (n=326) e baixa abundância em folhiço de remanso (n=3).
A maior abundância e menor riqueza de presas na nascente podem estar relacionada à elevada abundância de Leptophlebiidae (Fonseca & Hart, 1996Fonseca, D. M. & Hart, D. D. 1996. Density-dependent dispersal of black fly neonates is mediated by flow. Oikos 75(1):49-58.; Leung et al., 2009Leung, E. S.; Rosenfeld, J. S. & Bernhardt, J. R. 2009. Habitat effects on invertebrate drift in a small trout stream: implications for prey availability to drift-feeding fish. Hydrobiologia 623(1):113-125.). Em riachos de Cerrado essa família é estruturada por condições ambientais e elevada abundância do gênero Miroculis (Brasil et al., 2014Brasil, L. S.; Juen, L.; Batista, J. D.; Pavan, M. G. & Cabette, H. S. R. 2014. Longitudinal Distribution of the Functional Feeding Groups of Aquatic Insects in Streams of the Brazilian Cerrado Savanna. Neotropical Entomology 43(5):421-428.a). A similaridade da abundância de predador entre os ambientes condiz com a Teoria do Rio Contínuo que indica que a biomassa de predadores não se altera com a mudança de ordens nos córregos (Vannote et al., 1980Vannote, R. L.; Minshall, G. W.; Cummins, K. W.; Sedell, J. R. & Cushing, C. E. 1980. The river continuum concept. Canadian Journal of Fisheries and Aquatic Science 37(1):130-137.). No entanto, os ambientes analisados são de 1ª a 3ª ordem de fluxo, apresentando baixa variação nas características físicas, por exemplo, na largura. Entretanto, houve maior riqueza de predadores na porção intermediária, o que atribuímos à conservação desta porção, sendo a mais preservada entre os ambientes analisados. Portanto, ambientes com vegetação ciliar conservada são eficazes na preservação da integridade ecológica e dinâmica trófica dos ecossistemas aquáticos (Ferreira et al., 2017Ferreira, W.R., Hepp, L.U., Ligeiro, R., Macedo, D.R., Hughes, R.M., Kaufmann, P.R. & Callisto, M. 2017. Partitioning taxonomic diversity of aquatic insect assemblages and functional feeding groups in neotropical savanna headwater streams. Ecological Indicators 72, 365-373.) e consequentemente da alta diversidade (Milesi et al., 2016Milesi, S.V.; Dolédec, S. & Melo, A.S. 2016. Substrate heterogeneity influences the trait composition of stream insect communities: an experimental in situ study. Freshwater Science 35(4): 1321-1329.).
Quanto à riqueza, evidencia-se que a dispersão das presas e predadores é melhor influenciada pelo tipo de substrato, do que pelo ambiente longitudinal. Portanto, isso ocorre devido à relação com a qualidade do substrato ocupado, tipo de recurso alimentar, abrigo para presas, além de abrigo e forrageamento para predadores (Baptista, 2001Baptista, D. F.; Buss, D. F.; Drovillé, L. F. M. & Nessimian, J. L. 2001. Diversity and habitat preference of aquatic insects along the longitudinal gradient of the Macaé river basin, Rio de Janeiro, Brazil. Revista Brasileira de Biologia 61(2):249-258. ; Fidelis et al., 2008Fidelis, L.; Nessimian, J. L. & Hamada, N. 2008. Distribuição espacial de insetos aquáticos em igarapés de pequena ordem na Amazônia Central. Acta Amazonica 38(1):127-134. ; Hay et al., 2008Hay, C. H.; Franti, T. G.; Marx, D. B.; Peters, E. J. & Hesse, L. W. 2008. Macroinvertebrate drift density in relation to abiotic factors in the Missouri River. Hydrobiologia 598(1):175-189. ). Entre os substratos, areia apresentou menores valores de riqueza, o que é atribuído à baixa oferta de alimento e baixa complexidade estrutural, resultando em poucas presas (Baptista et al., 2001Baptista, D. F.; Buss, D. F.; Drovillé, L. F. M. & Nessimian, J. L. 2001. Diversity and habitat preference of aquatic insects along the longitudinal gradient of the Macaé river basin, Rio de Janeiro, Brazil. Revista Brasileira de Biologia 61(2):249-258. ; Shimano et al., 2012Shimano, Y.; Salles, F. F.; Faria, L. R. R.; Cabette, H. S. R. & Nogueira, D. S. 2012. Distribuição espacial das guildas tróficas e estruturação da comunidade de Ephemeroptera (Insecta) em córregos do Cerrado de Mato Grosso, Brasil. Iheringia, Série Zoologia 102(2):187-196.). Esses resultados são condizentes com a literatura, pois em geral os substratos inorgânicos são mais pobres (e.g. Brasil et al., 2017Brasil, L. S.; Giehl, N. F. S.; Batista, J. D.; Resende, B. O. & Cabette, H. S. R. 2017. Aquatic insects in organic and inorganic habitats in the streams on the Central Brazilian savana. Revista Colombiana de Entomología 43(2): 286-291.). A alta riqueza de predadores no substrato raiz se deve à disponibilização de microhabitats resultantes do emaranhado de suas ramificações, tais como raízes marginais (Townsend et al., 2010Townsend, C. R.; Begon, M. & Harper, J. L. 2010. Fundamentos em ecologia. Porto Alegre, Artmed. 576p.; Dias-Silva et al., 2013Dias-Silva, K.; Cabette, H. S. R.; Giehl, N. F. S. & Juen, L. 2013. Distribuição de Heteroptera Aquáticos (Insecta) em Diferentes Tipos de Substratos de Córregos do Cerrado Matogrossense. EntomoBrasilis 6(2):132-140. ) que são refúgios importantes contra o carreamento dos organismos durante os períodos de aumento de vazão e de camuflagem para predadores de tocaia.
A composição de presas e predadores também esteve relacionada com o tipo dos substratos, similar ao encontrado em estudos com grupos tróficos de córregos (Fidelis et al., 2008Fidelis, L.; Nessimian, J. L. & Hamada, N. 2008. Distribuição espacial de insetos aquáticos em igarapés de pequena ordem na Amazônia Central. Acta Amazonica 38(1):127-134. ; Shimano et al., 2012Shimano, Y.; Salles, F. F.; Faria, L. R. R.; Cabette, H. S. R. & Nogueira, D. S. 2012. Distribuição espacial das guildas tróficas e estruturação da comunidade de Ephemeroptera (Insecta) em córregos do Cerrado de Mato Grosso, Brasil. Iheringia, Série Zoologia 102(2):187-196.; Pes, 2012Pes, A. 2012. Ordem Trichoptera. In: Hamada, N. & Ferreira-Keppler, R. L. eds. Guia ilustrado de insetos aquáticos e semiaquáticos da Reserva Florestal Ducke, Manaus, Amazonas, Brasil. Manaus, Editora da Universidade Federal do Amazonas . p. 37-54. ). Apesar das presas mostrarem ampla distribuição, nos ambientes lóticos, alguns gêneros podem apresentar preferência por substratos específicos, esse fato pode ser resultado da interação de requisitos de alguns organismos (Minshal, 1984Minshall, G. W. 1984. Aquatic insect substratum relationships. In: Resh, V.H. & Rosenberg, D.M. eds. The Ecology of Aquatic Insects. Nova York, Praeger. p. 358-400.). Os gêneros de Ephemeroptera, Campsurus Eaton, 1868, Campylocia Needham & Murphy, 1924 e de Trichoptera, Triplectides Kolenati, 1859, Leptonema Guérin 1843, Smicridea McLachlan, 1871, Phylloicus Müller, 1880, Protoptila Banks, 1904 e Chimarra Stephens, 1829, apresentam preferência por folhiço de remanso (Fidelis et al., 2008Fidelis, L.; Nessimian, J. L. & Hamada, N. 2008. Distribuição espacial de insetos aquáticos em igarapés de pequena ordem na Amazônia Central. Acta Amazonica 38(1):127-134. ). Isso implica que a homogeneização dos ambientes com retirada de mata ciliar, devido à diminuição de entrada de material alóctone, tais como folhas e troncos (que propiciam os ambientes de remanso) resultará na redução da abundância e consequente desaparecimento destes organismos nos ambientes aquáticos.
Dentre os grupos de predadores, larvas de Odonata podem ser encontradas em vários tipos de ambiente, porém alguns gêneros apresentam preferências específicas aos substratos, por exemplo, Progomphus e Aplhylla Selys, 1854 da família Gomphidae, observada associada a substratos arenosos, onde se enterram (Carvalho & Nessimian, 1998Carvalho, A. L. & Nessimian, J. L. 1998. Odonata do Estado do Rio de Janeiro, Brasil: Hábitats e hábitos das larvas. In: Nessimian, J. L. & A. L. Carvalho eds.. Ecologia de Insetos Aquáticos Oecologia Brasiliensis 5(1):3-28.). Além disso, Aplhylla apresenta o último segmento abdominal alongado funcionando como sifão respiratório (Merritt et al., 2008Merritt, R. W.; Cummins, K. W. & Berg, M. B. 2008. An introduction to the aquatic insects of North America. Dubuque, Kendall Hunt Publishing Company. 1158p.). Por outro lado, entre os heterópteros há gêneros generalistas, como Ambrysus Stal, 1862, que pode estar presente nos substratos de raiz, folhiço de remanso e corredeira, e alguns com preferência por substratos específicos, como Stridulivelia Hungerford, 1929 associados à raiz (Dias-Silva et al., 2013Dias-Silva, K.; Cabette, H. S. R.; Giehl, N. F. S. & Juen, L. 2013. Distribuição de Heteroptera Aquáticos (Insecta) em Diferentes Tipos de Substratos de Córregos do Cerrado Matogrossense. EntomoBrasilis 6(2):132-140. ). Ademais, entre os Plecoptera o gênero Anacroneuria Klapálek, 1909 apresenta preferência por folhiço de corredeira bem oxigenados. Isso reforça a importância de conservar os ambientes com maior complexidade ambiental que favorece a maior diversidade.
A natureza do substrato está entre os maiores determinantes da biota aquática (Gaines et al., 1989Gaines, W. L.; Cushing, C. E. & Smith, S. D. 1989. Trophic relations and functional group composition of benthic insects in three cold desert streams. Southwestern Naturalist 34(4):478-482.). Modificações das características naturais dos córregos, como a retirada da vegetação ciliar pode influenciar diretamente a composição dos substratos do leito, ocorrendo, por exemplo, aumento da presença de sedimento arenoso e pouca liteira (Silva et al., 2015Silva, M. V. D.; Rosa, B. F. J. V. & Alves, R. G. 2015. Effect of mesohabitats on responses of invertebrate community structure in streams under different land uses. Environmental Monitoring and Assessment 187(11):714. ). Assim, essas alterações podem causar a diminuição da diversidade de presa e predadores, modificando a estrutura da composição desses organismos. Além disso, a perturbação humana causou redução da diversidade funcional nas assembleias de EPT e aumentou sua homogeneização funcional em córregos de Cerrado (Castro et al., 2018Castro, D.M.P, Dolédec, S. & Callisto, M. 2018. Land cover disturbance homogenizes aquatic insect functional structure in neotropical savanna streams. Ecological Indicators 84:573-582.). Esses resultados evidenciam a importância da diversidade de substratos no canal para manutenção de diversidade de presas e predadores garantindo os serviços ecossistêmicos (e.g. ciclagem de nutrientes e controle biológico) providos por estes organismos nos ambientes aquáticos, o que reforça a importância de se manter a vegetação ciliar no entorno dos córregos.
Agradecimentos
Ao FIDIPEX /UNEMAT pelo fomento da pesquisa, PROCAD (#109/2007) e PELD/CNPq (#403725/2012-7) pela manutenção do Laboratório de Entomologia e pelo apoio aos orientadores vinculados ao programa de Pós-Graduação em Ecologia e Conservação durante o desenvolvimento deste trabalho. Ao laboratório de Entomologia da Universidade do Estado de Mato Grosso-UNEMAT pelo apoio institucional e acadêmico, e equipe pelas coletas de dados. Ao técnico de laboratório Lourivaldo A. Castro pelo suporte de campo. Ao M.Sc. Handerson, B. Castro e biólogo Donizete Genevro pela contribuição na identificação dos gêneros de Odonata e Ephemeroptera. A CAPES pela concessão de bolsa de doutorado à N.F.S. Giehl e bolsa de mestrado à B.O. Resende e P.F.S.S. Roges.
REFERÊNCIAS BIBLIOGRÁFICAS
- Baptista, D. F.; Buss, D. F. L.; Dias, G.; Nessimian, J. L.; Silva, E. R.; Moraes, A. H. A.; Carvalho, N. S. N.; Oliveira, M. A. & Andrade, L. R. 2006. Functional feeding groups of Brazilian Ephemeroptera nymphs: ultrastructure of mouthparts. Annales de Limnologie 429(2):87-96.
- Baptista, D. F.; Buss, D. F.; Drovillé, L. F. M. & Nessimian, J. L. 2001. Diversity and habitat preference of aquatic insects along the longitudinal gradient of the Macaé river basin, Rio de Janeiro, Brazil. Revista Brasileira de Biologia 61(2):249-258.
- Baptista, V. A; Antunes, M. B.; Martello, A. R.; Figueiredo, N. S. B.; Amaral, A. M. B.; Secretti, E. & Braun, B. 2014. Influência de fatores ambientais na distribuição de famílias de insetos aquáticos em rios no sul do Brasil. Ambiente & Sociedade 17(3):155-176.
- Brasil, L. S.; Juen, L.; Batista, J. D.; Pavan, M. G. & Cabette, H. S. R. 2014. Longitudinal Distribution of the Functional Feeding Groups of Aquatic Insects in Streams of the Brazilian Cerrado Savanna. Neotropical Entomology 43(5):421-428.
- Brasil, L. S.; Juen, L. & Cabette, H. S. R. 2014a. The effects of environmental integrity on the diversity of mayflies, Leptophlebiidae (Ephemeroptera), in tropical streams of the Brazilian Cerrado. Annales de Limnologie 50(4): 325-334.
- Brasil, L. S.; Giehl, N. F. S.; Batista, J. D.; Resende, B. O. & Cabette, H. S. R. 2017. Aquatic insects in organic and inorganic habitats in the streams on the Central Brazilian savana. Revista Colombiana de Entomología 43(2): 286-291.
- Calvão, L. B.; Juen, L.; Oliveira-Junior, J.M.B. Batista, J.D & De Marco JR, P. 2018. Land use modifies Odonata diversity in streams of the Brazilian Cerrado. Journal of Insect Conservation. Doi: 10.1007/s10841-018-0093-5
» https://doi.org/10.1007/s10841-018-0093-5 - Carvalho, A. L. & Nessimian, J. L. 1998. Odonata do Estado do Rio de Janeiro, Brasil: Hábitats e hábitos das larvas. In: Nessimian, J. L. & A. L. Carvalho eds.. Ecologia de Insetos Aquáticos Oecologia Brasiliensis 5(1):3-28.
- Castro, D.M.P, Dolédec, S. & Callisto, M. 2018. Land cover disturbance homogenizes aquatic insect functional structure in neotropical savanna streams. Ecological Indicators 84:573-582.
- Crawley, M. J. 2007. The R Book. Chichester, John Wiley & Sons Ltd. p. 942.
- Cummins, K. W.; Merritt, R. W. & Rade, P. C. 2005. The use of invertebrate functional groups to characterize ecosystem attributes in selected streams and rivers in southeast Brazil. Studies on Neotropical Fauna and Environmental 40(1):71-90.
- Dias-Silva, K.; Cabette, H. S. R.; Giehl, N. F. S. & Juen, L. 2013. Distribuição de Heteroptera Aquáticos (Insecta) em Diferentes Tipos de Substratos de Córregos do Cerrado Matogrossense. EntomoBrasilis 6(2):132-140.
- Dias-Silva, K.; Cabette, H.S.R.; Juen, L. & De Marco Jr, P. 2010. The influence of habitat integrity and physical-chemical water variables on the structure of aquatic and semi-aquatic Heteroptera. Zoologia 27(6):918-930.
- Ferreira, W.R., Hepp, L.U., Ligeiro, R., Macedo, D.R., Hughes, R.M., Kaufmann, P.R. & Callisto, M. 2017. Partitioning taxonomic diversity of aquatic insect assemblages and functional feeding groups in neotropical savanna headwater streams. Ecological Indicators 72, 365-373.
- Fidelis, L.; Nessimian, J. L. & Hamada, N. 2008. Distribuição espacial de insetos aquáticos em igarapés de pequena ordem na Amazônia Central. Acta Amazonica 38(1):127-134.
- Fonseca, D. M. & Hart, D. D. 1996. Density-dependent dispersal of black fly neonates is mediated by flow. Oikos 75(1):49-58.
- Gaines, W. L.; Cushing, C. E. & Smith, S. D. 1989. Trophic relations and functional group composition of benthic insects in three cold desert streams. Southwestern Naturalist 34(4):478-482.
- Giller, P. I. & Malmqvist, B. 1998. The Biology of Streams and Rivers. Oxford, Oxford University Press. 296p.
- Hay, C. H.; Franti, T. G.; Marx, D. B.; Peters, E. J. & Hesse, L. W. 2008. Macroinvertebrate drift density in relation to abiotic factors in the Missouri River. Hydrobiologia 598(1):175-189.
- Hepp, L. U. & Melo, A. S. 2013. Dissimilarity of stream insect assemblages: effects of multiple scales and spatial distances. Hydrobiologia 703(1):239-246.
- INMET - Instituto Nacional de Meteorologia, Brasil. 2016. Estação Metereológica 83319. Brasília: Disponível em <Disponível em http://www.inmet.gov.br/html/clima.php >. Acessado em 11 de novembro de 2016.
» http://www.inmet.gov.br/html/clima.php - Legendre, P. & Legendre, L. 2012. Numerical Ecology. Amsterdam, The Netherlands: Elsevier Science BV. 853p.
- Leung, E. S.; Rosenfeld, J. S. & Bernhardt, J. R. 2009. Habitat effects on invertebrate drift in a small trout stream: implications for prey availability to drift-feeding fish. Hydrobiologia 623(1):113-125.
- Merritt, R. W.; Cummins, K. W. & Berg, M. B. 2008. An introduction to the aquatic insects of North America. Dubuque, Kendall Hunt Publishing Company. 1158p.
- Milesi, S.V.; Dolédec, S. & Melo, A.S. 2016. Substrate heterogeneity influences the trait composition of stream insect communities: an experimental in situ study. Freshwater Science 35(4): 1321-1329.
- Minshall, G. W. 1984. Aquatic insect substratum relationships. In: Resh, V.H. & Rosenberg, D.M. eds. The Ecology of Aquatic Insects. Nova York, Praeger. p. 358-400.
- Neiss , U.G. & Hamada, N. 2014. Ordem Odonata. In: Hamada, N.; Nessimian, J.G. & Querino, R.B. eds. Insetos aquáticos na Amazônia brasileira: taxonomia, biologia e ecologia. Manaus, Editora da Universidade Federal do Amazonas. p. 217-284.
- Oliveira, A. L. H. & Nessimian, J. L. 2010. Spatial distribution and functional feeding groups of aquatic insect communities in Serra da Bocaina streams, southeastern Brazil. Acta Limnologica Brasiliensia 22(4):424-441.
- Peel, M. C.; Finlayson, B. L. & Mcmahon, T. A. 2007. Updated world map of the Köppen-Geiger climate classification. Hydrology and Earth System Sciences 11(1):1633-1644.
- Pes, A. 2012. Ordem Trichoptera. In: Hamada, N. & Ferreira-Keppler, R. L. eds. Guia ilustrado de insetos aquáticos e semiaquáticos da Reserva Florestal Ducke, Manaus, Amazonas, Brasil. Manaus, Editora da Universidade Federal do Amazonas . p. 37-54.
- R Core Team. 2016. R: A Language and Environment for Statistical Computing. Vienna, R Foundation for Statistical Computing.
- Rezende, C. F. 2007. Estrutura da comunidade de macroinvertebrados associados ao folhiço submerso de remanso e correnteza em igarapés da Amazônia Central. Biota Neotropica 7(2):301-305.
- Roque, F. O.; Lecci, L. S.; Siqueira, T. & Froehlich, C. G. 2008. Using environmental and spatial filters to explain stonefly occurrences in southeastern Brazilian streams: implications for biomonitoring. Acta Limnologica Brasiliensis 20(1):35-44.
- Ruegg, J. & Robinson, C. T. 2004. Comparison of macroinvertebrate assemblages of permanent and temporary streams in an Alpine flood plain, Switzerland. Archiv für Hydrobiologie 161(4):489-510.
- Santos, I. G. A. & Rodrigues, G. G. 2015. Colonização de macroinvertebrados bentônicos em detritos foliares em um córrego de primeira ordem na Floresta Atlântica do nordeste brasileiro. Iheringia, Série Zoologia 105(1):84-93.
- Shimano, Y.; Salles, F. F.; Faria, L. R. R.; Cabette, H. S. R. & Nogueira, D. S. 2012. Distribuição espacial das guildas tróficas e estruturação da comunidade de Ephemeroptera (Insecta) em córregos do Cerrado de Mato Grosso, Brasil. Iheringia, Série Zoologia 102(2):187-196.
- Silva, M. V. D.; Rosa, B. F. J. V. & Alves, R. G. 2015. Effect of mesohabitats on responses of invertebrate community structure in streams under different land uses. Environmental Monitoring and Assessment 187(11):714.
- Strahler, H. N. 1957. Quantitative analysis of watershed geomorphology. American Geophysical Union Transactions, 38(6):913-920.
- Thorp, J. H.; Thoms, M. C. & Delong, M. D. 2006. The riverine ecosystem synthesis: biocomplexity in river networks across space and time. River Research and Applications 147(2):123-147.
- Townsend, C. R.; Begon, M. & Harper, J. L. 2010. Fundamentos em ecologia. Porto Alegre, Artmed. 576p.
- Vannote, R. L.; Minshall, G. W.; Cummins, K. W.; Sedell, J. R. & Cushing, C. E. 1980. The river continuum concept. Canadian Journal of Fisheries and Aquatic Science 37(1):130-137.
- Winegardner, A. K.; Jones, B. K.; Siqueira, T. & Cottenie, K. 2012. The terminology of metacommunity ecology. Trends Ecology Evolution 27(5):3-4.
Apêndice 1
.Ocorrência dos gêneros ou morfoespécies de insetos aquáticos presa ou predador (Pred) nos substratos (A, areia; C, cascalho; FC, folhiço de corredeira; FR, folhiço de remanso; P, pedra; R, raiz) e nos ambientes (N, Nascente; I, Intermediário; F, foz). (a numeração das espécies/morfoespécies seguem o padrão anotado na CZNX)
Apêndice 2
.Apêndice 3
.Publication Dates
-
Publication in this collection
06 Dec 2018 -
Date of issue
2018
History
-
Received
06 Dec 2017 -
Accepted
12 Nov 2018