Resumos
Chaves de identificação de larvas aos níveis de família e gênero de Trichoptera da Amazônia Central são apresentadas.
Amazônia Central; insetos aquáticos; larvas; taxonomia; Trichoptera
Keys for identification of larvae to families and genera of Trichoptera of Central Amazonia are presented.
Aquatic Insects; Central Amazonian; larvae; taxonomy; Trichoptera
SISTEMÁTICA, MORFOLOGIA E BIOGEOGRAFIA
Chaves de identificação de larvas para famílias e gêneros de Trichoptera (Insecta) da Amazônia Central, Brasil
Identification key to families and genera of larvae of Trichoptera from Central Amazonia, Brazil
Ana Maria Oliveira PesI; Neusa HamadaII; Jorge Luiz NessimianIII
IDivisão de Curso em Entomologia, Instituto Nacional de Pesquisas da Amazônia, Caixa Postal 478, 69011-970 Manaus-AM, Brasil. pesanamaria@yahoo.com.br
IICoordenação de Pesquisas em Entomologia, Instituto Nacional de Pesquisas da Amazônia, Caixa Postal 478, 69011-970 Manaus-AM, Brasil. nhamada@inpa.gov.br
IIILaboratório de Entomologia, Departamento de Zoologia, Instituto de Biologia, Universidade Federal do Rio de Janeiro, Caixa Postal 68044, 21944-970 Rio de Janeiro-RJ, Brasil. nessimia@acd.ufrj.br
RESUMO
Chaves de identificação de larvas aos níveis de família e gênero de Trichoptera da Amazônia Central são apresentadas.
Palavras-chave: Amazônia Central; insetos aquáticos; larvas; taxonomia; Trichoptera.
ABSTRACT
Keys for identification of larvae to families and genera of Trichoptera of Central Amazonia are presented.
Keywords: Aquatic Insects; Central Amazonian; larvae; taxonomy; Trichoptera.
Os Trichoptera surgiram no Triássico e compartilham um ancestral comum com Lepidoptera (Resh & Solem 1996). Larvas apresentam cabeça esclerotinizada, antenas muito curtas, mandíbulas bem desenvolvidas, palpos maxilares reduzidos, tórax com o pronoto esclerotinizado, meso e metanoto com esclerotinização variável ou ausente. O abdome, membranoso, pode apresentar brânquias e o segmento IX tem um par de falsas pernas anais providas de garras (Angrisano 1998). Vivem em ambientes dulcícolas lóticos e lênticos, raras espécies são marinhas (Flint et al. 1999). Produzem seda que é usada na construção de casas, abrigos ou redes para retenção de partículas alimentares. Alguns grupos só constroem casa no último estádio larval (Angrisano 1998; Wiggins 1996).
Foram registradas 130 espécies de Trichoptera para a região norte, sendo 106 no estado do Amazonas e 53 em áreas próximas à Manaus (Flint et al. 1999; Prather 2003). Esses números indicam grande riqueza de espécies na região, pois estes trabalhos foram baseados em coletas esporádicas.
Trabalhos com descrições de Trichoptera da região amazônica foram realizados por Ulmer (1905, 1906) Martynov (1912), Sattler (1963a, b), Flint (1971, 1978, 1991), Sattler & Sykora (1977). Outros trabalhos taxonômicos, com descrição de larvas e adultos foram realizados em países vizinhos como: Venezuela, Equador (Botosaneanu & Flint 1982), Peru (Flint 1996; Flint & Reyes 1991), Suriname (Flint 1974) e Colômbia (Flint 1981; Flint & Bueno-soria 1982).
A maioria das espécies da região amazônica foi descrita no estágio adulto, os imaturos e sua biologia são quase que desconhecidos e as chaves de identificação disponíveis, principalmente, para larvas são da região neártica e da Argentina (Angrisano 1995; Wiggins 1996).
Este trabalho tem por objetivo fornecer chaves de identificação de famílias e gêneros de larvas de último estádio dos Trichoptera coletados em três municípios da Amazônia Central, contribuindo para o conhecimento taxonômico do grupo.
Como muitas larvas de Trichoptera são sensíveis a alterações ambientais em cursos d'água e esta resposta é especifica a identificação mesmo que genérica é imprescindível. Esta chave será um instrumento para auxiliar na identificação desses insetos em trabalhos de ecologia e avaliação de impacto ambiental.
MATERIAL E MÉTODOS
As larvas de Trichoptera foram coletadas em igarapés do município de Presidente Figueiredo (01º59'S/60º01'W), localizado a 100 km ao norte de Manaus, no período de fevereiro 2000 a janeiro de 2002; em abril-maio de 2001 nos igarapés da Reserva Florestal Adolpho Ducke (02º53'S/59º58'W) a 26 km de Manaus e setembro de 2001, nos igarapés do Projeto Dinâmica Biológica de Fragmentos Florestais (PDBFF), nos municípios de Manaus (Fazenda Dimona: 02º19'S/60º04'W) e Rio Preto da Eva (Reserva do km 41 - ZF2: 02º26'S/59º46'W).
As larvas foram examinadas sob estereomicroscópio e desenhadas com auxílio de câmara lúcida. Larvas pequenas foram dissecadas e algumas clarificadas para permitir observar estruturas como antenas, pernas e cerdas. Estas foram colocadas em lâminas escavadas com uma gota de glicerina para observação sob microscópio óptico e posteriormente montadas em lâminas permanentes utilizando Euparal®, como meio de montagem.
Para a identificação das famílias e gêneros foram utilizados, principalmente, os trabalhos de Angrisano (1995), Flint (1963, 1983), Flint & Harris (1992), Flint et al. (1994), Flint & Wallace (1980), Guahyba, (1991), Holzenthal (1995), Holzenthal & Pes, (2004), Marlier (1964), Pes & Hamada (2003, 2004), Roback (1966), Sattler (1963a, b) e Wiggins (1996). Quando necessário a identificação dos gêneros foi realizada por meio da associação das larvas com os adultos farados.
As larvas estão depositadas na Coleção de Invertebrados do Instituto Nacional de Pesquisas da Amazônia (INPA), Manaus, AM.
As figuras foram dispostas por ordem alfabética de famílias e gêneros. Gêneros citados como sp. 1, sp. 2, correspondem a larvas morfotipadas por PES (2001).
RESULTADOS
Foram identificados 13 famílias e 33 gêneros na área de estudo (em Leptoceridae e Sericostomatidae dois gêneros foram morfotipados, pois não foi possível a identificação).
Chave de identificação para larvas de último estádio de famílias e gêneros de Trichoptera da Amazônia Central (adaptada de Wiggins 1996).
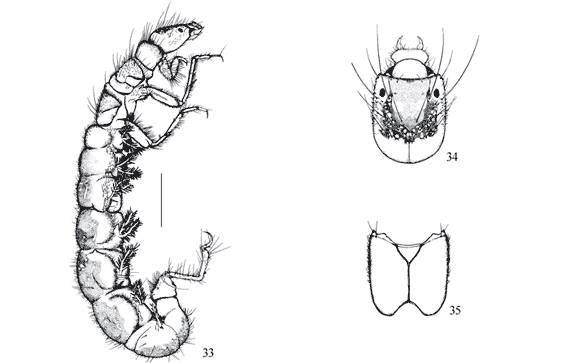
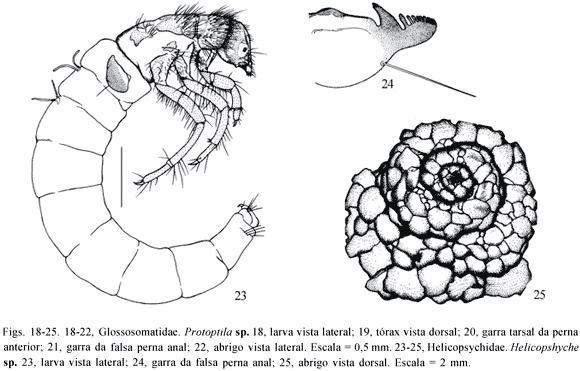
Larva com abrigo móvel de areia em forma de caracol (Fig. 25); abdome encurvado (Fig. 23); garra da falsa perna anal em forma de pente (Fig. 24) .................................. Helicopsyche Sielbold - Helicopsychidae
Larva com abrigo ausente ou de outra forma; abdome não encurvado; garra da falsa perna anal não como acima .............................................................................. 2
Somente o pronoto com placa inteira esclerotinizada, meta e mesonoto membranosos (Figs. 26, 28, 134, 135, 138 , 147, 151, 152, 162 , 163 ) ou com placas subdivididas (Figs. 2, 8, 13 , 19 , 104, 107, 110 , 111 , 115, 119 , 125, 130 , 159 ) ................................................ 5
Abdome com brânquias ventro-laterais; garra da falsa perna anal com tufo de cerdas longas (Figs. 29, 33, 36 , 41, 47 ) ........................................... Hydropsychidae
Abdome sem brânquias (Figs. 5, 62 , 74, 82, 89 ); garra da falsa perna anal sem tufo de cerdas longas ........ 4
Larvas com cerca de 15 mm de comprimento (Fig. 5); trocatim longo, mais longo que a coxa da perna anterior, em forma de canaleta, protegendo a coxa (Fig. 6) ............... Austrotinodes Schmid Ecnomidae
Larvas pequenas, no máximo com 3 mm de comprimento (Figs. 50-103); trocantim geralmente truncado ou pontiagudo, nunca como acima .......... Hydroptilidae
Mesonoto recoberto por placas esclerotinizadas recobrindo mais da metade do noto (Figs. 2, 107, 111 , 115, 119 , 125, 130 , 159 ) .............................................. 10
Mesonoto sem placas esclerotinizadas (Figs. 28, 135, 138 , 147, 152, 163 ), ou com pequenos escleritos cobrindo não mais do que a metade do noto (Figs. 8, 13 , 19 ) ........................................................................... 6
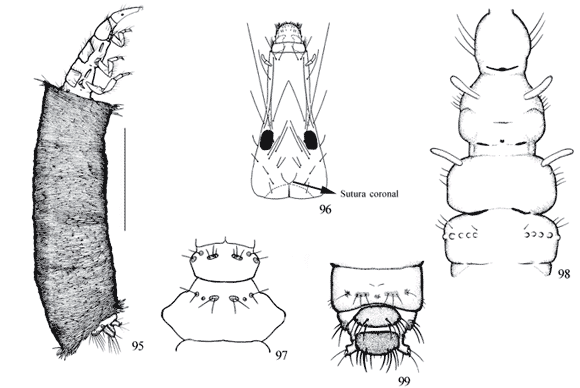
Segmento abdominal IX com uma placa esclerotinizada na região dorsal (Figs. 7, 14 , 18 , 27) .......................... 7
Segmento abdominal IX sem placa esclerotinizada na região dorsal (Figs. 141 , 153) ..................................... 8
Porção basal das falsas pernas anais livre; garra da falsa perna anal longa (Fig. 26); garra do primeiro par de pernas em forma de pinça (Fig. 26); larva de vida livre sem abrigo.... Atopsyche Banks Hydrobiosidae
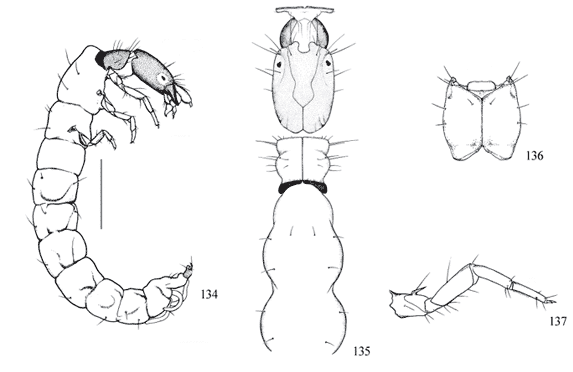
Porção basal das falsas pernas anais unidas ao segmento IX (Fig. 14 ); garra da falsa perna anal curta, unida ao abdome; abrigo de grãos de areia com duas aberturas ventrais, com formato semelhante a casco de tartaruga (Figs. 11, 17 , 22 ) .......... Glossosomatidae
Labro membranoso arredondado .................................. 9
Tíbia e tarso fundidos em todas as pernas; mesopleura expandida anteriormente formando um processo lobado (Figs. 162 , 163 ); palpo labial em forma de tubo afunilado (Figs. 163 , 164 ); abrigo longo e estreito, constituído de seda, areia e sedimento (Fig.165 ) ...................................................... Machairocentron Schmid e Xiphocentron Brauer Xiphocentronidae
Tíbia e tarso não fundidos; mesopleura não modificada como acima (Figs. 146, 151), palpo labial normal; abrigo, quando presente, de outra forma ...................................................................... Polycentropodidae
Antenas curtas, não mais que 3 vezes a largura, ou não aparentes .................................................................... 11
Labro com no máximo 8 cerdas (Figs. 130 , 157 ), pronoto sem projeção como acima; abrigo de outra forma .. 12
Trocantim muito pequeno, pouco visível; regiões ventro-lateral e dorsal dos segmentos abdominais II-IX, com muitos filamentos branquiais ramificados na base (Fig. 129 ); abrigo de areia, recurvado e resistente (Fig. 133 ) . Marilia Müller Odontoceridae
Trocantim visível, em forma de gancho, região ventro-lateral dos segmentos abdominais I- IV com brânquias finas e de difícil visualização, não ramificados na base (Fig. 156 ); abrigo de areia, recurvado e frágil (Fig. 161 ) ................................ gênero A Sericostomatidae
Chave de identificação para larvas de último estádio para os gêneros de Glossosomatidae
Garra da falsa perna anal composta por 1 processo e 2 pares de garras acessórias (Fig. 15 ), garras tarsais com cerda articulada longa e grossa (Fig. 16 ) .............. ......................................................... Mortoniella Ulmer
Garra da falsa perna anal composta de 1 processo e 3 ou 4 pares de garras acessórias (Figs. 10, 21 ), cerda das garras tarsais não como acima ............................ 2
Garra da falsa perna anal com 1 processo e 4 pares de garras acessórias (Fig. 21 ); cerda das garras tarsais longa e fina (Fig. 20 ); abrigo de grãos de areia grossos com duas aberturas dorsais em forma de chaminé (Fig. 22 ) ............................................ Protoptila Banks
Garra da falsa perna anal com 1 processo e 3 pares de garras acessórias (Fig. 10); cerda da garra tarsal curta e grossa (Fig. 9); abrigo com grãos de areia grossa com aberturas dorsais simples, sem chaminé (Fig. 11) ............................................................ Itaura Müller
Chave de identificação para larvas de último estádio para os gêneros e subgênero de Hydropsychidae (modificada de Flint 1983)
Brânquias abdominais ventrais com haste central grossa, de onde se originam filamentos finos, distribuídos de forma uniforme (Figs. 29, 33, 36 , 47 ) ........................................................................................ 3
Brânquias abdominais ventrais e ventro lateral sem haste central, bifurcando-se na base, com poucos filamentos grossos, distribuídos de maneira não uniforme (Fig. 41) ............... Smicridea McLahlan 2
Esclerito ventral do segmento abdominal VIII formado por duas placas (Fig. 44 ) . Smicridea (Rhyacophylax)
Trocantim não alargado na base, pontiagudo apicalmente; fêmur não alargado e truncado apicalmente; cabeça e tórax não alongados como acima (Figs. 31, 30, 33, 37 , 39 ) ..................................... 4
Garra anal não alongada (Figs. 29, 32, 36 ); cabeça ventralmente com estrutura de estridulação (Figs. 30, 38 ) .................................................................................. 5
Cabeça dorsalmente sem carena (Fig. 31); base do labro sem par de escleritos; abrigo de fragmentos vegetais, preso a rochas ou vegetação ........ Leptonema Guérin
Chave de identificação para larvas de último estádio para os gêneros de Hydroptilidae
Larva achatada dorso-ventralmente (Fig. 50) ou com abdome retrátil (Figs. 52 , 57, 69 , 100 ) ........................ 2
Larva não achatada dorso-ventralmente; abdome não retrátil (Figs. 62 , 74, 79 , 82, 89 , 95) ............................. 6
Segmentos abdominais IV, V e VI aproximadamente da mesma largura (Fig. 50) ................... Alisotrichia Flint
Somente o segmento abdominal I com placa inteira (Fig. 58); segmentos II-VII sem placa dorsal, somente dois pequenos escleritos latero-dorsais (Figs. 57, 59); ................................................................ Ceratotrichia Flint
Placas dorsais sem lacuna circular central (Figs. 54 , 71 , 72 ) ................................................................................. 5
Segmentos abdominais I-VII com escleritos largos e curtos com coloração uniforme, sem manchas escuras (Figs. 69 , 71 , 72 .......................... Leucotrichia Mosely
Falsas pernas anais não se destacando do abdome (Figs. 66, 74, 89 ) ........................................................... 8
Cabeça não tão longa e afilada como acima; suturas coronal e do frontoclípeo presentes (Fig. 83); papilas ventro-laterais do abdome ausentes ............................................................................. Neotrichia Morton
Antenas sem cerda mediana; pernas anteriores não como acima; abrigo de outra forma ........................... 9
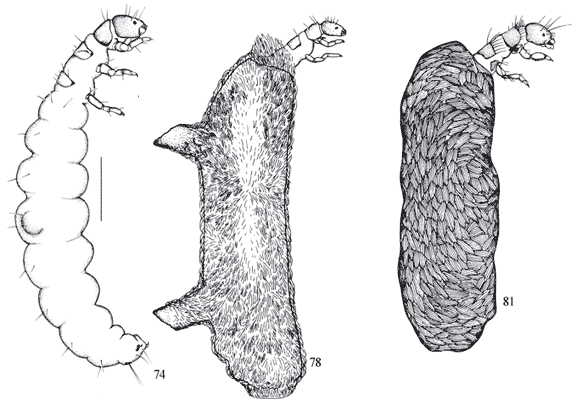
Segmento abdominal IX com uma papila longa na base do esclerito dorsal e uma em cada esclerito da garra anal (Figs. 62 , 66, 67); pernas recobertas por muitas cerdas; garras tarsais de todas as pernas com uma cerda na base (Figs. 63-65 ); abrigo bivalve de areia e algas (Fig. 68 ) ou somente areia .... Hydroptila Dalman
Segmento abdominal IX sem papila ou apenas com uma papila no esclerito dorsal, sem papilas no esclerito lateral da garra anal; pernas não recobertas por muitas cerdas e somente garra do primeiro par de pernas com uma cerda na base (Figs. 75-77 ); abrigo de algas, com chaminé ou não (Figs. 78, 80 ) ou de fragmentos vegetais (Fig. 81) ................................ Metrichia Ross
Chave de identificação para larva de último estádio para os gêneros de Leptoceridae
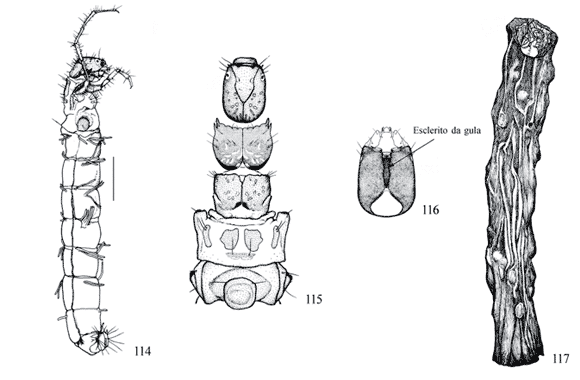
Metanoto com três ou cinco escleritos (Figs. 115 e 119 ) ........................................................................................ 2
Metanoto membranoso ou com apenas dois pequenos escleritos (Figs. 107, 111 , 125) ................................... 3
Metanoto com três escleritos (Fig. 119 ); pernas posteriores robustas, com a tíbia triangular achatada expandida lateralmente, não dividida (Fig. 123 ); esclerito anterior da gula pequeno e triangular (Fig. 121 ); abrigo de seda transparente (Fig. 118 ) ................ ...... Amazonatolica hamadae Holzenthal & Pes 2004
Metanoto com dois pequenos escleritos ou manchas com cerdas (Figs. 107); palpo maxilar curto; abrigos de fragmentos vegetais com diferentes arranjos ou grãos de areia (Figs. 109, 128) .................................... 4
Placa dorsal do segmento abdominal IX e garra anal de outra forma sem coroa de espinhos (Fig. 108); cabeça dorsalmente, sem carena (Fig. 105); esclerito da gula grande, de forma trapezoidal (Fig. 106) .................... ........................................................ Nectopsyche Muller
Chave de identificação para larvas de último estádio para os gêneros de Philopotamidae
Margem anterior do frontoclípeo sem reentrância (Fig. 139 ); cabeça com um par de cerdas pequenas e escuras localizadas na metade posterior da região ventral (Fig. 140 ) .................... Wormaldia McLachlan
Chave de identificação para larvas em último estádio para os gêneros de Polycentropodidae
Garra anal com um pente de dentes tão longos quanto a garra na região côncava (Figs. 151; 155) ................................................... Polyplectropus Ulmer
Garra anal sem pente de dentes longos (Fig. 144), se presentes são curtos (Figs. 146, 148) ........................ 2
Placa dorsal da falsa perna anal (entre a garra e o esclerito lateral) com duas faixas escuras que não se tocam na região mediana (Fig. 149); garra da falsa perna anal com um par de dentes curtos (Fig. 148) ou cerdas na região proximal; cabeça sem manchas escuras conspícuas .......................... Cyrnellus Banks
DISCUSSÃO
Na família Xiphocentronidae, não foi possível detectar diferenças entre as larvas dos gêneros Machairocentron e Xiphocentron, a identificação foi realizada por meio da associação das larvas com o adulto farado. Os dois gêneros apresentam o mesmo comportamento, as larvas localizam-se sobre pedras, em áreas de remanso, ou fora da água em locais muito úmidos (Pes 2001).
As descrições das larvas do gênero Macrostemum (Wiggins 1996; Angrisano & Korob 2001) indicam que as larvas desse gênero apresentam uma carena fechada na região posterior da cabeça. Entretanto, as larvas de Macrostemum sp., coletadas e associadas com adultos farados, não apresentam esta carena fechada e sim aberta como em Blepharopus diaphanus Kolenati, 1856 (Flint & Wallace 1980).
Algumas diferenças observadas podem ser úteis para separar as larvas de Macrostemum sp. e B. diaphanus: a) a estrutura de estridulação na região ventral da cabeça de B. diaphanus, é marcada destacando-se em uma região mais clara, enquanto que em Macrostemum sp. esta região tem coloração uniforme; b) as larvas de Macrostemum sp. apresentam menos cerdas do que as de B. diaphanus; c) o abrigo de Macrostemum sp. é construído com areia, formando dois túneis em forma de "Y" para entrada e saída de água, a larva localiza-se na porção anterior que geralmente fica enterrada na areia (Fig. 40 ) ou troncos em decomposição, enquanto que em B. diaphanus o abrigo de areia ou/e fragmentos vegetais é simples, não tem esta forma.
Este é o primeiro registro da família Sericostomatidae para a região amazônica. Até o momento somente um gênero com uma espécie, Grumicha grumicha (Vallot) 1855, foi registrada na região sul do Brasil (Flint et al. 1999). A larva de Sericostomatidae coletada e ilustrada neste trabalho, claramente não pertence a esse gênero. A larva de Sericostomatidae gênero A, é semelhante à larva de Notidobiella chacayana Schmid 1957, por apresentar carena dorsal na cabeça, muitas cerdas no tórax; ausência de escleritos laterais no mesotórax e abrigo de grãos de areia e seda (Flint 1967). Porém, pode pertencer a um gênero cuja larva não tenha sido descrita, como Chioecia Navas, Myotrichia Schmid (Flint et al. 1999), ou mesmo a um gênero novo. A identificação do gênero só será possível com a associação da larva com o adulto.
A presente chave é uma contribuição para o conhecimento dos Trichoptera na amazônia, porém muito ainda precisa ser feito, como revisões taxonômicas e levantamentos faunísticos para se conhecer quantas espécies ocorrem na região, além de realizar associações de larvas com os adultos descritos. São necessários ainda trabalhos sobre biologia, comportamento de larvas e adultos destes insetos para saber qual a sua importância biológica, o potencial bioindicador e seu papel na biologia de conservação na bacia amazônica.
Agradecimentos. A J. O. da Silva, J. Bosco, Y. B. Alencar e U. C. Barbosa (INPA) pelo auxílio nos trabalhos de campo. Aos funcionários da Secretaria de Turismo e Meio Ambiente do Município de Presidente Figueiredo pelo apoio no período das coletas. A Deyse C. Q. Santos e B. Otávio pela ilustração deste trabalho. À Capes pela concessão de bolsa de mestrado, ao CNPq pela concessão de bolsa de doutorado ao primeiro autor. Este trabalho foi financiado pelos PPI 1-3070, 1-3570 (INPA/MCT), Edital Universal processo nº 479258/2001-5 (CNPq) e Projeto Diversidade Biológica de Fragmentos Florestais (INPA/Smithsonian Institution), sub-projeto Ygarapés (série técnica nº: 438).
Recebido em 21.VII.2004; aceito em 10.II.2005
APÊNDICE
- Angrisano, E. B. 1995. Insecta Trichoptera, p. 1199-1237. In: E. C. Lopretto & G. Tell (Eds.). Ecosistemas de aguas continentales, metodologia para su estudio. Tomo III. La Plata, Ediciones Sur, 1401 p.
- Angrisano, E. B. 1998. Trichoptera, p. 374-384. In: J. J. Morrone & S. Coscarón (Eds.). Biodiversidad de Artrópodos Argentinos. La Plata, Ediciones Sur, 599 p.
- Angrisano, E. B & P. G. Korob. 2001. Trichoptera, p. 55-92. In: H. R. Fernández & E. Domíngues (Eds.). Guía para la determinacíon de los artrópodos bentónicos sudamericanos Tucumán, Universidad Nacional de Tucumán, 282 p.
- Botosaneanu, L. & O. S. Flint Jr. 1982. On some Trichoptera from Northern Venezuela and Ecuador (Insecta). Beaufortia 32: 1326.
- Flint Jr., O. S. 1963. Studies of Neotropical Caddisflies, I: Rhyacophilidae and Glossosomatidae (Trichoptera). Proceedings of the United States National Museum 114: 453478.
- Flint Jr., O. S. 1967. Studies of Neotropical Caddisflies, II: Trichoptera collected by Prof. J. Illies in the Chilean Subregion. Beiträge zur Neotropischen Fauna 5: 4568.
- Flint Jr., O. S. 1971. Studies of Neotropical Caddisflies, XII: Rhyacophilidae, Glossosomatidae, Philopotamidae, and Psycomyiidae from the Amazon Basin (Trichoptera). Amazoniana 3: 167.
- Flint Jr., O. S. 1974. Studies of Neotropical Caddisflies, XV: The Trichoptera of Surinam. Studies on the Fauna of Suriname and other Guyanas 14: 1157.
- Flint Jr., O. S. 1978. Studies of Neotropical Caddisflies, XXII: Hydropsychidae of the Amazon Basin (Trichoptera). Amazoniana 6: 73421.
- Flint Jr., O. S. 1981. Studies of Neotropical Caddisflies, XXVIII: The Trichoptera of the Río Limón. Smithsonian Contributions to Zoology 330: 161.
- Flint Jr., O. S. 1983. Studies of Neotropical Caddisflies, XXXIV: The genus Plectromacromena (Trichoptera: Hydropsychidae). Proceedings of the Biological Society of Washington 96: 225237.
- Flint Jr., O. S. 1991. Studies of Neotropical Caddisflies, XLIV: On a collection from Ilha de Maraca, Brazil. Acta Amazônica 21: 6383.
- Flint Jr., O. S. 1996. The Trichoptera collected on the expeditions to Parque Manu, Madre de Dios, Peru. In: D. E. Wilson & A. Sandoval (Eds). Manu: the biodiversity of southeastern Peru. Washington, Smithsonian Institution Press, 679 p.
- Flint Jr., O. S. & J. Bueno-Soria. 1982. Studies of Neotropical Caddisflies, XXXII: The immature stages of Macronema viriipenne Flint & Bueno, with the division Macronema by the resurrection of Macrostemum (Trichoptera: Hydropsychidae). Proceedings of the Biological Society of Washington 95: 358370.
- Flint Jr., O. S. & S. C. Harris. 1992. Studies of Neotropical Caddisflies, XLII: Taraxitrichia amazonensis, a new genus and species of microcaddisfly from Venezuela (Trichoptera: Hydroptilidae), p. 411-414. In: C. Tomaszewski (Ed.). Proceedings of the Sixth International Symposium on Trichoptera. Lódz-Zakopane, Adam Michiewicz University Press, xiv+479 p.
- Flint Jr., O. S. & L. A. Reyes. 1991. Studies of Neotropical Caddisflies, XLVI: The Trichoptera of the Rio Moche Basin, Department of la Libertad, Peru. Proceedings of the Biological Society of Washington 104: 474492.
- Flint Jr., O. S. & J. B. Wallace. 1980. Studies of Neotropical Caddisflies, XXV: The immature stages of Blepharopus diaphanus and Leptonema columbianus (Trichoptera: Hydropsychidae). Proceedings of the Biological Society of Washington 93: 178193.
- Flint Jr., O. S.; S. C. Harris, & L. Botosaneanu. 1994. Studies of Neotropical Caddisflies, L: The description of Cerasmatrichia, new genus, a relative of Alisotrichia, with descriptions of new and old species and the larva (Trichopera: Hydroptilidae). Proceedings of the Biological Society of Washington 107: 360382.
- Flint Jr., O. S.; R.w. Holzenthal & S. C. Harris. 1999. Catalog of the Neotropical Caddisflies (Insecta: Trichoptera). Columbus, Ohio Biological Survey, iv+239p.
- Guahyba, R. R. 1991. Estágios imaturos de Anchitrichia duplifurcata Flint, 1983 (Trichoptera, Hydroptilidae). Revista Brasileira de Biologia 35: 121125.
- Holzenthal, R. W. 1995. The caddisfly genus Nectopsyche: new gemma group species from Costa Rica and the Neotropics (Trichoptera: Leptoceridae). Journal of the North American Benthological Society 14: 6183.
- Holzenthal, R. W. & A. M. O. Pes. 2004. A new genus of long-horned caddisfly from the Amazon basin (Trichoptera: Leptoceridae: Grumichellini). Zootaxa 621: 116.
- Marlier, G. 1964. Trichoptères de l'Amazonie recueillis par Professeur H. Sioli. Memoires Institut Royal des Sciences naturalles de Belgique, series 2, fasc. 76: 1167.
- Martynov, A. B. 1912. On two collections of Trichoptera from Peru. Annuaire de Musée Zoologique de l'Académie Impérial des Sciences de St. Pétersbourg 17: 140.
- Pes, A. M. O. 2001. Taxonomia e estrutura de comunidade de Trichoptera (Insecta) no município de Presidente Figueiredo, Amazonas, Brasil. Dissertação de Mestrado. Manaus, Instituto Nacional de Pesquisas da Amazônia, 164 p.
- Pes, A. M. O. & N. Hamada. 2003. The occurrence of Taraxitrichia Flint & Harris, 1992 (Trichoptera: Hydroptilidae) in Brazil, with description of the final larval stage. Zootaxa 328: 17.
- Pes, A. M. O. & N. Hamada. 2004. Ceratotrichia Flint, 1992 (Trichoptera: Hydroptilidae) larval and pupal description and new genus records for Brazil. Entomotropica 19: 3137.
- Prather, L. A. 2003. Revision of the Neotropical caddisfly genus Phylloicus (Trichoptera: Calamoceratidae). Zootaxa 275: 1214.
- Resh, V. H & J. O. Solem. 1996. Phylogenetic Relationships and Evolutionary adaptations of aquatic insects. In: R. W. Merritt & K. W. Cummins (Eds). An Introdution to the Aquatic Insects of North America. 3rd Ed. Dubuque, Kendall/Hunt Publishing Company, 862 p.
- Roback, S. S. 1966. The Trichoptera larvae and pupae. p. 235-303. In: R. Patrick; F. A. Aldrich; J. Cairns Jr.; F. Drouet; M. H. Hohn; S. S. Roback; H. Skuja; P. J. Spangler, Y. H. Swabey & L. A. Whitford (Eds.). Catherwood Foundation Peruvian-Amazon expedition. Monographs of the Academy of Natural Sciences of Philadelphia 14: 1495.
- Sattler, W. 1963a. Eine neue Triplectides Art (Leptoceridae, Trichoptera) aus dem brasilianischen Amazonasgebeit, ihre Metamorphosestadien und Bemerkungen zu ihrer Biologie. Beiträge zur Neotropische Fauna 3: 2033.
- Sattler, W. 1963b. Über den Körperbau, die Ökologie und Ethologie der Larve und Puppe von Macronema Pict. (Hydropsychidae), ein als Larve sich von "Mikro-Drift"ernährendes Trichopter aus dem Amazonasgebiet. Stuttgart. Archiv Für Hydrobiologie 59: 2660.
- Sattler, W. & J. Sykora 1977. Über eine durch ihr Bauinstinkt, merkwürdige neotropische Köcherflie Leucotrichia brasiliana n. sp. (Trichoptera, Hydroptilidae). Amazoniana 6: 237255.
- Ulmer, G. 1905. Zur Kenntniss aussereupäischer Trichopteren. Stettiner Entomologische Zeitung 66: 1119.
- Ulmer, G. 1906. Ueber die Larve einer Brasilianischen Trichopteren Spezies. Annales de Biologie Lacustre 1: 18.
- Wiggins, G. B. 1996. Larvae of the North American Caddisfly genera (Trichoptera). 2rd Ed. Toronto, University of Toronto Press Incorporated, 457 p.
Datas de Publicação
-
Publicação nesta coleção
09 Ago 2005 -
Data do Fascículo
Jun 2005
Histórico
-
Recebido
21 Jul 2004 -
Aceito
10 Fev 2005