Resumos
Adultos de Chinavia pengue (Rolston, 1983) foram coletados em Garopaba, SC, e criados em laboratório sob condições controladas (24 ± 1°C; UR 70 ± 10%; 12hL:12hE). Como alimento, adultos e ninfas receberam vagens verdes de feijão (Phaseolus vulgaris L.). Os ovos de C. pengue seguem o padrão de coloração e esculturação do cório e coloração e forma dos processos aero-micropilares descrito para as espécies neotropicais de Chinavia. Ninfas de 1º instar possuem uma mancha ovalada no dorso da cabeça e tórax, característica das espécies de Chinavia. Em C. pengue, essa mancha tem coloração laranja-avermelhada, e as manchas abdominais (4+4 manchas laterais e uma mediana) são brancas. Características exclusivas das ninfas de 2º a 5º ínstares de C. pengue são a coloração laranja-avermelhada das manchas do pro- e mesotórax e das manchas circulares no centro das placas abdominais laterais. Não se observou sobreposição nas medidas da largura da cabeça entre os cinco ínstares. Cada fêmea depositou 15,9 ± 4,18 posturas e 218,8 ± 48,60 ovos, sendo 14 ovos/postura o arranjo mais freqüente. A fertilidade foi de 70,0% ± 19,01; a mortalidade no 2º ao 5º estádio foi de 1,6% ± 4,49. A razão sexual obtida foi de 1 macho: 1 fêmea. A duração da fase imatura (ovo a adulto) foi de 45,7 ± 2,99 dias.
Morfologia externa; ninfa; ovo; percevejo; tempo de desenvolvimento
Adults of Chinavia pengue (Rolston, 1983) were collected in Garopaba county, SC, and used to establish a laboratory culture under controlled conditions (24 ± 1°C; 70 ± 10% RH; 12hL:12hD). Adults and nymphs were fed with green beans (Phaseolus vulgaris L.). Eggs of C. pengue follow the pattern of coloration, chorion sculpture, color and shape of the aero-micropylar processes described to other neotropical Chinavia species. The first instar has the dorsal macula of the head and thorax characteristic of Chinavia species. In C. pengue, this macula is orange-red, and the abdominal maculae (4+4 lateral maculae and one median) are white. From second to fifth instars diagnostic characteristics are orange-red maculae at pro and mesothorax, and at middle of abdominal lateral plates. There was no overlapping of the head-capsule measurements between the five instars of C. pengue. Each female laid an average of 15.9 ± 4.18 egg masses and 218.8 ± 48.60 eggs; there was a marked peak at 14 eggs per egg mass. Mean egg fertility was 70.0% ± 19.01; mortality in the second to fifth stadium was 1.6% ± 4.49. Sex ratio was 1 male: 1 female. The mean duration of the immature stage (egg to adult) was 45.7 ± 2.99 days.
Developmental time; egg; external morphology; nymph; stink bug
BIOLOGIA, ECOLOGIA E DIVERSIDADE
Descrição dos estágios imaturos e biologia de Chinavia pengue (Rolston) (Hemiptera, Pentatomidae)1 1 Contribuição Nº 514 do Departamento de Zoologia, Instituto de Biociências, Universidade Federal do Rio Grande do Sul.
Description of the immature stages and biology of Chinavia pengue (Rolston) (Hemiptera, Pentatomidae)
Viviana C. MatescoI, II; Cristiano F. SchwertnerI, II; Jocélia GraziaI, III
IPrograma de Pós-Graduação em Biologia Animal, Departamento de Zoologia, Instituto de Biociências, Universidade Federal do Rio Grande do Sul. Av. Bento Gonçalves, 9500. Bloco IV, Prédio 43435, 91501-970 Porto Alegre-RS, Brasil
IIBolsista CAPES. vimatesco@yahoo.com.br; acrosternum@yahoo.com.br
IIIBolsista CNPq. jocelia@ufrgs.br
RESUMO
Adultos de Chinavia pengue (Rolston, 1983) foram coletados em Garopaba, SC, e criados em laboratório sob condições controladas (24 ± 1°C; UR 70 ± 10%; 12hL:12hE). Como alimento, adultos e ninfas receberam vagens verdes de feijão (Phaseolus vulgaris L.). Os ovos de C. pengue seguem o padrão de coloração e esculturação do cório e coloração e forma dos processos aero-micropilares descrito para as espécies neotropicais de Chinavia. Ninfas de 1º instar possuem uma mancha ovalada no dorso da cabeça e tórax, característica das espécies de Chinavia. Em C. pengue, essa mancha tem coloração laranja-avermelhada, e as manchas abdominais (4+4 manchas laterais e uma mediana) são brancas. Características exclusivas das ninfas de 2º a 5º ínstares de C. pengue são a coloração laranja-avermelhada das manchas do pro- e mesotórax e das manchas circulares no centro das placas abdominais laterais. Não se observou sobreposição nas medidas da largura da cabeça entre os cinco ínstares. Cada fêmea depositou 15,9 ± 4,18 posturas e 218,8 ± 48,60 ovos, sendo 14 ovos/postura o arranjo mais freqüente. A fertilidade foi de 70,0% ± 19,01; a mortalidade no 2º ao 5º estádio foi de 1,6% ± 4,49. A razão sexual obtida foi de 1 macho: 1 fêmea. A duração da fase imatura (ovo a adulto) foi de 45,7 ± 2,99 dias.
Palavras-chave: Morfologia externa; ninfa; ovo; percevejo; tempo de desenvolvimento.
ABSTRACT
Adults of Chinavia pengue (Rolston, 1983) were collected in Garopaba county, SC, and used to establish a laboratory culture under controlled conditions (24 ± 1°C; 70 ± 10% RH; 12hL:12hD). Adults and nymphs were fed with green beans (Phaseolus vulgaris L.). Eggs of C. pengue follow the pattern of coloration, chorion sculpture, color and shape of the aero-micropylar processes described to other neotropical Chinavia species. The first instar has the dorsal macula of the head and thorax characteristic of Chinavia species. In C. pengue, this macula is orange-red, and the abdominal maculae (4+4 lateral maculae and one median) are white. From second to fifth instars diagnostic characteristics are orange-red maculae at pro and mesothorax, and at middle of abdominal lateral plates. There was no overlapping of the head-capsule measurements between the five instars of C. pengue. Each female laid an average of 15.9 ± 4.18 egg masses and 218.8 ± 48.60 eggs; there was a marked peak at 14 eggs per egg mass. Mean egg fertility was 70.0% ± 19.01; mortality in the second to fifth stadium was 1.6% ± 4.49. Sex ratio was 1 male: 1 female. The mean duration of the immature stage (egg to adult) was 45.7 ± 2.99 days.
Keywords: Developmental time; egg; external morphology; nymph; stink bug.
Estudos morfológicos e taxonômicos em Pentatomidae têm se dirigido preferencialmente à fase adulta, apesar da reconhecida importância dos estágios imaturos para o estudo dos heterópteros em geral (Cobben 1978; Brailovsky et al. 1992). Para a identificação e classificação dos percevejos-do-mato, os estágios de ovo e ninfa apresentam características relevantes em nível de família, gênero e espécie (Candan et al. 2001; Schwertner et al. 2002). A biologia de poucas espécies tem sido estudada, principalmente daquelas relacionadas a plantas cultivadas (DeCoursey & Esselbaugh 1962; Brailovsky et al. 1992).
O gênero Chinavia Orian, 1965 tem ampla distribuição geográfica e inclui atualmente mais de 80 espécies (Grazia et al. 2006; Schwertner & Grazia 2006). Compreende parte dos pentatomídeos conhecidos como percevejos-verdes, grupo que inclui, entre outros, espécies dos gêneros Nezara Amyot & Serville, 1843 e Piezodorus Fieber, 1860 (Buzzi 1994). Várias espécies desse grupo são registradas sobre plantas cultivadas e relacionadas como pragas primárias, secundárias ou em potencial (Panizzi et al. 2000). Além disso, sua diversidade e padrão de distribuição apontam esses organismos como modelos em potencial para estudos ecológicos, biogeográficos e aplicados.
Em vista da relação do gênero Chinavia com plantas cultivadas na região neotropical, a biologia de algumas espécies é conhecida (Brailovsky et al. 1992; Hallman et al. 1992; LaPorta & Avalos 1993; Avalos & LaPorta 1996; Matesco et al. 2003). Cerca de 30 espécies ocorrem no Brasil, das quais apenas cinco têm seus imaturos conhecidos (Grazia et al. 1982; Vecchio et al. 1988; Schwertner et al. 2002; Matesco et al. 2003, 2006).
Chinavia pengue (Rolston, 1983) foi originalmente descrita para o sul do Brasil (SC) e Argentina (Rolston 1983) e posteriormente registrada sobre plantas cultivadas no Rio Grande do Sul (Brasil): soja (Glycine max [L.] Merrill, Fabaceae), tremoço branco (Lupinus albus L., Fabaceae) e colza (Brassica napus L., Brassicaceae) (Link & Grazia 1987). Registros adicionais não publicados de C. pengue ampliam sua distribuição para o estado do Paraná (Brasil) e Paraguai e sua ocorrência em outras plantas: crotalária (Crotalaria mucronata Desv., Fabaceae), algodão (Gossypium hirsutum L., Malvaceae) e solanácea (Solanum sp., Solanaceae).
O objetivo deste trabalho contempla a descrição da morfologia externa dos estágios imaturos de C. pengue e de aspectos da biologia da espécie, contribuindo assim para o conhecimento de Chinavia. Os resultados obtidos são comparados àqueles existentes na literatura sobre as demais espécies do gênero.
MATERIAL E MÉTODOS
Adultos de Chinavia pengue foram coletados sobre Crotalaria mucronata em Garopaba, SC, em janeiro de 2004. Em laboratório, os insetos foram mantidos em câmara climatizada (B.O.D.), sob condições controladas de temperatura (24 ± 1°C), umidade relativa do ar (70 ± 10%) e fotoperíodo (12hL:12hE). A criação dos adultos e ninfas foi feita em potes plásticos (500 ml; 12 cm diâmetro superior; 7,5 cm altura), com tampa telada. Para manter a umidade no interior do pote, utilizou-se um tubo ependorf contendo água e tampado com algodão.
As posturas obtidas em laboratório foram acondicionadas em placas de Petri contendo algodão umedecido até a muda para o 2º instar, quando foram transferidas para os potes plásticos. As ninfas da mesma postura foram mantidas juntas até a emergência dos adultos. Durante a criação das ninfas e adultos, os potes plásticos foram trocados sempre que necessário.
Como alimento, ofereceram-se aos adultos e às ninfas de 2º a 5º instar vagens verdes de feijão (Phaseolus vulgaris L.), como recomendado para outras espécies de Chinavia e outros pentatomídeos (Harris & Todd 1981; LaPorta & Avalos 1993; Avalos & LaPorta 1996). O alimento foi substituído duas vezes por semana.
Para o estudo da morfologia e dos parâmetros morfométricos, 15 exemplares de cada instar e 15 posturas foram fixados em álcool etílico 70%. Para a descrição do padrão de coloração das ninfas, foram observados indivíduos vivos. A terminologia adotada para as descrições dos ovos e das ninfas foi baseada em Wolf et al. (2002) e Matesco et al. (2006), respectivamente.
As medidas apresentadas correspondem à média ± DP (n = 15 ovos e n = 15 ninfas de cada instar) em milímetros, tendo sido obtidas em microscópio estereoscópico com auxílio de ocular de medição. Para os ovos, foram realizadas medições da altura e largura e contagem de processos aero-micropilares. Para as ninfas, foram medidos comprimento total (CT), do ápice da cabeça à extremidade do abdome; largura total (LT), correspondendo à maior largura abdominal; comprimento da cabeça (CC); largura da cabeça ao nível médio dos olhos; distância interocular ao nível médio dos olhos (DI); comprimento dos segmentos antenais I, II, III e IV; comprimento do rostro (CR); comprimento do pronoto (CP), e largura do pronoto (LP). As medidas de comprimento foram feitas ao longo da linha mediana longitudinal da estrutura.
Fotografias foram obtidas com máquina fotográfica digital; as ilustrações foram elaboradas com auxílio de câmara clara acoplada ao estereomicroscópio. Após finalização com caneta nanquim descartável, as ilustrações foram digitalizadas e coloridas utilizando o programa Adobe Photoshop®.
Para estudo da biologia da espécie, acompanharam-se as datas de posturas das fêmeas e das mudas e morte das ninfas mediante registro diário. Calculou-se a longevidade média das fêmeas, o período de pré-oviposição, oviposição e pós-oviposição, o número médio de ovos por fêmea, número médio de posturas por fêmea, número médio e moda de ovos por postura. A fertilidade dos ovos foi identificada pelo aparecimento dos olhos como um par de manchas vermelhas através do cório. Foram calculados ainda os valores médios de duração (em dias) e mortalidade do estágio de ovo, do 1º estádio e do 2º ao 5º estádio. A razão sexual foi determinada considerando o número de machos e fêmeas que chegaram ao estágio adulto.
Os espécimes estudados foram depositados na Coleção Entomológica do Departamento de Zoologia da Universidade Federal do Rio Grande do Sul.
RESULTADOS
Ovo (Fig. 1). Forma de barril; opérculo circular e convexo. Altura: 1,8 ± 0,05 mm, largura: 1,6 ± 0,07 mm. Superfície do cório irregularmente reticulada, de coloração castanho-clara. Processos aero-micropilares clavados, brancos, em número médio de 70 ± 5 (62-81). Com o desenvolvimento do embrião, são visíveis os olhos vermelhos e o ruptor ovis castanho-escuro. Cada postura com 13,7 ± 6,87 ovos; moda de 14 ovos por postura.
1º instar (Fig. 2, Tabs. I e II). Corpo circular e fortemente convexo, superfície do corpo lisa. Coloração geral castanho-escura a negra, com exceção das manchas brancas abdominais e de uma mancha mediana, dorsal, alongada, laranja-avermelhada, que se estende da base da cabeça à margem posterior do metanoto. Cabeça cônica, fortemente declivente; clípeo com ápice arredondado, ultrapassando as jugas, subtriangulares. Olhos pouco mais estreitos que a largura da base do clípeo; ocelos ausentes. Antenas negras, exceto as áreas intersegmentares, que são mais claras; quatro segmentos antenais, recobertos por poucos pêlos curtos, mais densos no terceiro e no quarto segmentos. Primeiro segmento antenal mais curto que os demais; quarto segmento tão longo quanto o segundo e terceiro juntos, estes subiguais. Rostro negro, ultrapassando a margem anterior do segundo urosternito. Tórax predominantemente escuro, com exceção da mácula mediana laranja-avermelhada; pro-, meso- e metasterno negros. Pernas negras, com pêlos curtos, mais densos e longos no ápice das tíbias e nos tarsos; tíbias aplainadas dorsalmente; tarsos com dois segmentos, um par de garras tarsais e pulvilo. Abdome predominantemente castanho-escuro, com manchas brancas constantes ao longo do desenvolvimento do instar. Placas dorso-medianas negras; as três primeiras com 1+1 aberturas das glândulas odoríferas. Placas laterais dorsais semicirculares, adjacentes à margem lateral de cada segmento, negras; placas laterais ventrais apresentando pequena reentrância ao nível do espiráculo. Manchas abdominais dorsais brancas com a seguinte distribuição: uma pequena mancha circular anterior à primeira placa mediana; 1+1 manchas circundando a primeira placa lateral; 1+1 manchas, maiores e de forma ovalada, lateralmente à primeira placa mediana; 1+1 manchas lateralmente à segunda placa mediana, menores e semicirculares, e 1+1 manchas lateralmente à terceira placa mediana, de igual forma e tamanho que as anteriores. Espiráculos ventrais do II ao VIII segmento abdominal, próximos à margem anterior das placas laterais. Do III ao VII urosternito, visíveis 1+1 tricobótrios internamente à linha dos espiráculos, próximos à margem posterior de cada segmento.
2º instar (Fig. 3, Tabs. I e II). Corpo oval e menos convexo que no instar anterior, com pontuações no dorso da cabeça, tórax e placas abdominais medianas e laterais. Coloração geral predominantemente negra, com exceção de manchas laranja-avermelhadas no tórax e manchas brancas no abdome. Cabeça menos declivente do que no instar anterior e com ápice truncado; clípeo subigual às jugas, estas mais amplas no ápice do que no primeiro instar e apresentando as margens externas da metade apical convexas. Olhos tão largos quanto a base do clípeo. Antenas negras; primeiro segmento mais curto que os demais; segundo e terceiro subiguais em comprimento, em conjunto maiores que o quarto. Rostro negro, ultrapassando pelo menos a margem anterior do terceiro urosternito. Tórax com 1+1 manchas retangulares laranja-avermelhadas junto às margens laterais do protórax (visíveis dorsal e ventralmente); margens do pro- e mesotórax deprimidas e levemente defletidas; bordos levemente serrilhados. Pernas negras; tíbias aplainadas dorsalmente e cilíndricas ventralmente. Abdome castanho-escuro a negro; manchas junto à segunda placa mediana ausentes; manchas junto à terceira placa mediana com localização látero-posterior e forma retangular; surgimento de 1+1 manchas circulares brancas laterais à quarta placa mediana. Placas medianas e laterais negras. Ventralmente, quatro placas medianas, menores que as dorsais, nos segmentos V a VIII e 2+2 tricobótrios nos urosternitos III a VII, sendo 1+1 na linha dos espiráculos e 1+1 internamente a essa linha. Demais características conforme descrito para o 1º instar.
3º instar (Fig. 4, Tabs. I e II). Coloração e forma do corpo similares ao 2º instar. Jugas podem apresentar 1+1 faixas submarginais vermelho-escuras. Olhos mais largos que a base do clípeo. Primeiro segmento antenal mais curto que os demais; segundo e terceiro subiguais em comprimento, em conjunto maiores que o quarto. Rostro negro, ultrapassando a margem anterior do terceiro urosternito. Tórax negro, com 1+1 manchas laranja-avermelhadas no protórax e, às vezes, 1+1 manchas semicirculares de mesma coloração na margem lateral do mesotórax (ambas visíveis dorsal e ventralmente). Pernas negras. Abdome castanho-escuro, com pontuações negras também entre as placas medianas e laterais; podem estar presentes manchas semicirculares laranja-avermelhadas no centro de cada placa lateral. Ventralmente, cinco placas medianas, menores que as dorsais, nos segmentos IV a VIII. Demais características conforme descrito para o 2º instar.
4º instar (Fig. 5, Tabs. I e II). Corpo oval a piriforme, predominantemente negro. Cabeça menos declivente do que no 3º instar; jugas vermelhas, exceto a margem negra; cabeça vermelha ventralmente. Antenas negras. Primeiro segmento antenal menor; o segundo e o quarto subiguais, e o terceiro de comprimento menor que estes. Rostro negro, ultrapassando a margem anterior do segundo urosternito. Tórax negro; pronoto trapezoidal; mesonoto retangular, levemente intumescido; margem posterior medianamente em "U" aberto, evidenciando a formação do escutelo. Pro- e mesotórax com margens laterais levemente serrilhadas. Pterotecas levemente desenvolvidas, atingindo a margem posterior do metanoto. Manchas junto às margens laterais do protórax ocupando os dois terços anteriores do segmento; manchas laterais do mesotórax sempre presentes. Pernas negras. Abdome violáceo a negro, mais claro ventralmente; pontuações mais densas que no instar anterior. Manchas semicirculares no centro de cada placa lateral sempre presentes (visíveis dorsal e ventralmente). Demais características conforme descrito para o 3º instar. Alguns exemplares podem apresentar o primeiro segmento e a metade basal do segundo segmento do rostro, assim como as coxas, os fêmures e o terço basal das tíbias despigmentados e o ventre abdominal castanho-esverdeado.
5º instar (Fig. 6, Tabs. I e II). Corpo oval a piriforme, predominantemente negro. Cabeça plana; jugas vermelho-alaranjadas, exceto a margem negra; cabeça vermelha ventralmente. Antenas predominantemente negras, com exceção do primeiro segmento que pode ser despigmentado. Primeiro segmento antenal mais curto e o segundo mais longo que os demais; terceiro e quarto subiguais em comprimento. Rostro negro, ultrapassando a margem anterior do segundo urosternito. Tórax predominantemente negro; manchas em mesmo número e coloração que no instar anterior. Pro- e mesonoto podem se apresentar medianamente mais claros ou todo o noto torácico pode ter coloração castanho-alaranjada, exceto as manchas junto às margens. Pronoto com margens ântero-laterais levemente convexas; mesonoto mais desenvolvido; escutelo, em desenvolvimento, bem delimitado. Pterotecas bem desenvolvidas, estendendo-se além da metade do terceiro segmento abdominal, cobrindo totalmente as manchas junto à primeira placa lateral e deixando as manchas junto à primeira placa mediana parcialmente encobertas. Pro-, meso- e metasterno castanho-alaranjados. Pernas predominantemente negras, exceto metade apical das coxas, fêmures e, em alguns indivíduos, os 2/3 basais das tíbias despigmentados. Abdome dorsal violáceo a negro, densamente pontuado, com a mesma distribuição e número de manchas que o instar anterior, exceto as manchas junto à primeira placa lateral. Placas medianas podem apresentar a área central alaranjada. Abdome ventral castanho-claro; placas medianas ventrais avermelhadas. Nesse instar, ocorre o início da diferenciação de genitália externa: nas fêmeas, o urosternito VIII se apresenta fendido longitudinalmente na porção mediana; nos machos, este segmento é íntegro. Demais características conforme descrito para o 4º instar.
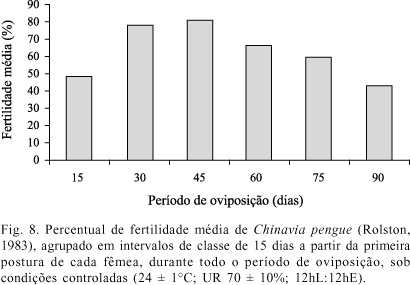
Biologia. Foram acompanhados, ao total, 14 casais, obtendo-se 223 posturas e 3063 ovos. As fêmeas viveram 89,6 ± 16,92 dias e depositaram 15,9 ± 4,18 posturas e 218,8 ± 48,60 ovos. O número mais freqüente foi 14 ovos/postura (Fig. 7). O período de pré-oviposição foi 15,8 ± 2,55 dias; o período de oviposição foi 65,7 ± 15,49 dias, e o período de pós-oviposição foi 8,1 ± 6,48 dias. A fertilidade encontrada foi de 70,0% ± 19,01; a variação do percentual de fertilidade durante o período de oviposição das fêmeas, agrupado em intervalos de classe de 15 dias a partir da data da primeira postura de cada fêmea, é apresentada na Figura 8. A mortalidade no 2º ao 5º estádio foi de 1,6% ± 4,49. A razão sexual obtida foi 1 macho: 1 fêmea. Os tempos de desenvolvimento dos diferentes ínstares de C. pengue são apresentados na Tabela III.
DISCUSSÃO
Os ovos de C. pengue se enquadram no padrão descrito para as espécies neotropicais de Chinavia: cório de coloração castanho-clara, com padrão de esculturação reticulado e processos aero-micropilares numerosos (entre 50 e 90), brancos e de forma clavada (Saini 1984; Schwertner et al. 2002; Wolf et al. 2002; Matesco et al. 2003, 2006). Tais caracteres são compartilhados por todas as espécies de Chinavia nesse estágio do desenvolvimento e permitem o reconhecimento precoce do táxon. O reconhecimento específico com base nos ovos é mais difícil, embora estudos recentes em microscopia eletrônica de varredura (MEV) apontem a possibilidade de identificação de novos caracteres (Lambdin & Lu 1984; Candan & Suludere 1999; Suludere et al. 1999; Bundy & McPherson 2000; Candan et al. 2001; Wolf & Reid 2004). Até o momento, apenas Chinavia bella (Rolston, 1983) e Chinavia marginata (Palisot de Beauvois, 1805) tiveram seus ovos estudados em MEV (Vecchio et al. 1988; Wolf et al. 2002, 2003).
Com exceção de Chinavia erythrocnemis (Berg, 1878), as espécies conhecidas do gênero têm ovos menores que os de C. pengue. O número médio de processos aero-micropilares em C. pengue é maior que o encontrado em Chinavia herbida (Stål, 1859) e Chinavia ubica (Rolston, 1983), mas muito semelhante ao verificado nas demais espécies (Saini 1984; Vecchio et al. 1988; Brailovsky et al. 1992; Schwertner et al. 2002; Matesco et al. 2003, 2006). Nesse estágio do desenvolvimento, C. pengue pode ser confundida com Chinavia obstinata (Stål, 1860), cujos ovos têm tamanho semelhante (1,7 por 1,3 mm) e entre 63 e 86 processos aero-micropilares (em média, 72,4) (Matesco et al. 2003).
No estágio ninfal, a identificação das espécies de Chinavia pode ser feita com base no padrão de coloração geral do corpo e no número, tamanho e coloração das manchas do facies dorsal dos imaturos, as quais aparecem já no 1º instar e modificam-se ao longo do desenvolvimento (Matesco et al. 2006).
No 1º instar, há considerável dificuldade na identificação de C. pengue. Neste instar, o reconhecimento do gênero é possível devido à presença de uma mancha ovalada no dorso da cabeça e do tórax em todas as espécies conhecidas de Chinavia (Schwertner et al. 2002; Matesco et al. 2006). Essa mancha varia, entre as espécies, na intensidade de sua coloração: é laranja-avermelhada em C. pengue; vermelha em C. erythrocnemis; alaranjada em C. obstinata e C. ubica, e amarelada nas ninfas das demais espécies com imaturos conhecidos. No abdome, um par de manchas brancas, ovaladas, lateralmente à primeira placa mediana ocorre em todas as espécies de Chinavia, à exceção de C. obstinata, em que essas manchas são amareladas. O padrão de coloração e disposição das manchas do dorso abdominal na ninfa de 1º instar de C. pengue assemelha-se ao descrito para Chinavia impicticornis (Stål, 1872), C. bella e C. ubica. O 1º instar de C. pengue pode ser diferenciado dessas espécies pela coloração da mancha mediana na cabeça e tórax.
A presença de apenas 1+1 tricobótrios bem desenvolvidos, internos à linha dos espiráculos, em ninfas de 1º instar e 2+2 tricobótrios nos ínstares seguintes constitui o padrão descrito por Schaefer (1975) para Pentatomoidea e aparece como característica de C. pengue. No entanto, nas espécies de Chinavia em que se realizaram estudos em MEV, verificou-se a presença adicional de 1+1 pré-tricobótrios, externos à linha dos espiráculos (Vecchio et al. 1988; Schwertner et al. 2002), indicando a necessidade de um amplo estudo em MEV para confirmar a presença dos pré-tricobótrios nas demais espécies.
A partir do 2º instar, todas as ninfas conhecidas de Chinavia apresentam uma mancha subretangular na margem lateral do protórax que, juntamente com as manchas do dorso abdominal, formam um conjunto característico de cada espécie. A partir do 3º ou, mais comumente, no 4º e 5º ínstares, surge um par de manchas no mesotórax e uma mancha no centro de cada placa lateral do abdome, geralmente de mesma coloração que a mancha lateral do protórax.
Apenas em C. pengue e C. ubica, as manchas laterais do pro- e mesotórax e as manchas nas placas abdominais laterais têm coloração laranja-avermelhada. Nessas duas espécies, as manchas abdominais têm coloração branca, pelo menos nos ínstares iniciais. A presença dessas manchas e a ausência de manchas nos segmentos abdominais IV e V e de manchas medianas anteriores à 2ª, 3ª e 4ª placas medianas do abdome permite reconhecer C. pengue no estágio ninfal. Em C. ubica, o par de manchas lateral à primeira placa mediana tem coloração amarela a partir do 3º instar, e as manchas dorsais apresentam-se menores e mais numerosas que em C. pengue. Segundo Pennington (1918), as ninfas de Chinavia abnormis (Berg, 1892) também apresentam manchas laranja-avermelhadas no tórax e nas placas abdominais laterais, além de manchas branco-esverdeadas no abdome. No entanto, o autor não menciona os ínstares a que se refere, o que dificulta a comparação das ninfas dessa espécie com as demais conhecidas.
Embora algumas ninfas de 4º instar de C. pengue exibam coloração mais clara, não foram registradas formas predominantemente claras, como descrito para outras espécies de Chinavia (Whitmarsh 1917; Miner 1966; Vecchio et al. 1988; Brailovsky et al. 1992; Schwertner et al. 2002).
Os cinco ínstares de C. pengue podem ser distinguidos entre si pelas características de coloração e morfologia descritas e ilustradas, especialmente observando-se os segmentos torácicos (grau de desenvolvimento do escutelo e pterotecas). O tamanho é também um caráter importante, embora não seja totalmente preciso (DeCoursey & Esselbaugh 1962; Brailovsky et al. 1992). A largura da cabeça, porém, parece aumentar a uma taxa praticamente constante nos cinco ínstares, de modo que suas medidas não se sobrepõem entre ínstares consecutivos (Jones & Coppel 1963; Hallman et al. 1992). Em C. pengue não se observou sobreposição nas medidas da largura da cabeça entre os ínstares (Tab. II).
O número de posturas (223) e ovos (3063) obtidos e a baixa mortalidade do 2º ao 5º estádio (1,6%) confirmam o valor nutricional de vagens de feijão para ninfas e adultos de Chinavia, como já evidenciado em outros estudos (Hallman et al. 1992; LaPorta & Avalos 1993; Avalos & LaPorta 1996), inclusive quando comparado com outras plantas hospedeiras conhecidas ou em potencial (C. F. Schwertner, observação pessoal). Os pentatomídeos fitófagos, embora sejam considerados polífagos, são mais encontrados sobre certos táxons de plantas; as espécies de Chinavia, bem como as espécies do gênero relacionado Nezara, parecem exibir preferência por leguminosas (Fabaceae) (Panizzi 1997). Além disso, esses insetos, de modo geral, apresentam melhor desempenho em plantas cultivadas que em hospedeiras silvestres (Panizzi 1997).
O número médio de posturas (15,9) e de ovos (218,8) obtidos para C. pengue é pelo menos duas vezes maior que o observado para a maioria das outras espécies de Chinavia criadas em condições semelhantes (Miner 1966; Javahery 1990; Hallman et al. 1992; LaPorta & Avalos 1993; Avalos & LaPorta 1996), o que pode estar relacionado à maior longevidade das fêmeas observada no presente estudo. Apenas C. ubica apresenta capacidade reprodutiva equivalente (11,07 posturas/fêmea e 216,88 ovos/fêmea) e maior longevidade (110,56 dias) quando alimentada com feijão e criada sob condições similares (C. F. Schwertner, observação pessoal).
Em relação ao número de ovos por postura, posturas mais freqüentemente com 14 ovos, como em C. pengue (Fig. 7), é o padrão encontrado na maioria das espécies de Chinavia e várias espécies de Pentatomidae (Esselbaugh 1946; Grazia et al. 1982; Vecchio et al. 1988; Brailovsky et al. 1992; Hallman et al. 1992; Matesco et al. 2003). Quatorze reflete o número total de ovaríolos usualmente encontrado nas fêmeas de Pentatomidae (Pendergrast 1957). Com base no tamanho das posturas, Kiritani & Hokyo (1965) estabeleceram três padrões de oviposição para a família. De acordo com essa classificação, as espécies de Chinavia pertenceriam ao tipo II, no qual as fêmeas colocam posturas com poucos ovos (12-14 ovos) e um curto intervalo entre elas, de modo que a oviposição é feita assim que o primeiro ovo em cada ovaríolo se encontra pronto para ser depositado.
Em Pentatomidae, a fertilidade dos ovos é afetada pela qualidade do alimento e pela idade das fêmeas (Nilakhe 1976; Panizzi & Herzog 1984; Slansky & Panizzi 1987; Silva 1992; Cividanes & Parra 1994). A fertilidade média observada em C. pengue (70%) pode ser considerada baixa; em outros estudos sobre o gênero foram observados valores acima de 80% (Whitmarsh 1917; Javahery 1990). Entretanto, cabe ressaltar que a maioria dos estudos biológicos avaliou o percentual médio de emergência dos ovos (que inclui também dados relativos à mortalidade no estágio de ovo), constatando valores entre 70 e 95% (Sailer 1953; Javahery 1990; Hallman et al. 1992; LaPorta & Avalos 1993; Avalos & LaPorta 1996; Matesco et al. 2003). Para Chinavia hilaris (Say, 1831), Javahery (1990) verificou fertilidades médias cerca de 6 a 12% maiores que as taxas de emergência. Em C. ubica, dentre várias características medidas, a fertilidade apresentou variação significativa em relação à planta utilizada como alimento (C. F. Schwertner, observação pessoal).
Observando-se o percentual de fertilidade média ao longo do período de oviposição das fêmeas (Fig. 8), constata-se um baixo percentual de ovos férteis nos primeiros quinze dias. Kiritani (1963) verificou que fêmeas hibernantes de Nezara viridula (Linnaeus, 1758) depositam ovos inférteis em pequenas posturas no início do período de oviposição; o que, entretanto, não foi observado em fêmeas da primeira e segunda geração após a hibernação. No período de oviposição restante, constata-se que a fertilidade dos ovos de C. pengue tendeu a diminuir com o avanço da idade das fêmeas, como observado em outras espécies de pentatomídeos (Nilakhe 1976; Silva 1992).
O grande número de ovos inférteis nas primeiras posturas não pode ser satisfatoriamente explicado pelos dados disponíveis. Pode indicar que há necessidade de complementação nutricional (incluindo diferentes espécies de plantas), embora a baixa mortalidade das ninfas do 2º ao 5º instar sugira que o alimento utilizado seja adequado. Velasco & Walter (1993) estabeleceram que uma sobrevivência maior que 60% no período ninfal indicaria uma alimentação adequada para Nezara viridula. A constatação de que o período de pré-oviposição de C. pengue foi mais curto que em outras espécies do gênero e de que todos os ovos da primeira postura de oito das 14 fêmeas foram inférteis sugere que essas fêmeas tenham efetuado as primeiras oviposições antes de copularem. Segundo Kiritani (1963), fêmeas virgens de N. viridula ovipositaram normalmente.
A duração média do estágio de ovo em C. pengue (Tab. III) foi maior que aquela verificada para C. bella, C. hilaris, C. impicticornis, C. marginata e C. ubica quando criadas sob condições semelhantes (Whitmarsh 1917; Esselbaugh 1948; Hallman et al. 1992; Avalos & LaPorta 1996; C. F. Schwertner, observação pessoal). No entanto, foi semelhante à encontrada para Chinavia apicicornis (Spinola, 1852) e C. obstinata, esta última criada em temperatura de 21,9°C (LaPorta & Avalos 1993; Matesco et al. 2003).
Para C. hilaris, praga de diferentes culturas nos Estados Unidos, há pouca concordância sobre a duração dos estágios imaturos na literatura, provavelmente relacionada à variação nas condições de criação. Whitmarsh (1917) e Esselbaugh (1948) verificaram duração do estágio de ovo mais curta que em C. pengue. Outros estudos com a mesma espécie, criada em temperaturas entre 20 e 24°C, evidenciaram tempos de incubação bem mais longos (Sailer 1953; Miner 1966; Simmons & Yeargan 1988, Javahery 1990). Entre os pentatomídeos, a duração do estágio de ovo tem como fator determinante a temperatura e, dentro dos limites de cada espécie, diminui progressivamente com o aumento da temperatura (Simmons & Yeargan 1988; Silva 1992; Vecchio & Grazia 1993).
Ninfas de pentatomídeos não se alimentam durante o 1º estádio, e sua duração também é dependente principalmente da temperatura (Simmons & Yeargan 1988). O tempo médio desse estádio em C. pengue foi 5,1 dias. Entre quatro e cinco dias parece ser o tempo despendido entre a emergência do ovo e a primeira muda na maioria das espécies do gênero criadas em temperaturas entre 22 e 25°C (Simmons & Yeargan 1988; Hallman et al. 1992; Avalos & LaPorta 1996; Matesco et al. 2003). Entretanto, espécies de Chinavia criadas sob condições similares apresentaram duração mais longa desse estádio (Miner 1966; Javahery 1990; LaPorta & Avalos 1993).
O tempo médio de desenvolvimento do 2º ao 5º estádio em C. pengue (32,6 dias) foi muito similar ao obtido para várias espécies de Chinavia criadas em condições semelhantes (Miner 1966; Simmons & Yeargan 1988; LaPorta & Avalos 1993; Avalos & LaPorta 1996). A duração do período ninfal (do 2º ao 5º estádio) é diretamente influenciada pela temperatura e pela qualidade e quantidade dos recursos alimentares (Slansky & Panizzi 1987; Simmons & Yeargan 1988). Espécies de Chinavia submetidas a condições similares de temperatura e alimento mostram desempenhos semelhantes. Desse modo, características intrínsecas de cada espécie parecem exercer maior influência sobre aspectos reprodutivos dos adultos do que sobre o desenvolvimento do estágio ninfal.
A razão sexual obtida na emergência dos adultos (1:1) parece ser a regra para Pentatomidae (Botton et al. 1996; Martins & Campos 2006).
Agradecimentos. A Thaís Devincenzi pela oportunidade de coleta dos espécimes. A João Vicente Soeiro Guimarães pelo auxílio na criação dos insetos em laboratório. A CAPES e CNPq pela concessão das bolsas.
Recebido em 30/10/2006; aceito em 08/02/2007
- Avalos, D. S. & N. C. LaPorta. 1996. Biología de Acrosternum bellum Rolston, 1983 (Hemiptera, Pentatomidae). Agriscientia 13: 2530.
- Botton, M.; J. F. S. Martins; A. E. Loeck & M. d'Á. Rosenthal. 1996. Biologia de Tibraca limbativentris Stål sobre plantas de arroz. Anais da Sociedade Entomológica do Brasil 25: 2132.
- Brailovsky, H.; L. Cervantes & C. Mayorga. 1992. Hemiptera: Heteroptera de México. XLIV - Biología, estadios ninfales y fenologia de la tribu Pentatomini (Pentatomidae) en la Estación de Biología Tropical "Los Tuxtlas", Veracruz. México, UNAM, 204 p. (Publicaciones Especiales No. 8)
- Bundy, C. S. & R. M. McPherson. 2000. Morphological examination of stink bug (Heteroptera: Pentatomidae) eggs on cotton and soybeans, with a key to genera. Annals of the Entomological Society of America 93: 616624.
- Buzzi, Z. J. 1994. Coletânea de nomes populares de insetos do Brasil. Curitiba, UFPR, 230 p.
- Candan, S. & Z. Suludere. 1999. External morphology of eggs of Carpocoris pudicus (Poda, 1761) (Heteroptera: Pentatomidae). Journal of the Entomological Research Society 1: 2126.
- Candan, S.; Z. Suludere & S. Kiyak. 2001. External morphology of eggs of Codophila varia (Fabricius, 1787) (Heteroptera: Pentatomidae). Journal of the Entomological Research Society 3: 3339.
- Cividanes, F. J. & J. R. P. Parra. 1994. Biologia em diferentes temperaturas e exigências térmicas de percevejos pragas da soja. I. Nezara viridula (L.) (Heteroptera: Pentatomidae). Anais da Sociedade Entomológica do Brasil 23: 243250.
- Cobben, R. H. 1978. Evolutionary trends in Heteroptera. Part II. Mouthpart-structures and feeding strategies. Wageningen, Mededelingen Landbouwhogeschool 785, 407 p.
- DeCoursey, R. M. & C. O. Esselbaugh. 1962. Descriptions of the nymphal stages of some North American Pentatomidae (Hemiptera-Heteroptera). Annals of the Entomological Society of America 55: 323342.
- Esselbaugh, C. O. 1946. A study of the eggs of the Pentatomidae. Annals of the Entomological Society of America 39: 667691.
- Esselbaugh, C. O. 1948. Notes on the bionomics of some Midwestern Pentatomidae. Entomologica Americana 28: 173.
- Grazia, J.; M. C. del Vecchio & R. Hildebrand. 1982. Estudo das ninfas de pentatomídeos (Heteroptera) que vivem sobre soja [Glycine max (L.) Merrill]: IV Acrosternum impicticorne (Stål, 1872). Anais da Sociedade Entomológica do Brasil 11: 261268.
- Grazia, J.; C. F. Schwertner & A. Ferrari. 2006. Description of five new species of Chinavia Orian (Hemiptera, Pentatomidae, Pentatominae) from western and northwestern South America, p. 423434. In: W. Rabitsch (ed.). Hug the bug For love of true bugs. Festschrift zum 70 Geburtstag von Ernst Heiss. Denisia 19, 1184 p.
- Hallman, G. J.; C. G. Morales & M. C. Duque. 1992. Biology of Acrosternum marginatum (Heteroptera: Pentatomidae) on common beans. Florida Entomologist 75: 190196.
- Harris, V. E. & J. W. Todd. 1981. Rearing the southern green stink bug, Nezara viridula, with relevant aspects of its biology. Journal of the Georgia Entomological Society 16: 203210.
- Javahery, M. 1990. Biology and ecological adaptation of the green stink bug (Hemiptera: Pentatomidae) in Québec and Ontario. Annals of the Entomological Society of America 83: 201206.
- Jones, P. A. & H. C. Coppel. 1963. Immature stages and biology of Apateticus cynicus (Say) (Hemiptera: Pentatomidae). The Canadian Entomologist 95: 770779.
- Kiritani, K. 1963. Oviposition habit and effect of parental age upon the post-embryonic development in the southern green stink bug, Nezara viridula Japanese Journal of Ecology 13: 8895.
- Kiritani, K. & N. Hokyo. 1965. Variation of egg mass size in relation to the oviposition pattern in Pentatomidae. Kontyu 33: 427432.
- Lambdin, P. L. & G. Q. Lu. 1984. External morphology of eggs of the spined soldier bug, Podisus maculiventris (Say) (Hemiptera: Pentatomidae). Proceedings of the Entomological Society of Washington 86: 374377.
- LaPorta, N. C. & D. S. Avalos. 1993. Aspectos biológicos de Acrosternum apicicorne (Spinola, 1862) (Hemiptera, Pentatomidae). Agriscientia 10: 4549.
- Link, D. & J. Grazia. 1987. Pentatomídeos da região central do Rio Grande do Sul (Heteroptera). Anais da Sociedade Entomológica do Brasil 16: 115129.
- Martins, F. S. & L. A. Campos. 2006. Morfologia e biologia dos imaturos de Euschistus hansi (Hemiptera, Heteroptera, Pentatomidae). Iheringia, Série Zoologia 96: 213218.
- Matesco, V. C.; N. D. F. Fortes & J. Grazia. 2003. Imaturos de pentatomídeos (Hemiptera, Heteroptera): morfologia e biologia de Acrosternum obstinatum Iheringia, Série Zoologia 93: 8188.
- Matesco, V. C.; C. F. Schwertner & J. Grazia. 2006. Descrição dos estágios imaturos de Chinavia erythrocnemis (Berg) (Hemiptera, Pentatomidae). Neotropical Entomology 35: 483488.
- Miner, F. D. 1966. Biology and control of stink bugs on soybeans. Agricultural Experiment Station Bulletin (708): 140.
- Nilakhe, S. S. 1976. Overwintering, survival, fecundity, and mating behaviour of the rice stink bug. Annals of the Entomological Society of America 69: 717720.
- Panizzi, A. R. 1997. Wild hosts of pentatomids: ecological significance and role in their pest status on crops. Annual Review of Entomology 42: 99122.
- Panizzi, A. R. & D. C. Herzog. 1984. Biology of Thyanta perditor (Hemiptera: Pentatomidae). Annals of the Entomological Society of America 77: 646650.
- Panizzi, A. R.; J. E. McPherson; D. J. James; M. Javahery & R. M. McPherson. 2000. Stink bugs (Pentatomidae), p. 421474. In: C. W. Schaefer & A. R. Panizzi (eds.). Heteroptera of Economic Importance. Boca Raton, CRC Press, 828 p.
- Pendergrast, J. G. 1957. Studies on the reproductive organs of the Heteroptera with a consideration of their bearing on classification. Transactions of the Royal Entomological Society of London 109: 163.
- Pennington, M. S. 1918. Notas sobre la larva y la pseudo-imagen de la Nezara abnormis Berg. Physis 4: 333334.
- Rolston, L. H. 1983. A revision of the genus Acrosternum Fieber, subgenus Chinavia Orian, in the Western Hemisphere (Hemiptera: Pentatomidae). Journal of the New York Entomological Society 91: 97176.
- Sailer, R. I. 1953. A note on the bionomics of the green stink bug. Journal of the Kansas Entomological Society 26: 7071.
- Saini, E. D. 1984. Identificación de los huevos de pentatomidos (Heteroptera) encontrados en cultivos de soja. Idia (425-428): 7984.
- Schaefer, C. W. 1975. Heteropteran trichobothria (Hemiptera, Heteroptera). International Journal of Insect Morphology and Embryology 4: 193264.
- Schwertner, C. F.; G. S. Albuquerque & J. Grazia. 2002. Descrição dos estágios imaturos de Acrosternum (Chinavia) ubicum Rolston (Heteroptera: Pentatomidae) e efeito do alimento no tamanho e coloração das ninfas. Neotropical Entomology 31: 571579.
- Schwertner, C. F. & J. Grazia. 2006. Descrição de seis espécies de Chinavia (Hemiptera, Pentatomidae, Pentatominae) da América do Sul. Iheringia, Série Zoologia 96: 237248.
- Silva, C. P. 1992. Aspectos biológicos básicos de Oebalus poecilus (Dallas, 1851) (Heteroptera: Pentatomidae) no estágio de ovo, em condições de laboratório. Anais da Sociedade Entomológica do Brasil 21: 225231.
- Simmons, A. M. & K. V. Yeargan. 1988. Development and survivorship of the green stink bug, Acrosternum hilare (Hemiptera: Pentatomidae) on soybean. Environmental Entomology 17: 527532.
- Slansky, Jr., F. & A. R. Panizzi. 1987. Nutritional ecology of seed-sucking insects, p. 283319. In: F. Slansky Jr. & J. G. Rodriguez (eds.). Nutritional ecology of insects, mites, spiders and related invertebrates. Wiley, New York, 1016 p.
- Suludere, Z.; S. Candan & Y. Kalender. 1999. Chorionic sculpturing in eggs of six species of Eurydema (Heteroptera: Pentatomidae): a scanning electron microscope investigation. Journal of the Entomological Research Society 1: 2756.
- Vecchio, M. C. del; J. Grazia & R. Hildebrand. 1988. Estudo dos imaturos de pentatomídeos (Heteroptera) que vivem sobre soja [Glycine max (L.) Merrill]: V Acrosternum bellum Rolston, 1983 com a descrição da genitália da fêmea. Anais da Sociedade Entomológica do Brasil 17: 467482.
- Vecchio, M. C. del & J. Grazia. 1993. Estudo dos imaturos de Oebalus ypsilongriseus (De Geer, 1773): III - Duração e mortalidade dos estágios de ovo e ninfa (Heteroptera: Pentatomidae). Anais da Sociedade Entomológica do Brasil 22: 121129.
- Velasco, L. R. I. & G. H. Walter. 1993. Potential of host-switching in Nezara viridula (Hemiptera: Pentatomidae) to enhance survival and reproduction. Environmental Entomology 22: 326333.
- Whitmarsh, R. D. 1917. The green soldier bug. Ohio Agricultural Experiment Station Bulletin 310: 519552.
- Wolf, K. W.; W. Reid & D. A. Rider. 2002. Eggs of the stink bug Acrosternum (Chinavia) marginatum (Hemiptera: Pentatomidae): a scanning electron microscopy study. Journal of Submicroscopic Cytology and Pathology 34: 143149.
- Wolf, K. W.; W. Reid & M. Schrauf. 2003. Optical illusions in scanning electron micrographs: the case of the eggshell of Acrosternum (Chinavia) marginatum (Hemiptera: Pentatomidae). Micron 34: 5762.
- Wolf, K. W. & W. Reid. 2004. Postdepositional dynamics of eggs of Podisus sagitta (Hemiptera: Pentatomidae: Asopinae). A light and scanning electron microscopy study. Journal of the Entomological Research Society 6: 111.
Datas de Publicação
-
Publicação nesta coleção
02 Maio 2007 -
Data do Fascículo
Mar 2007
Histórico
-
Recebido
30 Out 2006 -
Aceito
08 Fev 2007