Resumo
Objetivo:
Avaliar o impacto do laser de baixa potência na prevenção de hipofluxo salivar em pacientes portadores de câncer de cabeça e pescoço após radioterapia e quimioterapia.
Materiais e Métodos:
Treze pacientes receberam laserterapia e dez receberam cuidados clínicos. Utilizou-se um InGaAlP laser diodo para aplicação intraoral (comprimento de onda de 660 nm, 40 mW de potência e dose média de 10 J/cm2) e extraoral (comprimento de onda de 780 nm, 15 mW de potência e dose média de 3,7 J/cm2), três vezes por semana, em dias alternados. Sialometrias estimulada e não estimulada foram realizadas antes da primeira sessão de radioterapia e quimioterapia (N0) e 30 dias após o final do tratamento (N30).
Resultados:
Em N30, os pacientes submetidos à laserterapia apresentaram médias estatisticamente maiores de fluxo salivar estimulado (p = 0,0131) e não estimulado (p = 0,0143), em comparação com os pacientes que receberam apenas cuidados clínicos.
Conclusão:
A laserterapia de baixa potência realizada concomitantemente a radioterapia e quimioterapia foi capaz de mitigar a hipofunção das glândulas salivares em pacientes portadores de câncer de cabeça e pescoço após o tratamento oncológico.
Unitermos:
Terapia a laser de baixa potência; Radioterapia; Quimioterapia; Câncer de cabeça e pescoço
Abstract
Objective:
To determine whether low-level laser therapy can prevent salivary hypofunction after radiotherapy and chemotherapy in head and neck cancer patients.
Materials and Methods:
We evaluated 23 head and neck cancer patients, of whom 13 received laser therapy and 10 received clinical care only. An InGaAlP laser was used intra-orally (at 660 nm and 40 mW) at a mean dose of 10.0 J/cm2 and extra-orally (at 780 nm and 15 mW) at a mean dose of 3.7 J/cm2, three times per week, on alternate days. Stimulated and unstimulated sialometry tests were performed before the first radiotherapy and chemotherapy sessions (N0) and at 30 days after the end of treatment (N30).
Results:
At N30, the mean salivary flow rates were significantly higher among the laser therapy patients than among the patients who received clinical care only, in the stimulated and unstimulated sialometry tests (p = 0.0131 and p = 0.0143, respectively).
Conclusion:
Low-level laser therapy, administered concomitantly with radiotherapy and chemotherapy, appears to mitigate treatment-induced salivary hypofunction in patients with head and neck cancer.
Keywords:
Lasers, semiconductor/therapeutic use; Radiotherapy; Head and neck neoplasms/drug therapy
INTRODUÇÃO
O câncer de cabeça e pescoço (CCP) envolve uma diversidade de neoplasias malignas com diferentes características, porém, em aproximadamente 95% dos casos, o tipo histológico primário observado é o carcinoma de células escamosas(11 Ruback MJ, Galbiatti AL, Arantes LM, et al. Clinical and epidemiological characteristics of patients in the head and neck surgery department of a university hospital. Sao Paulo Med J. 2012;130:307-13.). O câncer da cavidade oral é o tipo mais representativo da doença, sendo considerado também problema de saúde pública mundial(22 Rubira CM, Devides NJ, Ubeda LT, et al. Evaluation of some oral postradiotherapy sequelae in patients treated for head and neck tumors. Braz Oral Res. 2007;21:272-7.,33 Oton-Leite AF, Corrêa de Castro AC, Morais MO, et al. Effect of intraoral low-level laser therapy on quality of life of patients with head and neck cancer undergoing radiotherapy. Head Neck. 2012;34:398-404.). A última estimativa realizada no ano de 2012 apontou que ocorreriam cerca de 300.000 novos casos no mundo naquele ano, e no Brasil, em 2014, são estimados aproximadamente 15.000 novos casos(44 Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Estimativa 2014: incidência de câncer no Brasil. Rio de Janeiro, RJ: INCA; 2014.).
A radioterapia (RT) é importante modalidade terapêutica para cura e controle do CCP, pois permite a erradicação do tumor preservando a função dos tecidos normais da região afetada(55 Almeida FCS, Vaccarezza GF, Cazal C, et al. Avaliação odontológica de pacientes com câncer de boca pré e pós tratamento oncológico - uma proposta de protocolo. Pesqui Bras Odontopediatria Clín Integr. 2004;4:25-31.,66 Withers HR. Radiation biology and treatment options in radiation oncology. Cancer Res. 1999;59(7 Suppl):1676s-1684s.). É adotada como tratamento primário nos estágios iniciais da doença, porém, em casos mais avançados, é geralmente associada a quimioterapia (QT) e/ou cirurgia(77 Bonan PR, Pires FR, Lopes MA, et al. Evaluation of salivary flow in patients during head and neck radiotherapy. Pesqui Odontol Bras. 2003;17:156-60.
8 Jellema AP, Slotman BJ, Doornaert P, et al. Impact of radiation-induced xerostomia on quality of life after primary radiotherapy among patients with head and neck cancer. Int J Radiat Oncol Biol Phys. 2007;69:751-60.-99 Kakoei S, Haghdoost AA, Rad M, et al. Xerostomia after radiotherapy and its effect on quality of life in head and neck cancer patients. Arch Iran Med. 2012;15:214-8.). A dose total de radiação empregada no tratamento com intenção curativa é baseada na localização e tipo do tumor, ficando em torno de 50 a 70 Gy nos modelos da RT convencional. Esta dose, na maioria dos casos, é distribuída em frações de 1,8 a 2 Gy/dia, em um período de cinco a sete semanas, cinco dias por semana(1010 Jensen SB, Pedersen AM, Reibel J, et al. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer. 2003;11:207-25.,1111 Vissink A, Jansma J, Spijkervet FK, et al. Oral sequelae of head and neck radiotherapy. Crit Rev Oral Biol Med. 2003;14:199-212.).
As células não neoplásicas incluídas ou adjacentes aos campos de irradiação durante a RT também sofrem consequências. A extensão e intensidade dos efeitos citotóxicos são determinadas por fatores do tratamento, como dose total de radiação, dose por fração, volume do campo irradiado, distribuição da dose no volume de tecido, associação ou não à QT, e por fatores individuais dos pacientes(1212 Lima AAS, Figueiredo MAZ, Krapf SMR, et al. Velocidade do fluxo e pH salivar após radioterapia da região de cabeça e pescoço. Rev Bras Cancerol. 2004;50:287-93.). Estes efeitos podem ocorrer durante ou logo depois da RT, mas podem surgir também meses ou anos após o tratamento, sendo denominados, respectivamente, agudos e tardios(22 Rubira CM, Devides NJ, Ubeda LT, et al. Evaluation of some oral postradiotherapy sequelae in patients treated for head and neck tumors. Braz Oral Res. 2007;21:272-7.,55 Almeida FCS, Vaccarezza GF, Cazal C, et al. Avaliação odontológica de pacientes com câncer de boca pré e pós tratamento oncológico - uma proposta de protocolo. Pesqui Bras Odontopediatria Clín Integr. 2004;4:25-31.,1313 Cardoso MFA, Novikoff S, Tresso A, et al. Prevenção e controle das sequelas bucais em pacientes irradiados por tumores de cabeça e pescoço. Radiol Bras. 2005;38:107-15.).
Em relação à QT, utilizam-se principalmente os derivados da platina e a 5-fluorouracila, em protocolos semanais, com o intuito de radiossensibilizar o tumor(1414 Rosenthal DI, Trotti A. Strategies for managing radiation-induced mucositis in head and neck cancer. Semin Radiat Oncol. 2009;19: 29-34.). De maneira geral, os efeitos desejados dos derivados da platina são decorrentes da interação com bases púricas do DNA, que, por sua vez, afeta diretamente os processos de duplicação celular. A cisplatina, em especial, se liga à base nitrogenada guanina, prejudicando os eventos da mitose. Esses efeitos citotóxicos são sistêmicos, ocorrendo nas células tumorais e nas normais(1515 Bachaud JM, David JM, Boussin G, et al. Combined postoperative radiotherapy and weekly cisplatin infusion for locally advanced squamous cell carcinoma of the head and neck: preliminary report of a randomized trial. Int J Radiat Oncol Biol Phys. 1991;20:243-6.,1616 Qin H, Luo J, Zhu YP, et al. Combination of taxanes, cisplatin and fluorouracil as induction chemotherapy for locally advanced head and neck cancer: a meta-analysis. PLoS One. 2012;7:e51526.), todavia, ainda é obscura grande parte de seus mecanismos, assim como suas manifestações clínicas nos diferentes órgãos, tecidos e células humanas(1010 Jensen SB, Pedersen AM, Reibel J, et al. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer. 2003;11:207-25.).
A diminuição do fluxo salivar é uma complicação extremamente comum nos pacientes portadores de CCP submetidos a RT e QT, no entanto, os mecanismos pelos quais a função glandular em humanos é afetada ainda não estão bem definidos(1010 Jensen SB, Pedersen AM, Reibel J, et al. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer. 2003;11:207-25.,1717 Eisbruch A, Rhodus N, Rosenthal D, et al. How should we measure and report radiotherapy-induced xerostomia? Semin Radiat Oncol. 2003;13:226-34.). Observa-se seu início logo nos primeiros dias de tratamento, e se mostra mais evidente após doses totais de 20 Gy, o que corresponde, aproximadamente, à segunda semana de RT(1818 Barros Pontes C, Polizello AC, Spadaro AC. Clinical and biochemical evaluation of the saliva of patients with xerostomia induced by radiotherapy. Braz Oral Res. 2004;18:69-74.).
Acredita-se que até 72% da quantidade de saliva presente antes da RT tende a ser recuperada após sua finalização, porém, é relatado que doses totais maiores que 60 Gy são capazes de promover danos irreversíveis nas glândulas salivares(1818 Barros Pontes C, Polizello AC, Spadaro AC. Clinical and biochemical evaluation of the saliva of patients with xerostomia induced by radiotherapy. Braz Oral Res. 2004;18:69-74.
19 Roesink JM, Moerland MA, Battermann JJ, et al. Quantitative dose-volume response analysis of changes in parotid gland function after radiotherapy in the head-and-neck region. Int J Radiat Oncol Biol Phys. 2001;51:938-46.-2020 Lopes CO, Mas JRI, Zângaro RA. Prevenção da xerostomia e da mucosite oral induzidas por radioterapia com o uso do laser de baixa potência. Radiol Bras. 2006;39:131-6.). Além disso, a diminuição do fluxo salivar é acompanhada por alterações nas características da saliva, como pH, concentração de proteínas e íons, viscosidade e coloração, gerando uma série de efeitos secundários deletérios sobre os tecidos bucais e suas funções básicas(1919 Roesink JM, Moerland MA, Battermann JJ, et al. Quantitative dose-volume response analysis of changes in parotid gland function after radiotherapy in the head-and-neck region. Int J Radiat Oncol Biol Phys. 2001;51:938-46.,2121 Guggenheimer J, Moore PA. Xerostomia: etiology, recognition and treatment. J Am Dent Assoc. 2003;134:61-9.,2222 Bomeli SR, Desai SC, Johnson JT, et al. Management of salivary flow in head and neck cancer patients - a systematic review. Oral Oncol. 2008;44:1000-8.).
Não existe ainda um tratamento totalmente eficaz para o hipofluxo salivar induzido por RT e QT(2323 Dirix P, Nuyts S, Vander Poorten V, et al. The influence of xerostomia after radiotherapy on quality of life: results of a questionnaire in head and neck cancer. Support Care Cancer. 2008;16:171-9.). Diversos métodos e técnicas são descritos na literatura na tentativa de minimizá-lo, bem como suas consequentes complicações, todavia, muitos são paliativos e direcionados apenas para os sintomas(33 Oton-Leite AF, Corrêa de Castro AC, Morais MO, et al. Effect of intraoral low-level laser therapy on quality of life of patients with head and neck cancer undergoing radiotherapy. Head Neck. 2012;34:398-404.). Visto que o uso de saliva artificial e estimulantes mecânicos e gustatórios muitas vezes não são bem aceitos pelos pacientes, e os sialogogos sistêmicos, como a pilocarpina e o betanecol, podem resultar em efeitos colaterais importantes, outras soluções vêm ganhando destaque e interesse clínico. Entre estas, destacam-se a transposição cirúrgica de glândulas salivares maiores, os citoprotetores(1111 Vissink A, Jansma J, Spijkervet FK, et al. Oral sequelae of head and neck radiotherapy. Crit Rev Oral Biol Med. 2003;14:199-212.,2424 Zhang Y, Guo CB, Zhang L, et al. Prevention of radiation-induced xerostomia by submandibular gland transfer. Head Neck. 2012;34: 937-42.), a acupuntura(2121 Guggenheimer J, Moore PA. Xerostomia: etiology, recognition and treatment. J Am Dent Assoc. 2003;134:61-9.) e o uso do laser de baixa potência(1111 Vissink A, Jansma J, Spijkervet FK, et al. Oral sequelae of head and neck radiotherapy. Crit Rev Oral Biol Med. 2003;14:199-212.,2525 Vidovic Juras D, Lukac J, Cekic-Arambasin A, et al. Effects of low-level laser treatment on mouth dryness. Coll Antropol. 2010;34: 1039-43.).
A terapia com luz laser de baixa potência tem demonstrado ser eficaz no tratamento das mais diversas condições ou doenças, por promover biomodulação do metabolismo celular, analgesia e efeitos anti-inflamatórios, sem efeitos mutagênicos e fototérmicos. A conversão da energia luminosa do laser em energia útil para as células, decorrente de reações fotoquímicas e fotofísicas, é capaz de estimular a produção de trifosfato de adenosina mitocondrial, proliferação celular e síntese proteica(33 Oton-Leite AF, Corrêa de Castro AC, Morais MO, et al. Effect of intraoral low-level laser therapy on quality of life of patients with head and neck cancer undergoing radiotherapy. Head Neck. 2012;34:398-404.,2020 Lopes CO, Mas JRI, Zângaro RA. Prevenção da xerostomia e da mucosite oral induzidas por radioterapia com o uso do laser de baixa potência. Radiol Bras. 2006;39:131-6.,2626 Simões A, de Campos L, de Souza DN, et al. Laser phototherapy as topical prophylaxis against radiation-induced xerostomia. Photomed Laser Surg. 2010;28:357-63.). Estes mecanismos possibilitam o emprego do laser de baixa potência como agente estimulador do fluxo salivar em portadores de diversas condições ou doenças que envolvam sua diminuição, tais como síndrome de Sjögren(2020 Lopes CO, Mas JRI, Zângaro RA. Prevenção da xerostomia e da mucosite oral induzidas por radioterapia com o uso do laser de baixa potência. Radiol Bras. 2006;39:131-6.), aplasia de glândulas salivares, uso de medicações e até mesmo em pacientes submetidos a RT e QT(2525 Vidovic Juras D, Lukac J, Cekic-Arambasin A, et al. Effects of low-level laser treatment on mouth dryness. Coll Antropol. 2010;34: 1039-43.).
Por não ser invasiva, apresentar baixo custo e facilidade de aplicação, a laserterapia de baixa potência está disponível na rotina clínica da maioria dos serviços oncológicos, sendo utilizada há muito tempo para tratamento e prevenção das mucosites induzidas por RT e QT(2727 Gautam AP, Fernandes DJ, Vidyasagar MS, et al. Effect of low-level laser therapy on patient reported measures of oral mucositis and quality of life in head and neck cancer patients receiving chemoradiotherapy - a randomized controlled trial. Support Care Cancer. 2013;21:1421-8.). No entanto, ainda não há padronização dos protocolos que devem ser adotados especificamente para cada condição, dificultando a dosimetria pelo clínico.
Em razão da importância dos efeitos radioinduzidos e quimioinduzidos na qualidade de vida dos pacientes portadores de CCP, o presente estudo teve como objetivo verificar a eficácia da laserterapia de baixa potência, realizada concomitante a RT e QT, na prevenção do hipofluxo salivar após finalização do tratamento oncológico.
MATERIAIS E MÉTODOS
Pacientes
Conduziu-se este estudo prospectivo no Setor de Radioterapia da Universidade Federal de São Paulo (Unifesp), no período de junho de 2010 a agosto de 2012. Foram incluídos 30 pacientes portadores de CCP (cavidade oral, faringe, laringe e tumor primário oculto) submetidos a RT-3D convencional, com campos de irradiação englobando obrigatoriamente todas as glândulas salivares maiores. A dose total variou de 66 a 70 Gy, administrada em frações de 2 Gy/dia, semanalmente, combinada com cisplatina (40 mg/m2) e associada ou não a cirurgia. A RT foi realizada em acelerador linear (6 MV, Varian) ou em telecobaltoterapia - 60Co (Alcyon II, CGR-MeV), em áreas cervicofaciais e fossas supraclaviculares. Todos os pacientes eram maiores de 18 anos e apresentavam índice da escala de Karnofsky ≥ 70.
Foram excluídos pacientes portadores de diabetes mellitus, doenças autoimunes, infectocontagiosas e do colágeno, tumores iniciais (T1 e T2) limitados à laringe, trismo ou limitação de abertura da boca por sequela cirúrgica.
Todos os sujeitos de pesquisa leram e assinaram termo de consentimento livre e esclarecido. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Unifesp - parecer do CEP 0844/10.
Procedimentos clínicos
Todos os pacientes foram submetidos a preparo e adequação bucal pré-RT, que incluiu: tratamento periodontal e restaurador, exodontias, remoção de fatores que pudessem influenciar na gravidade dos efeitos agudos e tardios da RT (próteses mal adaptadas, restaurações inadequadas) e aconselhamento da suspensão do uso de aparelhos protéticos removíveis. Foram também esclarecidos a respeito das complicações orais mais frequentes e orientados quanto à higiene oral. Além disso, receberam tratamento clínico que consistiu na prescrição de enxaguatórios com chá de camomila (cinco vezes por dia), solução de bicarbonato de sódio (três vezes por dia), antifúngicos (quando necessários) e aplicação diária de flúor em gel neutro a 2% (pacientes dentados). Todos foram avaliados três vezes por semana durante a RT e QT.
Por terem retirado seus consentimentos durante a pesquisa, não terem realizado todos os procedimentos propostos, ou por falecimento, apenas 23 pacientes puderam ser efetivamente avaliados. Portanto, foram contabilizados 13 pacientes que receberam laserterapia (grupo laser) e 10 que receberam apenas o tratamento clínico convencional (grupo controle). Oito doentes operados previamente foram distribuídos numericamente de forma homogênea entre os dois grupos, entretanto, assim como todos os outros sujeitos de pesquisa, foram agrupados de forma aleatória.
Laserterapia
A laserterapia foi realizada com aparelho InGaAlP laser diodo (Twin Laser - MMOptics® Ltda.; São Carlos, SP, Brasil), três vezes por semana, em dias alternados e sempre pelo mesmo cirurgião-dentista.
A laserterapia foi iniciada previamente à primeira sessão de RT e QT e terminou posteriormente à última sessão de RT e QT, totalizando 21 sessões.
Para a laserterapia intraoral, utilizou-se o comprimento de onda de 660 nm e 40 mW de potência, sendo a dose média de 10 J/cm2. O tempo de irradiação com laser por ponto foi 10 segundos, de acordo com o tamanho da ponta do emissor (0,04 cm2). Sempre excluindo a área do tumor, foram iluminados três pontos em ambas as mucosas jugais (direita e esquerda), três na mucosa labial superior e três na inferior, dois no palato duro, um no palato mole, um no dorso da língua, dois nas bordas da língua bilateralmente, um no pilar amigdaliano direito e um no esquerdo, e dois no assoalho bucal.
Para a aplicação extraoral, utilizou-se o comprimento de onda de 780 nm, potência de 15 mW, com dose média de 3,8 J/cm2. O tempo de aplicação foi 10 segundos por ponto, de acordo com o tamanho da ponta do emissor do laser (0,04 cm2). Foram iluminados seis pontos em cada glândula parótida e dois em cada glândula submandibular.
A fibra ótica da peça de mão do laser foi colocada sempre perpendicularmente e em contato com o tecido durante as aplicações. Método de desinfecção química (álcool 70%) foi utilizado na limpeza do aparelho, além de barreira plástica individual. Durante o tratamento, o operador do laser e o paciente usaram óculos de proteção com lentes específicas.
Coleta de saliva
Foram realizadas para avaliação do fluxo salivar, na primeira sessão de RT e QT (N0) e 30 dias após a última (N30), sialometria não estimulada e estimulada, ambas de acordo com o Protocolo 97-09 do RTOG(2828 Radiation Therapy Oncology Group. A phase III study to test the efficacy of the prophylactic use of oral pilocarpine to reduce hyposalivation and mucositis associated with curative radiation therapy in head and neck cancer patients. RTOG97-09. Philadelphia, PA: Radiation Therapy Oncology Group; 1999. [cited 2014 Nov 24]. Available from: Available from: https://www.rtog.org/ClinicalTrials/ProtocolTable/StudyDetails.aspx?action=openFile&FileID=7573 .
https://www.rtog.org/ClinicalTrials/Prot...
).
Para a realização da sialometria não estimulada, os pacientes foram instruídos a permanecer sentados, com os olhos abertos e com a cabeça ligeiramente inclinada para frente, devendo também diminuir os movimentos orofaciais. Posteriormente, foram orientados a engolir toda a saliva da boca e então deixar acumular saliva no assoalho bucal por 60 segundos, sem engolir. Em seguida, deveriam cuspir o volume acumulado em um tubo de coleta graduado. O procedimento foi realizado mais quatro vezes, totalizando cinco minutos. O frasco com a saliva coletada foi deixado fechado e em repouso de um dia para o outro. No final, o fluxo salivar, em mililitros (mL), foi calculado por minuto por meio de média aritmética.
Para a coleta de saliva estimulada, primeiramente foi solicitado que o paciente esvaziasse a boca de qualquer saliva ou muco. Em seguida, uma solução de citrato de sódio a 2% foi aplicada nas bordas laterais da língua com o auxílio de uma haste plástica com algodão, cinco vezes durante dois minutos (0, 30, 60, 90 e 120 segundos). O frasco com a saliva coletada também foi deixado fechado e em repouso de um dia para o outro. No final, o fluxo salivar, em mL, foi calculado por minuto pela média aritmética.
Análise estatística
As variáveis categóricas (gênero, etnia, etilismo, tabagismo, sítio primário, tipo histológico, estádio, cirurgia e dose total de radiação) foram submetidas a análise estatística descritiva.
As médias dos fluxos salivares estimulados e não estimulados foram submetidas a análise estatística analítica. O teste de Wilcoxon foi utilizado para verificação da possível diferença dos valores das sialometrias dentro de cada grupo, nos diferentes tempos de estudo. Com o objetivo de comparar as possíveis alterações sialométricas entre grupos, em N0 e N30, utilizou-se o teste de Mann-Whitney. Valores significantes foram adotados para p ≤ 0,05.
Utilizou-se o programa de análise estatística Statistical Package for the Social Sciences, versão 21.0.
RESULTADOS
Algumas características demográficas, do tumor e do tratamento dos pacientes estão referidas nas Tabelas 1 e 2.
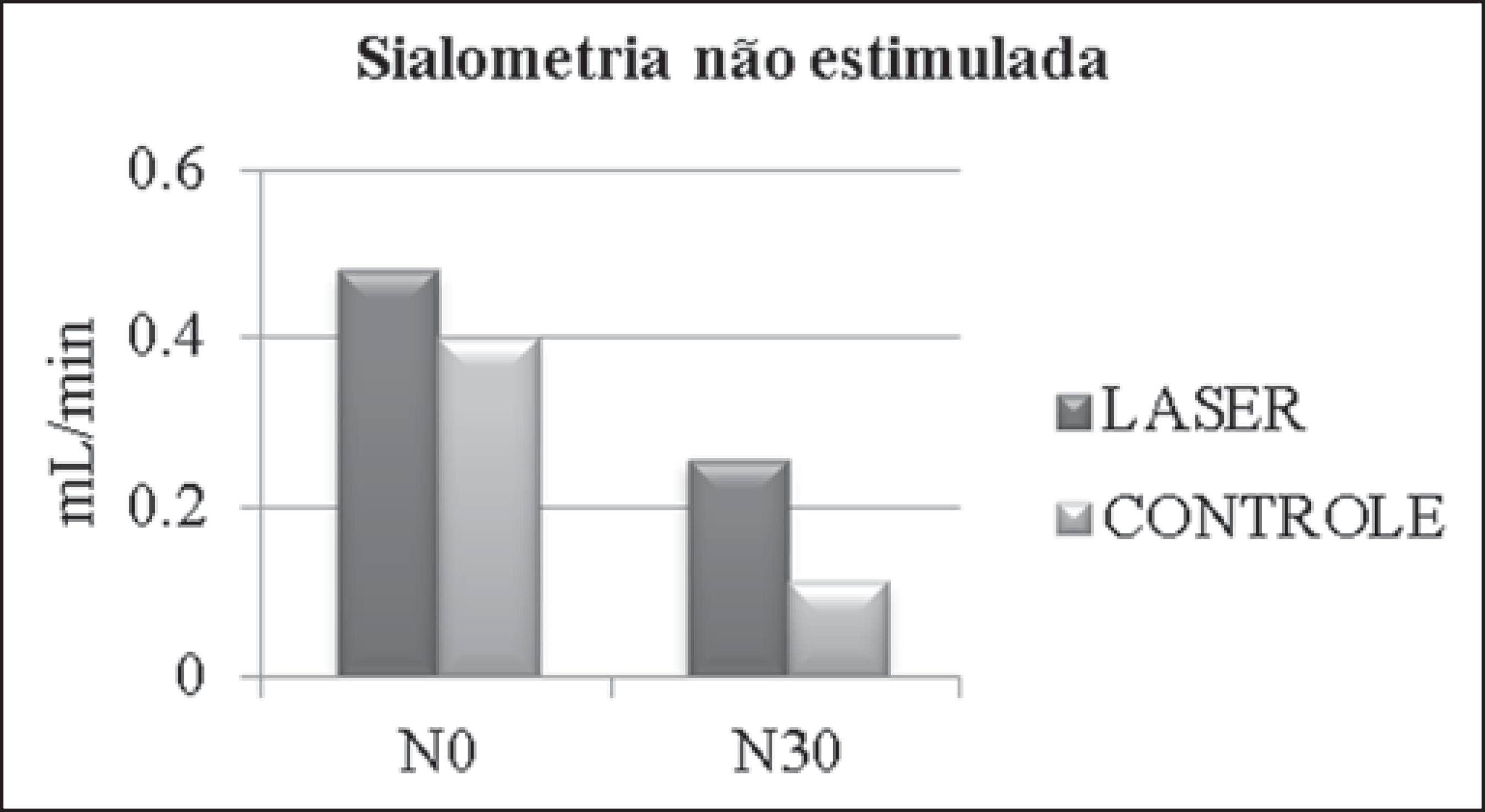
As médias das sialometrias não estimuladas estão apresentadas na Tabela 3 e Figura 1 e as das sialometrias estimuladas, na Tabela 4 e Figura 2.
Comparações entre o valor médio de fluxo salivar não estimulado entre pacientes que receberam laserterapia (grupo laser) e pacientes que receberam apenas cuidados clínicos (grupo controle), no início da RT e QT (N0) e 30 dias após término (N30).
Comparações entre o valor médio de fluxo salivar estimulado entre pacientes que receberam laserterapia (grupo laser) e pacientes que receberam apenas cuidados clínicos (grupo controle), no início da RT e QT (N0) e 30 dias após término (N30).
DISCUSSÃO
A saliva desempenha papel fundamental no equilíbrio das características fisiológicas e microbiológicas da cavidade oral, e também participa dos processos iniciais de digestão(77 Bonan PR, Pires FR, Lopes MA, et al. Evaluation of salivary flow in patients during head and neck radiotherapy. Pesqui Odontol Bras. 2003;17:156-60.,1010 Jensen SB, Pedersen AM, Reibel J, et al. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer. 2003;11:207-25.). O hipofluxo salivar resultante de danos glandulares é sequela importante e comum em pacientes portadores de CCP submetidos a RT e QT(1919 Roesink JM, Moerland MA, Battermann JJ, et al. Quantitative dose-volume response analysis of changes in parotid gland function after radiotherapy in the head-and-neck region. Int J Radiat Oncol Biol Phys. 2001;51:938-46.). Esta diminuição de fluxo pode causar prejuízos nas funções orais básicas e aumentar o risco de cárie, doença periodontal e infecções oportunistas, influenciando diretamente na qualidade de vida dos pacientes(88 Jellema AP, Slotman BJ, Doornaert P, et al. Impact of radiation-induced xerostomia on quality of life after primary radiotherapy among patients with head and neck cancer. Int J Radiat Oncol Biol Phys. 2007;69:751-60.). Desta forma, são oportunos e necessários melhores esclarecimentos a respeito dos mecanismos e processos envolvidos na resposta glandular a RT e QT, a fim de estabelecer medidas preventivas e tratamentos eficientes.
No presente estudo, a não obtenção de significância estatística no momento inicial (N0) das médias entre os grupos de ambas as sialometrias reforça a homogeneidade inicial idealizada pelos pesquisadores, na qual os oito pacientes submetidos a cirurgia foram distribuídos igualmente para receber laserterapia (quatro) ou apenas cuidados clínicos rotineiros (quatro). Além disso, todos esses oito operados tiveram apenas uma glândula submandibular removida cirurgicamente. Quanto à QT, os 23 sujeitos da pesquisa receberam cisplatina. A escassez de informações a respeito da influência dos quimioterápicos nas funções glandulares, por carência de estudos com métodos padronizados, amostras representativas, duração satisfatória e dissociação da RT(1010 Jensen SB, Pedersen AM, Reibel J, et al. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer. 2003;11:207-25.), justificou a inclusão de pacientes com esquemas quimioterápicos análogos.
As avaliações sialométricas foram realizadas em N0 e N30 por diferentes motivos. Uma vez que durante o tratamento oncológico são esperadas diminuição acentuada do fluxo e alta viscosidade salivar(99 Kakoei S, Haghdoost AA, Rad M, et al. Xerostomia after radiotherapy and its effect on quality of life in head and neck cancer patients. Arch Iran Med. 2012;15:214-8.), os resultados volumétricos poderiam não condizer com a realidade em razão da influência das dificuldades nos procedimentos de coleta. Em adição, neste período crítico, os pacientes estão submetidos a altos níveis de estresse e geralmente apresentam reações inflamatórias de mucosa (mucosite). O uso do estimulante gustatório citrato de sódio 2% poderia exacerbar a irritação da mucosa e dos níveis de dor.
Nossos resultados demonstraram significativa redução das médias dos fluxos salivares, em ambas as sialometrias, nos dois grupos de estudo. Um trabalho realizado por Lopes et al.(2020 Lopes CO, Mas JRI, Zângaro RA. Prevenção da xerostomia e da mucosite oral induzidas por radioterapia com o uso do laser de baixa potência. Radiol Bras. 2006;39:131-6.) com método e objetivos semelhantes aos do presente estudo, porém com parâmetros de laserterapia diferentes, também reportou quedas progressivas nas médias das sialometrias do grupo não submetido ao laser em diferentes tempos após RT, entre eles 30 dias.
Quanto ao fluxo não estimulado, observamos que os pacientes que receberam laserterapia tiveram redução de aproximadamente 0,223 mL/min (46,5%), e os outros, de 0,287 mL/min (71,75%). Extrapolando estes dados, podemos corroborar a literatura, que refere que durante e ao final de RT, associada ou não a cirurgia, o fluxo salivar não estimulado de pacientes que não receberam nenhum método preventivo pode diminuir até 45% do inicial e continuar decrescendo progressivamente(77 Bonan PR, Pires FR, Lopes MA, et al. Evaluation of salivary flow in patients during head and neck radiotherapy. Pesqui Odontol Bras. 2003;17:156-60.). Certamente, nos pacientes submetidos à luz laser também era esperado algum grau de hipofluxo decorrente da RT e QT, porém, isto se deu com menor intensidade, reforçando o benefício da laserterapia na prevenção deste efeito secundário. De acordo com a escala de fluxo salivar não estimulado proposta por Eisbruch et al.(1717 Eisbruch A, Rhodus N, Rosenthal D, et al. How should we measure and report radiotherapy-induced xerostomia? Semin Radiat Oncol. 2003;13:226-34.), em N30 o grupo laser manteve sua média maior que 0,2 mL/min, ou seja, com ausência de hipossalivação ou hipossalivação leve; em contrapartida, o grupo controle apresentou valores médios entre 0,1 e 0,2 mL/min, ou seja, hipossalivação moderada.
Em relação às avaliações do fluxo estimulado, o grupo laser apresentou, em média, diminuição de 0,254 mL/min (35,4%), e o grupo controle, 0,374 mL/min (63,7%). A literatura reporta que pacientes submetidos apenas a RT e sem nenhum tratamento adicional preventivo ao hipofluxo demonstram redução nas médias sialométricas estimuladas(22 Rubira CM, Devides NJ, Ubeda LT, et al. Evaluation of some oral postradiotherapy sequelae in patients treated for head and neck tumors. Braz Oral Res. 2007;21:272-7.,1818 Barros Pontes C, Polizello AC, Spadaro AC. Clinical and biochemical evaluation of the saliva of patients with xerostomia induced by radiotherapy. Braz Oral Res. 2004;18:69-74.) em torno de 64% após RT (aproximadamente 70 Gy) e 74% após mais dois meses(1212 Lima AAS, Figueiredo MAZ, Krapf SMR, et al. Velocidade do fluxo e pH salivar após radioterapia da região de cabeça e pescoço. Rev Bras Cancerol. 2004;50:287-93.). Não foi levantado nenhum trabalho com método semelhante ao nosso e que investigasse dados de sialometria estimulada após 30 dias do final da RT e QT, porém, foi possível notar que a laserterapia também foi benéfica na prevenção da redução do fluxo salivar estimulado.
Nosso protocolo de laserterapia intraoral, que abrangeu as glândulas sublinguais e outras glândulas salivares menores distribuídas por toda a cavidade oral, aliado à aplicação extraoral para estimulação direta das glândulas parótidas e submandibulares, foi conceituado com base nos relatos de aumento de fluxo salivar e diminuição de xerostomia quando a terapia com laser foi utilizada para mucosite em pacientes irradiados para CCP(33 Oton-Leite AF, Corrêa de Castro AC, Morais MO, et al. Effect of intraoral low-level laser therapy on quality of life of patients with head and neck cancer undergoing radiotherapy. Head Neck. 2012;34:398-404.,2020 Lopes CO, Mas JRI, Zângaro RA. Prevenção da xerostomia e da mucosite oral induzidas por radioterapia com o uso do laser de baixa potência. Radiol Bras. 2006;39:131-6.,2626 Simões A, de Campos L, de Souza DN, et al. Laser phototherapy as topical prophylaxis against radiation-induced xerostomia. Photomed Laser Surg. 2010;28:357-63.,2929 Campos L, Simões A, Sá PH, et al. Improvement in quality of life of an oncological patient by laser phototherapy. Photomed Laser Surg. 2009;27:371-4.). Não há relatos de estudos prévios com protocolos de laserterapia projetados especificamente para a estimulação direta de glândulas salivares nestes pacientes oncológicos e que também combinassem diferentes comprimentos de onda e aplicações extraorais e intraorais.
Considerando as limitações do estudo, acreditamos que os resultados foram satisfatórios. A manutenção do fluxo salivar após 30 dias da última sessão de RT e QT foi evidentemente mais efetiva nos pacientes que receberam a aplicação da luz laser durante o curso do tratamento. Apesar de a rotina da laserterapia ter requerido grande número de pontos de aplicação e ter sido executada por um período relativamente longo, foi bem tolerada pelos pacientes, que se mostraram mais receptivos ao tratamento. Além disso, apresentou-se viável em um hospital público que recebe grande número de doentes cotidianamente.
CONCLUSÃO
Avaliados em conjunto, os resultados obtidos demonstraram que o laser de baixa potência é um agente eficiente para atenuação da hipofunção salivar após RT e QT. A manutenção do fluxo salivar dentro da normalidade é bastante desejada após a finalização do tratamento oncológico, permitindo a prevenção ou redução de outros possíveis e posteriores efeitos radioinduzidos e quimioinduzidos, além de garantir menor impacto na qualidade de vida destes pacientes.
REFERENCES
-
1Ruback MJ, Galbiatti AL, Arantes LM, et al. Clinical and epidemiological characteristics of patients in the head and neck surgery department of a university hospital. Sao Paulo Med J. 2012;130:307-13.
-
2Rubira CM, Devides NJ, Ubeda LT, et al. Evaluation of some oral postradiotherapy sequelae in patients treated for head and neck tumors. Braz Oral Res. 2007;21:272-7.
-
3Oton-Leite AF, Corrêa de Castro AC, Morais MO, et al. Effect of intraoral low-level laser therapy on quality of life of patients with head and neck cancer undergoing radiotherapy. Head Neck. 2012;34:398-404.
-
4Brasil. Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Estimativa 2014: incidência de câncer no Brasil. Rio de Janeiro, RJ: INCA; 2014.
-
5Almeida FCS, Vaccarezza GF, Cazal C, et al. Avaliação odontológica de pacientes com câncer de boca pré e pós tratamento oncológico - uma proposta de protocolo. Pesqui Bras Odontopediatria Clín Integr. 2004;4:25-31.
-
6Withers HR. Radiation biology and treatment options in radiation oncology. Cancer Res. 1999;59(7 Suppl):1676s-1684s.
-
7Bonan PR, Pires FR, Lopes MA, et al. Evaluation of salivary flow in patients during head and neck radiotherapy. Pesqui Odontol Bras. 2003;17:156-60.
-
8Jellema AP, Slotman BJ, Doornaert P, et al. Impact of radiation-induced xerostomia on quality of life after primary radiotherapy among patients with head and neck cancer. Int J Radiat Oncol Biol Phys. 2007;69:751-60.
-
9Kakoei S, Haghdoost AA, Rad M, et al. Xerostomia after radiotherapy and its effect on quality of life in head and neck cancer patients. Arch Iran Med. 2012;15:214-8.
-
10Jensen SB, Pedersen AM, Reibel J, et al. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer. 2003;11:207-25.
-
11Vissink A, Jansma J, Spijkervet FK, et al. Oral sequelae of head and neck radiotherapy. Crit Rev Oral Biol Med. 2003;14:199-212.
-
12Lima AAS, Figueiredo MAZ, Krapf SMR, et al. Velocidade do fluxo e pH salivar após radioterapia da região de cabeça e pescoço. Rev Bras Cancerol. 2004;50:287-93.
-
13Cardoso MFA, Novikoff S, Tresso A, et al. Prevenção e controle das sequelas bucais em pacientes irradiados por tumores de cabeça e pescoço. Radiol Bras. 2005;38:107-15.
-
14Rosenthal DI, Trotti A. Strategies for managing radiation-induced mucositis in head and neck cancer. Semin Radiat Oncol. 2009;19: 29-34.
-
15Bachaud JM, David JM, Boussin G, et al. Combined postoperative radiotherapy and weekly cisplatin infusion for locally advanced squamous cell carcinoma of the head and neck: preliminary report of a randomized trial. Int J Radiat Oncol Biol Phys. 1991;20:243-6.
-
16Qin H, Luo J, Zhu YP, et al. Combination of taxanes, cisplatin and fluorouracil as induction chemotherapy for locally advanced head and neck cancer: a meta-analysis. PLoS One. 2012;7:e51526.
-
17Eisbruch A, Rhodus N, Rosenthal D, et al. How should we measure and report radiotherapy-induced xerostomia? Semin Radiat Oncol. 2003;13:226-34.
-
18Barros Pontes C, Polizello AC, Spadaro AC. Clinical and biochemical evaluation of the saliva of patients with xerostomia induced by radiotherapy. Braz Oral Res. 2004;18:69-74.
-
19Roesink JM, Moerland MA, Battermann JJ, et al. Quantitative dose-volume response analysis of changes in parotid gland function after radiotherapy in the head-and-neck region. Int J Radiat Oncol Biol Phys. 2001;51:938-46.
-
20Lopes CO, Mas JRI, Zângaro RA. Prevenção da xerostomia e da mucosite oral induzidas por radioterapia com o uso do laser de baixa potência. Radiol Bras. 2006;39:131-6.
-
21Guggenheimer J, Moore PA. Xerostomia: etiology, recognition and treatment. J Am Dent Assoc. 2003;134:61-9.
-
22Bomeli SR, Desai SC, Johnson JT, et al. Management of salivary flow in head and neck cancer patients - a systematic review. Oral Oncol. 2008;44:1000-8.
-
23Dirix P, Nuyts S, Vander Poorten V, et al. The influence of xerostomia after radiotherapy on quality of life: results of a questionnaire in head and neck cancer. Support Care Cancer. 2008;16:171-9.
-
24Zhang Y, Guo CB, Zhang L, et al. Prevention of radiation-induced xerostomia by submandibular gland transfer. Head Neck. 2012;34: 937-42.
-
25Vidovic Juras D, Lukac J, Cekic-Arambasin A, et al. Effects of low-level laser treatment on mouth dryness. Coll Antropol. 2010;34: 1039-43.
-
26Simões A, de Campos L, de Souza DN, et al. Laser phototherapy as topical prophylaxis against radiation-induced xerostomia. Photomed Laser Surg. 2010;28:357-63.
-
27Gautam AP, Fernandes DJ, Vidyasagar MS, et al. Effect of low-level laser therapy on patient reported measures of oral mucositis and quality of life in head and neck cancer patients receiving chemoradiotherapy - a randomized controlled trial. Support Care Cancer. 2013;21:1421-8.
-
28Radiation Therapy Oncology Group. A phase III study to test the efficacy of the prophylactic use of oral pilocarpine to reduce hyposalivation and mucositis associated with curative radiation therapy in head and neck cancer patients. RTOG97-09. Philadelphia, PA: Radiation Therapy Oncology Group; 1999. [cited 2014 Nov 24]. Available from: Available from: https://www.rtog.org/ClinicalTrials/ProtocolTable/StudyDetails.aspx?action=openFile&FileID=7573 .
» https://www.rtog.org/ClinicalTrials/ProtocolTable/StudyDetails.aspx?action=openFile&FileID=7573 -
29Campos L, Simões A, Sá PH, et al. Improvement in quality of life of an oncological patient by laser phototherapy. Photomed Laser Surg. 2009;27:371-4.
-
*
Trabalho realizado no Setor de Radioterapia do Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil.
Datas de Publicação
-
Publicação nesta coleção
Mar-Apr 2016
Histórico
-
Recebido
24 Dez 2014 -
Aceito
22 Maio 2015