Resumo
The susceptibility of Drosophila melanogaster to carbofuran and the use of this organism in biomonitoring residues of the insecticide in cabbage was evaluated. Under the conditions of the bioassay, residues-film bioassay in Petri dish, carbofuran degraded depending on the temperature and time of exposure. Bioassays conducted with D. melanogaster showed that its toxicity increases with temperature (20 to 35 °C). LC50 values, calculated as a function of temperature, ranged from 3.6 to 10.5 mg/g body weight (bw) for males and from 2.9 to 8.7 mg/g bw for females. The formulated product Furadan® G was applied on cabbage (Brassica oleracea, var. capitata) and the residues of carbofuran were determined by bioassay. The determination limit of the bioassay was 0.1 mg/kg and the method presented reproducibility with coefficient variation of 17 %. The validation of the bioassay by high performance liquid chromatography confirms the viability of the bioassay with D. melanogaster in monitoring the residues of carbofuran in cabbage.
carbofuran; bioassay; D. melanogaster; cabbage
carbofuran; bioassay; D. melanogaster; cabbage
Artigo
DROSOPHILA MELANOGASTER MEIGEN: 3. SENSIBILIDADE AO CARBOFURAN E BIOMONITORAMENTO DE SEUS RESÍDUOS EM REPOLHO
Garcia Rodrigues de Almeida*
Faculdade Adventista de Biologia, Centro Universitário Adventista, CP 12630, 05858-001 São Paulo - SP
Felix G. R. Reyes**
Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, CP 6121, 13083-970 Campinas - SP
Susanne Rath***
Instituto de Química, Universidade Estadual de Campinas, CP 6154, 13083-970 Campinas - SP
* e-mail: garcia@cablenet.com.br
** e-mail: reyesfgr@fea.unicamp.br
*** e-mail: raths@iqm.unicamp.br
Recebido em 11/9/00; aceito em 23/3/01
DROSOPHILA MELANOGASTER MEIGEN: 3. SUSCEPTIBILITY TO CARBOFURAN AND BIOMONITORING OF ITS RESIDUES IN CABBAGE. The susceptibility of Drosophila melanogaster to carbofuran and the use of this organism in biomonitoring residues of the insecticide in cabbage was evaluated. Under the conditions of the bioassay, residues-film bioassay in Petri dish, carbofuran degraded depending on the temperature and time of exposure. Bioassays conducted with D. melanogaster showed that its toxicity increases with temperature (20 to 35 °C). LC50 values, calculated as a function of temperature, ranged from 3.6 to 10.5 mg/g body weight (bw) for males and from 2.9 to 8.7 mg/g bw for females. The formulated product Furadan® G was applied on cabbage (Brassica oleracea, var. capitata) and the residues of carbofuran were determined by bioassay. The determination limit of the bioassay was 0.1 mg/kg and the method presented reproducibility with coefficient variation of 17 %. The validation of the bioassay by high performance liquid chromatography confirms the viability of the bioassay with D. melanogaster in monitoring the residues of carbofuran in cabbage.
Keywords: carbofuran; bioassay; D. melanogaster; cabbage.
INTRODUÇÃO
Carbofuran (2,3-diidro-2,2-dimetil-7-benzofuranil-N-metil carbamato) é um inseticida e nematicida do grupo dos carbamatos, que apresenta curta persistência no ambiente e pequeno deslocamento para regiões adjacentes, sendo efetivo por contato, ingestão e por ação sistêmica1,2.
O inseticida é aplicado no solo em culturas de algodão, amendoim, arroz, milho, trigo, feijão, banana, batata, café, cana-de-açúcar, cenoura, repolho, tomate, e utilizado no tratamento de sementes de algodão, arroz, trigo, milho e feijão, na época do plantio1.
O carbofuran é biotransformado por reações de hidrólise, hidroxilação e/ou oxidação produzindo nos animais e plantas, o 3-hidroxi-carbofuran como metabólito principal2. Este, por sua vez, se oxida a 3-ceto carbofuran, o qual por hidrólise produz o 3-ceto carbofuran fenol3,4. Os metabólitos 3-hidroxi carbofuran e 3-ceto carbofuran têm curta persistência no solo5, 6, são formados lentamente e apresentam baixa toxicidade aguda para insetos3,4.
No ambiente, a biodegradação do carbofuran é dependente da temperatura, da umidade, do pH do solo, da biomassa disponível, assim como da atividade degradativa da mesma7. Aplicações periódicas de carbofuran, no mesmo solo, aumentam a atividade degradativa do composto5,8, o que é devido ao maior crescimento de microrganismos capazes de utilizá-lo como fonte de carbono e nitrogênio9.
O valor da DL50 do carbofuran, reportado para mosca doméstica (Musca domestica) é de 4,6 - 6,7 mg/kg pc (exposição tópica) e de 2,0 mg/kg pc para camundongos (exposição oral)3,10,11. O Comitê de Peritos da FAO/OMS sobre Resíduos de Pesticidas (Joint Meeting on Pesticide Residues ¾ JMPR)12 relatou valores de DL50 (exposição oral) de 14,4 mg/kg pc para camundongos e de 6,0 -18,0 mg/kg pc para ratos.
O carbofuran é absorvido rapidamente, independentemente da via de administração e distribui-se nos órgãos, tecidos moles e esqueleto, sendo excretado como carbofuran nas fezes e seus metabólitos pelas vias urinária e pulmonar3,13,14,15. Os processos de detoxificação ocorrem por hidrólise, N-, S- e O-dealquilação e hidroxilação do anel fenólico10.
Os bioensaios com a mosca Drosophila melanogaster (Meig.) têm sido usados por alguns pesquisadores como indicador de resíduos de agrotóxicos em alimentos16,17,18 e da presença, no ambiente, de substâncias químicas com potencial mutagênico19. Cabe destacar que as drosófilas, além da sua elevada sensibilidade para detectar a presença de substâncias tóxicas, são insetos de fácil criação, manutenção e manipulação em condições de laboratório apresentando, assim, vantagens frente a outros organismos para a realização de bioensaios20,21.
Com o propósito de detectar resíduos de inseticidas em quantidades que possam apresentar perigo à saúde humana é necessário pesquisar e avaliar métodos alternativos de triagem que sejam satisfatórios, práticos e que reduzam significativamente os custos para o controle de qualidade de produtos alimentícios, especialmente os hortifrutigranjeiros, quanto à presença de agrotóxicos em geral e de inseticidas em particular22.
O objetivo deste estudo foi avaliar a sensibilidade das moscas D. melanogaster ao carbofuran e a viabilidade da sua utilização no biomonitoramento dos resíduos desse inseticida em produtos hortigranjeiros.
PARTE EXPERIMENTAL
Equipamentos
As análises por cromatografia líquida de alta eficiência foram realizadas em Cromatógrafo Líquido Waters, modelo 486, com detector UV/VIS Waters, injetor Rheodyne e integrador CHROMJET. Como fase estacionária foi utilizada coluna cromatográfica de fase reversa RP-18 LiChroCart, 125 mm x 4 mm (Merck).
A aplicação do inseticida foi realizada mediante pulverizador costal Jato (20 L) provido com bico tipo jato cônico para aplicação em alto volume.
Solventes e reagentes
Todos os solventes e reagentes utilizados foram de grau para análise de resíduos, Merck. O sulfato de sódio anidro e o florisil foram aquecidos a 400 oC, durante 8 horas; antes do uso, a resina foi desativada com 2 % de água. Como padrão analítico foi utilizado carbofuran (99,5 %) e para os experimentos, o produto comercial Furadan® G.
Criação das moscas D. melanogaster
As moscas D. melanogaster, usadas para a realização dos bioensaios, foram criadas em ambiente com temperatura de 25 ± 2 °C, a partir de cepas cedidas pelo Laboratório de Toxicologia do Instituto Biológico de São Paulo.
O meio de cultura foi preparado conforme Joseph & Knobel23, com modificações sugeridas por Almeida & Reyes16. O meio, recém-preparado, foi distribuído em frasco de vidro transparente, de boca larga (50 mL/frasco) e conservados em refrigerador até o momento do uso.
Drosófilas machos e fêmeas, num total de quinze moscas para cada sexo, foram transferidas para os frascos de cultura e mantidas à temperatura de 25 ± 2 °C. No oitavo dia, foram removidas dos frascos, remanescendo as larvas. Após 48 h do início da emergência, as novas moscas foram transferidas para outro frasco de cultura, procedimento que foi repetido a cada 48 h, para obtenção de novos lotes de moscas.
Bioensaio
No bioensaio utilizou-se o método do filme seco24 em placa de Petri (50 x 20 mm). O filme foi preparado mediante aplicação de 0,10 mL de solução inseticida por placa. O procedimento do bioensaio foi realizado conforme descrito por Almeida & Reyes16.
Para avaliação da concentração letal mediana (CL50) foi utilizada a formulação Furadan® G, sendo que as concentrações do princípio ativo, carbofuran, nas soluções utilizadas variaram entre 0,3 a 2,5 µg/mL para as temperaturas 20, 25, 30 e 35 ºC. Alíquotas de 0,10 mL dessas soluções foram aplicadas nas placas de Petri.
Estabilidade do carbofuran no bioensaio
A estabilidade do carbofuran foi avaliada nas condições do bioensaio aplicando-se na placa de Petri 0,10 mL de solução inseticida de concentração 50 µg/mL e seguido o procedimento descrito por Almeida & Reyes16. O carbofuran residual foi determinado por cromatografia líquida de alta eficiência (CLAE) nas seguintes condições de trabalho: fase móvel: metanol:água (1:1 v/v), fluxo 0,5 mL/min e detecção UV a 220 nm.
Ensaio de campo
Repolho (Brassica oleracea, var. capitata) foi cultivado, segundo as boas práticas agrícolas, no campo experimental do Instituto Adventista São Paulo, em Hortolândia, SP.
As mudas foram plantadas em junho, com espaçamento de 60 x 80 cm, em área com aproximadamente 200 m2, dividida em duas partes iguais. Por ocasião do repique das mudas, foi aplicado, na metade da área cultivada, o produto formulado Furadan® G, na proporção de 4,0 - 5,0 g/cova, equivalente a 0,2 - 0,25 g do ingrediente ativo/cova. A área não tratada serviu como controle.
Amostras de repolho foram colhidas aleatoriamente 30 dias após o plantio, embaladas em sacos de plástico, transportadas para o laboratório e congeladas a - 20 ºC, no máximo 30 min após a colheita.
Validação do bioensaio
Para validação do método de bioensaio, extratos de amostras de repolho tratado com Furadan® G foram também analisados por CLAE conforme o fluxograma apresentado na Figura 1.
Na quantificação por CLAE os resíduos do carbofuran foram determinados conforme a metodologia proposta por Lawrence & Leduc25, com modificações. Para tanto, de uma amostra de repolho triturado e homogeneizado, de aproximadamente 1 kg, foram transferidos 20 g para um erlenmeyer (250 mL) e, após ser adicionado 100 mL de acetona e agitado durante 5 minutos, a mistura foi filtrada em funil de Büchner, com papel-filtro Whatman n° 1 e o resíduo lavado com 50 mL de acetona. Ao filtrado, transferido para um funil de separação (500 mL), acrescentou-se 200 mL de diclorometano:n-hexano (1:1 v/v). Após agitação vigorosa da mistura por 2 minutos, separou-se a fase a orgânica. A fase aquosa foi transferida para outro funil de separação (250 mL), contendo 15 mL de solução aquosa saturada de NaCl, sendo extraída com duas porções de 20 mL de diclorometano. A fase orgânica total, adicionada de 5 g de Na2SO4 anidro, foi agitada, deixada em repouso durante 10 min e, posteriormente, percolada por uma coluna de Na2SO4 anidro e lavada com 10 mL de diclorometano. O eluato foi transferido para um balão de fundo redondo, concentrado em evaporador rotatório à temperatura de 30 °C, até aproximadamente 1 mL, o qual foi transferido para um tubo concentrador e ressuspendido, em metanol para 10 mL.
A limpeza do extrato foi realizada em uma coluna cromatográfica (200 x 15 mm) contendo 5 g de florisil desativado com 2 % de água e, no topo, cerca de 1 g de Na2SO4 anidro e, previamente lavada com 50 mL de n-hexano. Após a adição de 5 mL do extrato, o resíduo foi eluido da coluna com 100 mL de n-hexano. O eluato foi concentrado em evaporador rotatório a 30 °C até quase à secura e transferido com 10 mL de n-hexano para tubo concentrador graduado. O solvente foi removido com nitrogênio, o tubo lavado com n-hexano, seco novamente com nitrogênio, diluído com 2 mL de metanol e injetado 10 µL no cromatógrafo líquido, nas condições de trabalho anteriormente estabelecidas.
Para avaliação da metodologia quanto à recuperação e sensibilidade, amostras de repolho (20 g) livre de inseticidas, foram adicionadas de 2 mL de solução padrão do inseticida nas concentrações de 10,0 e 1,0 µg/mL, caracterizando fortificações de 1,0 e 0,1 mg/kg de amostra, respectivamente.
Para quantificação dos resíduos do carbofuran por bioensaio (Figura 2), placas testemunha e aquelas preparadas com diferentes alíquotas do extrato (número de repetições para as diferentes alíquotas do extrato, n=3), foram mantidas durante 24 h a 30 ºC, para calcular o volume de extrato necessário para provocar a morte de 50 % da população teste.
Cálculo da CL50
Na avaliação da CL50 levou-se em consideração as moscas mortas e as moribundas, observadas no momento da contagem20. Os cálculos dos valores da CL50 foram efetuados por análise de probito26.
Análise estatística
Os dados obtidos no bioensaio foram avaliados por análise de variância (ANOVA). O teste de Tukey (P < 0,05) foi utilizado para verificar se havia diferença entre os resultados obtidos para as moscas machos e fêmeas e também para as temperaturas consideradas no bioensaio. Os cálculos foram feitos utilizando-se um software estatístico S.A.S.
RESULTADOS E DISCUSSÃO
A toxicidade dos inseticidas depende da temperatura de exposição e de outros fatores como sua formulação, concentração, método de administração, espécie e estágio de desenvolvimento do inseto 27.
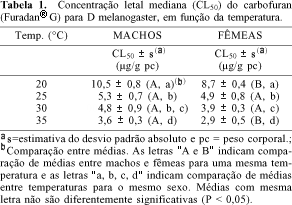
Os valores de CL50 para as moscas D. melanogaster, machos e fêmeas, em função da variação da temperatura, são apresentados na Tabela 1. Os dados mostram que as drosófilas machos e fêmeas apresentaram susceptibilidade semelhante ao carbofuran, sendo que as fêmeas mostraram-se significativamente (P < 0,05) mais susceptíveis a ação do inseticida nos bioensaios realizados a 20 e 35 ºC. Verifica-se, ainda, que a 35 °C a sensibilidade ao carbofuran foi, aproximadamente, 3 vezes maior do que a 20 °C, o que pode ser devido a uma absorção mais rápida do inseticida com o aumento da temperatura. Esse comportamento é semelhante ao relatado por outros pesquisadores, utilizando diferentes inseticidas e sistemas biológicos27,28,29. Ainda, essa diferença na resposta foi sugerida como um artifício para aumentar a sensibilidade do bioensaio30.
O estudo da degradação do carbofuran em função do tempo de exposição e da variação da temperatura foi conduzido para avaliar a quantidade do inseticida que estaria disponível nas placas, durante a realização do bioensaio, pelo método do filme seco24. Os valores da percentagem residual do carbofuran, remanescente nas placas de Petri, após 6, 12 e 24 h nas temperaturas de 20, 25, 30 e 35 °C, são apresentados na Figura 3. Verifica-se que a degradação do carbofuran é proporcional tanto ao tempo de exposição, como à variação da temperatura.
Os bioensaios com D. melanogaster para detecção dos resíduos do carbofuran em repolho foram conduzidos em temperatura de 30 °C, durante 24 h de exposição. Assim, diferentes volumes do extrato foram usados para determinar o volume necessário para provocar a morte de 50 % da população teste. A massa do carbofuran contida nesse volume (Tabela 2), relacionada àquela correspondente à CL50 a 30 ºC (Tabela 1) permitiu estimar o nível de resíduo do carbofuran no repolho (Tabela 3).
A sensibilidade dos métodos químicos de análise de resíduos, assim como os valores do limite máximo de resíduos estabelecidos pela legislação de agrotóxicos, exigem que os organismos usados nos bioensaios sejam suficientemente sensíveis para detectar níveis residuais menores do que 1,0 mg/kg17,18.
O limite de determinação calculado para o método do bioensaio, foi de 0,07 e 0,09 mg de carbofuran/kg de amostra para as drosófilas machos e fêmeas, respectivamente. Esse valor foi obtido considerando-se que de 2 mL de um extrato purificado de couve (20 g), uma alíquota de 0,1 mL provocou a morte de 50 % da população teste. Ainda, três repetições na análise de uma mesma amostra de repolho mostraram para o método de bioensaio um coeficiente de variação de 17 %, indicando boa reprodutibilidade, quando comparado aos de até 20 %, considerados aceitáveis na determinação de contaminantes traço31. Esses resultados confirmam a elevada sensibilidade das moscas D. melanogaster ao carbofuran e fortalecem a confiabilidade de sua utilização nos bioensaios com a finalidade de quantificar resíduos de inseticidas em produtos agrícolas.
Para detectar a possível presença, no repolho, de substâncias naturais com ação inseticida que poderiam interferir nos resultados do bioensaio32, amostras de extratos isentos de agrotóxicos foram avaliados pelo bioensaio. Todas as moscas sobreviveram ao teste, resultado que indica ausência ou a presença em níveis não-letais de substâncias tóxicas para esse inseto.
Com intuito de validar o método biológico, os mesmos extratos utilizados nos bioensaios foram analisados, quanto ao teor de carbofuran, por CLAE. Na Tabela 3, são apresentados os níveis de resíduos do carbofuran determinados no repolho 30 dias após a aplicação do inseticida. Verifica-se que não existe diferença significativa entre os valores obtidos por ambos os métodos (P <0,01).
Na determinação por CLAE, a faixa de linearidade da curva analítica (y = 26148,86x + 1828,12, onde y: área do pico em 12,4 min e x: concentração de carbofuran em mg/mL) foi de 1,0 a 10,0 µg/mL, com um coeficiente de correlação linear de 0,999. Os limites de detecção e determinação do método, calculados a partir da curva analítica, foram de 0,03 e 0,1 mg de carbofuran/kg de amostra, respectivamente. Os valores de recuperação do carbofuran nas amostras de repolho fortificadas com teores de inseticida de 0,1 mg/kg e 1,0 mg/kg foram, respectivamente, 100 % e 71 %, valores que se encontram dentro ou próximos da faixa de 80 a 120 % aceita internacionalmente31, o que indica que as modificações introduzidas no método de Lawrence & Leduc25, não afetaram a sua confiabilidade e aplicabilidade.
Embora os métodos cromatográficos sejam de grande sensibilidade, a sua utilização, do ponto de vista econômico, é limitada para o monitoramento de resíduos de inseticidas em alimentos, especialmente nos países emergentes, devido aos custos elevados de equipamentos e reagentes. Ainda, nesses países, inseticidas e outros pesticidas freqüentemente são usados em culturas para as quais não são autorizados e/ou de modo excessivo e indiscriminado o que pode resultar em resíduos acima dos níveis permitidos em alimentos.
Comparado ao método de CLAE o de bioensaio apresenta, além de baixo custo e simplicidade de execução, limite de determinação adequado e boa reprodutibilidade, qualidades necessárias para o monitoramento de resíduos de agrotóxicos em alimentos.
CONCLUSÕES
Os bioensaios com Drosophila melanogaster demonstraram a sua elevada sensibilidade para a detecção de resíduos de carborfuran em repolho, ficando evidente a possibilidade de utilização desses organismos para os bioensaios destinados ao monitoramento de resíduos de carbofuran nesta ou em outras matrizes. Em comparação à CLAE, o método de bioensaio apresenta baixo custo e simplicidade de execução, sem comprometer o padrão de acuidade necessário para o monitoramento de resíduos de pesticidas em alimentos.
AGRADECIMENTOS
Os autores agradecem ao Dr. F. Puga, Instituto Biológico de São Paulo, pela doação das cepas de D. melanogaster, ao Centro de Química de Alimentos e Nutrição Aplicada / Laboratório de Análise de Resíduos de Pesticidas do ITAL, pela doação do padrão analítico e ao Serviço de Análise e Diagnósticos / Laboratório de Agrotóxicos da CATI, Campinas, SP, pela doação do produto técnico. G. R. de Almeida agradece a CAPES pela bolsa de estudos e ao Instituto Adventista de Ensino - Campus São Paulo, pelo apoio recebido.
-
1ILSI BRASIL; Relação de substâncias para uso fitossanitário e domissanitário: Portarias do Ministério da Saúde International Life Sciences Institute do Brasil, São Paulo, 1995; p 716.
- 2. Kuhr, R. J.; Dorough, H. W.; Carbamate insecticides: Chemistry, Biochemistry and Toxicology; CRC Press; Cleveland, Ohio, 1976; p 178.
- 3. Metcalf, R. L.; Fukuto, T. R.; Collins, C.; Borck K.; El-Aziz, S. A.; Munoz, R.; Cassil, C. C.; J. Agric. Food Chem. 1968, 16, 300.
- 4. Talebi, K.; Walker, C. H.; Pestic. Sci 1993, 39, 65.
- 5. Felsot, A,; Maddox, J. V.; Bruce, W.; Bull. Environ. Contam. Toxicol. 1981, 26, 781.
- 6. Williams, I. H.; Pepin, H. S.; Brown, M. J.; Bull. Environ. Contam. Toxicol. 1976, 15, 244.
- 7. Parkin, T. R.; Shelton, D. R.; Pestic. Sci 1994, 40, 163.
- 8. Felsot, A. S.; Ann. Rev. Entomol 1989, 34, 453.
- 9. Charnay, M. P.; Fournier, J. C.; Pestic. Sci 1994, 40, 207.
- 10. Metcalf, R. L.; Osman, M. F.; Fukuto, T. R.; J. Econ. Entomol 1967, 60, 445.
- 11. Yu, C.; Metcalf, R. L.; Booth, G. M.; J. Agric. Food Chem 1972, 20, 923.
-
12JMPR ¾ Joint FAO/WHO Meeting on Pesticide Residues in Food. 1996 Evaluations Part II ¾ Toxicological. World Health Organization; Geneva. 1997; p 23-43.
- 13. Ahdaya, S.; Guthrie, F. E.; Toxicol. 1982, 22, 311.
- 14. Dorough, H. W.; Bull. Environ. Contam. Toxicol. 1968, 16, 319.
- 15. Shah, P. V.; Monroe, R. J.; Guthrie, F. E.; Toxicol. Appl. Pharmacol 1981, 59, 414.
- 16. Almeida, G. R.; Reyes, F. G. R.; Rev. Inst. Adolfo Lutz, 1999, 58, 15.
- 17. Bagdonas, M.; Mello, M. H. S. H.; Ungaro, M. T. S.; Guindani, C. M. A.; Ferreira, M. S.; Gaeta, R.; Rev. Soc. Brasil. Toxicol. l988, 1, 3.
- 18. Puga, F. R.; Rubano, S. In Métodos prácticos para detección de resíduos de plaguicidas; Almeida, V. F., Ed.; Centro Panamericano de Ecologia Humana y Salud, OPS/OMS, Mexico, 1987; p 37.
- 19. Zimmering, S.; Ann. N. Y. Acad. Sci 1975, 269, 26.
- 20. Bartlett, B. R.; J. Econ. Entomol 1951, 44, 621.
- 21. Sun, Y. P.; Pankaskie, J. E.; J. Econ. Entomol. 1954, 47, 180.
- 22. Almeida, W. F. Métodos prácticos para detección de resíduos de plaguicidas Centro Panamericano de Ecologia Humana y Salud, OPS/OMS, México: 1987; p 1-54.
- 23. Joseph Jr, H.; Knobel, M. G.; Rev. Inst. Adolfo Lutz 1980, 40, 43.
- 24. Laug, E. P.; Jour. Pharm. Exptl. Terap 1946, 86, 324.
- 25. Lawrence, J. F.; Leduc, B.; J. Assoc. Off. Anal. Chem. 1978, 61, 872.
- 26. Hoffmann, R.; Análise de probito com determinaçăo da dose letal mediana ž Programa probito. Escola Superior de Agricultura Luiz de Queiroz (ESALQ), USP, Piracicaba, SP, Maio de 1990.
- 27. Harris, C. R.; J. Econ. Entomol 1971, 64, 1044.
- 28. Guthrie, F. E.; J. Econ. Entomol. 1950, 43, 559.
- 29. Harris, C. R.; Kinoshita, G. B.; J. Econ. Entomol. 1977, 70, 215.
- 30. Sun, Y. P.; Johnson, E. R. Pankaskie, J. E. Earle, N. W.; Sun, J. T.; J. Assoc. Off. Anal. Chem 1963, 46, 530.
- 31. Horwitz, W.; Kamps, L. R.; Boyer, K. W.; J. Assoc. Off. Anal. Chem. 1980, 63, 1344.
- 32. Lichtenstein, E. P.; Morgan, D. G.; Mueller, C. H.; J. Agric. Food Chem 1964, 12, 138.
Datas de Publicação
-
Publicação nesta coleção
08 Fev 2002 -
Data do Fascículo
Dez 2001
Histórico
-
Recebido
11 Set 2000 -
Aceito
23 Mar 2001