Resumo
The oleochemical industry has a permanent interested in controlling the physical, functional and organoleptical properties of their products and in producing useful derivatives from their raw materials. The potential of biotechnology for developing novel or well-known products at more competitive costs meets the need of this industrial segment in expanding their goals. In this work some technical aspects, problems and perspectives related to the production of oil and fat derivatives using biotransformation techniques are discussed. Particular emphasis is given to the description of biotransformation processes using lipase as catalyst, in view of the great versatility of this enzyme class to mediate typical reactions in this technological sector.
oil and fats; biotransformations; industrial applications
oil and fats; biotransformations; industrial applications
DIVULGAÇÃO
Modificação de óleos e gorduras por biotransformação
Modification of oils and fats by biotransformation
Heizir F. de CastroI, * * e-mail: heizir@dequi.faenquil.br ; Adriano A. MendesI; Júlio C. dos SantosI; Cláudio L. de AguiarII
IDepartamento de Engenharia Química, Faculdade de Engenharia Química de Lorena, CP 116, 12606-970 Lorena - SP
IIDepartamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, CP 6121, 13083-970 Campinas - SP
ABSTRACT
The oleochemical industry has a permanent interested in controlling the physical, functional and organoleptical properties of their products and in producing useful derivatives from their raw materials. The potential of biotechnology for developing novel or well-known products at more competitive costs meets the need of this industrial segment in expanding their goals. In this work some technical aspects, problems and perspectives related to the production of oil and fat derivatives using biotransformation techniques are discussed. Particular emphasis is given to the description of biotransformation processes using lipase as catalyst, in view of the great versatility of this enzyme class to mediate typical reactions in this technological sector.
Keywords: oil and fats; biotransformations; industrial applications.
LIMITAÇÕES ATUAIS DA TECNOLOGIA DE MODIFICAÇÃO DE ÓLEOS E GORDURAS
Óleos e gorduras têm um papel fundamental na alimentação humana. Além de fornecerem calorias, agem como veículo para as vitaminas lipossolúveis, como A, D, E e K1. Também são fontes de ácidos graxos essenciais como o linoleico, linolênico e araquidônico e contribuem para a palatabilidade dos alimentos2,3.
Nos últimos quinze anos tem surgido um crescente interesse na tecnologia de modificação dos óleos e gorduras1,4-6. Esta tendência pode ser atribuída principalmente ao fato desses materiais serem obtidos de fontes naturais e empregados como importantes matérias-primas para as indústrias químicas, farmacêuticas e alimentícias. Mundialmente é estimada uma produção anual de óleos e gorduras de aproximadamente 100 milhões de toneladas7.
Os componentes mais expressivos dos óleos e gorduras são os triglicerídeos e suas propriedades físicas dependem da estrutura e distribuição dos ácidos graxos presentes1,8. Os óleos e gorduras naturais podem ser o único constituinte de um produto ou podem fazer parte da mistura de diversos constituintes em um composto. Existem casos, entretanto, que se torna necessário modificar as características desses materiais, para adequá-los a uma determinada aplicação. Portanto, o setor industrial de óleos e gorduras tem desenvolvido diversos processos para manipular a composição das misturas de triglicerídeos9-11.
A estrutura básica dos óleos e gorduras pode ser redesenhada, por meio da modificação química dos ácidos graxos (hidrogenação), pela reversão da ligação éster (hidrólise) e reorganização dos ácidos graxos na cadeia principal do triglicerídeo (interesterificação)1,11 .
A hidrólise é geralmente conduzida sob pressão da ordem de 4,83 MPa e temperatura ao redor de 250 ºC, por um período máximo de 2 h, obtendo-se rendimentos entre 96 a 99%. Os produtos resultantes são ácidos graxos extremamente escuros e uma solução aquosa rica em glicerol, que necessitam ser redestilados para remoção da cor e de subprodutos. Depois da destilação, alguns desses produtos encontram aplicação direta e outros são quimicamente processados, fornecendo uma variedade de outros produtos1,8.
O processo de interesterificação é normalmente empregado para modificar as características físicas e propriedades das misturas de óleos e gorduras, por meio da alteração da distribuição dos grupos glicéricos1,11. Nesse processo, catalisadores químicos alcalinos como sódio metálico e metilato de sódio são usados para promover a migração dos grupos acila, de modo que os produtos formados sejam misturas de resíduos acila de ácidos graxos, distribuídos aleatoriamente. O processo é conduzido em grande escala, em regime descontínuo ou contínuo, em temperatura de 260 ºC e pressão de 5 MPa, particularmente, para produção de gorduras usadas em margarinas1.
Sem levar em consideração os outros processos existentes, como hidrogenação e fracionamento, pode-se afirmar que as limitações na obtenção desses produtos estão associadas aos tipos de catalisadores químicos empregados, que são pouco versáteis e requerem altas temperaturas para atingir razoável velocidade de reação. Além disso, possuindo baixa especificidade, geralmente fornecem produtos de composição química mista ou contaminada, que requerem uma etapa posterior de purificação.
Nesse contexto, o enfoque biotecnológico vem se apresentando como uma alternativa atrativa para exploração na indústria de óleos e gorduras (Tabela 1)11, principalmente quando são consideradas algumas das vantagens dessa rota, tais como maior rendimento do processo, obtenção de produtos biodegradáveis, menor consumo de energia, redução da quantidade de resíduos, introdução de rotas mais acessíveis de produção9,11-13.
A área da biotecnologia, que pode alcançar as metas acima traçadas, é denominada de biotransformação14. O tópico abordado neste trabalho insere-se nesta nova área de atuação da biotecnologia, que explora a ação específica e diferenciada do imenso número de catalisadores existentes na natureza, as enzimas15,16.
BIOTRANSFORMAÇÃO
O termo biotransformação pode ser aplicado às modificações específicas ou interconversões da estrutura química realizadas por catalisadores bioquímicos14. Os óleos e gorduras são matérias-primas versáteis para aplicação desta tecnologia, sendo inúmeros os processos implementados em escala comercial13,16-18. A escolha do tipo de biocatalisador é efetuada entre microorganismos vivos íntegros ou outros materiais biológicos como RNA, anticorpos ou enzimas isoladas ou contidas em células14,19. O uso de enzimas isoladas é preferível, quando existirem limitações com relação à permeabilidade do substrato na membrana da célula, ou quando ocorrerem reações secundárias indesejáveis16-18.
Enzimas isoladas ou purificadas possuem um número de propriedades que tornam seu uso atrativo como catalisador em biotransformação, tais como alta eficiência catalítica (podem elevar a velocidade de uma reação de 108 a 1012 vezes); seletividade; atuação em condições brandas de temperatura (30 a 70 ºC) e em pressão atmosférica15-17.
Com um mercado crescente e promissor, a maior parte da produção de enzimas ainda é destinada às indústrias de detergente e amido. Num estudo realizado por Shanley20, o mercado mundial de enzimas foi estimado em cerca de US$ 1.355 milhões por ano, conforme dados apresentados na Tabela 2.
Enquanto o número de companhias que comercializam enzimas está próximo do milhar, o número de produtores é muito inferior. Ao todo, nos Estados Unidos e parte oeste da Europa, existem apenas cerca de 30 indústrias produtoras de enzimas. Muitos produtores são do ramo da indústria químico-farmacêutica, para os quais o lucro proveniente da comercialização das enzimas desempenha um papel pouco significativo no seu faturamento global. Cerca de 90% da produção anual provém das maiores empresas produtoras de enzima20, como Novozymes com sede na Dinamarca; Gist Brocades, na Holanda; Amano, no Japão; Solvay, Pfizer e Genencor, nos Estados Unidos.
O interesse industrial por tecnologias enzimáticas vem aumentando gradativamente, principalmente, nas áreas de engenharia de proteínas21 e enzimologia em meios não convencionais14, as quais ampliaram consideravelmente o potencial de aplicação das enzimas como catalisadores em processos industriais16-18. Entre os processos de maior interesse estão as reações de hidrólise, síntese e interesterificação de lipídeos por meio das lipases18. As razões do enorme potencial biotecnológico dessa enzima incluem fatos relacionados com: i) sua alta estabilidade em solventes orgânicos; ii) não requerem a presença de co-fatores; iii) possuem uma larga especificidade pelo substrato e, iv) exibem uma alta enantiosseletividade22.
O reconhecimento dessas vantagens tem proporcionado um aumento considerável na produção e comercialização de lipases, resultando no desenvolvimento de tecnologias alternativas consistentes para utilização no setor industrial23-29. Atualmente, o maior consumidor da enzima lipase é a indústria de formulação de detergentes17,22, na qual é usada geralmente em combinação com outras enzimas (proteases e celulases), sendo responsável pela remoção de manchas de gordura tais como batom, fritura, manteiga, azeite, molhos e as difíceis manchas em colarinhos e punhos. Lipolase (Humicola lanuginosa lipase-Novozymes) é empregada na formulação de um grande número de marcas importantes de detergentes em todo mundo, desde 1988. Lipolase Ultra foi lançada, em 1995, com melhor desempenho de lavagem17. Dez anos após a primeira Lipolase ter sido comercializada, foi lançada uma nova versão (LipoPrime) que garante retirada completa das manchas gordurosas em um único ciclo de lavagem30. Outros produtos, como o "Lumafast" (Genencor) e o "Lipomax" (Gist Brocades), contêm lipases extracelulares de Pseudomonas com estabilidade e atividade ótimas sob as condições de lavagem23.
Embora, atualmente, as aplicações industriais das lipases estejam concentradas nas indústrias de detergentes, novas aplicações vêm se estabelecendo nos mais diversos campos, tais como indústria farmacêutica31-33, química fina33,34, cosméticos24,33, oleoquímica27,33,34, couros35, polpa de celulose e papel22,26,33 e no tratamento de resíduos industriais22,36,37. As lipases vêm, deste modo, conquistando uma faixa crescente do mercado de enzimas industriais.
O interesse crescente em lipases pode também ser constatado pelo aumento no número de excelentes monografias e artigos de revisão cobrindo aspectos referentes à biologia molecular21,24, propriedades bioquímicas23,24,38 e, em particular, sua aplicação na indústria de óleos e gorduras11-13,39.
LIPASES COMO CATALISADORES
Fontes e propriedades
As lipases são enzimas classificadas como hidrolases (glicerol éster hidrolases, E.C. 3.1.1.3) e atuam sobre a ligação éster de vários compostos, sendo os acilgliceróis seus melhores substratos22. São comumente encontradas na natureza, podendo ser obtidas a partir de fontes animais, vegetais e microbianas24. Inicialmente, eram obtidas a partir de pâncreas de animais e usadas como auxiliar digestivo para consumo humano18,24. Em função do baixo rendimento do processo fermentativo, as lipases microbianas tinham também um custo bem mais elevado quando comparado com outras hidrolases, como proteases e carboxilases. Entretanto, os recentes avanços registrados na tecnologia do DNA têm permitido aos fabricantes de enzimas colocar no mercado lipases microbianas com atividade bem elevada, a um custo bem mais acessível18. Atualmente, lipases microbianas são produzidas por diversas indústrias, como Novozymes, Amano, Gist Brocades, entre outras. Uma publicação recente sobre a disponibilidade comercial de lipases listou enzimas de 34 diferentes fontes, incluindo 18 a partir de fungos e 7 de bactérias22. Nesta mesma publicação é destacada a existência de uma confusão considerável sobre a origem de algumas lipases e de mudanças nos nomes sistemáticos de linhagens fúngicas e bacterianas que produzem estas enzimas: Candida rugosa era anteriormente denominada de Candida cylindracea; Thermomyces lanuginosus de Humicola lanuginosa; Pseudomonas glumae e Pseudomonas cepacia foram renomeadas como Burkholderia glumae e Burkholderia cepacia, respectivamente. Além disso, a lipase Burkholderia glumae é idêntica à Chromobacterium viscosum.
Dependendo da fonte, as lipases podem ter massa molecular variando entre 20 a 75 kDa, atividade em pH na faixa entre 4 a 9 e em temperaturas variando desde a ambiente até 70 °C. Lipases são usualmente estáveis em soluções aquosas neutras à temperatura ambiente apresentando, em sua maioria, uma atividade ótima na faixa de temperatura entre 30 e 40 °C18. Contudo, sua termoestabilidade varia consideravelmente em função da origem, sendo as lipases microbianas as que possuem maior estabilidade térmica18,24.
Estrutura e mecanismo de atuação
A estrutura tridimensional da lipase fúngica de Rhizomucor miehei e da lipase pancreática foram determinadas em 199022. Desde então, mais de onze estruturas de lipases já foram determinadas, das quais, com exceção da lipase pancreática, todas são de origem microbiana22,24. Estas enzimas mostram uma característica padrão conhecida como o entrelaçado de a/b hidrolase22,41.
O sítio ativo da lipase é formado por uma tríade catalítica constituída pelos aminoácidos: serina, ácido aspártico (ou glutâmico) e histidina; o resíduo nucleofílico serina é localizado no C-terminal da fita b5 de um pentapeptídeo GXSXG altamente conservado, formando uma característica principal "b em torno de a", designada como a cavidade nucleofílica22,41. O sítio é composto de uma folha b central consistindo de 8 diferentes fitas b (b1-b8) conectadas com seis a hélices (A-F)41.
A hidrólise do substrato inicia-se com o ataque nucleofílico pelo oxigênio da serina no átomo de carbono carbonílico na ligação éster, levando à formação de um intermediário tetraédrico estabilizado pelas ligações do hidrogênio a átomos de nitrogênio de resíduos da cadeia principal pertencente à cavidade de oxiânion. Um álcool é liberado após a formação do complexo acil-lipase, o qual é finalmente hidrolisado com a liberação dos ácidos graxos e regeneração da enzima22,42.
As reações lipolíticas ocorrem na interface água-lipídeo podendo, em alguns casos, impedir que as cinéticas das reações enzimáticas sejam descritas pelas equações do tipo Michaelis-Menten, que só são válidas se a reação catalítica ocorrer em fase homogênea33. Substratos lipolíticos usualmente formam um equilíbrio entre os estados monoméricos, micelar e emulsificados, resultando na necessidade de um modelo de sistema adequado ao estudo da cinética da lipase. A técnica de camada única tem sido usada extensivamente e, mais recentemente, a tecnologia gota-óleo foi proposta para estabelecimento da cinética da lipase, que é monitorada pela análise automática do perfil de uma gota de óleo suspensa em água; a redução na tensão superficial entre o óleo e a água causada pela hidrólise da lipase é medida em função do tempo22,42.
O fenômeno mais conhecido originado de estudos cinéticos recentes de reações lipolíticas é a "ativação interfacial", que relaciona o aumento da atividade da lipase em função de substratos insolúveis, que formam emulsão22,24. Lipases, diferentemente das esterases, são definidas como carboxilesterases que atuam em substratos emulsificados22,41.
A determinação da estrutura tridimensional da lipase fornece uma explicação elegante para a ativação interfacial. O sítio ativo das lipases é coberto por uma superfície entrelaçada, denominada de tampa (ou borda). Quando há ligação do substrato na superfície da enzima, esta tampa move-se, alterando a forma fechada da enzima para a forma aberta, com o centro ativo agora acessível ao substrato e, ao mesmo tempo, expondo uma larga superfície hidrofóbica que facilita a ligação da lipase à interface22,41.
Recentemente, revelou-se que a presença de uma estrutura em forma de tampa não está necessariamente correlacionada com a ativação interfacial. Lipases de origem microbiana (Pseudomonas aeruginosa, Burkholderia glumae e Candida antarctica B) e uma lipase pancreática não específica não mostraram ativação interfacial, embora apresentem uma "tampa" anfifílica cobrindo seus sítios ativos. Esta observação sugere que a presença de uma tampa dominante e a ativação interfacial não são critérios adequados para classificar uma enzima como a lipase. Portanto, a definição atual é bastante simples: uma lipase é uma carboxiesterase que catalisa a hidrólise de acilglicerol de cadeia longa22.
Reações catalisadas pelas lipases
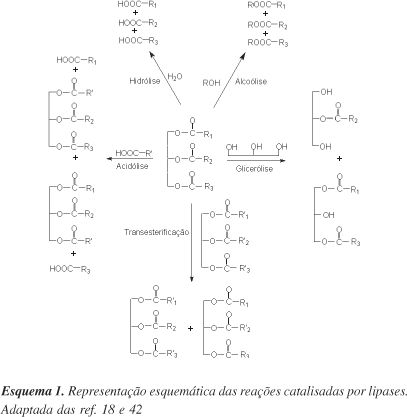
As lipases catalisam uma série de diferentes reações24,43. Além de quebrar as ligações de éster de triacilgliceróis com o consumo de moléculas de água (hidrólise), as lipases são também capazes de catalisar a reação reversa sob condições microaquosas, como por exemplo, a formação de ligações éster, a partir de um álcool e ácido carboxílico (síntese de éster)26,27. Estes dois processos básicos podem ser combinados numa seqüência lógica para resultar em reações de interesterificação (acidólise, alcoólise e transesterificação), dependendo dos reagentes de partida empregados (Esquema 1)18,42.
Outros compostos, além de água e álcool, podem ser utilizados como nucleófilos em reações catalisadas por estas enzimas. Desta forma, as lipases podem participar de reações como aminólises, tiotransesterificações e oximólises, em solventes orgânicos, com elevada seletividade40,43. O uso deste biocatalisador em aminólise de ésteres, em meios anidros, tem sido bem sucedido na síntese de peptídeos e amidas de ácidos graxos24. Esses resultados são promissores para a utilização de tecnologia de lipases em síntese de peptídeos opticamente ativos, polímeros, surfactantes e novos detergentes com baixo custo24-29. A atividade hidrolítica da lipase pode ser diretamente relacionada com sua atividade de síntese, mas é independente de sua atividade de interesterificação. Lipases de diferentes fontes são capazes de catalisar a mesma reação, embora possam diferir no desempenho sob as mesmas condições reacionais27.
Especificidade das lipases
Para aplicação industrial, a especificidade da lipase é um fator crucial24,40. A enzima pode ser específica com relação à molécula ácida ou alcoólica do substrato. As lipases são divididas em 3 grupos baseados em sua especificidade24,44. Lipases não específicas (ex: produzidas por Candida rugosa, Staphylococcus aureus, Chromobacterium viscosum e Pseudomonas sp.) quebram as moléculas de acilglicerol na posição randômica, produzindo ácidos graxos livres, glicerol, monoacilgliceróis e diacilgliceróis como intermediários. Neste caso, os produtos são similares àqueles produzidos por catálise química, porém com menor grau de termodegradação, devido à temperatura na biocatálise ser bem inferior24.
Lipases 1,3 específicas (ex: de Aspergillus niger, Mucor javanicus, Humicola lanuginosa, Rhizopus delemar, Rhizopus oryzae, Candida lipolytica, Rhizopus niveus e Penicillium roquefortii) liberam ácidos graxos das posições 1 e 3 e formam, por esta razão, produtos com composições diferentes daquelas obtidas pelas lipases não-regiosseletivas, ou mesmo pelo catalisador químico13,24.
Lipases ácido graxo específicas são lipases com ação específica na hidrólise de ésteres, cujos ácidos graxos são de cadeia longa insaturada com duplas ligações, em cis no carbono 9. Ésteres com ácidos graxos insaturados, ou sem insaturação no carbono 9, são lentamente hidrolisados. Este tipo de especificidade não é comum entre as lipases e o exemplo mais estudado até hoje é a lipase de Geotrichum candidum24. Esta habilidade de produzir novos tipos de misturas de triacilglicerídeos utilizando lipases regioespecíficas é uma das características mais interessantes para a aplicação no setor de óleos e gorduras1,11,17.
Também merece referência a estereoespecificidade, ou seja, a capacidade que algumas lipases possuem de discriminar os enantiomêros de uma mistura racêmica45,46. A especificidade estrutural ou regiosseletividade é decorrente da orientação imposta pelas dimensões e pela estrutura do centro ativo à ligação do substrato47. Estas restrições levam à distinção e à transformação seletiva de funções quimicamente similares na mesma molécula. A seletividade e a estereoquímica advém da própria quiralidade da enzima, ou seja, de sua simetria estrutural, que limita a ação em substratos que não satisfaçam determinadas relações espaciais. Desse modo, a catálise enzimática permite transferir ou criar centros quirais nas moléculas, assim como distinguir formas enantiômeras. Lipase tem sido empregada para resolução de racematos, resultando em rendimentos elevados, para obtenção de ésteres, álcoois e ácidos opticamente puros45-48.
PROCESSOS DE MODIFICAÇÃO DE ÓLEOS E GORDURAS
A versatilidade das lipases tem sido explorada ou para substituir processos existentes, ou para produzir uma série de compostos considerados praticamente inviáveis de serem obtidos por via química convencional. Esta habilidade catalítica tem sido aplicada na hidrólise de gorduras para produção de ácidos graxos, esterificação ou interesterificação de gorduras e outros lipídeos para preparação de produtos alimentícios ou não alimentícios11,13,17,39. A Tabela 3 apresenta, de forma resumida, potencias aplicações das lipases no setor de óleos e gorduras18,50.
Produtos obtidos em meio aquoso
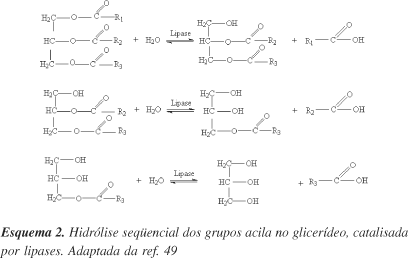
A reação típica catalisada pelas lipases em meio aquoso é a hidrólise de éster. Esta reação ocorre via hidrólise seqüencial dos grupos acila no glicerídeo, de tal forma que, num dado momento, a mistura reacional contém não somente triglicerídeo, água, glicerol e ácidos graxos, como também diacilgliceróis e monoacilgliceróis (Esquema 2)26,49. O processo enzimático não somente reduz os requerimentos energéticos como também previne a decomposição de alguns ácidos graxos12,13.
O procedimento usual é realizado em reatores agitados, contendo gordura na fase líquida e solução aquosa da enzima. A duração global do processo é de aproximadamente 72 h, sendo alcançadas taxas de conversão variando entre 90-95% e concentrações finais de glicerol na fase aquosa entre 10-20%. Este grau de hidrólise só é aceitável para utilização dos ácidos graxos obtidos na manufatura de sabões, tendo em vista que, para esse tipo de produto, pequenas quantidades de glicerídeos são toleradas11. A empresa japonesa Miyoshi Oil and Fat Co adota esse processo em escala industrial para produção de sabão, utilizando lipase microbiana (Candida rugosa)18.
Do ponto de vista comercial, a reação de hidrólise de gordura catalisada por lipase, é aparentemente menos econômica que a técnica convencional. Entretanto, considerando a possibilidade da obtenção de produtos específicos de alto valor agregado, como por exemplo, a astaxantina (corante de alimentos), ácido 4-hidroxidecanóico usado como precursor de aromas, o éster g-decalactona (sabor de frutas), ácidos dicarboxílicos para indústrias de pré-polímeros33 e ácidos graxos polinsaturados (PUFAs) do tipo ômega-3 e ômega-6, a partir da hidrólise de óleos marinhos por lipases não específicas, este tipo de processo pode tornar-se viável economicamente26,51. Os ácidos mais importantes, contidos nos óleos marinhos, são os eicosapentaenóico (EPA) e docosaexaenóico (DHA), que apresentam aplicações terapêuticas no tratamento de enfermidades inflamatórias auto-imunes e doenças cardiovasculares, e não podem ser obtidos por métodos convencionais de aquecimento, sem sofrer uma decomposição substancial51. Da mesma forma, o ácido g-linolênico, um importante produto nutricional encontrado em sementes oleaginosas, pode ser obtido pela hidrólise catalisada por lipases sob condições moderadas de temperatura52.
Diversas patentes têm sido registradas, e descrevem o uso de lipase em clivagem hidrolítica de óleos e gorduras, entre as quais destaca-se a patente pioneira depositada em 1986 (Nº 4.629.742)53 nos Estados Unidos, empregando reatores de membrana hidrofóbica microporosa, conforme ilustrado na Figura 1.
Mais recentemente, Karleskind2 descreveu um processo contínuo (Figura 2) de hidrólise enzimática de triglicerídeos, constituído de uma coluna encamisada para aquecimento, na qual uma suspensão aquosa de lipase era continuamente alimentada pelo topo da coluna, enquanto em sua base um difusor impulsionava a ascensão de finas partículas de óleo em fluxo contra-corrente. Uma solução contendo água-glicerina e lipase era recolhida na base da coluna e os ácidos graxos recolhidos no topo da coluna. A recuperação da lipase era processada por ultrafiltração. Na prática, este sistema é bem mais complexo e ainda requer uma série de ajustes, tendo em vista que frações de gordura e lipase são perdidas na fase aquosa. Além disso, uma pequena fração de lipase carreada com os ácidos graxos é destruída na etapa da destilação. Progressos na tecnologia de centrifugação e de membrana seletiva para ultrafiltração podem melhorar o desempenho do processo proposto.
A hidrólise seletiva da gordura do leite é um outro exemplo de aplicação potencial de lipases. Segundo Balcão e Malcata54, o declínio do consumo per capita de gordura de leite em diversos países e a demanda por leite e derivados com menor teor de gordura têm aumentado a necessidade e o interesse do setor industrial em encontrar alternativas para o uso desta gordura. Neste caso, a lipase é responsável pela formação do aroma distinto no preparo de queijos do tipo Cheddar, para produzir substitutos de manteiga, aroma de queijo e outros aditivos usados na manufatura de cereais, balas, aperitivos e bolos. Hidrolisados deste tipo de gordura têm sido extensivamente utilizados em cereais, molhos, aperitivos e assados em geral (um exemplo clássico é o uso em pipocas), resultando em produtos com melhor aroma e maior aceitabilidade pelos consumidores. A adição desses hidrolisados aos alimentos confere uma variedade de efeitos organolépticos e é dependente da quantidade empregada54. Em níveis baixos, nenhum aroma de ácido graxo livre no alimento é detectável, ocorrendo apenas um enriquecimento característico no aroma; conforme o teor dessa adição é aumentado, um aroma semelhante à manteiga começa a ser detectado e, em presença de elevados níveis, o aroma sugere queijo54. As características dos hidrolisados dependem da fonte da lipase utilizada, sendo adequadas as enzimas oriundas do leite (lipase lipoprotéica), pâncreas (lipase pancreática), fungos (Aspergillus niger, Geotrichum candidum, Penicillium roquefortii), bactérias (Achromobacter lipolyticum, Pseudomonas fluorences) e trato gastrointestinal54.
Outro campo de aplicação de lipase, com boa perspectiva de crescimento, é na indústria de panificação55. O uso de lipase 1,3-específica tem um excelente efeito condicionador da massa, facilitando o seu manuseio em máquinas convencionais da indústria de panificação. Além disso, aumenta o volume do pão, melhora a textura do miolo e confere ao mesmo uma cor mais branca. Nesta aplicação, a lipase degrada os lipídeos do trigo, modificando sua interação com o glúten, permitindo que o glúten obtenha uma rede mais forte e mais elástica55. Na produção de salsichas fermentadas, a aplicação de lipases de Rhizomucor miehei apresenta também aspectos econômicos positivos, uma vez que proporciona encurtamento do tempo de maturação, com manutenção de características analíticas e sensoriais28.
O processo de hidrólise enzimática necessita de dois requisitos para a operação: a formação de uma interface lipídeo/água e a absorção da enzima nesta interface. Assim, quanto maior a interface, maior a quantidade de enzima adsorvida, acarretando taxas de hidrólise mais elevadas42,52. Diferentes parâmetros podem influenciar o desempenho da hidrólise de óleos e gorduras e, conseqüentemente, diversas técnicas têm sido utilizadas para aumentar a taxa de hidrólise de gorduras usando lipases como catalisadores56-65.
A hidrólise do óleo de palma foi investigada para obtenção de mono e diacilgliceróis empregando preparações de lipases de fontes microbiana (Candida rugosa), vegetal (gérmen de trigo) e animal (pâncreas de porco). Entre as lipases testadas, as taxas de conversão de hidrólise mais elevadas foram obtidas com a lipase de Candida rugosa, com atividade ótima a 37 °C e pH = 7,556.
Linfield et al.57 estudaram a hidrólise de sebo e óleos de coco e oliva utilizando lipases de Candida rugosa, Aspergillus niger e Rhizopus arrhizus. A reação em emulsão foi conduzida em sistemas de frascos agitados, obtendo-se altos valores de conversão (97-99% em 72 h). Em outro trabalho, Linfield et al.58 utilizando os mesmos óleos e lipase de Candida rugosa, abordaram a influência do pH, da temperatura e de aditivos sobre a atividade enzimática, determinando também uma quantidade mínima de enzima necessária para o alcance de taxas de hidrólise superiores a 95% em 72 h.
A hidrólise de óleo de soja com diferentes tipos de lipase foi estudada por Park et al.59, tendo como principal objetivo a comparação das atividades dessas enzimas em sistemas isolados e combinados. Após 10 h de reação, foi verificado que os sistemas combinados de lipases microbianas, tais como Penicillium sp. e Rhizopus niveous ou Penicillium sp. e Rhizopus delemar, forneceram rendimentos mais elevados (98,0 e 99,5% de hidrólise) que os obtidos em sistemas contendo apenas uma lipase (7,2 e 44,4% de hidrólise).
O uso de solventes no meio reacional também tem sido descrito como um fator responsável no aumento das taxas de hidrólise dos triacilgliceróis52. Mukataka et al.60 testaram diferentes solventes no processo de hidrólise de óleos em sistema com emulsão e selecionaram o isoctano como o mais adequado. Wang et al.61 verificaram que a hidrólise do óleo de oliva catalisada pela lipase de Candida rugosa em um sistema emulsificado apenas por agitação mecânica apresentou taxas de hidrólise similares às obtidas nos sistemas reacionais contendo emulsificante.
Bilyk et al.62 estudaram a hidrólise de diferentes óleos vegetais e animais por lipases de Candida rugosa, Rhizomucor miehei e de pâncreas suíno, em sistemas contendo hexano como solvente. O sistema adotado permitiu a recuperação da enzima por filtração e sua reutilização no processo hidrolítico, não sendo verificado perda significativa de atividade nos reciclos consecutivos.
A hidrólise enzimática em ácidos graxos, a partir de óleos comerciais de alta acidez como de coco, soja, mostarda, girassol e arroz, foi investigada por Ghosh e Bhattacharyya63. Acilgliceróis neutros de óleos de alta acidez foram hidrolisados por lipase de Candida rugosa quase completamente, num período máximo de 48 h. O óleo de coco, com acidez inicial de 69,2% em ácido láurico, foi hidrolisado numa temperatura de 35 °C durante 48 h, atingindo acidez final de 80%.
Considerando que inúmeras variáveis podem estar envolvidas nesse tipo de processo, observa-se uma tendência pelo emprego da metodologia de planejamento estatístico, que possibilita verificar a influência das variáveis e suas interações no rendimento de um determinado processo com grande economia de tempo, material e recursos64. Como exemplo, cita-se o trabalho desenvolvido por Oliveira et al.65 no qual foi analisada a influência da concentração de lipase e do tempo de reação no desempenho da hidrólise da gordura de babaçu por lipase comercial empregando a metodologia de superfície de resposta, sendo obtidas taxas de hidrólise entre 6,52 e 41,44%. O ponto ótimo do processo (maior porcentagem de hidrólise no menor tempo possível), entretanto, não foi alcançado, tendo em vista que o planejamento fatorial proposto não cobriu a faixa correspondente a maiores tempos de reação.
A aplicação de lipases tem sido também preconizada na degradação biológica e remoção de carga lipolítica de efluentes industriais gerados em frigoríficos, abatedouros, laticínios e indústrias de alimentos em geral26,28,66. Estas indústrias produzem um elevado teor de resíduos líquidos e sólidos, com odores desagradáveis, que prejudicam intrinseca e extrinsecamente as unidades industriais. Além disso, esses resíduos contêm elevados teores de demanda bioquímica e química de oxigênio (DBO e DQO), tendo em vista que o conteúdo de gorduras aumenta a concentração de matéria orgânica66,67. Neste contexto, processos alternativos que visam a recuperação ou diminuição da carga de gorduras de efluentes são de extremo interesse para a indústria. Um tratamento preliminar desses efluentes por meio da ação das lipases reduz o teor de lipídeos, o diâmetro das partículas de gorduras em até 60% e o tempo de residência do efluente nas lagoas de estabilização36,37.
O uso de lipases em tratamento de efluentes fornece várias vantagens potenciais, entre as quais destacam-se simplicidade e facilidade no controle do processo; não há necessidade de aclimatação de biomassa; não há efeitos de choque por carga de poluentes; aplicação em processos com baixa ou alta concentração de poluentes; operação em amplas faixas de pH, temperatura e salinidade68.
Produtos obtidos em meio orgânico
Produtos de esterificação
Em meio orgânico, as lipases catalisam a transferência de grupos acila de compostos doadores para uma ampla faixa de compostos aceptores diferentes da água27. Entre os possíveis processos catalisados pelas lipases em meio orgânico, a síntese de ésteres apresenta-se como uma vertente bastante promissora, conforme atestam os processos em fase de implantação industrial18,27,50,69.
Inúmeros ésteres são considerados de grande importância na vida cotidiana. Produtos naturais, tais como triglicerídeos, fosfolipídeos, esteróides, aromatizantes e fragrâncias, apresentam em comum uma ligação éster, apesar das diferentes propriedades físicas e diversas estruturas químicas que possuem18.
Industrialmente, a esterificação por lipase foi comercializada pela Unichema International para produção de ésteres de ácidos graxos de alto grau de pureza e qualidade, como o isopropilmiristato, isopropilpalmitato e 2-etilexilpalmitato, que são ingredientes empregados na formulação de cremes, cosméticos e outros produtos de higiene. O processo em questão é conduzido em reatores agitados, utilizando uma preparação de lipase imobilizada numa temperatura entre 50-70 ºC. A água gerada durante a reação de esterificação é removida por destilação a vapor. O processo permite a recuperação da preparação enzimática e sua reutilização em bateladas subseqüentes52.
Uma das características importantes de um produto para sua aplicação em alimentos, cosméticos ou fármacos é sua maior ou menor facilidade de formar emulsões estáveis. Lipídeos, por exemplo, são insolúveis em meio aquoso devido à sua baixa afinidade química com a água (nos lipídeos predominam ligações apolares). Emulsificante é uma substância que tem afinidade tanto por substâncias polares, quanto por apolares e permite a dispersão de substâncias como lipídeos em água. Dependendo de sua composição, podem fazer parte de sistemas para uso em cremes, molhos e loções, tendo, portanto, considerável uso industrial e sua produção ultrapassa 350000 t/ano17,18. São, principalmente, mono e diglicerídeos e sua síntese química envolve temperaturas maiores que 200 ºC, gerando cor, gosto e aroma indesejáveis. A empresa Amano, no Japão, selecionou uma lipase de Penicillium cyclopium para produção de emulsificantes70, possuindo alta capacidade de síntese, produzindo 95% de monoglicerídeos sob condições de excesso de glicerol (1:15) durante 100 h numa temperatura de 40 ºC.
Lipases também podem catalisar a síntese de ésteres de poliglicerol18. Esses tipos de ésteres são ingredientes multifuncionais, sendo usados como emulsificantes, substitutos de gorduras, como meio de solubilização de vitaminas lipossolúveis para facilitar a incorporação destas em sistemas lipofóbicos; podem ser utilizados em sorvetes, margarinas, coberturas, sobremesas e produtos de panificação6.
Uma outra aplicação importante desta tecnologia é a produção de ésteres de ácidos graxos e açúcares, que apresentam larga aplicação como emulsificantes em alimentos, cosméticos e produtos farmacêuticos69,71-73. Além de seu efeito conservante, ésteres de carboidratos e ácidos graxos têm sido associados como agentes antitumor e inibidores do crescimento de plantas. O processo é baseado na esterificação de carboidratos (glicose, frutose, sacarose e sorbitol) com ácidos graxos (esteárico, oleico e linoleico) utilizando lipases de diferentes fontes74-76. A limitação deste processo é referente à alta polaridade do solvente requerido para dissolução dos açúcares, o que pode ocasionar inativação da preparação enzimática69.
Finalmente, merece referência a produção de ésteres aromatizantes, ésteres de baixo peso molecular, principalmente para o uso em diversos produtos alimentícios, farmacêuticos e cosméticos77. O mercado mundial para esses compostos está avaliado em US$ 3 bilhões, um montante que representa aproximadamente um quarto do valor do mercado de aditivos alimentares18,77. Além disso, quando preparados por processos enzimáticos podem ser caracterizados como naturais ou idênticos ao natural sendo, portanto, preferidos pelo mercado consumidor18. Aproximadamente 50 ésteres, formadores de aromas, foram sintetizados por reações catalisadas por lipases27,69,77. Em princípio, o processo pode ser realizado em meios reacionais contendo mistura de álcool e ácido carboxílico em presença ou ausência de solventes, resultando em altas produtividades e rendimentos praticamente quantitativos50.
Apesar das inúmeras vantagens apresentadas por esta técnica, a síntese de selecionados ésteres de baixo peso molecular apresenta dificuldades técnicas, em função do complexo mecanismo da ação enzimática em meios altamente polares. Diversos parâmetros, como por exemplo, hidratação da enzima, temperatura, concentração do substrato, tamanho da cadeia e estrutura química, podem afetar o desempenho da síntese27,50.
Castro et al.78 estudaram a influência do tamanho da cadeia alifática do ácido graxo (C2 a C18) e obtiveram altas taxas de esterificação (95 a 98%) para ácidos contendo 4 ou mais carbonos. Resultados similares foram obtidos por Habulin et al.79 e Janssen et al.80.
Hedstron et al.81 observaram que a atividade enzimática da lipase de Candida rugosa foi maior para álcoois de cadeias curtas (propanol e butanol) e longas (decanol e dodecanol) quando comparado a cadeias alifáticas intermediárias (pentanol, hexanol e octanol).
Quanto à configuração estrutural do álcool utilizado, Fonteyn et al.82 sintetizaram vários acetatos empregando a lipase de Candida antarctica comercializada pela Novozymes (Novozym SP 435) em meio de heptano, e observaram que ocorreram diferenças quanto à estrutura e tamanho da cadeia dos álcoois: linalol e mentol não foram esterificados, enquanto que, a esterificação de 1-dodecanol teve alta taxa de conversão (86%).
Diversos trabalhos de pesquisa estão sendo realizados, visando a otimização e o desenvolvimento de processos em escala industrial para a síntese de diversos ésteres de valor comercial. Recentemente, Garcia et al.83 desenvolveram um modelo cinético que descreve a síntese de oleato de cetila (um análogo do óleo de cachalote, que possui importantes aplicações em indústrias de cosméticos, lubrificantes, alimentos e fármacos), usando como catalisador lipase Novozym SP 435 (Novozymes). É também recente o desenvolvimento de um processo contínuo para esterificação de etanol e ácido oleico catalisada pela lipase de Rhizomucor miehei imobilizada, empregando um biorreator de disco rotativo perfurado84. Os resultados experimentais deste trabalho mostraram um decaimento na atividade enzimática, independente do tempo de residência utilizado. A constante de desativação obtida foi da ordem de 0,003 h-1, revelando um tempo de meia-vida de 10 dias.
Produtos de interesterificação
A interesterificação é o processo mais usado para a obtenção de óleos e gorduras com funções desejáveis na manufatura de produtos específicos. Esse processo consiste em um rearranjo na molécula de glicerol possibilitando modificações das propriedades dos óleos e gorduras, por meio de um catalisador que, em sua forma ativa, promove a separação dos ácidos graxos da cadeia inicial.
Um dos mais importantes usos da lipase, em processos de interesterificação de óleos e gorduras, é o aproveitamento de óleos de baixo custo para produção de análogos de manteiga de cacau18,85-87. A manteiga de cacau é um tipo de aditivo, que confere ao chocolate as características necessárias de cristalização e fusão. Geralmente, os produtos de chocolate contêm 30% de manteiga de cacau. Esta, tendo um custo bem elevado, levou o setor alimentício a buscar soluções mais econômicas para a sua substituição no processo, tendo os chamados análogos de manteiga de cacau alcançando uma posição de destaque, sob o ponto de vista técnico e econômico, para aplicação na produção de chocolates e seus derivados85-87.
A interesterificação de 1,3-dipalmitoil e 2-monoleína, presente em grande quantidade no óleo de dendê, com ácido esteárico ou triestearina, utilizando lipases específicas, pode originar produtos enriquecidos como 1,3-palmitoil-3,1-estearil-2-monoleína. Esses triglicerídeos são os principais componentes da manteiga de cacau87.
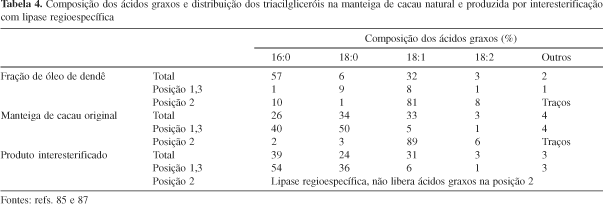
Outro método consiste na mistura de frações de óleo de dendê e um éster esterato, seguido de desidratação e reação enzimática85. Depois da destilação, o triglicerídeo formado é fracionado com solventes e a fração obtida de baixo ponto de fusão, é o produto desejado. Uma comparação entre as características da manteiga de cacau e o seu análogo é apresentada na Tabela 4, como uma forma de ilustração da viabilidade técnica deste processo85. A valorização de óleos de baixo custo, por meio da interesterificação, utilizando a enzima Lipozyme (lipase imobilizada em resina de troca aniônica), possibilitou à Cia. Loders Croklaan (grupo Unilever) a comercialização desse produto em 199388. A recomendação para manutenção da estabilidade da enzima é a utilização da matéria prima com um baixo teor de impurezas permitindo, desta forma, diversas reutilizações da Lipozyme em reator de leito fixo, antes de ser descartada.
Outros estudos estão sendo realizados principalmente com a fração intermediária do óleo de palma e com gorduras de frutos de plantas exóticas da Índia (sal, mahua, kokum, manga e dhupa) e do Brasil (piqui)87. Dados da composição em ácidos graxos do óleo da polpa e da amêndoa do piqui (Cariocar brasiliense Camb) mostram que os mesmos são constituídos, na sua maior parte por ácidos oleico e palmítico, enquanto que a manteiga de cacau apresenta altos teores de ácidos oleico, palmítico e esteárico. Facioli e Gonçalves87 estudaram a transformação do óleo deste fruto em um similar da manteiga de cacau, por meio da interesterificação enzimática usando lipase sn-1,3 específica (Lipozyme) na presença de ácido esteárico, o qual foi incorporado na posição sn-1,3-3,1 do triglicerídeo.
Várias patentes têm sido propostas, relatando a imobilização da enzima e o reator utilizado neste processo. Entre as patentes registradas, referentes à produção de substitutos de manteiga de cacau, cita-se o método proposto (Patente nº 4.268.527)89 para obtenção destes substitutos a partir de gorduras e óleos que possuem triglicerídeos ricos em resíduos de ácido oleico na posição 2 com ésteres de ácido esteárico e/ou palmítico empregando lipase 1,3 específica, contendo teores de água no meio reacional não superiores a 0,18% (p/v). O emprego desta metodologia forneceu um produto rico em compostos 1,3-diestearil-2-oleil e 1-palmitil-2-oleil-3-estearil com elevados rendimentos e baixa geração de subprodutos.
A semelhança da composição do análogo de manteiga de cacau com o produto natural tem originado inúmeros estudos para a identificação da presença deste análogo na fabricação de chocolate90,91. A necessidade de estudos se justifica, tendo em vista que a legislação brasileira proíbe a adição destes análogos ao chocolate91. Esta adição, entretanto, é permitida em outros países como a Inglaterra, Irlanda, Dinamarca e Japão91.
Com a redução do preço internacional da manteiga de cacau, o interesse atual para produção de análogos tem sido também reduzido e direcionado para outras rotas de fabricação de produtos com maior aceitação no mercado92.
O exemplo mais recente foi o lançamento no mercado japonês, pela empresa Kao em 1999, de um azeite com propriedades funcionais, denominado "Healthy Econa Cooking Oil", que impede o aumento de gordura no corpo, especialmente gordura que se deposita nos órgãos internos. Este novo óleo pode ser usado de maneira similar aos azeites comestíveis convencionais, tendo alcançado, em apenas três anos, 80% do mercado de azeites de cozinha de primeira classe92.
O ingrediente principal do "Healthy Econa Cooking Oil" é o diacilglicerol (DAG), produzido enzimaticamente, a partir de óleo natural, com a utilização de lipase imobilizada da Novozymes. O DAG é digerido e absorvido no intestino delgado, sendo consumido como energia, sem voltar a se sintetizar como gordura neutra, como acontece com os azeites convencionais. Em conseqüência, reduz o nível de gordura neutra no sangue e o seu uso, a longo prazo, ajuda a combater a obesidade92.
Um outro exemplo de interesse comercial é a interestificação enzimática do óleo de algodão com o óleo de soja completamente hidrogenado1, conseguindo-se um produto no qual os cristais Beta prima têm uma estabilidade relativa, servindo como matéria prima para fabricação de margarina "trans free"5. A interesterificação não altera a característica física dos ácidos graxos, produzindo gorduras com baixo teor em isômeros trans. Este fato agrega valor às gorduras, visto que estudos recentes da área médica associam o consumo exagerado de produtos ricos em isômeros trans, ao aumento do mau colesterol no organismo humano. Ainda com relação a este fato, vale ressaltar que isômeros trans podem ser encontrados em óleos não hidrogenados, devido a altas temperaturas utilizadas na desodorização dos óleos.
Ressalta-se ainda a potencialidade do emprego da interesterificação catalisada por lipase na síntese de lipídeos estruturados (LEs). LEs são triacilgliceróis reestruturados ou modificados pela mudança na composição de ácidos graxos e/ou sua distribuição na molécula de glicerol, por processos químicos ou enzimáticos2,7,93,94. Esses produtos possuem uma ampla aplicação nas indústrias farmacêuticas, de cosméticos e alimentos, sendo fontes de ácidos graxos específicos e desejáveis para fins terapêuticos ou nutricionais. LEs podem também ser sintetizados para mudar ou melhorar características físicas e químicas de triglicerídeos, como ponto de fusão ou índice de saponificação1.
Um importante uso destes verdadeiros lipídeos projetados relaciona-se à sua aplicação para fins terapêuticos. Algumas vantagens medicinais têm sido relacionadas ao uso de LEs, como aumento da função imunológica, não agressão ao tecido reticuloendotelial, diminuição do risco de câncer, ajuda na prevenção de trombose, diminuição de colesterol e aumento do balanço de nitrogênio93-95.
Os lipídeos estruturados podem ser produzidos por via química ou enzimática, por meio da combinação de triglicerídeos de cadeia média (TCMs) e de cadeia longa (TCLs) ou da reação entre triglicerídeos e ácidos graxos. As misturas de TCMs e TCLs são reesterificadas, obtendo-se uma mistura com composição química e, conseqüentemente, propriedades diferentes da original9,93,94. A via enzimática para produção destes lipídeos tem alcançado muitos progressos e desperta particular interesse, principalmente devido às reações regiosseletivas, as quais permitem a síntese de produtos impraticáveis de serem obtidos por via química7.
A obtenção de TCMs por via enzimática é exemplificada no trabalho de Kim e Rhee96, que estudaram a síntese de glicerídeos de cadeia média por meio da reação entre os ácidos cáprico e oleico e glicerol, utilizando lipase imobilizada (Lipozyme). A reação foi conduzida na ausência de solventes ou surfactantes. A velocidade máxima da reação foi obtida a 50 °C para síntese de glicerídeos do ácido cáprico e 60 °C para o ácido oleico. A conversão final foi bastante influenciada pelos métodos de remoção de água utilizados.
Ferrari et al.97 submeteram amostras de óleos refinados de milho, soja e canola à interesterificação química (com metilato de sódio por 30 min a 110 °C) e enzimática (Candida rugosa, Novozym SP 435 e Lipozyme) e observaram as alterações ocorridas na distribuição posicional dos ácidos graxos nas moléculas dos triacilglicerídios. Alterações severas foram verificadas no produto obtido por interesterificação química, enquanto o mesmo não foi constatado para o produto obtido por via enzimática, independente da preparação de lipase empregada.
A transesterificação com lipases pode ser usada para converter misturas de lipídeos em gorduras plásticas usadas em produtos cosméticos. Lai et al.98 estudaram a transesterificação de misturas de óleos de palma-estearina e girassol (PS-SO) numa razão de 40:60 em meio isento de solvente, com lipases específica-1,3 (Aspergillus niger, Mucor javanicus, Rhizomucor miehei, Rhizopus javanicus e Rhizopus niveus) e não-específica (Pseudomonas sp. e Candida rugosa). Os resultados indicaram que lipase de Pseudomonas sp. produziu altos graus (77,3%) e razão (50 h-1) de transesterificação, seguido da Rhizomucor miehei a 32,7% e 27,1 h-1.
Pesquisadores da Unilever desenvolveram um novo triglicerídeo, via interesterificação enzimática, baseado em gorduras vegetais com a finalidade de simular a distribuição de ácidos graxos da gordura do leite humano. Este TG só pode ser obtido por meio do uso de lipase 1,3 específica, pela reação de tripalmitina com ácidos graxos insaturados. O produto formado é um TG rico em palmitato na posição 2, e de resíduos de ácidos graxos insaturados nas posições 1,3. Este produto está sendo desenvolvido industrialmente para uso em formulação infantil sob o nome comercial de Betapol7.
Destaque-se ainda os estudos recentes de aplicação de lipase na geração de energia, como a produção de biocombustível, alternativo ao óleo diesel, a partir de óleos vegetais brutos99-109. O uso de lipases para produção de biodiesel é de relevante importância, considerando-se o crescimento da utilização desse biocombustível em âmbito mundial, não somente pelo aspecto de meio ambiente mas, principalmente, por se tratar de uma fonte de energia renovável.
O diesel é constituído de hidrocarbonetos com número médio de carbonos em torno de quatorze. Os óleos vegetais são triésteres da glicerina, ou seja, produtos naturais da condensação da glicerina com ácidos graxos, cujas cadeias laterais de ácidos graxos têm número de carbonos variando entre dez e dezoito, com valor médio de quatorze, para os óleos mais abundantes. Além da presença do grupamento funcional do tipo éster, os óleos vegetais possuem peso molecular cerca de três vezes maior que o diesel.
Visando reduzir a alta viscosidade dos óleos vegetais, diferentes alternativas têm sido consideradas, tais como diluição; microemulsão com metanol ou etanol; decomposição térmica; craqueamento catalítico e reação de interesterificação com etanol ou metanol. Entre essas alternativas, a interesterificação é a melhor escolha, particularmente com monoálcoois (alcoólise), especificamente metanol ou etanol, promovendo a quebra da molécula dos triglicerídios, gerando mistura de ésteres metílicos ou etílicos dos ácidos graxos correspondentes, liberando glicerina como subproduto99-108.
O peso molecular desses monoésteres é próximo ao do diesel. Os ésteres de ácidos graxos obtidos são conhecidos como biodiesel e apresentam características físicas semelhantes às do óleo diesel, podendo ser utilizados em motores do ciclo diesel sem nenhuma adaptação99,100.
Embora os processos de transesterificação enzimática para obtenção de biodiesel ainda não sejam comercialmente desenvolvidos, novos resultados têm sido reportados em artigos e patentes101-108. O aspecto comum desses estudos consiste na otimização das condições de reação (solvente, temperatura, pH, enzima, entre outros), a fim de estabelecer as características para aplicações industriais. Contudo, tanto o rendimento, como o tempo de reação ainda são desfavoráveis se comparados com o sistema de reação por catálise básica.
CONCLUSÕES
Lipase pertence a um grupo de enzimas que, quando em presença de água, catalisa as ligações de ésteres dos triglicerídeos. Recentemente, o interesse comercial tem aumentado, em função da possibilidade de reverter sua forma de atuação em meio orgânico, de tal forma que reações de esterificação e interesterificação possam ser conduzidas. Tais reações são de extrema importância para o desenvolvimento de novas rotas de processo, para obtenção de produtos novos ou conhecidos a custos mais competitivos ampliando, simultaneamente, o potencial de aplicação das enzimas em processos. Como exemplo, foram descritos neste trabalho processos de biotransformação para lipases em reações de esterificação, hidrólise e interesterificação, para obtenção de produtos de interesse industrial do setor de óleos e gorduras. Este setor tem um interesse permanente em desenvolver técnicas capazes de modificar as propriedades físico-químicas, funcionais e organolépticas das matérias-primas oleosas ampliando, desta forma, a possibilidade de aplicação de seus produtos. O potencial da biotecnologia para melhorar as propriedades de matérias-primas naturais, ou submetê-las a transformações profundas, vem ao encontro da necessidade deste setor em alcançar as metas de expansão. As lipases tendem a exercer, em futuro próximo, um papel fundamental na indústria alimentícia, em processos de produção de margarinas, óleos comestíveis, queijos e manteigas com características nutricionais e funcionais desejáveis.
Recebido em 18/12/02; aceito em 3/6/03
- 1. Clauss, J.; Óleos & Grãos 1996, 5, 31.
- 2. Karleskind, A.; Oils and Fats: Manual, Lavoisier Publishing: Paris, 1996, vol. 2, p. 1432-1572.
- 3. Gurr, M. I.; Harwood, J. L. Em Lipid Biochemistry: An Introduction; 4th ed.; Chapman & Hall: London, 1996, p. 162-243.
- 4. Gonçalves, L. A. G.; Óleos & Grãos 1996, 5, 27.
- 5. Ahmed, J. I.; Food Sci. Technol. Today 1995, 9, 228.
- 6. Lima, J. R.; Nassu, R. T.; Quim. Nova 1996, 19, 127.
- 7. Gunstone, F. D.; J. Sci. Food Agric 1999, 79, 1535.
- 8. Grampone, M. A.; Óleos & Grãos 1993, 2, 5.
- 9. Casey, J.; Macrae, A. R.; Inform 1992, 3, 203.
- 10. Gunstone, F. D.; Fett-Lipid 1999, 101, 124.
- 11. Hammond, E. G.; Glatz, B. A. Em Food Biotechnology; Kling, R. D.; Cheetham, P. S. J., eds.; Elsevier Publishers Limited, 1988, vol. 2, p. 173-217.
- 12. Macrae, A. R.; Hammond, R. C.; Biotechnol. Genetic Eng. Rev 1985, 3, 193.
- 13. Willis, W. M.; Maragoni, A. G.; Biotechnol. Genetic Eng. Rev 1999, 16, 141.
- 14. Léon, R.; Fernades, P.; Pinheiro, H. M.; Cabral, J. M. S.; Enzyme Microb. Technol. 1998, 23, 483.
- 15. Dixon, M.; Webb, E. C. Em Enzymes; 3rd ed.; Longman Group Limited: London, 1979.
- 16. Wiseman, A. Em Handbook of Enzyme Biotechnology; 3rd ed.; Ellis Horwood Publication: London, 1995.
- 17. Novo Nordisk Em Catálogo Informativo; 1995, 30.
- 18. Vulfson, E. N. Em Lipases: Their Structure, Biochemistry and Application; Woolley, P.; Petersen, S. B., eds.; Cambridge University Press: Great Britain, 1994, p. 271.
- 19. Pereira, R. S.; Quim. Nova 1995, 5, 452.
- 20. Shanley, A.; Chem. Eng. 1998, 105, 63.
- 21. Svendsen, A.; Clausen, I. G.; Patkar, S. A.; Borch, K.; Thellersen, M.; Method Enzymol. 1997, 284, 317.
- 22. Jaeger, K-E.; Reetz, M. T.; TIBTECH 1998, 16, 396.
- 23. Jaeger, K-E.; Ransak, S.; Koch, H. B.; Ferrato, F.; Dijkstra, B. W.; FEMS Microbiol. Rev. 1994, 15, 29.
- 24. Kazlauskas, R. J.; Bornscheuer, U. T. Em A Multi-Volume Comprehensive Treatise Biotechnology; Rehm, H. J.; Stader, P., eds.; 1998, vol. 8A, 38.
- 25. Paiva, A. L; Malcata, F. X.; J. Mol. Catal. B: Enzym. 1997, 3, 99.
- 26. Gandhi, N. N.; J. Am. Oil Chem. Soc. 1997, 74, 621.
- 27. Yahya, A. R. M.; Anderson, W. A.; Moo-Young, M.; Enzyme Microb. Technol. 1998, 23, 438.
- 28. Pandey, A.; Benjamin, S.; Soccol, C. R.; Nigam, P.; Krieger, N.; Soccol, V.T.; Biotechnol. Appl. Biochem. 1999, 29, 119.
- 29. Ghotra, B. S.; Dyal, S. D.; Narine, S. C.; Food Res. Int. 2002, 35, 1015.
- 30. Novo Nordisk, Biotimes, 1998, www.novozymes.com.Biotimes
- 31. Priya, K.; Chadha, A.; Enzyme Microb. Technol. 2003, 32, 485.
- 32. Cernia, E.; Delfini, M.; Di Cocco, E.; Palloci, C.; Soro, S.; Bioorg. Chem. 2002, 30, 276.
- 33. Sharma, R.; Chisti, Y.; Banerjee, U. C.; Biotechnol. Adv. 2001, 19, 627.
- 34. Reetz, M. T.; Curr. Opin. Chem. Biol. 2002, 6, 145.
- 35. Teles, F. R. R.; Cabral, J. M. S.; Santos, J. A. L.; Biotechnol. Lett. 2001, 23, 1159.
- 36. Leal, M. C. M. R.; Cammarota, M. C.; Freire, D. M. G.; Sant'Anna Jr., G. L.; Braz. J. Chem. Eng. 2002, 19, 175.
- 37. Masse, L.; Kennedy, K. J.; Chou, S.; Bioresour. Technol. 2001, 77, 145.
- 38. Gilbert, J. E.; Enzyme Microb. Technol. 1993, 15, 634.
- 39. Valenzuela, A.; Nieto, S.; Grasas Y Aceites 1994, 45, 337.
- 40. Faber, K., ed. Em Biotransformations in Organic Chemistry: A Textbook; 3rd ed.; Springer Produktions-Gesellschaft: Berlin, 1997, cap. 2.
- 41. Petersen, S. B. Em Engineering of with lipases; Malcata, F. X., ed.; Kluver Academic Publisheres: The Netherlands, 1996, p. 125.
- 42. Balcão, V. M.; Paiva, A. L.; Malcata, F. X.; Enzyme Microb. Technol. 1996, 18, 392.
- 43. Villeneuve, P.; Muderhwa, J. M.; Graille, J.; Haas, M. J.; J. Mol. Catal. B: Enzym. 2000, 9, 113.
- 44. Jensen, R. G.; Galluzzo, D. R.; Bush, V. J.; Biocatalysis 1990, 3, 307.
- 45. Jaeger, K-E.; Eggert, T.; Curr. Opin. Biotechnol. 2002, 13, 390.
- 46. Jaeger, K-E.; Reetz, M. T.; Curr. Opin. Chem. Biol. 2000, 4, 68.
- 47. Choi, C. Y.; Park, H. J.; Choi, W. J.; Huh, E. C.; Lee, E. Y.; J. Biosci. Bioeng. 1999, 87, 545.
- 48. Fadnavis, N. W.; Koteshwar, K.; Tetrahedron: Asymmetry 1997, 8, 337.
- 49. Haraldsson, G. G.; Marine Lipids Biotechnology 1991, 7, 337.
- 50. de Castro, H. F.; Anderson, W. A.; Quim. Nova 1995, 18, 544.
- 51. Masson, W.; Loftsson, T.; Haraldsson, G. G.; Pharmazie 2000, 55, 172.
- 52. Mukherjee, K. D.; Biocatalysis 1990, 3, 277.
- 53. Brady, C. C.; Matcalfe, L. D.; Slabaoszewski, D. R.; Frank D.; US pat. 4, 629, 742 1986
- 54. Balcão, V. M.; Malcata, F. X.; Biotechnol. Adv. 1998, 16, 309.
- 55. Si, J. Q.; Cer. Foods World 1997, 42, 802.
- 56. Khor, H. T.; Tan, N. H.; Chua, C. L.; J. Am. Oil Chem. Soc. 1986, 63, 538.
- 57. Linfield, W. M.; Barauskas, R. A.; Sivieri, L.; Serota, S.; Stevenson, J. R.; J. Am. Oil Chem. Soc. 1984, 61, 191.
- 58. Linfield, W. M.; O´Brien, D. J.; Serota, S.; Barauskas, R. A.; J. Am. Oil Chem. Soc. 1984, 61, 1067.
- 59. Park, Y. K.; Pastore, G. M.; De Almeida, M. M.; J. Am. Oil Chem. Soc. 1988, 65, 252.
- 60. Mukataka, S.; Kobayashi, T.; Takahashi, J.; J. Ferment. Technol. 1985, 63, 461.
- 61. Wang, Y. J.; Sheu, J.Y.; Wang, F. F.; Shaw, J. F.; Biotechnol. Bioeng. 1988, 31, 628.
- 62. Bilyk, A.; Bistline, R. G.; Haas, M. J.; Feairheller, S. H.; J. Am. Oil Chem. Soc. 1991, 68, 320.
- 63. Ghosh, S.; Bhattacharyya, D. K.; J. Am. Oil Chem. Soc. 1995, 72, 1541.
- 64. Box, G. E. P.; Hunter, W. G.; Hunter, J. S.; Statistic for Experimenters, John Wiley: New York, 1978, p. 510.
- 65. Oliveira, A. L. A.; Gioielli, L. A.; Oliveira, M. N.; Ciênc. Tecnol. Aliment. 1999, 19, 270.
- 66. Lie, E.; Molin, G. Em Bioconversion of waste materials to industrial products; Martin, A. M., ed.; Elsevier Applied Science: New York, 1991, p. 401.
- 67. Raunkjaer, K.; Hvitved-Jacobsen, T.; Nielsen, P. H.; Water Res. 1994, 8, 251.
- 68. Karam, J.; Nicell, J. A.; J. Chem. Technol. Biotechnol. 1997, 69, 141.
- 69. Lortie, R.; Biotechnol. Adv. 1997, 15, 1.
- 70. Met, S.; Dandik, L.; Aksoy, H. A.; Appl. Biochem. Biotechnol. 1995, 50, 333.
- 71. Chamouleau, F.; Coulon, D.; Girardin, M.; Ghoul, M.; J. Mol. Catal. B: Enzim. 2001, 11, 949.
- 72. Coulon, D.; Ismail, A.; Girardin, M.; Rovel, B.; Ghoul, M.; J. Biotechnol. 1996, 51, 115.
- 73. Tsitsimpikou, C.; Daflos, H.; Kolisis, F. N.; J. Mol. Catal. B: Enzim. 1997, 3, 189.
- 74. Cao, L.; Bornscheuer, U. T.; Schimid, R. D.; J. Mol. Catal. B: Enzim. 1999, 6, 279.
- 75. Coulon, D.; Ismail, A.; Girardin, M.; Ghoul, M.; J. Mol. Catal. B: Enzim. 1998, 5, 45.
- 76. Gao, C.; Whitcombe, M. J.; Vulfson, E. N.; Enzyme Microb. Technol. 1999, 25, 264.
- 77. Gatfield, I. L.; Food Sci. Technol. Today 1995, 9, 237.
- 78. De Castro, H. F.; Oliveira, P. C.; Soares, C. M. F.; Ciênc. Tecnol. Aliment. 1997, 17, 237.
- 79. Habulin, M.; Krmelj, V.; Knez, Z.; J. Agric. Food Chem. 1996, 44, 338.
- 80. Janssen, A. E. M.; VanDerPadt, A.; VantReit, K.; Biotechnol. Bioeng. 1993, 42, 953.
- 81. Hedstrom, G.; Backlund, M.; Slotte, J. P.; Biotechnol. Bioeng. 1993, 42, 618.
- 82. Fonteyn, F.; Lognay, G.; Marlier, M.; Bulletin des Recherches Agronomiques de Gembloux 1995, 30, 183.
- 83. Garcia, T.; Coteron, A.; Martinez, M.; Aracil, J.; Chem. Eng. Sci. 2000, 55, 1411.
- 84. Oliveira, A. C.; Rosa, M. F.; Aires-Barros, M. R.; Cabral, J. M. S.; Enzyme Microb. Technol. 2000, 26, 446.
- 85. Undurraga, D.; Markovits, A.; Erazo, S.; Process Biochem. 2001, 36, 933.
- 86. Khumalo, L. W.; Majolo, L.; Read, J. S.; Ncube, I.; Ind. Crops Products 2002, 16, 237.
- 87. Facioli, N. L.; Gonçalves, L. A. G.; Quim. Nova 1998, 21, 16.
- 88. Clarke, C.; Biotimes 1994, 9, 6.
- 89. Matsuo, T.; Sawamura, N.; Hashimoto, Y.; Hashida, W.; US pat. 4, 268, 527 1981
- 90. Minim, V. P. R.; Cecchi, H. M. J.; High Resol. Chromatography 1999, 22, 305.
- 91. Minim, V. P. R.; Cecchi, H. M.; Ciênc. Tecnol. Aliment. 1998, 18, 111.
- 92. Dahl, K.; Biotimes 2001, 4-5, www.novozymes.com.Biotimes
- 93. Iwasaki, Y.; Yamane, T.; J. Mol. Catal. B: Enzym. 2000, 10, 129.
- 94. Neklyudov, A. D.; Ivankin, A. N.; Appl. Biochem. Microbiol. 2002, 38, 399.
- 95. Macrae, A. R. Em Biocatalysts in Organic Synthesis; Laane, C.; Tramper, J.; Lilly, M., eds.; Elsevier: Amsterdam, 1985, p. 195.
- 96. Kim, S. M.; Rhee, J. S.; J. Am. Oil Chem. Soc. 1991, 68, 499.
- 97. Ferrari, R. A.; Esteves, W.; Mukherjee, K. D.; Process Biochem. 2001, 37, 65.
- 98. Lai, O. M.; Ghazali, H. M.; Cho, F.; Chong, C. L.; Food Chem. 1999, 64, 221.
- 99. Schuchardt, U.; Serchel, R.; Vargas, R. M.; J. Braz. Chem. Soc. 1998, 9, 199.
- 100. Costa Neto, P. R.; Rossi, L. F. S.; Zagonel, G. F.; Ramos, L. P.; Quim. Nova 2000, 23, 531.
- 101. Ma, F.; Hanna, M. A.; Bioresour. Technol. 1999, 70, 1.
- 102. Crabbe, E.; Noscalo-Hipolito, C.; Kobayashi, G.; Sonomoto, K.; Ishizaki, A.; Process Biochem. 2001, 37, 65.
- 103. Kamini, N. R.; Iefuji, H.; Process Biochem. 2001, 37, 405.
- 104. Watanabe, Y.; Shimada, Y.; Sugihara, A.; Noda, H.; Fukuda, H.; Tominaga, Y.; J. Am. Oil Chem. Soc. 2000, 77, 355.
- 105. Watanabe, Y.; Shimada, Y.; Sugihara, A.; Tominaga, Y.; J. Am. Oil Chem. Soc. 2001, 78, 703.
- 106. Iso, M.; Chen, B.; Eguchi, M.; Kudo, T.; Shrestha, S.; J. Mol. Catal. B: Enzym. 2001, 16, 53.
- 107. Ban, K.; Kaieda, M.; Matsumoto, T.; Kondo, A.; Fukuda, H.; Biochem. Eng. J 2001, 8, 39.
- 108. Kaieda, M.; Samukawa, T.; Kondo, A.; Fukuda, H.; J. Biosci. Bioeng 2001, 91, 12.
Datas de Publicação
-
Publicação nesta coleção
09 Mar 2004 -
Data do Fascículo
Fev 2004
Histórico
-
Aceito
03 Jun 2003 -
Recebido
18 Dez 2002