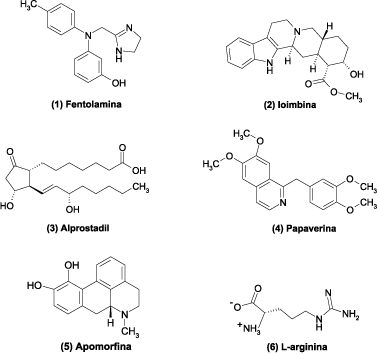
Resumo
The understanding of the scientific basis of the erectile function expanded rapidly the range of therapies for treating erectile dysfunction in recent years. This article reviews the role of dopamine on the erection mechanisms and its importance for new pro-erectile drug design. The ability of dopaminergic agents to elicit penile erection has been described since 1975 and successively confirmed by numerous studies. The development of apomorphine SL (dopaminergic non selective agonist) to enhance erectile function represents a new pharmacological approach to the management of erectile dysfunction using CNS drugs. The search for selective D4 dopaminergic agents is being explored by some research groups and pharmaceutical companies.
erectile dysfunction; dopaminergic agents; apomorphine
erectile dysfunction; dopaminergic agents; apomorphine
REVISÃO
Agentes dopaminérgicos e o tratamento da disfunção erétil
Dopaminergic agents and erectile dysfunction treatment
Gilda NevesI; Stela M. K. RatesI,* * e-mail: ratessmk@farmacia.ufrgs.br ; Carlos A. M. FragaII; Eliezer J. BarreiroII
IFaculdade de Farmácia, Universidade Federal do Rio Grande do Sul, Av. Ipiranga, 2752, 91610-000 Porto Alegre - RS
IIFaculdade de Farmácia, Universidade Federal do Rio de Janeiro, CP 68006, 21944-970 Rio de Janeiro - RJ
ABSTRACT
The understanding of the scientific basis of the erectile function expanded rapidly the range of therapies for treating erectile dysfunction in recent years. This article reviews the role of dopamine on the erection mechanisms and its importance for new pro-erectile drug design. The ability of dopaminergic agents to elicit penile erection has been described since 1975 and successively confirmed by numerous studies. The development of apomorphine SL (dopaminergic non selective agonist) to enhance erectile function represents a new pharmacological approach to the management of erectile dysfunction using CNS drugs. The search for selective D4 dopaminergic agents is being explored by some research groups and pharmaceutical companies.
Keywords: erectile dysfunction; dopaminergic agents; apomorphine.
INTRODUÇÃO
A disfunção erétil (DE), também conhecida como impotência sexual masculina, é definida como a inabilidade persistente (por no mínimo 6 meses) de obter e manter uma ereção firme o suficiente para permitir uma performance sexual satisfatória1. Depois da ejaculação precoce, este é o comprometimento mais comum da função sexual masculina, afetando cerca de 30 milhões de indivíduos apenas nos Estados Unidos2.
Um estudo realizado em 1994 com homens entre 40 e 70 anos, residentes nos EUA, relatou uma prevalência total de 52% de DE nos seus vários graus de gravidade, distribuídos em prevalências de 17, 25 e 10% para os graus mínimo, moderado e completo, respectivamente. O mesmo estudo apontou a incidência de 24 novos casos a cada 1000 homens por ano3. No Brasil, um estudo realizado no ano de 2000 com homens maiores de 18 anos demonstrou uma prevalência de 42%, sendo 31,5% para mínima, 12,1% moderada e 2,6% para DE completa4.
Os casos de DE são geralmente classificados em quatro diferentes tipos, de acordo com sua etiologia: psicogênicos, vasculogênicos ou orgânicos, neurológicos e endócrinos. Por muitos anos acreditou-se que os fatores psicológicos eram os principais causadores deste distúrbio. Porém, sabe-se hoje que a DE originária de problemas vasculares é responsável por cerca de 75% dos casos relatados, enquanto o hipogonadismo e os fatores psicológicos contribuem com 19 e 14%, respectivamente5,6.
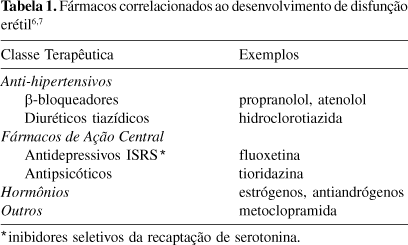
A idade avançada é o principal fator de risco para o desenvolvimento de DE e estima-se que aproximadamente 55% dos homens são completamente impotentes aos 75 anos de idade5. No Brasil, esta estimativa encontra-se em torno de 11% para homens em idade superior a 70 anos4. Também são fortemente relacionados ao desenvolvimento de DE a pré-existência de doenças cardíacas, hipertensão, níveis altos de colesterol e triglicerídeos plasmáticos, ateroesclerose, Diabetes mellitus, depressão, hiperprolactinemia e tabagismo6. Outro fator que pode desencadear o desenvolvimento de DE é o tratamento contínuo com algumas classes de fármacos (Tabela 1)6,7.
A crescente elucidação das bases fisiológicas e bioquímicas da função erétil, nos últimos anos, possibilitou a evolução das opções de tratamento da DE. As próteses penianas, primeiras opções de tratamento utilizadas que, de forma artificial, fornecem uma ereção rígida, estão sendo reservadas aos casos mais graves de DE, sendo nas demais situações substituídas por agentes farmacológicos planejados para restaurar ou ativar os mecanismos bioquímicos necessários a uma ereção natural8. Heaton e colaboradores (2000) classificaram os agentes utilizados no tratamento da disfunção erétil de acordo com seu mecanismo e local de ação. Esta classificação engloba cinco diferentes categorias9 e pode ser visualizada na Tabela 2. Os principais fármacos atualmente utilizados no tratamento da DE estão listados na Tabela 3.
No mercado, são encontradas formas farmacêuticas de aplicação local (intracavernosa, intrauretral e tópica) e de administração oral. A administração oral é fácil, não-invasiva, facilmente reversível e bem tolerada tanto pelo paciente quanto por sua parceira. Assim, os fármacos de administração oral tornaram-se a terapia de primeira escolha para os mais diversos casos de DE, destacando-se entre eles o sildenafil (7) (Viagra®)11.
Introduzido na terapêutica em 1998, o sildenafil (7) é um inibidor seletivo da isoforma 5 da enzima fosfosdiesterase (PDE 5) e pode ser classificado como um agente condicionador da ereção peniana de ação periférica. Mediante estímulo sexual, sua ação resulta em maior relaxamento da musculatura peniana e, conseqüentemente, em maior acúmulo de sangue nos sinusóides cavernosos, levando à ereção mais rígida. Os efeitos colaterais mais freqüentemente atribuídos a este fármaco são rubor facial, dores de cabeça, congestão nasal e dispepsias, sendo os distúrbios visuais relatados mais raramente. Seu uso é contra-indicado em pacientes com problemas cardíacos ou que fazem uso de nitratos ou outros fármacos doadores de óxido nítrico (NO), devido ao risco de desenvolvimento de hipotensão grave12,13. Outros inibidores de PDE 5 foram sintetizados buscando maior seletividade frente às outras isoformas da enzima14, tendo sido o vardenafil (8) (Levitra®) e o taladafil (9) (Cialis®) recentemente introduzidos no mercado farmacêutico10.
Por outro lado, é de extrema importância o desenvolvimento de fármacos com diferentes mecanismos de ação, que possam beneficiar pacientes até o momento não atendidos pelas terapias atuais. Além disso, diferentes mecanismos de ação podem viabilizar o uso concomitante de dois fármacos, buscando efeito sinérgico e melhor resposta em pacientes não responsivos às terapias isoladas14.
PSICOFARMACOLOGIA DO COMPORTAMENTO SEXUAL MASCULINO
De forma bastante simplificada, o comportamento sexual masculino pode ser dividido em três etapas principais. O primeiro estágio, a libido, está relacionado ao desejo sexual. O segundo estágio é o da excitação, quando são ativados os mecanismos pró-eréteis, preparando a genitália para a relação sexual. O terceiro e último estágio é o orgasmo acompanhado da ejaculação15.
O estágio da libido é extremamente relacionado ao desejo por sexo e é considerado um fenômeno mediado pelas vias dopaminérgicas centrais ligadas aos mecanismos de recompensa. Acredita-se que esta via, denominada via mesolímbica, media não somente os mecanismos do desejo sexual, mas também o orgasmo. Uma influência negativa à libido é exercida pela prolactina, um hormônio secretado pela hipófise, cuja liberação é tonicamente inibida pela neurotransmissão dopaminérgica. Apesar dos relatos de diversos casos de DE diretamente ligada à hiperprolactinemia, a relação entre a prolactina e a função sexual masculina é pouco compreendida15.
O segundo estágio da resposta sexual é a ereção. A mensagem neuroquímica que resulta na preparação do pênis para a relação sexual se inicia no cérebro, segue caminhos descendentes através da medula espinhal e é conduzida por fibras autonômicas periféricas simpáticas e parassimpáticas aos tecidos vasculares e à genitália. Os dois principais neurotransmissores pró-eréteis são a acetilcolina e o NO15. Os mecanismos que levam à ereção peniana serão discutidos mais detalhadamente a seguir.
O último estágio da função sexual masculina é o orgasmo, acompanhado de ejaculação. Fibras serotoninérgicas, que descem através da coluna espinhal, exercem função inibitória sobre este comportamento via ativação de receptores 5-HT2A, enquanto fibras descendentes noradrenérgicas facilitam tanto a ejaculação quanto o orgasmo15. A representação esquemática destes estágios pode ser visualizada na Figura 1.
MECANISMOS DA EREÇÃO PENIANA
A ereção peniana é um fenômeno neurovascular modulado por fatores psicológicos e hormonais, cujo resultado final é o relaxamento da musculatura lisa do pênis. Este fenômeno envolve uma complexa interação entre o sistema nervoso central (SNC) e estímulos locais. É basicamente mediado por reflexos espinhais, pelo processamento de informações no hipotálamo e pela integração de estímulos táteis, visuais, olfatórios, auditivos e imaginários5,6.
Anatomicamente, o corpo cavernoso, principal músculo envolvido no processo da ereção, é enervado por, ao menos, três vias neuroefetoras responsáveis pela modulação de seu tônus: uma via adrenérgica, uma colinérgica e uma terceira denominada não-adrenérgica e não-colinérgica (NANC)5,6. O processo de ereção e detumescência consiste de uma série de complexas interações envolvendo o sistema nervoso autônomo e a subseqüente variação no fluxo sangüíneo local. Este processo pode ser dividido em 7 fases6, mostradas na Tabela 4.
A contração do corpo cavernoso e da musculatura vascular local é mediada por um estímulo a receptores a1-adrenérgicos, limitando o fluxo sangüíneo local e mantendo o estado flácido usual do pênis. A ereção ocorre quando um estímulo erótico, recebido por qualquer um dos cinco sentidos e processado no hipotálamo, resulta na inibição do tônus simpático, no aumento da neurotransmissão parassimpática e na liberação de NO pelas vias NANC e por células endoteliais das arteríolas do pênis. O NO é considerado, atualmente, o principal modulador bioquímico da ereção peniana6. O NO ativa a enzima guanilato ciclase, responsável pela síntese de guanosina monofosfato cíclica (cGMP). A presença de cGMP na musculatura vascular e no corpo cavernoso resulta, em última instância, na diminuição do influxo de cálcio nestes tecidos, induzindo o relaxamento muscular. Este efeito permite a entrada de sangue nos sinusóides cavernosos, produzindo a ereção2,5,6,16. Igualmente importante ao aumento de fluxo sangüíneo no corpo cavernoso é a inibição do defluxo venoso, fenômeno este que ocorre passivamente através da compressão do plexo venoso pelos sinusóides cavernosos distendidos. No retorno ao estado flácido, o cGMP formado é hidrolisado a GMP (guanosina monofosfato) pela enzima fosfodiesterase tipo 5 (PDE 5), a isoforma predominante no pênis2,5,6. Nesta etapa é que atuam os inibidores de PDE 5 (sildenafil (7), vardenafil (8) e taladafil (9)), bloqueando a hidrólise do cGMP e conferindo uma ereção mais duradoura (Figura 2)12,13.
Além de NO, as vias NANC são responsáveis pela liberação de diversos outros mediadores que levam ao relaxamento das musculatura lisa do pênis. Entre eles podemos citar neuropeptídeos, como o peptídeo vasoativo intestinal, peptídeo relacionado ao gene da calcitonina, substância P, purinas, como adenosina trifosfato (ATP); aminoácidos descarboxilados, bem como agentes parácrinos como prostaglandinas, bradicinina e fatores endoteliais. Entre os moduladores anti-eréteis podemos mencionar, além da norepinefrina, o neuropeptídeo Y e agentes parácrinos como tromboxano, histamina, endotelina e angiotensina II8.
Contudo, apesar de toda ação periférica coordenada necessária para a obtenção de uma ereção, quem comanda a ocorrência da mesma é o cérebro. A visão de que este apenas controla os mecanismos responsáveis pelos reflexos pró-eréteis na medula espinhal é hoje considerada muito simplista. Fortes evidências experimentais demonstram que estruturas supraespinhais são capazes, por si próprias, de iniciar uma ereção, provavelmente via projeções diretas aos núcleos espinhais7.
O hipotálamo é, sem dúvida, a principal estrutura supraespinhal envolvida no controle e modulação dos mecanismos que levam à ereção. Dentro deste, pode-se destacar duas áreas principais: o núcleo paraventricular (PVN) e a área preóptica medial (MPOA). Porém, outras regiões centrais também estão envolvidas nos mecanismos pró-eréteis, como o núcleo medial dorsal do tálamo, o hipocampo e algumas áreas corticais17.
A MPOA é a mais forte candidata ao papel de centro integrativo supraespinhal, possuindo função tanto na motivação frente a estímulos sexuais, quanto na coordenação dos reflexos genitais necessários à ereção e à ejaculação, e na coordenação dos movimentos específicos de cada espécie necessários à consumação da cópula18,19. Esta região é responsável por receber informações hormonais, sensoriais e de mais uma variedade de origens, processá-las e redistribuí-las a estruturas mais diretamente conectadas com os núcleos espinhais que controlam a ereção, como é o caso do PVN. O PVN contém neurônios pré-motores, que se projetam diretamente à medula espinhal, e diversos dados experimentais sugerem que esta região seja o centro supraespinhal dos estímulos pró-eréteis20.
Diversos neurotransmissores e neuropeptídeos estão envolvidos no controle dos estímulos pró-eréteis nas diversas regiões centrais envolvidas. Um corpo crescente de evidências tem apontado para o papel fundamental de neuromoduladores como NO, serotonina, dopamina (10) e ocitocina. Em particular, o papel da dopamina (10) tem se mostrado fundamental na mediação das respostas eréteis em roedores, não-roedores, primatas não-humanos e homens9,19,20.
DOPAMINA E OS MECANISMOS DE EREÇÃO PENIANA
A dopamina (10) constitui cerca de 80% do conteúdo de catecolaminas cerebrais, possuindo importante papel na regulação de fatores motivacionais, cognitivos, motores e hormonais. Neurônios dopaminérgicos encontram-se principalmente em regiões do mesencéfalo (substância negra, estriado, amigdala) e diencéfalo (hipotálamo). A dopamina (10) exerce seus efeitos biológicos através da ativação de duas famílias de receptores: a D1-like, que compreende os sub-tipos D1 e D5, e a D2-like, da qual fazem parte os receptores D2, D3 e D421,22.
Todos os cinco subtipos de receptores dopaminérgicos exercem suas ações biológicas através da ligação e ativação de diferentes proteínas G. Os receptores D1-like interagem com o complexo protéico Gs, que ativa a enzima adenilato ciclase e, conseqüentemente, aumenta a síntese de adenosina monofosfato cíclico (cAMP). Já a ligação de agonistas aos receptores D2-like resulta na ativação de proteínas Gi ou G0, exercendo influência negativa sobre a atividade da adenilato ciclase (Figura 3)21,23. Estas duas famílias de receptores podem apresentar efeitos fisiológicos opostos ou sinérgicos, dependendo da via central envolvida, bem como do efeito que está sendo observado.
Os receptores D1 são os mais amplamente distribuídos e expressos no SNC, sendo encontrados em regiões como o estriado, núcleo accumbens e tubérculo olfatório, bem como tálamo e hipotálamo. Os receptores D5 possuem um padrão de expressão muito mais restrito, sendo sua presença detectada apenas no hipocampo, no tálamo e no hipotálamo24.
O receptor D2 é o mais abundante da família D2-like, sendo encontrado em áreas como estriado, substância negra, tubérculo olfatório e núcleo accumbens. O receptor D3 é encontrado em abundância nas ilhas de Calleja e em níveis menores em alguns núcleos septais, cerebelo, tálamo e hipotálamo (PVN)24. Por fim, os receptores D4 são encontrados principalmente no cortex entorrinal, núcleo septal lateral, hipocampo e na MPOA25.
São três as principais vias dopaminérgicas responsáveis pelo controle da motivação sexual e das respostas genitais e motoras em ratos machos. A ativação da via nigroestriatal está relacionada à resposta a estímulos sexuais, bem como aos aspectos motores necessários à consumação da cópula. A via mesolímbica, como já comentado, está estreitamente relacionada a fatores de apetite sexual, como a motivação, a libido e a sensação de recompensa. A via dopaminérgica incerto-hipotalâmica é a responsável pela liberação de dopamina (10) tanto na MPOA quanto no PVN, sendo esta a via diretamente ligada aos efeitos pró-eréteis de agentes dopaminérgicos18,19.
A habilidade de agonistas dopaminérgicos em induzir ereções penianas é descrita desde 1975 e foi sucessivamente confirmada por um grande número de estudos. Esta investigação teve início a partir da observação do efeito erectogênico da apomorfina (5)26. A apomorfina (5) é um agonista dopaminérgico não-seletivo com afinidade um pouco maior por receptores D2-like (Ki's: D1 = 680 nM, D2 = 24 nM, D3 = 32 nM, D4 = 4 nM, D5 = 163 nM)24. A administração sistêmica de baixas doses deste composto é capaz de induzir ereções ex-cópula em ratos e camundongos. Este efeito é inibido por baixas doses de antagonistas D2 centrais (haloperidol (11)), mas não pela administração de domperidona (12) (antagonista D2 periférico - não ultrapassa a barreira hematoencefálica), confirmando o SNC como o local de ação primário deste fármaco19,27.
Inúmeros estudos demonstram o efeito erectogênico da administração sistêmica de baixas doses de agonistas D2 seletivos, como quimpirol (13), quinorelano (14) e bromocriptina (15)11,19. Porém, os dados referentes à administração sistêmica de agonistas D1 (SKF 38393 (16), CY 208-243 (17)) são conflitantes. Primeiramente, acreditava-se que os mesmos não possuíam efeito sobre os mecanismos pró-eréteis, quando administrados sistemicamente11,19. Mais recentemente, com o desenvolvimento de agonistas plenos de receptores D1, como o A 77636 (18), foi demonstrada a participação deste tipo de receptores no efeito erectogênico da dopamina (10) em roedores26.
A microinjeção de agentes dopaminérgicos nas principais regiões hipolâmicas envolvidas nos mecanismos da ereção apresenta resultados bastante claros e contrastantes. Evidências sugerem que um pequeno aumento na quantidade de dopamina (10) liberada na MPOA leva à ativação de receptores D1-like, facilitando o desenvolvimento de ereções mediadas pelo sistema nervoso parassimpático12. Por outro lado, altos níveis de dopamina (10) resultam na ativação de receptores D2-like favorecendo os efeitos simpáticos, como a detumescência e a ejaculação18. A natureza oposta da ação das duas famílias de receptores dopaminérgicos nesta região é confirmada pelo fato de que a ativação de receptores D1-like provoca a inibição da emissão de sêmen, provavelmente prevenindo a ejaculação precoce. Por outro lado, altas doses de agonistas de receptores D2-like inibem os mecanismo eréteis e diminuem a duração da cópula28. Estes indícios apontam para uma regulação dos diversos estágios do comportamento sexual masculino através do aumento dos níveis extracelulares de dopamina (10), mediante a ativação de diferentes famílias de receptores nesta região.
Experimentos semelhantes demonstraram que, ao contrário da MPOA, no PVN a ativação de receptores D2-like possui um papel facilitatório sobre os mecanismos eréteis. Em baixas doses, a microinjeção tanto de apomorfina (5) quanto de agonistas seletivos de receptores D2 (lisurida (19), quimpirol (13), quinorelano (14)) no PVN aumenta o número de ereções, enquanto em doses mais altas ocorre aumento da emissão de sêmen e diminuição dos reflexos penianos29,30. A microinjeção de agonistas D1 (SKF 38393 (16)) nesta área não teve nenhum efeito sobre o número de ereções, porém a administração de um antagonista D1 (SCH 23390 (20)) resulta no aumento do número de ejaculações, sugerindo papéis antagônicos das famílias de receptores dopaminérgicos também no PVN19.
Dados experimentais apontam para o PVN como o local de ação primário da apomorfina (5) na indução da ereção. A administração de apomorfina (5) no PVN, em doses capazes de induzir ereções penianas, leva a um aumento de cerca de 4 a 5 vezes na concentração dos metabólitos do NO nesta região. A pré-administração tanto de haloperidol (11) quanto de L-NAME (inibidor da enzima óxido nítrico sintetase NOS) foi capaz de inibir este aumento na produção de NO, bem como o efeito pró-erétil da apomorfina (5). O mesmo não foi observado quando da pré-administração de um antagonista seletivo D1 (SCH 23390 (20))31. O PVN também é uma região rica em neurônios que sintetizam ocitocina e se projetam aos núcleos espinhais da região sacrolombar. Em ratos, a administração intracerebroventricular de ocitocina e apomorfina (5) resulta em respostas similares, caracterizadas pela indução de ereções penianas, ambas bloqueadas pelo pré-tratamento sistêmico com um antagonista de receptores de ocitocina9,31.
Assim, a principal hipótese para o mecanismo da ação pró-erétil da apomorfina é que a administração desta leva à estimulação de receptores D2-like no PVN, a qual dispara uma cascata de eventos bioquímicos intracelulares, que levam à ativação da enzima NOS e o conseqüente aumento na síntese de NO. O aumento da concentração de NO intracelular, por sua vez, estimula a liberação de ocitocina em outras regiões do SNC, como o hipocampo e a medula espinhal, resultando na promoção da ereção peniana31.
Além da interação com ocitocina e NO, outra interação importante demonstrada foi entre agentes dopaminérgicos e hormônios esteróides. Sabe-se que em animais castrados o efeito positivo da apomorfina (5) sobre os mecanismos eréteis é abolido, mas, em animais que venham a receber reposição hormonal com testosterona, ocorre a restauração do mesmo. Porém, um aumento na concentração circulante deste hormônio não é capaz de potenciar os efeitos da apomorfina (5). Estes dados sugerem que a presença de testosterona é essencial para o efeito de agonistas dopaminérgicos e que a redução nos níveis destes hormônios influencia indiretamente os efeitos da dopamina (10) sobre os mecanismos eréteis9,19.
AGENTES DOPAMINÉRGICOS E O TRATAMENTO DA DISFUNÇÃO ERÉTIL
A procura por uma terapia farmacológica ideal para o tratamento da DE tem o objetivo de satisfazer características como eficácia, fácil administração, redução da toxicidade e efeitos adversos, bem como oferecer uma latência e duração de efeito adequadas ao quadro, visando sempre a melhor aceitação do tratamento pelo paciente e sua parceira, bem como a melhoria na qualidade de vida de ambos1. O avanço no conhecimento das bases fisiológicas e bioquímicas da ereção peniana e da própria DE abriu novas perspectivas para o desenvolvimento de fármacos pró-eréteis. A observação de que medicamentos corriqueiramente utilizados no tratamento de distúrbios neuropsiquiátricos podem causar ou agravar uma disfunção sexual levou à percepção de que fármacos de ação central também poderiam ser utilizados para reverter este quadro. Atualmente, a apomorfina (5) pode ser considerada o protótipo farmacológico de uma nova série de fármacos dopaminérgicos de ação central, eficazes no tratamento da DE, que está prestes a surgir.
Os primeiros relatos do efeito de agentes dopaminérgicos na atividade sexual datam da década de 60, quando foi observado que a utilização da apomorfina (5) no tratamento de alguns sintomas de Parkinson apresentava como efeito colateral a indução de ereções em alguns pacientes. Sintetizada pela primeira vez no final do século XIX, a apomorfina (5) apresenta um longo histórico de segurança em humanos32. Este fato e dados pré-clínicos anteriormente descritos aqui, que demonstram um mecanismo de ação apropriado ao tratamento da DE, levaram à introdução da apomorfina sublingual (Uprima®) no mercado farmacêutico9, em 2001.
Apomorfina
A apomorfina (5) é um derivado sintético obtido pelo tratamento da morfina (21) com ácido clorídrico concentrado (Esquema 1)33. Esta apresenta similaridades estruturais com a dopamina (10), ilustradas na Figura 4. De acordo com Heaton e colaboradores (2000), pode ser classificada como um agente iniciador da ereção de ação central18. Dados de sua avaliação pré-clínica, bem como seu mecanismo de ação já foram discutidos anteriormente e não serão aqui mencionados.
Em estudos clínicos, a administração subcutânea (s.c.) de apomorfina (5) (0,25 1,0 g) mostrou-se efetiva na indução de ereções. Porém, diversos relatos de náuseas graves ocorreram demonstrando uma relação efeito adverso/benefício inaceitável. Este fato levou ao desenvolvimento de uma forma de administração sublingual (SL) para a apomorfina (5), que resultou na absorção rápida e eficiente da mesma, com um tempo de meia-vida plasmática (t1/2) de 2 a 3 h, além de apresentar a vantagem, frente a formas orais de administração, de ser inalterada pela ingesta de alimentos2,5,11,34. Dados farmacocinéticos a respeito da apomorfina (5) são escassos. Sabe-se que esta é muito pouco absorvida por via gastrointestinal e é rapidamente eliminada do organismo, devido a seu elevado volume de distribuição e rápida biotransformação6. Porém, quando administrada na forma sublingual, a apomorfina (5) não sofre efeito de primeira passagem, atingindo rapidamente os níveis plasmáticos necessários ao efeito terapêutico11.
Contudo, náuseas também são o principal efeito indesejado quando da administração sublingual, sendo um episódio relatado por cerca de 7% dos pacientes em estudos clínicos11. Este efeito se dá através da ativação de receptores do subtipo D2, principalmente periféricos que, em última instância, levam à diminuição da motilidade gástrica. Outros feitos adversos como êmese, cansaço, bocejos e tonturas são dose-dependentes e pouco relatados ou de baixa intensidade nas doses terapêuticas6,34.
Com a apomorfina SL, o efeito central desejado já é alcançado em doses menores que 1 mg. Um estudo clínico realizado com 457 pacientes com DE sem um componente orgânico maior9 relatou uma percentagem de sucesso na relação sexual de 45,8, 52,0 e 59,6% para as doses de 2, 4 e 6 mg, respectivamente, frente a valores de placebo em torno de 30%. A realização de vários outros estudos de fase III levou à conclusão de que a dose ideal para o tratamento é de 3 mg. Nesta dose, a ocorrência da ereção se dá, em média, em 23 min, com uma duração média de 13 min2,5,11,34.
Outros estudos clínicos demonstraram o efeito pró-erétil do tratamento com apomorfina SL em homens normais, impotentes e alcoólatras, confirmando sua eficácia no tratamento da DE. O fármaco pode ser utilizado em pacientes com hiperplasia prostática benigna, doença arterial coronariana e hipertensão6. A apomorfina (5) não possui propriedades analgésicas decorrentes de sua similaridade estrutural com a morfina (21) e nem capacidade de induzir dependência11. Em conjunto, estes dados apontam para a apomorfina SL como alternativa eficaz e segura para o tratamento de diversos casos de DE.
Outros agentes dopaminérgicos
Poucos estudos clínicos existem sobre o efeito de outros agentes dopaminérgicos nos mecanismos eréteis e no tratamento da DE. É relatado que a administração de L-DOPA (22), um precursor da biossíntese de dopamina (10) (Esquema 2), é capaz de induzir ereções em pacientes que sofrem da doença de Parkinson5,35.
O quinorelano (14) é um agonista seletivo de receptores do subtipo D2, eficaz na indução de ereções em modelos animais. Porém, os estudos clínicos com esta substância foram descontinuados prematuramente antes que sua eficácia pudesse ser comprovada5.
A bromocriptina (15) é um alcalóide do ergot com ação agonista de receptores D2-like. Alguns relatos apontam para a potencial utilização deste fármaco no tratamento da DE causada por hiperprolactinemia36. Estudo realizado com 17 pacientes que obtiveram sucesso no tratamento com apomorfina (5) aponta para a potencial ação pró-erétil deste fármaco, uma vez que oito destes pacientes apresentaram melhora após o tratamento com bromocriptina (15)37. Porém, ainda existe a necessidade da realização de estudos complementares que possam confirmar os efeitos benéficos deste fármaco.
A possibilidade de utilização da bupropiona (23) no tratamento da DE também vem sendo discutida. A bupropiona (23) é um fármaco antidepressivo inibidor da recaptação de aminas bioativas, com uma afinidade muito maior pelo transportador de dopamina (DAT) que de noradrenalina (NAT) e serotonina (5-HTT) (Ki's: NAT = 52,6 µM; 5-HTT = 9,1 µM; DAT = 0,53 µM)38. Uma das abordagens que vem sendo investigada é a utilização de uma forma de liberação controlada deste fármaco para o tratamento da DE induzida por antidepressivos inibidores seletivos da recaptação de serotonina (ISRS). Um primeiro estudo publicado em 2001 com a administração de 150 mg/dia da forma de liberação controlada por um período de três semanas apresentou resultados negativos na melhoria da DE39. Porém, estudos posteriores vêm demonstrando a eficácia deste tratamento quando administrado por períodos maiores (4 a 6 semanas). Estes estudos relatam a melhoria do desempenho sexual de pacientes deprimidos em tratamento com ISRS, bem como o aumento do desejo sexual e da freqüência de relações dos mesmos40.
Finalmente, explorando a reconhecida habilidade de derivados piperazínicos e piperidínicos adequadamente funcionalizados modularem em maior ou menor extensão os bioreceptores dopaminérgicos22, várias indústrias farmacêuticas vêm investindo na obtenção de novos e seletivos ligantes dopaminérgicos que apresentem propriedades pró-eréteis, mas sejam destituídos dos efeitos adversos da apomorfina (5). Isto pode ser exemplificado por três registros internacionais de proteção patentária41-43 de moléculas com ação agonista seletiva de receptores D4, efetivas em modelos de ereção peniana e êmese em roedores (Tabela 5). Uma vez que o subtipo de receptor D4 apresenta distribuição restrita a alguns centros do SNC, entre eles a MPOA, esta abordagem pode representar uma perspectiva promissora na descoberta de novos agentes úteis no tratamento da DE.
No Brasil, nosso grupo depositou recentemente um pedido de proteção patentária44 junto ao INPI (Instituto Nacional de Propriedade Industrial) de uma série de novos derivados N-fenilpiperazínicos com ação dopaminérgica45,46. Ensaios preliminares com uma destas substâncias, denominada LASSBio579 (28), demonstraram seu potencial para o tratamento da DE, através da observação de efeito pró-erétil em camundongos (Tabela 5)44. Estudos complementares com LASSBio579 (28) e outros derivados N-fenilpiperazínicos estruturalmente relacionados estão sendo realizados a fim de se obter um novo protótipo de fármaco pró-erétil com ação central.
GLOSSÁRIO
Administração intracavernosa procedimento pelo qual se injeta o medicamento diretamente na musculatura do pênis (corpo cavernoso), objetivando ação local47.
Administração intracerebroventricular (i.c.v.) procedimento geralmente realizado em roedores, através do qual se injeta a substância teste dentro de um dos ventrículos cerebrais para confirmar o SNC como seu local de ação47.
Administração intrauretral procedimento pelo qual se aplica o medicamento no interior da uretra, objetivando ação local47.
Administração subcutânea (s.c.) procedimento pelo qual se injeta o medicamento imediatamente abaixo da última camada da pele (derme), objetivando a absorção mais rápida para ação sistêmica47.
Administração sublingual (s.l.) procedimento pelo qual se aplica o medicamento abaixo da língua, objetivando a absorção mais rápida para ação sistêmica. Geralmente empregada para evitar a eliminação pré-sistêmica47.
Agentes parácrinos substâncias elaboradas por células especializadas existentes em certas glândulas endócrinas e em glândulas do sistema digestivo cujas ações, com freqüência, são exercidas principalmente em células vizinhas48.
Amigdala estrutura do sistema límbico, também chamada corpo amigdalóide ou núcleo amigdalóide48. É um núcleo em forma de amêndoa localizada no interior do lobo temporal, envolvida no controle das emoções e em certos processos de aprendizagem e memória22.
Área preóptica medial (MPOA) pequena área pertencente ao hipotálamo, localizada na parte mais anterior do III ventrículo cerebral49.
Aterosclerose combinação variável de alterações no interior das artérias, que consiste no acúmulo local de placas lipídicas nas paredes dos vasos, podendo levar ao bloqueio do fluxo sangüíneo no vaso ou à promoção de trombose50,51.
Córtex entorrinal pequena área pertencente ao giro para-hipocampal formada por um tipo de córtex muito antigo (paleocórtex). Informações sensoriais processadas no córtex cerebral penetram no sistema límbico através desta região, de onde seguem para o hipocampo49.
Detumescência processo de transição do pênis do estado ereto para o flácido, caracterizado pela liberação do defluxo venoso e conseqüente diminuição da pressão intracavernosa6,8.
Dispepsia digestão perturbada, distúrbio gástrico51,52.
Doença de Parkinson também chamada parkinsonismo. Causada pela perda de neurônios da parte compacta da substância negra que fornece enervação dopaminérgica ao estriado, pode ser caracterizada por três efeitos clínicos: tremor nas extremidades, rigidez e oligocinesia (lentidão e redução da atividade motora espontânea, dificuldade em dar início aos movimentos)49,53.
Efeito sinérgico situação na qual os efeitos combinados de dois fármacos atuando simultaneamente são maiores que a soma algébrica de seus efeitos individuais. Um sinergismo é dito terapêutico quando o efeito obtido pela combinação dos fármacos representa vantagem no tratamento de determinado quadro47.
Êmese processo de contração do piloro (porção terminal do estômago) e relaxamento da parte susperior do estômago que, junto com a contração coordenada do diafragma e dos músculos abdominais, leva à expulsão do conteúdo gástrico. Vômito54.
Estriado estrutura cerebral formada pelo núcleo caudado, o putâmem e o globo pálido. Sua função é essencialmente motora, exercendo influência tanto na execução do movimento voluntário como no planejamento do ato motor. O estriado e o núcleo accumbens formam os núcleos da base49.
Estruturas supraespinhais estruturas pertencentes ao sistema nervoso central, situadas acima da medula espinhal22,49.
Fibras autonômicas fibras nervosas (conjunto de axônios) pertencentes ao sistema nervoso autônomo49.
Hiperplasia prostática benigna aumento de volume da próstata devido ao aumento do número de células51.
Hiperprolactinemia secreção aumentada de prolactina, geralmente causada pela presença de tumores na hipófise ou pelo tratamento crônico com fármacos antagonistas dopaminérgicos55.
Hipocampo estrutura alongada e curva que, no homem, se situa acima do giro para-hipocampal. Formado por um tipo de córtex muito antigo (arqueocórtex). Possui importante função na regulação do comportamento emocional e nos processos de aprendizagem e memória22,49.
Hipogonadismo Hipofunção das glândulas sexuais. No caso de homens, caracteriza-se pela deficiência de testosterona devido à diminuição da secreção interna dos testículos. Esta diminuição pode ser resultante de um defeito primário (anomalia congênita, desenvolvimento testicular incompleto) ou secundário a uma insuficiência de estimulação pela hipófise51,56.
Hipotálamo estrutura cerebral situada na parte ventral do diencéfalo, dispondo-se nas paredes do III ventrículo, abaixo do tálamo. É constituída fundamentalmente de substância cinzenta, que se agrupa em núcleos. Suas principais funções são a regulação do sistema nervoso autônomo, da temperatura corporal e da glândula hipofisária22,49.
Ilhas de Calleja aglomerados de células nervosas distribuídos ao longo da face ventral do tubérculo olfatório, geralmente considerados como parte do estriado. Outros autores as consideram uma extensão rostral do hipotálamo lateral. Estão envolvidas principalmente na mediação dos reflexos neuroendócrinos57.
Neurônios pré-motores neurônios eferentes que possuem conexão sináptica com um neurônio motor49.
Núcleo accumbens estrutura cerebral constituída de massa de substância cinzenta situada na zona de união entre o putâmem e a cabeça do núcleo caudado, também denominada de corpo estriado ventral49.
Núcleo paraventricular (PVN) estrutura cerebral constituída de massa de substância cinzenta situada no hipotálamo supra-óptico49.
Núcleos septais aglomerados de corpos de neurônios situados abaixo do corpo caloso. Compõem o septo, uma estrutura do sistema límbico. Também são denominados grupos de neurônios subcorticais49.
Plexo venoso rede de veias anastomosadas, isto é, que possuem comunicação entre si51.
Prolactina hormônio secretado pela hipófise anterior, é um polipeptídeo único de 199 resíduos de aminoácidos, com massa molecular de 23 kDa. A prolactina desencadeia o processo de lactação após o acentuado declínio das concentrações de estrogênio e progesterona que ocorre após o parto55.
Região sacrolombar região situada na altura das vértebras lombares e sacrais da medula espinhal51.
Sinusóides cavernosos vasos sangüíneos relativamente grandes, que constituem a principal parte do sistema circulatório do corpo cavernoso51.
Substância negra estrutura cerebral, núcleo compacto formado por neurônios, que apresentam a peculiaridade de conter inclusões de melanina, situado próximo à base do pedúnculo cerebral49. Utiliza dopamina como neurotransmissor e enerva o estriado22.
Tálamo estrutura cerebral situada na parte dorsal do diencéfalo, disposta acima do sulco hipotalâmico. Fundamentalmente constituída de substância cinzenta, em sua estrutura podem ser distinguidos vários núcleos. Sua principais funções são o reconhecimento de estímulos sensitivos, a regulação da motricidade, do comportamento emocional e a ativação do neocórtex22,49.
Tubérculo olfatório estrutura cerebral, dilatação de substância cinzenta responsável pelo processamento dos estímulos olfatórios49.
Via incerto-hipotalâmica conexão de neurônios cujos corpos neuronais estão localizados na porção rostral da zona incerta medial e apresentam curtas projeções a várias regiões do hipotálamo58.
Via mesolímbica conexão de neurônios cujos corpos neuronais se encontram predominantemente na área tegmentar ventral e projetam seus axônios a áreas límbicas do cérebro, como o núcleo accumbens, septo, amígdala e o tubérculo olfatório. A esta via é atribuída importante função no controle das emoções e motivações15,23.
Via nigroestriatal conexão de neurônios cujos corpos neuronais estão localizados na substância negra e se projetam ao estriado. Esta via é associada ao controle de funções motoras15,23.
AGRADECIMENTOS
Este trabalho foi desenvolvido no âmbito do Programa PROCAD/CAPES, ao qual os autores agradecem.
48. Morrow, J. D.; Roderts II, J. Em ref. 38, p. 643.
50. Mahley, R. W.; Bersot, T. P. Em ref. 38, p. 971.
52. Hoogerwerf, W. A.; Pasricha, P. J. Em ref. 38, p. 1005.
53. Standaert, D. G.; Young, A. B. Em ref. 38, p. 549.
54. Pasricha, P. J. Em ref. 38, p. 1021.
55. Parker, K. L.; Schimmer, B. P. Em ref. 38, p. 1541.
56. Snyder, P. J. Em ref. 38, p. 1635.
Recebido em 30/7/03; aceito em 15/3/04; publicado na web em 27/8/04
- 1. Wespes, E.; Amar, A.; Hatzichristou, D.; Montorsi, F.; Pryor, J.; Vardi, Y.; Eur. Urol. 2002, 41, 1.
- 2. Cohan, P.; Korenman, S. G.; J. Clin. Endocrinol. Metabol. 2001, 86, 2391.
- 3. Feldman, H. A.; Goldstein, I.; Hatzichristou, D. G.; Krane, R. J.; McKinlay, J. B.; J. Urol. 1994, 151, 54.
- 4. Moreira, E. D.; Abdo, C. H. N.; Torres, E. B.; Lobo, C. F. L.; Fittipaldi, J. A. S.; Urology 2001, 58, 583.
- 5. Andersson, K. E.; Pharmacol. Rev 2001, 53, 417.
- 6. Thomas, J. A.; Jpn. J. Pharmacol. 2002, 89, 101.
- 7. Wirshing, D. A.; Pierre, J. M.; Marder, S. R.; Saunders, C. S.; Wirshing, W. C.; Schizoph. Res. 2002, 56, 25.
- 8. Burnett, A. L.; Urology 1999, 54, 392.
- 9. Heaton, J. P. W.; Neurosci. Biobehav. Rev. 2000, 24, 561.
-
10http://www.anvisa.gov.br/, acessada em Março 2003.
- 11. Brock, G.; Eur. Urol. Suppl. 2002, 1, 12.
- 12. Zarrindast, M.; Shokravi, S.; Samini, M.; Gen. Pharmac. 1992, 23, 671.
- 13. Markowiski, V. P.; Eaton, R. C.; Lumley, L. A.; Moses, J.; Hull, E. M.; Pharmacol. Biochem. Behav. 1994, 47, 483.
- 14. Fricker, J.; DDT 2001, 6, 704.
- 15. Stahl, S. M.; Essential Psychopharmacology Neuroscientific Basis and Practical Applications, Cambridge University Press: New York, 2000, p. 539.
- 16. Queiroz, S. L.; Batista, A. A,; Quim. Nova 2003, 22, 584.
- 17. Giuliano, F.; Rampin, O.; Neurosci. Biobehav. Rev. 2000, 24, 517.
- 18. Hull, E. M.; Lorrain, D. S.; Du, J.; Matuszewich, L.; Lumley, L. A.; Putnam, S. K.; Moses, J.; Behav. Brain Res. 1999, 105, 105.
- 19. Melis, M. R.; Argiolas, A.; Neurosc. Biobehav. Rev. 1995, 19, 19.
- 20. Agmo, A.; Paredes, R. G.; Ramos, J. I.; Contreras, J. L.; Pharmacol. Biochem. Behav. 1996, 55, 289.
- 21. Cooper, J. R.; Bloom, F. E.; Roth, R. H.; The Biochemical Basis of Neuropharmacology, Oxford University Press: New York, 1996, p. 293.
- 22. Menegatti, R.; Fraga, C. A. M.; Barreiro, E. J.; Eifler Lima, V. L.; Rates, S. M. K; Dalla Costa, T.; Quim. Nova 2004, 27, 447.
- 23. Bear, M. F.; Connors, B. W.; Paradiso, M. A.; Neuroscience Exploring the Brain, Williams & Wilkins: Baltimore, 1996, p. 122.
- 24. Vallone, D.; Picetti, R.; Borrelli, E.; Neurosci. Behav. Rev. 2000, 24, 125.
- 25. Primus, R.; Thurkauf, A.; Xu, J.; Yevich, E.; McInerney, S.; Shaw, K.; Tallman, J.; Gallagher, D.; J. Pharmacol. Exp. Ther. 1997, 282, 1020.
- 26. D'Aquila, P. S.; Panin, F.; Cossu, M.; Peana, A. T.; Serra, G.; Eur. J. Pharmacol. 2003, 460, 71.
- 27. Rampin, O.; Jérôme, N.; Suaudeau, C.; Life Sci. 2003, 72, 2329.
- 28. Hull, E. M.; Eaton, R. C.; Markowski, V. P.; Moses, J.; Lumley, L. A.; Loucks, J. A.; Life Sci. 1992, 51, 1705.
- 29. Eaton, R. C.; Markowski, V. P.; Lumley, L. A.; Thompson, J. T.; Moses, J.; Hull, E. M.; Pharmacol. Biochem. Behav. 1991, 39, 177.
- 30. Chen, K. K.; Chan, J. Y.; Chang, L. S.; J. Urol. 1999, 162, 237.
- 31. Melis, M. R.; Argiolas, A.; Prog. Neuro-Pharmacol. Biol. Psychiat. 1997, 21, 899.
- 32. Giuliano, F.; Eur. Urol. Suppl. 2002, 1, 1.
- 33. Small, L.; Faris, B. F.; Mallonee, J. E.; J. Org. Chem. 1940, 5, 334.
- 34. Stief, C.; Padley, R. J.; Perdok, R. J.; Sleep, D. J.; Eur. Urol. Suppl. 2002, 1, 12.
- 35. Jiménez-Jiménez, F. J.; Tallón-Barranco, A.; Cabrera-Valdivia, F.; Gasalla, T.; Orti-Pareja, M.; Zurdo, M.; Neurology 1999, 52, 210.
- 36. Lopez-Cubillana, P.; Hita-Rosino, E.; Asensio-Egea, L.; Rigabert-Montiel, M.; Hita-Villaplana, G.; Server-Pastor, G.; Server Falgas, G.; Arch. Esp. Urol. 1997, 50, 526.
- 37. Lal, S.; Kiely, M. E.; Thavundayil, J. X.; Stewart, J. D.; Assalian, P.; Ackman, C. F.; J. Psychiatry Neurosci. 1991, 16, 262.
- 38. Baldessarini, R. J. Em Goodman & Gilman's Pharmacological Bases of Therapeutics; Hardman, J. G.; Limbird, L. E., eds.; McGraw Hill: New York, 2001, p. 643.
- 39. Masand, P. S.; Ashton, A. K.; Gupta, S.; Frank, B.; Am. J. Psychiatry 2001, 158, 805.
- 40. Ashton, A. K.; Masand, P. S.; Gupta, S.; Frank, B.; Am. J. Psychiatry 2002, 159, 677.
- 41. Brioni, J. D.; Kolasa, T.; Hsieh, G.; Donnelly-Roberts, D. L.; The Use of Selective Dopamine D4 Receptor Agonists for Treating Sexual Dysfunction, 2002, WO 02/041894 A2.
- 42. Cowart, M. D.; Bhatia, P. A.; Daanen, J. F.; Stewart, A. O.; Kolasa, T.; Rohde, J. J.; Patel, M. V.; Brioni, J. D.; Benzimidazoles that are Useful in Treatingt Sexual Dysfunction, 2002, WO 02/088093 A1.
- 43. Cowart, M. D.; Bhatia, P. A.; Daanen, J. F.; Stewart, A. O.; Patel, M. V.; Kolasa, T.; Brioni, J. D.; US pat. 008878 2003
- 44. Barreiro, E. J.; Rates, S. M. K.; Neves, G.; Dalla-Costa, T. C. T.; Tasso, L.; Fraga, C. A. M.; Eifler-Lima, V. L.; Menegatti, R.; Br INPI 0303465-8 1999
- 45. Menegatti, R.; Cunha, A. C.; Ferreira, V. F.; Perreira, E. F. R.; El-Nawabi, A.; Eldefrawi, A. T.; Albuquerque, E. X.; Neves, G.; Rates, S. M. K.; Fraga, C. A. M.; Barreiro, E. J.; Bioorg. Med. Chem. 2003, 11, 4807.
- 46. Neves, G.; Fenner, R.; Heckler, A. P.; Viana, A. F.; Tasso, L.; Menegatti, R.; Fraga, C. A. M.; Barreiro, E. J.; Dalla-Costa, T. C.; Rates, S. M. K.; Braz. J. Med. Biol. Res. 2003, 36, 625.
- 47. Arias, T. D.; Glosario de Medicamentos: Desarrollo, Evaluación y Uso, OPS/OMS, Washington, 1999, p. 1.
- 49. Machado, A.; Neuroanatomia Funcional, Atheneu: São Paulo, 2000.
- 51. Osol, A.; Dicionário Médico Blakiston, McGraw Hill: São Paulo, 1995.
- 57. Calaresu, F. R.; Zhang, J.; Chitravanshi, V. C.; McKitrick, D. J.; Brain Res. 1994, 655, 45.
- 58. Moore, K. E.; Lookingland, K. J. Em Psychopharmacology The Fourth Generation of Progress; Bloom, F. E.; Kupfer, D. J., eds.; Raven Press Ltda: Nova York, 1995, p. 245.
Datas de Publicação
-
Publicação nesta coleção
30 Nov 2004 -
Data do Fascículo
Dez 2004
Histórico
-
Aceito
15 Mar 2004 -
Recebido
30 Jul 2003