Resumo
Brucite (Mg(OH)2) is a structural model of several natural layered minerals as well as of synthetic layered double hydroxides (LDH). Exchange reaction studies of these compounds are well documented in the literature but surface chemical modifications, especially for brucite, are quite rare. We report the behaviour of brucite in reaction with succinic and benzoic acid in different solvents and temperatures. The compounds were analysed through X-ray diffraction (XRD) and infrared spectroscopy (FTIR). The surfaces of brucite crystals were grafted producing expansions, attributed to the arrangement of the grafted species between the layers.
brucite; grafting; carboxylic acids
brucite; grafting; carboxylic acids
ARTIGO
Intercalação e funcionalização da brucita com ácidos carboxílicos
Intercalation and functionalization of brucite with carboxylic acids
Fernando Wypych* * e-mail: wypych@quimica.ufpr.br ; Gregorio Guadalupe Carbajal Arízaga
Departamento de Química, Universidade Federal do Paraná, CP 19081, 81531-990 Curitiba - PR
ABSTRACT
Brucite (Mg(OH)2) is a structural model of several natural layered minerals as well as of synthetic layered double hydroxides (LDH). Exchange reaction studies of these compounds are well documented in the literature but surface chemical modifications, especially for brucite, are quite rare. We report the behaviour of brucite in reaction with succinic and benzoic acid in different solvents and temperatures. The compounds were analysed through X-ray diffraction (XRD) and infrared spectroscopy (FTIR). The surfaces of brucite crystals were grafted producing expansions, attributed to the arrangement of the grafted species between the layers.
Keywords: brucite; grafting; carboxylic acids.
INTRODUÇÃO
Processos de intercalação envolvendo matrizes derivadas da estrutura da brucita (Mg(OH)2), especialmente em hidróxidos duplos lamelares (HDL), são amplamente discutidos na literatura1-4. As matrizes dos HDL estão intimamente ligadas à estrutura da brucita, onde íons magnésio são coordenados octaedricamente a grupamentos hidroxila. Esses octaedros estão ligados entre si através das arestas, obtendo-se lamelas "bidimensionais", que são ligadas umas às outras através de forças de van der Waals e ligações de hidrogênio.
Os HDL possuem uma formulação genérica do tipo [M+21-xM+3x (OH)2]x+(Am- )x/m.nH2O, onde M+3 e M+2 representam cátions passíveis de ocuparem sítios octaédricos e Am- representa um ânion de carga m-. Nesses compostos, o cátion trivalente substitui isomorficamente um cátion divalente da estrutura do hidróxido, criando cargas residuais que são compensadas com a intercalação de ânions hidratados. As forças que mantêm esta estrutura coesa são atribuídas às forças eletrostáticas entre as lamelas positivamente carregadas e os ânions, além de ligações de hidrogênio estabelecidas entre as moléculas de água co-intercaladas e grupamentos hidroxila das lamelas.
Matrizes contendo diferentes metais ou mesmo metal com diferentes estados de oxidação podem também produzir compostos semelhantes aos HDL5,6. Apesar de muitos artigos terem sido publicados reportando reações de troca iônica dos HDL1-3 e compostos com estruturas semelhantes aos HDL5,6, os quais possuem estruturas adequadas para funcionalização, poucos são os trabalhos que abordam essa classe de reações1,7-9.
Além dos HDL, os hidroxisais lamelares (HSL) também possuem estruturas adequadas para serem submetidos a reações de intercalação e funcionalização. Nesses compostos, parte dos grupamentos hidroxila são substituídos por ânions orgânicos ou inorgânicos, produzindo compostos neutros com a formulação genérica M+2(OH)2-x(A-)x.nH 2O10-14. Esses compostos possuem íons interlamelares trocáveis, os quais podem gerar compostos pilarizados através de um processamento posterior15,16.
Apesar da brucita possuir superfícies interlamelares reativas e estrutura lamelar, com espaçamento basal de 4,8 Å, da qual são derivadas as estruturas tantos dos HDL quanto dos HSL, poucas referências citam essa matriz nas reações de funcionalização. A principal razão baseia-se no fato de que as ligações que mantêm a estrutura coesa limitam o número de moléculas que podem penetrar nos espaçamentos interlamelares e serem submetidas à reação17. Reações de funcionalização foram reportadas recentemente para outros hidróxidos simples lamelares8,18,19 e HDL1,14,20,21.
Baseado nesse fato, o objetivo do presente trabalho é a descrição do comportamento da brucita frente à reação com ácidos succínico e benzóico, que possuem diferentes forças ácidas, em diferentes solventes e condições experimentais.
PARTE EXPERIMENTAL
A brucita foi a matriz lamelar testada frente a sua reatividade com ácido succínico (dicarboxílico) e ácido benzóico (monocarboxílico), em diferentes temperaturas e solventes. Nos ensaios foram utilizados: MgSO4.7H2O (Reagen), solução 30% de NH3 (Nuclear), uréia (Carlo Erba), Mg(NO3)2.6H2O (Vetec), ácido benzóico (Merkc) e ácido succínico (Riedel).
Síntese da brucita
A síntese da matriz foi realizada por precipitação segundo o procedimento descrito na literatura17, dissolvendo-se MgSO4.7H2O (10,605 g, 0,0425 mol) em 50 mL de água destilada. Sob agitação magnética, gotejou-se 11,5 mL de solução 30% de NH3 obtendo o pH=11 na suspensão final. Manteve-se a agitação por 24 h à temperatura ambiente e, em seguida, o material foi lavado três vezes com 25 mL de água destilada, centrifugando-se o gel a 4500 rpm por 5 min. Considerando-se a constante de produto de solubilidade da brucita (1,8x10-11), o pH final da suspensão e o volume da solução de lavagem, as perdas por solubilização podem ser consideradas desprezíveis. O material foi seco a 60 ºC por 24 h.
Tratamento hidrotérmico da brucita
Logo após a adição da solução aquosa de NH3 na preparação da brucita, 15 mL da suspensão foram transferidos para um reator de teflon de 20 mL com camisa de aço, o qual foi aquecido a 160 ºC por 21 h. Após esfriamento, o material resultante foi lavado e seco da mesma maneira que o produto por precipitação direta.
Tentativas de modificação da brucita
Para toda a série de ensaios a seguir foi empregada a brucita obtida por precipitação direta, pois considerou-se que a submetida a tratamento hidrotérmico possui cristais maiores, como sugerem as reflexões estreitas no DRX (Figura 1b). Portanto, seria mais fácil introduzir moléculas hóspedes em cristais menores.
Cinco métodos experimentais foram testados, a saber: 1) a precipitação de íons magnésio com solução 30% de NH3 na presença de ácido carboxílico, 2) a agitação sob aquecimento de uma suspensão de brucita recém preparada e o ácido carboxílico, em meio aquoso e em outros solventes, 3) ou o tratamento da suspensão anterior com o ácido em um reator térmico de teflon com camisa de aço, 4) o aquecimento de uma pastilha composta de brucita e ácido carboxílico prensada a 6 t/cm2 (reação no estado sólido), 5) um último procedimento envolvendo a trituração de uma mistura de nitrato de magnésio hexaidratado, uréia e ácido carboxílico em um cadinho de porcelana, ao qual são acrescentados 2 mL de água para auxiliar a homogeneização. Nessa etapa, observou-se a formação de uma pasta com um aspecto de material fundido, denominada como "melt reaction"6. Em seguida, o cadinho foi colocado em estufa e agitado esporadicamente. Os processos e condições de cada ensaio estão apresentados na Tabela 1.
Os produtos resultantes dos ensaios da brucita com ácido succínico foram lavados com 30 mL de água, enquanto que para todos os outros, 25 mL de etanol. A lavagem e secagem foram realizadas como descrito no procedimento de lavagem da matriz.
INSTRUMENTAL
Foram empregadas as técnicas de difratometria de raios-X (DRX) e espectroscopia vibracional na região do infravermelho (IV) para monitorar a eficácia das reações, tanto da síntese da brucita original, quanto dos seus compostos derivados com ácidos orgânicos. Os difratogramas de raios-X foram obtidos em filmes dos materiais sobre porta-amostras de vidro neutro, utilizando-se um difratômetro Shimadzu, XRD-6000, operando com radiação CuKa=1,5418 Å (40 kV e 30 mA) e velocidade de varredura de 1°/min. As medidas de IV foram realizadas num equipamento Bio-Rad, FTS 3500GX, através do uso de pastilhas de KBr (Merck), acumulação de 16 medidas e resolução de 2 cm-1.
RESULTADOS E DISCUSSÃO
Brucita
Os difratogramas de raios-X da Figura 1 correspondem ao hidróxido de magnésio, preparado pelo método de precipitação direta (a) e tratamento hidrotérmico (b). Como esperado, o composto submetido a tratamento hidrotérmico apresentou maior cristalinidade, concordando com os estudos comparativos da estrutura do hidróxido de magnésio obtida por diferentes vias, reportados por Henrist e colaboradores22.
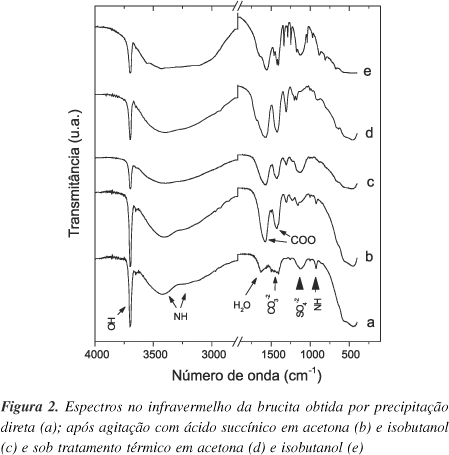
Os difratogramas de raios-X foram comparados na base de dados do JCPDS23 e identificados como sendo da estrutura da brucita, ficha 44-1482. No espectro no infravermelho (Figura 2a) destaca-se a banda do estiramento do grupamento OH ligado ao magnésio em 3699 cm-1, em concordância com dados da literatura24,25. As bandas extras observadas no espectro da brucita podem ser interpretadas como descrito a seguir: 1630 cm-1 (água adsorvida/absorvida/coordenada), banda larga em 1255 e 925 cm-1 (ìons amônio provenientes do agente precipitante), banda em 1360 cm-1 (íons carbonato, provenientes do ar) e banda larga em 1120 cm-1 (íon sulfato livre, proveniente do sal de magnésio)26.
Funcionalização da brucita com ácido succínico
Ácido succínico em meio aquoso
A espectroscopia no IV foi a primeira técnica empregada para caracterização de todos os materiais obtidos nos ensaios deste trabalho, já que por comparação direta com o espectro da brucita seria evidente alguma modificação química na estrutura lamelar. Para os materiais tratados com ácido succínico em meio aquoso, por três diferentes métodos (E1 a E7), observou-se que os respectivos espectros eram iguais ao da matriz mineral, sem a presença de banda característica do ácido carboxílico ou do correspondente sal. Com isto se deduz que a brucita não foi quimicamente modificada (espectros não mostrados).
Ácido succínico: agitação em acetona e isobutanol
Os espectros no IV dos materiais resultantes dos ensaios 8 e 9 (Figuras 2b e c) apresentam duas bandas de interesse observadas em 1577 cm-1 (na COO-) e 1427 cm-1 (ns COO-), ausentes no espectro da matriz (Figura 2a). A separação entre estas duas bandas é um indicativo do tipo de coordenação do ânion carboxilato com o cátion magnésio. Neste caso, o Dn = (na-ns) = 150 cm-1 gerado é um valor maior que o observado para o succinato de sódio, 129 cm-11. Essa variação é característica do íon carboxilato ligado a um cátion da lamela através de um átomo de oxigênio26.
Aproximadamente 0,3 g deste produto foram lavados 3 vezes com 30 mL de água destilada e centrifugados a 4500 rpm por 5 min. No espectro de IV desapareceram as bandas próximas a 1500 cm-1 atribuídas ao ânion carboxilato, confirmando assim a hidrólise do material resultante da funcionalização das superfícies externas da brucita com o íon succinato (espectro não mostrado).
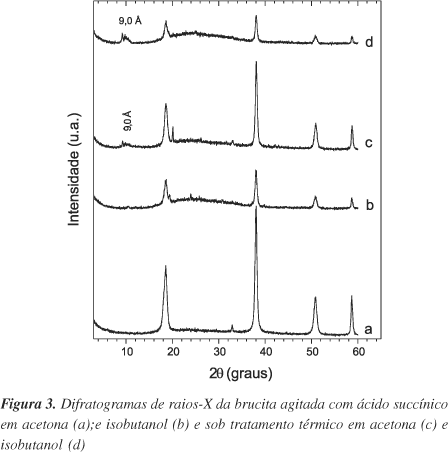
Embora os espectros no IV evidenciem a presença de matéria orgânica, os difratogramas de raios-X mostram que a estrutura da brucita não sofreu alterações no espaçamento basal (Figuras 3a e b). Este fato sugere que a modificação ocorre nas superfícies externas dos cristais da brucita. Isto pode ser confirmado também pela banda estreita em 3695 cm-1 atribuída a grupos OH livres, que sofre pequena alteração na sua intensidade, evidenciando que os grupamentos hidroxila superficiais participaram da reação com o ácido carboxílico.
As reflexões no difratograma de raios-X do material tratado com isobutanol diminuem de intensidade, o que representa uma perda de cristalinidade (Figura 3b).
Ácido succínico: processo solvotérmico
Nos espectros no IV dos materiais resultantes dos ensaios 10 e 11 são notáveis as bandas características dos íons carboxilato (Figuras 2d e e). Para descartar que as novas bandas fossem causadas pela presença de isobutanol, foi realizado um teste (E12) envolvendo o contato direto da brucita com o solvente. O espectro no IV (não mostrado) revelou que o isobutanol não altera a estrutura da brucita nas condições utilizadas (150 ºC, 72 h).
A banda atribuída a ns COO- dos materiais sob tratamento térmico em acetona (E10) e isobutanol (E11) está posicionada em 1425 cm-1. Já no caso do estiramento assimétrico do referido grupamento, a banda se desloca a 1573 cm-1 para o produto tratado em acetona, e em 1561 cm-1, para o tratado em isobutanol, obtendo-se os respectivos valores de Dn de 148 e 136 cm-1. Pode-se dizer que, nas duas situações, os íons carboxilato estão ligados à lamela através de um átomo de oxigênio, pois os valores de Dn são maiores do que o observado para o succinato de sódio (129 cm-1 1). Um fato interessante nos espectros no IV é o surgimento de ombros nas bandas referentes ao na(COO-) em números de onda maiores (1685 cm-1 para E10 e 1635 cm-1 para E11), evidenciando uma ligação mais forte da fração orgânica com a matriz mineral1.
Nos difratogramas de raios-X dos dois materiais (Figuras 3c e d), evidencia-se a formação de uma reflexão de baixa intensidade correspondente a uma nova fase cristalina com distância basal de 9 Å, em concordância com espaçamentos basais reportados da intercalação do íon succinato em compostos lamelares27,28. O incremento nas distâncias dos espaçamentos basais de 4,2 Å (9 - 4,8) é próximo do diâmetro de van der Waals da cadeia alifática (3,9 Å)29 orientada paralelamente às lamelas da brucita. Considerando-se que somente um átomo de oxigênio de cada carboxilato interage com a lamela da brucita (informação gerada por IV), é provável que esse íon esteja intercalado com um pequeno ângulo de inclinação em relação à lamela, deixando um átomo de oxigênio livre. (Figura 4)
Funcionalização da brucita com ácido benzóico
Precipitação em presença de ácido benzóico
O material resultante da precipitação direta da brucita em presença de ácido benzóico (E13) resultou na brucita não funcionalizada, como evidenciado pelo espectro no IV e no difratograma de raios-X (não mostrados).
Ácido benzóico em diferentes solventes
Nos espectros no IV dos produtos dos ensaios 14 a 16, (Figuras 5b, c e d) observa-se que a banda estreita em 3699 cm-1 atribuída aos estiramentos dos grupamentos hidroxila da brucita (Figura 5a) diminui de intensidade para os produtos obtidos em isobutanol, tolueno e dimetilsulfóxido, sendo o fenômeno mais evidente para o primeiro solvente. À medida que os grupamentos hidroxila tendem a ser eliminados, surgem duas bandas: em 1614 cm-1 das flexões dos C=C aromáticos e em 1573 cm-1 dos estiramentos assimétricos do COO-. Os estiramentos simétricos dos íons carboxilato são observados em 1400 cm-1, cuja banda teve o respectivo sinal estourado na medição realizada.
Nos espectros de IV dos produtos dos ensaios 14 e 15, a variação entre as bandas atribuídas ao na(COO-) e ns(COO-) do íon benzoato interlamelar foi de 173 cm-1. Este desdobramento é maior que o valor de referência de 136 cm-1 obtido para o benzoato de sódio30, portanto conclui-se que o ácido benzóico se liga às lamelas da brucita através de um átomo de oxigênio (coordenação monodentada)26.
Nos difratogramas de raios-X, observa-se que os espaçamentos interlamelares da brucita tratada em dimetilsulfóxido (E16) não foram alterados (Figura 6c), evidenciando reações nas superfícies externas dos cristais conforme sugere o espectro da Figura 5d.
O ácido benzóico é mais facilmente inserido entre as lamelas da brucita quando a reação se processa em isobutanol. O difratograma de raios-X do produto do ensaio 14 (Figura 6b), evidencia a formação de um composto principal com distância basal de 14,7 Å, além da presença de uma outra reflexão de menor intensidade com d= 11,9 Å. Os dois tipos de espaçamentos formados devem-se a diferentes orientações dos íons orgânicos entre as lamelas da brucita. A reação em tolueno produz um composto com uma distância basal de 15,2 Å (Figura 6a). No caso da intercalação do íon benzoato no HDL de Mg-Al, espaçamentos basais de 15,4 Å são observados31. Em HDL de Zn-Cr, Zn-Al e Mg-Al32, espaçamentos da ordem de 15 a 15,5 Å foram reportados, embora Prevot e colaboradores1 tenham obtido HDL de Zn-Al com espaçamento basal de 14,4 Å. Nem todos os pesquisadores concordam no que se refere à posição dos íons benzoato entre as lamelas: Meyn e colaboradores32 propõem uma monocamada da fase orgânica, enquanto Hsue e Chen33 sugerem camadas duplas. A diferenciação entre as intercalações na forma de mono e duplas camadas depende do volume do cátion e da carga da lamela por unidade de área.
A intercalação de derivados simples do ácido carboxílico também forma materiais com espaçamentos basais semelhantes. Hsue e Chen33 reportam uma distância de 15 Å no produto da intercalação do para-aminobenzoato em HDL de Mg-Al, e O'Hare e colaboradores34 obtiveram 15,1 Å ao inserir o íon tereftalato em HDL de Li-Al.
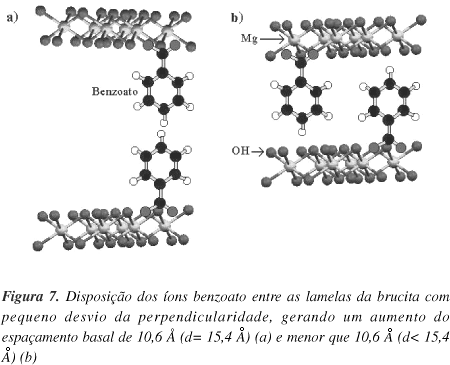
A distância entre o carbono do grupo carboxílico e o carbono em posição para no ácido benzóico é de 4,3 Å32, sendo que este valor concorda com a distância calculada para a referida molécula utilizando-se o programa de modelagem molecular Hyperchem 635. Considerando-se a distância entre o carbono carboxílico até o hidrogênio em posição para, o valor calculado aumenta para 5,3 Å. Se o átomo de oxigênio do ácido benzóico é ligado à lamela ocupando uma posição de um oxigênio da brucita, a separação entre as lamelas será função da distância entre o carbono carboxílico e o hidrogênio em posição para. Considerando duplas camadas (5,3 x 2= 10,6 Å) (Figura 7a), somada à distância basal da brucita (4,8 Å), corresponderia a uma distância basal de 15,4 Å. Um espaçamento ligeiramente menor é fácil de explicar, considerando que um íon benzoato não necessariamente se posiciona exatamente na direção de outro da lamela adjacente (Figura 7b).
Reações no estado sólido
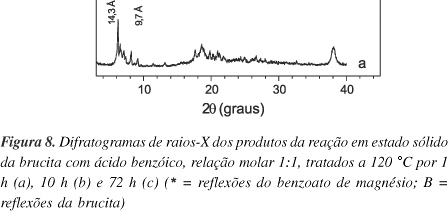
Observa-se na Figura 8, que o difratograma do material preparado com relação molar 1:1 sob aquecimento por 1 h (E17) apresenta uma reflexão com espaçamento basal de 14,3 Å (Figura 8a). No entanto, existe uma série de reflexões que começam a aparecer em 9,7 Å, que são fases intermediárias do processo, de tal forma que após 10 h de reação (E18) predomina a reflexão do espaçamento de 14,4 Å (Figura 8b). Neste ponto surge um novo espaçamento basal de 17,6 Å, variação compatível com a adição do diâmetro de van der Waals da molécula de água (cerca de 3 Å). Portanto, a temperatura de fusão do ácido benzóico de 120 °C empregada na reação por 10 h não é suficiente para retirar as moléculas de água coordenadas.
Após 72 h de reação (E19), o espaçamento basal de 17,6 Å desaparece e resta o de 14,4 Å (Figura 8c). No padrão de DRX da Figura 8b são identificadas as reflexões correspondentes ao benzoato de magnésio (ficha 01-0012 do JCPDS23). As reflexões de maior intensidade (14,4 e 5,9 Å) ajudam a identificar a formação do benzoato de magnésio nos outros ensaios realizados no estado sólido (E17 a E19, Figura 8). Coincidentemente, o valor do espaçamento basal do benzoato de magnésio é semelhante aos valores característicos da monocamada de íons benzoato em estruturas de alguns HSL14. Este espaçamento basal corresponde também à formação de uma camada dupla de compostos aromáticos naqueles materiais lamelares cujas lamelas são folhas de octaedros14,36. Contudo, a reflexão em 5,9 Å define a formação do benzoato de magnésio e não o produto da reação topotática esperada.
Os ensaios 20 e 21 confirmam que uma relação molar brucita/ácido benzóico maior ou menor que a empregada no ensaio 19 (1:1) também leva à formação de benzoato de magnésio (difratogramas não mostrados).
Para todos os materiais obtidos por reação no estado sólido (E17 a E21), os espectros no IV (não mostrados) apresentam bandas características do íon carboxilato em 1414 e 1551-1570 cm-1, e das hidroxilas ligadas ao magnésio em cerca de 3700 cm-1.
Fusão do ácido benzóico na presença de uréia e nitrato de magnésio hexaidratado
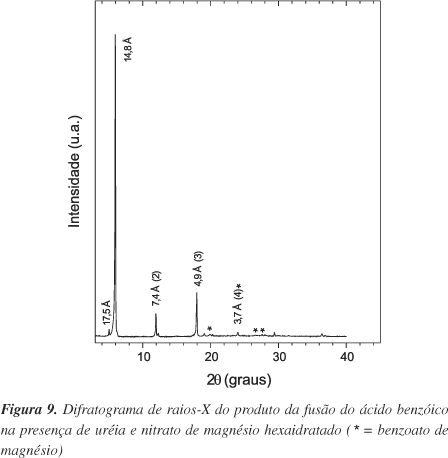
O padrão de difração de raios-X do produto do ensaio 22 (Figura 9) é característico de um composto lamelar37, já que a reflexão do plano basal (14,8 Å) aparece com mais três reflexões harmônicas (indicadas entre parêntesis na Figura 9). O produto apresenta uma fase cristalina predominante, todavia existem reflexões de baixa intensidade características do benzoato de magnésio (marcadas com asteriscos na Figura 9).
No espectro no IV (Figura 10) é observada uma banda intensa e estreita em 1651 cm-1 atribuída ao estiramento C=O38, provavelmente devida à presença de ácido benzóico. Embora esta espécie não tenha sido detectada no difratograma de raios-X, a mesma poderia estar dispersa nas galerias interlamelares formadas por pilares de ânion benzoato, pois é clara a presença do ânion carboxilato no produto, devido às bandas características em 1558 cm-1 (na) e 1419 cm-1 (ns)38. A diferença observada de 139 cm-1 entre Dna e Dns é praticamente a mesma encontrada para o benzoato de sódio (136 cm-1). Isto indica a possibilidade dos átomos de oxigênio do grupamento carboxilato realizarem uma ponte entre dois íons magnésio vizinhos. As bandas atribuídas a estiramentos e deformações do anel aparecem em 1599, 1509 e 721 cm-1 33,38. O espectro no IV também revela que no material existem íons nitrato, pela presença de bandas em 1384, 1305, 1025 e 807 cm-1 26, originalmente presentes no sal de magnésio utilizado e que não foram retirados totalmente na lavagem com etanol. Observou-se também a presença de íons carbonato26, com bandas em 840 e 678 cm-1, formados provavelmente do CO2 desprendido da hidrólise da uréia. Estudos estão em progresso na tentativa de caracterizar química e estruturalmente a fase obtida.
CONCLUSÕES
Deve-se evitar o emprego do meio aquoso nas reações de funcionalização com ácido succínico, pois em caso de reação, ocorre hidrólise do produto, regenerando-se a matriz, com conseqüente perda de cristalinidade. A agitação em acetona e isobutanol não é um procedimento adequado para a inserção do íon succinato, pois funcionaliza somente a superfície externa dos cristais de brucita.
Reagindo-se a brucita em condições solvotérmicas, existem sinais de funcionalização das superfícies internas das lamelas, pois um novo composto é produzido com distância basal de 9 Å. Os respectivos espectros de IV mostram que os íons carboxilato estão ligados ao hidróxido de magnésio com maior força que nos materiais obtidos pela técnica de agitação. O incremento no espaçamento corresponde ao diâmetro de uma cadeia alifática (3,9 Å).
Em condições solvotérmicas, a reação em acetona diminui a cristalinidade da brucita em comparação com o isobutanol, enquanto que nas condições de agitação, é o isobutanol que mais influencia na cristalinidade do mineral.
A precipitação do hidróxido de magnésio em presença de ácido benzóico produz brucita não funcionalizada. A agitação em dimetilsulfóxido não altera o espaçamento basal da brucita. As reações em meio aquoso e estado sólido levam à formação de benzoato de magnésio identificado pelo difratograma de raios-X e, em alguns casos, misturas com a presença de brucita.
A reação de fusão do ácido benzóico na presença de nitrato de magnésio hidratado, uréia e ácido benzóico leva à formação de um composto lamelar com espaçamento basal de 14,8 Å, cujo padrão de difração de raios-X é diferente do benzoato de magnésio, evidenciando que essa rota pode ser a mais promissora para o processo de funcionalização de brucita com ácidos carboxílicos.
35. Hyperchem; Release 4.5 for Windows. Hypercube Inc., 1995.
Recebido em 23/10/03; aceito em 26/8/04; publicado na web em 12/11/04
- 1. Prevot, V.; Forano, C.; Besse, J. P.; Appl. Clay Sci. 2001, 18, 3.
- 2. Hibino, T.; Jones, W.; J. Mater. Chem. 2001, 11, 1321.
- 3. Tong, Z.; Shichi, T.; Takagi, K.; Mater. Lett 2002, 4146, 1.
- 4. Crepaldi, L; Valim, J. B.; Quim. Nova 1998, 21, 300.
- 5. Géhin, A.; Ruby, C.; Abdelmoula, M.; Benali, O.; Ghanbaja, J.; Refait, P.; Géhin, J-M. R.; Solid State Sci. 2002, 4, 61.
- 6. Rajamathi, M.; Kamath, P. V.; Int. J. Inorg. Mater 2001, 3, 901.
- 7. Tagaya, H.; Morioka, H.; Kadokawa, J-i.; Karasu, M.; Chiba, K.; Supramol. Sci 1995, 2, 33.
- 8. Maeda, K.; Kiyozumi, Y.; Mizukami, F.; Angew. Chem., Int. Ed 1994, 33, 2335.
- 9. Ogata, S.; Tagaya, H.; Karasu, M.; Kadokawa, J.; J. Mater. Chem. 2000, 10, 321.
- 10. Markov, L.; Petrov, K.; Petkov, V.; Thermochim. Acta 1986, 106, 283.
- 11. Auer, S.; Pöllmann, H.; J. Solid State Chem 1993, 109, 187.
- 12. Laget, V.; Drillon, M.; Hornick, C.; Rabu, P.; Romero, F.; Turek, P.; Ziessel, R.; J. Alloys Compd. 1997, 262-263, 423.
- 13. Rabu, P.; Drillon, M.; Hornick, C.; Analusis 2000, 28, 103.
- 14. Newmann S. P.; Jones, W.; J. Solid State Chem 1999, 148, 26.
- 15. Meyn, M.; Beneke, K.; Lagaly, G.; Inorg. Chem 1993, 32, 1209.
- 16. Nishizawa, H.; Yuasa, K.; J. Solid State Chem 1998, 141, 229.
- 17. Wypych, F.; Schreiner, W. H.; Marangoni, R.; J. Colloid Interface Sci. 2002, 253, 180.
- 18. Inoue, M.; Tanino, H.; Kondo, Y.; Inui, T.; Clays Clay Miner 1991, 39, 151.
- 19. Isupov, V. P.; J. Struct. Chem 1999, 40, 672.
- 20. Vaysse, C.; Guerlou-Demourges, L.; Delmas, C.; Inorg. Chem. 2002, 41, 6905.
- 21. Aisawa, S.; Takahashi, S.; Ogasawara, W.; Umetsu, Y.; Narita, E.; J. Solid State Chem 2001, 162, 52.
- 22. Henrist, C.; Mathieu, J.-P.; Vogels, C.; Rulmont, A.; Cloots, R.; J. Cryst. Growth 2003, 249, 321.
- 23. Data collection of The Joint Committee on Powder Diffraction Standard; PCPDFWIN version 2.2, June 2001. Copyright © 2001.
- 24. Frost, R. L.; Kloprogge. J. T.; Spectrochim. Acta, Part A 1999, 55, 2195.
- 25. Oliveira de, E. F.; Hase, Y.; Vib. Spectrosc. 2002, 941, 1.
- 26. Nakamoto, K.; Infrared and raman spectra of inorganic and coordination compounds, 4th ed., Wiley: New York, 1986.
- 27. Hornick, C.; Rabu, P.; Drillon, M.; Polyhedron 2000, 19, 259.
- 28. Dutta, P. K.; Robins, D. S.; Langmuir 1994, 10, 1851.
- 29. Lévy, F.; Physics and chemistry of materials with layered structures. Intercalated Layered Materials, D. Reidel Publishing Company: Netherlands, 1979, vol. 6.
- 30. Wypych, F.; Arízaga, G. G. C.; Gardolinski, J. E. F. C.; J. Colloid Interface Sci, no prelo.
- 31. Moggridge, G. D.; Parent, P.; Tourillon, G.; Physica B 1995, 208 & 209, 269.
- 32. Meyn, M.; Beneke, K.; Lagaly, G.; Inorg. Chem 1990, 29, 5201.
- 33. Hsue, H-B.; Chen, C-Y.; Polymer 2003, 44, 1151.
- 34. O'Hare, D.; Fogg, A.; Green, V. M.; Harvey, H. G.; Mol. Cryst. Liq. Cryst 2000, 341, 295.
- 36. Wypych, F.; Schreiner, W. H.; Richard, Jr. E.; J. Colloid Interface Sci 2004, 276, 167.
- 37. Carlino, S.; Solid State Ionics 1997, 98, 73.
- 38. Silverstein, R. M.; Bassler, G. C.; Morril, T. C.; Identificação espectrométrica de compostos orgânicos, 5Ş ed., Guanabara Koogan: Rio de Janeiro, 1994.
Datas de Publicação
-
Publicação nesta coleção
23 Fev 2005 -
Data do Fascículo
Fev 2005
Histórico
-
Aceito
04 Ago 2004 -
Recebido
23 Out 2003