Resumo
The trans-dichlorobis(ethylenediamine)cobalt(III) chloride was synthesized in an undergraduate laboratory and its aquation reaction was carried out at different temperatures. This reaction follows pseudo-first-order kinetics and the rate constants, determined at 25, 35, 45, 55 and 70 º C, are 1.44 x 10-3; 5.14 x 10-3; 1.48 x 10-2; 4.21 x 10-2 and 2.21 x 10-1 s-1, respectively. The activation energy is 93.99 ± 2.88 kJ mol-1.
Arrhenius equation; teaching experiment; activation energy
Arrhenius equation; teaching experiment; activation energy
EDUCAÇÃO
Estudos Cinéticos da aquação do trans-[Co(en)2Cl2]Cl
Kinetic studies of trans-[Co(en)2Cl2]Cl aquation
Aline O. Moura; Paolla C. Martins; Lucas B. F. R. Cunha; Lucas B. Bolzon; Jonas Pertusatti; Alexandre G. S. Prado* * e-mail: agsprado@unb.br
Instituto de Química, Universidade de Brasília, CP 4478, 70904-970 Brasília-DF
ABSTRACT
The trans-dichlorobis(ethylenediamine)cobalt(III) chloride was synthesized in an undergraduate laboratory and its aquation reaction was carried out at different temperatures. This reaction follows pseudo-first-order kinetics and the rate constants, determined at 25, 35, 45, 55 and 70 º C, are 1.44 x 10-3; 5.14 x 10-3; 1.48 x 10-2; 4.21 x 10-2 and 2.21 x 10-1 s-1, respectively. The activation energy is 93.99 ± 2.88 kJ mol-1.
Keywords: Arrhenius equation; teaching experiment; activation energy.
INTRODUÇÃO
Historicamente, compostos de cobalto têm sido usados como pigmentos de vidros e cerâmicas. Existem registros de cerâmicas egípcias datadas em torno de 2600 A.C. e vidros iranianos em torno de 2200 A.C. que continham pigmentos à base de cobalto. Porém este elemento foi isolado somente em 1780, por T. O. Bergman1.
O cobalto pertence ao grupo 9 da tabela periódica e está intimamente ligado ao desenvolvimento da química de coordenação. Foi através de complexos de cobalto que Alfred Werner desenvolveu parte de sua teoria, que sucumbiu com as hipóteses de Jorgensen-Blomstrand2.
Quimicamente este elemento apresenta os estados de oxidação I, II, III, IV, V e VI, tendo como mais importantes os estados II e III. Os íons Co2+ são muito estáveis e podem ser encontrados em vários compostos simples, tais como CoCl2, CoSO4, CoCO3, sendo que todos os sais hidratados apresentam coloração rósea devido ao complexo [Co(H2O)6]2+. Já os íons Co3+ são bastante oxidantes e relativamente instáveis.
Praticamente todos os complexos de Co(III) possuem 6 ligantes dispostos em um arranjo octaédrico. Muitos deles apresentam formas isoméricas, sendo que os ligantes mais comuns são os doadores N (amônia, amina e amida).
Dentre as diversas reações que podem ser estudadas para estes complexos em água, deve-se destacar a aquação como a reação de substituição predominante de complexos octaédricos de cobalto (III)3:
Este tipo de reação é bastante simples e permite seu acompanhamento por alunos de graduação em laboratórios de ensino. Além do mais, muitas reações de substituição podem ser acompanhadas cineticamente, introduzindo aos alunos os conceitos de velocidade de reação.
O objetivo deste trabalho é a síntese de um composto octaédrico de cobalto (III), o trans-diclorobis(etilenodiamina)cobalto(III) e o acompanhamento cinético da aquação desse composto em diferentes temperaturas para determinação da energia de ativação dessa reação. O experimento é adequado para laboratórios de ensino de química inorgânica.
PARTE EXPERIMENTAL
Materiais
Todos os reagentes utilizados nas reações apresentadas são de grau analítico e foram usados sem quaisquer purificações prévias.
Síntese do trans-[Co(en)2Cl2]Cl
Uma solução aquosa de 10,0 mL, contendo 2,5 g de CoCl2.6H2O, foi preparada. A esta solução foram adicionados 10,0 mL de solução aquosa de etilenodiamina 10%. Em seguida foram colocados 2,0 mL de H2O2, gota a gota. A solução foi posta em banho-maria, à temperatura de 70 ºC, até cessar o borbulhamento. Então, foram acrescentados 7,5 mL de HCl concentrado, mantendo o aquecimento até restar 1/3 do volume original. Em seguida, a mistura foi filtrada e seca à temperatura ambiente e lavada com éter etílico para a obtenção dos cristais verdes do composto trans-[Co(en)2Cl2]Cl.
Estudo cinético da aquação do trans-[Co(en)2Cl2]Cl
A análise da cinética da aquação do trans-[Co(en)2Cl2]Cl foi realizada nas seguintes temperaturas: 25, 35, 45, 55 e 70 ºC. Para cada temperatura, foi dissolvida uma alíquota do trans-[Co(en)2Cl2]Cl em água. A solução foi separada em 15 diferentes tubos de ensaio e estes foram colocados em banho-maria, com temperatura controlada. A cada intervalo de tempo, um tubo de ensaio foi retirado do banho e a solução foi analisada em um espectrofotômetro Beckman DU-650 para o acompanhamento cinético da reação de aquação.
RESULTADOS
Primeiramente, o complexo trans-diclorobis(etilenodiamina)cobalto(III) foi sintetizado. Para que esse complexo fosse formado, primeiro o cobalto foi oxidado a cobalto (III) pela H2O2 na presença de etilenodiamina. Posteriormente, foi adicionado excesso de HCl para formação da ligação coordenada de cloro com o cobalto, resultando no complexo octaédrico.
Com o complexo formado, foi feito o acompanhamento da reação de aquação deste material. A aquação do complexo trans-[Co(en)2Cl2]+ está baseada na reação de substituição de um cloreto por uma molécula de água, formando o complexo trans-[Co(en)2Cl(H2O)]2+ .
Os processos de substituição em complexos octaédricos de cobalto (III) com ligantes negativos contendo pelo menos mais de um par eletrônico isolado, tais como NH2-, OH-, Cl-, são particularmente propensos a reações segundo o mecanismo SN1, pois a presença desses pares eletrônicos estabiliza o intermediário desse mecanismo, que é um complexo com a geometria de pirâmide tetragonal4,5. Assim, a reação de aquação deve seguir o mecanismo SN1, conforme a Figura 1.
O complexo trans-[Co(en)2Cl2]+ em solução aquosa assume uma coloração verde, sendo que, na medida em que avança a reação, uma molécula de água substitui um Cl- e o complexo assume uma coloração rósea, conforme a Equação 2:
A velocidade da reação em questão pode ser expressa como:
em que k é a constante de velocidade da reação. Como a reação deve seguir o mecanismo SN1, então a etapa determinante da velocidade está relacionada com a perda do cloreto formando o composto intermediário, conforme a etapa 1 da Figura 1. Com isso, a velocidade de reação depende somente da concentração do complexo [Co(en)2Cl2]+ e a reação deve seguir um mecanismo cinético de primeira ordem6.
O progresso da reação de substituição foi acompanhado pela absorção de luz na região do visível em um espectrofotômetro Beckman DU-650. O complexo trans-[Co(en)2Cl2]+ possui uma absorbância máxima característica em 605 nm, enquanto o complexo [Co(en)2Cl(H2O)]2+ possui uma absorbância característica em 500 nm. Dessa forma, pode-se acompanhar a evolução da reação pela diminuição da absorbância em 605 nm e/ou pelo aumento do valor de absorbância em 500 nm (Figura 2). Assim, as concentrações dos complexos [Co(en)2Cl2]+, [M-Cl], e do [Co(en)2Cl(H2O)]2+ , [M-H2O], podem ser relacionadas com a absorbância. Sendo
pode-se chegar ao resultado
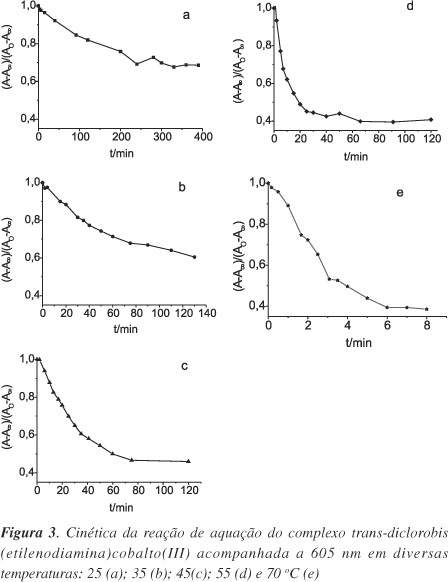
em que [M-Cl]t é a concentração no tempo t; [M-Cl]0 é a concentração quando t = 0; At é a absorbância no tempo t, A0 é a absorbância quando t = 0 e A¥ é a absorbância depois da reação ter se completado. Assim, a Equação 5 elimina a necessidade de calcular o coeficiente de absorção molar, pois a medida expressa é relativa aos valores de absorbância. A cinética da reação nas diversas temperaturas foi acompanhada pela diminuição da absorbância em 605 nm (Figura 3).
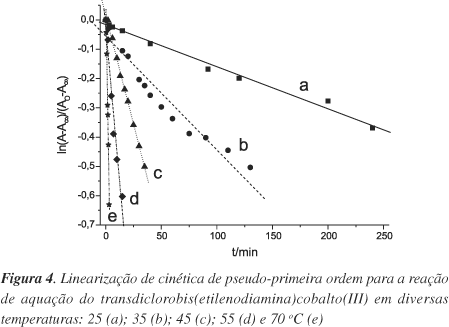
As constantes de velocidade foram determinadas através de um gráfico de ln[(At-A¥)/(A0- A¥)] em função do tempo para cada temperatura (Figura 4). Assim, os valores de k foram determinados a partir do coeficiente angular da reta, de acordo com a equação de 1ª ordem:
Os valores de k foram obtidos a partir dos coeficientes angulares das retas da Figura 4, e estão apresentados na Tabela 1, nas correspondentes temperaturas de estudo.
Tendo os valores de k, fez-se o gráfico do logaritmo natural de k em função do inverso da temperatura para se determinar a energia de ativação, Ea, da reação, segundo a Equação de Arrhenius (Figura 5) 7.
O valor de Ea foi determinado a partir do coeficiente angular da reta da Figura 5, apresentando o valor de 93,99 ± 2,88 kJ mol-1.
CONSIDERAÇÕES FINAIS
Esta prática permite aos alunos de graduação o contato inicial com a síntese de complexos inorgânicos, bem como a aprendizagem de reações de substituição de ligantes. Mais ainda, ela insere conceitos de cinética química e de energia de ativação. Assim, o experimento proposto explora diversas áreas da química, tais como química de coordenação, mecanismos de reações inorgânicas, cinética química e permite aos alunos o contato direto com a técnica de espectrofotometria.
Neste experimento, foram sugeridas algumas questões para que os estudantes pudessem consolidar os conceitos desenvolvidos no experimento:
-
Escreva as reações da prática.
-
Escreva a estrutura dos complexos CoCl
2.6H
2O, trans- [Co(en)
2Cl
2]Cl e do composto final obtido.
-
Qual é a função da H
2O
2 na reação química?
-
Qual é a função do HCl na reação química?
-
Qual é o número de oxidação e de coordenação do íon central nos complexos CoCl
2.6H
2O, trans-[Co(en)
2Cl
2]Cl e no complexo final?
-
A constante de velocidade da reação varia com a temperatura?
AGRADECIMENTOS
Ao CNPq/PIBIC pela bolsa cedida a L. B. Bolzon e a A. O. Moura, alunos do 1º semestre 2004 da disciplina de Laboratório de Inorgânica, do período noturno.
Recebido em 10/12/04; aceito em 27/7/05; publicado na web em 3/2/06
- 1. Lee, J. D.; Química Inorgânica não tão Concisa, 5Ş ed., Edgard Blücher: São Paulo, 1999.
- 2. Cotton, F. A.; Wilkinson, G.; Advanced Inorganic Chemistry, 5th ed., John Wiley & Sons: New York, 1988.
- 3. Jackson, W. G.; Frasier, B.; Goodyear, K.; Cooper, J. N.; Inorg. Chim. Acta 2003, 358, 137.
- 4. Bailan, J. C.; Inorg. Synth. 1946, 2, 222.
- 5. Jolly, W. L.; Synthetic Inorganic Chemistry, Prentice Hall: New Jersey,1960.
- 6. Atkins, P.W.; Paula, J.; Atkins' Physical Chemistry, 7th ed., Oxford University Press: Oxford, 2002.
- 7. Avery, H. E.; Cinética Química Básica y Mecanismos de Reacción, Editorial Reverte: Barcelona, 1982.
Datas de Publicação
-
Publicação nesta coleção
03 Abr 2006 -
Data do Fascículo
Abr 2006
Histórico
-
Recebido
11 Dez 2004 -
Aceito
27 Jul 2005