Resumo
The study assessed selenium concentrations in the muscle tissues and liver samples of three fish species and in the soft tissues of a mussel species. The samples were analyzed by GF-AAS using Zeeman background correction. Selenium in the muscle samples was higher in carnivorous fish. The liver of all studied fish species presented higher selenium concentrations than the muscle. The fish species presented a high positive correlation between their total length and selenium concentration. A significant correlation was observed between the selenium concentration in the mussel soft tissues and the condition index.
total selenium; fish and mussel; Guanabara Bay
total selenium; fish and mussel; Guanabara Bay
ARTIGO
Distribuição de selênio em organismos marinhos da Baía de Guanabara/ RJ
Distribution of selenium in marine organisms from Guanabara Bay/ RJ
Tércia Guedes SeixasI, * * e-mail: tercia@rdc.puc-rio.br ; Isabel MoreiraI; Helena do Amaral KehrigII; Olaf MalmII
IDepartamento de Química, Pontifícia Universidade Católica Rio, Rua Marquês de São Vicente, 225, 22453-900 Rio de Janeiro RJ, Brasil
IIInstituto de Biofísica Carlos Chagas Filho, Centro de Ciências da Saúde, Universidade Federal do Rio de Janeiro, 21949-900 Rio de Janeiro RJ, Brasil
ABSTRACT
The study assessed selenium concentrations in the muscle tissues and liver samples of three fish species and in the soft tissues of a mussel species. The samples were analyzed by GF-AAS using Zeeman background correction. Selenium in the muscle samples was higher in carnivorous fish. The liver of all studied fish species presented higher selenium concentrations than the muscle. The fish species presented a high positive correlation between their total length and selenium concentration. A significant correlation was observed between the selenium concentration in the mussel soft tissues and the condition index.
Keywords: total selenium; fish and mussel; Guanabara Bay.
INTRODUÇÃO
O selênio (Se) é conhecido como um micronutriente essencial para a maioria dos animais, porém em concentrações elevadas é considerado tóxico1,2. Estudos vêm mostrando que a morte de algumas espécies de organismos mais susceptíveis ao selênio é observada em ambientes aquáticos cuja água apresentou concentração de Se na faixa de 0,06 a 0,6 µg g-1 2. Para o ser humano, o Se é considerado como essencial em concentrações que variam de 0,04 a 0,1 µg g-1 2. Entretanto, para os organismos marinhos, como os peixes, o selênio se torna tóxico a partir de 3,0 µg g-13. Há um grande interesse em se entender o comportamento do Se nos organismos marinhos, devido a sua importância fisiológica e toxicológica. Existem poucos trabalhos dedicados ao metabolismo e à acumulação do Se no meio ambiente aquático e seu ciclo biogeoquímico é parcialmente conhecido4. Alguns estudos relacionados ao metabolismo do Se nos produtores primários5,6 e acumulação do Se pelos consumidores7 forneceram algumas informações básicas a respeito da importância e do papel deste elemento para a biota marinha. Os bivalvos e os peixes são reconhecidamente empregados como biomonitores de Se em ambientes aquáticos1. Peters e colaboradores8 concluíram que a cadeia alimentar bentônica é uma importante fonte de Se para os peixes e que a principal rota para a bioacumulação é via cadeia alimentar. Porém, uma variedade de parâmetros abióticos e bióticos pode influir na eficiência com que os organismos aquáticos acumulam os metais pesados e o selênio em seus tecidos e órgãos9. A concentração de Se nos detritos orgânicos dos sedimentos é mais importante para a contaminação da cadeia alimentar aquática que a concentração de Se dissolvido na coluna d'água8. Estudos vêm mostrando que a contaminação dos sistemas aquáticos por Se pode causar sérios danos à biota, inclusive a mortalidade de peixes10.
Neste trabalho foram determinadas as concentrações de selênio total em tecido muscular e fígado de três espécies de peixes bentônicos com diferentes hábitos alimentares (Mugil liza tainha, peixe planctívoro; Bagre spp. bagre, peixe onívoro e Micropogonias furnieri corvina, peixe carnívoro) e nos tecidos moles de uma espécie de mexilhão (Perna perna), coletados na Baía de Guanabara.
A Baía de Guanabara (22ºS, 43ºW) é um estuário de aproximadamente 400 km2, localizada no estado do Rio de Janeiro, na região sudeste brasileira (Figura 1). É uma importante área com relação à produção pesqueira, porém recebe impactos na forma de esgotos domésticos e efluentes industriais não tratados, que são provenientes de uma área densamente povoada, com aproximadamente 10.000 indústrias, além de uma intensa atividade portuária e um complexo pólo petroquímico11. Sua bacia de drenagem pode ser considerada como uma região bastante impactada por matéria orgânica, óleo e um grande número de outros compostos, incluindo-se os metais pesados12. Como conseqüência, encontram-se elevadas concentrações de metais tóxicos e hidrocarbonetos nos sedimentos e alterações nas comunidades bentônicas e pelágicas11,13. A Baía de Guanabara tem sido objeto de vários estudos ambientais, porém, segundo a literatura científica, não são encontrados dados a respeito de selênio, tanto no ambiente quanto na biota deste importante estuário brasileiro.
PARTE EXPERIMENTAL
Coleta e preparo das amostras
Durante os anos de 2000 e 2003, foram coletadas na Baía de Guanabara, com auxílio da colônia de pesca da Praia de Mauá (município de Magé, RJ) (Figura 1), 31 indivíduos de tainha (peixe planctívoro), 14 indivíduos de bagre (peixe onívoro), 34 indivíduos de corvina (peixe carnívoro), perfazendo um total de 79 indivíduos. Após cada coleta, foram tomados o peso e o comprimento total de cada peixe. Em seguida, foram retirados o músculo dorso lateral esquerdo e o fígado de cada indivíduo. Também foram coletados, manualmente, com auxílio de estiletes 40 indivíduos de mexilhão (bivalvo filtrador) em três pontos distintos da baía: Marina da Glória (N=10), Praia da Boa Viagem (N=10) e Ponte Rio-Niterói (N=20) (Figura 1). Em seguida, foram tomados os comprimentos da concha e foram pesados os tecidos moles de cada indivíduo. Posteriormente, fez-se uma amostra composta homogênea de aproximadamente 10 indivíduos por amostra. As amostras de tecido muscular dos peixes e as amostras de tecidos moles dos mexilhões foram liofilizadas perdendo, aproximadamente, 75 e 80% de água, respectivamente.
Instrumental
A determinação de selênio total nas amostras foi realizada através de espectrofotômetro de absorção atômica da Analytik Jena AG (Jena, Alemanha), modelo ZEEnit 60, equipado com um corretor Zeeman de "background" e um auto amostrador MPE-52 (Analytik Jena AG). Como célula de absorção foi utilizado um forno de grafite (pirolítico) com aquecimento transversal e plataforma PIN (Analytik Jena AG, Part N° 407-152.011). Como fonte de radiação foi utilizada uma lâmpada de catodo oco de selênio (Analytik Jena AG, Part N° 226832), operando a 6,0 mA, no comprimento de onda de 196,0 nm, com uma fenda de 1,2 nm. Argônio (95% de pureza) foi utilizado com gás inerte de carreamento e proteção do forno de grafite. As leituras foram realizadas por área do pico de absorvância, utilizando um tempo de integração de 5 s, sendo feitas em duplicata e descontados os respectivos brancos. As etapas do programa de temperatura empregado são apresentadas na Tabela 1.
Soluções e reagentes
Todos os reagentes utilizados foram de grau analítico e não foram previamente purificados. Ácido nítrico suprapuro (65% p/v) (Merck) foi utilizado tanto na digestão das amostras, quanto no preparo das soluções estoque. Água de alta pureza (Sistema Millipore Milli-Q) foi usada em todas as diluições. Uma solução estoque de 1.000 µg mL-1 de SeO2 (Titrisol®, Merck) foi preparada pela dissolução com uma solução 0,2% v/v de HNO3. As soluções de trabalho (50 ng mL-1) de selênio foram obtidas a partir da diluição da solução estoque de 1.000 µg mL-1 com uma solução 0,2% v/v de HNO3 (Merck), e foram preparadas diariamente. Uma solução 1,5 µg mL-1 de nitrato de paládio (Merck) foi utilizada como modificador químico. Foi preparada a partir da diluição, em água deionizada, de uma solução estoque de 10.000 µg mL-1 de Pd(NO3)2 (Merck).
Procedimento analítico
A metodologia analítica aplicada neste estudo baseou-se no trabalho de Deaker e Maher14. Neste estudo foram empregadas cerca de 0,1 g de amostra seca ou 0,2 g de amostra úmida, que sofreram digestão ácida em 2,0 mL de HNO3 suprapuro concentrado (65 %p/v) (Merck) por aproximadamente 2 h a 60 ºC em banho-maria, utilizando tubos de Pirex® fechados. Após o resfriamento, a solução da amostra digerida foi diluída cinco vezes em água Milli-Q® (Sistema Millipore) e uma alíquota de 20 µL foi retirada e analisada pela técnica do forno de grafite. Utilizou-se sempre uma curva analítica de selênio inorgânico (SeO2) (Titrisol®, Merck) em meio ácido, que precedeu a cada dia de análise.
O controle de qualidade analítica do método foi determinado utilizando-se, a cada batelada de análise, amostras de materiais certificados de referência fornecidos pelo "National Research Council Canada" (DORM-2, tecido muscular) e pelo "National Institute for Science and Technology" (EUA, NIST 2976, tecidos moles de mexilhão). As metodologias de digestão e de determinação de Se, descritas anteriormente, foram aplicadas a duplicatas de cada amostra. O coeficiente de variação (C.V.) encontrado para cada amostra foi sempre inferior a ± 10%, significando que o procedimento analítico aplicado foi plenamente satisfatório.
Análise estatística
Após verificar-se a não normalidade na distribuição dos dados através do teste de Shapiro-Wilk (teste W; p=0,00), aplicaram-se, os testes não paramétricos: análise de variância (Kruskal-Wallis ANOVA), para se testar as diferenças na concentração de Se entre as espécies, níveis tróficos, tecidos e hábito alimentar; e Mann-Whitney (Teste U) para se comparar a concentração de selênio nos diversos tecidos dos organismos. Também, utilizou-se a correlação de Spearman para verificar se havia relação entre os parâmetros estudados.
RESULTADOS E DISCUSSÃO
Controle de qualidade analítica
A precisão e exatidão do método analítico foram verificadas através da utilização de materiais certificados de referência fornecidos pelo "National Research Council Canada" (DORM-2, tecido muscular) e pelo "National Institute for Science and Technology" (EUA, NIST 2976, tecidos moles de mexilhão) e também através de uma comparação interlaboratorial entre o laboratório de referência do "Finish National Public Health Institute" (FNPHI) e o Laboratório de Radioisótopos Eduardo Penna Franca (LREPF UFRJ) utilizando amostras de tecido muscular e fígado de peixes (N=9). Os resultados das análises das amostras de materiais de referência são apresentados na Tabela 2. Na Figura 2 são apresentados os resultados das análises da comparação interlaboratorial realizada entre os dois laboratórios.
Os resultados obtidos demonstraram a boa precisão e exatidão da metodologia analítica empregada. Obtiveram-se bons fatores de recuperação do Se-T, nas diferentes matrizes certificadas tanto do "National Research Council" (Canadá, DORM-2) quanto do "National Institute for Science and Technology" (EUA, NIST 2976) (Tabela 3). A comparação entre os dois laboratórios mostrou uma boa concordância dos dados, com uma correlação altamente significativa (r2 = 0,98), indicando que os resultados encontrados neste trabalho, no LREPF (UFRJ), foram tão precisos quanto os do FNPHI. O valor do coeficiente angular da equação (a = 0,99), que se apresentou próximo a 1 (tangente 45°), mostrou que os resultados encontrados pelo Laboratório de Radioisótopos Eduardo Penna Franca foram tão exatos quanto os do laboratório de referência para análise de selênio do FNPHI. O teste t mostrou que os resultados são similares, pois, o valor t encontrado (t = 0,71) é muito menor que t tabelado (t = 1,75) para N = 9 e p = 0,05. Estes resultados mostram claramente, que o método analítico empregado, desde a digestão das amostras até a determinação de selênio pela técnica do forno de grafite, mostrou-se eficiente e reprodutivo para a análise de selênio em amostras de organismos aquáticos.
O limite de detecção (3s) para o método foi de 1,00 mg L-1 e o limite de quantificação (L.Q.) foi de 0,03 µg g-1.
Biota aquática
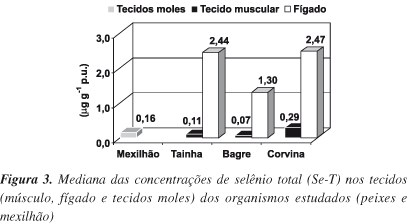
Os resultados das medianas das concentrações de selênio total determinadas nos tecidos e órgãos das espécies estudadas e seus respectivos hábitos alimentares são apresentados na Tabela 3 e Figura 3.
As concentrações de Se no tecido muscular dos peixes mostraram-se significativamente diferentes (H=31,90; p<1x10-4) e foram mais elevadas na corvina, peixe bentônico carnívoro. Entretanto, esta espécie de peixe apresentou uma concentração de Se no fígado similar (p=0,88) à encontrada no mesmo órgão da tainha e significativamente diferente à do fígado do bagre (H=17,46; p<1x10-4). Trabalhos preliminares verificaram a influência do hábito alimentar e da posição trófica na acumulação de selênio15-18. Todos observaram que as espécies carnívoras ou piscívoras, geralmente, apresentaram maiores concentrações de selênio no tecido muscular que as espécies onívoras ou planctívoras. As concentrações de selênio obtidas no presente estudo apresentaram-se menores e dentro de uma variação habitual quando comparadas às concentrações observadas em estudos anteriores em outros ecossistemas mundiais, como é mostrado na Tabela 4 e algumas vezes, abaixo daquelas relatadas em peixes de consumo humano em outros países (Tabela 5). O fígado dos peixes estudados foi o tecido que apresentou a maior concentração de Se quando comparado ao tecido muscular dos mesmos. Estas observações estão consistentes com estudos realizados com peixes de outros ecossistemas mundiais2,10,27,28. Porém, as concentrações de selênio obtidas, no presente estudo, para o fígado dos peixes apresentaram-se menores e dentro de uma variação habitual quando comparadas às concentrações em ambientes não impactados por selênio relatadas em estudos anteriores com peixes, como mostra a Tabela 6.
O teste H de Kruskal-Wallis-ANOVA mostrou haver diferença significativa na concentração de Se entre os tecidos (H=95,87; p<1x10-4). Este teste também foi aplicado ao conjunto de todos os dados com o intuito de se verificar qual dentre os tecidos (músculo e fígado) sofre maior influência do hábito alimentar na acumulação de Se. Observou-se que o músculo foi o único tecido que apresentou uma diferença significativa (H=31,90; p<1x10-4) nas concentrações de Se em função do hábito alimentar de cada espécie de peixe. Portanto, conclui-se que o fígado, provavelmente, é um órgão que pouco sofre a influência do hábito alimentar. A exposição do organismo ao selênio via água, sedimento e alimento parece ser o principal fator que influi na acumulação deste metalóide pela biota aquática. Outros fatores que também podem influir são a espécie de peixe, o hábito alimentar, a posição trófica, o comprimento, peso e idade15.
A mediana da concentração de Se obtida para os tecidos moles do mexilhão, 0,16 µg g-1 em peso úmido ou 0,71 µg g-1 em peso seco (Tabela 7), foi similar àquelas encontradas por Baldwin e Maher28 (0,7-1,8 mg g-1 em peso seco) e inferiores àquelas encontradas em moluscos bivalvos de ambientes relativamente não impactados da Austrália, que variavam de 1,3 a 11 µg g-1 em peso seco36 e, em ambientes da costa indiana1 (3,94 µg g-1 em peso seco). Porém, quando comparada às concentrações de Se encontradas nos peixes (Figura 3), se apresenta inferior àquelas encontradas no peixe carnívoro. Este fato vem em desencontro ao observado em trabalhos anteriores. onde os bivalvos acumularam mais selênio nos seus tecidos que os peixes1. Neste estudo, tanto nos peixes quanto nos mexilhões, as concentrações de Se encontradas nos tecidos apresentaram-se abaixo do limite recomendável pela OMS (1,5 µg g-1 em peso úmido) para o consumo humano e, também, apresentaram-se menores e dentro de uma variação habitual quando comparadas às concentrações relatadas em estudos anteriores com bivalvos, em áreas não impactadas por selênio, como mostra a Tabela 7.
Na Tabela 8 são apresentadas as correlações testadas entre o comprimento total (L) e a concentração de Se nos tecidos dos organismos estudados.
Foram encontradas correlações significativas (p<0,05) e positivas entre as concentrações de Se no tecido muscular da corvina e tainha e seus respectivos comprimentos totais (L) (Tabela 8 e Figura 4). Estes resultados mostraram-se perfeitamente coerentes, uma vez que com o aumento do comprimento, há o aumento da idade do peixe e, conseqüentemente, o aumento do tempo de exposição do organismo ao Se, através do ambiente em que vive e, também, do alimento. Outros autores já verificaram a influência do fator tamanho na acumulação do selênio20,42-44. Esses autores não encontraram relações significativas (p<0,05) entre as concentrações de selênio e o comprimento total dos organismos. Somente Mackay e colaboradores35 encontraram relações significativas entre as concentrações de selênio e o comprimento total, no tecido muscular e no fígado de peixes (marlim-negro).
Os mexilhões apresentaram uma correlação significativa e positiva entre a concentração de Se e o índice de condição (IC). O IC é um parâmetro utilizado na normalização de dados de acumulação de metais pesados em bivalvos45, pois, através deste pode-se excluir diferenças individuais, como tamanho, massa, estágio de vida, ciclo sexual, que são efeitos importantes no processo de bioacumulação de metais traço em mexilhões46-48. O teste H de Kruskal-Wallis-ANOVA mostrou haver diferença significativa na concentração de Se, nos tecidos moles dos mexilhões, entre os diferentes locais de coleta na Baía de Guanabara (praia de Boa Viagem, Marina da Glória e Ponte Rio-Niterói) (H=5,96; p=0,05). Estas observações vêm de encontro aos resultados observados com metais pesados no ecossistema da Baía de Guanabara. Kehrig e colaboradores49 com o estudo de Hg total e metilmercúrio (MeHg) e Lima50 com Cd, Cr, Cu e Zn mostraram haver diferenças espaciais nas concentrações dos metais entre as áreas da Baía de Guanabara amostradas. Porém as concentrações de selênio foram semelhantes às encontradas em ambientes considerados não impactados1,28,36.
CONCLUSÕES
Apesar do ecossistema da Baía de Guanabara ser altamente impactado por substâncias tóxicas, provavelmente, este estuário não deva estar sofrendo lançamentos antropogênicos de selênio, uma vez que a biota analisada apresentou concentrações de selênio em seus tecidos semelhantes às de áreas consideradas não impactadas.
Verificou-se que o organismo predador foi o que apresentou as maiores concentrações de selênio no tecido muscular indicando, assim, que o hábito alimentar influi diretamente na acumulação de selênio neste tecido.
Há uma tendência do Se em se acumular em órgãos com atividade metabólica muito intensa (fígado) e esta pode não ser influenciada pelo hábito alimentar, mas sim pelo modo de incorporação do Se (via dieta ou água).
AGRADECIMENTOS
Ao suporte financeiro concedido pela CAPES através de uma bolsa de mestrado, CNPq (processo 476735/2003-3) e FAPERJ (processo E-26/170.998/2002).
Recebido em 1/2/06; aceito em 3/7/06; publicado na web em 19/1/07
- 1. Chatterjee, A.; Bhattacharya, B.; Adv. Environ. Res. 2001, 5, 167.
- 2. Eisler, R.; U.S. Fish and Wildlife Service Biological Report 85 (1.5), 1985.
- 3. Lemly, A. D.; Ecotoxicol. Environ. Saf. 1997, 37, 259.
- 4. Pelletier, E.; Mar. Environ. Res. 1985, 18, 111.
- 5. Fries, L.; J. Phycology 1982, 18, 328.
- 6. Price, N. M.; Thompson, P. A.; Harrison, P. J.; J. Phycology 1987, 23, 1.
- 7. Fowler, S. W.; Benayoun, G.; Bull. Environ. Contam. Toxicol.1976, 16, 339.
- 8. Peters, G. M.; Maher, W. A.; Krikova, F.; Roach, A. C.; Jeswani, H. K.; Barford, J. P.; Gomes, V. G.; Reible, D. D.; Mar. Environ. Res. 1999, 47, 491.
- 9. Reindfelder, J. R.; Fisher, N. S.; Luoma, S. N.; Nichols, J. W.; Wang, W. X.; Sci. Total Environ. 1998, 219, 117.
- 10. Gillespie, R. B.; Baumann, P. C.; Trans. Am. Fisheries Soc. 1986, 115, 208.
- 11. Fundação Estadual de Engenharia do Meio Ambiente - RJ; Projeto de recuperação gradual do ecossistema da Baía de Guanabara, Rio de Janeiro, 1990.
- 12. Rebello, A. L.; Haekel, W.; Moreira, I., Santelli, R.; Schroeder, F.; Mar. Chem. 1986, 18, 215.
- 13. Carreira, R. S.; Wagener, A. L. R.; Readman, J. W.; Fileman, T. W.; Macko, S. A.; Veiga, A.; Mar. Chem. 2002, 79, 202.
- 14. Deaker, M.; Maher, W.; Anal. Chim. Acta 1997, 350, 287.
- 15. Besser, J. M.; Giesy, J. P.; Brown, R. W.; Buell, J. M.; Dawson, G. A.; Ecotoxicol. Environ. Saf. 1996, 35, 7.
- 16. Burger, J.; Gaines, K. F.; Boring, C. S.; Stephens, W. L. Jr.; Snodgrass, J.; Gochfeld, M.; Environ. Res., A 2001, 87, 108.
- 17. Barwick, M.; Maher, W.; Mar. Environ. Res. 2003, 56, 471.
- 18. Bhattacharya, B.; Sarkar, S. K.; Das, R.; Ecological Indicators 2003, 2, 367.
- 19. Maher, W.; Baldwin, S.; Deaker, M.; Irving, M.; Appl. Organomet. Chem. 1992, 6, 103.
- 20. Roberts, B.; Unpublished BSc. Honorous Thesis, University of Canberra, 1993.
- 21. Wlodarczkyk, J.; Beath, K.; Heavy metals in seafood in Lake Macquarie: a cross-sectional survey, (Report to the Hunter Public Health Unit), University of Newcastle Research Association, New Lambton, New South Wales, 1997.
- 22. Rayment, G. E.; Barry, G. A.; Mar. Pollut. Bull. 2000, 41, 353.
- 23. Schmitt, C. J.; Brumbaugh, W. G.; Arch. Environ. Contam. Toxicol.1990, 19, 731.
- 24. Rayment, G.; Barry, G. A.; Mar. Pollut. Bull. 2000, 41, 353.
- 25. Simonoff, M.; Hamon, C.; Moreto, P.; Llabador, Y.; Simonoff, G.; J. Food Comp. Anal. 1988, 1, 295.
- 26. Wyatt, C. J.; Meléndez, J. M.; Acuña, N.; Rascon, A.; Nutr. Res. 1996, 16, 949.
- 27. Liu, D. L.; Yang, Y. P.; Hu, M. H.; Harrison, P. J.; Price, N. M.; Mar. Environ. Res. 1987, 22, 151.
- 28. Baldwin, S.; Maher, W.; Mar. Environ. Res. 1997, 44, 243.
- 29. Grimanis, A. P.; Zafiropoulos, D.; Vassilaki-Grimani, M.; Environ. Sci. Technol 1978, 12, 723.
- 30. De Goeij, J. J. M.; Guinn, V. P.; Young, D. R.; Mearns, A. J.; Comparative studies of food and environmental contamination, International Atomic Energy Agency: Vienna, 1974, p. 189-200.
- 31. Hall, R. A.; Zook, E. G.; Meaburn, G. M.; National Marine Fisheries Service survey of trace elements in the fishery resource, U.S. Dep. Commer., NOAA Tech. Rep., NMFS SSRF-721, 1978.
- 32. Luten, J. B.; Ruiter, A.; Ritskes, T. M.; Rauchbaar, A. B.; Riekwel-Booy, G.; J. Food Sci. 1980, 45, 416.
- 33. Heit, M.; Bull. Environ. Contam. Toxicol. 1979, 23, 1.
- 34. Tamura, Y.; Maki, T.; Yamada, H.; Shimamura, Y.; Ochiai, S.; Nishigaki, S.; Kimura, Y.; Tokyo Toritsu Eisei Kenkyusho Nenpo 1975, 26, 200.
- 35. Mackay, N. J.; Kazacos, M. N.; Williamns, R. J.; Leedow, M. I.; Mar. Pollut. Bull. 1975, 6, 57.
- 36. Lobel, P. B.; Logerich, H. P.; Jackson, S. E.; Belkhode, S. P.; Arch. Environ. Cont. Toxicol. 1991, 21, 118.
- 37. Lunde, G.; J. Sci. Food Agric. 1970, 21, 242.
- 38. Bertine, K. K.; Goldberg, E. D.; Limnol. Ocean. 1972, 17, 877.
- 39. Karbe, L.; Schnier, Ch.; Slewers, H. O.; J. Radioanal. Chem.1977, 37, 927.
- 40. Fukai, R.; Oregioni, B.; Vas, D.; Oceanologica Acta 1978, 1, 391.
- 41. Stump, I. G.; Kearney, J. M.; D'Auria, J.; Popham, J. D.; Mar. Pollut. Bull. 1979, 10, 270.
- 42. Lyle, J. M.; Aust. J. Mar. Freshwat. Res. 1986, 37, 309.
- 43. Chvojka, R.; Mar. Pollut. Bull. 1988, 19, 210.
- 44. Maher, W.; Deaker, M.; Jolley, D.; Krikowa, B.; Roberts, B.; Appl. Organomet. Chem. 1997, 11, 313.
- 45. Joiris, C. R.; Holsbeek, L.; Otchere, F.A.; Mar. Pollut. 2000, 40, 457.
- 46. Wang, W.; Environ. Int. 1987, 13, 437.
- 47. Cossa, D.; Oceanologica Acta 1989, 12, 417.
- 48. Rebelo, M. F.; do Amaral, M. C. R.; Pfeiffer, W. C.; Mar. Pollut. Bull. 2003, 46, 1341.
- 49. Kehrig, H. A.; Costa, M.; Moreira, I.; Malm, O.; Mar. Pollut. Bull. 2002, 44, 1018.
- 50. Lima, E. F. A.; Dissertação de Mestrado, Pontifícia Universidade Católica, Brasil, 1997.
Datas de Publicação
-
Publicação nesta coleção
28 Maio 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Recebido
01 Fev 2006 -
Aceito
03 Jul 2006