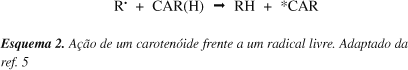Resumo
Carotenoids are widely distributed in nature, providing yellow, orange or red color in a great number of vegetables, microorganisms and in some animals. Carotenoids act as biological antioxidants and seem to play an important role in human health by protecting cells and tissues from the damaging effects of free radicals and singlet oxygen. Several authors describe the oxidative cleavage of carotenoids in flavor compounds as occuring through chemical or photochemical degradations or through biotechnological processes. Biotransformation of carotenoids seems to be a reasonable alternative to produce flavor compounds since these compounds are considered 'natural' ingredients. In this work we describe the properties of some carotenoids, as well as biotechnological approaches to obtain its oxyfunctionalized derivatives.
carotenoids; biotransformation; functional properties
carotenoids; biotransformation; functional properties
REVISÃO
Carotenóides: propriedades, aplicações e biotransformação para formação de compostos de aroma
Carotenoids: properties, applications and biotransformation in flavor compounds
Mariana Uenojo* * e-mail: mariu@fea.unicamp.br ; Mário Roberto Maróstica Junior; Gláucia Maria Pastore
Departamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, CP 6121, 13083-862 Campinas SP, Brasil
ABSTRACT
Carotenoids are widely distributed in nature, providing yellow, orange or red color in a great number of vegetables, microorganisms and in some animals. Carotenoids act as biological antioxidants and seem to play an important role in human health by protecting cells and tissues from the damaging effects of free radicals and singlet oxygen. Several authors describe the oxidative cleavage of carotenoids in flavor compounds as occuring through chemical or photochemical degradations or through biotechnological processes. Biotransformation of carotenoids seems to be a reasonable alternative to produce flavor compounds since these compounds are considered 'natural' ingredients. In this work we describe the properties of some carotenoids, as well as biotechnological approaches to obtain its oxyfunctionalized derivatives.
Keywords: carotenoids; biotransformation; functional properties.
INTRODUÇÃO
Os carotenóides são um grande grupo de pigmentos presentes na natureza, com mais de 600 estruturas caracterizadas1-4 com uma produção estimada em 100 milhões de t por ano1, identificados em organismos fotossintetizantes e não fotossintetizantes, plantas superiores, algas, fungos, bactérias e em alguns animais1,3,5. São responsáveis pelas cores do amarelo ao vermelho de frutas, vegetais, fungos e flores5, utilizados comercialmente como corantes alimentícios e em suplementos nutricionais, com um mercado global estimado em US$ 935 milhões para 20051.
HISTÓRICO
A b-ionona foi sintetizada em 1893, por Tiemann e Kinger, em uma tentativa de esclarecer a estrutura de um composto de aroma de impacto do óleo obtido de Iris florentina, as chamadas ironas. Em 1929, a b-ionona foi isolada de Boronia megastigma. Em 1934, a picrocrocina foi identificada como precursora de safranal em estigmas de Crocus sativus (açafrão)5.
Com o advento da cromatografia gasosa e da cromatografia gasosa acoplada à espectrometria de massas, o número de noroisoprenóides identificados aumentou drasticamente durante as décadas de 60 a 80. Um dos fatos marcantes foi a identificação de rosa-cetonas, como a b-damascenona e b-damascona em óleo de Rosa damascena, em 1967 e o isolamento de b-damascenona de óleo de rosa Bulgária, em 1970 e sua identificação em uvas e vinho em 19745. Devido à diversidade do perfil de odores e extrema potencialidade, rosa-cetonas têm se tornado uma das mais importantes descobertas no ramo de aromas e fragrâncias6.
ESTRUTURA QUÍMICA E NOMENCLATURA
Os carotenóides são tetraterpenóides de 40 carbonos unidos por unidades opostas no centro da molécula1,7. Ciclização, hidrogenação, desidrogenação, migração de duplas ligações, encurtamento ou alongamento da cadeia, rearranjo, isomerização, introdução de funções com oxigênio ou a combinação destes processos resultam na diversidade de estruturas dos carotenóides7.
A cadeia poliênica pode ter de 3 a 15 duplas ligações conjugadas e o comprimento do cromóforo determina o espectro de absorção e a cor da molécula. Todas são baseadas em 7 diferentes grupos terminais, dos quais somente 4 (b, e, k e y) são encontradas em carotenóides de vegetais superiores1.
Carotenóides compostos somente de carbono e hidrogênio são chamados de carotenos e os carotenóides oxidados, as xantofilas, apresentam grupos substituintes com oxigênio, como hidroxilas, grupos ceto e epóxi1,7,8.
FUNÇÕES NA SAÚDE E PREVENÇÃO DE DOENÇAS - MECANISMOS ENVOLVIDOS
Os carotenóides parecem desempenhar alguns papéis fundamentais na saúde humana, sendo essenciais para a visão. Apesar de muitas hipóteses comprovadas, suas funções não estão completamente elucidadas in vivo6. b-caroteno e outros carotenóides foram reconhecidos no século XX como as principais fontes de vitamina A. Mais recentemente, efeitos benéficos de carotenóides contra cânceres, doenças de coração e degeneração macular foram reconhecidos e estimularam intensas investigações sobre o papel desses compostos como anti-oxidantes e como reguladores de resposta do sistema imune6.
O licopeno, caroteno presente em produtos de tomate, previne oxidação do LDL e reduz o risco do desenvolvimento de arteriosclerose e doenças coronárias9. Estudos mostram que o consumo diário de produtos à base de tomate proporciona quantidades suficientes de licopeno para redução substancial da oxidação do LDL. Relata-se ainda que a absorção do licopeno advindo de produtos processados de tomate é mais eficiente que a absorção do composto no produto in natura pois, durante o processamento térmico, o licopeno ligado quimicamente a outros compostos é convertido em uma forma livre e mais facilmente absorvível. Outras pesquisas sugerem que o licopeno pode reduzir o risco de câncer de próstata, pulmão, pele e bexiga10.
Evidências epidemiológicas sugerem que a ingestão de b-caroteno pode inibir certos tipos de câncer e doenças mediadas por radicais livres6. A capacidade dos carotenóides como agente quelante do oxigênio singlete molecular é bem conhecida. Assim como a prevenção do câncer, o potencial anti-oxidante dos carotenóides pode ser útil na inibição de outras doenças provocadas pela ação dos radicais livres11.
Carotenóides possuem um efeito destacável na resposta imune e na comunicação intracelular e apresentam efeitos benéficos contra doenças relacionadas ao envelhecimento. Além disso, há indícios de que os carotenóides em associação com outros componentes de frutas e vegetais apresentam efeito protetor contra algumas doenças crônicas. Por ex., o efeito sinergístico entre b-caroteno e vitaminas C e E foi observado na proteção celular, provavelmente decorrente da capacidade do b-caroteno em destruir os radicais livres e reparar os radicais de tocoferol produzidos pela ação do a-tocoferol6.
Ação quelante do oxigênio molecular singlete
O oxigênio singlete pode ser formado pela transferência de energia eletrônica de um composto em um estado excitado para o oxigênio triplete. Em sistemas biológicos, moléculas como porfirinas, clorofilas e riboflavina podem levar à formação de 1O2, acarretando efeitos deletérios como alteração do DNA e peroxidação de lipídios. O Esquema 1 mostra a ação do carotenóide frente à presença do 1O25.
Uma vez formado, o carotenóide no estado excitado (*CAR) pode facilmente retornar ao estado fundamental, dissipando energia na forma de calor. Investigações sobre o tema revelam que a capacidade de um determinado carotenóide em quelar o 1O2 está relacionada com o número de duplas ligações conjugadas e aos grupos ligados às extremidades da cadeia6.
Interações dos carotenóides com radicais livres
As reações dos carotenóides com radicais livres levam à transferência de elétrons ou possíveis reações adicionais. O Esquema 2 exemplifica o modo de ação de um carotenóide frente a um radical livre.
A reação do *CAR com uma molécula de oxigênio pode levar à formação de um peróxido, como mostrado no Esquema 3.
O b-caroteno pode agir como um pró-oxidante em altas pressões de oxigênio e altas concentrações do carotenóide.
Uma vez que os carotenóides em sistemas biológicos estarão sempre associados com outros sistemas de óxido-redução, a interação com outros antioxidantes poderá gerar efeitos sinergísticos. Sabe-se que a estrutura dos carotenóides exerce grande influência sobre a atividade antioxidante. Por ex., cataxantina e astaxantina apresentam melhores atividades anti-oxidantes que b-caroteno ou zeaxantina. A atividade anti-oxidante aumenta com o aumento do número de duplas ligações conjugadas, grupos cetona e presença de anéis ciclopentano em sua estrutura5.
Carotenóides como precursores da vitamina A
Os carotenóides são conhecidos por serem precursores de vitamina A, sendo que essa conversão ocorre naturalmente no fígado. A simetria da molécula de b-caroteno sugere que a clivagem ocorre na posição central da molécula, produzindo duas moléculas de vitamina A. Entretanto, essa teoria não está bem estabelecida até o momento. Tentativas recentes de entender esse mecanismo são especulativas uma vez que a clivagem ocorre in vivo, tornando as condições de reação muito difíceis de serem controladas. Apesar de a clivagem central do b-caroteno pela enzima 15,15'-dioxigenase estar provada in vivo e in vitro, o ataque iniciando a partir da posição 8' também encontra subsídios consideráveis. Alguns autores sugerem que ambos os mecanismos (posição 15' ou 8') são possíveis. Existem muitos relatos propostos acerca das etapas envolvidas na clivagem, mas nenhum deles oferece evidências convincentes de possíveis rotas metabólicas ou intermediários envolvidos nessa reação enzimática12.
FUNÇÃO DOS CAROTENÓIDES EM VEGETAIS E MICRORGANISMOS
As plantas são a maior fonte de carotenóides, os quais são responsáveis por conferir as cores características de frutas, como morango, laranja e maracujá, respondendo ainda pelas cores de alguns pássaros, como o flamingo e o canário, alguns insetos e animais marinhos (camarão, lagosta e salmão)11.
Os carotenóides acumulam-se em cloroplastos de todas as plantas verdes como uma mistura de a e b-carotenos, b-criptoxantina, luteína, zeaxantina, violaxantina e neoxantina, estando complexados não-covalentemente com proteínas. Os carotenóides também se encontram em microrganismos, nos quais são sintetizados pela rota metabólica dos isoprenóides. Aproximadamente 80 carotenóides diferentes são sintetizados por bactérias fotossintéticas e em alguns fungos filamentosos5. As funções dos carotenóides na fotossíntese são: pigmento para absorção de luz e fotoprotetores contra danos oxidativos6.
Os níveis de carotenóides em células de folhas e frutas mantem-se relativamente constantes até o início da senecência. A cor amarela subseqüente à degradação de clorofila é indicativa da presença e dos efeitos das enzimas degradadoras de carotenóides. Dois tipos de enzimas são responsáveis pela oxigenação e degradação dos carotenóides: lipoxigenases, advindas dos cloroplastos, que catalisam a conversão de lipídios insaturados a compostos de aroma em plantas; e peroxidases, da mitocôndria, sendo que ambos necessitam de oxigênio molecular e cofatores para suas atividades. Uma grande variedade de oxigenações produz terpenóides de cadeia curta de tetraterpenos em plantas. Essas degradações envolvem clivagem das ligações C (9-10), (8-9), (7-8) e (6-7) para gerar compostos cíclicos com 13, 11, 10 e 9 carbonos, respectivamente13.
AROMAS NATURAIS
A atual demanda do mercado consumidor por produtos 'naturais' e 'saudáveis' abre caminho para a síntese microbiana de compostos de aroma14.
As legislações norte-americana e européia referem-se aos compostos de aroma naturais àqueles obtidos por processos físicos (extração de suas fontes naturais) ou por processos enzimáticos e microbianos que envolvem precursores isolados na natureza, sendo que o composto obtido deve ser idêntico ao já existente na natureza para que a substância seja legalmente rotulada como 'natural'15.
Grande parte dos compostos de aromas utilizados no mundo pertence aos chamados aditivos químicos, pois são obtidos por processos químicos.
Algumas vantagens dos bioprocessos frente à síntese química são: utilização de condições brandas de processo; geram baixa carga de resíduos; estéreo- e régio-seletividades das reações enzimáticas16; os produtos são considerados naturais14.
OCORRÊNCIA DE COMPOSTOS DE AROMA NOROISOPRENÓIDES
Compostos de aroma derivados de carotenóides têm sido detectados em produtos folhosos (tabaco, chá, mate), em óleos essenciais, frutas (uva, maracujá, carambola, marmelo, maçã, nectarina, melão, tomate), vegetais, condimentos (açafrão, páprica) e em outras fontes, como vinho, rum, café, carvalho, mel, algas marinhas etc. Estes são alguns exemplos que ilustram a importância dos noroisoprenóides como compostos de aroma e de fragrâncias e sua ocorrência na natureza4.
Tabaco
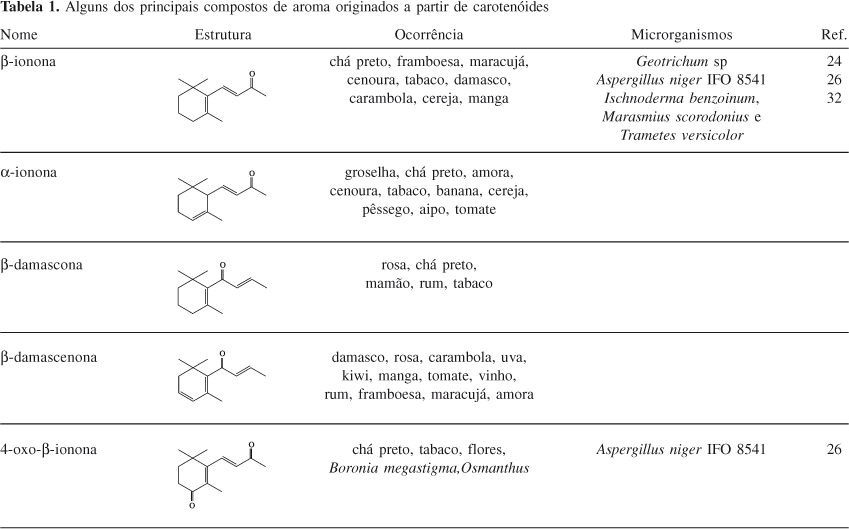
Tabaco (Nicotina tabacum) é uma das maiores fontes de degradação de carotenóides, com mais de 100 compostos identificados. Derivados oxigenados, como megastigma-5,8-dien-4-ona e 4-oxo-b-ionona (Tabela 1), são considerados constituintes importantes no aroma de tabaco4.
Chá
Iononas isoméricas e damasconas têm sido identificadas entre os compostos voláteis presentes em Camellia sinensis. O teaspirano (Tabela 1) e seus derivados oxigenados e outros compostos derivados de carotenóides têm sido identificados em aroma de chá. Um composto típico é o C13-espiroéter-teaspirona que apresenta notas "de chá" e "florais doces"4.
Frutas
Metabólitos de carotenóides são constituintes comuns em aromas de frutas. Em marmelo, carambola, nectarina e maracujá eles são considerados importantes devido ao aroma típico dessas frutas.
O amadurecimento do marmelo gera um aroma característico e intenso, derivado de precursores não voláteis. Entre os constituintes voláteis encontra-se uma série de estruturas isoprenóides de 10 carbonos denominadas de lactonas e óxidos de marmelo, além de quantidades traço de éteres de 12 carbonos estruturalmente relacionados, chamados de oxepino e oxepano de marmelo.
Noroisoprenóides voláteis de 13 carbonos têm sido identificados em carambola, incluindo b-damascenona. A formação de metabólitos de 10 e 15 carbonos obtidos da hidrólise da parte central de um carotenóides indica a ação de 2 enzimas: uma dioxigenase altamente específica que hidrolisa somente as duplas ligações 11-12 gerando metabólitos de 15 carbonos e uma 9-10-dioxigenase que aceita vários carotenóides e libera compostos de 13 carbonos com grupos cetônicos terminais. Em nectarina, b-ionona e b-damascenona são os maiores contribuintes de aroma4.
Vegetais
Derivados de furano com propriedades olfativas interessantes têm sido isolados de folhas de espinafre. Estes compostos apresentaram descritores como "cenoura cortada fresca" e "amadeirado", descritos como produtos de fotoxidação de um epóxido de 13 carbonos4.
Vinhos
Compostos de aroma derivados de carotenóides foram reconhecidos como importantes contribuintes do aroma de vinhos tintos e brancos e em sucos de uvas.
Em sucos de uvas Chardonnay, 70% da concentração total de metabólitos voláteis compreendem noroisoprenóides de 13 carbonos, observado principalmente nas frações ácida e hidrolisadas por glicosidases. A hidrólise ácida do suco de uvas Chardonnay exibe descritores como "chá", "lima" e "mel", que o vinho preparado do suco também apresenta4.
Mel
Mel extraído na Nova Zelândia contém diversos compostos de aroma de interesse derivados de carotenóides. Noroisoprenóides de 8, 9, 13 e 15 carbonos foram identificados em mel, incluindo dicetonas alênicas e acetilênicas4.
Algas comestíveis
Na alga Porphyra tenera (Asakusa-nori), uma das mais populares algas comestíveis do Japão, foi encontrada uma série de metabólitos de carotenóides de 9, 10, 11 e 13 carbonos. Entre os noroisoprenóides de 10 carbonos encontrou-se a e b-ciclocitral e safranal (Tabela1). Entre os compostos de 11 carbonos observou-se a presença de b-ionona4.
OBTENÇÃO DE COMPOSTOS DE AROMA DERIVADOS DE CAROTENÓIDES
Compostos de aroma derivados de carotenóides têm atraído a atenção de químicos e aromistas há algum tempo, o que resultou no isolamento e elucidação da estrutura química de muitos dos compostos de aroma derivados dos carotenóides obtidos por extração de plantas. Compostos como b-ionona, a-ionona, diidroactinidiolida, damascenol e b-ciclocitral são alguns dos voláteis derivados de carotenóides que, nas plantas, têm a função de antifungicida, afastar herbívoros e até mesmo atrair agentes polinizadores13.
Papel dos carotenóides como precursores de aromas
Compostos de aromas advindos de carotenóides podem ser produzidos via enzimática ou não enzimática. A clivagem não enzimática inclui fotoxigenação, (auto) oxidação e degradação térmica. A biodegradação é catalisada por sistemas de dioxigenases.
Em geral, três passos são necessários para se gerar um composto de aroma a partir de um carotenóide: clivagem inicial por dioxigenase; subseqüente transformação enzimática dos produtos iniciais de clivagem gerando intermediários polares (precursores de aromas) e conversão catalisada por ácidos de precursores não voláteis na forma ativa dos compostos de aroma.
Um exemplo desta reação é a formação de b-damascenona a partir de neoxantina (Figura 1). A primeira clivagem oxidativa do precursor produz uma cetona (denominada "grasshopper ketone") que é reduzida enzimaticamente e convertida ao produto de interesse4. Por outro lado, o b-caroteno é convertido a b-ionona por meio de apenas uma clivagem (Figura 2).
Produção biotecnológica de noroisoprenóides
Em geral, três métodos podem ser aplicados para a produção biotecnológica de compostos de aroma derivados de carotenóides: uso de enzimas, de microrganismos e uso de tecidos vegetais ou culturas de células.
Os noroisoprenóides ocorrem predominantemente em formas complexadas nos tecidos vegetais, possibilitando o uso de glicosidases ou hidrolases. O uso de tecidos vegetais hidrolisa o carotenóide por co-oxidação usando lipoxigenase ou outros sistemas de oxidase com fenol-oxidase, lacto-peroxidase ou xantina-oxidase. No caso de b-caroteno, há formação de b-ionona, 5,6-epóxi-b-ionona e diidroactinidiolida como compostos voláteis majoritários4.
OXIDAÇÃO E HIDRÓLISE ENZIMÁTICA
Nornier e colaboradores17 estudaram o efeito da luz, temperatura e oxidação na degradação de carotenóides. Sob a influência da luz, observaram que o b-caroteno sofre rápida degradação. Após 30 min de exposição, a concentração de b-caroteno se reduz à metade da concentração inicial. À temperatura ambiente e na ausência da luz, a velocidade de degradação do carotenóide torna-se muito lenta, mas à medida que há aumento de temperatura, há também aumento na velocidade de degradação. Compostos das classes dos noroisoprenóides e sesquiterpenos foram identificados decorrentes da degradação de b-caroteno, tais como megastigmatrienonas e b-ionona. Terpenos e noroisoprenóides foram identificados a partir da degradação de luteína, entre eles, megastigmatrienonas, 6-hidróxi-b-ionona e 2-hidróxi-b-ionona. A oxidação com cobre e por radicais foi realizada com b-caroteno e foram identificados b-ciclocitral, b-ionona, 3-oxo-b-ionona, 6-hidróxi-b-ionona, 3-oxo-b-ionol e sesquiterpenos.
Durante o processamento de folhas de chá, b-caroteno, luteína e zeaxantina são degradados, liberando compostos de aroma desejáveis. A decomposição ocorre principalmente via reação enzimática oxidativa durante a secagem e fermentação, por foto e auto-oxidação. b-ionona é o maior produto de degradação do b-caroteno, enquanto a-ionona, b-ionona, linalool e outros aldeídos terpenóides e cetonas são produtos de degradação de outros carotenóides presentes no chá. A adição de carotenóides durante o processamento de chá influenciou a formação de a- e b-damascenona, b-damascona, 3-oxo-b-ionona, sugerindo a formação a partir de carotenóides18.
Co-oxidação enzimática de b-caroteno por xantina oxidase em soluções aquosas leva à formação de b-ionona e derivados como epóxi-b-ionona, diidroactinidiolida, b-ciclocitral e pseudo-ionona, devido à formação de radicais livres durante as primeiras horas de reação. b-ionona é o principal produto obtido e sua quantidade depende do tempo de reação após a adição de substrato utilizado por xantina oxidase19.
O efeito da temperatura, fotoxidação e oxidação química (com ácido m-cloro-perbenzóico) do b-caroteno e posterior análise dos voláteis originados foram avaliados. Os voláteis advindos de cada tipo de oxidação foram muito similares, mas diferiam em suas concentrações relativas. Destaca-se a formação de diidroactinidiolida, b-ionona e 5,6-epóxi-b-ionona em todos os métodos de oxidação estudados. A auto-oxidação a 80 °C e fotoxidação originaram produtos mais específicos: b-ionona e diidroactinidiolida20.
Diferentes concentrações iniciais de b-caroteno (10, 45 e 90 mg/L) foram avaliadas quanto à degradação e ao acúmulo de b-ionona em sistemas aquosos. Nas três concentrações estudadas, mais da metade do b-caroteno foi degradado nas 2 primeiras horas de reação. A concentração de b-ionona aumentava em 3 ou 4 h, declinando posteriormente. O meio contendo 45 mg/L de b-caroteno apresentou o maior acúmulo de b-ionona, 450 mg/L, talvez pela inibição de xantina oxidase pelas micelas de b-caroteno em altas concentrações. Na presença de solventes, a degradação de b-caroteno ocorreu em hexano ou em benzeno. Solventes mais polares como diclorometano ou benzeno inibiram a atividade enzimática21.
A b-damascenona pode ser formada pela hidrólise de metabólitos secundários complexos derivados de carotenóides, como a neoxantina. Estudos hidrolíticos com glicosidases mostraram que o triol foi convertido rapidamente em b-damascenona, 3-hidróxi-damascona e megastigma à temperatura ambiente em solução aquosa e pH 3. Dióis como a luteína podem gerar b-damascenona e 3-hidróxi-damascona lentamente nas mesmas condições e podem gerar b-damascenona em vinhos durante o envelhecimento na garrafa22.
BIOSSÍNTESE DE COMPOSTOS DE AROMA DE CAROTENÓIDES
A degradação de carotenóides é considerada chave na formação de muitos compostos de aroma em plantas e em produtos vegetais. Os carotenóides servem como substrato, mas a natureza dos mecanismos bioquímicos (enzimáticos ou não enzimáticos) mediante degradações oxidativas ainda não está bem elucidada. As reações catalisadas por peroxidases, lipoxigenases e dioxigenases e as reações não enzimáticas têm sido realizadas in vitro23.
A capacidade de algumas enzimas em converter b-caroteno em b-ionona tem sido demonstrada e parcialmente caracterizada. Os genes que codificam as enzimas envolvidas na clivagem específica de carotenóides têm sido isolados de Arabidopsis e de petúnia. Estudos in vitro indicaram que geraniol e muitos compostos noroisoprenóides não cíclicos encontrados em tomate e melancia podem ser obtidos da hidrólise de licopeno. b-ionona, b-ciclocitral e diidroactinodiolida são produtos da degradação oxidativa de b-caroteno. As enzimas e os genes responsáveis por estas reações ainda não estão totalmente identificados, mas a razão entre licopeno e o conteúdo de compostos de aromas está relacionada com o estágio de maturação do tomate. Genes de dioxigenases envolvidas na formação de ácido abscíssico, geranil acetona, pseudo-ionona e b-ionona são relatadas, mas não é claro se esses genes ou similares ou enzimas possuem atividade na formação destes compostos de aroma23.
Os compostos de aroma advindos da degradação enzimática e fotoxidação de carotenóides possuem em geral 9, 10, 11 e 13 carbonos, sendo essenciais para o perfil de aroma dos vegetais nos quais estão presentes23. Exemplos de compostos de aroma produzidos por biotransformação são mostrados na Tabela 1.
Biotransformação
Esforços têm sido direcionados para explorar a grande gama de possibilidades oferecidas pelas reações microbianas no que se refere à clivagem de carotenóides. Destaca-se o consórcio formado por Geotrichum sp e Bacillus sp, capaz de converter luteína da flor de calêndula (marigold, Calendula officinalis) ao ser utilizada como única fonte de carbono. A linhagem de Geotrichum sp foi a responsável por converter luteína em b-ionona, enquanto a linhagem de Bacillus sp transformou a b-ionona em outros compostos através da redução do noroisoprenóide produzindo 7,8-diidro-b-ionona e 7,8-diidro-b-ionol. A associação entre os dois microrganismos preveniu os efeitos tóxicos e inibitórios dos produtos e um forte aroma de tabaco foi produzido24.
Recentemente, a seleção de algumas cepas para a degradação de b,b-caroteno foi realizada com mais de 50 linhagens. Dez mostraram potencial para converter o carotenóide em compostos de aroma. Diidroactinidiolida foi o único produto da bioconversão de b,b-caroteno nas culturas submersas de Ganoderma applanatum, Hypomyces odoratus, Kuehneromyces mutabilis e Trametes suaveolens. Compostos voláteis de carotenóides foram detectados no meio de cultura de Ischnoderma benzoinum, Marasmius scorodonius e Trametes versicolor, sendo a b-ionona o metabólito principal para essas linhagens, enquanto b-ciclocitral, diidroactinidiolida, e 2-hidróxi-2,6,6-trimetil-cicloexanona foram formados em quantidades menores, sendo as enzimas extracelulares as responsáveis pela biocatálise25.
A biotransformação de b-ionona por células de Aspergillus niger IFO 8541 imobilizadas em leito de alginato foi investigada. A adição de b-ionona inibiu o crescimento microbiano e somente foi convertida em compostos de aroma quando se tornou a única fonte de carbono do meio. A baixa solubilidade do precursor levou à escolha da reação em sistema bifásico. A reação ocorreu depois da transferência do precursor da fase orgânica para o interior da célula, através de adsorção no complexo da membrana celular. Os compostos originados da biotransformação atingiram a concentração de 3,5 g/L após 400 h de reação. Compostos como 4-oxo-b-ionona, 2-hidróxi-b-ionona, 4-hidróxi-b-ionona, 2-oxo-b-ionona e 4-hidróxi-5,6-epóxi-b-ionona foram formados através da biotransformação26.
Um tipo de monooxigenase do citocromo P450 de Bacillus megaterium (P450 BM-3) possui baixa atividade de hidroxilação de b-ionona. A fenilalanina na posição 87 da monooxigenase está localizada diretamente sobre um grupo heme e controla régio- e enantio-seletividades da enzima. A substituição da fenilalanina 87 por uma valina, aumentou a capacidade de hidroxilação da b-ionona e a introdução de uma glicina apresentou um incremento na atividade enzimática, porém em menor extensão que a valina e a fenilalanina. Valina, alanina e fenilalanina são aminoácidos não polares e hidrofóbicos, enquanto a glicina é um aminoácido pouco polar e possui um efeito diferente na interação com o substrato. A P450 BM-3 e mutantes produziram somente 4-hidróxi-b-ionona a partir de b-ionona. Além disso, são capazes de oxidar ácidos graxos saturados e alcanos nas posições subterminais, produzindo diferentes produtos hidroxilados e podem oxidar hidrocarbonetos aromáticos policíclicos e terpernos em diferentes posições. A a-ionona foi hidroxilada pela P450 BM-3 e pelos três mutantes em diversos produtos: 3-hidróxi-a-ionona (70%), 7- hidróxi-a-ionona (24%) e outros derivados hidroxilados em menores concentrações27.
O mecanismo exato da oxidação microbiana de carotenóides não está claro até o momento, sendo possível a existência de diferentes rotas oxidativas em microrganismos degradadores de carotenóides28.
Enzimas
Compostos noroisoprenóides de 13 carbonos como b-ionona, 3-hidróxi-b-ionona e 3-hidróxi-5,6-epóxi-b-ionona são derivados de carotenóides importantes na formação de compostos de aroma durante o amadurecimento de nectarinas. A clivagem de b-caroteno por carotenases obtidas de nectarinas seguiu o modelo de uma reação de primeira ordem e a degradação enzimática foi unicamente dependente da concentração de substrato. Essas enzimas apresentaram maior e menor afinidade com o substrato que as enzimas isoladas de marmelo e carambola, respectivamente29.
Diversas enzimas nomeadas de dioxigenases de carotenóides são encontradas em plantas, cianobactérias e animais. Estas enzimas podem clivar as duplas ligações 9, 10 (9'-10') de vários carotenóides e liberar b-ionona e derivados, importantes na senescência das flores. Frutos de gardênia e açafrão contêm mono- e diglicosídeos de 20 carbonos, as crocetinas, de intensa cor vermelha. Fungos de raízes de açafrão também acumulam compostos como picrocrocina e safranal, responsáveis pelo amargor e aroma destes compostos. A biossíntese de crocina, picrocrocina e safranal envolve a clivagem de zeaxantina na posição 7-8 (7'-8') pela dioxigenase de carotenóide30.
Investigações em bioquímica e biologia molecular avançam no sentido de isolar e caracterizar as enzimas responsáveis pela degradação de carotenóides. Condições brandas de processo e tempos curtos de reação tornam as culturas livres de células promissoras para a produção de compostos de aroma noroisoprenóides. Entretanto, algumas investigações relativas aos mecanismos de ação ainda são necessárias para uma compreensão mais abrangente de toda a potencialidade envolvida25.
Uma fração enzimática obtida de carambola foi testada quanto à clivagem de b-caroteno. O maior produto de reação isolado foi a b-ionona, obtido da clivagem da dupla ligação 9-10 (9'-10'). A importância da ação enzimática de carotenóides na carambola está relacionada com o amadurecimento da fruta31.
O produto extra-celular do fungo Lepista irina foi capaz de degradar eficientemente o b,b-caroteno gerando quatro compostos: b-ionona, b-ciclocitral, diidroactinidiolida e 2-hidróxi-2,6,6-trimetil-ciclohexanona. O b-apo-10'-carotenal foi identificado como produto de degradação não-volátil. A enzima chave (peroxidase) para a clivagem do b,b-caroteno foi caracterizada por possuir massa molecular de 50,5 kDa e ponto isoelétrico de 3,75. A degradação mais rápida ocorreu a 34 °C com pH entre 3,5 e 4. Esta peroxidase representa a primeira enzima microbiana com capacidade degradadora do carotenóide caracterizada molecularmente32.
A co-oxidação do b-caroteno por lipoxigenase de soja é caracterizada pelo ataque randômico em diferentes posições da molécula. A enzima mostrou capacidade de atacar o carotenóide em presença de ácido linolênico sob condições aeróbicas. O grande número de compostos obtidos sustenta a hipótese do ataque randômico33.
A clivagem de carotenóides por 9-cis-epóxi-carotenóide-dioxigenases de Arabidopsis thaliana foi estudada. Para determinação de sua função bioquímica, a proteína foi expressa em E. coli e utilizada em ensaios in vitro. A proteína recombinante foi capaz de clivar b-caroteno, luteína, zeaxantina, trans-violaxantina, 9-cis-violaxantina, 9-cis-neoxantina nas posições 9-10 e 9'-10'. A enzima cliva os substratos de maneira simétrica produzindo compostos de 13 e 14 carbonos, destacando-se a obtenção de 3-hidróxi-b-ionona como reconhecido composto de aroma34.
CONCLUSÃO
A formação e degradação de carotenóides afetam a cor, o valor nutricional e o perfil de aromas de frutas e vegetais. O conhecimento dos mecanismos químicos, enzimáticos e moleculares que controlam a formação de compostos de aroma em vegetais é ainda insuficiente. Apesar disso, alguns relatos descrevem a produção de compostos de aroma advindos de carotenóides em plantas e em uma grande variedade de microrganismos.
Da mesma forma, as enzimas isoladas e caracterizadas de plantas e microrganismos parecem ter um grande potencial para hidrólise de carotenóides. Entretanto, observa-se que o rendimento dos processos biotecnológicos descritos ainda não é compatível com aplicação industrial direta, sendo imperativa a realização de investigações adicionais de forma a otimizar os processos em questão.
O uso de células inteiras proporciona reações com muitos passos em apenas um organismo, sendo esta uma possibilidade para gerar compostos de aroma mais complexos. Após a elucidação do metabolismo celular, é possível a simplificação de toda a estrutura de uma célula inteira em apenas um conjunto de enzimas diretamente envolvidas.
Nesse sentido, a aplicação de técnicas genéticas para alterar rotas metabólicas permite a produção de novas variedades de frutas e vegetais com perfil de cor e aroma superiores, maior valor nutricional e maior vida-de-prateleira, com modificações nos teores de aminoácidos essenciais, lipídios, ácidos graxos, minerais e compostos nutracêuticos, para produção de alimentos mais saudáveis e mais atrativos ao consumidor.
Dessa forma, mais ênfase nas propriedades bioquímicas e moleculares de rotas metabólicas certamente serão a chave para criar novas oportunidades para a produção de maiores quantidades de compostos de aromas 'naturais' através da biotransformação.
Estratégias inovadoras para a geração biocatalítica de compostos de aroma serão conseqüências diretas de progressos nos campos da genômica, proteômica e engenharia metabólica. Hospedeiros microbianos de vetores simplificam a expressão molecular e caracterização bioquímica de enzimas heterólogas. Assim, a co-expressão de muitas das rotas metabólicas com diferentes tipos de enzimas clivadoras gera novas perspectivas para produção de diversos compostos de aroma derivados de carotenóides em células microbianas recombinantes.
11. http://www.leffingwell.com/caroten.htm, acessada em Setembro 2005.
Recebido em 9/12/05; aceito em 30/6/06; publicado na web em 22/2/07
- 1. Fraser, P. D.; Bramley, P. M.; Prog. Lipid Res. 2004, 43, 228.
- 2. Astorg, P.; Trends Food Sci. Technol. 1997, 8, 406.
- 3. Su, Q.; Rowley, K. G.; Balazs, N. D. H. J. Chromatogr., B: Anal. Technol. Biomed. Life Sci. 2002, 781, 393.
- 4. Wintherhalter, P.; Rouseff, R. Em Carotenoid-Derived Aroma Compounds; Wintherhalter, P.; Rouseff, R., eds.; American Chemical Society: Washington D. C., 2002, cap. 1.
- 5. Maldonado-Robledo, G.; Rodriguez-Bustamante, E.; Sanchez-Contreras, A.; Rodriguez-Sonoja, R.; Sanchez, S.; Appl. Microbiol. Biotechnol. 2003, 62, 484.
- 6. Delgado-Vargas, F.; Jiménez, A. R.; Paredes-Lópes, O.; Crit. Rev. Food Sci. Nutr. 2000, 40, 173.
- 7. Rodrigues-Amaya, D.; A Guide to Carotenoid Analysis in Foods, OMNI Research: ILSI Press: Washington D. C. 1999.
- 8. Olivier, J.; Palou, A.; J. Chromatogr., A 2000, 881, 543.
- 9. Agarwal, S.; Rao, A. V.; Lipids 1998, 33, 981.
- 10. Edge, R.; McGarvey, D. J.; Truscott, T. G.; J. Photochem. Photobiol., B 1997, 41, 189.
- 12. Mohamed, N.; Hashim, R.; Rahman, N. A.; Zain, S. M.; J. Mol. Struct.: Theochem 2001, 538, 245.
- 13. Weeks, W. W. Em Biogeneration of Aromas; Parliament, T. H.; Croteau, R., eds.; American Chemical Society: Washington D. C., 1986, cap. 12
- 14. Demyttenaere, J.; Kimpe, N.; J. Mol. Catal. B: Enzym. 2001, 11, 265.
- 15. Serra, S.; Fuganti, C.; Brenna, E.; Trends Biotechnol. 2005, 23, 193.
- 16. Chatterjee, T.; Bhattacharyya, D. K.; Appl. Microbiol. Biotechnol. 2001, 55, 541.
- 17. Nornier, M.-F.; de Gaulejac, N. V.; Vivas, N.; Vitry, C.; C. R. Chim. 2004, 7, 689.
- 18. Ravichandran, R.; Food Chem. 2002, 78, 23.
- 19. Bosser, A.; Belin, J. M.; Biotechnol. Prog. 1994, 10, 129.
- 20. Gloria, M. B.; Grulke, E. A.; Gray, J. I.; Food Chem. 1993, 46, 401.
- 21. Waché, Y.; Bosser-DeRatuld, A.; Ly, H. M.; Belin, J.-M.; J. Mol. Catal. B: Enzym. 2002, 19-20, 197.
- 22. Puglisi, C. J.; Elsey, G. M.; Prager, R. H.; Skouroumounis, G. K.; Sefton, M. A.; Tetrahedron Lett. 2001, 42, 6937.
- 23. Lewinsohn, E.; Situt, Y.; Bar, E.; Azulay, Y.; Ibdah, M.; Meir, A.; Yosef, E.; Zamir, D.; Tadmor, Y.; Food Sci. Tecnhol. 2005, 16, 407.
- 24. Sànchez-Contreras, A.; Jimenez, M.; Sanches, S.; Appl. Microbiol. Biotechnol. 2000, 54, 528.
- 25. Zorn, H.; Langhoff, S.; Scheibner, M.; Berger, R. G.; Appl. Microbiol. Biotechnol. 2003, 62, 331.
- 26. Grivel, F.; Larroche, C.; Gros, J. B.; Biotechnol. Prog. 1999, 15, 697.
- 27. Urlacher, V. B.; Makhsumkhanov, A.; Schmid, R. D.; Appl. Microbiol. Biotechnol. 2006, 70, 53.
- 28. Marasco, S.-D.; Appl. Biotechnol. Food Sci. Policy 2003, 1, 145.
- 29. Balderman, S.; Naim, M.; Fleishmann, P.; Food Res. Int. 2005, 38, 833.
- 30. Giuliano, G.; Al-Babili, S.; von Lintig, J.; Trends Plant Sci. 2003, 8, 145.
- 31. Fleischmann, P.; Watanabe, N.; Wintherhalter, P.; Phytochemistry 2003, 63, 131.
- 32. Zorn, H.; Langhoff, S.; Scheibner, M.; Nimtz, M.; Berger, R. G.; Biol. Chem. 2003, 384, 1049.
- 33. Wu, Z.; Robinson, D. S.; Hughes, R. K.; Casey, R.; Hardy, D.; West, S. I.; J. Agric. Food Chem. 1999, 47, 4899.
- 34. Schwartz, S. H.; Qin, X.; Zeevaart, J. A. D.; J. Biol. Chem. 2001, 276, 25208.
Datas de Publicação
-
Publicação nesta coleção
28 Maio 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Aceito
30 Jun 2006 -
Recebido
09 Dez 2005