Resumo
The yields and chemical compositions of the essential oils obtained by steam distillation of the fresh and dried (30 and 40 ºC) leaves, stems and roots of Tanaecium nocturnum are reported. The identification and quantification of the volatile constituents were accomplished by GC/MS and GC/FID, respectively. The essential oils obtained from the various parts of the plant were constituted mainly of benzaldehyde. Large losses and variations in the quantities of the components during the drying process were observed. The presence of mandelonitrile in higher concentration in the stem and roots indicates that this species produces cyanogenic glycosides.
Tanaecium nocturnum; benzaldehyde; chemical characterization
Tanaecium nocturnum; benzaldehyde; chemical characterization
ARTIGO
Influência da temperatura de secagem sobre o rendimento e a composição química do óleo essencial de Tanaecium nocturnum (barb. Rodr.) bur. & K. Shum
The influence of drying temperature on the yield and the chemical composition of the essential oil from Tanaecium nocturnum (Barb. Rodr.) Bur. & K. Shum
Flávio A. PimentelI,* * e-mail: flavio.pimentel@cnpat.embrapa.br ; Maria das Graças CardosoII; Lidiany M. ZacaroniII; Milene Aparecida AndradeII; Luiz Gustavo de Lima GuimarãesII; Ana Paula S. P. SalgadoII; Juliana Mesquita FreireII; Fabiana R. MunizII; Augusto Ramalho de MoraisIII; David Lee NelsonIV
IEmbrapa Agroindústria Tropical, 60511-110 Fortaleza - CE, Brasil
IIDepartamento de Química, Universidade Federal de Lavras, CP 37, 37200-000 Lavras - MG, Brasil
IIIDepartamento de Exatas, Universidade Federal de Lavras, CP 37, 37200-000 Lavras - MG, Brasil
IVDepartamento de Alimentos, Faculdade de Farmácia, Universidade Federal de Minas Gerais, 31270-901 Belo Horizonte - MG, Brasil
ABSTRACT
The yields and chemical compositions of the essential oils obtained by steam distillation of the fresh and dried (30 and 40 ºC) leaves, stems and roots of Tanaecium nocturnum are reported. The identification and quantification of the volatile constituents were accomplished by GC/MS and GC/FID, respectively. The essential oils obtained from the various parts of the plant were constituted mainly of benzaldehyde. Large losses and variations in the quantities of the components during the drying process were observed. The presence of mandelonitrile in higher concentration in the stem and roots indicates that this species produces cyanogenic glycosides.
Keywords:Tanaecium nocturnum; benzaldehyde; chemical characterization.
INTRODUÇÃO
Os óleos essenciais apresentam grande importância econômica, sendo largamente empregados na indústria química de perfumaria, farmacologia, inseticidas, fungicidas, alimentos, bebidas, anti-sépticos e estimulantes etc1. Por esta razão, embora ainda de forma lenta, é crescente o número de estudos sobre a composição química e propriedades biológicas, bem como os fatores taxonômicos, ambientais e de cultivo que levam à variação tanto na quantidade como na qualidade dessas essências2. O Brasil é considerado um grande produtor e exportador de óleos essenciais e de alguns de seus componentes puros, sendo que as essências mais produzidas são as cítricas, menta, eucalipto, geranim, citronela, vetiver, pau rosa e cravo3. Na Amazônia, por exemplo, a maioria dos óleos essenciais são de interesse comercial desconhecido ou escasso, sendo extraídos de plantas aromáticas silvestres de maneira rudimentar. Desta forma, a população nativa extrai diversos óleos essenciais e óleos resinas, os quais são utilizados popularmente, sem atender a qualquer padrão de qualidade para aproveitamento em outros mercados.
Espécies com variadas aplicações são utilizadas pelos habitantes amazônicos de forma in natura ou pré-processada, sem nenhum conhecimento da composição química e/ou do nível de toxicidade, entre as quais se encontra a Tanaecium nocturnum (Barb. Rodr.) Bur. & K. Shum, pertencente à família Bignoniaceae. Conhecida como cipó vick ou cipó carimbó é uma trepadeira, de odor forte de amêndoas amargas. Suas folhas são utilizadas externamente pela população como analgésico e os índios da aldeia de Gotira, localizada às margens do rio Fresco, afluente do rio Xingu, utilizam-na para combater abelhas e formigas (saúvas) e como descongestionante nasal4,5.
A qualidade adequada das matérias-primas deve ser realizada de acordo com bases científicas e técnicas. Parâmetros essenciais para qualidade da matéria-prima vegetal podem variar dependendo da procedência do material. Sendo assim, a origem geográfica, as condições de cultivo, estágio de desenvolvimento, colheita, secagem e armazenamento devem ser conhecidos2,6,7.
Embora material seco apresente maior estabilidade química, devido à interrupção de processos metabólicos que ocorrem mesmo após a coleta da planta, a utilização de material fresco torna-se indispensável para a produção e detecção de alguns componentes específicos. Seu emprego traz a vantagem de evitar a presença de substâncias oriundas do metabolismo de fenecimento vegetal. Neste sentido, as condições da matéria-prima a ser processada irão depender de resultados de pesquisas fundamentadas no produto final que se quer obter2,8. Este trabalho relata a identificação e quantificação dos constituintes químicos voláteis de T. nocturnum e estabelece método de controle de qualidade da matéria-prima para a produção de óleos essenciais.
PARTE EXPERIMENTAL
Colheita
O material genético foi coletado de população nativa de T. nocturnum, na Reserva Florestal da Embrapa Acre, localizada no município de Rio Branco, AC. A colheita foi realizada em janeiro/2005, no período de 8-10 h. Após a colheita, as plantas foram submetidas às operações de seleção e lavagem, separando-se as partes da planta (raiz, caule e folha) e descartando-se os materiais atacados por praga ou doenças.
Condições edafoclimáticas
O tipo de clima dominante na área de colheita é AW, com médias anuais de temperatura de 22,5 ºC e precipitação pluviométrica de 1950 mm. O solo foi classificado como sendo Argissolo Vermelho Distrófico típico e classe de textura de média/argilosa9.
Secagem
Para avaliar a influência da temperatura do ar de secagem sobre os teores e composições químicas dos óleos essenciais de raízes, caules e folhas de T. nocturnum, foram utilizados secadores de bandejas com circulação de ar, nas temperaturas de 30 e 40 ºC por um período de 6 dias10.
Determinação da umidade
Para a determinação da umidade utilizaram-se 5 g de matérias-primas frescas e secas picadas, emergidas em 50 mL de cicloexano. Após o processo de destilação, realizado por 3 h à temperatura de 100 ± 5 ºC, quantificou-se o volume de água presente nas matérias-primas, por meio do coletor de vidro tipo Dean Stark (trap para destilação). A umidade foi calculada considerando-se o teor de água contido em 100 g da amostra11,12.
Obtenção do óleo essencial
A extração do óleo essencial (50 g de matéria-prima picada) foi realizada por hidrodestilação, utilizando um aparelho Clevenger modificado. Após 4 h de extração coletou-se o hidrolato, separando em seguida o óleo essencial da fase aquosa com diclorometano (3 x 30 mL). Para a remoção do solvente utilizou-se evaporador rotativo, sob pressão reduzida à 35 ºC. Após a pesagem da massa do óleo obtido, armazenaram-se as amostras em frascos de vidro em geladeira a 10 ºC, até o momento das análises10,13.
Análises qualitativa e quantitativa
As análises qualitativas dos óleos essenciais das matérias-primas frescas e secas (raízes, caules e folhas) de T. nocturnum foram realizadas, por meio de cromatografia gasosa acoplada à espectrometria de massas (CG-EM), utilizando-se um equipamento da marca Shimadzu, modelo GCMS-QP 5050A. Para a identificação dos constituintes químicos, foi empregada uma coluna DB-5, da marca J & W Scientific, com 30 m de comprimento, d.i. de 0,25 mm, espessura do filme de 0,25 µm, e hélio como gás carreador. As condições de operação do cromatógrafo a gás foram: pressão interna da coluna de 100 KPa, fluxo de gás na coluna de 1,8 mL min-1, temperatura no injetor de 220 ºC, temperatura no detector ou na interface (CG-EM) de 240 ºC. A temperatura inicial da coluna foi de 40 ºC por 2 min, seguida de um incremento de 3 ºC min-1 até atingir 240 ºC, sendo mantida constante por 30 min. A razão de split foi de 1:10. O espectrômetro de massas foi programado para realizar leituras em uma faixa de 29 a 600 Da, em intervalos de 0,5 s, com energia de ionização de 70 eV. Foi injetado 1 µL da amostra, na concentração de 1%, dissolvida em diclorometano. A identificação dos componentes foi feita pela comparação de seus espectros de massas com os disponíveis no banco de dados da espectroteca Willey, 7ª edição, com dados da literatura e também pelos índices de Kovats14. Para cálculo dos índices de Kovats, foi injetado no cromatógrafo uma mistura de alcanos lineares (C9 a C26)15.
Para a quantificação dos componentes do óleo essencial, utilizou-se um cromatógrafo a gás com detector de ionização de chamas (CG-DIC) de marca Shimadzu, modelo GC-17A. As análises foram realizadas em triplicata nas mesmas condições descritas para a identificação dos constituintes.
Delineamento experimental e análise estatística
Os experimentos foram conduzidos no delineamento inteiramente casualizado, os tratamentos (material fresco e secos a 30 e 40 ºC) relativos a cada parte da planta foram conduzidos em relação às variáveis rendimento e composição química, respectivamente, com 5 e 3 repetições. Os dados referentes aos efeitos dos tratamentos foram submetidos às análises de variâncias, de desvios padrão e testes de comparações múltiplas de médias (Tukey), utilizando o programa SISVAR16.
RESULTADOS E DISCUSSÃO
As folhas, caules e raízes frescas de T. nocturnum apresentaram teores de umidade, respectivamente, de 62, 54 e 56%. Após 6 dias de secagem, suas respectivas umidades foram reduzidas sob temperatura do ar de 30 ºC para 9,6; 14,0 e 8,0%; e sob 40 ºC para 8,0; 8,0 e 7,0%.
Os óleos essenciais das folhas, caules e raízes apresentaram, concomitantemente, densidades de 1,008; 1,006 e 1,018 g/cm3, sendo que suas colorações variaram de amarelo a transparente para os obtidos das folhas e caules, e de amarelo a avermelhado o extraído das raízes.
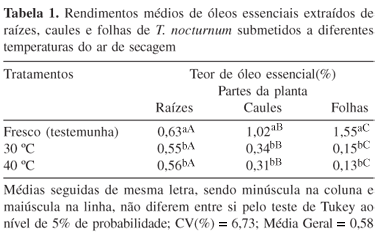
Na Tabela 1 são apresentados os teores de óleos essenciais extraídos das diferentes partes da espécie T. nocturnum, quando submetidas a diferentes temperaturas de secagem. Os dados referentes às matérias-primas frescas mostraram que as folhas apresentaram o maior teor de óleo essencial (1,55%), seguido do caule (1,02%) e raízes (0,63%). Em relação à secagem, constataram-se perdas significativas para todas as partes da planta. Estas reduções foram de até 91,6% (folhas), 69,6% (caules) e 11,0% (raiz). Entre as temperaturas de secagem não foram observadas diferenças significativas entre os teores de óleo essencial.
Apesar de ainda não ter sido relatada a fisiologia de T. nocturnum, pesquisas sobre a anatomia de diversas espécies da família Bignoniaceae revelam a existência de substâncias lipofílicas em células parenquimáticas e em tricomas glandulares17-19. Com base neste aspecto, a elevada diferença em perdas do óleo essencial durante a secagem de folhas, caules e raízes pode estar associada em parte a anatomia celular, bem como na localização deste metabólito secundário em estruturas secretoras10,20. Neste sentido, as maiores perdas ocorridas nas folhas e caules possivelmente podem ter sido ocasionadas pelo nível de lignificação do tecido parenquimatoso ou pela presença do óleo essencial em tricomas gradulares, localizados mais externamente21,22.
Resultados relacionados a perdas de óleos essenciais em função do processo de desidratação e da temperatura operacional têm sido encontrados em diversos trabalhos. Perdas semelhantes às obtidas neste trabalho foram encontradas com secagem de espécies de Cymbopogon citratus (44%, 40 ºC), Chamaemelum nobile (53%, 40 ºC) e Aillanthus altissima (76%, 30 ºC)23-25.
Embora a desidratação de plantas aromáticas tenha o propósito de minimizar as perdas de metabólitos secundários e de retardar a sua deterioração em decorrência da redução da atividade enzimática, a técnica de secagem com circulação de ar quente mostrou-se inviável para a produção de óleos essenciais de T. nocturnum.
As análises dos óleos essenciais de folhas, caules e raízes por CG/EM e CG/DIC, pesquisas em espectroteca, índices de Kovats14 e dados literários possibilitaram a identificação e quantificação de 14 constituintes químicos. Nas matérias-primas frescas de todas as partes da planta observa-se como componente majoritário o benzaldeído (71,61 a 76,09%), seguido de mandelonitrila (3,96 a 13,21%) e álcool benzílico (1,64 a 10,25%). Os demais constituintes identificados (0,20 a 22,79%) consistem em uma mistura de benzoatos, aldeídos e álcoois. Constata-se diferenças na composição química entre as partes da planta estudada. As presenças de 1-octen-3-ol (0,81%), o-cimeno (0,21%), feniletanal (0,60%) e benzoato de etila (0,93%) foram encontradas somente nas folhas; o salicilato de etila, apenas no caule (1,39%) e a mistura de neral e geranial, nas raízes (4,67%) (Tabela 2). Não se tem encontrado na literatura a composição do óleo essencial de T. nocturnum, porém relata-se a presença de aldeído benzóico como constituinte majoritário, seguido de monoterpenos4. Espectros de massas similares aos encontrados neste trabalho, referentes às moléculas de benzaldeído e mandelonitrila, têm sido relatados em literatura26. Tais compostos foram identificados simultaneamente por CG/EM e CLAE, utilizando amostras autênticas de cada componente.
No óleo essencial extraído das folhas, observa-se que a partir de 30 ºC houve reduções significativas do benzaldeído (de 74,70 para 61,98%), álcool benzílico (de 7,89 para 5,93%) e 1-octen-3-ol (de 0,81 para 0,33%). Nos dois primeiros componentes não houve perdas significativas entre as temperaturas de 30 e 40 ºC. Para a concentração do benzoato de etila, um aumento significativo do seu teor ocorreu até 30 ºC (de 0,93 para 1,82%), enquanto que o benzoato de benzila elevou-se simultaneamente com a temperatura (3,28 para 26,12%).
Entre os constituintes extraídos do caule verifica-se que o benzaldeído (de 71,61 para 83,16%) e o benzoato de benzila (de 0,20 para 1,22%) foram os únicos que obtiveram suas concentrações elevadas com o aumento da temperatura. O álcool benzílico e o salicilato de etila não apresentaram alterações significativas com a secagem. O salicilato de metila obteve elevação da concentração até 30 ºC (de 0,82 para 1,73%). A mandelonitrila foi o único componente que obteve redução significativa com a secagem (de 13,21 para 2,11%).
Com relação aos óleos obtidos das raízes, o benzaldeído e a mandelonitrila apresentaram resultados semelhantes aos do caule. O álcool benzílico elevou significativamente seu teor até a temperatura de 30 ºC (de 1,64 para 5,60%), enquanto o salicilato de metila obteve um aumento progressivo em função da temperatura de secagem (de 0,83 para 0,52%).
Durante o processo de secagem as maiores variações ocorreram com benzaldeído, mandelonitrila e benzoato de benzila. Com exceção do óleo essencial obtido das folhas, onde houve a maior perda deste metabólito secundário durante a desidratação, observa-se uma correlação inversa entre os teores de benzaldeído e mandelonitrila. Estes dados estão condizentes com vários trabalhos publicados, que relatam a conversão de mandelonitrila em benzaldeído com liberação de HCN, promovido pelo efeito da temperatura e atividade enzimática26-28. A enzima mandelonitrila liase, catalisadora da reação, apresenta atividade máxima entre 35 e 40 ºC29-31. Esta reação pode ter sido favorecida pela fragmentação da matéria-prima durante o período de secagem (6 dias). O elevado aumento do teor benzoato de benzila, ocorrido principalmente nas folhas, pode ter sido ocasionado pela sua maior estabilidade à temperatura, associada as perdas dos constituintes mais voláteis. Oscilações como estas foram encontradas em vários trabalhos com secagem de plantas aromáticas10,21,32,33.
Apesar das perdas do óleo essencial, os dados revelam que a secagem apresentou efeito positivo em relação à qualidade deste metabólito secundário, eliminando ou reduzindo o teor de constituinte indesejável como a mandelonitrila, presente em maiores quantidades no caule e raiz.
CONCLUSÕES
Os óleos essenciais obtidos das diversas partes da planta são constituídos majoritariamente de benzaldeído e apresentam elevadas perdas de rendimentos e variações quantitativas das composições químicas com o processo de secagem.
A presença de mandelonitrila com maior intensidade no caule e raiz fornece indícios de que a espécie seja produtora de glicosídio cianogênico.
AGRADECIMENTOS
À EMBRAPA Acre, ao Departamento de Química da Universidade Federal de Viçosa (UFV) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo auxílio ao projeto de pesquisa e pelo fornecimento de bolsas de doutorado e pesquisa.
Recebido em 17/1/07; aceito em 30/8/07; publicado na web em 26/2/08
- 1. Maia, J. G. S.; da Silva, M. L.; Luz, A. I. R.; Zogbi, M. G. B.; Ramos S. S.; Quiím. Nova 1987, 10, 200.
- 2. Simões, C. M. O.; Schenkel, E. P.; Gosmann, G.; Mello, J. C. P.; Mentz, L. A.; Petrovick, P. R.; Farmacognosia da planta ao medicamento, 5Ş ed., UFRGS/UFSC: Porto Alegre/Florianópolis, 2003.
- 3. Keifer, H.; I Simpósio sobre Exploração de Plantas Aromáticas e Óleos Essenciais da Fundação Cargill, Campinas, Brasil, 1986.
- 4. Gottlieb, O. R.: Koketsu, M.; Magalhães, M. T.; Maia, J. G. S.; Mendes, A. I. R.; Silva, M. L.; Wilberg, V. C.; Acta Amazônica 1981, 11, 142.
- 5. Ming, L. C.; Tese de Doutorado, Universidade Estadual Paulista, Brasil, 1995.
- 6. List, P. H.; Schmidt, P. C.; Phytopharmaceutical Technology, CRC Press: London, 1989, p. 39-49.
- 7. Harborne, J. B.; Phytochemical methods. A guide to modern techniques of plant analysis, Chapman and Hall: London, 1973.
- 8. Silva, F.; Casali, V. W. D.; Plantas medicinais e aromáticas: Pós-colheita e óleos essenciais, Arte e Livros: Belo Horizonte, 2000.
-
9EMBRAPA - Amazônia Oriental; Caracterização e classificação dos solos do Campo Experimental da Embrapa Acre, Rio Branco, Estado do Acre, Zoneamento Agroecológico, Belém, 2001.
- 10. Barbosa, F. F.; Barbosa, L. C. A.; Quim. Nova 2006, 29, 1221.
-
11AOCS Official Method Da2b-42.; Official Methods and Recommended Practices of the American Oil Chemists Society, 4th ed., American Oil Chemists Society: Champaign, 1994.
- 12. Pimentel, F. A.; Cardoso, M. G.; Salgado, A. P. S. P.; Aguiar, P. M.; Silva, V. F.; Morais, A. R.; Nelson, D. L.; Quim. Nova 2006, 29, 373.
- 13. Craveiro, A. A.; Fernandes, A. G.; Andrade, C. H. S.; Matos, F. J. de A.; Alencar, J. W.; Machado, M. I. L.; Óleos essenciais de plantas do Nordeste, 1Ş ed., UFC: Fortaleza, 1981.
- 14. Adams, R. P.; Identification of essential oil components by Gas Chromatography Mass Spectroscopy, Allured Publishing Corporation: Illinois, 1995.
- 15. Thomazini, M.; Franco, M. R. B.; SBCTA 2000, 34, 52.
- 16. Ferreira, D.F.; Manual do sistema Sisvar para análises estatísticas, UFLA: Lavras, 2000.
- 17. Coral, D. J.; Dallaqua, M. A. M.; Resumos do 54ş Congresso Nacional de Botânica e 3Ş Reunião Amazônica de Botânica, Belém, Brasil, 2003.
- 18. Díaz-Castelazo, C.; Rico-Gray, V.; Ortega, F.; Ángeles, G.; Annals of Botany 2005, 96, 1175.
- 19. Lopes, A. V.; Vogel, S.; Machado, I. C.; Annals of Botany 2002, 90, 169.
- 20. Ogundipe, O. T.; Wujek, D. E.; Acta Bot. Hung 2004, 46, 337.
- 21. Radünz, L. L.; Tese de Doutorado, Universidade Federal de Viçosa, Brasil, 2004.
- 22. Lewinsohn, E.; Dudai, N.; Tadmor, Y.; Katzir, I.; Ravid, U.; Putievsky, E.; Joel, D. M.; Annals of Botany 1998, 81, 35.
- 23. Costa, L. C. B.; Corrêa, R. M.; Cardoso, J. C. W.; Pinto, J. E. B. P.; Bertolucci, K. V.; Ferri, P. H.; Hortic. Bras 2005, 23, 965.
- 24. Mastelic, J.; Jerkoic, I.; Croat. Chem. Acta 2002, 75, 189.
- 25. Omidbaigi, R.; Selfdkon, F.; Kazemi, F.; Flavour Fragrance J. 2004, 19, 196.
- 26. Ômura, H.; Kuwahara, Y.; Tanabe, T.; Appl. Entomol. Zool 2002, 37, 73.
- 27. Matsura, F. C. A. U.; Folegatti, M. I. S.; Miranda, M. S.; Menezes, H. C.; Rev. Bras. Toxicol 2005, 18, 63.
- 28. Darling, C.; Schoroeder, F.; Meinwald, J.; Eisner, M.; Eisner, T.; Naturwissenschaften 2001, 88, 306.
- 29. Petrounia, I. P.; Goldberg, J.; Brush, E. J.; Biochemistry 1994, 33, 28.
- 30. Swain, E.; Poulton, J. E.; Plant. Physiol 1994, 106, 1285.
- 31. Wajant, H.; Föster, S.; Selmar, D.; Effenberger, F.; Pfizenmaier, K.; Plant. Physiol 1995, 109, 1231.
- 32. Arabhosseini, A.; Padhye, S.; Beek, T. A.; Boxtel, A. J. B.; Huisman, W.; Posthumus, M. A.; Müller J.; J. Sci. Food Agric. 2006, 86, 2543.
- 33. Martins, P. M.; Melo, E. C.; Barbosa, L. C. A.; Santos, R. H. S.; Machado, M. C.; Acta Hort 2002, 569, 155.
Datas de Publicação
-
Publicação nesta coleção
13 Jun 2008 -
Data do Fascículo
2008
Histórico
-
Aceito
30 Ago 2007 -
Recebido
17 Jan 2007