Resumo
This work aimed to assess the photocatalytic degradation of a model odor compound (dimethyl disulfide, DMDS), found in liquid and gaseous wastes of plants for processing poultry byproducts. The effect of pH and temperature on adsorption and photocatalytic degradation was evaluated through factorial experimental designs. The results suggest the presence of an optimum region for adsorption, at 45.0 ºC and pH 4.0. In the photocatalytic runs an optimum for temperature and pH was also observed. At 45 ºC and pH 4.0 the removal of DMDS was 99% after 60 min of irradiation.
photocatalytic degradation; dimethyl disulfide; wastes
photocatalytic degradation; dimethyl disulfide; wastes
ARTIGO
Estudo da degradação fotocatalítica de dimetil dissulfeto: avaliação estatistica do efeito do pH da temperatura e concentração do contaminante orgânico
Assessment of the photocatalytic degradation of dimethyl disulfide: effect of pH, temperature and concentration of the organic contaminant
Rogério Marcos DallagoI,* * e-mail: dallago@uricer.edu.br ; Fabrício DomenechI; Joncimar ReolonI; Marco Di LuccioI; Silvia Maria da Silva EguesII
ICentro Tecnológico, Universidade Regional Integrada do Alto Uruguai e Missões, Campus Erechim, Av. Sete de Setembro, 1621, 99700-000 Erechim - RS, Brasil
IIInstituto de Tecnologia e Pesquisa, Universidade Tiradentes, Av. Murilo Dantas, 300, 149032-490 Aracaju - SE, Brasil
ABSTRACT
This work aimed to assess the photocatalytic degradation of a model odor compound (dimethyl disulfide, DMDS), found in liquid and gaseous wastes of plants for processing poultry byproducts. The effect of pH and temperature on adsorption and photocatalytic degradation was evaluated through factorial experimental designs. The results suggest the presence of an optimum region for adsorption, at 45.0 ºC and pH 4.0. In the photocatalytic runs an optimum for temperature and pH was also observed. At 45 ºC and pH 4.0 the removal of DMDS was 99% after 60 min of irradiation.
Keywords: photocatalytic degradation; dimethyl disulfide; wastes.
INTRODUÇÃO
A poluição tem sido um assunto de extremo interesse em todas as partes do mundo. A crescente preocupação com o meio ambiente tem como principal conseqüência a criação de normas e legislações cada vez mais restritivas quanto à disposição final e ao descarte de subprodutos na biosfera.1
As atividades industriais vinculadas ao beneficiamento de alimentos, mais especificamente em fábricas de subprodutos de processamento de aves, caracterizam-se pela emissão e dispersão no ambiente de uma variedade de compostos sulfurados voláteis, como gás sulfídrico (H2S), dimetil sulfeto (DMS, Me2S), dimetil dissulfeto (DMDS, Me2S2), dimetil trissulfeto (DMTS, Me2S3), metanotiol (MeSH) e dissulfeto de carbono (CS2), os quais, dependendo da concentração, podem apresentar elevada toxicidade ao meio ambiente.2-4
Esses compostos são produzidos por degradação biológica ou por decomposição térmica. Pelo fato desses sulfurados possuírem um baixo limiar de odor (concentração mínima detectável pelo olfato humano), a ocorrência dessas substâncias em emissões industriais pode causar sérios problemas de odores para essas empresas. A biodegradação de compostos odoríferos muitas vezes é ineficiente devido ao fato dos microrganismos consumirem preferencialmente algumas substâncias, deixando que outras passem pelo processo sem serem degradadas.5
Os processos oxidativos avançados (POAs) têm sido muito investigados e propostos como alternativa a processos convencionais, com especial atenção à fotocatálise heterogênea utilizando TiO2 como catalisador.6-8 A grande vantagem da fotocatálise heterogênea deve-se ao fato de que, na maioria das vezes, pode conduzir à total mineralização de compostos orgânicos. Desta forma, evita-se a transferência do poluente da fase aquosa para a sólida, além de aliar alta eficiência a baixos custos operacionais.9
Nesse sentido, este trabalho teve como objetivo avaliar a influência do pH e da temperatura sobre a eficiência da fotocatálise heterogênea na degradação de dissulfeto de dimetila (DMDS), utilizando dióxido de titânio como fotocatalisador. O dissulfeto de dimetila foi escolhido como modelo, pois foi um dos compostos identificados em efluentes gasosos e águas de lavagem de gases, geradas em fábrica de subprodutos de processamento de carne de aves.10
PARTE EXPERIMENTAL
Fotocatalisador e composto odorífero modelo
O TiO2 comercialmente disponível (Degussa P-25) foi utilizado como fotocatalisador sem qualquer tratamento adicional. Apresenta-se principalmente na forma anatásio (80% anatásio e 20% rutilo em massa) e possui área superficial BET de 50 m2 g-1 e tamanho de partícula de aproximadamente 20 nm.
Para a realização dos experimentos foi utilizado um padrão comercial do composto dissulfeto de dimetila 99% (DMDS, Aldrich).
Ensaios de adsorção e fotocatálise
Os experimentos de adsorção e fotocatálise foram conduzidos em reator de vidro encamisado sem tampa, acoplado a um banho termostático ajustado para manter a temperatura constante. A agitação constante foi assegurada por um agitador magnético. O diâmetro e altura internos do reator são, respectivamente, 4,5 e 9,5 cm, com volume útil de 100 mL. Este sistema foi montado no interior de uma caixa de madeira com dimensões internas de 85 x 42,5 x 42,5 cm com paredes internas revestidas em papel alumínio. Os ensaios de adsorção foram realizados em batelada, em ambiente isento de luz, por 24 h. As soluções foram mantidas sob agitação para promover uma completa homogeneização do catalisador. Periodicamente foram retiradas alíquotas de 2 mL do meio reacional, que foram centrifugadas e filtradas em membrana de éster de celulose (0,22 µm, Millipore). A concentração do DMDS remanescente em solução foi determinada em espectrofotômetro UV/Vis (Agilent 8453) em um comprimento de onda de 205 nm utilizando cubeta de quartzo. As quantidades de substrato orgânico adsorvido no sólido foram determinadas por balanço de massa.
Para os estudos fotocatalíticos, a irradiação na faixa do ultravioleta foi fornecida por uma lâmpada de vapor de mercúrio de 125 W, marca Phillips (modelo HPLN 125W-IMP, fluxo luminoso 6200 lm e eficiência luminosa 50 lm/W), sem bulbo de vidro, posicionada a 50 cm da superfície do líquido. Os ensaios de adsorção foram conduzidos no mesmo sistema com a lâmpada apagada.
Os dados foram tratados utilizando o programa Statistica 6.0 (Statsoft Inc., Tulsa, OK, USA, www.statsoft.com). Foram realizadas réplicas de todos os experimentos, sendo que o erro experimental não ultrapassou a margem de 10%.
Efeito do pH e da temperatura na adsorção
Para o estudo da adsorção, a influência de algumas variáveis foi investigada utilizando-se a técnica do planejamento de experimentos.11,12 Primeiramente, foi realizado um planejamento fatorial completo 22 com três pontos centrais, para avaliação dos efeitos do pH e da temperatura na adsorção do DMDS em TiO2 (Tabela 1). Baseado nos resultados do primeiro planejamento elaborou-se um segundo planejamento fatorial 22 com triplicata do ponto central e dois pontos axiais para cada variável independente (planejamento composto central rotacional - PCCR, Tabela 1), avaliando-se os efeitos do pH e temperatura, fixando-se a concentração do DMDS (2,5 x 10-4 gmol L-1). A faixa de estudo das variáveis foi determinada com base em ensaios anteriores.10
As mesmas variáveis, faixas e planejamentos, foram investigadas nos estudos fotocatalíticos.
Após a realização dos planejamentos foi definida a melhor condição de pH e temperatura para a degradação fotocatalítica do DMDS. A partir das condições otimizadas avaliou-se o efeito da concentração de DMDS na faixa de 1,0 x 10-4 a 1,0 x 10-3 mol L-1.
Ensaios em branco, conduzidos sem a utilização de TiO2, foram realizados para se avaliar a magnitude da contribuição da fotodegradação e perdas por evaporação do DMDS, nos resultados obtidos para os ensaios conduzidos na presença de fotocatalisador (TiO2).
RESULTADOS
Fotólise
A Figura 1 apresenta os resultados obtidos para os ensaios de fotodegradação conduzidos na ausência de TiO2.
A taxa de remoção de DMDS, após 6 h de incidência, oscilou entre 10 e 20%. A menor taxa de remoção observada para o ensaio conduzido com o reator tampado pode estar vinculada à propriedade que o vidro apresenta em absorver radiação na faixa do ultravioleta, principalmente acima de 300 nm, limitando a radiação incidente sobre a solução. Constatou-se também que a presença da tampa contribui, minimizando perdas por volatilização do DMDS da solução.
Efeito do pH e da temperatura na adsorção
A adsorção dos poluentes na superfície do fotocatalisador é um dos principais pré-requisitos para a eficiência das reações fotocatalíticas.13,14 A Figura 2 apresenta as cinéticas da adsorção do dimetil dissulfeto (DMDS) para os experimentos do primeiro planejamento completo 22 (Tabela 1). Pode-se observar que, independentemente das condições experimentais avaliadas, todos os ensaios apresentaram o mesmo comportamento, isto é, uma queda progressiva da concentração do DMDS na solução.
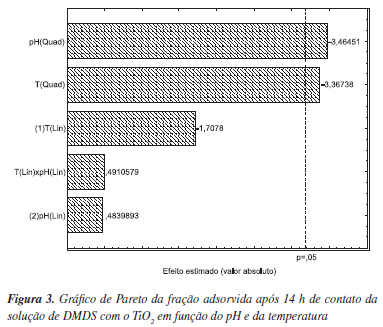
As maiores frações adsorvidas ( 0,7) correspondem aos ensaios conduzidos com o menor valor de pH (3,4) e diferentes níveis de temperatura. O tratamento estatístico (software Statistica 6.0) dos valores referentes às frações adsorvidas após 24 h de contato demonstrou que todas as variáveis (pH, temperatura e pH x temperatura) apresentaram efeito negativo significativo (p<0,05) sobre o processo adsortivo.
0,7) correspondem aos ensaios conduzidos com o menor valor de pH (3,4) e diferentes níveis de temperatura. O tratamento estatístico (software Statistica 6.0) dos valores referentes às frações adsorvidas após 24 h de contato demonstrou que todas as variáveis (pH, temperatura e pH x temperatura) apresentaram efeito negativo significativo (p<0,05) sobre o processo adsortivo.
O efeito do pH no ensaio adsortivo pode ser explicado principalmente pela carga da superfície do TiO2 (ponto de carga zero do TiO2 P-25, pHpcz ~ 6), uma vez que alterações no pH modificam sua carga superficial.15,16 Em pH inferior ao ponto de carga zero (PCZ), o catalisador está com predominância de cargas positivas em sua superfície, favorecendo a adsorção, mediante interações eletrostáticas, do DMDS, que se caracteriza por apresentar elevada densidade eletrônica vinculada aos pares de elétrons livres dos átomos de enxofre.
Em relação à temperatura, seu efeito está diretamente vinculado às propriedades termodinâmicas da interação adsorvato/adsorvente. Dependendo do poluente e do adsorvato envolvidos no processo adsortivo, o mesmo pode se caracterizar como endotérmico ou exotérmico. Por exemplo, a adsorção de chumbo, mediante interações eletrostáticas apresenta-se como um processo endotérmico quando a argila é empregada como adsorvente. No entanto, quando a adsorvente for a kaolinita ou a montmorilonita o processo é caracterizado como exotérmico.17 Neste estudo, o efeito negativo observado para a temperatura sugere ser o processo adsortivo exotérmico, apresentando um aumento da capacidade adsortiva de DMDS com a diminuição da temperatura. Além disto, o aumento da temperatura, por favorecer a solubilidade do soluto aumentando sua solvatação, limita sua atração para a superfície do adsorvente.17
Para o segundo planejamento experimental (PCCR - Tabela 1), conduzido empregando faixas de temperatura e pH ajustadas e ampliadas, as maiores frações adsorvidas após 14 h de contato foram observadas para as condições do ponto central (Tabela 2). O limite inferior da temperatura, mesmo esta apresentando efeito negativo, foi mantido à temperatura ambiente (25 ºC) por questões de economia e praticidade, visando a aplicação deste processo em escala industrial.
A análise estatística dos resultados deste segundo planejamento forneceu o gráfico de Pareto (Figura 3), onde somente os efeitos de segunda ordem foram estatisticamente significativos (p<0,05) e negativos. Isto é um indicativo de que há um ponto de ótimo para estas duas variáveis, o qual se encontra próximo à condição experimental do ponto central (45,0 ºC e pH 4,0).12
Fotocatálise
O fluxo fotônico do sistema foi determinado seguindo a metodologia descrita por Kuhn et al..18 O valor de fluxo fotônico obtido para 1 min de irradiação, 6,06 x 10-5 einstein s-1, está coerente com valores descritos na literatura para este tipo de lâmpada.19
Previamente à etapa de fotocatálise, todos os ensaios foram submetidos a uma etapa de adsorção, empregando as mesmas condições experimentais (25 ºC, sem controle de pH, por um período de 14 h de contato solução/fotocatalisador). Posteriormente a este período, necessário para atingir o equilíbrio, as condições experimentais (pH e temperatura), descritas no planejamento composto central rotacional (PCCR) 22 - Tabela 1, foram ajustadas, dando inicio à etapa fotocatalítica (Figura 4).
Pode-se observar que, independente das condições experimentais empregadas, todos os ensaios apresentaram mesma tendência de degradação, apresentando em 6 h de irradiação uma remoção do DMDS presente na solução de aproximadamente 100%.
As frações de DMDS removidos após 30 e 60 min de irradiação são apresentadas na Tabela 3.
A análise estatística foi efetuada para os dois tempos (30 e 60 min), fornecendo os mesmos resultados. A Equação 1 apresenta o modelo codificado otimizado para a remoção fotocatalítica do DMDS, após 30 min de irradiação, o qual foi validado pela análise de variância apresentada na Tabela 4.
Verifica-se que o coeficiente de correlação obtido (R = 0,92) e o teste F (2,3 vezes maior que o valor tabelado) validaram estatisticamente o modelo (p<0,05), permitindo a construção da superfície de resposta e curva de contorno (Figuras 5a e b).
Observa-se que, na faixa investigada, ambas variáveis independentes apresentaram efeito significativo sobre a degradação do DMDS. Verifica-se a presença de uma região de ótimo localizada em torno do ponto central (pH = 4 e 45 ºC), que está coerente com a literatura, que descreve uma região de temperatura ótima entre 20 e 80 ºC, devido à pequena energia de ativação aparente.20,21 Este comportamento está de acordo com os resultados de adsorção, que se caracteriza como principal etapa limitante do processo de fotodegradação.7,20 O efeito do pH, no que se refere à degradação fotocatalítica, atua efetivamente na etapa adsortiva. Em pH maior que o ponto de carga zero (PCZ), o catalisador está com predominância de cargas negativas em sua superfície, desfavorecendo a adsorção e degradação do DMDS. Por outro lado, pH excessivamente baixo leva à redução da taxa de degradação, uma vez que a adsorção completa do DMDS pode ocorrer, bloqueando os sítios ativos do TiO2, impedindo a ativação fotônica dos mesmos e, conseqüentemente, a degradação fotocatalítica. Ainda, o pH baixo pode levar à aglomeração das partículas de TiO2, diminuindo a área superficial para adsorção e absorção de fótons.15,16
O pH também pode afetar o mecanismo de degradação. Enquanto em pH baixo as lacunas (h+) desempenham um papel predominante na oxidação, em pH neutro a alcalino os radicais hidroxila são as espécies oxidantes predominantes, pela facilidade na sua geração devido à maior presença de íons hidróxido disponíveis na superfície do catalisador. No entanto, pH elevado pode levar à repulsão entre a superfície do catalisador e a molécula de DMDS, por exclusão de cargas, e entre a superfície do catalisador e os íons hidroxila, diminuindo a taxa de formação dos radicais hidroxila.22 Neste contexto, o efeito do pH dependerá da magnitude com que cada um destes mecanismos contribui em cada sistema estudado, sugerindo a existência de um pH ótimo para a fotodegradação, de acordo com o que foi observado.
As variações de temperatura e pH na região de máxima conversão sugerem que o efeito da temperatura foi menos pronunciado que o do pH (Figura 5b).
Gálves et al.23 mostraram que a velocidade das reações fotoquímicas não sofre grande influência da temperatura, o que é um comportamento típico das reações iniciadas por absorção de fótons. Rigoni,24 estudando a degradação fotocatalítica de corante alimentício, observou também um efeito pouco pronunciado da temperatura.
Considerando que a variação de temperatura influencia diretamente na velocidade com que as reações se processam (a velocidade aumenta proporcionalmente com a temperatura) e no equilíbrio químico das mesmas (processo exotérmico ou endotérmico), a ocorrência de uma faixa ótima de temperatura sugere um efeito competidor entre o aumento das taxas de reação e a diminuição da capacidade de adsorção com o aumento da temperatura.
Efeito da concentração de DMDS na degradação fotocatalítica
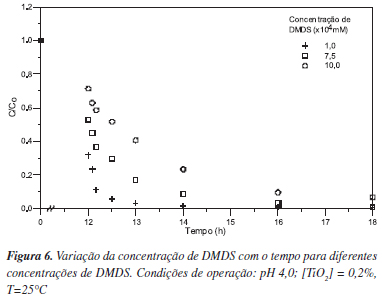
O efeito da concentração de DMDS na cinética de degradação não foi incluído no planejamento de experimentos, uma vez que poderia mascarar o efeito das outras variáveis independentes, pois o efeito de concentração em cinéticas de degradação normalmente é negativo.24
Os resultados referentes a este estudo, apresentados na Figura 6, demonstram que mesmo em uma ampla faixa de concentração (1,0x10-4 a 1,0x10-3 mol L-1 ou 9,4 a 94 mg L-1) é possível remover mais de 90% da concentração inicial de DMDS após 6 h de irradiação. Como esperado, o aumento da concentração de DMDS, mantendo a quantidade de catalisador fixa, leva a uma menor taxa de degradação. Este efeito é comum em processos com catálise heterogênea, pois como o mecanismo envolve a adsorção dos compostos a serem degradados sobre a superfície do catalisador, em concentrações mais elevadas é possível que todos os sítios catalíticos estejam ocupados, limitando o processo de adsorção/degradação.
A linearização dos resultados da Figura 6, considerando-se um modelo cinético de pseudo primeira ordem, encontra-se apresentada na Tabela 5.
Os valores das constantes de taxa de reação e tempos de meia-vida, encontrados para as diferentes concentrações de DMDS estudadas, são comparáveis aos obtidos por Demeestere et al.25 para a degradação de dimetil sulfeto (DMS) por fotocatálise em fase gasosa, utilizando TiO2 dopado com enxofre. No trabalho destes autores, o menor tempo de meia-vida obtido foi de 10 min para uma concentração de DMS de 109 mg L-1, enquanto que o maior foi de 74 min para uma concentração de equilíbrio de 539 mg L-1, utilizando uma fonte de irradiação na faixa do espectro visível.
CONCLUSÕES
Os resultados obtidos no planejamento fatorial mostraram que somente os efeitos de segunda ordem foram estatisticamente significativos (p<0,05) e negativos, indicando a presença de uma região mais favorável à adsorção localizada próxima à condição experimental do ponto central (45 ºC e pH 4,0).
Em relação aos ensaios fotocatalíticos, também se observou um ótimo de degradação para a região em torno do ponto central. Empregando uma temperatura de 45 ºC e pH 4,0 obteve-se uma remoção de DMDS da solução de aproximadamente 99% após 60 min de irradiação. O efeito do pH foi vinculado a alterações da carga na superfície do catalisador e da densidade eletrônica do DMDS.
A diminuição da taxa de remoção com o aumento da concentração de DMDS foi vinculada ao mecanismo envolvido no processo de adsorção do DMDS sobre a superfície do catalisador, a qual, com o aumento da concentração amplia a possibilidade de saturação dos sítios catalíticos, limitando o processo de adsorção/degradação.
Recebido em 26/2/08; aceito em 10/9/08; publicado na web em 26/1/09
- 1. Jardim, W. F.; Fotocatálise: aplicações ambientais, Instituto de Química, UNICAMP, 1996.
- 2. Rappert, S.; Müller, S.; Waste Manage 2005, 25, 887.
- 3. Cheremisinoff, P. N.; Air Pollution Control and Design for Industry, Marcel Dekker: New York, 1993.
- 4. Wright, D. W.; Eaton, D. K.; Nielsen, F. W. K.; Koziel, J. A.; Spinhirne, J. P.; Parker, D. B.; J. Agric. Food Chem 2005, 53, 8663.
- 5. Zhang, L.; Hirai, M.; Shoda, M.; J. Ferment. Bioeng 1991, 72, 392.
- 6. Nogueira, R. F. P.; Jardim, W. F.; Quim. Nova 1998, 21, 69.
- 7. Konstantinou, I. M.; Albanis, T. A.; Appl. Catal., B 2004, 49, 1.
- 8. Karkmaz, M.; Puzenat, E.; Guillard, J.; Herrmann, J. M.; Appl. Catal., B 2004, 51, 181.
- 9. Poulios, I.; Tsachpinis, I.; J. Chem. Technol. Biotechnol 1999, 74, 349.
- 10. Krüger, R. L.; Dissertação de Mestrado, Unversidade Regional Integrada do Alto Uruguai e das Missões, Brasil, 2006.
- 11. Barros Neto, B.; Scarminio, I. S.; Bruns, R. E.; Planejamento e otimização de experimentos, 2Ş ed., UNICAMP: Campinas, 1996.
- 12. Rodrigues, M. I.; Iemma, A. F.; Planejamento de experimentos e otimização de processos: uma estratégia seqüencial de planejamento, Ed. Casa do Pão: Campinas, 2005.
- 13. Fox, M.; Dulay, M. T.; Chem. Rev 1993, 93, 341.
- 14. Murugababdham, M.; Swaminathan, M.; Dyes Pigm 2006, 68, 133.
- 15. Fernàndez, J.; Kiwi, J.; Baeza, J.; Freer, J.; Lizama C.; Mansilla, H. D.; Appl. Catal., B 2004, 48, 205.
- 16. Sauer, T. P.; Casaril, L.; Humeres, E.; Moreira, R. F. P. M.; J. Appl. Electrochem 2005, 35, 821.
- 17. Bhattacharyya, K. G.; Gupta, S. S.; Colloids Surf., A 2006, 277, 191.
- 18. Kuhn, H. J.; Braslavsky, S. E.; Schmidt, R.; Pure Appl. Chem 2004, 76, 2105.
- 19. Cesconetto Neto, G.; Sauer, T. P.; José, H. J.; Moreira, R. F. P. M.; Humeres, J. J. E.; J. Air Waste Manage 2004, 54, 77.
- 20. Herrmann, J. M.; Catal. Today 1999, 53, 115.
- 21. Gogate, P. R.; Pandit, A. B.; Adv. Environ. Res 2004, 8, 501.
- 22. Habibi, M. H.; Hassanzadeh, A.; Mahdavi, S.; J. Photochem. Photobiol., A 2005, 172, 89.
- 23. Gálvez, J. B.; Rodríguez, S. M.; Gasca, C. A. E.; Bandala, E. R.; Gelover, S.; Leal, T. Em Purificación de águas por fotocatálisis heterogénea: estado da arte; Miguel Blesa ed.; La Plata, 2001, cap. 3.
- 24. Rigoni, R. E.; Dissertação de Mestrado, Universidade Regional Integrada do Alto Uruguai e das Missões, Brasil, 2006.
- 25. Demeestere, K.; Dewulf, J.; Witte, B. D.; Langenhove, H. V.; Appl. Catal., B 2005, 60, 93.
Datas de Publicação
-
Publicação nesta coleção
23 Abr 2009 -
Data do Fascículo
2009
Histórico
-
Recebido
26 Fev 2008 -
Aceito
10 Set 2008