Resumo
This paper describes a degradation study of the anti-inflammatory sodium diclofenac in aqueous medium using an electro-chemical flow reactor with a gas diffusion electrode as cathode. Two degradation processes were compared: by H2O2 electro-generated and H2O2 electro-generated/Fe(II). Concentration of sodium diclofenac was determined during the experiments by HPLC. The changes in chemical oxigen demand (COD) were also evaluated. Under the specific reaction conditions, 350 mg L-1 of H2O2 was electro-generated and 99.2% of sodium diclofenac was degradated, with 27.4% COD reduction. At the same conditions, but using Fe(II), drug degradation was 99.4% and the COD reduction was 63.2%.
sodium diclofenaco; electrochemical reactor; gas diffusion electrode
sodium diclofenaco; electrochemical reactor; gas diffusion electrode
ARTIGO
Avaliação da degradação do diclofenaco sódico utilizando H2O2/fenton em reator eletroquímico
Evaluation of the degradation of sodium diclofenac using H2O2/fenton in electrochemical reactor
Robson S. RochaI; André A. G. F. BeatiI; Joaquim G. OliveiraII; Marcos R. V. LanzaII,* * e-mail: marcos.lanza@saofrancisco.edu.br
IDepartamento de Engenharia de Materiais, Faculdade de Engenharia Mecânica, Universidade Estadual de Campinas, CP 6122, 13083-970 Campinas - SP, Brasil
IILaboratório de Pesquisas em Eletroquímica e Eletroanalítica, Universidade São Francisco de Assis, 12916-900 Bragança Paulista - SP, Brasil
ABSTRACT
This paper describes a degradation study of the anti-inflammatory sodium diclofenac in aqueous medium using an electro-chemical flow reactor with a gas diffusion electrode as cathode. Two degradation processes were compared: by H2O2 electro-generated and H2O2 electro-generated/Fe(II). Concentration of sodium diclofenac was determined during the experiments by HPLC. The changes in chemical oxigen demand (COD) were also evaluated. Under the specific reaction conditions, 350 mg L-1 of H2O2 was electro-generated and 99.2% of sodium diclofenac was degradated, with 27.4% COD reduction. At the same conditions, but using Fe(II), drug degradation was 99.4% and the COD reduction was 63.2%.
Keywords: sodium diclofenaco; electrochemical reactor; gas diffusion electrode.
INTRODUÇÃO
A indústria farmacêutica ocupa um lugar de destaque, tanto no âmbito nacional quanto no internacional, quanto ao volume de recursos destinados ao desenvolvimento de novos fármacos e a sistemas de produção mais eficientes. Anualmente são produzidas grandes quantidades de produtos farmacêuticos com aplicação nas mais diversas áreas da saúde humana e animal, sendo que a maioria dos princípios ativos utilizados é de compostos orgânicos biologicamente ativos.
Considerando que os processos de produção mais modernos são planejados para maximizar a produção e minimizar a geração de resíduos ou efluentes líquidos, as operações de manutenção e limpeza das áreas de fabricação e equipamentos geram efluentes líquidos que necessitam de um tratamento adequado antes de serem descartados no meio ambiente. Outra fonte de efluentes é o processo de inutilização e/ou destruição de lotes de medicamentos com prazos de validade vencidos, que são recolhidos do mercado.
Um exemplo de princípio ativo largamente comercializado é o diclofenaco sódico, um fármaco não-esteróide com pronunciadas propriedades anti-reumática, anti-inflamatória, analgésica e antipirética. Este fármaco é um dos princípios ativos mais vendido no Brasil e esse grande consumo é devido a uma ampla diversidade de aplicações, que vão desde o tratamento pós-operatório até o tratamento pós-traumático da dor.1,2
O grande consumo do diclofenaco sódico, sua diversificada forma de apresentação e sua variada fonte de geração de resíduos dentro da indústria, torna o estudo da degradação desse composto ativo e o conseqüente tratamento das águas residuárias da indústria farmacêutica de grande importância, devido ao impacto que esses compostos biologicamente ativos causam no meio ambiente. Para controle desses compostos ativos existentes nos despejos da indústria farmacêutica, existem vários processos de tratamento de efluentes aquosos que podem ser utilizados, como o tratamento químico, biológico e a incineração do efluente.
As dificuldades observadas no tratamento usual de compostos da indústria farmacêutica abrem precedentes para a utilização de técnicas não convencionais, como as técnicas eletroquímicas de tratamento de resíduos e efluentes.3
Os tratamentos eletroquímicos de efluentes promovem a remoção ou a destruição de espécies poluentes, direta ou indireta, através de processos eletroquímicos de oxidação e/ou redução em células eletroquímicas, sem a adição de grandes quantidades de produtos químicos evitando, assim, a possível formação de organometálicos e o aumento do volume a ser tratado.
Nesse sentido, a tecnologia eletroquímica oferece um meio eficiente de controle da poluição por meio de reações redox, seja através das reações diretas entre as espécies poluentes e as superfícies eletródicas ou do sinergismo desses processos com o poder de espécies oxidantes geradas in situ. Alguns processos eletroquímicos aplicados ao tratamento de efluentes, contendo substâncias orgânicas, propõem a conjugação dos processos anódicos de oxidação com a produção catódica in situ de espécies oxidantes, como o peróxido de hidrogênio.
Neste âmbito, os reatores eletroquímicos que utilizam eletrodos de difusão gasosa (EDG) apresentam um grande avanço no processo catódico de geração de H2O2; a utilização destes eletrodos em reatores eletroquímicos permite, além da possibilidade de gerar catodicamente em meio ácido (Equação 1) peróxido de hidrogênio in situ, diminuir a diferença de potencial catodo/anodo, implicando em uma economia de energia elétrica considerável quando pensamos em uma escala industrial.4,5
Diante da eletrogeração catódica in situ de peróxido de hidrogênio, o tratamento de efluentes ganha uma nova perspectiva, onde o H2O2 gerado atua diretamente na degradação de compostos orgânicos ou o H2O2 pode ser combinado com um catalisador metálico com o objetivo de maximizar sua ação na degradação de orgânicos como, por exemplo, o eletro-Fenton, que combina H2O2 (eletrogerado catodicamente) com sulfato ferroso em meio ácido. Em uma primeira etapa, ocorre a formação do radical hidroxila (Equação 2) e posteriormente ocorre a regeneração do catalisador Fe2+, conforme as Equações 3 e 4.6
A utilização do sulfato ferroso como catalisador é largamente abordada na literatura, onde sua utilização associada ao H2O2 é colocada como uma das técnicas mais eficientes e abrangentes na degradação de compostos orgânicos, devido à alta taxa de formação de OH a partir de H2O2 na presença de íons ferrosos.6-9
O objetivo deste artigo foi estudar o tratamento eletroquímico de efluentes simulados da indústria farmacêutica, contento compostos biologicamente ativos, utilizando reatores de fluxo construídos com catodo de EDG e anodo de DSA®.
PARTE EXPERIMENTAL
O estudo da degradação química/eletroquímica do diclofenaco sódico foi realizado em duas etapas. Na primeira realizou-se o estudo das reações redox da molécula do diclofenaco sódico, utilizando-se voltametria hidrodinâmica. Na segunda etapa, foi construído um reator eletroquímico de bancada, no qual foram feitos ensaios eletroquímicos com soluções contendo o fármaco. Nesta fase, foi avaliada a influência das principais condições operacionais sobre a constante de velocidade de degradação do diclofenaco sódico.
Estudo das reações redox do diclofenaco sódico
Para o estudo das reações de oxi-redução da molécula de diclofenaco sódico, foram realizadas voltametrias cíclicas utilizando um eletrodo disco rotatório (RDE) de carbono vítreo. Para o registro das voltametrias utilizou-se um sistema potenciostato/galvanostato Autolab modelo PGSTAT-30 com módulo de alta corrente (BSTR 10A) interfaciado com um computador PC. Para realização dos experimentos utilizou-se uma velocidade de varredura de 20 mV s-1 durante cinco ciclos, na faixa de potencial de -1,5 a +1,0 V vs. Ag/AgCl. Como eletrólito de suporte, utilizou-se um meio não aquoso (250 mL de N,N Dimetil Formamida com 0,1 mol L-1 de perclorato de sódio).
Os ensaios eletroquímicos foram realizados em uma célula eletroquímica de um compartimento e três eletrodos com um eletrodo de trabalho conectado ao módulo RDE, um contra-eletrodo de platina e um eletrodo de referência de Ag/AgCl.
Preparação do eletrodo de difusão gasosa
Para a construção do EDG utilizou-se uma massa composta com pigmento grafítico condutivo do tipo negro de fumo da família Printex 6L da Degussa e como aglomerante hidrofóbico, uma dispersão Dyneon TF 3035 PTFE da 3M (dispersão com 60% de PTFE). A preparação da massa catalítica e construção do EDG seguiu procedimentos descritos na literatura.10,11
Reator eletroquímico
Para o registro das voltametrias e para a realização das eletrólises foi utilizado um reator eletroquímico do tipo flow-by, com apenas um compartimento, tendo sido construído com placas de PVC montadas na forma de um filtro-prensa, projetado para ser acoplado em um sistema de recirculação com capacidade de 2,0 L.
No reator utilizou-se um eletrodo do tipo EDG (com 20% de PTFE) na placa catódica (com uma área geométrica total de aproximadamente 20 cm2), um Dimensionally Stable Anodes (DSA-Cl2®) da De Nora do Brasil Ltda na placa anódica (com uma área geométrica total de 250 cm2) e como referência um fio de platina, localizado na face de um EDG, conectado a uma eletrodo de referência Ag/AgCl. Entre as duas placas, anódica e catódica, foi colocado um espaçador, promovendo uma distância uniforme de 3 mm entre as duas placas. O reator foi conectado a um sistema de recirculação, composto por bombas e medidores de vazão, responsável pela vazão estável do eletrólito através do reator.
Degradação do diclofenaco sódico
O estudo da degradação do diclofenaco sódico foi dividido em duas etapas: estudo da eletrogeração de H2O2 no reator eletroquímico e, estudo da degradação química/eletroquímica do diclofenaco sódico. Para estas duas etapas utilizou-se a técnica de eletrólise à corrente constante no reator eletroquímico em interface com uma fonte de tensão estabilizada Tectrol TC 20-05. Para a realização das eletrólises foram estabelecidas as correntes 1,0; 2,0; 3,0 e 4,0 A em relação ao catodo. O volume do eletrólito utilizado foi 1,2 L de K2SO4 0,1 mol L-1 para a eletrogeração de H2O2 e para o estudo da degradação do fármaco (200 mg L-1 de diclofenaco sódico) ambos os eletrólitos com pH natural de 5,8. Para os ensaios de degradação via Fenton foi acrescido 1x10-2 mol L-1 de FeSO4 e em todos os ensaios foi aplicado fluxo de O2 com pressão de 0,20 Bar aproximadamente e a vazão foi de 200 L h-1. Durante os experimentos foram retiradas amostras (aproximadamente 15 mL) em intervalos de tempo regulares.
Instrumentação e procedimento de análise
Para quantificar o H2O2 eletrogerado no reator eletroquímico, as amostras coletadas foram analisadas utilizando uma solução de (NH4)6Mo7O2.4H2O 2,4x10-3 mol dm-3 e analisadas em um espectrofotômetro UV-Vis (Lambda 40 da Perkin Elmer Instruments), os espectros foram registrados no intervalo de 200 a 500 nm e a absorbância da solução determinada em 350 nm. A concentração do H2O2 eletrogerado foi determinado conforme descrito na literatura.10
Com relação à degradação do diclofenaco, as amostras retiradas durante as eletrólises foram analisadas em um cromatógrafo Shimadzu modelo 20A, com detector UV/Visível SPD-20A. A fase estacionária utilizada foi uma coluna 250 x 4,6 mm (coluna C18) e a fase móvel composta de uma mistura de metanol e ácido fosfórico 18,7x10-3 mol L-1 em uma proporção de 80:20.12 Para estas amostras das eletrólises, foi determinada a demanda química de oxigênio (DQO), utilizando um reator de digestão da Hach, e para a leitura dos resultados foi utilizado um espectrofotômetro Visível Hach modelo Odyssey. Todas as análises foram efetuadas em duplicata em tubos Hach com reagente na faixa de concentração de 0-1500 mg L-1 de DQO.
RESULTADOS E DISCUSSÃO
Estudo das reações redox do diclofenaco sódico
O objetivo de se utilizar o N,N Dimetil Formamida (DMF), como eletrólito não aquoso, foi por ser tratar de um solvente orgânico isento de água e conseqüentemente livre de H+, característica essa que auxilia na observação das reações redox. O H+, em excesso no caso do meio aquoso, pode interferir na reação (protonando ou desprotonando a molécula orgânica) quando o H+ entra rapidamente em equilíbrio, estabiliza a molécula e assim encobre possíveis sinais de reações redox que podem estar ocorrendo.
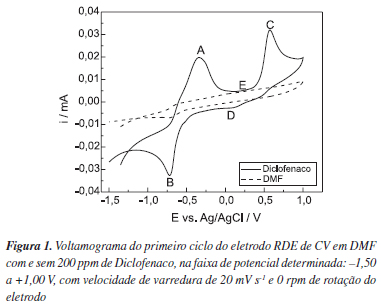
A Figura 1 mostra a influência da adição do diclofenaco em DMF. Observa-se o aparecimento de dois picos de oxidação (A e C), em aproximadamente -0,33 V vs. Ag/AgCl e 0,57 V vs. Ag/AgCl respectivamente e também o aparecimento de dois picos de redução (B e D), em aproximadamente 0,72 V vs. Ag/AgCl e 0,05 V vs. Ag/AgCl, respectivamente. Observando o voltamograma do diclofenaco nota-se que a oxidação do diclofenaco pode estar acontecendo em duas etapas, região (A) e região (C), nota-se ainda que a reação de oxidação do fármaco, nessa faixa de potencial, não está sofrendo influência do fenômeno de adsorção no eletrodo pois, entre cada um dos dois picos, a corrente retorna a valores próximos às correntes do eletrólito, região (E).
Observando ainda a Figura 1, nota-se na região (D) um discreto pico de redução e na região (B) outro pico de redução, porém com uma corrente de pico maior. As análises das reações do diclofenaco sódico no eletrodo de carbono vítreo em meio não aquoso mostram que o fármaco sofre reações redox. Diante destes resultados, assumiu-se que o diclofenaco apresenta reações redox e é passível de degradação eletroquímica, por esse motivo estabeleceu-se como próxima etapa a degradação do fármaco em um reator eletroquímico.
Estudo da degradação do diclofenaco sódico
A degradação do diclofenaco sódico em reator eletroquímica baseia-se na oxidação via H2O2 eletrogerado no catodo (EDG) e na oxidação do fármaco na superfície do anodo (DSA). Diante da importância da concentração do H2O2 para a degradação, foram realizados diversos experimentos com o objetivo de determinar a eficiência do reator eletroquímico em eletrogerar H2O2, para isso utilizou-se uma fonte de tensão conectada ao reator eletroquímico, para verificar em qual corrente ocorre a formação da maior quantidade de H2O2 no reator eletroquímico.
A geração de H2O2 no reator eletroquímico baseia-se na reação de redução do oxigênio, essa reação ocorre no eletrodo de difusão gasosa, utilizado como catodo no reator. A seguir são apresentados os resultados da geração do H2O2 em relação à densidade de corrente aplicada.
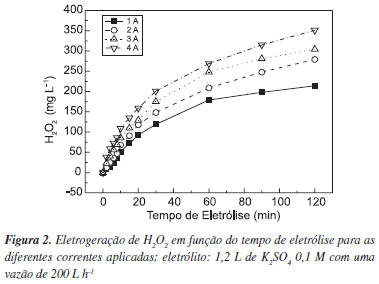
A Figura 2 mostra o comportamento da eletrogeração de H2O2 em reator eletroquímico. Nota-se que o aumento da corrente aplicada influencia proporcionalmente na geração do H2O2, onde a menor corrente (1 A) alcançou a menor concentração, 214 mg L-1, ao final da eletrólise e, conseqüentemente, a maior corrente aplicada (4 A) alcançou a maior concentração, 351 mg L-1.
Observando a variação da concentração do H2O2 gerado em função do tempo de eletrólise, nota-se o início da estabilização da concentração do peróxido nos últimos 30 min dos experimentos. Essa estabilização da concentração do H2O2 pode estar associada à oxidação do H2O2 na superfície do anodo, sendo que reator é dotado de apenas uma câmara interna e este fato pode contribuir para que o peróxido gerado no catodo se oxide em contato com o anodo.
Considerando que o reator eletroquímico é eficiente na eletrogeração de H2O2, iniciou-se o estudo da degradação do diclofenaco sódico, utilizando H2O2 gerado. Durante as eletrólises, a concentração do fármaco foi monitorada por CLAE a partir das amostras retiradas do reator eletroquímico.
Na Figura 3 observa-se o comportamento da concentração do diclofenaco durante as eletrólises no reator. A concentração do fármaco diminui rapidamente nos primeiros 20 min de experimento, comportamento que se reproduz em todas as eletrólises. A Tabela 1 relaciona as reduções na concentração do diclofenaco durante as eletrólises à corrente aplicada.
Comparando a Figura 3 com as reduções do diclofenaco da Tabela 1, nota-se que a molécula do fármaco é facilmente modificada, pois sua concentração decai rapidamente nos primeiros 20 min de experimento e a partir desse ponto as concentrações variam com uma taxa reduzida até o final do experimento. Observando ainda o decaimento da concentração do fármaco, verificou-se que a degradação do diclofenaco está associada diretamente à corrente aplicada ao sistema, pois as maiores correntes alcançaram as maiores reduções do diclofenaco e em um menor tempo de experimento.
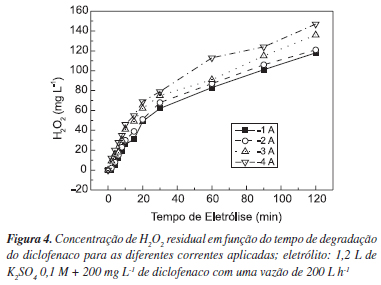
Diante das características da degradação química/eletroquímica estarem associadas também à oxidação química do fármaco via H2O2 e considerando que a próxima etapa é o estudo da degradação via Fenton/oxidação eletroquímica, quantificou-se o H2O2 residual durante os experimentos de degradação do diclofenaco e os resultados são apresentados na Figura 4.
Na Figura 4, observam-se as concentrações de H2O2 residual durante as eletrólises com diclofenaco sódico; essa concentração de peróxido se forma, provavelmente, devido à baixa velocidade de formação de radiais hidroxila (OH) a partir do H2O2. 6-9
Diversos trabalhos publicados mostram que a degradação de compostos via H2O2 ocorre através do ataque do OH na molécula orgânica, porém esse ataque é lento devido à baixa taxa de conversão do H2O2 em OH; devido a esse fato, ocorreu um acúmulo de peróxido residual, no qual o tempo de eletrólise não foi suficiente para a conversão para OH e conseqüente oxidação da molécula do diclofenaco.12-16
Observando os resultados (Figura 3 e Tabela 1), nota-se que o fármaco foi degradado quase totalmente. Com o objetivo de estabelecer o grau de diminuição da demanda de oxigênio das amostras, foi determinada a demanda química de oxigênio (DQO) e os resultados são apresentados na Figura 5.
A Figura 5 mostra ainda, uma diminuição na DQO nos primeiros 20 min de eletrólise, seguida de uma estabilização da DQO em função do tempo. Esse comportamento mostra que a oxidação dos compostos orgânicos (diclofenaco e sub-produtos) acontece no inicio da eletrólise, mas não ocorre a oxidação completa da carga orgânica, como mostra a Tabela 1.
Observando a Figura 5 e a Tabela 1, nota-se que a carga orgânica foi oxidada, porém sua DQO decai rapidamente nos primeiros 20 min de experimento e a partir desse ponto a concentração se comporta de forma quase linear em função do tempo de eletrólise. Observando ainda o decaimento da DQO, nota-se que a oxidação da matéria orgânica está associada diretamente à corrente aplicada ao sistema, pois as maiores correntes alcançaram as maiores reduções de DQO.
Diante dos resultados apresentados, planejou-se utilizar o H2O2 residual para melhorar os resultados da DQO, através do acréscimo de um catalisador Fe2+ (FeSO4) que atuou na formação de OH a partir do H2O2 presente no eletrólito; a associação do H2O2 com o íon Fe2+ é conhecido na literatura como reagente de Fenton. 6-9,13-20
Na Figura 6 observa-se o comportamento da concentração do diclofenaco durante as eletrólises no reator na presença de íons Fe2+. A concentração do fármaco diminui rapidamente nos primeiros 20 min de experimento, comportamento que se reproduz em todas as eletrólises. A Tabela 1 relaciona as reduções na concentração do diclofenaco durante as eletrólises à corrente aplicada.
Observando a Figura 6 com a Tabela 1, nota-se que o fármaco foi degradado quase totalmente e para se estudar o quanto foi reduzida da carga orgânica durante estes experimentos com sulfato ferroso, foi quantificada a demanda química de oxigênio (DQO).
A Figura 7 mostra o decaimento da DQO em função do tempo de eletrólise na presença de 10 mM L-1 FeSO4. Nota-se uma diminuição acentuada da DQO até 20 min de eletrólise, a partir desse ponto observa-se uma estabilização da demanda de oxigênio. A Tabela 1 compara a redução da carga orgânica em função da corrente aplicada.21,22
Comparando a Figura 7 com as reduções da DQO da Tabela 1, nota-se que a carga orgânica foi oxidada, porém sua concentração decai rapidamente nos primeiros 20 min de experimento e a partir desse ponto a concentração cai lentamente até o fim da eletrólise. Observando ainda o decaimento da DQO, nota-se que a oxidação da matéria orgânica está associada diretamente à corrente aplicada ao sistema, pois as maiores correntes alcançaram as maiores reduções de DQO.16-21
Comparando os resultados da degradação Fenton/eletroquímica do diclofenaco sódico, onde o fármaco se oxida via OH catalisado pela presença de íon ferroso e na superfície do anodo, ocorre o decaimento quase total da sua concentração (degradação de 99,4% em 4 A), porém a diminuição da DQO não acompanha esse efeito, pois mostra um relativo decaimento da demanda de oxigênio (63,2% em 4 A), estes resultados mostram que a degradação forma sub-produtos, que não são identificados na CLAE, nas condições de análise.23,24
Consumo energético do sistema
Para uma comparação mais completa do tratamento eletroquímico de efluentes simulados contendo diclofenaco sódico, foi analisado o consumo de energia elétrica envolvido no processo de remoção da demanda química de oxigênio.
Nas eletrólises realizadas, o potencial de célula (Ecel) e a corrente elétrica (i) aplicada ditam o consumo elétrico (CE), associado a quantidade de DQO removida obtém-se o gasto de energia elétrica por kg de remoção, conforme a Equação 5.
Quando se compara o processo de degradação via H2O2 com o processo via Fenton, observa-se nas mesmas condições experimentais um aumento no consumo energético, onde o processo via H2O2 gastou 528,8 kWh por kg de DQO removido, enquanto o processo de degradação via Fenton gastou 354,8 kWh por kg de DQO removido, ou seja, a diminuição da DQO é energeticamente mais favorável via Fenton, possivelmente associada a maior formação de espécies OH na presença de Fe2+, se comparado com o processo via H2O2 onde não existe um catalisador para essa função.
CONCLUSÃO
O reator eletroquímico utilizado para degradação eletroquímica do diclofenaco sódico mostrou-se eficiente na eletrogeração de H2O2, a partir da reação de redução do O2. Em todas as correntes estudadas, o máximo na concentração de peróxido foi alcançado com a corrente de 4,0 A, chegando a 351 mg L-1 em 2 h de eletrólise.
A degradação do diclofenaco, nos dois sistemas estudados, mostrou que o acréscimo de íons ferroso no sistema aumenta a cinética de diminuição da DQO. A base da degradação de compostos orgânicos é a formação de OH no meio reacional; em virtude disso, as melhores cinéticas ocorreram nas eletrólises a 4,0 A, devido a maior geração de H2O2 nessas correntes.
Quanto à redução das concentrações iniciais, a degradação via H2O2 reduziu em 99,2% a concentração inicial do diclofenaco e alcançou uma redução na DQO de 27,4% do total da carga inicial com um gasto energético de 528,8 kWh por kg de DQO removido. Com relação à degradação via Fenton, a redução do diclofenaco alcançou 99,4% da concentração inicial, enquanto a DQO chegou a 63,2% da carga orgânica total com um gasto energético de 354,8 kWh por kg de DQO removido.
AGRADECIMENTOS
À Fundação de Amparo à Pesquisa do Estado de São Paulo - FAPESP.
Recebido em 29/2/08; aceito em 26/9/08; publicado na web em 5/2/09
- 1. Holst, A.; Evers, H.; Experimental studies of new topical anaesthetics on the oral mucosa 1989, 58, 1345.
- 2. Bonfim, J. R. A.; Boletim Sobravime 2004, 40/41, 23.
- 3. Di Bernardo, L.; A. D. B. Dantas, A. D. B.; Métodos e Técnicas de Tratamento de Água, 2Ş ed., Rima: São Paulo, 2005, vol. 2.
- 4. Ragnini, C. A. R.; Di Iglia, R. A.; Bertazzoli, R.; Quim. Nova 2001, 24, 252.
- 5. Vielstich, W.; Fuel Cells - Modern Processes for the Electrochemical Prodution of Energy, 1970, p. 501.
- 6. Skoumal, M.; Cabot, P.; Centellas, F.; Arias, C.; Rodríguez, R. M.; Garrido, J. A.; Brillas, E.; Appl. Catal 2006, 66, 228.
- 7. Sires, I.; Garrido, J. A.; Rodriguez, R. M.; Cabot, P.; Centellas, F.; Arias, C.; Brillas, E.; J. Electrochem. Soc 2006, 153, D1.
- 8. Gaudiano, M. C.; Valvo, L.; Bertocchi, P.; Manna, L.; J. Pharm. Biomed.l Anal 2003, 32, 151.
- 9. Pérez-Estrada, L. A.; Malato, S.; Gernjak, W.; Agüera, A.; Thurman, E. M.; Ferrer, I.; Fernández-Alba, A. R.; Environ. Sci. Technol 2005, 39, 8300.
- 10. Forti, J. C.; Rocha, R. S.; Lanza, M. R. V.; Bertazzoli, R.; J. Electroanal. Chem 2007, 601, 63.
- 11. Forti, J. C.; Nunes, J. A.; Lanza, M. R. V.; Bertazzoli, R.; J. Appl. Electrochem. 2007, 37, 527.
- 12. Florey, K.; Analytical Profiles of Drug Substances 1990, 19, 123.
- 13. Harrington, T.; Pletcher, D.; J. Electrochem. Soc 1999, 146, 2983.
- 14. Hofmann, F.; Freier, U.; Appl. Catal 2007, 70, 447.
- 15. Zwiener, C.; Frimmel, F. H.; Water Res 2000, 34, 1881.
- 16. Vogna, D.; Marotta, R.; Napolitano, A.; Andreozzi, R.; d'Ischia, M.; Water Res 2004, 38, 414.
- 17. Molinari, R.; Pirillo, F.; Loddo, V.; Palmisano, L.; Catal. Today 2006, 118, 205.
- 18. Sharma, V. K.; Mishra, S. K.; Environ. Chem. Lett 2006, 3, 182.
- 19. Skoumal, M.; Cabot, P.; Centellas, F.; Arias, C.; Rodríguez, R. M.; Garrido, J. A.; Brillas, E.; Appl. Catal 2006, 66, 228.
- 20. Waterston, K.; Wang, J. W.; Bejan, D.; J. Appl. Electrochem 2006, 36, 277.
- 21. Ravina, M.; Campanella, L.; Kiwi, J.; Water Res 2002, 36, 3553.
- 22. Pérez-Estrada, L. A.; Maldonado, M. I.; Gernjak, W.; Agüera, A.; Fernández-Alba, A. R.; Ballesteros, M. M.; Malato, S.; Catal. Today 2005, 101, 219.
- 23. Weigel, S.; Kallenborn,R.; Hühnerfuss, H.; J. Chromatogr., A 2004, 1023, 183.
- 24. Galmier, M. J.; Bouchon, B.; Madelmont, J. C.; Mercier, F.; Lartigue, C.; J. Pharm. Biomed. Anal 2005, 38, 790.
Datas de Publicação
-
Publicação nesta coleção
23 Abr 2009 -
Data do Fascículo
2009
Histórico
-
Recebido
29 Fev 2008 -
Aceito
26 Set 2008