Resumo
The removal study was conducted using 1.00 g of the rice husk ash (RHA) and 20.0 mL solution with concentrations in the range of 10-1000 mg/L of Zn(II). The influence of contact time, initial metal concentration, agitation and pH of the removal process was investigated. Superior removals to 95% were obtained at the end of 24 h of contact. The agitation increased in 20% the removal of Zn(II), being needed only 5 min to reach the equilibrium. The adsorption process was studied by the models of isotherms of Langmuir, Freundlich and BET, obtaining results of R L and 1/n for a process favorable of adsorption. BET isotherm best represents the equilibrium adsorption. The results showed that the RHA has the largest capacity and affinity for the removal of Zn(II).
rice husk ash; removal; Zn (II)
rice husk ash; removal; Zn (II)
ARTIGO
Uso da cinza da casca do arroz (CCA) obtida da geração de energia térmica como adsorvente de Zn(II) em soluções aquosas
Use of rice husk ash (RHA) obtained from thermal energy generation as Zn (II) adsorbent in aqueous solutions
Thiago Faheina ChavesI,* * e-mail: thiago_faheina@yahoo.com.br ; Zilvanir Fernandes de QueirozI; Diana Nara Ribeiro de SousaI; José Hélio Saraiva GirãoI; Esiana de Almeida RodriguesII
IDepartamento de Química, Faculdade de Filosofia Dom Aureliano Matos, Universidade Estadual do Ceará, Av. Dom Aureliano Matos, 2058, 62930-000 Limoeiro do Norte - CE, Brasil
IILaboratório de Solos e Tecidos Vegetais, Faculdade de Tecnologia Centec, R. Estevâm Remígio, 1145, 62930-000 Limoeiro do Norte - CE, Brasil
ABSTRACT
The removal study was conducted using 1.00 g of the rice husk ash (RHA) and 20.0 mL solution with concentrations in the range of 10-1000 mg/L of Zn(II). The influence of contact time, initial metal concentration, agitation and pH of the removal process was investigated. Superior removals to 95% were obtained at the end of 24 h of contact. The agitation increased in 20% the removal of Zn(II), being needed only 5 min to reach the equilibrium. The adsorption process was studied by the models of isotherms of Langmuir, Freundlich and BET, obtaining results of RL and 1/n for a process favorable of adsorption. BET isotherm best represents the equilibrium adsorption. The results showed that the RHA has the largest capacity and affinity for the removal of Zn(II).
Keywords: rice husk ash; removal; Zn (II).
INTRODUÇÃO
Sabe-se que a Terra possui uma capacidade finita tanto para a disponibilidade de recursos como para o descarte dos resíduos, fato que acentua a importância da minimização de perdas ambientais, bem como do uso mais eficiente de recursos e de energia para um desenvolvimento sustentável das nações. Assim, é evidente a necessidade de novas tecnologias para uma produção ambientalmente adequada.1
Ao longo de décadas, a atividade industrial tem produzido rejeitos gasosos, líquidos e sólidos nocivos ao meio ambiente. Os processos industriais que utilizam grandes volumes de água contribuem significativamente com a contaminação dos corpos d'água, principalmente por metais, que têm seu impacto ambiental aumentado pela falta de tratamento dos efluentes.2
As tecnologias tradicionais para o tratamento de água (coagulação, floculação, decantação, filtração e desinfecção) em geral não são totalmente eficientes na remoção de traços de metais solúveis em águas. O processo comumente aplicado à remoção de íons metálicos solúveis em água é a precipitação. A remoção dos metais se dá na forma de óxidos, hidróxidos, carbonatos ou sulfatos, decorrentes da adição de coagulantes e/ou álcalis. Esta técnica produz grandes quantidades de lodo após a decantação. A precipitação de metais pesados na forma de colóides ou de gel amorfo e sua ocorrência na forma de ânions, bem como a presença de substâncias complexantes em solução, dificultam o processo de precipitação. Para efetiva remoção dos metais pesados por precipitação, as condições de pH e temperatura devem ser rigidamente controladas. Frequentemente, após a filtração final, a concentração dos metais pesados na água ainda permanece na faixa de alguns miligramas por litro.3
A adsorção é um processo de separação, tecnologia importante e muito usada na Química. Os carvões ativados são os adsorventes mais utilizados para esse fim, por apresentarem alta área superficial e porosidade desenvolvida. O custo dos carvões ativados comerciais é ainda um dos empecilhos do seu uso em larga escala industrial, o que tem conduzido o desenvolvimento de novos produtos adsorventes, de custo inferior aos carvões ativados comerciais.2
A literatura relata a utilização de diversos materiais como potenciais adsorventes na remoção de íons metálicos de águas residuais.4-7 Entretanto, a maioria dos estudos investiga o processo de preparação do adsorvente através de pré-tratamentos ácidos, básicos ou com solventes orgânicos, seguidos de posterior ativação térmica visando o aumento de suas propriedades de área superficial e adsorção.8-18 Porém, isso torna o processo bastante oneroso, dificultando a utilização do material e sua aplicação em grande escala.
No Brasil, segundo a Conab (Companhia Nacional de Abastecimento), 19 em 2007 foram produzidos mais de 11 milhões de toneladas de arroz. Considerando que do total de arroz colhido 23% correspondem à casca e 4% correspondem à cinza,20 conclui-se que aproximadamente 440.000 toneladas de cinza foram geradas no país até o final de 2007.
A casca do arroz é um material fibroso, composto basicamente por celulose, lignina e matéria orgânica. A principal utilização desse rejeito é na geração de energia térmica, entretanto desse uso é gerado um resíduo negro, de difícil degradação e com alto teor de silício que, se depositado de maneira incorreta, pode causar danos ao meio ambiente e aos seres humanos.20
Estes aspectos motivam o desenvolvimento e a aplicação de materiais alternativos como potenciais substituintes nos processos de tratamento de efluentes e é nesse contexto que esse trabalho visa estudar a eficiência da cinza da casca do arroz, utilizada in natura, obtida da queima para a geração de energia térmica em uma caldeira de beneficiamento como material adsorvente de zinco em concentrações elevadas.
PARTE EXPERIMENTAL
Materiais e equipamentos
As soluções de zinco(II) foram preparadas por diluição a partir da Solução Padrão Tritisol Merck® contendo 1000 mg/L do íon metálico para as concentrações desejadas, utilizando-se água deionizada em sistema Quimis. A verificação da fase cristalográfica foi realizada em um difratômetro Rigaku mediante difração de Raios-X, usando o método do pó em geometria de Bragg-Brentano de modo contínuo com velocidade de 0,5 min-1 (2θ); radiação de Cu Kα foi usada com tubo operando a 40 kV e 25 mA. Foi feita uma varredura na região do infravermelho de 4000 a 400 cm-1 em um equipamento modelo FTIR-8300 da Shimadzu para a caracterização do material quanto aos grupos funcionais presentes na CCA; a amostra foi diluída em pastilha de KBr. A análise química do material foi realizada por fluorescência de Raios-X em um equipamento ZSXMini II, da Rigaku (Japão). A área superficial da CCA foi determinada em um equipamento Surface Area and Porosity Analyzer micromeritics ASAP 2020. A distribuição granulométrica foi estimada submetendo a CCA a um peneiramento por diferentes malhas de aberturas que variaram de 2 a 0,05 mm. As concentrações dos íons metálicos foram determinadas por espectrometria de absorção atômica (EAA) em um equipamento modelo Varian SpectrAA55, Austrália, com atomizador com chama ar-acetileno (6 mL/min), comprimento de onda (λ) 248,3 nm, corrente da lâmpada de catodo oco 5 mÅ, abertura da fenda (slit) 0,2.
Preparação da cinza da casca do arroz (CCA)
A cinza da casca do arroz que foi utilizada neste trabalho foi gentilmente cedida pela CIVAB - Cooperativa Central Agropecuária dos Irrigantes do Vale do Banabuiú LTDA (Alto Tiradentes, Morada Nova - CE). O resíduo retirado da caldeira, onde a casca é queimada, foi seco em estufa a 65 °C por 24 h, em atmosfera de ar, para a retirada da umidade residual da cinza. Após essa etapa, a CCA não passou por nenhum tratamento químico nem térmico, sendo utilizada in natura diretamente nos testes.
Efeito da concentração inicial e do tempo de contato
Os experimentos para estimar a capacidade de remoção do material foram realizados em duplicata, utilizando 1,00 g do adsorvente previamente submetido à secagem e 20,0 mL de solução sintética de Zn(II) nas concentrações de 10, 50 e 100 mg/L. Os sistemas foram mantidos em repouso e após diferentes tempos de contato (1, 3, 6, 12 e 24 h) a mistura foi filtrada e as concentrações finais determinadas por EAA. A taxa de retenção do metal adsorvido foi calculada através do decréscimo da concentração dos íons metálicos no meio usando-se a Equação 1:
onde Co(mg/L) e C(mg/L) são, respectivamente, as concentrações da fase aquosa antes e depois do período de tratamento.21
Estudo de agitação
Para a verificação da influência da agitação no processo de remoção, utilizou-se 1,00 g do material adsorvente e 20,0 mL da solução sintética de Zn(II) na concentração de 10 mg/L. As misturas foram deixadas em repouso e outras submetidas à agitação em mesa agitadora orbital Tecnal, modelo TE - 145, à velocidade de 150 rpm por diferentes intervalos de tempo (5, 15, 30, 45 e 60 min). Decorridos os tempos, as misturas foram filtradas e o filtrado analisado por EAA.
Influência do pH inicial (pHo)
O efeito do pHo no processo de adsorção foi avaliado em sistemas contendo 20,0 mL de solução com concentração 10 mg/L de Zn(II) e 1,00 g de CCA. O pH foi ajustado para valores na faixa de 3 a 11 pela adição de soluções 0,1 mol/L de NaOH ou HNO3. Os sistemas foram mantidos sob agitação orbital por 30 min a 150 rpm.
Isotermas de adsorção
As capacidades de adsorção de Zn(II) em soluções aquosas foram estudadas em agitação, mantidas por 2 h a 150 rpm. O efeito da concentração inicial do íon metálico na capacidade de adsorção da CCA foi determinado usando soluções com concentrações variando de 100 a 1000 mg/L de Zn(II). Em cada caso, 20,0 mL da solução foram adicionados a 1,00 g de cinza. Decorrido o tempo, as concentrações finais foram determinadas por EAA. A capacidade de adsorção do adsorvente, qe (mg do metal/g do adsorvente) foi determinada com base na diferença de concentração dos íons metálicos, usando-se a Equação 2:
onde Co é a concentração do soluto na solução inicial (mg/L); Ce, concentração do soluto no equilíbrio (mg/L); V, volume da solução (L); m, massa do adsorvente (g).21
RESULTADOS E DISCUSSÃO
Caracterização do material
O difratograma de raios-X da cinza da casca do arroz está ilustrado na Figura 1. Pode-se observar pela forma dos picos apresentados que se trata de um material com uma estrutura cristalina bem definida. É possível identificar os picos como fase da estrutura cristobalita,22 o que reafirma a grande quantidade de silício presente na CCA já citada anteriormente. Na Tabela 1 são apresentadas a composição química e a distribuição granulométrica do material. A composição química da CCA varia em função do solo em que o arroz é plantado, dos tipos e teores de fertilizantes utilizados, das condições climáticas, bem como do tipo de arroz propriamente dito. A sílica é predominante na composição (88%), o K, P e o S presentes são oriundos dos tipos de fertilizantes usados na plantação do arroz.20 Observa-se na Tabela 1 que o material não apresenta homogeneidade quanto ao tamanho de partícula; a maior porcentagem é encontrada na faixa de tamanho entre 0,25 e 0,5 mm.
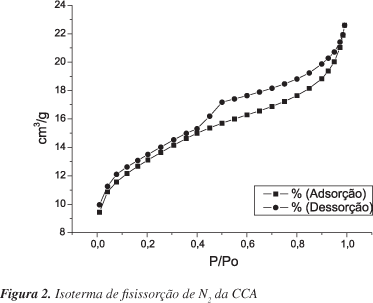
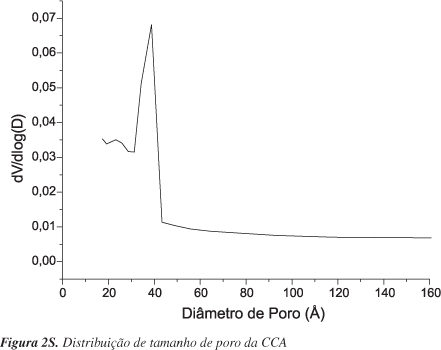
O espectro de absorção na região do infravermelho, Figura 1S (Material Suplementar), mostra as absorções características dos grupos funcionais presentes na cinza. Em 3431 cm-1 indica a presença de grupamentos -OH de silanois (Si-OH) e siloxanos (Si-O-Si-OH), fato que é confirmado pela absorção intensa em 1096 cm-1, atribuída às vibrações de estiramento assimétrico Si-O-Si. A banda em 793 cm-1 é devida a vibrações de estiramento simétrico Si-O-Si e em 467 cm-1 indica as ligações do tipo Si-O. A absorção fraca observada em 619 cm-1 é característica de cristobalita cristalina.23,24 Assim, mostra-se que a cinza apresenta grupos com potencial de adsorção, fator que pode contribuir bastante para o processo de remoção. Pela análise de fisissorção de N2 (Figura 2) o material apresentou uma área superficial de 42,94 m2/g e distribuição de poros (Figura 2S) na faixa dos mesoporos, com a maior parte dos poros tendo diâmetros em torno de 38 Å.
Efeito da concentração inicial e do tempo de contato
A eficiência na adsorção de Zn(II) é afetada pela concentração do adsorbato no meio; a remoção percentual decresce quando aumenta a concentração de Zn(II) na solução (Figura 3). Tal aspecto pode ser atribuído à necessidade de uma quantidade de energia e tempos de contato maiores para que o adsorbato seja adsorvido pela superfície, visto que alguns locais já estão ocupados, restando apenas regiões de mais difícil acesso. Observam-se valores de retenção para as três concentrações com patamares acima de 95% ao final de 24 h. A maior quantidade do íon metálico é removida na primeira hora; os resultados mostram remoções entre 74 e 88% apenas nesse período de contato. O processo é rápido inicialmente e a CCA continua removendo o metal no decorrer do tempo, entretanto, com uma taxa de aumento bem inferior, ocasionada pela baixa disponibilidade de sítios de adsorção já ocupados. Assim, tem-se uma remoção inicial rápida e a necessidade de um tempo de contato maior para que a adsorção ocorra com valores de retenção superiores a 95%.
Estudo de agitação
Depois de se realizar os testes de concentração inicial e tempo de contato, foram obtidas as condições ótimas do processo e estudou-se a influência da agitação na remoção do íon metálico. Avaliou-se tempos de até 1 h de contato com uma solução na concentração de 10 mg/L de Zn(II). Os resultados apresentados na Figura 4 mostram que a eficiência aumenta em cerca de 20% quando o processo é feito sob agitação. No equilíbrio, com apenas 5 min de contato, observam-se remoções em torno de 80%. Durante o mesmo intervalo de tempo os resultados submetidos à agitação mostraram valores superiores a 99% de retenção de Zn(II).
Influência do pH inicial (pHo)
Os resultados da Figura 5 mostram que com o aumento do pHo de 3 para 5 o processo de adsorção é favorecido, chegando a valores de 99,25% de retenção. Em valores de pHo superiores a 5 as taxas de retenção do metal diminuem seguindo a seguinte ordem: 7, 9 e 11. Isso pode ser explicado devido à concentração de H+ e OH- na solução, grandes concentrações do próton fazem com que ocorra concorrência com o Zn(II) pelos sítios de adsorção, todavia, elevadas concentrações de OH- podem competir com os sítios pelo metal e/ou precipitá-lo na forma de hidróxido. Em pHo 5, a presença das espécies H+ e OH- parece que não é suficiente para competir com o metal pelos sítios ou precipitá-lo na forma de hidróxido. Esse resultado obtido é corroborado com outros trabalhos, e pode ser visto na Tabela 2. O valor de pH da solução padrão utilizada nos testes é próxima do valor ótimo, portanto, o pH não foi alterado para os testes seguintes.
Isotermas de adsorção
As isotermas de adsorção foram construídas a partir dos dados obtidos no estudo de remoção. Os dados experimentais foram analisados usando-se os modelos de isoterma de Langmuir (Equação 3), Freundlich (Equação 5)25 e BET (Equação 6),2,3
onde Ce é a concentração do metal no equilíbrio (mg/L), qe é a quantidade adsorvida no equilíbrio (mg/g), Qm (mg/g) e b (L/mg) são constantes relacionadas com a capacidade de adsorção máxima e a energia de adsorção, respectivamente. O parâmetro RL (Equação 4) é uma constante adimensional chamada parâmetro de equilíbrio, o qual é definido como:
onde Co é a concentração inicial do metal mais alta (mg/L). O valor de RL entre 0 e 1 indica adsorção favorável.25
As variáveis da isoterma de Freundlich representam: x = quantidade do metal adsorvido pelo material (mg); m = massa da cinza (g); Kf = constante de Freundlich; 1/n = fator de linearidade da isoterma; Ce = concentração do metal na solução final em equilíbrio (mg/L), a Equação na forma linear é representada por:26
o valor de n na isoterma de Freundlich apresenta a mesma função do parâmetro RL na isoterma de Langmuir. Valores de n entre 2 e 10 representam uma adsorção favorável.27 A partir da constante de Langmuir foi calculado o ΔH de adsorção através da aproximação ΔH = -RT ln b, onde R é constante universal dos gases (8.314 J/mol K), T é a temperatura em Kelvin e b é a constante de Langmuir. O valor obtido (14,66 KJ/mol) traduz uma interação do tipo de fisissorção. Diante disso, um modelo de isoterma de BET foi ajustado para os dados experimentais. A isoterma de BET é típica de fisissorção sendo escrita, na forma linearizada como:
onde, Co é concentração do soluto na solução inicial (mg/L); Ce, concentração do soluto no equilíbrio (mg/L); qe é a quantidade adsorvida no equilíbrio (mg/g); Q é quantidade adsorvida na monocamada (mg/g) e B é a constante de interação adsorbato-adsorvente2,3.
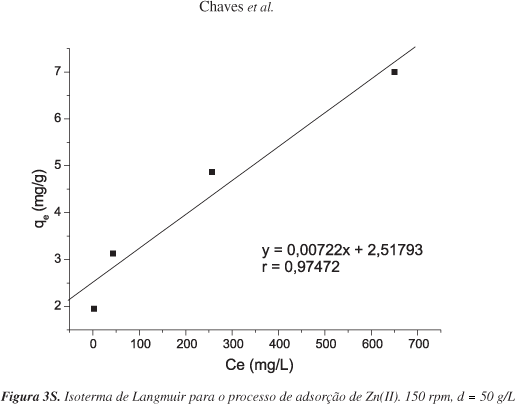
A Tabela 1S (Material Suplementar) mostra os valores obtidos nos testes de isotermas. Os desvios apresentam valores inferiores a 5%, o que mostra uma boa linearidade e confiabilidade dos resultados obtidos nos testes. As Figuras 3S, 6 e 7 apresentam o tratamento dado às informações de adsorção do metal, na forma linearizada, estudados pelas isotermas de Langmuir, Freundlich e BET, respectivamente. Os procedimentos descritos foram empregados apesar da temperatura não ter sido rigorosamente controlada. Os experimentos foram realizados a temperatura ambiente (27 a 30 °C), intervalo esse que não sofreu grandes variações.
A partir dos coeficientes angular e linear da equação da reta foram determinadas a capacidade máxima de adsorção (mg/g) e a constante de Langmuir. O mesmo procedimento foi repetido com a reta obtida através do gráfico log Ce x log qe, utilizando a equação de Freundlich. Os dados estão apresentados na Tabela 2 e são comparados com os reportados na literatura para diferentes adsorventes. É possível notar que a CCA apresenta características bastante superiores, nas condições estudadas, às dos outros materiais, evidenciando a sua grande afinidade pelo Zn(II) e apresentando uma boa linearidade mesmo em concentrações bastante elevadas.
O valor de Qm evidencia a alta afinidade do material com o íon metálico (Qm = 138,5 mg/g), o parâmetro RL < 1 mostra que a adsorção é favorável, assim como o valor de n entre 2 e 10 que possui a mesma função na isoterma de Freundlich.
Em princípio, propõe-se que o processo de remoção se desenvolva por meio de interações entre o adsorbato e a superfície do material através de fisissorção, como é confirmado pelo valor da entalpia calculada a partir da constante de Langmuir. Depois de adsorvido na superfície, o adsorbato difunde para o interior dos mesoporos (Figura 2S) ficando lá aprisionado, visto que os poros possuem formas cônicas, com um volume interno grande e uma saída estreita. Esse fato é confirmado pela curva de dessorção da isoterma de fisissorção de N2 característica do Tipo II (Figura 2) onde é observado o fenômeno de histerse HIII, típico de materiais com poros cônicos. Como as interações entre adsorvato e adsorvente parecem ser de natureza física, outro modelo de isoterma foi ajustado aos dados experimentais utilizando a isoterma de BET, que é característica de adsorções por fisissorção. A isoterma de BET obtida na forma linearizada é apresentada na Figura 7 ; dentre os modelos utilizados esse foi o que melhor se ajustou, sendo obtido coeficiente de correlação r = 0,99956. Este resultado fortalece a teoria de que ocorre um preenchimento dos poros da CCA pelo adsorbato. Diante disso, as proposições citadas anteriormente são reforçadas e nos dão indicativos sobre a alta capacidade de remoção apresentada pela CCA.
CONCLUSÃO
Pelos resultados obtidos conclui-se que é possível utilizar a cinza da casca do arroz obtida da queima em caldeiras secadoras de grãos para a remoção de Zn(II). A utilização direta após a retirada da umidade residual do material, sem que sejam feitos pré-tratamentos, mostrou-se bastante eficiente e simples. Em tempos curtos de contato já são observadas remoções significativas, a agitação melhora em 20% a taxa de retenção do metal, sendo necessário apenas 5 min para remoções superiores a 99%. Em pH = 5 a remoção é máxima, chegando a valores de 99,25% de retenção. A CCA apresentou capacidade máxima de adsorção bastante elevada, mostrando que possui grande afinidade pelo metal. Os parâmetros das isotermas apresentaram resultados de adsorção favorável, com respostas de RL e n dentro das faixas recomendadas. A isoterma de BET foi a que melhor se ajustou ao processo de remoção. Assim, a cinza da casca do arroz pode ser uma aliada de baixo custo nos processos de remoção de Zn(II) em ambientes contaminados com elevadas concentrações do metal.
MATERIAL SUPLEMENTAR
Está disponível em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso gratuito e contém: FTIR da CCA (Figura 1S), distribuição de poros do material (Figura 2S), isoterma de Langmuir (Figura 3S) e os dados experimentais utilizados nos modelos de isotermas de adsorção (Tabela 1S).
AGRADECIMENTOS
Ao Prof. J. M. Sazaki, Laboratório de Raios-X - UFC, pelas análises de DRX e FRX. Ao Prof. J. R. de Sousa, Departamento de Química Orgânica e Inorgânica - UFC, pela análise de FTIR. À Profª A. Chaves, Laboratório de Tecidos Vegetais - FATEC / Limoeiro do Norte, pelas análises de zinco e ao Prof. D. Cardoso, Departamento de Engenharia Química, UFSCar, pela análise de fisissorção de N2.
Recebido em 5/3/08; aceito em 26/1/09; publicado na web em 25/6/09
MATERIAL SUPLEMENTAR
- 1. Ferreira, O. P.; Alves, O. L.; Macedo, J. S.; Gimenez, I. F.; Barreto, L. S.; Quim. Nova 2007, 30, 464.
- 2. Fernandes, R.; Dissertação de Mestrado, Universidade Federal de Santa Catarina, Brasil, 2005.
- 3. Francischetti, J.; Dissertação de Mestrado, Universidade Federal de Santa Catarina, Brasil, 2004.
- 4. Sousa, F. W.; Moreira, S. A.; Oliveira, A. G.; Cavalcante, R. M.; Nascimento, R. F.; Rosa, M. F.; Quim. Nova 2007, 30, 1153.
- 5. Wang, S.; Soudi, M.; Li, L.; Zhu, Z. H.; J. Hazard. Mater. 2006, B133, 243.
- 6. Bhattacharya, A. K.; Mandal, S. N.; Das, S. K.; Chem. Eng. J. 2006, 123, 43.
- 7. Srivastava, V. C.; Mall, I. D.; Mishra, I. M.; Chem. Eng. J. 2007, 132, 267.
- 8. Bishnoi, N. R.; Bajaj, M.; Sharma, N.; Gupta, A.; Bioresour. Technol. 2004, 91, 305.
- 9. Feng, Q.; Lin, Q.; Gong, F.; Sugita, S.; Shoya, M.; J. Colloid Interface Sci. 2004, 278, 1.
- 10. Daifullah, A. A. M.; Awwad, N. S.; El-Reefy, S. A.; Chem. Eng. Process. 2004, 43, 193.
- 11. Hsu, S.; Pan, T.; Bioresour. Technol. 2007, 98, 3617.
- 12. Kumar, U.; Bandyopadhyay, M.; Bioresour. Technol. 2006, 97, 104.
- 13. Guo, Y.; Rockstraw, D. A.; Microporous Mesoporous Mater. 2007, 100, 12.
- 14. Kalderis, D.; Bethanis, S.; Paraskeva, P.; Diamadopoulos, E.; Bioresour. Technol. 2008, 99, 6809.
- 15. Kalderis, D.; Koutoulakis, D.; Paraskeva, P.; Diamadopoulos, E.; Otal, E.; Valle, J. O.; Fernández-Pereira, C.; Chem. Eng. J. 2008, 144, 42.
- 16. Mohan, S.; Sreelakshmi G.; J. Hazard. Mater. 2008, 153, 75.
- 17. Wan Ngah, W. S.; Hanafiah, M. A. K. M.; Bioresour. Technol. 2008, 99, 3935.
- 18. El-Shafey, E. I.; J. Hazard. Mater. 2008, 147, 546.
-
19http://www.conab.gov.br/conabweb/, acessada em Junho 2007.
» link - 20. Della, V. P.; Hotza, D.; Junkes, J. A.; Oliveira, A. P. N.; Quim. Nova 2006, 29, 1175.
- 21. Perguer, S. B. C.; Caovilla, M.; Detoni, C.; Machado, N. R. C. F.; Quim. Nova 2005, 28, 397.
-
22http://www.iza-online.org/, acessada em Dezembro 2007.
» link - 23. Prasetyoko, D.; Ramil, Z.; Endud, S.; Hamdam, H.; Sulikowski, B.; Waste Manage. 2006, 26, 1173.
- 24. Tabak, A.; Afsin, B.; Caglar, B.; Koksal, E.; J. Colloid Interface Sci. 2007, 313, 5.
- 25. Fungaro, D. A.; Silva, M. G. da; Quim. Nova 2002, 25, 1081.
- 26. Falone, S. Z.; Vieira, E. M.; Quim. Nova 2004, 27, 849.
- 27. Soares, J. L.; Dissertação de Mestrado, Universidade Federal de Santa Catarina, Brasil, 1998.
- 28. Cho, H.; Oh, D.; Kim, K.; J. Hazard. Mater. 2005, 127, 187.
- 29. Rao, G. P. C.; Satyavenia, S.; Ramesh, A.; Seshaiah, K.; Murthyb, K. S. N.; Choudary, N. V.; J. Environ. Manage. 2006, 81, 265.
- 30. Shukla, S. R.; Pai, R. S.; Bioresour. Technol. 2005, 96, 1430.
- 31. Fonseca, M. G.; Oliveira, M. M.; Arakaki, L. N. H.; J. Hazard. Mater. 2006, B137, 288.
- 32. Kayaa, A.; Oren, A. H.; J. Hazard. Mater. 2005, B125, 183.
- 33. Ucer, A.; Uyanik, A.; Aygun, S. F.; Sep. Purif. Technol. 2006, 47, 113.
- 34. Srivastava, V. C.; Mall, I. D.; Mishra, I. M.; Colloids Surf., A 2008, 321, 172.
- 35. Srivastava, V. C.; Mall, I. D.; Mishra, I. M.; Sep. Sci. Technol. 2006, 41, 2685.
Datas de Publicação
-
Publicação nesta coleção
22 Set 2009 -
Data do Fascículo
2009
Histórico
-
Aceito
26 Jan 2009 -
Recebido
05 Mar 2008