Resumo
Five samples of natural clays denominated: diatomite, CN-20, CN-29, CN-40 and CN-45 from Aliança Latina LTDA were characterized by differents supplementary techniques such as: XRD, chemical analysis, adsorption N2 measurements, infrared spectroscopy analysis, thermogravimetric analysis. Clays were tested in adsorption of blue methylene. All of isotherms adjust in a model of physics adsorption with formation of multilayers, however in the case of diatomite was a favorable adsorption (type II) and the CNs were a not favorable adsorption (type III). In the case of CNs had flocculation of clay in high concentration of coloring.
characterization; adsorption; clays
characterization; adsorption; clays
ARTIGO
Caracterização de argilas bentonitas e diatomitas e sua aplicação como adsorventes
Bentonites and diatomites clays characterization and aplication in adsorption
Enéderson Rossetto; Rosa Beraldin; Fábio Garcia Penha; Sibele B. C. Pergher* * e-mail: pergher@uri.com.br
Departamento de Química, Universidade Regional Integrada do Alto Uruguai e das Missões, Campus Erechim, Av. Sete de Setembro, 1621, 99700-000 Erechim - RS, Brasil
ABSTRACT
Five samples of natural clays denominated: diatomite, CN-20, CN-29, CN-40 and CN-45 from Aliança Latina LTDA were characterized by differents supplementary techniques such as: XRD, chemical analysis, adsorption N2 measurements, infrared spectroscopy analysis, thermogravimetric analysis. Clays were tested in adsorption of blue methylene. All of isotherms adjust in a model of physics adsorption with formation of multilayers, however in the case of diatomite was a favorable adsorption (type II) and the CNs were a not favorable adsorption (type III). In the case of CNs had flocculation of clay in high concentration of coloring.
Keywords: characterization; adsorption; clays.
INTRODUÇÃO
As argilas, por serem um material natural e considerado barato, estão sendo muito estudadas nos últimos anos como adsorventes alternativos ao carvão ativo na remoção de corantes em efluentes.1-7 Estes minerais são filossilicatos hidratados que, devido ao fenômeno de substituição isomórfica na sua estrutura cristalina lamelar, por exemplo, de Si+4 por Al+3, apresentam cátions trocáveis entre as lâminas e por isto possuem alta capacidade de troca catiônica (CTC).8
Bentonitas7 são argilas do grupo das montmorillonitas, que possuem como cátions de compensação Na+ e Ca+2. A montmorillonita é uma argila que possui unidade estrutural tipo 2:1, uma folha de tetraedros de sílica ligados pelos oxigênios localizados nos vértices da base e uma folha de octaedros de alumínio ligados pelas faces laterais (Figura 1S, material suplementar).9
Diatomitas10,11 são argilas formadas pela acumulação de esqueletos de algas marinhas que contêm 87-91% de sílica SiO2, com quantidades significativas de alumina, Al2O3, e óxido de ferro, Fe2O3. Apresentam estrutura porosa, podendo ser usadas como material adsorvente e em catálise.
O azul de metileno, um corante catiônico, apresenta afinidade pela superfície das argilas e pode ser usado como uma molécula sonda no auxílio da determinação das características da superfície do mineral e, também, para propor modelos de adsorção para outras moléculas semelhantes a este corante.2
O trabalho tem como objetivos caracterizar amostras de argilas naturais fornecidas pela Aliança Latina Ltda. e estudar as propriedades de adsorção destes materiais.
PARTE EXPERIMENTAL
Materiais
Cinco amostras de argilas naturais, denominadas CN-20,CN-29,CN-40, CN-45 e Diatomita foram fornecidas pela Aliança Latina Ltda. (Rio Negro - Argentina).
Caracterização
As amostras de argilas naturais foram caracterizadas através de diversas técnicas complementares, tais como difração de raios X (DRX), análise mineralógica, medidas de adsorção de N2, análise espectroscópica no infravermelho, análise termogravimétrica, análise química e microscopia eletrônica de varredura (MEV).
O equipamento utilizado para as análises de DRX foi um difratômetro modelo D5000 (Siemens) utilizando filtro de Ni e radiação Cu-Ka (λ = 1,54 Å). A análise textural dos materiais foi realizada utilizando um Autosorb-1 da Quantachrome (Nova-2200e). Antes da análise, cerca de 100 mg de amostra foram tratadas a vácuo, a uma temperatura de 300 ºC por 3 h. As medidas foram realizadas na temperatura do N2 líquido (77 K). As análises de microscopia eletrônica de varredura das amostras foram obtidas em um MEV SSZ 550 Shimadzu e as amostras foram previamente atomizadas com ouro.
A análise termogravimétrica foi realizada em um TGA Q50 V6,4. As amostras foram aquecidas da temperatura ambiente até 800 ºC a uma taxa de aquecimento de 20 ºC/min em fluxo de N2 de 40-60 mL/min.
A análise de espectroscopia no infravermelho foi realizada em um espectrotofotômetro FTIR Shimadzu modelo 8300. O espectro foi obtido com 32 varreduras e com 4 cm-1 de resolução. Para a análise, a amostra foi preparada na forma de pastilhas de aproximadamente 2 mm de espessura e 5 mm de diâmetro. Uma diluição de cerca de 10% de amostra foi realizada com KBr.
A análise da composição foi realizada por fluorescência de raios X (FRX). Para esta análise, a argila é misturada com um fundente (mistura de tetraborato e metaborato de lítio), numa relação em massa de 1:5 (argila:fundente). Esta mistura é homogeneizada e, a seguir, são adicionadas 0,3 mL de solução de LiBr a 4% em peso. O cadinho contendo a mistura é levado à fusão num forno Rigaku à 1200 ºC, por aproximadamente 7 min. A pastilha formada é analisada utilizando-se um espectro de raios Philips modelo PW 148D. Este equipamento possui um tubo gerador de raios de ródio.
Testes de adsorção
Os testes de adsorção foram realizados empregando-se 100 mg de cada argila e 50 mL de solução de azul de metileno, nas concentrações de 5.10-6 a 5.10-4 mol/L. A argila e o corante foram colocados em contato durante 2 h sob agitação de 125 rpm a 26 ºC. A quantidade adsorvida foi determinada pela diferença da concentração de azul de metileno das soluções antes e após o processo de adsorção. A concentração de azul de metileno foi medida via espectrofotometria de UV (Spectrometer Perkinelmer Lamba EZ 150) em 665 nm.
RESULTADOS E DISCUSSÃO
Análise por DRX
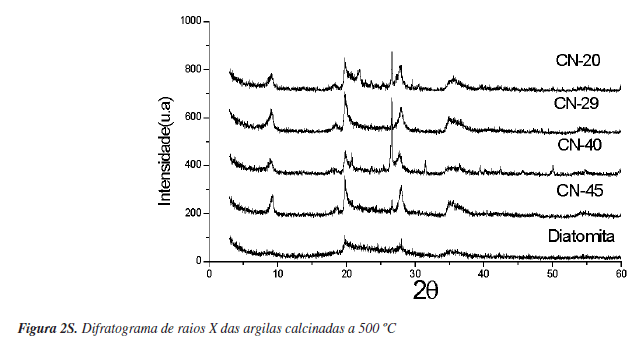
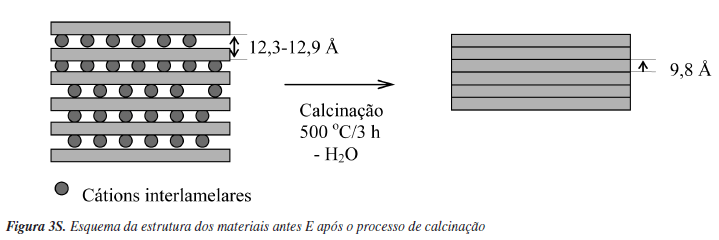
As amostras de argilas foram inicialmente caracterizadas por difração de raios X. A Figura 1 apresenta os difratogramas obtidos. Observa-se que os materiais, excetuando-se a diatomita, possuem um pico em aproximadamente 2θ = 7º indicando que são essencialmente montmorillonitas. Ao calcinar os materiais a 500 ºC por 3 h (Figura 2S, material suplementar) ocorre um deslocamento deste primeiro pico, indicando uma diminuição do espaçamento basal (d 001). O que está de acordo com a idéia de que a 500 ºC ocorre eliminação de águas de hidratação de cátions interlamelares, provocando o colapso da estrutura (Figura 3S, material suplementar). Os valores do espaçamento basal encontrados estão na Tabela 1. Observam-se diferentes intensidades para o primeiro pico nos diferentes materiais. Isso seria um indicativo da organização dos materiais lamelares (empilhamento). No caso das amostras naturais, a CN-29 aparentemente seria um material mais ordenado. A diatomita calcinada apresentou um pico de aproximadamente 9º, que poderia ser a presença de montmorillonita que aparece normalmente junto com as diatomitas.
A análise mineralógica realizada comparando-se os difratogramas obtidos com os padrões da biblioteca do equipamento de DRX mostrou que os materiais são essencialmente montmorillonitas e que possuem como impurezas gipso, plagioclásio, quartzo, fedlspato alcalino e anatásio (Tabela 2).
Área superficial específica
Através da análise dos dados de adsorção de N2 nos diferentes materiais, foram calculadas as áreas superficiais especificas segundo o método BET.12 Os resultados estão apresentados na Tabela 3. Observa-se que os materiais apresentam elevadas áreas superficiais, sendo que a maior foi a da diatomita. As áreas obtidas são similares às normalmente obtidas para materiais lamelares e argilas montmorillonitas. A ordem crescente de áreas superficiais é CN-45< CN-29 < CN-20 < CN-40 < diatomita. Isto está de acordo a porosidade dos materiais e a acessibilidade de molécula de N2. No caso da diatomita observa-se uma área superficial elevada (153 m2/g) devido a sua morfologia e porosidade.
Infravermelho
A Figura 2 apresenta os espectros de refletância difusa na região do infravermelho, os sinais aparecem na região de estiramento e deformação de OH. A banda observada a ~3500 cm-1 pode ser atribuída a combinações de oscilações simétricas e assimétricas do OH da molécula de água ou pode ser devida a oscilações de molécula de água localizadas em posições diferentes da estrutura.13,14
A banda observada a ~1640 cm-1 refere-se à interação do OH com o oxigênio da estrutura da argila. Na região entre 600 e 1500 cm-1 observam-se vibrações referentes à estrutura da montmorillonita. A vibração em 1120 cm-1 refere-se à vibração do estiramento Si-O dos oxigênios apical da lâmina tetraédrica. A banda a ~930 cm-1 é devida ao grupo OH ligado aos átomos de Al. A região de 600-900 cm-1 está relacionada a diferentes vibrações Si-O e Si-O-Al.15 A banda a ~1235 cm-1 refere-se ao estiramento assimétrico de Si-O-Si da estrutura.16
Analisando o espectro da Diatomita, observam-se grandes diferenças na região de 600 a 1500 cm-1, indicando que não se trata de uma argila montmorillonta. Ocorre o desaparecimento das bandas a 1120 e 930 cm_1, referentes a vibrações Si-O e OH-Al típicas das lâminas das argilas. Observa-se uma intensificação da banda a 1235 cm-1 referente à vibração Si-O-Si, típica de diatomitas por possuírem elevada quantidade de SiO2.
Análise termogravimétrica
Os resultados da análise termogravimétrica (Tabela 4) mostraram que as montmorillonitas possuem uma perda de peso similar nas etapas de aquecimento. A primeira etapa de aquecimento (até 100 ºC) refere-se à água adsorvida nos materiais e é a que apresenta a maior perda de massa. As etapas seguintes referem-se a perdas de água de hidratação dos cátions interlamelares. A temperaturas mais elevadas ocorre desidroxilação da estrutura, com o seu colapso. A diatomita apresentou uma maior perda de peso, indicando uma maior quantidade de água adsorvida, o que está de acordo com sua maior área superficial.
Microscopia eletrônica de varredura
As micrografias (Figura 3) mostraram que os materiais, exceto a diatomita, apresentam morfologia lamelar. Os diâmetros das partículas variam de 5 a 150 µm para as montmorillonitas. A diatomita apresenta diâmetros pequenos ( <10 µm), em sua grande maioria, observa-se na amostra de diatomita uma morfologia tubular com poros, característica destes materiais, além de cristais de material lamelar que provavelmente seja a montmorillonita.
Isotermas de adsorção
A Figura 4a mostra a isoterma de adsorção para a CN-45, sendo que para a CN29 e CN20 o resultado foi semelhante e está apresentado na Figura 5S. A Figura 4b mostra a isoterma da adsorção para a diatomita. Observa-se que todas as isotermas se ajustam a um modelo de adsorção física com formação de multicamadas, porém a diatomita mostra uma adsorção favorável (tipo II) e as CNs, uma adsorção não favorável (tipo III). A diferença entre os modelos de adsorção entre a diatomita e as CNs é devida a suas estruturas cristalinas e composições químicas diferentes. Um modelo de adsorção para as CNs está representado na Figura 5 e para a diatomita, na Figura 6.
A adsorção não favorável para as CNs pode ser devida ao fato delas apresentarem uma estrutura lamelar, que dificulta a adsorção interna do corante, etapa 1 (Figura 6). A adsorção sobre a superfície externa da argila parece não ser favorável, ou seja, o corante não apresenta afinidade pela superfície externa das CNs. A molécula do corante deve se difundir para a região interlamelar8 e só após esta etapa a adsorção passa a ser favorável. Portanto, o corante apresenta afinidade pela região interlamelar da argila, provavelmente por um processo de troca catiônica, etapas 2 e 3. Neste ponto começam a ocorrer interações entre as partículas de argilas adsorvidas com o corante, etapa 4. Chega-se então num ponto, etapa 5, onde existe a atração de muitas partículas de argilas adsorvidas com o corante e ocorre a floculação da argila. Neste ponto a solução aquosa fica incolor e a concentração do corante de equilíbrio tende a zero.
A diatomita não apresenta estrutura lamelar, e sim estrutura porosa. O modelo de adsorção é de outro tipo (tipo II) e nota-se que a quantidade de corante adsorvido pela diatomita é bem maior do que para as CNs, o que está de acordo com sua maior área superficial. Neste caso, como a adsorção é preferencialmente interna, não ocorre a floculação.
CONCLUSÕES
A série de argilas CNs apresentaram características similares, eram essencialmente motmorillonitas e apresentaram uma adsorção não favorável (tipo III). Em elevadas concentrações ocorre floculação.
A diatomita apresentou características diferenciadas, sua estrutura particular proporcionou uma elevada área superficial e apresentou uma adsorção favorável (tipo II). Os resultados indicam que a morfologia, área superficial e composição química dos materiais cumprem um papel importante na adsorção.
MATERIAL SUPLEMENTAR
No material suplementar, disponível gratuitamente em http://quimicanova.sbq.org.br, na forma de aquivo PDF, encontram-se as Figuras 1S a 5S.
Recebido em 23/9/08; aceito em 28/4/09; publicado na web em 6/10/09
Material Suplementar
Figure 1s - click to extend
Figure 2s - click to extend
Figure 3s - click to extend
Figure 4s - click to extend
Figure 5s - click to extend
- 1. Hajjaji, M.; Alami, A.; Bouadili, A. E.; J. Hazard. Mater.B 2006, 135, 188.
- 2. Gurses, A.; Dogar, Ç.; Yalçin, M.; Açikyldiz, M.; Bayrak, R.; Karaca, S.; J. Hazard. Mater.B 2006, 131, 217.
- 3. Bukallah, S. B.; Raulf, M. A.; AlAli, S. S.; Dyes Pigm. 2007, 74, 85.
- 4. Eren, E.; Afsin, B.; Dyes Pigm. 2008, 76, 220.
- 5. Hu, Q. H.; Qiao, S. Z.; Haghseresht, F.; Wilson, M. A.; Lu, G. Q.; Ind. Eng. Chem.Res. 2006, 45, 733.
- 6. Mouzdahir, Y. E.; Elmchaouri, A.; Mahboub, R.; Gil, A.; Korili, S. A.; J. Chem. Eng. Data 2007, 521621.
- 7. Ozacar, M.; Sengil, I. A.; J. Environm. Manag. 2006, 80, 372.
- 8. Neumann, M. G.; Gessner, F.; Cione, A. P. P.; Sartori, R. A.; Cavalheiro, C. C. S.; Quim. Nova 2000, 23, 818.
- 9. Coelho, A. C. V.; Santos, P. S.; Quim. Nova 2007, 30, 1282.
- 10. Tsai, W-T.; Lai, C-W.; Hsien, K-J.; J. Colloid Interf. Sci 2006, 297, 749.
- 11. Hadjadj-Aoul, O.; Belabbles, R.; Belkadi, M.; Guermouche, M. H.; Appl. Surf. Sci. 2005, 240,131.
- 12. Gregg, S. I.; Sing, K. S. W.; Adsorption, surface Área and Porosity, Academic Press: London, 1982.
- 13. Gianeto, G.; Montes, A.; Rodrigues, G.; Zeólitas: Características, propiedades y aplicaciones industriales, Edit: Caracas, 2000.
- 14. Hunger, J.; Beta, I. A.; Bolhlig, H.; Ling, C.; Jobic, H.; Hunger, B.; J. Phys. Chem. B 2006, 110, 342.
- 15. Tichit, D.; Fajula, F.; Figueras, F.; Ducourant, B.; Mascherpa, G.; Gueguen, C.; Clays Clay Miner. 1988, 36, 369.
- 16. Araujo, R. S.; Azevedo, D. C. S.; Rodrigues-Castellan, E.; Jiménez-López, A.; Calvacante Jr., C. L. ; J. Mol. Catal A: Chem. 2008, 281, 154.
Datas de Publicação
-
Publicação nesta coleção
26 Nov 2009 -
Data do Fascículo
2009
Histórico
-
Aceito
28 Abr 2009 -
Recebido
23 Set 2008