Resumo
Coffee is widely consumed and appreciated all over the world, both for their stimulating effect and organoleptic characteristics. Due to its complex chemical composition and the factors involving brews preparation, the consumer is exposed to a wide range of chemical compounds. Several investigations aimed to clarify and understand coffee health effects. There is no evidence that moderate consumption could be harmful. On the contrary, some benefits and possible protective effects against several pathologies have been suggested. This review compiles the main conclusions related with the "coffee and health" topic, reporting, when possible, the chemicals involved.
coffee; health; review
coffee; health; review
REVISÃO
Benefícios do café na saúde: mito ou realidade?
Health benefits of coffee: myth or reality?
Rita C. Alves* * e-mail: rita.c.alves@gmail.com ; Susana Casa; Beatriz Oliveira
REQUIMTE/Serviço de Bromatologia, Faculdade de Farmácia da Universidade do Porto, Rua Aníbal Cunha 164, 4030-099 Porto, Portugal
ABSTRACT
Coffee is widely consumed and appreciated all over the world, both for their stimulating effect and organoleptic characteristics. Due to its complex chemical composition and the factors involving brews preparation, the consumer is exposed to a wide range of chemical compounds. Several investigations aimed to clarify and understand coffee health effects. There is no evidence that moderate consumption could be harmful. On the contrary, some benefits and possible protective effects against several pathologies have been suggested. This review compiles the main conclusions related with the "coffee and health" topic, reporting, when possible, the chemicals involved.
Keywords: coffee; health; review.
INTRODUÇÃO
O café é uma das matérias-primas com maior importância no comércio internacional. É igualmente uma das bebidas mais apreciadas em todo mundo, não só pelas suas características organolépticas, mas também pelo seu efeito estimulante. Dado o seu elevado e distribuído consumo, os potenciais efeitos na saúde causados por esta bebida suscitaram, desde cedo, o interesse da comunidade científica.
Inicialmente, o foco destes estudos teve unicamente como base a cafeína e os seus efeitos fisiológicos, sempre com alguma conotação nefasta. Mais recentemente, novas linhas de investigação têm dado relevo a outros compostos químicos, igualmente presentes no café, sugerindo até potenciais efeitos benéficos e protectores ao nível da saúde dos consumidores desta bebida.
A composição química do grão verde de café é bastante complexa.1,2 Durante o processo de torrefacção ocorrem, ainda, diversas reacções químicas, através das quais se degradam e/ou formam inúmeros compostos. Estima-se que o grão de café torrado possua mais de 2000 compostos químicos alguns destes com actividades biológicas conhecidas (adversas e/ou benéficas).1,2 Deste modo, os efeitos do consumo de café irão depender da qualidade e quantidade dos compostos químicos ingeridos, estando o consumo moderado normalmente descrito como a ingestão de 3 a 5 doses diárias de café (aproximadamente 150-300 mg de cafeína/dia).3,4
No entanto, a composição química da bebida é bastante variável e largamente dependente das espécies de café utilizadas, sendo as mais comuns a Coffea arabica (cerca de 70% da produção mundial) e a Coffea canephora var. robusta (mais de 25%).2 Estas duas espécies diferem entre si pelas suas características organolépticas, físicas e químicas. O aroma e o sabor do café arábica são mais apreciados que os do robusta, sendo por isso mais valorizado comercialmente. O café robusta resiste mais facilmente ao ataque de pragas durante o seu cultivo e é especialmente utilizado para aumentar o corpo e a espuma de algumas bebidas, assim como para a produção de café solúvel.1 Quimicamente, estas espécies diferenciam-se pelo seu teor em diversos componentes: cafeína (o dobro no café robusta),2 minerais,5 compostos fenólicos,6 trigonelina,7 aminoácidos,8 aminas biogénicas,9 diterpenos,10 ácidos gordos,11 esteróis,12β-carbolinas,13 entre muitos outros.
Além da influência da espécie de café, o tipo de processamento a que os grãos verdes são sujeitos (via seca, húmida ou mista, descafeinização), o grau de torra e de moagem, assim como o método de preparação da bebida (filtro, expresso, cafeteira, fervido, etc) e o respectivo volume, irão igualmente contribuir para a variação da composição química da bebida final.14
Finalmente, a frequência de ingestão, os hábitos alimentares, o estilo de vida (consumo de álcool e/ou tabaco) e a predisposição genética individual para o desenvolvimento de determinadas doenças poderão de igual modo influenciar os efeitos do café na saúde do consumidor.
Nesta revisão, apresentam-se, sucintamente, as principais conclusões de inúmeras investigações acerca da temática "Café e Saúde", realizadas até à presente data, correlacionando, sempre que possível, com a componente química do café.
CAFÉ E SISTEMA NERVOSO CENTRAL
Café e efeito estimulante
O principal componente psicoactivo do café é, sem dúvida, a cafeína (1,3,7-trimetilxantina) (Figura 1). Os efeitos comportamentais mais notáveis ocorrem após a ingestão de doses baixas a moderadas (50-300 mg) deste composto, verificando-se uma melhoria na performance cognitiva e psicomotora do consumidor (melhoria do estado de alerta, da energia, da capacidade de concentração, do desempenho em tarefas simples, da vigilância auditiva, do tempo de retenção visual e diminuição da sonolência e do cansaço).15
O principal mecanismo de acção da cafeína deve-se à sua similaridade estrutural com a molécula de adenosina (Figura 1), um potente neuromodulador endógeno, que inibe a libertação de diversos neurotransmissores: glutamato, ácido gama-aminobutírico, acetilcolina e monoaminas. A cafeína pode ligar-se a receptores da adenosina (A1 e A2A), bloqueando-os. Deste modo, a acção maioritariamente inibitória da adenosina fica impedida, sendo o efeito da cafeína, consequentemente, estimulante.16-18
São igualmente conhecidos outros mecanismos de acção da cafeína, tal como inibição de fosfodiesterases (enzimas inactivadoras do AMP cíclico) ou mobilização do cálcio intracelular. No entanto, estes ocorrem apenas a um nível modesto, uma vez que as concentrações plasmáticas de cafeína necessárias para um efeito significativo são mais elevadas do que as atingidas através da ingestão de café.19
O consumo moderado de cafeína não parece, de um modo geral, acarretar riscos para a saúde.20 Porém, doses elevadas podem induzir efeitos negativos tais como taquicardia, palpitações, insónias, ansiedade, tremores, dores de cabeça e náuseas.21 É de realçar que estes efeitos indesejáveis podem manifestar-se, igualmente, em alguns indivíduos sensíveis à cafeína, mesmo sem o consumo de elevadas quantidades de café. Nestes casos, a lenta metabolização hepática da cafeína pelo citocromo P450 (CYP1A2) poderá ser o factor responsável pela maior susceptibilidade aos seus efeitos fisiológicos.22 Verificou-se, ainda, que a ansiedade causada pela ingestão de café é mais marcada em indivíduos naturalmente ansiosos ou que sofrem de ataques de pânico.23,24
Café e dependência
A Organização Mundial de Saúde define dependência como um estado em que ocorrem pelo menos três das seguintes manifestações: forte desejo ou compulsão para usar a substância; dificuldade em controlar o seu consumo; abstinência fisiológica; tolerância; abandono progressivo de interesses alternativos; persistência no uso, apesar das consequências prejudiciais.25
A possibilidade do consumo de café provocar dependência tem sido um assunto amplamente debatido. De um modo geral, e de acordo com a definição supracitada, a maioria dos consumidores de café não parece desenvolver dependência da cafeína.15,26,27 No entanto, alguns estudos descrevem que essa situação se pode verificar em pequenos subgrupos da população28-30 como, por exemplo, no caso de indivíduos com historial de abuso de substâncias químicas ou desordens psiquiátricas.30
Apesar do risco de dependência da cafeína ser relativamente baixo, comparativamente com outras drogas,14 a interrupção do consumo de café é responsável pelo aparecimento de sintomas de privação/abstinência em muitos consumidores (dores de cabeça, disforia, sensação de cansaço, fraqueza, sonolência, concentração diminuída, dificuldade em trabalhar, depressão, ansiedade, irritabilidade, tensão muscular aumentada, dores musculares, e mais raramente, tremores, náuseas e vómitos).29,31-36 Curiosamente, alguns destes sintomas são semelhantes aos associados a um consumo excessivo de cafeína.21 Os sintomas de abstinência surgem, em média, 12 a 24 h após a interrupção do consumo de café, atingindo normalmente um pico após 20 a 48 h e podendo durar alguns dias. No entanto, estes intervalos de tempo variam com o consumidor.35-40 Também o tipo de sintomas, assim como a sua frequência, diferem de indivíduo para indivíduo e não parecem estar associados à quantidade de cafeína ingerida diariamente. Podem, contudo, contribuir para a manutenção do consumo de café, uma vez que desaparecem com a sua retoma. Por norma, não se verifica a sua ocorrência se, ao invés de abrupta, a interrupção do consumo for gradual.14,21,29,41-45
Aparentemente, não existe tolerância do sistema nervoso central aos efeitos da cafeína. De facto, ao longo da sua vida, a maioria dos consumidores mantém a ingestão de café a um nível praticamente constante.14 Ensaios realizados em ratos sugerem, também, que o metabolismo energético cerebral não se torna tolerante à cafeína, uma vez que uma administração aguda deste composto induz aumentos metabólicos muito semelhantes, quer os animais tenham estado pré-expostos diariamente (durante 15 dias) à cafeína ou a uma solução salina. Deste modo, cada exposição à cafeína é capaz de produzir efeitos estimulantes cerebrais, especialmente nas áreas de controlo da actividade locomotora e no ciclo sono-vigília.46 Por outro lado, existem alguns estudos em humanos que descrevem uma possível tolerância parcial a algumas acções fisiológicas da cafeína, nomeadamente, sobre a pressão arterial e o ritmo cardíaco,47-51 diurese,52 níveis plasmáticos de aminas simpaticomiméticas,49 entre outros.
As propriedades psicoestimulantes da cafeína, as características organolépticas da bebida e o ambiente social que, usualmente, acompanham o consumo de café, parecem contribuir como um todo para a manutenção do seu consumo.14,53 Contudo, alguns indivíduos referem consumir café para evitar os sintomas de abstinência a ele associados.51,54
Café e cefaleias
A eficácia da cafeína no alívio das dores de cabeça induzidas pela sua privação (que leva à vasodilatação cerebral) reflecte as suas propriedades vasoconstritoras a nível central.42,55-57
Relativamente a outro tipo de cefaleias, como as de tensão, a cafeína parece ter também um papel activo no alívio da dor, sendo o efeito dependente da dose ingerida.58,59 De facto, a cafeína pode ser encontrada como adjuvante de várias preparações medicamentosas, frequentemente utilizadas no combate às dores de cabeça.60 Perante as cefaleias de tensão, a cafeína possui efeito analgésico por si só,58,59 além de potenciar também a acção de princípios activos vulgarmente utilizados nestas situações, tais como paracetamol, ácido acetilsalicílico e ibuprofeno.59,61,62 Todavia, neste tipo particular de cefaleias, não parecem ocorrer alterações vasculares,63-65 pelo que o efeito analgésico da cafeína poderá estar ligado a outros mecanismos, para além do efeito vasoconstritor cerebral da mesma.60
Café e doenças neurodegenerativas
Café e doença de Parkinson
A doença de Parkinson (DP) é causada por uma degeneração severa dos neurónios dopaminérgicos da substância nigra do cérebro, causando incapacidade de controlo voluntário dos movimentos e levando ao tremor, aquinésia, rigidez e instabilidade postural.66,67 De um modo geral, os estudos epidemiológicos68-75 sugerem que o consumo de café está inversamente associado ao risco de DP, especialmente em indivíduos do sexo masculino (relação dose-dependente).
Num estudo de coorte, homens que consumiam pelo menos 3 a 4 chávenas de café por dia apresentavam um risco 5 vezes menor de desenvolver DP, do que os não consumidores.74 Num outro estudo prospectivo, homens que consumiam diariamente a quantidade de cafeína correspondente a uma chávena de café possuíam um risco 50% menor de desenvolver a doença, não tendo sido encontrada qualquer associação em relação ao consumo de descafeinado.73 Curiosamente, no mesmo estudo, não foi verificada qualquer associação entre o consumo de café ou cafeína e a DP, no caso das mulheres.73 Estudos recentes sugerem que, no sexo feminino, esta associação é dependente do uso de estrogéneos como terapêutica de substituição hormonal pós-menopausa. Mulheres que consumiam 4 ou mais doses de café diárias possuíam um risco 50% menor de desenvolver DP do que as não consumidoras. Mas esse efeito benéfico estaria aparentemente impedido se usassem ou tivessem usado terapêutica de substituição estrogénica.71,72 Estes resultados sugerem uma possível interacção entre a cafeína e o uso de estrogéneos, embora o mecanismo dessa interacção não esteja devidamente esclarecido.66
Por outro lado, não foi encontrada qualquer associação entre o consumo de descafeinado e a DP, pelo que é sugerido que a cafeína deverá ter um papel essencial na prevenção desta doença.73
Ratinhos expostos à neurotoxina MPTP (1-metil-4-fenil-1,2,3,6-tetra-hidropiridina) que, após oxidação pela enzima monoamino oxidase B (MAO-B), origina o ião MPP+ (1-metil-4-fenilpiridínio), um neurotóxico activo,76 desenvolveram lesões bioquímicas e anatómicas no sistema nigroestriado semelhantes às existentes na DP.77 A administração de cafeína a ratinhos, em doses comparáveis à exposição humana típica (5 a 30 mg/kg), parece proteger contra a neurotoxicidade do MPTP (efeito dose-dependente).78 Os mecanismos através dos quais este efeito protector ocorre não se encontram totalmente esclarecidos, mas parecem estar relacionados com a actividade antagonista da cafeína sobre os receptores de adenosina A1 e A2A, no sistema nervoso central.79 Os receptores do subtipo A2A adquirem uma importância relevante, tendo em conta que a sua expressão no cérebro está restringida praticamente ao estriado,80 o principal alvo dos neurónios dopaminérgicos que degeneram na DP.66 Aliás, diversos estudos revelam que o antagonismo destes receptores por diversos compostos, incluindo a cafeína, possui um efeito protector sobre os neurónios dopaminérgicos nigroestriatais, relativamente a lesões neuronais isquémicas e excitotóxicas.66
Outros compostos químicos presentes no café torrado poderão também contribuir para a associação inversa verificada entre esta doença e o consumo de café. Recentemente, duas β-carbolinas, harmana (1-metil-9H-pirido[3,4-b]indol) e nor-harmana (9H-pirido[3,4-b]indol) (Figura 2), foram referidas como compostos potencialmente envolvidos na prevenção desta doença, devido à sua capacidade de inibir competitiva e reversivelmente as monoaminoxidases (A e B), duas enzimas envolvidas no metabolismo da dopamina e de outros neurotransmissores.81 A harmana e a nor-harmana formam-se essencialmente durante a torra do café, através de uma reacção de Pictet-Spengler entre indoletilaminas (ex: L-triptofano) e compostos carbonílicos (ex: acetaldeído ou formaldeído).82 O café robusta apresenta níveis de β-carbolinas aproximadamente três vezes superiores aos do arábica,13 provavelmente devido à maior quantidade de precursores da reacção. Além disso, a harmana e a nor-harmana também parecem ser sintetizadas endogenamente nos mamíferos (incluindo o homem),83 pouco se sabendo ainda sobre o exacto mecanismo de acção destes compostos. Verificou-se, no entanto, que alguns derivados N-metilados originados por bioactivação possuem uma estrutura semelhante à do MPP+, podendo desencadear uma acção neurotóxica. Sabe-se que os doentes de Parkinson apresentam níveis mais elevados de harmana e nor-harmana no organismo do que indivíduos saudáveis.83 A dúvida que permanece é se esta ocorrência é a causa da doença ou o seu resultado, uma vez que o próprio organismo poderá produzir estas β-carbolinas endogenamente como inibidores naturais da MAO, em resposta ao défice de dopamina que ocorre durante o desenvolvimento da DP.
Café e doença de Alzheimer
A Doença de Alzheimer é uma doença neurodegenerativa, que resulta numa diminuição progressiva das capacidades cognitivas, por aumento dos níveis cerebrais da proteína β-amilóide. Pensa-se que o aumento do stress oxidativo no cérebro possui um papel essencial na patogénese desta doença.84 Alguns estudos epidemiológicos recentes apontam para um papel neuroprotector do café/cafeína em relação ao desenvolvimento de Alzheimer, independentemente de outros factores.85,86 Contudo, o mecanismo desta protecção não se encontra totalmente esclarecido. Um estudo realizado com culturas de células nervosas animais sugere que o antagonismo dos receptores A2A da adenosina protege as células nervosas contra a neurotoxicidade induzida pela proteína β-amilóide.87 Num outro trabalho, a ingestão diária, por ratinhos, de 1,5 mg de cafeína (quantidade equivalente a um consumo humano diário de 500 mg), causou uma diminuição na produção dos níveis de proteína β-amilóide, protegendo a capacidade cognitiva dos animais.84
Além da cafeína, outros compostos com acção antioxidante existentes no café poderão ter um papel essencial na protecção contra esta doença, reduzindo o stress oxidativo celular, através da neutralização de radicais livres.88-94
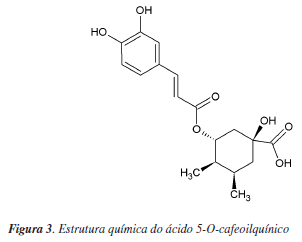
Neste sentido, tem sido dada especial ênfase ao grupo dos ácidos clorogénicos, compostos fenólicos formados a partir da esterificação do ácido quínico com alguns derivados do ácido cinâmico (ácido cafeico, ferúlico e p-cumárico). Os ácidos clorogénicos estão presentes no café verde em quantidades superiores à cafeína e em maior proporção no café robusta do que no arábica. Os subgrupos de isómeros essencialmente presentes no café são os ácidos cafeoilquínicos, feruloilquínicos e dicafeoilquínicos e, em menores quantidades, p-cumaroilquínicos, sendo o ácido 5-O-cafeoilquínico o composto maioritário (sendo, por essa razão, frequentemente denominado ácido clorogénico) (Figura 3). Durante a torra, como resultado das reacções de Maillard e Strecker, grande parte destes ácidos são degradados originando compostos de baixo peso molecular e 1,5-γ-quinolactonas, sendo estes também biologicamente activos.95 Deste modo, o teor em ácidos clorogénicos de uma chávena de café irá depender principalmente da extensão do grau de torra e das espécies de café utilizadas (70-350 mg por 200 mL de bebida).96
Enquanto alguns antioxidantes se degradam durante a torra, outros são formados, como é o caso das melanoidinas. Estas, resultam da reacção de Maillard (que envolve a condensação do grupo carbonilo de açúcares redutores com o grupo amino de aminoácidos ou proteínas)97 e parecem ser as responsáveis pelo aumento da actividade antioxidante observado em extractos de café torrado, quando comparados com café verde.98
Os tocoferóis, conhecidos como potentes antioxidantes in vivo, estão também presentes no óleo do café, especialmente no de café arábica.99 Sendo insolúveis em água, a sua extracção para a bebida irá depender essencialmente do método de preparação desta. Determinados processos (café turco, escandinavo e expresso) permitem uma maior extracção da componente lipídica dos grãos de café.100 Apesar de estarem presentes em quantidades relativamente pequenas,101 os tocoferóis contribuem para complementar a actividade antioxidante da bebida, já que, devido à sua elevada lipossolubilidade, poderão actuar em locais diferentes dos restantes antioxidantes do café.
Café e depressão/risco de suicídio
Vários estudos epidemiológicos descrevem uma associação inversa significativa entre o consumo de café e o risco de suicídio.102-104 As razões desta associação não estão, ainda, totalmente esclarecidas.
Sabe-se que doses moderadas de cafeína interferem positivamente no humor, na disposição, e na performance cognitiva devido ao seu efeito psicoestimulante.105 É possível que as β-carbolinas harmana e nor-harmana (Figura 2) tenham também alguma responsabilidade por este efeito, uma vez que inibem (competitiva e reversivelmente) a monoaminoxidase A (enzima que metaboliza a serotonina e noradrenalina, dois neurotransmissores associados ao bem-estar e boa disposição).106 Demonstrou-se, ainda, que o ácido cafeico possui efeito ansiolítico e antidepressivo quando administrado em animais sujeitos a stress, aparentemente através de uma modulação indirecta dos receptores adrenérgicos α1A.107,108
Não obstante, o consumo de café está intimamente associado a hábitos sociais de convívio que, por si só, aumentam o bem-estar pessoal.
CAFÉ E SISTEMA DIGESTIVO
Café e efeitos gastrointestinais
Não são raros os consumidores de café que descrevem desconfortos gastrointestinais após a ingestão desta bebida, estando o seu consumo desaconselhado em determinadas situações clínicas.
A azia é o sintoma gastrointestinal mais referenciado após a ingestão de café.109,110 Pensa-se que tal efeito poderá ter como base uma irritação directa da mucosa esofágica ou um fomento do refluxo gastro-esofágico.111 De facto, alguns estudos mostram que, comparativamente com a ingestão de água, o café e o descafeinado provocam um aumento desse refluxo,112-114 estimulando também a secreção ácida estomacal.115-119
Não foi demonstrada qualquer associação entre o consumo de café e o desenvolvimento de úlcera péptica,111 mas verificou-se que pacientes com úlcera duodenal alteraram os seus hábitos de consumo de café devido à ocorrência de dispepsia.120 Não obstante, a prevalência de sintomas dispépticos causados pela ingestão de café, parece ser mais elevada em indivíduos que sofrem de dispepsia funcional, do que nos que têm úlcera duodenal.115
A acção do café sobre o tracto digestivo não pode ser totalmente atribuída à cafeína, uma vez que alguns dos efeitos são referenciados, igualmente, para o descafeinado (embora, por vezes, em menor intensidade).111 As 5-hidroxitriptamidas (componentes principais da cera do café) parecem ser parcialmente responsáveis pela irritação gástrica, pelo que alguns processos tecnológicos que reduzem a camada cerosa (polimento, tratamento com vapor de água e/ou descafeinização dos grãos verdes), poderão ajudar a diminuir esse efeito.10 Com este objectivo, foram desenvolvidos os chamados stomach-friendly coffees, direccionados para indivíduos mais sensíveis a nível gástrico, sendo já comercializados em alguns países como, por exemplo, a Alemanha.
Café e absorção de ferro
A acção inibitória do café sobre a absorção do ferro não-hémico (de origem vegetal) é uma situação nutricionalmente relevante, especialmente quando esta bebida é consumida por indivíduos com carência em ferro ou anémicos. Alguns estudos indicam que a ingestão de uma chávena de café após uma refeição reduz em 40% a absorção de ferro não-hémico. Obteve-se o mesmo grau inibitório quando a bebida foi ingerida simultaneamente com a refeição ou 1 h após a mesma. Testes com café instantâneo evidenciaram que este efeito é dependente da dose de café ingerida. No entanto, a acção inibitória do café parece corresponder apenas a metade da verificada para o chá. Pelo contrário, não se verificou qualquer influência na absorção do ferro quando o café foi ingerido 1 h antes da refeição.121,122 A adição de leite ao café não alterou os resultados observados anteriormente.123,124 Os compostos fenólicos123 e as melanoidinas125 parecem ser os principais responsáveis por este efeito inibitório do café, já que possuem a capacidade de se complexarem com o ferro, tornando-o, deste modo, menos disponível para absorção no lúmen intestinal.
Café e cálculos biliares
Os resultados dos estudos epidemiológicos que tentam correlacionar o consumo de café com litíase vesicular são inconclusivos. Por um lado, alguns autores defendem um papel protector do café na prevenção da litíase vesicular sintomática, estando descrita uma menor ocorrência deste problema em consumidores moderados, quando comparados com não consumidores. Associa-se, ainda, o aumento do consumo de café a um decréscimo desta doença em mulheres, em situações previamente diagnosticadas.126-131 Por outro lado, algumas investigações associam positivamente a litíase vesicular com o consumo de café e chá.132-137 Um estudo de caso-controlo descreve total ausência de associação para consumidores moderados e uma maior prevalência de cálculos biliares em consumidores que ingerem elevadas quantidades de café.138 Finalmente, um estudo prospectivo feito com homens japoneses associou positivamente o consumo de café e cafeína com o aumento da prevalência de litíase vesicular previamente diagnosticada, não o associando, no entanto, a novos diagnósticos.139 Adicionalmente, estudos metabólicos mostraram que a ingestão de café estimula a libertação da hormona colecistoquinina e a contracção da vesícula biliar.140
Um dos factores que poderá estar na origem da inconsistência dos resultados poderá ser o tipo de bebida consumida. Alguns processos de extracção originam uma bebida mais rica em diterpenos (Figura 4), compostos com acção hipercolesterolémica (como será detalhado adiante), sendo o aumento do colesterol um factor preponderante na formação de cálculos biliares. 141
Por outro lado, a cafeína possui uma acção inibitória sobre a cristalização do colesterol biliar142,143 e aumenta o fluxo biliar.144 Estes resultados experimentais sugerem que a cafeína deverá ser o principal composto responsável pelo efeito protector descrito em alguns estudos. Além disso, o forte efeito protector do café descrito em estudos de coorte prospectivos145 não foi verificado com o consumo de descafeinados.145
É importante considerar, ainda, a hipótese de que o consumo de café por indivíduos com cálculos biliares previamente instalados possa levar a um aumento dos sintomas gastrointestinais associados, por estimulação da vesícula biliar, levando o indivíduo a procurar o médico e aumentando o número de casos diagnosticados.
CAFÉ E SISTEMA RENAL
Café e cálculos renais
Foi verificada uma associação inversa entre o consumo de café e a presença de cálculos renais num estudo de caso-controlo.146 Dois estudos de coorte posteriores vieram apoiar essa observação, tendo-se verificado uma diminuição do risco de desenvolvimento de cálculos renais em 10 e 9%, com o consumo diário de 240 mL de café ou descafeinado, respectivamente.147,148
Café e diurese
Apesar do ligeiro efeito diurético da cafeína, os estudos realizados até a data não suportam a ideia de que o consumo moderado de café possa causar desidratação. De facto, o café pode até ser uma fonte importante de líquidos na dieta de muitos indivíduos. A ingestão de cafeína provoca um ligeiro aumento da frequência de micção, não se observando, contudo, alterações do volume total de urina eliminado diariamente, uma vez que o pequeno aumento da produção de urina verificado após 3 h é compensado por uma diminuição durante as restantes horas do dia.149,150
A ingestão moderada de cafeína a curto e longo prazo não parece comprometer o estado de hidratação ou a termoregulação, em descanso ou durante o exercício.151,152 Também não existem evidências de que o consumo de café cause desequilíbrio electrolítico.153,154
CAFÉ E METABOLISMO
Café e diabetes tipo II
Diversos estudos epidemiológicos têm sido realizados em todo o mundo com o intuito de verificar a associação entre o consumo de café e o risco de desenvolvimento de diabetes tipo II.155-172 De um modo geral, a maioria das investigações indica que indivíduos que consomem pelo menos 6 a 7 chávenas de café por dia parecem estar sujeitos a um risco significativamente inferior de desenvolver diabetes tipo II, quando comparados com indivíduos que consomem 2 chávenas ou menos. O facto do consumo de café descafeinado estar igualmente associado a um menor risco de desenvolvimento desta doença158,162,173 e, simultaneamente, a menores concentrações do peptídeo C em jejum (indicando uma melhoria da sensibilidade à insulina)170 sugere que outros constituintes do café, em alternativa à cafeína, deverão ser responsáveis por esses efeitos benéficos.174,175
De facto, em estudos realizados em ratos, o consumo de ácidos clorogénicos e produtos de sua degradação durante a torra provocam uma diminuição da concentração de glucose e um aumento da sensibilidade à insulina, respectivamente.176-178
Diversos mecanismos de acção dos ácidos clorogénicos têm sido estudados, em animais e invitro, com o objectivo de clarificar os seus efeitos benéficos no metabolismo da glucose, entre os quais: redução da absorção de glucose no intestino (inibição da glicose-6-fosfato translocase 1); aumento subsequente dos níveis de peptídeo-1 semelhante ao glucagon;179,180 redução da libertação da glucose hepática (por inibição da glucose-6-fosfatase);181,182 efeito antioxidante,96 uma vez que o stress oxidativo desempenha um papel no desenvolvimento de resistência à insulina e diabetes tipo II;183 acção quelante de metais, modificando a composição mineral dos tecidos e melhorando a tolerância à glucose (ex: aumento das concentrações de magnésio no fígado);176 e inibição da formação de compostos N-nitrosos no tracto gastrointestinal,96 que seriam tóxicos para as células beta do pâncreas.184
Café e peso corporal
Vários estudos em humanos sugerem que o consumo de café induz a perda de peso por aumento da termogénese,175 uma vez que se verifica um aumento do gasto energético após a ingestão de cafeína185-188 ou café.189-192 Existem evidências de que esse aumento é dependente da quantidade de cafeína ingerida,187 tendo sido estimado que a ingestão média de 6 chávenas de café diárias causa um aumento no consumo diário de energia de aproximadamente 100 kcal.185 A cafeína parece ser o composto químico responsável pelo efeito termogénico do café, uma vez que este não foi verificado após a ingestão de descafeinado.189
Diversos estudos em humanos verificaram também um aumento da lipólise após a ingestão de cafeína186,193-197 ou café.192,193,195,198,199 Mais uma vez, não se observou um aumento significativo da lipólise após a ingestão de descafeinado.193,195,200 Adicionalmente, alguns estudos mostram que o efeito termogénico186,191,192 e lipolítico191,195 da cafeina é mais pronunciado em indivíduos não obesos do que em obesos.
CAFÉ E SISTEMA CARDIOVASCULAR
Café e pressão sanguínea
Estudos experimentais evidenciam que a administração de cafeína (em quantidades médias comparáveis às ingeridas diariamente) provoca uma elevação aguda da pressão arterial típica, na ordem dos 5 a 15 mm Hg (sistólica) e dos 5 a 10 mm Hg (diastólica), podendo esse efeito subsistir durante várias horas. Verificou-se, ainda, uma sensibilidade aumentada em indivíduos hipertensos, fumadores e/ou sujeitos a situações de stress psicológico.201
A vasoconstrição é conhecida como sendo o principal meio através do qual a cafeína influencia a pressão sanguínea, resultante da sua acção antagonista face à adenosina, um vasodilatador fisiológico.202,203 É necessário ter em conta que, na maioria dos estudos experimentais, a cafeína é administrada numa única dose (aguda), contrariamente ao que acontece no dia-a-dia dos consumidores de café, em que a mesma quantidade de cafeína é ingerida em várias doses ao longo do dia.
Diversos estudos mostram, ainda, que não existe uma tolerância completa aos efeitos da cafeína, mas sim uma tolerância parcial ao longo do dia. Ou seja, o aumento da pressão sanguínea induzido por cada dose de bebida cafeinada é inversamente proporcional ao número de doses previamente consumidas no mesmo dia e, consequentemente, aos níveis sistémicos do composto na altura da ingestão da bebida. No entanto, é restabelecida uma sensibilidade à cafeína próxima da original após a abstinência de consumo nocturna. Doses moderadas de café parecem ser suficientes para saturar todos os receptores de adenosina disponíveis e manifestar-se todo o efeito vasopressor da cafeína. Em situações de consumo excessivo de cafeína, este efeito tende a ser mais prolongado, não parecendo ser, contudo, mais pronunciado.201 Através da monitorização de consumidores habituais de café em ambulatório, verificou-se ainda que um prolongamento da abstinência nocturna pode levar a uma modesta diminuição da pressão arterial. Relativamente à possível tolerância resultante de um consumo habitual a longo prazo, os resultados são inconclusivos.204,205
Apesar destas constatações para a cafeína, os resultados dos estudos epidemiológicos que analisam o consumo de café e a sua influência na pressão sanguínea são muito inconsistentes, referindo associações positivas, inversas e inexistentes. De um modo geral, não existe uma clara relação causal entre o consumo de café e hipertensão. Contudo, os estudos que sugerem que o consumo regular de café contribui para um aumento estatisticamente significativo e contínuo da pressão sanguínea durante o dia, estimam aumentos de aproximadamente 2 a 4 mm Hg,202 menor do que o verificado para a cafeína isolada. É de considerar, neste caso, a presença de outros compostos químicos no café com acção contrária ao efeito constritor da cafeína como, por exemplo, os ácidos clorogénicos. De facto, verificou-se uma melhoria da função endotelial e atenuação da hipertrofia vascular e da hipertensão em ratos espontaneamente hipertensos, após administração de ácido clorogénico durante 8 semanas.201,206
Os estudos publicados não permitem confirmar efectivamente se o consumo de café está ou não associado à hipertensão. No entanto, recomenda-se moderação no consumo em indivíduos hipertensos, fumadores e/ou sujeitos a situações de stress, uma vez que existe um consenso geral de que serão grupos mais susceptíveis ao efeito vasopressor da cafeína.
Café e colesterol sérico
Inúmeros estudos têm associado o consumo de café a um aumento dos níveis séricos do colesterol total e LDL (lipoproteínas de baixa densidade), importante factor de risco de doença cardiovascular.207-212 Este aumento não se encontra associado ao consumo de todas as bebidas de café, sendo o seu método de preparação crucial no efeito hipercolesterolémico.213 Enquanto o consumo de café fervido e não filtrado é responsável por um aumento (dose-dependente) dos níveis de colesterol, foi demonstrado que o consumo de café de filtro possui pouca ou nenhuma associação com a concentração sérica de colesterol.214-218 Além disso, se o café fervido for posteriormente filtrado perde a sua acção hipercolesterolémica.219 Foram identificados, na fracção lipídica do café, dois compostos químicos diterpénicos, o cafestol e o kahweol (Figura 4), com actividade hipercolesterolémica.220 Durante a preparação do café fervido e não filtrado, a extracção de gotículas de gordura para a bebida é significativamente superior do que na preparação do café de filtro, em que as gotículas ficam retidas no pó e no papel de filtro. Consequentemente, o teor em diterpenos da bebida irá variar consoante o seu método de preparação.221,222 O aumento do colesterol total causado pela ingestão destes compostos deve-se essencialmente a um aumento do colesterol LDL. Em menor extensão, observou-se também um aumento das VLDL (lipoproteínas de muito baixa densidade) e uma ligeira diminuição do colesterol HDL (lipoproteínas de alta densidade).220 Num estudo realizado em indivíduos de ambos os sexos, verificou-se um efeito hipercolesterolémico, após exposição ao cafestol, mais evidente em homens do que em mulheres.223
O café fervido, ou escandinavo, e o café turco contêm níveis relativamente elevados de diterpenos (6-12 mg/chávena), enquanto que o café de filtro e o café solúvel apresentam teores da ordem dos 0,2-0,6 mg/chávena. Apesar da concentração destes compostos no café expresso ser elevada, o pequeno volume da bebida faz com que a sua contribuição em cafestol e kahweol seja intermédia, comparativamente às outras bebidas referenciadas (4 mg/chávena).224 Está descrito que o consumo de três expressos por dia não provoca uma alteração significativa dos níveis séricos de colesterol total e LDL.225 Por sua vez, a ingestão diária, durante um mês, de 10 mg de cafestol e 10 mg de kahweol, provocou aumento do colesterol sérico em 5,0 mg/dL e 0,9 mg/dL, respectivamente.220
O mecanismo para a acção destes diterpenos ainda não é totalmente claro. Observou-se que o consumo de cafestol e kahweol provoca um aumento da actividade da proteína de transferência de ésteres de colesterol (CEPT) em humanos, podendo esta acção contribuir para o aumento do colesterol LDL.224,226
Café e homocisteína
Níveis elevados de homocisteína total plasmática constituem, entre outros, risco de doença cardiovascular.227 Foi descrita em diversos estudos uma correlação positiva entre os níveis de homocisteína e o consumo de café (efeito dose-dependente).228-235 A cafeína parece ser apenas parcialmente responsável por esse efeito. Num estudo comparativo, o consumo diário de café de filtro (~870 mg de cafeína) provocou um aumento dos níveis de homocisteína superior aos causados pela ingestão de 870 mg de cafeína (distribuídas por 6 cápsulas), 11 e 5%, respectivamente, quando comparados com o grupo placebo. Os efeitos da cafeína foram mais acentuados nas mulheres do que nos homens, mas os efeitos do consumo de café não foram significativamente diferentes entre ambos os sexos.229 Por outro lado, observou-se um aumento dos níveis plasmáticos de homocisteína, em indivíduos saudáveis, após a ingestão de elevadas quantidades de ácido clorogénico (2 g/dia, dose comparável a 1,5 L de café forte),236 levando a supor que este composto estará também envolvido no aumento dos níveis de homocisteína em consumidores de café.
Café e doenças cardíacas
Diversos estudos epidemiológicos têm examinado a relação entre o consumo de café e o risco de doenças cardíacas.224 De um modo geral, os estudos de caso-controlo publicados apontam para um risco significativamente acrescido de doença coronária e enfarte do miocárdio, em indivíduos que consomem diariamente mais de 5 chávenas de café.237-242 Por sua vez, os estudos prospectivos publicados não suportam a associação entre o consumo de café e o risco de doença coronária.239,243-246 Foi até referenciado recentemente que o consumo moderado desta bebida terá um efeito protector relativamente ao aparecimento de doença coronária em mulheres.247
Embora os resultados nem sempre se apresentem consistentes, não foram observadas associações significativas entre o consumo moderado de café/cafeína e o aumento da frequência ou severidade de arritmias cardíacas.248-253
Café e acidente vascular cerebral
A maioria dos estudos prospectivos não associa o consumo de café ao risco de acidente vascular cerebral.254-256 Porém, no caso de consumidores do sexo masculino, hipertensos e com idade compreendida entre os 55 e 68 anos, parece existir um maior risco de acidente vascular cerebral, especialmente se a ingestão de café for elevada, pelo que se recomenda uma redução do consumo nesta situação particular.257
CAFÉ E SISTEMA MÚSCULO-ESQUELÉTICO
Café e blefaroespasmo
Os consumidores moderados de café parecem estar menos sujeitos a desenvolver um espasmo involuntário nos olhos (blefaroespasmo primário). Esta doença pode deixar um indivíduo efectivamente cego, uma vez que, em estado extremo, as pálpebras se podem fechar durante horas. A associação inversa verificou-se em pacientes que ingeriam pelo menos uma a duas doses de café diárias, aumentando este efeito com a dose de café ingerida. A idade em que os espasmos se iniciaram também foi mais avançada nos pacientes que consumiam mais café (1,7 anos por cada dose adicional diária). Assim, apesar do consumo de café não curar a doença, pode atrasar o seu desenvolvimento. Não é recomendado, no entanto, que indivíduos que padeçam desta doença aumentem o consumo de café com o intuito de a tratar. Os investigadores consideram que a cafeína deverá ser o composto responsável por este efeito, já que se ligando a receptores localizados nos gânglios basais, pode desempenhar um papel chave no controlo do movimento.258
Café e ossos
O consumo de café/cafeína foi associado, em alguns estudos, a um ligeiro efeito negativo sobre o balanço de cálcio, equivalente a uma perda de 4 mg de cálcio por chávena de café consumida.259,260 Numa fase de estudos iniciais, verificou-se que a ingestão de cafeína induzia significativamente uma diurese aguda de cálcio.261-263 Estudos subsequentes demonstraram que esse aumento agudo era seguido por uma diminuição da excreção urinária de cálcio,264 não tendo sido encontrada qualquer influência, por parte da cafeína ingerida, no cálcio eliminado durante 24 h, quer por via urinária, quer por via fecal endógena.265-269 Verificou-se, contudo, que a cafeína pode interferir negativamente (embora em pequena extensão) na homeostase do cálcio, em indivíduos que ingiram quantidades diárias de cálcio inferiores às recomendadas, através de uma fraca interferência com o mecanismo de absorção do cálcio, sendo estimado que esse efeito negativo pode ser contrabalançado aumentando o consumo de cálcio.266,270,271
Relativamente às dezenas de estudos observacionais realizados com o intuito de verificar a associação entre o consumo de café/cafeína ao índice de massa óssea e/ou risco de fractura óssea, os seus resultados não são consistentes ou conclusivos. No entanto, é sugerido que, especialmente os adultos de idade mais avançada, assegurem um consumo adequado de cálcio e vitamina D e consumam café até doses moderadas.224,260
CAFÉ E SISTEMA RESPIRATÓRIO
Café e asma
De acordo com estudos epidemiológicos desenvolvidos nesta área, a probabilidade dos consumidores moderados de café desenvolverem os sintomas usuais de asma é, em média, 30% menor do que os não consumidores, sendo o efeito benéfico significativamente dependente da dose ingerida.129,130 Além do seu efeito broncodilatador, a cafeína também reduz a fadiga dos músculos respiratórios. Comparativamente com um placebo, a cafeína provocou uma modesta melhoria da função pulmonar até 2 h após consumo.272,273 Os estudos realizados sugerem indirectamente que o consumo moderado de café, a longo prazo, pode não só reduzir os sintomas, mas também prevenir manifestações clínicas de asma.274
CAFÉ E CANCRO
Vários estudos epidemiológicos têm sido realizados para avaliar a relação entre o consumo de café e o risco de determinados tipos de cancro.
A relação entre o café e o cancro da bexiga é controversa, apesar dos muitos estudos publicados nas últimas décadas. Alguns trabalhos referem um risco de cancro na bexiga ligeiramente mais elevado nos consumidores de café, comparativamente com os não consumidores, não sendo dependente da quantidade de café ingerida. Não se sabe ainda, contudo, se esta leve associação é casual ou se é devida a algum outro factor.275 É hoje consensualmente aceite que o tabaco provoca um ligeiro aumento do risco de cancro na bexiga, estando o consumo de tabaco muitas vezes associado ao do café.92
Apesar de alguns estudos indicarem um ligeiro aumento no risco de desenvolvimento de cancro do pâncreas em indivíduos que ingerem elevadas quantidades de café, a maioria das investigações não encontrou qualquer associação positiva, especialmente para um consumo moderado.92
Até à data, não há evidências claras de que a ingestão de café possa causar cancro. Algumas investigações referem até um papel positivo do café na prevenção de determinados cancros, nomeadamente, da mama,276 ovários,277,278 pele,279 fígado, 280-282 cólon e recto.283-285
Como já foi referido, diversos estudos têm evidenciado o papel do café como fonte de antioxidantes, essenciais para a manutenção celular,93,286,287 tal como as melanoidinas,288 a cafeína,289 os tocoferois101 e os compostos fenólicos.96 No caso particular dos ácidos clorogénicos, apenas 33% são absorvidos, pelo que o restante permanece no tracto gastrointestinal inibindo a formação de compostos N-nitrosos.290 Os diterpenos cafestol e kawheol, presentes na fracção lipídica do café, possuem ainda actividade quimioprotectora e anticarcinogénica.92,291
CAFÉ E CIRROSE
Dados experimentais sugerem um potencial efeito benéfico de vários componentes do café sobre o fígado, nomeadamente a cafeína,292 o cafestol e o kahweol293-295 e os polifenóis.296
Múltiplos estudos epidemiológicos vão de encontro a estes resultados, apontando para um papel protector do café relativamente ao desenvolvimento de cirrose hepática, especialmente cirrose alcoólica.297-301
Diversos ensaios demonstraram, ainda, uma diminuição dos níveis da enzima hepática gama-glutamiltransferase302-305 e uma redução da actividade alanina aminotransferase sérica,303,306,307 dois marcadores de doença hepática.
CAFÉ E PELAGRA
Pelagra é uma doença caracterizada essencialmente por três sintomas (doença dos 3 D's): dermatite (aparecimento de uma cor escura na pele, que fica seca e áspera), diarreia e demência. Ocorre em situações de desnutrição, quando se verifica uma carência de niacina ou de aminoácidos essenciais, como o triptofano. Os alcoólicos crónicos também possuem um elevado risco de desenvolver esta doença, devido a uma alimentação insuficiente.308
A trigonelina, um alcaloide presente no café arábica (1-2%) e no café robusta (~0.7%), é rapidamente degradada durante a torra originando, entre outros compostos, a niacina, também designada por ácido nicotínico, vitamina B3 ou factor PP (esta última designação advém da sua acção farmacológica: PP = "prevenção da pelagra").308,309
As necessidades exógenas diárias desta vitamina rondam os 15-20 mg. O café torrado (em grão e solúvel) pode conter 10-40 mg de niacina/100 g. Uma chávena de café pode fornecer até 3 mg. Deste modo, o consumo moderado de café pode contribuir para a prevenção do desenvolvimento desta doença.308,309
CAFÉ E GRAVIDEZ
O metabolismo da cafeína é mais lento nas mulheres grávidas e no feto, resultando numa exposição a este composto mais longa e, possivelmente, em teores mais elevados.92 Uma vez que a cafeína atravessa facilmente a placenta e muitas mulheres consomem cafeína durante a gravidez, grande parte dos recém-nascidos possui níveis farmacologicamente activos de cafeína no plasma.226,234,310,311 Foram realizados diversos estudos com o intuito de determinar a influência do consumo de café e/ou cafeína durante a gestação. Os resultados são, no entanto, conflituosos.
A teratogenicidade da cafeína tem sido demonstrada em várias investigações com modelos animais. Contudo, são necessárias doses elevadas para que este efeito se manifeste. No que diz respeito aos humanos, a ingestão de café ou cafeína durante a gestação não parece ser prejudicial, especialmente se em quantidades moderadas. Contudo, a cafeína pode potenciar o efeito teratogénico de outras substâncias, tais como o tabaco e o álcool.312
Os vários estudos epidemiológicos que tentam relacionar o consumo de cafeína e o risco de aborto espontâneo apresentam, também, resultados conflituosos. Algumas investigações demonstram um ligeiro aumento do risco de aborto espontâneo devido ao consumo deste composto (através do café ou outras fontes), especialmente quando a sua ingestão excede os 300 mg/dia,313-316 enquanto outras não encontram qualquer associação.317,318
Apesar de não ser clinicamente relevante, o consumo de 200-400 mg/dia de cafeína, durante a gestação, parece estar associado a uma ligeira diminuição do peso médio do recém-nascido (aproximadamente 100 g).224
Por precaução, e porque são necessários ainda mais estudos sobre estas questões, recomenda-se a interrupção ou redução da ingestão diária de cafeína para o equivalente a uma ou duas chávenas de café (<150 mg), durante a gravidez.3,314
CONCLUSÃO
O café, consumido essencialmente pelo seu efeito estimulante e propriedades organolépticas, possui uma composição química bastante diversificada e complexa. Alguns dos seus componentes são responsáveis por variadas acções biológicas, muitas ainda não totalmente conhecidas e/ou compreendidas.
Não há evidência de que o consumo moderado de café (3 a 5 chávenas diárias), por indivíduos saudáveis, seja prejudicial. Existem, no entanto, alguns subgrupos da população que são mais sensíveis aos efeitos da cafeína, pelo que, nestes casos, o consumo desta bebida cafeinada será de evitar.
Apesar das inúmeras investigações a nível químico, metabólico e epidemiológico elaboradas até à data, por vezes é difícil obter evidências concretas relativamente aos efeitos desta bebida na saúde do consumidor. Muitos resultados são inconclusivos. A enorme variabilidade interindividual e a preferência por diferentes tipos de bebidas de café, com variações desde as espécies (arábica e/ou robusta), graus de torra e moagem e método de preparação da mesma, dificultam frequentemente a comparação entre os variados estudos.
No entanto, linhas de investigação recentes apontam para um efeito benéfico do café relativamente ao desenvolvimento de determinadas doenças, entre elas: diabetes tipo II, asma, cirrose alcoólica, determinados tipos de cancro, Doença de Parkinson e Alzheimer.
AGRADECIMENTOS
R. C. Alves agradece à Fundação para a Ciência e a Tecnologia a concessão de uma bolsa de doutoramento (SFRH/BD/22449/2005).
Recebido em 18/11/08; aceito em 8/4/09; publicado na web em 22/9/09
- 1. Smith, A. W. Em Coffee: Chemistry; Clarke, R. J.; Macrae, R., eds.; Elsevier Applied Science Publishers: London, 1987, vol. 1.
- 2. Illy, A.; Viani, R.; Espresso Coffee: the Science of Quality; 2nd ed., Elsevier Academic Press: London, 2005.
- 3. Fernandes, O.; Sabharwal, M.; Smiley, T.; Pastuszak, A.; Koren, G.; Einarson, T.; Reprod. Toxicol. 1998, 12, 435.
- 4. Schilter, B.; Cavin, C.; Tritscher, A.; Constable, A. Em Coffee: Recent Developments; Clarke, R. J.; Vitzthum, O. G., eds., Blackwell Science: London, 2001.
- 5. Martín, M. J.; Pablos, F.; González, A. G.; Food Chem. 1999, 66, 365.
- 6. Perrone, D.; Farah, A.; Donangelo, C. M.; de Paulis, T.; Martin, P. R.; Food Chem. 2008, 106, 859.
- 7. Casal, S.; Oliveira, M. B. P. P.; Alves, M. R.; Ferreira, M. A.; J. Agric. Food Chem. 2000, 48, 3420.
- 8. Casal, S.; Alves, M. R.; Mendes, E.; Oliveira, M. B. P. P.; Ferreira, M. A.; J. Agric. Food Chem. 2003, 51, 6495.
- 9. Casal, S.; Mendes, E.; Alves, M. R.; Alves, R. C.; Oliveira, M. B. P. P.; Ferreira, M. A.; J. Agric. Food Chem. 2004, 52, 6188.
- 10. Speer, K.; Kölling-Speer, I. Em Coffee: Recent Developments; Clarke, E. J.; Vitzthum, O. G., eds.; Blackwell Sciences: London, 2001.
- 11. Alves, M. R.; Casal, S.; Oliveira, M. B. P. P.; Ferreira, M. A.; J. Am. Oil Chem. Soc. 2003, 80, 511.
- 12. Carrera, F.; León-Camacho, M.; Pablos, F.; González, A. G.; Anal. Chim. Acta 1998, 370, 131.
- 13. Alves, R. C.; Casal, S.; Oliveira, M. B. P. P.; J. Agric. Food Chem. 2007, 55, 1832.
- 14. Nehlig, A.; Neurosci. Biobehav. Rev. 1999, 23, 563.
- 15. Nehlig, A. Em Coffee, Tea, Chocolate, and the Brain; Nehlig, A., ed.; CRC Press LLC: Boca Raton, 2004.
- 16. Fredholm, B. B.; Pharmacol. Toxicol. 1995, 76, 93.
- 17. Dunwiddie, T. V.; Masino, S. A.; Annu. Rev. Neurosci. 2001, 24, 31.
- 18. Biaggioni, I.; Paul, S.; Puckett, A.; Arzubiaga, C.; J. Pharmacol. Exp. Ther. 1991, 258, 588.
- 19. Daly, J. W.; Fredholm, B. B. Em Coffee, Tea, Chocolate, and the Brain; Nehlig, A., ed.; CRC Press LLC: Boca Raton, 2004.
- 20. Nawrot, P.; Jordan, S.; Eastwood, J.; Rotstein, J.; Hugenholtz, A.; Feeley, M.; Food Addit Contam 2003, 20, 1.
- 21. Dews, P. B.; O'Brien, C. P.; Bergman, J.; Food Chem. Toxicol. 2002, 40, 1257.
- 22. Cornelis, M. C.; El-Sohemy, A.; Kabagambe, E. K.; Campos, H.; JAMA 2006, 295, 1135.
- 23. Uhde, T. W. Em Neurobiology of Panic Disorders; Ballenger, J. C., ed.; New York: Alan Liss, 1990.
- 24. Nardi, A.; Lopes, F.; Valença, A.; Freire, R.; Veras, A.; de-Melo-Neto, V.; Nascimento, I.; King, A.; Mezzasalma, M.; Soares-Filho, G.; Zin, W.; Compr. Psychiatry 2007, 48, 257.
-
25World Health Organization; The ICD-10 classification of mental and behavioural disorders: diagnostic criteria for research, World Health Organization: Geneva, 1993.
- 26. Griffiths, R. R.; Mumford, G. K. Em Psychopharmacology: the Fourth Generation of Progress; Bloom, F. E.; Kupfer, D. J., eds.; Raven Press Ltd: New York, 1995.
- 27. Heishman, S. J.; Henningfield, J. E.; Pharmacopsychoecologia 1994, 7, 127.
- 28. Hughes, J. R.; Oliveto, A. H.; Helzer, J. E.; Bickel, W. K.; Higgins, S. T. Em Problems of Drug Dependence 1992; Harris, L. S., ed.; Government Printing Office: Washington DC, 1993.
- 29. Strain, E. C.; Mumford, G. K.; Silverman, K.; Griffiths, R. R.; J. Am. Med. Assoc. 1994, 272, 1043.
- 30. Kessler, R. C.; McGonagle, K. A.; Zhao, S.; Nelson, C. B.; Hughes, M.; Eshleman, S.; Wittchen, H. U.; Kendler, K. S.; Arch. Gen. Psychiatry 1994, 51, 8.
- 31. Griffiths, R. R.; Evans, S. M.; Heishman, S. J.; Preston, K. L.; Sannerud, C. A.; Wolf, B.; Woodson, P. P.; J. Pharmacol. Exp. Ther. 1990, 255, 1123.
- 32. Silverman, K.; Evans, S. M.; Strain, E. C.; Griffiths, R. R.; N. Engl. J. Med. 1992, 327, 1109.
- 33. Strain, E. C.; Griffiths, R. R.; J. R. Soc. Med. 1995, 88, 437.
- 34. Streufert, S.; Pogash, R.; Miller, J.; Gingrich, D.; Landis, R.; Lonardi, L.; Severs, W.; Roache, J. D.; Pharmacology 1995, 118, 377.
- 35. Hughes, J. R.; Oliveto, A. H.; Bickel, W. K.; Higgins, S. T.; Badger, G. J.; Drug. Alcohol. Depend. 1993, 32, 239.
- 36. Lane, J. D.; Pharmacol. Biochem. Behav. 1997, 58, 203.
- 37. James, J. E.; Caffeine and Health, Academic Press: London, 1991.
- 38. Nehlig, A.; Debry, G. Em Coffee and Health; Debry, G., ed.; Libbey: London, 1994.
- 39. Evans, S. M.; Griffiths, R. R.; J. Pharmacol. Exp. Ther. 1999, 289, 285.
- 40. Silverman, K.; Griffiths, R. R.; J. Exp. Anal. Behav. 1992, 57, 91.
- 41. Griffiths, R. R.; Woodson, P. P.; Psychopharmacology 1988, 94, 437.
- 42. Griffiths, R. R.; Woodson, P. P.; J. Pharmacol. Exp. Ther. 1988, 246, 21.
- 43. Griffiths, R. R.; Woodson, P. P.; Pharmacol. Biochem. Behav. 1988, 29, 419.
- 44. Hughes, J. R.; Hunt, W. K.; Higgins, S. T.; Bickel, W. K.; Fenwick, J. W.; Pepper, S. L.; Behav. Pharmacol. 1992, 3, 211.
- 45. James, J. E.; Paull, I.; Cameron-Traub, E.; Miners, J. O.; Lelo, A.; Birkett, D. J.; J. Behav. Med. 1988, 11, 15.
- 46. Nehlig, A.; Daval, J. L.; Boyet, S.; Vert, P.; Eur. J. Pharmacol. 1986, 129, 93.
- 47. Ammon, H. P.; Bieck, P. R.; Mandalaz, D.; Verspohl, E. J.; Br. J. Clin. Pharmacol. 1983, 15, 701.
- 48. Denaro, C. P.; Brown, C. R.; Jacob III, P.; Benowitz, N. L.; Eur. J. Clin. Pharmacol. 1991, 40, 273.
- 49. Robertson, D.; Wade, D.; Workman, R.; Woosley, R. L.; Oates, J. A.; J. Clin. Invest. 1981, 67, 1111.
- 50. Satoh, H.; Tanaka, T.; Eur. J. Clin. Pharmacol. 1997, 52, 239.
- 51. Shi, J.; Benowitz, N. L.; Denaro, C. P.; Sheiner, L. B.; Clin. Pharmacol. Ther. 1993, 53, 6.
- 52. Eddy, N. B.; Downs, A. W.; J. Pharmacol. Exp. Ther. 1928, 33, 167.
- 53. Rogers, P. J.; Richardson, N. J.; Dernoncourt, C.; Neuropsychobiology 1995, 31, 195.
- 54. Rogers, P. J.; Richardson, N. J.; Trends Food Sci. Technol. 1993, 4, 108.
- 55. Dreisbach, R. H.; Pfeiffer, C.; J. Lab. Clin. Med. 1943, 28, 1212.
- 56. Goldstein, A.; Kaizer, S.; Whitby, O.; Clin. Pharmacol. Ther. 1969, 10, 489.
- 57. Hughes, J. R.; Higgins, S. T.; Bickel, W. K.; Hunt, W. K.; Fenwick, J. W.; Gulliver, S. B.; Mireault, G. C.; Arch. Gen. Psychiatry 1991, 48, 611.
- 58. Ward, N.; Whitney, C.; Avery, D.; Dunner, D.; Pain 1991, 44, 151.
- 59. Diamond, S.; Balm, T. K.; Freitag, F. G.; Clin. Pharmacol. Ther. 2000, 68, 312.
- 60. Nehlig, A. Em Coffee, Tea, Chocolate and the Brain; Nehlig, A., ed.; CRC Press: Boca Raton, 2004.
- 61. Schachtel, B. P.; Thoden, W. R.; Konerman, J. P.; Brown, A.; Chaing, D. S.; Clin. Pharmacol. Ther. 1991, 50, 322.
- 62. Migliardi, J. R.; Armellino, J. J.; Friedman, M.; Gillings, D. B.; Beaver, W. T.; Clin. Pharmacol. Ther. 1994, 56, 576.
- 63. Andersson, J. L.; Muhr, C.; Lilja, A.; Valind, S.; Lundberg, P. O.; Långström, B.; Cephalalgia 1997, 17, 570.
- 64. Diener, H. C.; Headache 1997, 37, 622.
- 65. Sliwka, U.; Harscher, S.; Diehl, R. R.; van Schayck, R.; Niesen, W. D.; Weiller, C.; Headache 2001, 41, 157.
- 66. Schwarzschild, M. A.; Ascherio, A. Em Coffee, Tea, Chocolate, and the Brain; Nehlig, A., ed.; CRC: Boca Raton, 2004.
- 67. Eriksen, J. L.; Wszolek, Z.; Petrucelli, L.; Arch. Neurol. 2005, 62, 353.
- 68. Fall, P. A.; Frederikson, M.; Axelson, O.; Granérus, A. K.; Mov. Disord. 1999, 14, 28.
- 69. Benedetti, M. D.; Bower, J. H.; Maranganore, D. M.; McDonnel, S. K.; Peterson, B. J.; Ahlskog, J. E.; Schaid, D. J.; Rocca, W. A.; Neurology 2000, 55, 1350.
- 70. Hernán, M. A.; Takkouche, B.; Caamaño-Isorna, F.; Gestal-Otero, J. J.; Ann. Neurol. 2002, 52, 276.
- 71. Ascherio, A.; Weisskopf, M. G.; O'Reilly, E. J.; McCullough, M. L.; Calle, E. E.; Rodriguez, C.; Thun, M.J.; Am. J. Epidemiol. 2004, 160, 977.
- 72. Ascherio, A.; Chen, H.; Schwarzschild, M. A.; Zhang, S. M.; Colditz, G. A.; Speizer, F. E.; Neurology 2003, 60, 790.
- 73. Ascherio, A.; Zhang, S. M.; Hernán, M. A.; Kawachi, I.; Colditz, G. A.; Speizer, F. E.; Willett, W. C.; Ann. Neurol. 2001, 50, 56.
- 74. Ross, G. W.; Abbott, R. D.; Petrovitch, H.; Morens, D. M.; Grandinetti, A.; Tung, K.-H.; Tanner, C. M.; Masaki, K. H.; Blanchette, P. L.; Curb, J. D.; Popper, J. S.; White, L. R.; JAMA 2000, 283, 2674.
- 75. Paganini-Hill, A.; Neuroepidemiology 2001, 20, 118.
- 76. Chen, J.-F.; Steyn, S.; Staal, R.; Petzer, J. P.; Xu, K.; Van der Schyf, C. J.; Castagnoli, K.; Sonsalla, P. K.; Castagnoli Jr., N.; Schwarzschild, M. A.; J. Biol. Chem. 2002, 277, 36040.
- 77. Gerlach, M.; Riederer, P.; J. Neural Transm. 1996, 103, 987.
- 78. Schwarzschild, M. A.; Chen, J. F.; Ascherio, A.; Neurology 2002, 58, 1154.
- 79. Fisone, G.; Borgkvist, A.; Usiello, A.; Cell. Mol. Life Sci. 2004, 61, 857.
- 80. Svenningsson, P.; Le Moine, C.; Fisone, G.; Fredholm, B. B.; Prog. Neurobiol. 1999, 59, 355.
- 81. Herraiz, T.; Chaparro, C.; J. Chromatogr., A 2006, 1120, 237.
- 82. Herraiz, T.; J. Chromatogr., A 2000, 881, 483.
- 83. Pfau, W.; Skog, K.; J. Chromatogr., B 2004, 802, 115.
- 84. Arendash, G. W.; Schleif, W.; Rezai-Zadeh, K.; Jackson, E. K.; Zacharia, L. C.; Cracchiolo, J. R.; Shippy , D.; Tan, J.; Neurosci. Biobehav. Rev. 2006, 142, 941.
- 85. Lindsay, J.; Laurin, D.; Verreault, R.; Hébert, R.; Helliwell, B.; Hill, G. B.; McDowell, I.; Am. J. Epidemiol. 2002, 156, 445.
- 86. Maia, L.; de Mendonça, A.; Eur. J. Neurol. 2002, 9, 377.
- 87. Dall'lgna, O. P.; Porciúncula, L. O.; Souza, D. O.; Cunha, R. A.; Lara, D. R.; Br. J. Pharmacol. 2003, 138, 1207.
- 88. Zandi, P. P.; Anthony, J. C.; Khachaturian, A. S.; Stone, S. V.; Gustafson, D.; Tschanz, J. T.; Norton, M. C.; Welsh-Bohmer, K. A.; Breitner, J. C.; Arch. Neurol. 2004, 61, 82.
- 89. Engelhart, M. J.; Geerlings, M. I.; Ruitenberg, A.; van Swieten, J. C.; Hofman, A.; Witteman, J. C.; Breteler, M. M.; JAMA 2002, 287, 3223.
- 90. Morris, M. C.; Evans, D. A.; Bienias, J. L.; Tangney, C. C.; Bennett, D. A.; Aggarwal, N.; Wilson, R. S.; Scherr, P. A.; JAMA 2002, 287, 3230.
- 91. Sano, M.; Lancet Neurol. 2002, 1, 342.
- 92. George, S. E.; Ramalakshmi, K.; Mohan Rao, L. J.; Crit. Rev. Food Sci. Nutr. 2008, 48, 464.
- 93. Svilaas, A.; Sakhi, A. K.; Andersen, L. F.; Svilaas, T.; Ström, E. C.; Jacobs Jr, D. R.; Ose, L.; Blomhoff, R.; J. Nutr. 2004, 134, 562.
- 94. Cho, E. S.; Jang, Y. J.; Hwang, M. K.; Lee, K. W.; Lee, H. J.; Mutat. Res. 2009, 661, 18.
- 95. Farah, A.; de Paulis, T.; Moreira, D. P.; Trugo, L. C.; Martin, P. R.; J. Agric. Food Chem. 2006, 54, 374.
- 96. Clifford, M. N.; J. Sci. Food Agric. 1999, 79, 362.
- 97. Delgado-Andrade, C.; Morales, F. J.; J. Agric. Food Chem. 2005, 53, 1403.
- 98. Nicoli, M. C.; Anese, M.; Manzocco, L.; Lerici, C. R.; Lebensm. Wiss. Technol. 1997, 30, 292.
- 99. Alves, R. C.; Casal, S.; Alves, M. R.; Oliveira, M. B.; Food Chem. 2009, 114, 295.
- 100. Ratnayake, W. M. N.; Hollywood, R.; O'Grady, E.; Stavric, B.; Food Chem. Toxicol. 1993, 31, 263.
- 101. Alves, R.C.; Casal, S.; Oliveira, M.B.P.P.; Food Chem. 2009, 115, 1549.
- 102. Klatsky, A. L.; Armstrong, M. A.; Friedman, G. D.; Ann. Epidemiol. 1993, 3, 375.
- 103. Kawachi, I.; Willett, W. C.; Colditz, G. A.; Stampfer, M. J.; Speizer, F. E.; Arch. Int. Med. 1996, 156, 521.
- 104. Tanskanen, A.; Tuomilehto, J.; Viinamäki, H.; Vartiainen, E.; Lehtonen, J.; Puska, P.; Eur. J. Epidemiol. 2000, 16, 789.
- 105. Lieberman, H. R.; Tharion , W. J.; Shukitt-Hale, B.; Speckman, K. L.; Tulley, R.; Psychopharmacology 2002, 164, 250.
- 106. Herraiz, T.; Chaparro, C.; Life Sci. 2006, 78, 795.
- 107. Takeda, H.; Tsuji, M.; Miyamoto, J.; Masuya, J.; Iimori, M.; Matsumiya, T.; Neuroreport 2003, 14, 1067.
- 108. Takeda, H.; Tsuji, M.; Inazu, M.; Egashira, T.; Matsumiya, T.; Eur. J. Pharmacol. 2002, 449, 261.
- 109. Cohen, S.; N. Engl. J. Med. 1980, 303, 122.
- 110. Feldman, M.; Barnett, C. Gastroenterology 1995, 108, 125.
- 111. Boekema, P. J.; Samsom, M.; van Berge Henegouwen, G. P.; Smout, A. J.; Scand. J. Gastroenterol. 1999, 34, 35.
- 112. Wendl, B.; Pfeiffer, A.; Pehl, C.; Schmidt, T.; Kaess, H.; Aliment. Pharmacol. Ther. 1994, 8, 283.
- 113. Brazer, S. R.; Onken, J. E.; Dalton, C. B.; Smith, J. W.; Schiffman, S. S.; Physiol. Behav. 1995, 57, 563.
- 114. Pehl, C.; Pfeiffer, A.; Wendl, B.; Kaess, H.; Aliment. Pharmacol. Ther. 1997, 11, 483.
- 115. Elta, G. H.; Behler, E. M.; Colturi, T. J.; Am. J. Gastroenterol. 1990, 85, 1339.
- 116. Cohen, S.; Booth, G. H.; N.. Engl. J. Med. 1975, 293, 897.
- 117. Feldman, E. J.; Isenberg, J. I.; Grossman, M. I.; JAMA 1981, 246, 248.
- 118. McArthur, K.; Hogan, D.; Isenberg, J. I.; Gastroenterology 1982, 83, 199.
- 119. Salmon, P. R.; Barton, T.; Dig. Dis. Sci. 1997, 31, 55S.
- 120. Eisig, J. N.; Zaterka, S.; Massuda, H. K.; Bettarello, A.; Scand. J. Gastroenterol. 1989, 24, 796.
- 121. Hallberg, L.; Rossander, L.; Hum. Nutr. Appl. Nutr. 1982, 36, 116
- 122. Morck, T. A.; Lynch, S. R.; Cook, J. D.; Am. J. Clin. Nutr. 1983, 37, 416.
- 123. Hurrell, R. F.; Reddy, M.; Cook, J. D.; Br. J. Nutr. 1999, 81, 289.
- 124. Brune, M.; Rossander, L.; Hallberg, L.; Eur. J. Clin. Nutr. 1989, 43, 547.
- 125. Morales, F. J.; Fernández-Fraguas, C.; Jiménez-Pérez, S.; Food Chem. 2005, 90, 821.
- 126. Post, S. M.; de Wit, E. C. M.; Princen, H. M. G.; Arterioscler. Thromb. Vasc. Biol. 1997, 17, 3064.
- 127. Misciagna, G.; Leoci, C.; Guerra, V.; Chiloiro, M.; Elba, S.; Petruzzi, J.; Mossa, A.; Noviello, M. R.; Coviello, A.; Minutolo, M. C.; Mangini, V.; Messa, C.; Cavallini, A.; De Michele, G.; Giorgio, I.; Eur. J. Gastroenterol. Hepatol. 1996, 8, 585.
- 128. Akihiro, F.; Kyoko, M.; Kan, Tan, Sui 2003, 46, 139.
- 129. Leitzmann, M. F.; Stampfer, M. J.; Willett, W. C.; Spiegelman, D.; Colditz, G. A.; Giovannucci, E. L.; Gastroenterology 2002, 123, 1823.
- 130. Leitzmann, M. F.; Willett, W. C.; Rimm, E. B.; Stampfer, M. J.; Spiegelman, D.; Colditz, G. A.; Giovannucci, E.; JAMA 1999, 281, 2106.
- 131. Ruhl, C. E.; Everhart, J. E.; Am. J. Epidemiol. 2000, 152, 1034.
- 132. Sahi, T.; Paffenbarger Jr, R. S.; Hsieh, C.-C.; Lee, I.-M.; Am. J. Epidemiol. 1998, 147, 644.
- 133. La Vecchia, C.; Negri, E.; D'avanzo, B.; Franceschi, S.; Boyle, P.; Int. J. Epidemiol. 1991, 20 209.
- 134. Basso, L.; McCollum, P. T.; Darling, M. R.; Tocchi, A.; Tanner, W. A.; Eur. J. Epidemiol. 2004, 8, 629.
- 135. Jorgensen, T.; Gut 1989 30, 528.
- 136. Devesa, F.; Ferrando, J.; Caldentey, M.; Borghol, A.; Moreno, M. J.; Nolasco, A.; Moncho, J.; Berenguer, J.; Dig. Dis. Sci. 2001, 46, 1424.
- 137. Misciagna, G.; Centonze, S.; Leoci, C.; Guerra, V.; Cisternino, A. M.; Ceo, R.; Trevisan, M.; Am. J. Clin. Nutr. 1999, 69, 120.
- 138. Pastides, H.; Tzonou, A.; Trichopoulos, D.; Katsouyanni, K.; Trichopoulou, A.; Kefalogiannis, N.; Manousos, O.; Arch. Int. Med. 1990, 150, 1409.
- 139. Kratzer, W.; Kächele, V.; Mason, R. A.; Muche, R.; Hay, B.; Wiesneth, M.; Hill, V.; Beckh, K.; Adler, G.; Scand. J. Gastroenterol. 1997, 32, 953.
- 140. Ishizuka, H.; Eguchi, H.; Oda, T.; Ogawa, S.; Nakagawa, K.; Honjo, S.; Kono, S.; Eur. J. Epidemiol. 2003, 18, 401.
- 141. Clifford, M. N.; Ramirez-Martinez, J. R.; Food Chem. 1991, 40, 35.
- 142. Douglas, B. R.; Jansen, J. B.; Tham, R. T.; Lamers, C. B.; Am. J. Clin. Nutr. 1990, 52, 553.
- 143. Keiner, F.; Med. Welt. 1965, 34, 1907.
- 144. Lillemoe, K. D.; Magnuson, T. H.; High, R. C.; Peoples, G. E.; Pitt, H. A.; Surgery 1989, 106, 400.
- 145. Klapdor, R.; Knobel, H.; Schlosser, G. A.; Bartelheimer, H.; Arzneimittelforschung 1978, 28, 1635.
- 146. Shuster, J.; Finlayson, B.; Scheaffer, R. L.; Sierakowski, R.; Zoltek, J.; Dzegede, S.; J. Clin. Epidemiol. 1985, 38, 907.
- 147. Curhan, G. C.; Willett, W. C.; Rimm, E. B.; Spiegelman, D.; Stampfer, M. J.; Am. J. Epidemiol. 1996 143, 240.
- 148. Curhan, G. C.; Willett, W. C.; Speizer, F. E.; Stampfer, M. J.; Ann. Int. Med. 1998, 128, 534.
- 149. Armstrong, L. E.; Casa, D. J.; Maresh, C. M.; Ganio, M. S.; Exerc. Sport Sci. Ver. 2007, 35, 135.
- 150. Grandjean, A. C.; Reimers, K. J.; Bannick, K. E.; Haven, M. C.; J. Am. Coll. Nutr. 2000, 19, 591.
- 151. Ganio, M. S.; Casa, D. J.; Armstrong, L. E.; Maresh, C. M.; Clin. Sports Med. 2007, 26, 1.
- 152. Maughan, R. J.; Griffin, J.; J. Hum. Nutr. Diet. 2003, 16, 411.
- 153. Armstrong, L. E.; Int. J. Sport Nutr. Exerc. Metab. 2002, 12, 189.
- 154. Söndahl, M. R.; van der Vossen, H. A. M. Em Espresso coffee: the science of quality; Illy, A.; Vianni, R., eds.; Elsevier Academic Press: London, 2005.
- 155. Reunanen, A.; Heliövaara, M.; Aho, K.; Lancet 2003, 361, 702.
- 156. Saremi, A.; Tulloch-Reid, M.; Knowler, W. C.; Diab.Care 2003, 26, 2211.
- 157. Rosengren, A.; Dotevall, A.; Wilhelmsen, L.; Thelle, D.; Johansson, S.; J. Int. Med. 2004, 255, 89.
- 158. Salazar-Martinez, E.; Willett, W. C.; Ascherio, A.; Manson, J. E.; Leitzmann, M. F.; Stampfer, M. J.; Hu, F. B.; Ann. Int. Med. 2004, 140, 1.
- 159. Tuomilehto, J.; Hu, G.; Bidel, S.; Lindström, J.; Jousilahti, P.; JAMA 2004, 291, 1213.
- 160. Carlsson, S.; Hammar, N.; Grill, V.; Kaprio J.; Int. J. Epidemiol. 2004, 33, 616.
- 161. van Dam, R. M.; Dekker, J. M.; Nijpels, G.; Stehouwer, C. D.; Bouter, L. M.; Heine, R. J.; Diabetologia 2004, 47, 2152.
- 162. Greenberg, J. A.; Axen, K. V.; Schnoll, R.; Boozer, C. N.; Int. J. Obes. 2005, 29, 1121.
- 163. Isogawa, A.; Noda, M.; Takahashi, Y.; Kadowaki, T.; Tsugane, S.; Lancet 2003, 361, 703.
- 164. van Dam, R. M.; Feskens, E. J.; Kromhout, D.; Ann. Nutr. Metab. 2003, 47, 627.
- 165. Agardh, E. E.; Carlsson, S.; Ahlbom, A.; Efendic, S.; Grill, V.; Hammar, N.; Hilding, A.; Ostenson, C. G.; J. Int. Med. 2004, 255, 645.
- 166. Soriguer, F.; Rojo-Martinez, G.; de Antonio, I. E.; Ann. Int. Med. 2004, 141, 321.
- 167. Yamaji, T.; Mizoue, T.; Tabata, S.; Ogawa, S.; Yamaguchi, K.; Shimizu, E.; Mineshita, M.; Kono, S.; Diabetologia 2004, 47, 2145.
- 168. Ärnlöv, J.; Vessby, B.; Risérus, U.; JAMA 2004, 291, 1199.
- 169. Færch, K.; Lau, C.; Tetens, I.; Pedersen, O. B.; Jorgensen, T.; Borch-Johnsen, K.; Glümer, C.; J. Nutr. 2005, 135, 1177.
- 170. Wu, T.; Willett, W. C.; Hankinson, S. E.; Giovannucci, E.; Diab.Care 2005, 28, 1390.
- 171. van Dam, R. M.; Feskens, E. J.; Lancet 2002, 360, 1477.
- 172. van Dam, R. M.; Hu, F. B.; JAMA 2005, 294, 97.
- 173. Battram, D. S.; Arthur, R.; Weekes, A.; Graham, T.; J. Nutr. 2006, 136, 1276.
- 174. van Dam, R. M.; Nutr. Metab. Cardiovasc. Dis. 2006, 16, 69.
- 175. Greenberg, J. A.; Boozer, C. N.; Geliebter, A.; Am. J. Clin. Nutr. 2006, 84, 682.
- 176. Rodriguez de Sotillo, D. V.; Hadley, M.; J. Nutr. Biochem. 2002, 13, 717.
- 177. Andrade-Cetto, A.; Wiedenfeld, H.; J. Ethnopharmacol. 2001, 78, 145.
- 178. Shearer, J.; Farah, A.; de Paulis, T.; Bracy, D. P.; Pencek, R. R.; Graham, T. E.; Wasserman, D. H.; J. Nutr. 2003, 133, 3529.
- 179. McCarty, M. F.; Med. Hypotheses 2005, 64, 848.
- 180. Johnston, K. L.; Clifford, M. N.; Morgan, L. M.; Am. J. Clin. Nutr. 2003, 78, 728.
- 181. Arion, W. J.; Canfield, W. K.; Ramos, F. C.; Schindler, P. W.; Burger, H. J.; Hemmerle, H.; Schubert, G.; Below, P.; Herling, A. W.; Arch. Biochem. Biophys. 1997, 339, 315.
- 182. Herling, A. W.; Burger, H.; Schubert, G.; Hemmerle, H.; Schaefer, H.; Kramer, W.; Eur. J. Pharmacol. 1999, 386, 75.
- 183. Ceriello, A.; Motz, E.; Arterioscler. Thromb. Vasc. Biol. 2004, 24, 816.
- 184. van Dam, R. M.; Willett, W. C.; Rimm, E. B.; Stampfer, M. J.; Hu, F. B.; Diab.Care 2002, 25, 417.
- 185. Dulloo, A.; Geissler, C.; Horton, T.; Miller, D.; Am. J. Clin. Nutr. 1989, 49, 44.
- 186. Jung, R. T.; Shetty, P. S.; James, W. P. T.; Barrand, M. A.; Callingham, B. A.; Clin. Sci. 1981, 60, 527.
- 187. Astrup, A.; Toubro, S.; Cannon, S.; Hein, P.; Breum, L.; Madsen, J.; Am. J. Clin. Nutr. 1990, 51, 759.
- 188. Graham, T. E.; Sports Med. 2001, 31, 785.
- 189. Horst, K.; Willson, R. J.; Smith, R. G.; J. Pharmacol. Exp. Therap. 1936, 58, 294.
- 190. Hollands, M.; Cawthorne, M. A.; Am. J. Clin. Nutr. 1981, 34, 2291.
- 191. Acheson, K. J.; Zahorska-Markiewicz, B.; Pittet, P.; Anantharaman, K.; Jequier, E.; Am. J. Clin. Nutr. 1980, 33, 989.
- 192. Bracco, D.; Ferrarra, J. -M.; Arnaud, M. J.; Jequier, E.; Schutz, Y.; Am. J. Physiol. 1995, 269, 671.
- 193. Costill, D. L.; Dalsky, G. P.; Fink, W. J.; Med. Sci. Sports 1978, 10, 155.
- 194. Ryu, S.; Choi, S. K.; Joung, S. S.; Suh, H.; Cha, Y. S.; Lee, S.; Lim, K.; J. Nutr. Sci. Vitaminol. (Tokyo) 2001, 47, 139.
- 195. Daubresse, J.-C.; Luyckx, A.; Demey-Ponsart, E.; Franchimont, R.; Lefebvre, P.; Acta Diabetol. Lat. 1973, 10, 1069.
- 196. Keijzers, G. B.; De Galan, B. E.; Tack, C. J.; Smits, P.; Diab.Care 2002, 25, 364.
- 197. Thong, F. S.; Graham, T. E.; J. Appl. Physiol. 2002, 92, 2347.
- 198. Bellet, S.; Kershbaum, A.; Finck, E. M.; Metabolism 1968, 17, 702.
- 199. Avogaro, P.; Capri, C.; Pais, M.; Cazzolato, G.; Isr. J. Med. Sci. 1973, 9, 114.
- 200. Sawynok, J.; Yaksh, T. L.; Pharmacol. Rev. 1993, 45, 43.
- 201. James, J. E.; Psychosom. Med. 2004, 66, 63.
- 202. Nurminen, M. L.; Niittynen, L.; Korpela, R.; Vapaatalo, H.; Eur. J. Clin. Nutr. 1999, 53, 831.
- 203. Hartley, T. R.; Lovallo, W. R.; Whitsett, T. L.; Sung, B. H.; Wilson, M. F.; J. Clin. Hypertens. 2001, 3, 3.
- 204. Fuller, R. W.; Maxwell, D. L.; Conradson, T.-B. G.; Dixon, C. M. S.; Barnes, P. J.; Br. J. Pharmacol. 1987, 24, 309.
- 205. Smits, P.; Boekema, P.; De Abreu, R.; Thien, T.; van't Laar, A.; J. Cardiovasc. Pharmacol. 1987, 10, 136.
- 206. Hamer, M.; J. Hum. Hypertens. 2006, 20, 909.
- 207. Aro, A.; Tuomilehto, J.; Kostiainen, E.; Uusitalo, U.; Pietinen, P.; Metabolism 1987, 36, 1027.
- 208. Tverdal, A.; Stensvold, I.; Solvoll, K.; Foss, O. P.; Lund-Larsen, P.; Bjartveit, K.; BMJ 1990, 300, 566.
- 209. Thelle, D. S.; Arnesen, E.; Førde, O. H.; N. Engl. J. Med. 1983, 308, 1454.
- 210. Arnesen, E.; Førde, O. H.; Thelle, D. S.; Br. Med. J. ( Clin Res. Ed.) 1984, 288, 1960.
- 211. Pietinen, P.; Geboers, J.; Kesteloot, H.; Int. J. Epidemiol. 1988, 17, 98.
- 212. Aro, A.; Pietinen, P.; Uusitalo, U.; Tuomilehto, J.; J. Int. Med. 1989, 226, 127.
- 213. Thelle, D. S.; Heyden, S.; Fodor, J. G.; Atherosclerosis 1987, 67, 97.
- 214. Jee, S. H.; He, J.; Appel, L. J.; Whelton, P. K.; Suh, I.; Klag, M. J.; Am. J. Epidemiol. 2001, 153, 353.
- 215. Forde, O. H.; Knutsen, S. F.; Arnesen, E.; Thelle, D. S;. Br. Med. J. (Clin. Res. Ed.) 1985, 290, 893.
- 216. Bonaa, K.; Arnesen, E.; Thelle, D. S.; Forde, O. H.; BMJ 1988, 297, 1103.
- 217. Bak, A. A.; Grobbee, D. E.; N. Engl. J. Med. 1989, 321, 1432.
- 218. Pietinen, P.; Aro, A.; Tuomilehto, J.; Uusitalo, U.; Korhonen, H.; Int. J. Epidemiol. 1990, 19, 586.
- 219. Van Dusseldorp, M.; Katan, M. B.; Van Vliet, T.; Demacker, P. N. M.; Stalenhoef, A.; Arterioscler. Thromb. 1991, 11, 586.
- 220. Urgert, R.; Katan, M. B.; Annu. Rev. Nutr. 1997, 17, 305.
- 221. Urgert, R.; J. Agric. Food Chem. 1995, 43, 2167.
- 222. Defazio, G.; Martino, D.; Abbruzzese, G.; Girlanda, P.; Tinazzi, M.; Fabbrini, G.; Colosimo, C.; Aniello, M.; Avanzino, L.; Buccafusca, M.; Majorana, G.; Trompetto, C.; Livrea, P.; Berardelli, A.; J. Neurol. Neurosurg. Psychiatry 2007, 78, 877.
- 223. Weggemans, R. M.; Zock, P. L.; Urgert, R.; Katan, M. B.; Eur. J. Clin. Invest. 1999, 29, 827.
- 224. Higdon, J. V.; Frei, B.; Crit. Rev. Food Sci. Nutr. 2006, 46, 101.
- 225. D'Amicis, A.; Scaccini, C.; Tomassi, G.; Anaclerio, M.; Stornelli, R.; Bernini, A.; Int. J. Epidemiol. 1996, 25, 513.
- 226. De Roos, B.; Van Tol, A.; Urgert, R.; Scheek, L. M.; Van Gent, T.; Buytenhek, R.; Princen, H. M.; Katan, M. B.; J. Int. Med. 2000, 248, 211.
- 227. Boushey, C. J.; Beresford, S. A.; Omenn, G. S.; Motulsky, A. G.; JAMA 1995, 274, 1049.
- 228. Nygard, O.; Refsum, H.; Ueland, P. M.; Stensvold, I.; Nordrehaug, J. E.; Kvale, G.; Vollset, S. E.; Am. J. Clin. Nutr. 1997, 65, 136.
- 229. Verhoef, P.; Pasman, W. J.; van Vliet, T.; Urgert, R.; Katan, M. B.; Am. J. Clin. Nutr. 2002, 76, 1244.
- 230. Husemoen, L. L.; Thomsen, T. F.; Fenger, M.; Jorgensen, T.; Eur. J. Clin. Nutr. 2004, 58, 1142.
- 231. Mennen, L. I.; de Courcy, G. P.; Guilland, J.-C.; Ducros, V.; Bertrais, S.; Nicolas, J.-P.; Maurel, M.; Zarebska, M.; Favier, A.; Franchisseur, C.; Hercberg, S.; Galan, P.; Am. J. Clin. Nutr. 2002, 76, 1279.
- 232. de Bree, A.; Verschuren, W. M.; Blom, H. J.; Kromhout, D.; Am. J. Epidemiol. 2001, 154, 150.
- 233. Stolzenberg-Solomon, R. Z.; Miller 3rd, E. R.; Maguire, M. G.; Selhub, J.; Appel, L. J.; Am. J. Clin Nutr. 1999, 69, 467.
- 234. Urgert, R.; van Vliet, T.; Zock, P. L.; Katan, M. B.; Am. J. Clin. Nutr. 2000, 72, 1107.
- 235. Christensen, B.; Mosdol, A.; Retterstol, L.; Landaas, S.; Thelle, D. S.; Am. J. Clin Nutr. 2001, 74, 302.
- 236. Olthof, M. R.; Hollman, P. C.; Zock, P. L.; Katan, M. B.; Am. J. Clin. Nutr. 2001, 73, 532.
- 237. Panagiotakos, D. B.; Pitsavos, C.; Chrysohoou, C.; Kokkinos, P.; Toutouzas, P.; Stefanadis, C.; J. Nutr. 2003, 133, 3228.
- 238. Greenland, S.; Epidemiology 1993, 4, 366.
- 239. Kawachi, I.; Colditz, G. A.; Stone, C. B.; Br. Heart J. 1994, 72, 269.
- 240. Hammar, N.; Andersson, T.; Alfredsson, L.; Reuterwall, C.; Nilsson, T.; Hallqvist, J.; Knutsson, A.; Ahlbom, A.; J. Int. Med. 2003, 253, 653.
- 241. Palmer, J. R.; Rosenberg, L.; Rao, R. S.; Shapiro, S.; Am. J. Epidemiol. 1995, 141, 724.
- 242. Tavani, A.; Bertuzzi, M.; Negri, E.; Sorbara, L.; La Vecchia, C.; Eur. J. Epidemiol. 2001, 17, 1131.
- 243. Myers, M. G.; Basinski, A.; Arch. Int. Med. 1992, 152, 1767.
- 244. Willett, W. C.; Stampfer, M. J.; Manson, J. E.; Colditz, G. A.; Rosner, B. A.; Speizer, F. E.; Hennekens, C. H.; JAMA 1996, 275, 458.
- 245. Woodward, M.; Tunstall-Pedoe, H.; J. Epidemiol. Community Health 1999, 53, 481.
- 246. Kleemola, P.; Jousilahti, P.; Pietinen, P.; Vartiainen, E.; Tuomilehto, J.; Arch. Int. Med. 2000, 160, 3393.
- 247. Wu, J. N.; Ho, S. C.; Zhou, C.; Ling, W. H.; Chen, W. Q.; Wang, C. L.; Chen, Y. M.; Int. J. Cardiol. 2008, no prelo. (doi: 10.1016/j.ijcard.2008.06.051)
- 248. Lane, J. D.; Williams, R. B.; Psychophysiology 1985, 22, 648.
- 249. Chelsky, L. B.; Cutler, J. E.; Griffith, K.; Kron, J.;McClelland, J. H.; McAnulty, J. H.; JAMA 1990, 264, 2236.
- 250. Myers, M. G.; Ann. Int. Med 1991, 114, 147.
- 251. Frost, L.; Vestergaard, P.; Am. J. Clin. Nutr. 2005, 81, 578.
- 252. Wilhelmsen, L.; Rosengren, A.; Lappas, G. J.; Int. Med., 2001, 250, 382.
- 253. Sutherland, D. J.; McPherson, D. D.; Renton, K. W.; Spencer, C. A.; Montague, T. J.; Chest 1985, 87, 319.
- 254. Adolfsson, R.; Svardsudd, K.; Tibblin, G.; Scand. J. Soc. Med. Suppl. 1977, 14, 122.
- 255. Grobbee, D. E.; Rimm, E. B.; Giovannucci, E.; Colditz, G.;Stampfer, M.; Willett, W.; N. Engl. J. Med. 1990, 323, 10262.
- 256. Heyden, S.; Tyroler, H. A.; Heiss, G.; Hames, C. G.; Bartel, A.; Arch. Int. Med. 1978, 138, 1472.
- 257. Hakim, A. A.; Ross, G. W.; Curb, J. D.; Rodriguez, B. L.; Burchfiel, C. M.; Sharp, D. S.; Yano, K.; Abbott, R. D.; J. Clin. Epidemiol. 1998, 51, 487.
- 258. Kang, J. H.; Willett, W.; Rosner, B.; Hankinson, S.; Pasquale, L.; Invest. Ophthalmol. Vis. Sci. 2008, 49, 1924.
- 259. Heaney, R. P.; Recker, R. R.; J. Lab. Clin. Med. 1982, 99, 46.
- 260. Heaney, R. P.; Food Chem. Toxicol. 2002, 40, 1263.
- 261. Massey, L. K.; Wise, K. J.; Nutr. Res. 1984, 4, 43.
- 262. Massey, L. K.; Hollingbery, P. W.; Nutr. Res. 1988, 8, 1005.
- 263. Bergman, E. A.; Massey, L. K.; Wise, K. J.; Sherrard, D. J.; Life Sci. 1990, 47, 557.
- 264. Kynast-Gales, S. A.; Massey, L. K.; J. Am. Coll. Nutr. 1994, 13, 467.
- 265. Barger-Lux, M. J.; Heaney, R. P.; Stegman, M. R.; Am. J. Clin. Nutr. 1990, 52, 722.
- 266. Barger-Lux, M. J.; Heaney, R. P.; Osteoporos. Int. 1995, 5, 97.
- 267. Heaney, R. P.; Recker, R. R.; J. Bone Min. Res. 1994, 9, 1621.
- 268. Smith, S.; Swain, J.; Brown, E. M.; Wyshak, G.; Albright, T.; Ravnikar, V. A.; Schiff, I.; Arch. Int. Med. 1989, 149, 2517.
- 269. Massey, L. K.; Bergman, E. A.; Wise, K. J.; Sherrard, D. J.; J. Am. Coll. Nutr. 1994, 13, 592.
- 270. Barrett-Connor, E.; Chang, J. C.; Edelstein , S. L.; J. Am. Med. Assoc. 1994, 271, 280.
- 271. Harris, S. S.; Dawson-Hughes, B.; Am. J. Clin. Nutr. 1994, 60, 573.
- 272. Schwartz, J.; Weiss, S. T.; Ann. Epidemiol. 1992, 2, 627.
- 273. Pagano, R.; Negri, E.; Decarli, A.; La Vecchia, C.; Chest 1988, 94, 386.
- 274. Bara, A. I.; Barley, E. A.; Cochrane Database Syst. Rev. 2001, 4, CD001112.
- 275. Tavani, A.; La Vecchia, C.; Eur. J. Cancer Prev. 2000, 9, 241.
- 276. Ganmaa, D.; Willett, W. C.; Li, T. Y.; Feskanich, D.; van Dam, R. M.; Lopez-Garcia, E.; Hunter, D. J.; Holmes, M. D.; Int. J. Cancer 2008, 122, 2071.
- 277. Tworoger, S. S.; Gertig, D. M.; Gates, M. A.; Hecht, J. L.; Hankinson, S. E.; Cancer 2008, 112, 1169.
- 278. Jordan, S. J.; Purdie, D. M.; Green, A. C.; Webb, P. M.; Cancer Causes Control 2004, 15, 359.
- 279. Abel, E. L.; Hendrix, S. O.; McNeeley, S. G.; Johnson, K. C.; Rosenberg, C. A.; Mossavar-Rahmani, Y.; Vitolins, M.; Kruger, M.; Eur. J. Cancer Prev. 2007, 446.
- 280. Ohfuji, S.; Fukushima, W.; Tanaka, T.; Habu, D.; Tamori, A.; Sakaguchi, H.; Takeda, T.; Kawada, N.; Seki, S.; Nishiguchi, S.; Shiomi, S.; Hirota, Y.; Hepatol. Res. 2006, 36, 201.
- 281. Bravi, F.; Bosetti, C.; Tavani, A.; Bagnardi, V.; Gallus, S.; Negri, E.; Franceschi, S.; La Vecchia, C.; Hepatology 2007, 46, 430.
- 282. Larsson, S. C.; Wolk, A.; Gastroenterology 2007, 132, 1740.
- 283. Tavani, A.; Pregnolato, A.; La Vecchia, C.; Negri, E.; Talamini, R.; Franceschi, S.; Int. J. Cancer 1997, 73, 193.
- 284. Lee, K. J.; Inoue, M.; Otani, T.; Iwasaki, M.; Sasazuki, S.; Tsugane, S.; Group, J. S.; Int. J. Cancer 2007, 121, 1312.
- 285. La Vecchia, C.; Ferraroni, M.; Negri, E.; D'Avanzo, B.; Decarli, A.; Levi, F.; Franceschi, S.; Cancer Res. 1989, 49, 1049.
- 286. Sanchez-Gonaza, I.; Jimenez-Escrig, F.; Saura-Calixto, F.; Food Chem. Toxicol. 2005, 90, 133.
- 287. Cämmerer, B.; Kroh, L. W.; Eur. Food Res. Technol. 2006, 223, 469.
- 288. Borrelli, R. C.; Visconti, A.; Mennella, C.; Anese, M.; Fogliano, V.; J. Agric. Food Chem. 2002, 50, 6527.
- 289. Devasagayam, T. P.; Kamat, J. P.; Mohan, H.; Kesavan, P. C.; Biochim. Biophys. Acta. 1996, 1282, 63.
- 290. Olthof, M. R.; Hollman, P. C.; Katan, M. B.; J. Nutr. 2001, 131, 66.
- 291. Cavin, C.; Holzhaeuser, D.; Scharf, G.; Constable, A.; Huber, W. W.; Schilter, B.; Food Chem. Toxicol. 2002, 40, 1155.
- 292. He, P.; Noda, Y.; Sugiyama, K.; Biosci. Biotechnol. Biochem. 2001, 65, 670.
- 293. Huber, W. W.; Scharf, G.; Rossmanith, W.; Prustomersky, S.; Grasl-Kraupp, B.; Peter, B.; Turesky, R. J.; Schulte-Hermann, R.; Arch. Toxicol. 2002, 75, 685.
- 294. Scharf, G.; Prustomersky, S.; Huber, W. W.; Adv. Exp. Med. Biol. 2001, 500, 535.
- 295. Lee, K. J.; Choi, J. H.; Jeong, H. G.; Food Chem. Toxicol. 2007, 45, 2118.
- 296. Shapiro, H.; Bruck, R.; Gastroenterology 2006, 130, 1931.
- 297. Kendrick, S. F. W.; Day, C. P.; J. Hepatol. 2007, 46, 980.
- 298. Corrao, G.; Lepore, A. R.; Torchio, P.; Valenti, M.; Galatola, G.; D'Amicis, A.; Aricò, S.; di Orio, F.; Eur. J. Epidemiol. 1994, 10, 657.
- 299. Corrao, G.; Zambon, A.; Bagnardi, V.; D'Amicis, A.; Klatsky, A.; Ann. Epidemiol. 2001, 11, 458.
- 300. Gallus, S.; Tavani, A.; Negri, E.; La Vecchia, C.; Ann. Epidemiol. 2002, 12, 202.
- 301. Tverdal, A.; Skurtveit, S.; Ann. Epidemiol. 2003, 13, 419.
- 302. Poikolainen, K.; Vartiainen, E.; Am. J. Epidemiol. 1997, 146, 1019.
- 303. Tanaka, K.; Tokunaga, S.; Kono, S.; Tokudome, S.; Akamatsu, T.; Moriyama, T.; Zakouji, H.; Int. J. Epidemiol. 1998, 27, 438.
- 304. Honjo, S.; Kono, S.; Coleman, M. P.; Shinchi, K.; Sakurai, Y.; Todoroki, I.; Umeda, T.; Wakabayashi, K.; Imanishi, K.; Nishikawa, H.; Ogawa, S.; Katsurada, M.; Nakagawa, K.; Yoshizawa, N.; Ann. Epidemiol. 1999, 9, 325.
- 305. Nakanishi, N.; Nakamura, K.; Nakajima, K.; Suzuki, K.; Tatara, K.; Eur. J. Epidemiol. 2000, 16, 419.
- 306. Ruhl, C. E.; Everhart, J. E.; Gastroenterology 2005, 128, 24.
- 307. Honjo, S.; Kono, S.; Coleman, M. P.; Shinchi, K.; Sakurai, Y.; Todoroki, I.; Umeda, T.; Wakabayashi, K.; Imanishi, K.; Nishikawa, H.; Ogawa, S.; Katsurada, M.; Nakagawa, K.; Yoshizawa, N.; J. Clin. Epidemiol. 2001, 54, 823.
- 308. Ramos-e-Silva, M.; Filgueira, A. L.; An. Bras. Dermatol. 1989, 64, 249.
- 309. Santos, R. M.; Lima, D. R.; Coffee: The revolutionary drink for pleasure and health, Xlibris Corporation: USA, 2007.
- 310. Ahola, I.; Jauhiainen, M.; Aro, A.; J. Int. Med. 1991, 230, 293.
- 311. Fried, R. E.; Levine, D. M.; Kwiterovich, P. O.; Diamond, E. L.; Wilder, L. B.; Moy, T. F.; Pearson, T. A.; JAMA 1992, 267, 811.
- 312. Nehlig, A.; Debry, G.; Neurotoxicol. Teratol. 1994, 16, 531.
- 313. Dlugosz, L.; Belanger, K.; Hellenbrand, K.; Holford, T. R.; Leaderer, B.; Bracken, M. B.; Epidemiology 1996, 7, 250.
- 314. Weng, X.; Odouli, R.; Li, D.-K.; Am. J. Obstet. Gynecol. 2008, 198, 279.
- 315. Bech, B. H.; Nohr, E. A.; Vaeth, M.; Henriksen, T. B.; Olsen, J.; Am. J. Epidemiol. 2005, 162, 983.
- 316. Cnattingius, S.; Signorello, L. B.; Anneren, G.; Clausson, B.; Ekbom, A.; Ljunger, E.; Blot, W. J.; McLaughlin, J. K.; Petersson, G.; Rane, A.; Granath, F.; N. Engl. J. Med. 2000, 343, 1839.
- 317. Fenster, L.; Hubbard, A. E.; Swan, S. H.; Windham, G. C.; Waller, K.; Hiatt, R. A.; Benowitz, N.; Epidemiology 1997, 8, 515.
- 318. Mills, J. L.; Holmes, L. B.; Aarons, J. H.; Simpson, J. L.; Brown, Z. A.; Jovanovic-Peterson, L. G.; Conley, M. R.; Graubard, B. I.; Knopp, R. H.; Metzger, B. E.; JAMA 1993, 269, 593.
Datas de Publicação
-
Publicação nesta coleção
26 Nov 2009 -
Data do Fascículo
2009
Histórico
-
Aceito
08 Abr 2009 -
Recebido
18 Nov 2008