Resumo
The construction of a low cost mini sensor containing a bismuth-film electrode (BiFE), as work electrode, a silver electrode as pseudo reference electrode, and copper as counter electrode is proposed. The application of this mini sensor using a low cost electrochemical cell for in loco voltammetric determinations of inorganic and organic analytes is also described.
mini sensor; bismuth film electrode; environmental samples
mini sensor; bismuth film electrode; environmental samples
NOTA TÉCNICA
Construção e aplicação de um minissensor de filme de bismuto utilizando materiais de baixo custo para determinações voltamétricas in loco
Construction and application of a bismuth-film mini sensor using low cost materials for in loco voltammetric determinations
Luiz Carlos S. Figueiredo-FilhoI; Bruno C. JanegitzI; Ronaldo C. FariaI; Orlando Fatibello-FilhoI, * * e-mail: bello@ufscar.br † In Memoriam ; Luiz H. Marcolino-JuniorII; Fabio Roberto CaetanoII; Ivanildo Luiz de MattosIII,† * e-mail: bello@ufscar.br † In Memoriam
IDepartamento de Química, Universidade Federal de São Carlos, CP 676, 13560-970 São Carlos SP, Brasil
IIDepartamento de Química, Universidade Federal do Paraná, CP 19081, 81531-990 Curitiba - PR, Brasil
IIIDepartamento de Química de Los Materiales, Facultad de Química y Biología, Universidad de Santiago de Chile, 917-009 Santiago, Chile
ABSTRACT
The construction of a low cost mini sensor containing a bismuth-film electrode (BiFE), as work electrode, a silver electrode as pseudo reference electrode, and copper as counter electrode is proposed. The application of this mini sensor using a low cost electrochemical cell for in loco voltammetric determinations of inorganic and organic analytes is also described.
Keywords: mini sensor; bismuth film electrode; environmental samples.
INTRODUÇÃO
Os eletrodos de mercúrio (DME - Dropping Mercury Electrode, HMDE - Hanging Mercury Drop Electrode, MFE - Mercury Film Electrode entre outros) apresentam um comportamento eletroquímico bem conhecido e definido, com elevado sobrepotencial de hidrogênio, boa estabilidade e reprodutibilidade.1 Apesar disso, devido à alta toxicidade do mercúrio, diversas alternativas têm sido propostas a fim de substituir estes eletrodos por outros de menor toxicidade.1-3 Desta maneira, vários materiais eletródicos como cobre, ouro, irídio, rutênio, bismuto, antimônio, pasta e compósitos à base de carbono, entre outros, vêm sendo investigados para serem aplicados como eletrodos sólidos em substituição aos eletrodos de mercúrio.2
A principal característica desejável para estes materiais é que apresentem um desempenho melhor ou semelhante ao eletrodo de mercúrio, principalmente quanto a sua robustez e intervalo de potencial negativo de trabalho.2,4 Nesse sentido, o uso do eletrodo de filme de bismuto (BiFE - Bismuth Film Electrode) surgiu como uma alternativa viável desde o seu emprego pioneiro em 2000.2
Os eletrodos de filme de bismuto,5 além de serem materiais ambientalmente amigáveis e com amplo intervalo de potencial negativo de trabalho, apresentam baixas correntes capacitivas. Outrossim, apresentam boa precisão, boa reprodutibilidade dos filmes formados, melhor sensibilidade e seletividade para diversos cátions metálicos.6 Outra característica dos BiFEs, de alta relevância, é não responderem ao oxigênio, podendo ser aplicados em determinações in loco, uma vez que não há a necessidade de se utilizar nitrogênio para a desoxigenação da solução.
Wang e colaboradores2 foram os primeiros a utilizar o eletrodo de filme de bismuto em substituição ao eletrodo de mercúrio. Neste trabalho, o filme de bismuto foi eletrodepositado in situ sobre a superfície de um eletrodo de carbono vítreo para a determinação de Pb(II) e Cd(II) por voltametria de redissolução anódica, apresentando limites de detecção de 1,1 e 0,3 µg L1 para Pb(II) e Cd(II), respectivamente.
Os trabalhos recentes na literatura relatam o uso de BiFEs principalmente para a determinação de metais,7-14 como a determinação de Zn(II) em amostras de secreção de pâncreas,15 especiação de Sb(III) e Sb(V) em águas naturais16 e Pb(II) e Zn(II) em cabelo humano.9 Além disso, a determinação de pesticidas,17 aditivos em alimentos18 e outros analitos orgânicos utilizando BiFEs também foi descrita.19,20
Há uma tendência recente em se construir e aplicar eletrodos descartáveis de baixo custo, em substituição aos eletrodos sólidos, uma vez que muitos deles apresentam como desvantagem uma grande dificuldade da renovação e reprodução de sua superfície, além da dificuldade da aplicação em determinações in loco com emprego de potenciostatos portáteis. Adaptações no tamanho e arranjo dos eletrodos permitem a sua utilização, oferecendo ao operador não só instrumentos mais econômicos, com respostas sensíveis e seletivas, mas também facilidade de uso e simplicidade na medida da resposta.
Dentro deste contexto, o desenvolvimento de eletrodos impressos (EI) surge como uma alternativa interessante, pois são projetados com grande simplicidade e economia na forma de um arranjo de eletrodos, no qual os eletrodos de trabalho, auxiliar e referência são impressos no mesmo suporte. São dispositivos de baixo custo e tão funcionais que permitem a comercialização na forma de sensores descartáveis. Como consequência, têm mostrado alta versatilidade de aplicações, tanto na forma de eletrodo convencional, quanto na forma de eletrodo modificado.21-33 Ademais, dependendo da aplicação, esses eletrodos podem ser empregados muitas vezes, barateando ainda mais o custo das determinações analíticas.
Como notória aplicação e versatilidade deste tipo de dispositivo, pode-se destacar o trabalho publicado recentemente por Yang e colaboradores,34 no qual eletrodos impressos foram colocados em elásticos de roupas íntimas (cuecas) permitindo medir as concentrações de NADH e H2O2 por amperometria e, assim, correlacionar a concentração destas espécies com o nível de estresse da pessoa. Essa peça de roupa, apesar de inusitada, foi escolhida pelo fato do elástico proporcionar um contato direto entre a pele humana e os sensores. Concentrações na ordem de 0-100 µmol L1 para NADH responderam linearmente à variação de corrente. Os estudos relatados ainda estão em fase de caracterização eletroquímica dos EIs, mas apontam para o desenvolvimento de dispositivos para o monitoramento de espécies biológicas de forma não invasiva.
Outra aplicação interessante de dispositivos descartáveis utilizados como sensores eletroquímicos é a construção de eletrodos sólidos de ouro ou prata a partir de CD-Rs (Compact Disc - Recordable) desenvolvidos pelo Prof. Angnes e colaboradores.21,30,35-38 CD-Rs possuem em sua constituição uma película metálica de ouro ou prata que, de forma adequada, são expostas e transformadas em eletrodos sólidos destes metais. A aplicação destes dispositivos já foi relatada em diversos trabalhos, tanto para a quantificação de traços de metais35,36 como para a análise de fármacos.37,38
Sendo assim, propõe-se a construção de um minissensor descartável a partir de placas contendo filme de cobre,39-42 utilizadas para a confecção de circuitos impressos, como substrato para a eletrodeposição de bismuto (eletrodo de trabalho) e prata (pseudorreferência) para determinações in loco de Pb(II) e Paraquat em águas naturais utilizando um potenciostato portátil.
PARTE EXPERIMENTAL
Reagentes e equipamentos
Todos os reagentes utilizados foram de grau analítico e a água foi obtida de sistema MilliQ, mod. UV plus ultra-low organics water da Millipore, com resistividade igual ou superior a 18,2 MΩ cm.
As medidas eletroquímicas foram realizadas em um potenciostato/galvanostato Palm Sens (Palm Instruments BV) gerenciado pelo programa computacional Palm Sens PC.
Construção da base do minissensor sobre placa de cobre
A primeira etapa desenvolvida para a construção do minissensor foi definir a disposição dos eletrodos e as áreas a serem recobertas pelo bismuto (eletrodo de trabalho) e pela prata (eletrodo de pseudorreferência). O eletrodo auxiliar (contraeletrodo) utilizado foi o próprio substrato de cobre, uma vez que não apresentou nenhuma interferência nas medidas realizadas.
Com o objetivo de desenvolver um arranjo que pudesse ser facilmente reproduzido, de forma a obter áreas recobertas por bismuto e prata o mais reprodutível possível, foi utilizada uma impressora a laser para a impressão do arranjo de eletrodos sobre papel decalque e posterior transferência para a placa de cobre. Um arranjo de três eletrodos foi confeccionado no programa Corel Draw X4® e impresso em papel decalque. As etapas referentes à construção do minissensor são apresentadas na Figura 1 e seguem as seguintes sequências: impressão do desenho em papel decalque utilizando uma impressora HP LaserJet 1300; limpeza do cobre da placa utilizada para circuitos impressos com água deionizada e posteriormente com acetona, para a eliminação de gordura; transferência do desenho para a placa por aquecimento a 120 ºC durante 240 s, com o auxílio de uma prensa térmica Mogk modelo PTM 30; remoção química do cobre não recoberto pela tinta da impressora por meio da imersão da placa em uma solução de cloreto férrico 0,50 mol L1 em meio de HCl 0,10 mol L1 durante 15-20 min; lavagem da placa com água deionizada e, posteriormente, com acetona para a remoção da tinta; recorte da placa para obtenção dos eletrodos utilizando uma miniretífica (Ferrari Modelo MR).
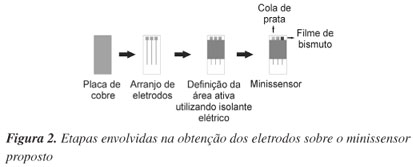
Após a realização das etapas supracitadas e a obtenção dos minissensores individuais, foram realizadas as etapas finais que incluíram a limitação das áreas expostas dos eletrodos e posterior recobrimento com cola de prata e bismuto dos eletrodos de referência e de trabalho, respectivamente. Como pode ser observado na Figura 2, há na extremidade superior do minissensor três quadrados com 4,0 mm2 de área, seguidos cada um, com três trilhas de aproximadamente 20 mm de comprimento e 1 mm de largura. Utilizando esmalte para unhas, que age aqui como um isolante elétrico, recobriu-se parte do minissensor de modo que somente a área inferior apresentasse 10 mm com cobre exposto (para posterior contato elétrico entre o sensor e o potenciostato) e a parte superior somente os três quadrados de 4,0 mm2 de área. Para uma aplicação do esmalte de forma eficiente, as áreas que deveriam permanecer com cobre exposto foram recobertas com fita adesiva e, então, foi aplicado o isolante delimitando as áreas a serem recobertas por cobre e cola de prata, como também o contato elétrico para conexão com o potenciostato. Após esta etapa, o minissensor foi limpo com álcool etílico para a eliminação de possíveis resquícios da cola presente na fita adesiva.
Preparo do eletrodo de pseudorreferência de prata do minissensor
O eletrodo de pseudorreferência de prata foi construído utilizando-se cola de prata da Electron Microscopy Sciences (Industry Road, Hatfield, PA.) que é composta por duas substâncias, Bright Silver Epoxy (BSE) e Gray Silver Hardener (GSH). Para a formação desta realizou-se a mistura e homogeneização manual da BSE e GSH e após o processo de pré-cura (cerca de 4 h) efetuou-se a aplicação sobre a área exposta do cobre, adequadamente delimitada com o auxílio de fita isolante. Após a aplicação na superfície de cobre um tempo de 24 h foi utilizado para a cura da cola de prata.
Eletrodeposição de filme de bismuto para construção do eletrodo de trabalho no minissensor
Para realizar a eletrodeposição do bismuto no minissensor, somente uma extremidade referente ao eletrodo de trabalho foi conectada ao potenciostato. Desta forma, apesar dos outros eletrodos (outras áreas) estarem imersos na solução de Bi(NO3)3 0,050 mol L1, HCl 1,0 mol L1 e citrato de sódio 0,15 mol L1, somente àquele conectado ao potenciostato foi aplicado um potencial de 0,18 V vs. Ag/AgCl (KCl 3,0 mol L1) durante 200 s utilizando eletrodos convencionais de referência e auxiliar, Ag/AgCl e de Pt, respectivamente, recobrindo a citada área com o filme de bismuto.17
A Figura 2 esquematiza o processo de obtenção do minissensor proposto.
Para a utilização do minissensor foi necessária a construção de um dispositivo que pudesse conectar o minissensor e o potenciostato. Este dispositivo necessitava ser suficientemente pequeno para que a proposta de construção de um sensor em miniatura continuasse sendo válida. Desta forma, utilizaram-se como materiais de baixo custo e de fácil acesso cabo de conexão de impressora tipo TT, pinos de contato do tipo banana e fios de cobre para a construção do dispositivo representado na Figura 3A.
Para as medidas voltamétricas utilizando-se o minissensor, uma célula eletroquímica foi construída, como mostrado na Figura 3B. Para este fim, se utilizaram frascos plásticos com capacidade para 5 mL, comercialmente encontrados para armazenar tintas do tipo guache. Após a limpeza do frasco, realizou-se um corte na tampa do mesmo para a introdução do minissensor e fixação do dispositivo de conexão com o potenciostato.
RESULTADOS E DISCUSSÃO
Aplicação do minissensor
O minissensor proposto foi utilizado em estudos preliminares para avaliar sua potencialidade na determinação de um cátion metálico e um herbicida de alta toxicidade. Na Figura 4, podem ser observados os voltamogramas obtidos para três diferentes concentrações de Pb(II) 1,2 × 106, 3,8 × 106 e 6,2 × 106 mol L1 utilizando a técnica de voltametria de onda quadrada de redissolução anódica (Figura 4A). Nesta determinação foi utilizada uma frequência de 50 Hz; amplitude de 25 mV, incremento de varredura de 5 mV, um tempo de pré-concentração de 90 s e um potencial de pré-concentração de 1,0 V. O eletrólito suporte utilizado foi o tampão acetato 0,10 mol L1 (pH 4,5). Também foram realizadas medidas voltamétricas sob as mesmas condições (exceto tempo e potencial de pré-concentração) citadas acima para a medida do pesticida Paraquat em três diferentes concentrações (1,9 × 106; 4,2 × 106 e 6,5 × 106 mol L1), como apresentadas na Figura 4B. Na determinação de Pb(II) e Paraquat, foram obtidos os limites de detecção de 3,3 × 10-7 e 1,2 × 10-8 mol L1 e limites de quantificação de 1,1 × 10-6 e 5,4 × 10-8 mol L-1 para uma faixa linear de 1,3 × 10-6 a 1,3 × 10-5 e 6,6 × 10-8 a 3,9 × 10-6 mol L1, respectivamente.
Nos estudos de reprodutibilidade do eletrodo de filme de bismuto na presença de íons Pb(II) e Paraquat, utilizaram-se três diferentes eletrodos com a mesma área geométrica (4,0 mm2) realizando-se medidas em triplicata para uma concentração de Pb(II) 1,0 × 105 mol L1 e Paraquat 6,5 × 106 mol L1, respectivamente. O desvio padrão relativo (RSD) obtido foi menor do que 5% para ambos os analitos. Estudou-se também a repetibilidade do eletrodo realizando-se diversas medidas utilizando-se um mesmo eletrodo imerso na solução contendo ambos os analitos (íons Pb(II) ou Paraquat). Após o uso contínuo do eletrodo, sem a renovação da superfície, obtiveram-se desvios padrão relativos de 1,8 e 2,4% (n = 10) para soluções de Pb(II) 1,0 × 105 mol L1 e Paraquat 6,5 × 106 mol L1, respectivamente.
O emprego do eletrodo de cobre como eletrodo auxiliar é pouco usual em função de suas propriedades redox. No entanto, existem algumas situações em que o mesmo pode ser empregado, como é o caso de eletrodos impressos (descartáveis). Analisando-se o diagrama de Pourbaix43 para o sistema cobre-água é possível discutir o que se segue.
Conforme pode ser observado neste diagrama, em valores de pH igual ou maior do que 6 e valores positivos de potencial, há a formação de diversos óxidos sobre o eletrodo de cobre metálico (contraeletrodo), ocorrendo assim mudanças na superfície do eletrodo, podendo até mesmo ocorrer a passivação do mesmo. Nestas situações, o emprego do eletrodo seria possível após estabilização de sua superfície.
Por outro lado, quando em meio ácido, o cobre metálico é oxidado diretamente a íons Cu(II), que são liberados em solução. Dessa forma, não há uma mudança estrutural na superfície do eletrodo, mas sim diminuição desprezível de sua área ativa por conta do consumo de cobre metálico.
Como a proposta do presente trabalho foi a fabricação de um eletrodo descartável, o número de medidas realizadas com cada dispositivo não é suficiente para que haja um consumo significativo do eletrodo auxiliar (15 medidas, pois após esse número de determinações o filme de bismuto começa a apresentar erros superiores a 5%), o que viabiliza o seu uso conforme discutido aqui. Vale lembrar porém, que por conta do consumo do eletrodo auxiliar, fica inviabilizada a possibilidade de determinação de íons Cu(II) utilizando este dispositivo, já que geraria uma séria interferência nas medidas eletroquímicas.
CONCLUSÕES
O eletrodo de filme de bismuto depositado sobre o minissensor proveniente de placas de circuito impresso de cobre, conforme proposto no presente trabalho, mostrou-se de fácil construção e com resultados bastante satisfatórios para a determinação de Pb(II) e Paraquat. Tanto o minissensor quanto o sistema de conexão e a célula eletroquímica propostos são de baixo custo, sendo ótima alternativa para a realização de análises em campo de substâncias orgânicas e cátions metálicos com o auxílio de um potenciostato portátil.
AGRADECIMENTOS
À FAPESP (processos 2008/07529-9, 2008/09893-0, 2007/04515-4 e 2010/20754-1), CNPq, CAPES e ao Programa de Mobilidade Acadêmica-Escala de Docentes (AUGM) pelo suporte financeiro.
Recebido em 2/6/11
Aceito em 2/12/11
Publicado na web em 31/1/12
- 1. Economou, A.; Fielden, P. R.; Analyst 2003, 128, 205.
- 2. Wang, J.; Lu, J. M.; Hocevar, S. B.; Farias, P. A. M.; Ogorevc, B.; Anal. Chem. 2000, 72, 3218.
- 3. Janegitz, B. C.; Marcolino-Junior, L. H.; Campana-Filho, S. P.; Faria, R. C.; Fatibello-Filho, O.; Sens. Actuators, B 2009, 142, 260.
- 4. Legeai, S.; Vittori, O.; Anal. Chim. Acta 2006, 560, 184.
- 5. Svancara, I.; Prior, C.; Hocevar, S. B.; Wang, J.; Electroanalysis 2010, 22, 1405.
- 6. Krasnodebska-Ostrega, B.; Paldyna, J.; Golimowski, J.; Kania, M.; Chem. Anal. 2009, 54, 109.
- 7. Krolicka, A.; Pauliukaite, R.; Svancara, I.; Metelka, R.; Bobrowski, A.; Norkus, E.; Kalcher, K.; Vytras, K.; Electrochem. Commun. 2002, 4, 193.
- 8. Krolicka, A.; Bobrowski, A.; Kalcher, K.; Mocak, J.; Svancara, I.; Vytras, K.; Electroanalysis 2003, 15, 1859.
- 9. Kefala, G.; Economou, A.; Voulgaropoulos, A.; Sofoniou, M.; Talanta 2003, 61, 603.
- 10. Hutton, E. A.; Hocevar, S. B.; Ogorevc, B.; Anal. Chim. Acta 2005, 537, 285.
- 11. Legeai, S.; Soropogui, K.; Cretinon, M.; Vittori, O.; De Oliveira, A. H.; Barbier, F.; Grenier-Loustalot, M. F.; Anal. Bioanal. Chem. 2005, 383, 839.
- 12. Legeai, S.; Bois, S.; Vittori, O.; J. Electroanal. Chem. 2006, 591, 93.
- 13. Charalambous, A.; Economou, A.; Anal. Chim. Acta 2005, 547, 53.
- 14. Hutton, E. A.; Hocevar, S. B.; Mauko, L.; Ogorevc, B.; Anal. Chim. Acta 2006, 580, 244.
- 15. Maghasi, A. T.; Halsall, H. B.; Heineman, W. R.; Rilo, H. L. R.; Anal. Biochem. 2004, 326, 183.
- 16. Zong, P.; Nagaosa, Y.; Microchim. Acta 2009, 166, 139.
- 17. de Figueiredo-Filho, L. C. S.; dos Santos, V. B.; Janegitz, B. C.; Guerreiro, T. B.; Fatibello-Filho, O.; Faria, R. C.; Marcolino-Junior, L. H.; Electroanalysis 2010, 22, 1260.
- 18. Xie, X. Y.; Luo, H. Q.; Li, N. B.; J. Electroanal. Chem. 2010, 639, 175.
- 19. Du, D.; Ye, X.; Zhang, J.; Liu, D.; Electrochim. Acta 2008, 53, 4478.
- 20. Zhang, W.; Tang, H.; Geng, P.; Wang, Q. H.; Jin, L. T.; Wu, Z. R.; Electrochem. Commun. 2007, 9, 833.
- 21. Richter, E. M.; de Jesus, D. P.; Neves, C. A.; do Lago, C. L.; Angnes, L.; Quim. Nova 2003, 26, 839.
- 22. Choudhry, N. A.; Banks, C. E.; Analytical Methods 2011, 3, 74.
- 23. Crew, A.; Lonsdale, D.; Byrd, N.; Pittson, R.; Hart, J. P.; Biosens. Bioelectron. 2011, 26, 2847.
- 24. Frag, E. Y. Z.; Mohamed, G. G.; El-Dien, F. A. N.; Mohamed, M. E.; Analyst 2011, 136, 332.
- 25. Bergamini, M. F.; Santos, D. P.; Zanoni, M. V. B.; Bioelectrochemistry 2010, 77, 133.
- 26. Khairy, M.; Kampouris, D. K.; Kadara, R. O.; Banks, C. E.; Electroanalysis 2010, 22, 2496.
- 27. Somerset, V. S.; Hernandez, L. H.; Iwuoha, E. I.; J. Environ. Sci. Health Part A-Toxic/Hazard. Subst. Environ. Eng. 2011, 46, 17.
- 28. Honeychurch, K. C.; Hart, J. P.; TrAC - Trends Anal. Chem. 2003, 22, 456.
- 29. Laschi, S.; Palchetti, I.; Mascini, M.; Sens. Actuators, B 2006, 114, 460.
- 30. Nascimento, V. B.; Angnes, L.; Quim. Nova 1998, 21, 614.
- 31. Merkoci, A.; Marcolino-Junior, L. H.; Marin, S.; Fatibello-Filho, O.; Alegret, S.; Nanotechnology 2007, 18, 035502.
- 32. Bergamini, M. F.; Santos, D. P.; Zanoni, M. V. B.; J. Braz. Chem. Soc 2009, 20, 100.
- 33. Safina, G.; Ludwig, R.; Gorton, L.; Electrochim. Acta 2010, 55, 7690.
- 34. Yang, Y. L.; Chuang, M. C.; Lou, S. L.; Wang, J.; Analyst 2010, 135, 1230.
- 35. Angnes, L.; Richter, E. M.; Augelli, M. A.; Kume, G. H.; Anal. Chem. 2000, 72, 5503.
- 36. Richter, E. M.; Augelli, M. A.; Magarotto, S.; Angnes, L.; Electroanalysis 2001, 13, 760.
- 37. Munoz, R. A. A.; Matos, R. C.; Angnes, L.; Talanta 2001, 55, 855.
- 38. Munoz, R. A. A.; Matos, R. C.; Angnes, L.; J. Pharm. Sci. 2001, 90, 1972.
- 39. Shih, Y.; Zen, J. M.; Kumar, A. S.; Huang, Y. N.; Bull. Chem. Soc. Jpn. 2005, 78, 864.
- 40. Limbut, W.; Thavarungkul, P.; Kanatharana, P.; Wongkittisuksa, B.; Asawatreratanakul, P.; Limsakul, C.; Electrochim. Acta 2010, 55, 3268.
- 41. Gamboa, J. C. M.; Pena, R. C.; Paixao, T.; Bertotti, M.; Talanta 2009, 80, 581.
- 42. Novakowski, W.; Bertotti, M.; Paixao, T.; Microchem J. 2011, 99, 145.
- 43. Pourbaix, M.; Atlas of Electrochemical Equilibria in Aqueous Solutions, 2nd ed., NACE: Houston, 1974.
Datas de Publicação
-
Publicação nesta coleção
02 Jul 2012 -
Data do Fascículo
2012
Histórico
-
Recebido
02 Jun 2011 -
Aceito
02 Dez 2011