Resumos
Compostos secundários presentes em plantas medicinais podem desempenhar funções importantes em interações planta-patógeno, através de ação antimicrobiana direta ou ativando mecanismos de defesa de outras plantas que venham a ser tratadas com esses compostos. Com o objetivo de verificar o potencial de eucalipto (Eucalyptus citriodora) no controle alternativo de antracnose em pepino (Cucumus sativus), extrato aquoso (EA) desta essência florestal, autoclavado ou não autoclavado, nas concentrações de 0,1, 1, 5, 10, 15, 20 e 25% foi utilizado nos seguintes ensaios: indução de fitoalexinas em mesocótilos estiolados de sorgo (Sorghum bicolor) e em cotilédones de soja (Glycine max); fungitoxicidade in vitro sobre conídios de Colletotricum lagenarium; indução de resistência local ou sistêmica em plantas de pepino. Água e Bion foram utilizados como tratamentos controle. Os resultados indicaram que os EAs autoclavados e não autoclavados induziram a síntese de fitoalexinas em sorgo a partir da concentração de 1%. Em soja ocorreu síntese de gliceolina a partir de 10% e 15% dos EAs autoclavados e não autoclavados, respectivamente. Houve inibição total na germinação de esporos e formação de apressórios de C. lagenarium em concentrações de 20% e 1% do EA autoclavado, respectivamente. Para o extrato não autoclavado houve 75% de inibição da germinação de esporos em 25% do EA e inibição total da formação de apressórios em 15% do EA. Baseado no parâmetro tamanho de lesão, o extrato aquoso de E. citriodora, não autoclavado, apresenta potencial para induzir resistência local em pepino contra C. lagenarium.
gliceolina; deoxiantocianidinas; resistência induzida
Secondary compounds present in medicinal plants can play important roles in plant-pathogen interactions, through immediate antimicrobial action or by inducing a defence mechanism in other plants that may be treated with such compounds. With the objective of verifying the potential of Eucalyptus citriodora in the alternative control of anthracnose in cucumber (Cucumus sativus), aqueous extract (AE) of this forest essence, autoclaved or unautoclaved, in concentrations of 0,1, 1, 5, 10, 15, 20 e 25% was used in the following experiments: induction of phytoalexins in sorghum (Sorghum bicolor) etiolated mesocotyls and soybean (Glycine max) cotyledons; fungitoxicity in vitro against Colletotrichum lagenarium conidia; local or systemic induction of resistance in cucumber plants. Water and Bion were used as control treatments. The results indicated that the autoclaved and unautoclaved AE induced phytoalexin synthesis in sorghum starting from the concentration of 1%. In soybean, gliceollin synthesis took place in 10% and 15% of the autoclaved and unautoclaved AEs, respectively. There was total inhibition in the spores germination and apressoria formation in concentrations of 20% and 1% of the autoclaved AE, respectively. As for the unautoclaved extract, there was 75% inhibition of the spores germination in 25% of AE and total inhibition in the apressoria formation in 15% of AE. Based on the parameter size of lesion, the unautoclaved aqueous extract of E. citriodora could potentially induce local resistance in cucumber against C. lagenarium.
ARTIGOS ARTICLES
Fungitoxicidade, atividade elicitora de fitoalexinas e proteção de pepino contra Colletotrichum lagenarium, pelo extrato aquoso de Eucalyptus citriodora* * Parte da Dissertação de Mestrado do primeiro autor. Universidade Estadual de Maring[a (2001)
Fungitoxicity, phytoalexins elicitor activity and protection of cucumber against Colletotrichum lagenarium, by Eucalyptus citriodora aqueous extract
Solange M. BonaldoI, ** ** Bolsista CNPq. ; Kátia R. F. Schwan-EstradaII; José R. StangarlinIII; Dauri J. TessmannII; Carlos A. ScapimII
IDepartamento de Entomologia, Fitopatologia e Zoologia Agrícola, ESALQ/USP, Cx. Postal 9, CEP 13418-900, Piracicaba, SP, e-mail: sbonaldo@esalq.usp.br
IIUniversidade Estadual de Maringá/UEM, Departamento de Agronomia, Avenida Colombo, 5790, CEP 87020-900, Maringá, PR
IIIUniversidade Estadual do Oeste do Paraná/UNIOESTE, Centro de Ciências Agrárias, Rua Pernambuco, 1777, Cx. Postal 91, CEP 85960-000, Marechal Cândido Rondon, PR
RESUMO
Compostos secundários presentes em plantas medicinais podem desempenhar funções importantes em interações planta-patógeno, através de ação antimicrobiana direta ou ativando mecanismos de defesa de outras plantas que venham a ser tratadas com esses compostos. Com o objetivo de verificar o potencial de eucalipto (Eucalyptus citriodora) no controle alternativo de antracnose em pepino (Cucumus sativus), extrato aquoso (EA) desta essência florestal, autoclavado ou não autoclavado, nas concentrações de 0,1, 1, 5, 10, 15, 20 e 25% foi utilizado nos seguintes ensaios: indução de fitoalexinas em mesocótilos estiolados de sorgo (Sorghum bicolor) e em cotilédones de soja (Glycine max); fungitoxicidade in vitro sobre conídios de Colletotricum lagenarium; indução de resistência local ou sistêmica em plantas de pepino. Água e Bion foram utilizados como tratamentos controle. Os resultados indicaram que os EAs autoclavados e não autoclavados induziram a síntese de fitoalexinas em sorgo a partir da concentração de 1%. Em soja ocorreu síntese de gliceolina a partir de 10% e 15% dos EAs autoclavados e não autoclavados, respectivamente. Houve inibição total na germinação de esporos e formação de apressórios de C. lagenarium em concentrações de 20% e 1% do EA autoclavado, respectivamente. Para o extrato não autoclavado houve 75% de inibição da germinação de esporos em 25% do EA e inibição total da formação de apressórios em 15% do EA. Baseado no parâmetro tamanho de lesão, o extrato aquoso de E. citriodora, não autoclavado, apresenta potencial para induzir resistência local em pepino contra C. lagenarium.
Palavras-chave adicionais: gliceolina, deoxiantocianidinas, resistência induzida.
ABSTRACT
Secondary compounds present in medicinal plants can play important roles in plant-pathogen interactions, through immediate antimicrobial action or by inducing a defence mechanism in other plants that may be treated with such compounds. With the objective of verifying the potential of Eucalyptus citriodora in the alternative control of anthracnose in cucumber (Cucumus sativus), aqueous extract (AE) of this forest essence, autoclaved or unautoclaved, in concentrations of 0,1, 1, 5, 10, 15, 20 e 25% was used in the following experiments: induction of phytoalexins in sorghum (Sorghum bicolor) etiolated mesocotyls and soybean (Glycine max) cotyledons; fungitoxicity in vitro against Colletotrichum lagenarium conidia; local or systemic induction of resistance in cucumber plants. Water and Bion were used as control treatments. The results indicated that the autoclaved and unautoclaved AE induced phytoalexin synthesis in sorghum starting from the concentration of 1%. In soybean, gliceollin synthesis took place in 10% and 15% of the autoclaved and unautoclaved AEs, respectively. There was total inhibition in the spores germination and apressoria formation in concentrations of 20% and 1% of the autoclaved AE, respectively. As for the unautoclaved extract, there was 75% inhibition of the spores germination in 25% of AE and total inhibition in the apressoria formation in 15% of AE. Based on the parameter size of lesion, the unautoclaved aqueous extract of E. citriodora could potentially induce local resistance in cucumber against C. lagenarium.
INTRODUÇÃO
A agricultura moderna tem aumentado tanto sua potencialidade de produção, quanto a aplicação de produtos tóxicos para o controle de pragas e doenças de plantas. O uso indiscriminado de fungicidas tem causado danos ao meio ambiente, aos seres vivos e tem favorecido a seleção de raças resistentes de patógenos a estas substâncias químicas (Ghini & Kimati, 2000). Termos como "agricultura sustentável" ou "agricultura alternativa" presumem expressão política (Zadoks, 1992), estimulando a busca por novas medidas de proteção das plantas contra as doenças. Um dos enfoques da agricultura alternativa é o controle alternativo de doenças, o qual inclui o controle biológico e a indução de resistência em plantas (Bettiol, 1991).
O controle biológico pode ser definido como o controle de um microrganismo através da ação direta de outro microrganismo, o qual pode atuar por meio de antibiose, parasitismo, competição, predação ou hipovirulência (Cook & Baker, 1983). A resistência induzida, envolve a ativação dos mecanismos latentes de resistência de uma planta (Hammerschmidt & Dann, 1997), que pode ser obtida pelo tratamento com agentes bióticos, como microrganismos viáveis ou inativados (Stangarlin & Pascholati, 1994) ou abióticos, como ácido salicílico (Hammerschmidt & Dann, 1997), ácido aminobutírico e ácido 2,6-dicloroisonicotínico (Hijwegnwn et al., 1996) e benzotiadiazólicos (Friedrich et al., 1996). A resposta das plantas pode ser, por exemplo, o acúmulo de fitoalexinas e de proteínas relacionadas à patogênese (Pascholati, 1998). Segundo Smith (1996), elicitores são moléculas de origem bióticas ou abióticas capazes de estimular qualquer resposta de defesa nas plantas. Os elicitores bióticos compreendem moléculas como oligossacarídeos, glicoproteínas, oligopeptídeos e ácidos graxos e os elicitores abióticos são representados por metais pesados (HgCl2) e luz ultravioleta, entre outros (Pascholati & Leite, 1995). A variada natureza química dos elicitores demonstra que não há uma característica estrutural única que determine a atividade elicitora.
A indústria de defensivos tem desenvolvido moléculas capazes de protegerem uma cultura contra os patógenos causadores de doenças apenas pela indução de mecanismos de defesa da planta (Zadoks, 1997). Diversos trabalhos mostram o potencial de plantas medicinais no controle de fitopatógenos, tanto por sua ação fungitóxica direta, inibindo o crescimento micelial e a germinação de esporos, quanto pela capacidade de induzir o acúmulo de fitoalexinas (Schwan-Estrada et al., 1997; Stangarlin et al., 1999), indicando a presença de moléculas com característica elicitora.
A planta medicinal eucalipto (Eucalyptus citriodora Hooker M.) possui na sua composição química compostos secundários como o citronelol (aproximadamente 85%), geraniol, isopulegol, a e b pineno, cineol, guaiol, estragol, g-elemento, nopineno, canfeno, mirceno e b-cimeno (Costa, 1986). O entendimento das propriedades antimicrobianas e/ou elicitoras dos compostos secundários presentes nessa planta medicinal podem contribuir para a aquisição de novas técnicas de controle de doenças de plantas.
Diante do exposto, o presente trabalho foi desenvolvido com o objetivo de verificar o potencial de extrato aquoso de eucalipto em inibir a germinação de esporos e a formação de apressórios de Colletotrichum lagenarium (Pass.) Ells & Halst; induzir a síntese de fitoalexinas em bioensaio com mesocótilos de sorgo (Sorghum bicolor L.) e cotilédones de soja [Glycine max (L.) Merril] e induzir resistência em plantas de pepino (Cucumis sativus L.) contra o patógeno C. lagenarium, agente causal da antracnose.
MATERIAL E MÉTODOS
Planta medicinal e obtenção do extrato aquoso
Para a obtenção do extrato aquoso com 25, 20, 15, 10, 5, 1 e 0,1% (p/v) de material vegetal, folhas frescas de E. citriodora foram coletadas e trituradas em liqüidificador com água destilada. Este extrato aquoso foi então passado em gaze e filtrado em funil de porcelana, utilizando-se papel de filtro Whatman no 41. Em seguida, o material foi esterilizado em filtro Millipore utilizando-se membrana com poros de 0,22 µm de diâmetro. O extrato aquoso obtido foi utilizado de duas formas: autoclavado (120 °C, 1 atm por 20 min) e não autoclavado, com o objetivo de avaliar o efeito do tratamento térmico sobre o extrato aquoso.
Produção de fitoalexinas em mesocótilos de sorgo
Neste bioensaio foram utilizadas sementes de sorgo, cultivar Brandes, que foram desinfetadas em hipoclorito de sódio 1% (15 min), lavadas em água destilada, enroladas em folhas de papel de germinação umedecidas com água e incubadas em escuro a 28 °C por quatro dias. As plântulas formadas foram expostas à luz por 4 h para paralisar a elongação dos mesocótilos (Nicholson et al., 1988; Yamaoka et al., 1990). Os mesocótilos obtidos foram excisados 0,5 cm acima do nó escutelar e colocados em tubos de ensaio (1,2 cm de diâmetro x 10 cm de altura) (três mesocótilos/tubo) contendo 1 ml de cada concentração do extrato aquoso de E. citriodora, autoclavado ou não autoclavado. Como testemunhas foram utilizados água destilada esterilizada e o ativador de defesa vegetal Bion (200 ppm do produto comercial) (Osswald et al., 1998). Os tubos de ensaio, abertos, foram colocados numa cuba de vidro e mantidos em câmara úmida, a 25 °C sob luz fluorescente (Wulff & Pascholati, 1999). Após 60 h, os mesocótilos foram retirados dos tubos e os 5 mm basais de cada mesocótilo foi excisado e descartado. A porção superior (2,5 cm) foi pesada, cortada em pequenos segmentos e colocada em tubos para microcentrífuga contendo 1,4 ml de metanol 80% acidificado (0,1% HCl; v/v). Os mesocótilos cortados foram mantidos a 4 °C no metanol por 96 h para extração dos pigmentos e a absorbância determinada a 480 nm (Nicholson et al., 1987, 1988).
Produção de fitoalexinas em cotilédones de soja
Sementes de soja da cultivar IAC-8 foram plantadas em areia esterilizada e mantidas em casa-de-vegetação. Após dez dias, os cotilédones foram destacados das plântulas, lavados em água destilada, enxugados e cortados em secção aproximada de 1 mm de espessura e 6 mm de diâmetro a partir da superfície inferior. Cinco cotilédones foram colocados em placa de Petri contendo papel de filtro umedecido com água destilada estéril. Aplicou-se sobre cada cotilédone uma alíquota de 75 µl de cada concentração de extrato aquoso de E. citriodora, autoclavado ou não-autoclavado, e de água esterilizada (controle). As placas de Petri foram mantidas a 25 °C e escuro. Após 20 h, os cotilédones foram transferidos para tubos de ensaio contendo 15 ml de água destilada esterilizada e deixados em agitação por 1 h para extração da fitoalexina formada. A absorbância foi determinada a 285 nm (Ayers et al., 1976; Ziegler e Pontzen, 1982).
Atividade antifúngica
Uma alíquota de 40 µl da suspensão de esporos (1,15 x 105 conídios/ml) e outra de 40 µl de cada concentração de extrato aquoso de E. citriodora, autoclavado ou não autoclavado, foram colocadas em cada um dos recipientes ("pocinhos") de uma placa usada em teste de ELISA (Regente et al., 1997). Como testemunha foi utilizada água destilada esterilizada. As placas foram incubadas sob luz constante a 25 °C, sendo a porcentagem de germinação e formação de apressórios determinada 20 h após o início do experimento, através do emprego de 20 µl do corante azul algodão de lactofenol, utilizado para paralisar a germinação. A avaliação foi realizada através da observação ao microscópio ótico com aumento de 400 vezes. Contaram-se 100 esporos por repetição, totalizando 800 esporos por tratamento. Foram considerados como esporos germinados aqueles que apresentaram qualquer emissão do tubo germinativo.
Proteção de pepino contra C. lagenarium
Plantas de pepino, cultivar Rubi, foram cultivadas em vasos contendo solo esterilizado e mantidas em casa-de-vegetação. As primeiras folhas verdadeiras de plantas com 15 dias de idade foram aspergidas com extrato aquoso não autoclavado de E. citriodora (concentração de 20%), Bion (200 ppm do produto comercial) e água. As pulverizações foram realizadas concomitante e 24, 48 e 72 h antes da inoculação com C. lagenarium (1 x 105 conídios/ml). Tanto a primeira folha tratada quanto a segunda folha não tratada foram inoculadas com o patógeno. Foram avaliados o tamanho e o número de lesões 8 dias após a inoculação.
RESULTADOS E DISCUSSÃO
Produção de fitoalexinas em mesocótilos de sorgo
Os resultados mostraram que não ocorreu o acúmulo de fitoalexinas do tipo deoxiantocianidinas, em mesocótilos de sorgo, pelo extrato aquoso de E. citriodora, autoclavado e não autoclavado, na concentração de 0,1% (Tabela 1). Esse resultado deveu-se provavelmente ao elevado grau de diluição do extrato aquoso nessa concentração, já que, nas demais concentrações, o acúmulo de fitoalexinas ocorreu. Observou-se que nas concentrações de 10 e 25% ocorreu maior indução de deoxiantocianidinas pelo extrato aquoso de E. citriodora não autoclavado. Já na concentração de 15% o extrato aquoso autoclavado induziu maior síntese das fitoalexinas. Portanto, os resultados indicam que o tratamento térmico promove modificações no extrato aquoso, que pode alterar a produção de deoxiantocianidinas em algumas concentrações.
Com relação ao tratamento controle Bion (Tabela 2), verificou-se que as médias referentes à indução de deoxiantocianidinas pelo extrato aquoso de E. citriodora, autoclavado e não autoclavado diferiram e foram inferiores em relação a esta testemunha. Observou-se que, na concentração de 25% do extrato aquoso não autoclavado, o valor de indução das fitoalexinas ficou próximo ao valor da testemunha Bion. Isto indica o potencial de indução de deoxiantocianidinas pelo extrato aquoso de E. citriodora, que é um extrato bruto em comparação à molécula purificada do Bion. Efeito elicitor semelhante já foi relatado também com outras plantas medicinais, como romã (Punica granatum Linn), erva cidreira [Lippia alba (Mill) N. E. Brown], manjerona (Origanum manjorana L.), babosa [Aloe vera (L.) N. L. Burm] e orégano (Origanum vulgare Linne) (Stangarlin et al., 1999) e cânfora (Artemisia camphorata Vill) (Schwan-Estrada et al., 1997).
Produção de fitoalexinas em cotilédones de soja
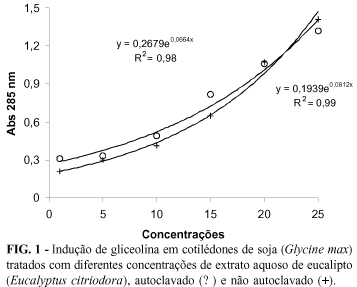
O extrato aquoso autoclavado de E. citriodora induziu a síntese de gliceolina, a partir da concentração de 10%, enquanto que o extrato aquoso não autoclavado, induziu a partir da concentração de 15% de extrato. No entanto, em altas concentrações do extrato aquoso de E. citriodora, o tratamento térmico reduziu a produção de gliceolina, conforme observado na concentração de 25%. Este resultado mostra que o extrato aquoso apresenta alterações quando submetido ao tratamento térmico que pode alterar a produção de gliceolina em algumas concentrações.
Pela análise de regressão obtida pelo desdobramento da interação concentrações x tratamento térmico, verificou-se que os tratamentos térmicos utilizados tiveram comportamentos iguais em relação às suas capacidades de indução de gliceolina. As curvas ajustadas apresentaram tendência exponencial (Figura 1), com uma pequena indução em baixas concentrações (1, 5 e 10%) do extrato aquoso e maior produção a partir da concentração de 15% de E. citriodora, autoclavado e não autoclavado.
Stangarlin et al. (1999), quando trabalharam com plantas medicinais e observaram que os extratos a 20%, não autoclavados, de pitanga, cânfora, poejo, romã e cardo santo foram efetivos em induzir o acúmulo de gliceolina em cotilédones de soja.
O efeito elicitor de fitoalexinas verificado nos bioensaios com mesocótilos de sorgo e cotilédones de soja indica que o extrato de eucalipto possui a capacidade de ativar mecanismos de defesa nessas plantas.
Atividade antifúngica
Observou-se que na concentração de 0,1% do extrato aquoso de E. citriodora, ocorreu maior germinação de esporos de C. lagenarium no tratamento com autoclavagem (Tabela 3). Na concentração de 1% não houve diferença significativa na germinação de esporos entre os extratos autoclavado e não autoclavado. A partir de 5% o extrato aquoso autoclavado inibiu em mais de 90% a germinação de esporos. Para o extrato não autoclavado, a inibição máxima foi de 75%. Portanto, observa-se que a autoclavagem do extrato promove maior inibição da germinação do patógeno.
Alteração na morfologia dos tubos germinativos de C. lagenarium foi observada em alguns tratamentos. Na concentração de 1% do extrato aquoso não autoclavado os tubos apresentavam um tamanho dez vezes maior que o tamanho do esporo. Já em 5%, estes tubos eram longos, porém menores que os tubos para a concentração anterior. Na concentração de 10%, os tubos germinativos apresentavam duas vezes o tamanho do esporo. Em concentrações de 15, 20 e 25% do extrato aquoso, não autoclavado, os tubos apresentavam somente uma vez o tamanho do esporo. Quando se utilizou o extrato aquoso autoclavado, a 0,1%, observou-se tubos germinativos com seis vezes o tamanho do esporo e a 1% os esporos apresentaram tubos pequenos, cerca de uma vez o seu tamanho.
Fiori et al. (2000) observaram que, com relação à germinação de esporos de Didymella bryoniae (Aurersw) Rehm, as plantas Ageratum conyzoides Linn. e Achillea millefolium Linne foram as que apresentaram maiores valores médios de inibição, seguidas por Cymbopogon citratus Stapf e E. citriodora, sendo que esta inibição apresentou uma tendência linear em relação às concentrações dos extratos brutos utilizados.
Com relação à formação de apressórios (Tabela 4), observou-se que na concentração de 0,1% do extrato aquoso de E. citriodora, ocorreu maior formação de apressórios de C. lagenarium no tratamento com autoclavagem. Nas demais concentrações, observou-se maior formação de apressórios quando o extrato aquoso de E. citriodora não foi autoclavado. A partir de 1%, o extrato autoclavado inibiu em 100% a formação de apressórios pelo fungo. Em todas as concentrações testadas as médias foram inferiores à média da testemunha água.
Stangarlin et al. (1999) quando estudaram o efeito do extrato bruto de E. citriodora, não autoclavado, na germinação de esporos de Colletotrichum graminicola (Ces.) Wilson observaram que ocorreu estímulo da germinação de esporos e redução de 14 a 34% na formação de apressórios em concentrações do extrato acima de 10%.
Indução de resistência em pepino a C. lagenarium
Com relação ao parâmetro número de lesões de C. lagenarium na primeira e na segunda folha de pepino, não houve diferença estatística entre os tratamentos, pelo teste F ao nível de 10% de probabilidade (Tabela 5).
Para o parâmetro tamanho de lesões (Tabela 6) de C. lagenarium na primeira folha de pepino, houve diferença estatística entre os tratamentos. O tratamento controle (água) apresentou as maiores lesões, quando comparado com os tratamentos Bion e extrato aquoso não autoclavado de E. citriodora a 20%. Na segunda folha de pepino, não houve diferença estatística no tamanho das lesões de C. lagenarium nos diferentes tratamentos testados, embora os valores tenham sido menores, em relação ao controle, para os tratamentos com extrato de eucalipto e Bion. Isto indica a ausência de um efeito sistêmico de indução de resistência.
Observando-se o intervalo de tempo entre a aplicação do indutor e a inoculação, verifica-se, para a primeira folha (Tabela 6), que 48 h foi o tempo que permitiu maior redução no tamanho das lesões, quando comparado com os tempos de 0, 24 e 72 h.
Diante dos resultados obtidos pode-se concluir que o extrato de eucalipto é um agente potencial para o controle da antracnose em pepino, tanto por sua atividade antifúngica direta quanto pela capacidade de indução local de resistência. Trabalhos posteriores serão conduzidos para fracionar esse extrato bruto aquoso e caracterizar/identificar as frações biologicamente ativas.
Aceito para publicação em 15/12/2003
Autor para correspondência: Solange Maria Bonaldo
- AYERS, A.R., EBEL, J., FINELLI, F., BERGER, N. & ALBERSHEIM, P. Host-pathogen interactions. IX. Quantitative assays of elicitor activity and characterization of the elicitor present in the extracellular medium of cultures of Phytophthora megasperma var. sojae Plant Physiology 57:751-759. 1976.
- BETTIOL, W. (Ed.). Controle Biológico de Doenças de Plantas. Jaguariúna. EMBRAPA-CNPDA. 1991.
- COOK, R.J. & BAKER, K.F. The Nature and Pratice of Biological Control of Plant Pathogens. St. Paul. APS Press. 1983.
- COSTA, A. F. Farmacognosia. Lisboa. Fundação Calouste Gulbenkian. 1986.
- FIORI, A.C.G., SCHWAN-ESTRADA, K.R.F., STANGARLIN, J.R., VIDA, J.B., SCAPIM, C.A., CRUZ, M.E.S. & PASCHOLATI, S.F. Antifungal activity of leaf extracts and essential oils of some medicinal plants against Didymella bryoniae Journal Phytopathology 148:483-487. 2000.
- FRIEDRICH, L., LAWTON, K., RUESS, W., MASNER, P., SPECKER, N. RELLA, M. G., MEIER, B., DINCHER, S., STAUB, T., UKNES, S., MÉTRAUX, J.P., KESSMANN, H. & RYALS, J. A benzothiadiazole derivative induces systemic acquired resistance in tobacco. The Plant Journal 10:61-70. 1996.
- GHINI, R. & KIMATI, H. Resistência de Fungos a Fungicidas. Jaguariúna. Embrapa Meio Ambiente. 2000.
- HAMMERSCHMIDT, H. & DANN, E.K. Induced resistance to disease. In: Rechcigl, N.A. & Rechcigl, J.E. (Eds.). Environmentally Safe Approaches to Crop Disease Control. Boca Raton: CRC - Lewis Publishers, 1997. Cap.8:177-199.
- HIJWEGNWN, T., VERHAAR, M.A., ZADOKS, J.C. Resistance to Sphaerotheca pannosa in roses induced by 2,6-dichloroisonicotinic acid. Plant Pathology 45:632-635. 1996.
- NICHOLSON, R.L., KOLLIPARA, S.S., VINCENT, J.R., LYONS, P.C. & CADENA-GOMEZ, G. Phytoalexin synthesis by the sorghum mesocotyl in response to infection by pathogenic and nonpathogenic fungi. Proceedings of the National Academy Science 84:5520-5524. 1987.
- NICHOLSON, R.L., JAMIL, F.F., SNYDER, B.A., LUE, W.L. & HISPKIND, J. Phytoalexin synthesis in the juvenile sorghum leaf. Physiological and Molecular Plant Pathology 33:271-278. 1988.
- OSSWALD, W., PASCHOLATI, S.F., STANGARLIN, J.R., LEME, L.D.C.T. & WULFF, N.A. Acúmulo de fitoalexinas em mesocótilos de sorgo em resposta ao tratamento com o ativador de defesa vegetal Bion. Fitopatologia Brasileira 23:266. 1998. (Resumo)
- PASCHOLATI, S.F. Potencial de Saccharomyces cerevisiae e outros agentes bióticos na proteção de plantas contra patógenos. (Tese de Livre Docência). Piracicaba. Escola Superior de Agricultura "Luiz de Queiroz". 1998.
- PASCHOLATI, S.F. & LEITE, B. Hospedeiro: mecanismos de resistência. In: Bergamin Filho, A., Kimati, H. & Amorim, L. (Eds.) Manual de Fitopatologia - Princípios e Conceitos. São Paulo. Ed. Agronômica Ceres. 1995. pp.417-454.
- REGENTE, M.C., OLIVA, C.R., FFELDMAN, M.L., CASTAGNARO, A.P. & CANAL, L. A sunflower leaf antifungal peptide active against Sclerotinia sclerotiorum Physiologia Plantarum 100:178-182. 1997.
- SCHWAN-ESTRADA, K.R.F., CRUZ, M.E.S., STANGARLIN, J.R. & PASCHOLATI S.F. Efeito do extrato bruto de plantas medicinais na indução de fitoalexinas em soja e sorgo. Fitopatologia brasileira 22:346. 1997. (Resumo)
- SMITH, C.J. Accumulation of phytoalexins: defense mechanisms and stimulus response system. The New Phytologist 132:1-45. 1996.
- STANGARLIN, J.R. & PASCHOLATI, S.F. Proteção de plântulas de milho pipoca contra Exserohilum turcicum pelo uso de Saccharomyces cerevisiae Summa Phytopathologica 20:16-21. 1994.
- STANGARLIN, J.R., SCHWAN-ESTRADA, K.R.F., CRUZ, M.E.S. & NOZAKI, M.H. Plantas medicinais e controle alternativo de fitopatógenos. Biotecnologia Ciência & Desenvolvimento 11:16-21. 1999.
- WULFF, N.A. & PASCHOLATI, S.F. Caracterização parcial de elicitores de fitoalexinas em sorgo isolados de Saccharomyces cerevisiae Fitopatologia Brasileira 24:428-435. 1999.
- YAMAOKA, N., LYONS, P.C., HIPSKIND, J. & NICHOLSON, R.L. Elicitor of sorghum phytoalexin synthesis from Colletotrichum graminicola Physiological and Molecular Plant Pathology 37:255-270. 1990.
- ZADOKS, J.C. The costs of change in plant protection. Journal of Plant Protection 9:151-159. 1992.
- ZADOKS, J.C. Modern plant protection. Developments and perspectives. Resumos de Palestras, 30o Congresso Brasileiro de Fitopatologia, Poços de Caldas, MG. 1997. pp.16-26.
- ZIEGLER, E. & PONTZEN, R. Specific inhibition of glucan-elicited glyceolin accumulation in soybeans by extracellular mannan-glycoprotein of Phytophthora megasperma f.sp. glycinea Physiological Plant Pathology 20:321-331. 1982.
Datas de Publicação
-
Publicação nesta coleção
27 Abr 2004 -
Data do Fascículo
Abr 2004