Resumos
Estudou-se a infecção de Stemphylium solani Weber em folíolos de tomateiros (Lycopersicon esculentum) resistente (Motelle) e suscetível (Moneymaker), usando-se técnicas histológicas e de microscopia eletrônica de varredura e transmissão. Inicialmente, foram quantificados os eventos de pré-penetração nas duas cultivares, os quais não diferiram significativamente entre si (teste F a 5%), indicando que a resistência é exercida em pós-penetração. A penetração ocorreu principalmente via estômatos e a hifa diferenciou-se na cavidade subestomática formando uma vesícula globosa ou irregular; a qual ramificou-se em hifas secundárias. Tanto a colonização intra quanto intercelular ocorreram no período de 24 e 36 h após a inoculação nas duas cultivares estudadas. Aposições foram observadas na parede das células do mesofilo resistente e, na maioria das células examinadas, aparentemente restringiram a colonização intracelular.
resistência; infecção; Lycopersicon esculentum; microscopia eletrônica
The infection process of Stemphylium solani on resistant (Motelle) and susceptible (Moneymaker) tomato (Lycopersicon esculentum) leaflets was studied using histochemical, scanning and transmission electron microscopy techniques. No quantitative differences were found in the pre-penetration conidial events on resistant and susceptible tomatoes, indicating that resistance results from post-penetration responses. The histological studies showed that the initial infection events were similar in resistant and susceptible plants. The pathogen invaded the tomato leaf primarily through stomates and a vesicle developed inside the substomatal cavity. Secondary hyphae originated from the vesicle and within 24 and 36 h after inoculation had branched inter and intracellularly in both cultivars. Cell wall appositions in the mesophyll of resistant tomato prevented intracellular colonization.
resistance; infection process; Lycopersicon esculentum; electron microscopy
ARTIGOS ARTICLES
Histologia da interação Stemphylium solani e tomateiro* * Parte da tese de doutorado do primeiro autor. Universidade Federal de Viçosa (2002)
Histology of Stemphylium solani and tomato interaction
Jânia L.S. BentesI, II, ** ** Bolsista do CNPq ; Kiyoshi MatsuokaI
IDepartamento de Fitopatologia, Universidade Federal de Viçosa, CEP 36570-000, Viçosa, MG
IIFaculdade de Ciências Agrárias, Universidade Federal do Amazonas, Av. General Rodrigo Otávio, 3000, CEP 69077-000, Manaus, AM
RESUMO
Estudou-se a infecção de Stemphylium solani Weber em folíolos de tomateiros (Lycopersicon esculentum) resistente (Motelle) e suscetível (Moneymaker), usando-se técnicas histológicas e de microscopia eletrônica de varredura e transmissão. Inicialmente, foram quantificados os eventos de pré-penetração nas duas cultivares, os quais não diferiram significativamente entre si (teste F a 5%), indicando que a resistência é exercida em pós-penetração. A penetração ocorreu principalmente via estômatos e a hifa diferenciou-se na cavidade subestomática formando uma vesícula globosa ou irregular; a qual ramificou-se em hifas secundárias. Tanto a colonização intra quanto intercelular ocorreram no período de 24 e 36 h após a inoculação nas duas cultivares estudadas. Aposições foram observadas na parede das células do mesofilo resistente e, na maioria das células examinadas, aparentemente restringiram a colonização intracelular.
Palavras-chave adicionais: resistência, infecção, Lycopersicon esculentum, microscopia eletrônica.
ABSTRACT
The infection process of Stemphylium solani on resistant (Motelle) and susceptible (Moneymaker) tomato (Lycopersicon esculentum) leaflets was studied using histochemical, scanning and transmission electron microscopy techniques. No quantitative differences were found in the pre-penetration conidial events on resistant and susceptible tomatoes, indicating that resistance results from post-penetration responses. The histological studies showed that the initial infection events were similar in resistant and susceptible plants. The pathogen invaded the tomato leaf primarily through stomates and a vesicle developed inside the substomatal cavity. Secondary hyphae originated from the vesicle and within 24 and 36 h after inoculation had branched inter and intracellularly in both cultivars. Cell wall appositions in the mesophyll of resistant tomato prevented intracellular colonization.
Additional keywords: resistance, infection process, Lycopersicon esculentum, electron microscopy.
INTRODUÇÃO
A mancha-de-estenfílio, causada por Stemphylium solani Weber, ocorre em praticamente todas as regiões onde se cultiva o tomateiro (Lycopersicon esculentum Mill.), afetando a cultura em diferentes estádios de desenvolvimento. É de importância relativa, porque os danos causados dependem da suscetibilidade das cultivares plantadas. Quando se plantam cultivares suscetíveis, esta doença torna-se uma das mais importantes, principalmente a partir do início das colheitas, pois nesta época o produtor reduz a aplicação de fungicidas. Os prejuízos são resultantes da redução da área foliar e do potencial produtivo da porção apical das plantas, uma vez que a incidência é maior em folhas mais novas (Kurosawa & Mussi, 1995). O uso de variedades resistentes é a medida de controle mais eficiente contra o fungo (Mizubuti & Brommonschenkel, 1996).
A interação S. solani e tomateiro foi estudada por Hendrix & Frazier (1949), visando detectar o gene responsável pela resistência de cultivares de tomateiro a esse patógeno. Segundo estes autores, a resistência é conferida por um único gene dominante, denominado Sm. Blancard & Laterrot (1986) verificaram que este gene também é eficiente contra isolados de Stemphylium vesicarium (Wallr) E. Simmons e S. floridanum Hannon & Weber. Apesar de já identificado este gene e embora existam variedades comerciais resistentes a este patógeno, ainda não são conhecidos os mecanismos responsáveis pela expressão da resistência. O entendimento dos mecanismos estruturais e bioquímicos de resistência de tomateiro a S. solani será de grande valia para se obter um modelo de mecanismo(s) de resistência que futuramente possa ser aplicado a outros patossistemas, assim como para fornecer subsídios para os programas de melhoramento que objetivam obter novas cultivares resistentes.
A histologia da interação patógeno-hospedeiro permite estudar o processo de infecção, esclarecendo os eventos de pré-penetração, penetração e colonização dos tecidos do hospedeiro, além de evidenciar possíveis mecanismos estruturais de resistência. Diener (l955) através da histologia da interação S. solani e tomateiro, verificou os processos iniciais de infecção, o modo de penetração e o início da colonização dos tecidos em tomateiros suscetíveis a S. solani, mas não abordou a interação fungo - planta resistente. A participação dos mecanismos estruturais na resistência ainda não foi estudada neste patossistema. Diante da ausência de conhecimentos a respeito dos mecanismos bioquímicos e estruturais da resistência de cultivares de tomateiro contra S. solani e da patogênese nesta interação, efetuou-se o presente trabalho, com os objetivos de estudar o processo de infecção no patossistema S. solani e tomateiro, através de técnicas histológicas e comparando-se a cultivar resistente com a suscetível, visando detectar diferenças estruturais entre elas, as quais podem estar relacionadas com a resistência.
MATERIAL E MÉTODOS
Material vegetal e preparo das plantas
Foram utilizados tomateiros da cv. Motelle, com o gene Sm de resistência, e da cv. Moneymaker, suscetível. A semeadura foi feita em substrato solo, areia e esterco de curral (3:l:l), pré-tratado com brometo de metila e acondicionado em bandejas de plástico (45 x 30 x 9,5 cm).
Preparo do Inóculo
Foi usado neste trabalho um variante esporulante de S. solani (S70l-5), isolado de plantas de tomateiro naturalmente infetadas e preservado em óleo mineral, disponível no Departamento de Fitopatologia da Universidade Federal de Viçosa.
Verificou-se inicialmente se permaneciam normais a esporulação e a virulência do isolado. O microrganismo foi repicado dos tubos de ensaio com óleo mineral para placas de Petri contendo meio de cultura V8 (200 ml de suco V8; l7 g de ágar; 800 ml de água destilada), o qual favorece a esporulação do patógeno. Estas placas foram incubadas por dez dias à temperatura de 25 ºC. Após este período verificou-se abundante produção de conídios do fungo. O teste de patogenicidade foi feito em tomateiros com cerca de 30 dias de idade, das cultivares Moneymaker e Motelle, as quais foram inoculadas com uma suspensão de conídios na concentração de 104conídios/ml, usando-se um atomizador DeVilbis nº 15. Foi feito o reisolamento do fungo a partir dos folíolos infetados. Na condução dos trabalhos seguintes, o fungo foi mantido em tubos de ensaio contendo meio BDA (batata-dextrose-ágar) e armazenado a 25 ºC. Por ocasião das inoculações, o fungo foi cultivado em meio V8 a 25 ºC, durante dez dias. A suspensão de inóculo foi obtida a partir da adição de água destilada às culturas e ajustada para 104 esporos/ml.
Determinação do estádio ideal para inoculação das plantas
Foram realizados testes preliminares para determinar a melhor idade dos tomateiros para a inoculação e verificar se havia diferença quanto à resistência ou suscetibilidade das plantas em diferentes estádios fenológicos.
As cultivares foram semeadas em cinco épocas diferentes, com intervalos de sete dias. As plantas foram inoculadas com uma suspensão de conídios na concentração de 104 conídios/ml, usando-se um atomizador DeVilbis nº 15, todas de uma só vez, aos sete, 14 , 21, 28 e 35 dias de idade. Para cada idade, foram usadas três plantas de cada cultivar e uma como testemunha, que foi pulverizada com água destilada. A avaliação diária foi feita observando-se, durante sete dias consecutivos, o surgimento dos sintomas típicos da doença. Este ensaio foi repetido três vezes.
Processo de infecção: pré-penetração e penetração
Plantas das cultivares resistente e suscetível foram inoculadas com suspensão de conídios na concentração de 104 conídios/ml, na face adaxial das folhas. Após a inoculação as plantas pemaneceram em câmara de nevoeiro a 25 ºC durante 48 h, em seguida foram transferidas para casa de vegetação onde ficaram até o término das coletas. As folhas cotiledonares e primárias inoculadas das duas cultivares, foram coletadas seis, 12, 24, 36, 48 e 72 horas após a inoculação (h.a.i) e diafanizadas segundo o método de Longo et al. (1994). As amostras diafanizadas foram coloridas com azul de algodão em lactofenol (100 ml de lactofenol, 1 ml de azul de algodão aquoso 1%, 20 ml de ácido glacial acético), montadas lâminas de microscopia e observadas a 100 e 400X, em microscópio óptico de luz branca.
Foi feita a avaliação quantitativa dos conídios germinados, do modo de penetração do tubo germinativo, direta ou via estômatos, e das vesículas subestomáticas produzidas nas amostras. Foram inoculadas quatro plantas por período de coleta, constituindo cada planta uma repetição, e avaliados quatro folíolos de cada planta. A testemunha consistiu de duas plantas pulverizadas com água destilada, para cada período de coleta. Este ensaio foi repetido duas vezes.
Amostras de tecido diafanizado das duas cultivares foram observadas em microscópio de fluorescência de luz transmitida, visando detectar autofluorescência nas áreas lesionadas. Foram montadas em lâmina de microscopia contendo lactofenol e observadas em microscópio de fluorescência (ZEISS) de luz transmitida, com lâmpada HBO 200 , filtro de excitação BG 12 (azul) e filtro de barreira 47 ou 50.
Amostras coletadas nos períodos de 24 e 48 h após a inoculação foram processadas para observação em microscópio eletrônico de varredura (MEV), de acordo com Matsuoka (1988). Fragmentos foliares de 0,5 cm2 das duas cultivares foram fixados em glutaraldeído a 3% (v/v), preparado em tampão cacodilato de sódio a 0,05 Mol/ l, pH 7,0, durante 8 a 10 h a 4 ºC. Após a fixação, as amostras foram lavadas seis vezes consecutivas, durante 10 min por vez, em tampão fosfato 0,05 Mol/ l, pH 7,0. A pós-fixação foi feita com tetróxido de ósmio a 1%, durante 4 h a 4 ºC, seguida de lavagens, como descrito anteriormente. A desidratação foi feita em série etanólica (30, 50, 70, 80, 95 e 100%). Em seguida as amostras foram submetidas à secagem ao ponto crítico e cobertas com um filme de ouro de 15 nm de espessura, mediante pulverização catódica. A observação foi feita em microscópio eletrônico de varredura JEOL JSM - T200, a 10 KV.
Colonização dos tecidos
Para observar a colonização dos tecidos, as plantas foram inoculadas com gotas de 30 ml de suspensão com 104 conídios/ml, distribuídas em diferentes pontos das folhas, e recobertas com discos de papel de filtro esterilizados, com 0,5 cm de diâmetro, para evitar o escorrimento das gotas. Este método foi usado visando facilitar a coleta de amostras pela localização dos pontos de inoculação e do patógeno nos tecidos do hospedeiro. Após a inoculação, as plantas permaneceram em câmara de nevoeiro a 25 ºC durante 48 h e, em seguida, foram transferidas para casa de vegetação onde ficaram até o término das coletas que foram feitas 24, 36, 48 e 72 h.a.i. Foram inoculadas quatro plantas por período de coleta, sendo cada planta um repetição, e avaliados quatro folíolos de cada planta. A testemunha consistiu de duas plantas para cada período de coleta, inoculadas com gotas de água destilada esterilizada. Este ensaio foi repetido três vezes.
Amostras de tecido foliar foram cortadas em fragmentos de 2 mm2, e processadas como descrito anteriormente para MEV, até a etapa de desidratação em série etanólica. Os fragmentos desidratados foram submetidos à infiltração com resina Spurr, em misturas de álcool e resina 1:1 (v/v), durante 30 min, álcool e resina 1:3 (v/v), mais 30 min, resina pura durante 4 h seguida de troca da resina, permanecendo em resina pura por 12 h. As amostras foram emblocadas em resina, em moldes de silicone, devidamente etiquetados e polimerizados a 70 ºC por 24 h.
O tecido incluído em resina Spurr foi seccionado em cortes semifinos, com cerca de 0,5 a 1mm de espessura, usando-se ultramicrótomo SORVALL MT2-B, equipado com navalha de vidro. Os cortes foram coloridos com azul de toluidina O a 0,1% (p/v) (borax p.a. 0,1 g; toluidina O 0,1 g; 100 ml de água destilada), montados em óleo de imersão e examinados ao microscópio óptico.
Os estudos ao microscópio eletrônico de transmissão (MET) foram feitos visando observar resultados da interação ao nível ultraestrutural e detectar alterações em organelas e/ ou na parede celular das cultivares em estudo. Para isso, as plantas foram inoculadas com gotas de suspensão de esporos de 30 µl, como descrito anteriormente. A coleta das amostras foi feita 24, 36, 48 e 72 h.a.i. e estas foram incluídas em resina Spurr e submetidas a cortes ultrafinos, em ultramicrótomo SORVALL MT2-B, equipado com navalha de diamante. Os cortes foram montados em telinhas de cobre e submetidos à contrastação com acetato de uranila a 2% em solução aquosa durante 30 min, seguida de exposição a citrato de chumbo por 15 min (Matsuoka, 1988). As observações foram feitas em microscópio eletrônico de transmissão Zeiss EM 109.
RESULTADOS
Teste de patogenicidade
Observou-se o desenvolvimento de lesões típicas da doença, visíveis somente na cultivar suscetível (Moneymaker) dois a três dias após a inoculação. O fungo foi reisolado a partir das folhas infetados, confirmando-se a viabilidade e virulência do isolado S 701-5.
Determinação do estádio ideal para inoculação das plantas
Não se observou diferença quanto à resistência ou suscetibilidade entre plantas da mesma cultivar, em diferentes estádios fenológicos. As plantas da cultivar suscetível apresentaram sintomas típicos da doença 24 a 48 h após a inoculação, em todas as idades testadas. Sete dias após a inoculação observou-se a morte das plantas da cultivar suscetível. Na cultivar resistente, constataram-se pequenas lesões necróticas de 48 a 72 h.a.i. em algumas plantas, que não originaram sintomas típicos da doença. De modo geral, as plantas resistentes se desenvolveram como aquelas completamente sadias. Com base nestes dados, optou-se utilizar plantas de 15 dias de idade em todos os experimentos.
Processo de infecção: pré-penetração e penetração
Pelas observações das amostras diafanizadas, o patógeno desenvolveu-se de maneira semelhante nas duas cultivares de tomateiro. A quantificação dos eventos de pré-penetração não mostrou diferença significativa, pelo teste F a 5% de probabilidade, entre o hospedeiro resistente e suscetível, quanto à germinação, penetração e formação de vesícula na cavidade subestomática (dados não mostrados). Estes dados sugerem que os mecanismos envolvidos na resistência se manifestam na fase de pós-penetração, após o contato das hifas do patógeno com as células do mesofilo.
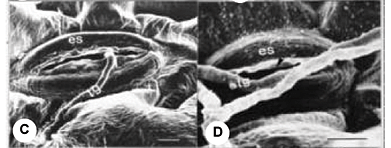
Com seis h.a.i., os conídios do patógeno haviam germinado, dando origem a vários tubos germinativos por conídio, dos quais somente um ou, eventualmente, dois penetraram no hospedeiro. A penetração, que ocorreu principalmente via estômatos, foi observada 12 h.a.i. (Figuras 1-A e 1-C). A penetração direta foi eventual e ocorreu através da parede periclinal das células da epiderme (Figura 1-B). Ao que parece, a entrada do tubo germinativo na abertura estomática ocorreu ao acaso, uma vez que foram observados os tubos germinativos do fungo ao lado ou por cima do estômato aberto, sem que houvesse penetração (Figura 1-D). Em algumas ocasiões, verificou-se a intumescência do ápice do tubo germinativo, originando uma estrutura semelhante ao apressório, mas não ocorreu penetração a partir desta estrutura. Na maioria dos casos, não houve diferenciação do tubo germinativo durante a penetração.
Em ambas cultivares, papilas foram observadas entre o plasmalema e a parede das células da epiderme, produzidas em resposta ao contato do tubo germinativo de S. solani com estas células (Figuras 1-E, 1-F e 1-G). Ao que parece, a formação de papilas impede a penetração direta do patógeno, que então utiliza os estômatos como via alternativa para penetrar. No entanto, em alguns sítios de penetração nas células da epiderme, não houve formação de papilas, ou estas não foram eficientes em prevenir a entrada do patógeno, tendo ocorrido a penetração direta do tubo germinativo nestas células.
Após a penetração, a hifa se expandiu originando uma vesícula de formato globoso ou irregular na cavidade subestomática, que se ramificou, originando hifas secundárias que colonizaram o mesofilo do hospedeiro. Com 24 h.a.i., as hifas de S. solani haviam se estabelecido no mesofilo das cultivares resistente e suscetível. Em alguns locais, as células do tecido paliçádico, em contato com as hifas, apresentavam alterações de parede celular ou formação de papilas.
Decorridas 36 h.a.i., os locais de infecção na cultivar suscetível caracterizavam-se pelo colapso de células do mesofilo e pela grande quantidade de hifas secundárias dentro e entre células. Neste período, foram observadas lesões macroscópicas, que com o tempo se desenvolveram em sintomas típicos da doença e evoluíram para murcha e queda das folhas. Na cultivar suscetível foi observada a degradação do conteúdo celular e o colapso de células do mesofilo, na presença de hifas intercelulares, e em células distantes das hifas do patógeno, demonstrando que a estratégia de infecção do fungo é do tipo necrotrófica.
Na cultivar resistente, decorridas 48 h.a.i., observou-se o colapso de algumas células, originando pequenas lesões macroscópicas. Estas não cresceram, permitindo o desenvolvimento normal do hospedeiro. Apesar de não surgirem sintomas típicos da doença no tomateiro resistente, hifas do patógeno foram localizadas infetando tecidos foliares deste hospedeiro.
Não foi detectada autofluorescência nas áreas lesionadas das amostras observadas, tanto para cultivar resistente quanto para a suscetível. No entanto, em observações feitas ao MET, em células dispersas do mesofilo, das duas cultivares (Moneymaker e Motelle), foram detectadas alterações em cloroplastos, mitocôndrias e núcleo. Nessas células, observaram-se massas de material eletrondenso, indicando a condensação de cromatina. Ao redor, o citoplasma apresentou-se desorganizado, com cloroplastos degradados.
Colonização dos tecidos
A colonização dos tecidos ocorreu tanto de forma inter como intracelular, nos parênquimas do mesofilo, tanto na cultivar resistente como na suscetível. Em observações feitas ao MET, nas duas cultivares, as células do mesofilo em contato com as hifas do patógeno não apresentavam parede celular definida, possivelmente em decorrência de degradação enzimática da parede celular do hospedeiro no sítio de penetração da hifa. Na cultivar resistente, enquanto a colonização se limitava aos espaços intercelulares, as células do parênquima apresentavam-se pouco danificadas e com muitos cloroplastos aparentemente intactos (Figura 2-A). Quando a hifa do fungo conseguia penetrar a célula, causava a degradação dos cloroplastos e colapso celular. No entanto, a colonização intracelular no material resistente poucas vezes ocorreu e, quando verificada, o número de células afetadas era reduzido, originando lesões pequenas. Na cultivar suscetível, os tecidos apresentavam-se intensamente colonizados, as células do mesofilo estavam danificadas e com cloroplastos destruídos ou sem conteúdo (Figura 2-B). Não foi constatado estreitamento das hifas durante a penetração nas células do parênquima. Aparentemente, o seu diâmetro permaneceu inalterado durante a penetração.
Na cultivar resistente, papilas formaram-se nas células do parênquima (Figuras 3-A e 3-B). Aparentemente, estas papilas foram eficientes em restringir a colonização intracelular na maioria das células, evitando o colapso das mesmas. No entanto, ainda não está clara a participação efetiva das papilas na resistência da cultivar Motelle a S. solani.
Apesar de não ter sido quantificada nas duas cultivares, a freqüência de papilas na cultivar suscetível (Figura 3-C) aparentou ser menor que a observada na cultivar resistente. Em alguns casos, observou-se espessamento da parede celular do hospedeiro suscetível em contato com a hifa do patógeno (Figura 3-D). Mas, ao que parece, essas alterações da parede celular não foram suficientes para restringir a colonização intracelular na cultivar Moneymaker .
DISCUSSÃO
O processo de infecção observado na interação S. solani e tomateiro resistente ('Motelle') e suscetível ('Moneymaker'), assemelhou-se ao descrito por Diener (1955) em tomateiros das cultivares suscetíveis (Louisiana Pink e Marglobe). Os tubos germinativos produzidos pelos esporos se alongaram na superfície do hospedeiro e, ocasionalmente, terminaram em estrutura semelhante a apressório. Não foi observada a penetração a partir de tal estrutura. Suheri & Price (2000) também verificaram apressórios terminais e intercalares no tubo germinativo de S. vesicarium. Destes, 60% penetraram com sucesso no hospedeiro. No presente estudo, as hifas dos esporos germinados foram bem sucedidas em penetrar o hospedeiro sem o envolvimento de apressório, indicando que esta estrutura não é essencial para infecção no patossistema S. solani e tomateiro.
A penetração do patógeno nos tecidos do hospedeiro ocorreu principalmente via estômatos, sendo este o modo de penetração mais comum entre as espécies do gênero Stemphylium (Borges et al. 1976; Cowling et al. 1982; Suheri & Price, 2000). Fatores químicos e físicos da superfície do hospedeiro podem influenciar no direcionamento do tubo germinativo e na diferenciação de estruturas de infecção de alguns fungos fitopatogênicos (Hoch & Staples, 1991). Allen et al. (1991) demonstraram que o crescimento do tubo germinativo e a formação de apressório de diferentes espécies fungos causadores de ferruge, ocorre em resposta a sinais topográficos da superfície onde estão depositados. Na interação S. solani e tomateiro, a entrada do tubo germinativo na abertura estomática se dá ao acaso, sem ser influenciada pela proximidade do conídio com o estômato, já que o tubo germinativo ramifica-se e alonga-se na superfície foliar, passando sobre os estômatos abertos, sem penetrar no hospedeiro, sugerindo que neste patossistema não há interferência de sinais da superfície da planta, para o direcionamento do tubo germinativo e para a penetração no hospedeiro. Cowling et al. (1982) observaram o mesmo comportamento em folhas de alfalfa (Medicago sativa L.) infetada por Sthemphylium botryosum Wallroth.
Foi observada penetração direta ocasional do tubo germinativo nas células da epiderme de ambas as cultivares. Na maioria dos casos, as papilas se formaram nessas células impedindo a penetração direta, sendo os estômatos uma via alternativa para penetrar no hospedeiro. A restrição da penetração nas células da epiderme pode resultar da ação inibitória de metabólitos presentes no sítio de formação de aposições na parede celular, em conjunto com o impedimento físico (Sherwood & Vance, 1980).
O tubo germinativo de S. solani não se diferenciou em uma hifa de infecção típica ("peg" de infecção) durante a penetração via estômatos ou nas células da epiderme. O mesmo foi observado por Nelson (1955) na interação S. botryosum e alfalfa, onde o fungo penetrou através dos estômatos ou na célula da epiderme, com o tubo germinativo mantendo o seu diâmetro aparentemente inalterado. A formação de vesícula subestomática e a colonização intercelular e intracelular parecem ser um comportamento típico de Stemphylium spp. (Drake, 1963).
A estratégia de infecção do fungo S. solani em tomateiro é do tipo necrotrófica (Alexopoulos et al. 1996), uma vez que foi observado na cultivar suscetível, o colapso de células do mesofilo distantes das hifas do fungo ou em contato com hifas intercelulares, sugerindo o envolvimento de substâncias produzidas pelo patógeno, como enzimas e/ou toxinas. Estas podem atuar danificando ou matando as células da hospedeira, permitindo assim a colonização dos tecidos.
Neste estudo verificou-se a degradação da parede das células do mesofilo no ponto de contato entre as hifas e a célula vegetal (dados não mostrados), o que sugere o envolvimento de enzimas extracelulares produzidas pelo fungo, capazes de degradar os componentes da parede celular do hospedeiro, permitindo a colonização intracelular. Segundo Walton (1994), enzimas degradadoras da parede celular são requeridas pelos patógenos para retirar nutrientes a partir da parede celular; para penetrar e colonizar os tecidos. O envolvimento enzimas na degradação de componentes da parede celular da planta hospedeira, tem sido relatado em diversas interações envolvendo patógenos necrotrófico e hemibiotróficos (Keon, 1989; Benhamou & Côte, 1992; Heller & Gierth, 2001).
Na cultivar resistente Motelle, a colonização intracelular foi observada em menor freqüência que na cultivar suscetível Moneymaker e, quando ocorreu, o número de células afetadas era reduzido, dando origem a lesões pequenas, as quais aparentemente não prejudicaram o desenvolvimento normal do hospedeiro. A restrição da colonização intracelular na cultivar resistente pode ser atribuída às papilas e/ou aposições na parede celular. Estas foram observadas nas células do mesofilo dessa cultivar e podem atuar fortalecendo a parede celular do hospedeiro por meio de barreira física que impede a entrada da hifa na célula vegetal. Existem numerosos relatos relacionando a presença de papilas com a resistência de plantas ao ataque de diversos patógenos (Aist, 1976; Sherwood & Vance, 1980; Koga et al. 1990; Siranidou et al. 2002).
Apesar de não ter sido quantificada a freqüência de papilas observadas nas células do mesofilo dos tomateiros resistente e suscetível durante a infecção, ficou claro que na cultivar resistente a freqüência das papilas, foi maior do que na cultivar suscetível. A deposição de papilas entre a parede celular e a membrana plasmática nas células do mesofilo da cultivar Motelle atuou impedindo a colonização intracelular e, desta forma, contribuindo significativamente para a manifestação da resistência.
As alterações de parede celular, eventualmente observadas no material suscetível, não restringiram a colonização intracelular neste hospedeiro. O mesmo foi observado por Mims & Vaillancourt (2002) na interação Colletotrichum graminicola (Cesati) Wilson e cultivar suscetível de milho (Zea mays L.), onde as papilas foram produzidas nas células da epiderme e do mesófilo em resposta à tentativa de penetração pelo patógeno, mas estas não tiveram sucesso em prevenir a entrada das hifas nas células. De acordo com Aist (1983), as papilas nem sempre são efetivas em restringir a penetração do patógeno no hospedeiro. A freqüência e a velocidade da formação das papilas são fatores que podem influenciar na retenção do patógeno. Nicholson & Hammerschimidt (1992) citam que se a papila é formada rapidamente e se esta se torna fortemente lignificada, pode prevenir a entrada do fungo no hospedeiro. Matsuoka (1988) verificou que a resistência de pimentão (Capsicum annuum L.) a Phytophthora capsici Leonian se manifesta através da rápida formação de papilas, em resposta à penetração da hifa infetiva.
As pequenas lesões necróticas presentes no material resistente, levantaram a suspeita do envolvimento de reação de hipersensibilidade. A autofluorescência em tecidos infetados tem sido relatada, em alguns patossistemas (Heath, 1998; Heath, 2000; Vleeshouers et al., 2000; Vleeshouers et al., 2000; Kombrink & Schmelzer, 2001), como indicativo in situ da reação de hipersensibilidade (HR). Lesões microscópicas encontradas nas amostras diafanizadas foram observadas em microscópio de fluorescência, no entanto, não foi detectada autofluorescência nas células da epiderme e/ou do mesofilo das áreas lesionadas no hospedeiro resistente e suscetível. Em nível ultraestrutural, em ambos os tomateiros, foram observadas alterações em organelas e no núcleo das células do mesofilo, que podem estar relacionadas com HR, como a condensação da cromatina, desorganização do citoplasma e degradação dos cloroplastos. Polverari et al. (2000) observaram que, durante a HR induzida pela inoculação de isolado avirulento de Xanthomonas campestris pv. vesicatoria (Doidge) Dye, raça 2, em folhas de pimentão, as células do mesofilo apresentaram desorganização geral do citoplasma, degeneração de organelas, como cloroplastos, além de massas de material eletrondenso no núcleo, aparentemente formado pela agregação da cromatina. Estes resultados se assemelham aos aqui observados em tomateiro infetado por S. solani. No entanto, estas alterações celulares ocorreram de forma esporádica e em número restrito de células do mesofilo.
Sobre as respostas de plantas a fungos necrotróficos, Mayer et al. (2001) mencionam que, quando a HR ocorre nessas interações, o crescimento do fungo é acelerado em vez de restringido. Os patógenos necrotróficos precisam estar equipados com arsenal enzimático capaz de inativar os compostos tóxicos formados durante a HR. Na interação S. solani e tomateiro, onde alterações celulares associadas com HR foram observadas de forma esporádica, tanto na cv. suscetível quanto na resistente, este mecanismo não contribuiu de forma significativa para a manifestação da resistência na cultivar Motelle. No entanto, a colonização intracelular e o conseqüente desenvolvimento de sintomas típicos da doença foram restringido nesta cultivar. Com base nos relatos de Mayer et al. (2001), é possível que este hospedeiro possua mecanismos bioquímicos de resistência capazes de inativar ou inibir a atividade enzimática do patógeno que, aliados aos mecanismos estruturais de resistência observados, como alterações da parede celular e papilas, contribuam para a manifestação plena da resistência.
Com base nos dados obtidos neste trabalho, conclui-se que a resistência de 'Motelle' a S. solani é do tipo pós-penetração e está fortemente relacionada com as alterações de parede celular e as papilas surgidas nas células do mesofilo. No entanto, este mecanismo não é suficiente, isoladamente, para explicar a resistência encontrada, uma vez que a colonização intracelular também foi observada em alguns casos na cultivar resistente, porém esta de alguma forma foi restringida, resultando em lesões pequenas. É provável que mecanismos bioquímicos de resistência também atuem em conjunto com as papilas. Estudos futuros poderão determinar se há envolvimento de componentes bioquímicos na expressão da resistência observada na cultivar Motelle.
MIMS, C.W. & VAILLANCOURT, L.J. Ultrastructural characterization of infection and colonization of maize leaves by
Aceito para publicação em 14/10/2004
Autor para correspondência: Jânia Lília da Silva Bentes
- AIST, J.R. Papillae and related wound plugs of plant cells. Annual Review of Phytopathology 14:145-163. 1976.
- ALEXOPOULOS, C.J., MIMS, C.W. & BLACKWELL, M. Introductory Mycology. 2nd ed. New York. John Wiley & Sons Inc. 1996.
- ALLEN, E.A., HAZEN, B. E., HOCH, H.C., KWON, Y., LEINHOS, G.M.E., STAPLES, R.C., STUMPF, M.A. & TERHUNE, B.T. Appressorium formation in response to topographical signals by 27 rust species. Phytopathology 81:323-331. 1991.
- BENHAMOU, N. & CÔTÉ, F. Ultrastructure and cytochemistry of pectin and cellulose degradation in tobacco roots infected by Phytophthora parasitica var. nicotianae Phytopathology 82:468-478. 1992.
- BLANCARD, D. & LATERROT, H. Les Stemphylia rencontrés sur le tomate. Phytopathologia Mediterranea 25:140-144. 1986.
- BORGES, O.L., STANFORD, E.H. & WEBSTER, R.K. The host-pathogen interaction of alfalfa and Stemphylium botryosum Phytopathology 66:749-753. 1976.
- COWLING, W.A., GILCHRIST, D.G. & GRAHAM, J.H. Biotypes of Stemphylium botryosum on alfalfa in North America. Phytopathology 72:679-684. 1982.
- DIENER, V.L. Host-penetration and pathological histology in gray leaf spot of tomato. Phytopathology 45:654-658. 1955.
- DRAKE, C.R. Host-parasite relations of Stemphylium leafspot and stem canker of birdsfoot trifoil (Lotus corniculatus). Phytopathology 53:1094-1099. 1963.
- HEATH, M.C. Apoptosis, programmed cell death and the hypersensitive response. European Journal of Plant Pathology 104:117-124. 1998.
- HEATH, M.C. Hypersensitive response-related death. Plant Molecular Biology 44:321-334. 2000.
- HELLER, A. & GIERTH, K. Cytological observations of the infection process by Phomopsis helianthi (Munt.-Cvet) in leaves of sunflower. Phytopathology 91:347-357. 2001.
- HENDRIX, J.W. & FRAZIER, W.A. Studies on the inheritance of stemphylium resistance in tomatoes. Technical Bulletin, 8. Honolulu: University of Hawaii, 1949.
- HOCH, H.C. & STAPLES, R.C. Signaling for infection structure formation in fungi. In: Cole, G.T. & Hoch, H.C. (Eds.) Fungal spore and disease initiation in plant and animals. New York. Plenum Press. 1991. pp.25-46.
- KEON, J. Importance of cell-wall degradading enzymes in pathogen specificity and pathogenicity. IACR Report. Institute of Arable Crops Research. Rothamsted. UK. 1989. pp.89-91.
- KOGA, H., BUSHNELL, W.R. & ZEYEN, R.J. Specificity of cell type and timing of events associated with papilla formation and the hypersensitive reaction in leaves of Hordeum vulgare attacked by Erysiphe graminis f.sp. hordei Canadian Journal of Botany 68:2344-2352. 1990.
- KOMBRINK, E. & SCHMELZER, E. The hypersensitive response and its role in local and systemic disease resistance. European Journal of Plant Pathology 107:69-78. 2001.
- KUROSAWA, C. & MUSSI, L. Avaliação de resistência em cultivares e híbridos de tomateiro à mancha de estenfílio. Summa Phytopathologica 21:199-201. 1995.
- LONGO, N., NALDINI, B., DROVANDI, F., GONNELLI, T. & TANI, G. Penetration and early colonization in basidiospore-derives infection of Melampsora pulcherrina (Bib.) Maire on Mercuralis annua L. Caryologia 47:208-222. 1994.
- MATSUOKA, K. Aspectos ultra-estruturais na interação de Phytophthora capsici Leonian e Capsicum annuum L. (Tese de doutorado). Viçosa. Universidade Federal de Viçosa, 1988.
- MAYER, A.M., STAPLES, R.C. & GIL-AD, N.L. Mechanisms of survival of necrotrophic fungal plant pathogens in host expressing the hypersensitive response. Phytochemistry 58:33-41. 2001.
- Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology 92:803-812. 2002.
- MIZUBUTI, E.S.G. & BROMMONSHENKEL, S.H. Doenças causadas por fungos em tomateiro. Informe Agropecuário 18:7-14.1996.
- NELSON, R.R. Studies on Stemphylium leafspot of alfafa. Phytopathology 45:352-356. 1955.
- NICHOLSON, R.L. & HAMMERSCHMIDT, R. Phenolic compounds and their role in disease resistance. Annual Review of Phytopathology 30:369-389. 1992.
- POLVERARI, A., BUONAURIO, R., GUIDERDONE, S., PEZATTI, M. & MARTE, M. Ultrastructural observations and DNA degradation analysis of pepper leaves undergoing a hypersensitive reaction to Xanthomonas campestris p.v. vesicatoria_European Journal of Plant Pathology 106:423-431. 2000.
- SHERWOOD, R.T. & VANCE, C.P, Resistance to fungal penetration in gramineae. Phytopathology 70:273-279. 1980.
- SIRANIDOU, E., KANG, Z. & BUCHENAUER, H. Studies on symptom development, phenolic compounds and morphological defense response in wheat cultivars differing in resistance to Fusarium head blight. Phytopathology 92:200-208. 2002.
- SUHERI, H. & PRICE, T.V. Infection of onion leaves by Alternaria porri and Stemphylium vesicarium and disease development in controlled enviromments. Plant Pathology 49:375-382. 2000.
- VLEESHOUWERS, V.G.A.A., Van DOOIGEWEERT, W., GOVERS, F., KAMOUN, S. & COLON, L.T. The hypersensitive response is associated with host and nonhost resistance to Phytophthora infestans Planta 210:853-864. 2000.
- WALTON, J.D. Desconstructing the cell wall. Plant Physiology 104:1113-1118. 1994.
Datas de Publicação
-
Publicação nesta coleção
05 Out 2005 -
Data do Fascículo
Jun 2005
Histórico
-
Aceito
14 Out 2004 -
Recebido
14 Out 2004