Resumos
O presente artigo descreve uma metodologia espectrofotométrica para a análise de paraformaldeído presente em amostras de saneantes comerciais e industriais, utilizando-se ácido cromotrópico (ACT), ácido clorídrico concentrado e peróxido de hidrogênio, produzindo um composto púrpura - avermelhado (lambda max = 575 nm). A lei de Beer é obedecida numa faixa de concentração de 0,8 - 4,8 mg L-1 em formaldeído, apresentando excelente coeficiente de correlação (r = 0,9999). Os valores obtidos nas análises concordaram muito favoravelmente com os obtidos pelo procedimento padrão recomendado pelo NIOSH (National Institute for Occupational Safety and Health).
análise de saneantes; quantificação de paraformaldeído; espectrofotometria; ácido cromotrópico
This paper describes a spectrophotometric method for the paraformaldehyde analysis in industrial and commercial disinfectant samples using chromotropic acid, concentrated hydrochloridric acid and hydrogen peroxide. The reaction produces a violet-red compound (lambda max = 575 nm). The method permits the determination of paraformaldehyde over a concentration range of 0.8-4.8 mg L-1 and the results obtained by the proposed method compared very favorably with those obtained by NIOSH’s standard procedure.
disinfectant analysis; formaldehyde quantification; spectrophotometry; chromotropic acid
DESENVOLVIMENTO DE MÉTODO ESPECTROFOTOMÉTRICO PARA ANÁLISE DE PARAFORMALDEÍDO EM SANEANTES COMERCIAIS E INDUSTRIAIS
Enelton FAGNANI** Doutorando do Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.Doutorando do Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.
Cristo Bladimiros MELIOS*** Doutorando do Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.Doutorando do Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.
Leonardo PEZZA**** Doutorando do Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.Doutorando do Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.
Helena Redigolo PEZZA*** Doutorando do Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.Doutorando do Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.
RESUMO: O presente artigo descreve uma metodologia espectrofotométrica para a análise de paraformaldeído presente em amostras de saneantes comerciais e industriais, utilizando-se ácido cromotrópico (ACT), ácido clorídrico concentrado e peróxido de hidrogênio, produzindo um composto púrpura - avermelhado (l max = 575 nm). A lei de Beer é obedecida numa faixa de concentração de 0,8 - 4,8 mg L-1 em formaldeído, apresentando excelente coeficiente de correlação (r = 0,9999). Os valores obtidos nas análises concordaram muito favoravelmente com os obtidos pelo procedimento padrão recomendado pelo NIOSH (National Institute for Occupational Safety and Health).
PALAVRAS-CHAVE: análise de saneantes, quantificação de paraformaldeído, espectrofotometria, ácido cromotrópico.
Introdução
O paraformaldeído (aldacide, Flo-Mor, parafórmio, formagênio, polioximetileno, polioximetano, metaformaldeído), formaldeído polimerizado, (CH2O)n (onde n varia de 8 a 100) e peso molecular médio de 600 g mol-1, é o produto de condensação do metilenoglicol e é normalmente manufaturado pela concentração a vácuo de uma solução aquosa de formaldeído. Sólido branco e de odor penetrante, contêm entre 78 e 98% em formaldeído. Apesar de irritante e possivelmente carcinogênico é usado em desinfecção de quartos e utensílios hospitalares, de tecidos como o linho, como ingrediente ativo de cremes contraceptivos, produtos dedetizadores, na manufatura de resinas sintéticas de uso odontológico e em outras destinadas à fabricação de peças artificiais de marfim e chifres. Também é usado em anti-sépticos, fungicidas, no tratamento de pequenas infecções de garganta, adesivos, como agente endurecedor e impermeabilizante para gelatina e em fluido aditivo de furadeiras8,13,15,24-26. O paraformaldeído sólido pode ainda ser utilizado industrialmente na fiação de seda e em formulações com outras substâncias para a desinfecção do bicho da seda.
Em geral, a comercialização do formaldeído para fins industriais é feita sob a forma de paraformaldeído sólido, ao invés de soluções concentradas. A Farmacopéia Brasileira12 destaca o uso do formaldeído como agente desinfetante, dada sua ampla utilização para essa finalidade no contexto nacional.
Os métodos para a determinação de formaldeído existentes na literatura são os mais diversos e envolvem voltametria por corrente alternada6, potenciometria18, titulometria14, espectrofotometria7,16,21 entre outros23.
Na maioria das indústrias, ainda são empregados os métodos titulométricos, que se baseiam em reações envolvendo o grupo carbonílico de aldeídos e cetonas, como é o caso do método do sulfito neutro14, ou que envolvem reações de oxidação usando peróxido de hidrogênio, mercurimetria ou iodometria23. Esses métodos têm a desvantagem de não serem seletivos para formaldeído, além de apresentarem limitada sensibilidade. Aplica-se bem a metodologia titulométrica para a padronização de soluções puras, mas para a análise de amostras reais são necessárias outras técnicas.
O método espectrofotométrico do ácido cromotrópico11 em meio de ácido sulfúrico concentrado se destaca no contexto analítico por apresentar grande sensibilidade, alta seletividade e é usado para a determinação de formaldeído no ar28, para análises ambientais3 e ocupacionais19,29, sendo atualmente recomendado pelo NIOSH (National Institute for Occupational Safety and Health)22. Nesse método, o formaldeído reage com o ácido cromotrópico (ACT) em meio de ácido sulfúrico concentrado produzindo um composto colorido que tem seu máximo de absorção a 575 nm, de acordo com a Figura 1. Segundo Georghiou11, trata-se de uma estrutura dibenzoxantílica monocatiônica, que pode ser melhor visualizada na Figura 2.
O uso de ácido sulfúrico concentrado (um ácido altamente corrosivo e um dos desidratantes mais enérgicos que se conhece) embora potencialmente perigoso, apresenta a vantagem inerente de tornar o método extremamente sensível.
Bricker & Vail5 e posteriormente Georghiou11 tentaram substituir o ácido sulfúrico concentrado por outros ácidos concentrados potencialmente menos perigosos como clorídrico, acético, fosfórico e não obtiveram êxito devido à baixa sensibilidade da reação na presença dos mesmos.
Um método recomendado no Reino Unido10 utiliza ácido cromotrópico em meio de ácido sulfúrico 50% (v/v) reduzindo assim os riscos em potencial do método original. Entretanto, Pickard & Clark23 observaram que nessas condições não ocorre liberação quantitativa de formaldeído do complexo formado entre este e o bissulfito, reduzindo-se assim a sensibilidade, a reprodutibilidade do método e evidenciando a necessidade de se trabalhar em meio de ácido sulfúrico concentrado.
Em recente trabalho deste grupo de pesquisa9 (Grupo de Pesquisas Fritz-Feigl, GPFF IQ/UNESP) verificou-se que a reação entre formaldeído e ácido cromotrópico é dependente de oxigênio dissolvido quando se trabalha com outros ácidos que não o sulfúrico concentrado. Baseado nessa constatação, propõe-se neste trabalho um novo método para a determinação de formaldeído presente em saneantes que envolve a reação deste com ácido cromotrópico (ACT) em meio de HCl e H2O2. Os resultados obtidos evidenciaram que o método proposto apresenta sensibilidade similar ao método padrão, menos inconvenientes operacionais e é potencialmente menos perigoso.
Materiais e Métodos
Instrumentação
As medidas espectrofotométricas foram realizadas utilizando-se um espectrofotômetro Hewlett Packard, mod. HP 8453, com cubetas de vidro apresentando 10 mm de caminho óptico. A fonte de calor empregada foi banho de água sob ebulição. Vidraria grau "A" e micropipetas das marcas Brand, Eppendorf e Petcelm, calibradas com água à 25ºC, foram empregadas.
Reagentes e Soluções
Todos os reagentes utilizados foram de grau analítico, marcas Aldrich, Merck ou Mallinckrodt.
-
Ácido clorídrico concentrado (37%, Mallinckrodt);
-
Solução de ácido cromotrópico (C10H6O8S2Na2.2H2O, Merck) a 5% (m/V), recentemente preparada e protegida da luz.
-
Solução de peróxido de hidrogênio 2,5x10-2 mol L-1 preparada por diluição adequada a partir da solução a 30% (m/V) e padronizada como descrito na literatura4 ;
-
Solução estoque de formaldeído 1000 mg L-1, preparada por diluição apropriada de solução a 37% (m/m, Mallinckrodt) e padronizada pelo método oficial da AOAC2 (método do peróxido de hidrogênio). De acordo com a literatura20, uma solução de formaldeído 1000 mg L-1, quando armazenada ao abrigo de luz e protegida do calor, mantêm suas características durante três meses. Uma solução nessas condições foi preparada e utilizada como matriz para o preparo das soluções mais diluídas.
Procedimento Recomendado
Curva Analítica
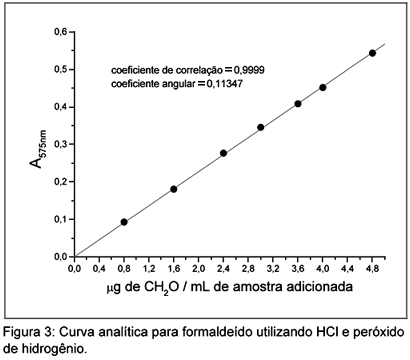
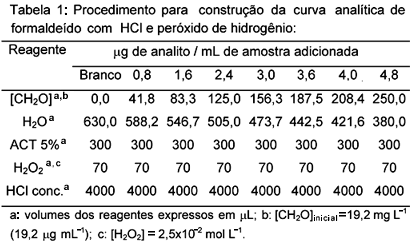
O procedimento para construção da curva de formaldeído em meio de HCl e peróxido é sumarizado na Tabela 1.
As bocas dos tubos foram recobertas com fita de PTFE e estes foram submetidos a aquecimento em banho de água sob ebulição por uma hora. Após esse período, os tubos foram resfriados até a temperatura ambiente e fez-se a leitura de absorbância em 575 nm.
Análise das Amostras
· Amostra comercial de saneante líquido: A amostra não sofreu nenhum processo de abertura, sendo adequadamente diluída e analisada pelo método padrão11,22 e pelo método proposto. Alíquota de 208 mL da amostra convenientemente diluída foi transferida para um béquer, juntamente com 422 mL de água deionizada, 300 mL de ACT 5%, 4000 mL de ácido clorídrico concentrado e 70 mL de H2O2 2,5x10-2 mol L-1, analisada segundo o método proposto. Os valores encontrados foram então comparados aos obtidos através de análises utilizando-se o método padrão.
· Amostra de desinfetante industrial sólido: Amostras sólidas contendo basicamente paraformaldeído e talco foram analisadas. A abertura da amostra consistiu na solubilização do sólido em meio ácido da seguinte forma: para cada lote, pesou-se em papel vegetal uma massa em torno de 100 mg da amostra e transferiu-se para balão volumétrico de 1000 mL. Completou-se o volume à aproximadamente metade da capacidade com água deionizada e acrescentaram-se 3,0 mL de ácido sulfúrico concentrado. Homogeneizou-se e deixou-se em repouso por 40 horas. Após esse período, completou-se o volume do balão à marca e homogeneizou-se. Alíquotas de 630 mL da amostra assim preparada, juntamente com 300 mL de ACT 5%, 4000 mL de ácido clorídrico concentrado e 70 mL de H2O2 2,5x10-2 mol L-1 foram analisadas seguindo o método proposto. Os valores encontrados foram então comparados aos obtidos através de análises utilizando-se o método padrão.
As análises das amostras sólidas e líquidas foram efetuadas em triplicata e seus sinais analíticos foram interpolados nas correspondentes curvas analíticas para formaldeído.
As metodologias aplicadas nas análises de paraformaldeído foram comparadas com o método de Georghiou11 que consiste numa modificação do método padrão recomendado pelo NIOSH22.
O gerenciamento dos resíduos químicos gerados durante a etapa experimental da pesquisa foi realizado de acordo com as orientações adotadas pela Seção de Apoio Técnico do Instituto de Química UNESP, Campus de Araraquara17.
Resultados e Discussão
A participação do oxigênio dissolvido na reação entre formaldeído e ácido cromotrópico, quando se trabalha com outros ácidos que não o sulfúrico concentrado, foi demonstrada em um recente trabalho deste grupo de pesquisa9 e deu sustentação para a elaboração da presente metodologia, a qual utiliza HCl concentrado e H2O2.
Como é bem sabido, peróxido de hidrogênio libera oxigênio molecular por decomposição térmica27 , segundo a reação:
Essa reação clássica é adotada na obtenção de uma fonte de oxigênio molecular, quando se reage formaldeído e ACT em meio de HCl e peróxido de hidrogênio, já que nessas condições a oxigenação do meio é fundamental na formação do produto colorido de interesse.
A lei de Beer é obedecida até 4,8 mg de formaldeído / mL de amostra adicionada, com um excelente coeficiente de correlação (r = 0,9999); inclinação = 0,11347). A curva analítica encontra-se representada na Figura 3.
Como a metodologia envolve HCl concentrado e peróxido, sabe-se que há invariavelmente uma contração de volume quando se adicionam soluções aquosas, não permitindo uma avaliação precisa da concentração final do produto. Portanto, decidiu-se expressar a curva analítica em função da massa de analito adicionada em 1,0 mL de amostra e não em função da concentração final, como comumente se vê em artigos nacionais e/ou internacionais, apesar que em artigo recente1 verificou-se a utilização de notação análoga a esta aqui empregada.
A possível interferência de talco presente nas amostras foi investigada e nenhuma interferência foi detectada.
Os resultados das análises, bem como a comparação com o método oficial e os devidos recobrimentos podem ser vistos na Tabela 2:
Conclusão
A metodologia proposta permite a utilização de outro ácido potencialmente menos perigoso do que o sulfúrico concentrado sem perda de sensibilidade e seletividade na determinação de formaldeído, possibilitando que novos procedimentos analíticos sejam desenvolvidos e testados para várias substâncias que liberem este ingrediente ativo.
Os resultados obtidos concordaram muito favoravelmente com aqueles obtidos pelo método oficial, mostrando que o método proposto apresenta sensibilidade e seletividade muito superiores quando comparado aos métodos titulométricos (comumente empregados nas indústrias), sem o inconveniente de se trabalhar com ácido sulfúrico concentrado.
Agradecimentos
Os autores agradecem a FAPESP, CAPES e CNPq pelo suporte financeiro e à Maria Aparecida Polli Silvestre pelo apoio técnico.
FAGNANI, E., MELIOS, C. B., PEZZA, L., PEZZA, H. R. Development of spectrophotometric method for the analysis of paraformaldehyde in commercial and industrial disinfectants. Ecl. Quím. (São Paulo), v. 27, p. , 2002.
ABSTRACT: This paper describes a spectrophotometric method for the paraformaldehyde analysis in industrial and commercial disinfectant samples using chromotropic acid, concentrated hydrochloridric acid and hydrogen peroxide. The reaction produces a violet-red compound (l max = 575 nm). The method permits the determination of paraformaldehyde over a concentration range of 0.8-4.8 mg L-1 and the results obtained by the proposed method compared very favorably with those obtained by NIOSHs standard procedure.
Keywords: disinfectant analysis, formaldehyde quantification, spectrophotometry, chromotropic acid.
Recebido em 22.02.2002.
Aceito em 09.04.2002.
** Departamento de Química Analítica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.
*** Departamento de Química Orgânica Instituto de Química UNESP 14801-970 Araraquara SP Brasil.
- 1 AMAN, T. et al. Spectrophotometric determination of amitriptyline-HCl in pure and pharmaceutical preparations. Anal. Lett., v.33, p. 2477-2490, 2000.
-
2ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS. Official methods of analysis of AOAC International: AOAC official method 898.01 Formaldehyde in pesticide formulations, hydrogen peroxide method. 16th.ed. Arlington: AOAC INTERNATIONAL, 1995, v.2, p.99.
- 3 BALMAT, J. L., MEADOWS, G. W. Monitoring of formaldehyde in air. Am. Ind. Hyg. Assoc. J., v.46, p.578-584, 1985.
- 4 BASSET, J. et al Análise inorgânica quantitativa. 4.ed. Rio de Janeiro: Guanabara Dois, 1981. p.265.
- 5 BRICKER, C. E.; VAIL, W. A. Microdetermination of formaldehyde with chromotropic acid. Anal. Chem., v.22, p.720-722, 1950.
- 6 DEDOV, A. G. et al. Indirect determination of formaldehyde by alternating-current voltammetry at a hanging mercury drop in the presence of oxygen. J. Anal. Chem., v.55, p.583-585, 2000.
- 7 EKBERG, D. R.; SILVER, E. C. Rapid spectrophotometric method for formaldehyde detection. Anal. Chem., v.38, p.1421-1422, 1966.
- 8 ELECTRON microscopy sciences - Paraformaldehyde solution 16%. Disponível em: : <http://www.emsdiasum.com/ems/chemicals/nma.html#15700>. Acesso em: 30 mar 2001.
- 9 FAGNANI, E.; MELIOS, C. B.; PEZZA, L.; PEZZA, H. R. Chromotropic acid - formaldehyde reaction in strongly acid aqueous media. The role of molecular oxygen. Anal. Chim. Acta, 2002. Submetido.
- 10 FORMALDEHYDE in air. MDHS 19. London: Health and Safety Executive, HMSO, 1983 apud PICKARD, A. D.; CLARK, E. R. The determination of traces of formaldehyde. Talanta, v.31, p.763-771, 1984.
- 11 GEORGHIOU, P. E.; HO, C. K. The Chemistry of the chromotropic acid method for the analysis of formaldehyde. Can. J. Chem., v.67, p.871-876, 1989.
-
12BRASIL. Governo Federal. Farmacopéia brasileira: formaldeído, solução. 4.ed. São Paulo: Atheneu, 1988. parte 1, p.XII.2.-13.
- 13 HODGMAN, C.D. (Ed.). Handbook of chemistry and physics. 42nd.ed. Cleveland: The Chemical Rubber, 1960. p.1172-1173.
- 14 HASLAM, J.; SQUIRRELL, D. C. M. Further observations on automatic titrimetry. Analyst, v.82, p.511-517, 1957.
- 15 HAWLEY diccionario de química y de productos químicos. Barcelona: Omega, 1993. p.755.
- 16 HOPPS, H. PurpaldŇ : a reagent that turns aldehydes purple! Aldrich Acta, v.33, p.28-30, 2000.
-
17UNIVERSIDADE ESTADUAL PAULISTA. Instituto de Química. Normas para organização e funcionamento do depósito de drogas para pesquisa e para gerenciamento de resíduos químicos. Disponível em : <http://intranet.iq.unesp.br/apoiotec/droga.htm> . Acesso em: 21 fev. 2001.
- 18 KOUPPARIS, M. A.; EFSTATHIOU, C. E.; HADJIIOANNOU, P. Kinetic determination of formaldehyde and hexamethylenetetramine with a cyanide-selective electrode. Anal. Chim. Acta, v.107, p.91-100, 1979.
- 19 LEE, C. W.; FUNG, Y. S.; FUNG, K.W. Determination of formaldehyde vapor in the atmospheres of clinical laboratories using chromotropic acid. Analyst, v.107, p.30-34, 1982.
- 20 LODGE JR, J. P. Methods of air sampling and analysis 3rd.ed. London: Longman, 1971. p.350.
- 21 MILKSCH, R. R. et al. Modified pararosaniline meted for the determination of formaldehyde in air. Anal. Chem., v.53, p.2118-2123, 1981.
-
22NATIONAL INSTITUTE FOR OCCUPATIONAL SAFETY AND HEALTH. NIOSH manual of analytical methods (NMAN): method 3500(2) Formaldehyde, 4th.ed. 1994. p.1-5.
- 23 PICKARD, A. D.; CLARK, E. R. The determination of traces of formaldehyde. Talanta, v.31, p.763-771, 1984.
- 24 Safety data for paraformaldehyde. Disponível em : <http://physchem.ox.ac.uk/MSDS/P/paraformaldehyde.html>. Acesso em: 30 mar 2001.
- 25 GANGOLLI, S. (Ed.). THE dictionary of substances and their effects. 2nd.ed. Cambridge: Royal Society of Chemistry, 1999. v.6, p. p8par-p9par.
- 26 BUDAVARI, S. (Ed.). THE Merck index. 12nd.ed. Whitehouse Station: Merck, 1996. p.1207.
- 27 VOGEL, A. I. Química analítica qualitativa 5.ed. Săo Paulo: Mestre Jou, 1981. p.412.
- 28 WEST, P. W., SEN, B. Spectrophotometric determination of traces of formaldehyde. Fresenius Z. Anal. Chem., v.153, p.177-183, 1956.
- 29 WOO, C. S.; BARRY, S. E.; ZAROMB, S. Detection and estimation of part-per billion levels of formaldehyde using a portable high-throughput liquid absorption air sampler. Environ. Sci. Technol., v.32, p.169-176, 1998.
Datas de Publicação
-
Publicação nesta coleção
02 Set 2002 -
Data do Fascículo
2002
Histórico
-
Aceito
09 Abr 2002 -
Recebido
22 Fev 2002