Resumos
Partículas esféricas de sílica foram obtidas via microemulsão inversa em sistema AOT / Heptano / H2O, utilizando-se soluções de silicato de sódio como precursor. Variações de condições experimentais durante a precipitação levam à mudanças no tamanho e na forma das partículas. O objetivo deste trabalho é otimizar a obtenção de partículas de sílica com homogeneidade de forma e tamanho, variando-se a ordem de adição dos reagentes, a concentração da solução de silicato de sódio, a razão água/surfactante (W), a ordem de mistura dos reagentes e a purificação do produto obtido. As micrografias evidenciaram que para se obter partículas esféricas, com faixa estreita de tamanho, utiliza-se duas microemulsões inversas a partir das soluções de ácido nítrico e de silicato de sódio, sendo que a mistura destas deve ser feita adicionando-se a microemulsão contendo o silicato de sódio sobre a microemulsão contendo o ácido nítrico. A relação silicato de sódio:água mais adequada de para os objetivos do trabalho é de 1:10. A purificação mais eficiente é aquela feita em duas etapas, com etanol e com água quentes. A partir dos resultados obtidos, pode-se verificar também que quanto maior o W maior será o tamanho médio de partícula.
microemulsão inversa; sílica; morfologia
Silica spherical particles were prepared in reverse microemulsion from sodium silicate solution precursor. Particle shape and size changes were investigated in function of reactants addition order, sodium silicate solution concentration and water to surfactant ratio (W) and product separation and purification. This paper reports on the uniform spherical silica particles preparation in function of the mentioned different experimental conditions. Scanning electron micrographs show uniform spherical silica particle obtained from the mixture of two reverse microemulsion: microemulsion A with soluble sodium silicate was added to a microemulsion B with nitric acid solution. Concentrated sodium silicate solution was diluted to 1:10 (silicate:water) ratio. Separation and purification was carried out in two steps with hot ethanol and water. The average particle size increases as W increases.
reverse microemulsion; silica; particle shape
Estudo de alguns esfeitos na precipitação de partículas esféricas de sílica via microemulsão inversa
Studies of some effects on the preparation of spherical silica particles from reverse microemulsion
Juliana FlorI; Marian Rosaly DavolosI; Miguel Jafelicci JúniorII
IDepartamento de Química Geral e Inorgânica - Instituto de Química - UNESP - 14801-970 - Araraquara - SP - Brasil
IIDepartamento de Físico-Química - Instituto de Química - UNESP - 14801-970 - Araraquara - SP - Brasil
RESUMO
Partículas esféricas de sílica foram obtidas via microemulsão inversa em sistema AOT / Heptano / H2O, utilizando-se soluções de silicato de sódio como precursor. Variações de condições experimentais durante a precipitação levam à mudanças no tamanho e na forma das partículas. O objetivo deste trabalho é otimizar a obtenção de partículas de sílica com homogeneidade de forma e tamanho, variando-se a ordem de adição dos reagentes, a concentração da solução de silicato de sódio, a razão água/surfactante (W), a ordem de mistura dos reagentes e a purificação do produto obtido. As micrografias evidenciaram que para se obter partículas esféricas, com faixa estreita de tamanho, utiliza-se duas microemulsões inversas a partir das soluções de ácido nítrico e de silicato de sódio, sendo que a mistura destas deve ser feita adicionando-se a microemulsão contendo o silicato de sódio sobre a microemulsão contendo o ácido nítrico. A relação silicato de sódio:água mais adequada de para os objetivos do trabalho é de 1:10. A purificação mais eficiente é aquela feita em duas etapas, com etanol e com água quentes. A partir dos resultados obtidos, pode-se verificar também que quanto maior o W maior será o tamanho médio de partícula.
Palavras-chave: microemulsão inversa, sílica, morfologia.
ABSTRACT
Silica spherical particles were prepared in reverse microemulsion from sodium silicate solution precursor. Particle shape and size changes were investigated in function of reactants addition order, sodium silicate solution concentration and water to surfactant ratio (W) and product separation and purification. This paper reports on the uniform spherical silica particles preparation in function of the mentioned different experimental conditions. Scanning electron micrographs show uniform spherical silica particle obtained from the mixture of two reverse microemulsion: microemulsion A with soluble sodium silicate was added to a microemulsion B with nitric acid solution. Concentrated sodium silicate solution was diluted to 1:10 (silicate:water) ratio. Separation and purification was carried out in two steps with hot ethanol and water. The average particle size increases as W increases.
Keywords: reverse microemulsion, silica, particle shape
Introdução
As aplicações de materiais com forma esférica estão relacionadas com a uniformidade da microestrutura e a confiabilidade nas propriedades. A habilidade em sintetizar e fabricar materiais com partículas de geometria esférica, sejam ocas ou sólidas, fornece componentes com importante capacidade de desempenho para uma grande variedade de produtos13.
Partículas esféricas são utilizadas para uma grande variedade de aplicações, incluindo: suporte para catalisadores 15, material de implante dentário 12, abrasivo 8, superfícies refletoras 6, suporte para recobrimento 10, encapsulação e microencapsulação para remédios, cosméticos, produtos agrícolas 2, 11, 9, varistores e fósforos 14, etc.
Diferentes métodos têm sido desenvolvidos para a produção, em grande escala, de materiais de forma esférica incluindo óxidos cerâmicos e vítreos, metais, polímeros e compostos orgânicos. Uma pequena classificação pode ser feita referente às técnicas utilizadas, baseando-se em categorias genéricas: a) caroços de sacrifício, b) sistemas de bico nebuilizador, c) emulsão - técnica de separação de fases, d) cominuição 13.
Nos últimos 10 anos, a pesquisa básica e aplicada sobre a estrutura, dinâmica e interações de microemulsões motivou a estratégia de se utilizar esses sistemas auto-organizados como um conjunto de microreatores dentro dos quais ocorrem as reações químicas de formação de partículas finas 4. Em trabalhos recentes, resultados obtidos na preparação de partículas de sílica por hidrólise de tetraetoxisilano (TEOS) em microemulsões inversas foram relatados1. Sílica com tamanho de 50 70 nm foi preparada em sistema de micelas inversas pelo controle de hidrólise de TEOS em surfactante não iônico (Igepal) hidróxido de amônio - ciclohexano 3 e em surfactante aniônico AOT hidóxido de amônio - decano 1. Sílica também foi obtida a partir de microemulsão inversa, em sistema AOT - heptano - água, utilizando-se solução de silicato de sódio como precursor 7, porém nenhum estudo relativo aos efeitos de mudanças das condições de obtenção sobre o tamanho médio de partícula foi feito. Cabe salientar que a purificação das partículas foi feita através de diálise utilizando-se membranas, a quantidade de amostra obtida em cada precipitação foi pequena e nenhuma investigação referente a distribuição de tamanho médio de partícula foi feito. Neste trabalho utilizou-se o método de microemulsão inversa para obter partículas de sílica esféricas e ocas com tamanho da ordem de 2mm. Sabe-se que pequenas variações durante a precipitação de sílica, via microemulsão inversa, podem levar às mudanças no tamanho e na forma das partículas. Assim, o objetivo geral do trabalho é otimizar a obtenção de partículas de sílica com homogeneidade de forma e de tamanho, para obtenção de maior quantidade de amostra. Para isso variou-se os seguintes parâmetros: 1)ordem de adição dos reagentes, 2) concentração da solução de silicato de sódio, 3) razão água/surfactante (W), 4) ordem de mistura dos reagentes e 5) purificação do produto obtido.
Material e métodos
Todas as amostras foram preparadas a partir de AOT, bis (2 etil hexil) sulfosuccinato de sódio (Sigma), n-heptano (Synth), solução de ácido nítrico 3 mol.L-1 (Merck) e solução de silicato de sódio - H.300 NDL (Crosfield). A precipitação durou uma semana sob agitação, 25 300C em ultra-som e rotação de 4 horas por dia em rotaevaporador. Variou-se a ordem de adição dos reagentes, concentração da solução de silicato de sódio, razão água / surfactante (W), método de mistura dos reagentes, e purificação da sílica obtida. As amostras foram preparadas e na Tabela 1 estão esquematizadas as preparações de cada uma das amostras para uma melhor visualização de resultados.
Amostra M0
Adicionou-se em dois erlenmeyers 3,07g AOT e 120 mL de heptano e deixou-se em ultra-som por aproximadamente 10 minutos até a total dissolução do AOT. A cada erlenmeyer adicionou-se 0,62 mL de água desionizada. Após agitação em ultra-som por aproximadamente 20 minutos adicionou-se 0,8 mL de solução de HNO3 3 mol L-1 em uma das microemulsões, denominada A, e 0,8 mL da solução de silicato de sódio (1:18,5) na outra denominada B, ambas sob agitação em banho de ultra-som. Passados 20 minutos para estabilização das microemulsões adicionou-se a microemulsão A em um balão de fundo redondo e misturou-se, sob ultra som, a microemulsão B. A mistura resultante das microemulsões foi então colocada em rotação em rotoevaporador sem aquecimento e em agitação de ultra-som por 4 horas por dia durante uma semana. Após este período o heptano foi evaporado a 90 0C e o precipitado foi lavado 3 vezes com etanol quente e 3 vezes com água quente. Para a separação, a solução foi centrifugada a 4000 rpm por 20 minutos. Uma amostra do sólido úmido foi depositada em suporte para microscopia eletrônica de varredura.
Amostra M1
Preparada de maneira análoga à amostra M0, porém, a solução de silicato de sódio utilizada foi mais concentrada, na proporção de 1:10, visando-se obter uma maior quantidade de precipitado. A microemulsão B foi adicionada à microemulsão A. O período de precipitação e a purificação foram os mesmos descritos para a amostra M0.
Amostra M2
A amostra M2 foi preparada, de maneira semelhante à amostra M0, sem a adição dos 0,62 mL de água em cada erlenmeyer. Neste caso a microemulsão A foi formada apenas com a água da solução aquosa de ácido nítrico. A ordem de mistura foi microemulsão B adicionada à A. O período de precipitação e a purificação foram os mesmos descritos para a amostra M0.
Amostra M3
A precipitação da sílica na amostra M3 foi feita em um único erlenmeyer, ao qual adicionou-se 6,15 g de AOT e 240 mL de n-heptano sob agitação de ultra-som, até a dissolução total do AOT. A esta solução adicionou-se 1,24 mL de água desionizada mantendo-se a agitação em ultra-som. Após 20 minutos adicionou-se 1,6 mL de vidro líquido (1:10) e depois de alguns minutos 1,6 mL de HNO3 3 mol L-1. O período de precipitação e a purificação foram os mesmos descritos para a amostra M0.
Amostra M4
A amostra M4 foi preparada da mesma maneira que a amostra M3 invertendo-se a ordem de adição dos reagentes. Primeiramente adicionou-se 1,6 mL de HNO3 3 mol L-1 e depois de aproximadamente 20 minutos, adicionou-se 1,6 mL de vidro líquido (1:10). O período de precipitação e a purificação foram os mesmos descritos para amostra M0.
Amostra M5
Esta amostra foi preparada adicionando-se 1,6 mL de HNO3 3 mol L-1 a um erlenmeyer contendo solução de 6,15 g de AOT e 240 mL de n-heptano sob agitação em ultra-som e, após 20 minutos 1,6 mL de vidro líquido 1:10. O período de precipitação e a purificação foram os mesmos descritos para a amostra M0.
Amostra M6
Esta amostra foi preparada da mesma maneira que a amostra M0, porém adicionando-se solução de silicato de sódio original (21,06% SiO2), visando-se assim obter uma maior quantidade de sílica esférica precipitada do que na amostra M1. O período de precipitação e a purificação foram os mesmos descritos para a amostra M0.
Amostra M7
Esta amostra foi preparada da mesma forma que a amostra M1, a única diferença foi na purificação. O período de precipitação foi o mesmo descrito para amostra M0. Para este caso o sólido obtido foi lavado apenas com água desionizada quente.
Amostra M10
Esta amostra foi preparada da mesma forma que a amostra M1, mas purificada de modo diferente O período de precipitação foi o mesmo descrito para amostra M0. Para este caso o sólido obtido foi lavado primeiramente com água desionizada quente e depois com etanol quente.
Amostra M12
A preparação desta amostra foi igual a da amostra M1 porém adicionou-se um volume de água deionizada bem maior em cada erlenmeyer, 6,22 mL de água.
A Tabela 1 resume a identificação das amostras com a ordem e as proporções dos reagentes, e a purificação das partículas de sílica. Os valores de W (razão água/surfactante) para as diferentes amostras estão na Tabela 2.
A caracterização das amostras foi feita por Microscopia Eletrônica de Varredura (SEM) e Espectroscopia Vibracional na região do Infravermelho (IR). Para SEM utilizou-se o microscópio eletrônico de varredura (JEOL JSM). As amostras de sílica foram suspensas em etanol e depositadas em lâminas de vidro sendo estas fixadas em suporte metálico com cola Super Bonder. Fez-se a metalização com ouro das amostras através de sputtering (Edward S150B) e antes de serem observadas ao microscópio fez-se o contato da lâmina de vidro com o suporte com tinta de prata para evitar o carregamento das partículas. Os espectros IR foram obtidos em espectrômetro infravermelho (Perkin Elmer Spectrum 2000). As amostras foram preparadas dispersando as diferentes amostras de sílica em KBr na proporção 1:9 em massa, as quais foram submetidas a pressão de cerca de 10 Kbar para formação de pastilhas transparentes.
Tratamento dos dados experimentais
O estudo estatístico do diâmetro médio e faixa de distribuição de tamanho das partículas foi realizado utilizando-se o programa computacional "Image Craft", em sistema UNIX, instalado em um computador acoplado ao microscópio eletrônico de varredura. A descrição detalhada da utilização deste programa está descrita em, Flor, et al., 2000 5.
Resultados e discussões
Nas Figuras 1 - 7 estão as fotomicrografias das diferentes amostras de sílica M0, M1, M3, M4, M6, M7 e M10. Pela observação e comparação dos resultados destas micrografias foi possível discutir os seguintes efeitos: 1) ordem de adição dos reagentes, 2) concentração da solução de silicato de sódio e 3) purificação.
Efeito da ordem de adição dos reagentes
A faixa de distribuição de tamanho de partícula da amostra M3, qualitativamente observada na Figura 3 é mais extensa. Nesta amostra, onde a dispersão de tamanho é grande, a maior parte das partículas é pequena, as quais se encontram preferencialmente agregadas. A forma esferoidal não foi observada principalmente nas partículas menores. Na micrografia da amostra M4, Figura 4, as partículas de sílica obtidas apresentam forma esférica com tamanho mais homogêneo e da ordem de 2 mm, conforme se constata para a maioria das demais amostras.
Ressalta-se que a amostra M3 foi preparada em uma microemulsão onde primeiramente adicionou-se a solução de silicato de sódio e depois a solução de ácido nítrico, enquanto que para a amostra M4 inverteu-se a ordem dos reagentes, adicionando-se a solução de ácido nítrico e depois a solução de silicato de sódio.
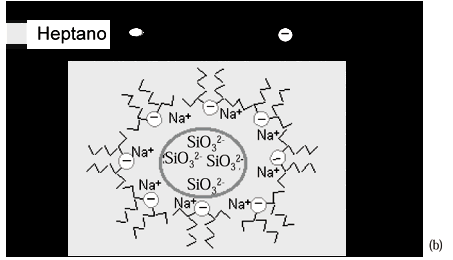
A diferença dos resultados para as partículas das micrografias das amostras M3 e M4 (Figuras 3 e 4) pode ser explicada segundo o modelo da microemulsão7. O modelo para a amostra M3 pressupõe a preparação das partículas de sílica formadas na microemulsão inversa, surfactante AOT - heptano - água, com a proporção água / surfactante W = 18. Nestas micelas, a cauda apolar do surfactante em contato com o n-heptano e a cabeça do surfactante em contato com a parte polar, estão representados na Figura 8 (a). Os cátions Na+ estão adsorvidos na camada elétrica da fase aquosa na interface água / n-heptano próximo as cargas negativas referentes aos grupos SO3- do AOT. Ao adicionarmos a solução de silicato de sódio, os grupos SiO3- ficam distribuídos no meio das gotículas de fase aquosa conforme a Figura 8 (b). Ao adicionarmos a solução de ácido nítrico ocorre a precipitação da sílica sem seguir a conformação molecular da microemulsão, dando origem às partículas com tamanho menor, sendo que grande parte das partículas obtidas não apresentam forma esférica, Figura 8 (c). As partículas pequenas obtidas neste caso apresentam elevada densidade de carga na superfície e agregam-se devido à intensa força de atração partícula - partícula resultando na amostra com agregados.
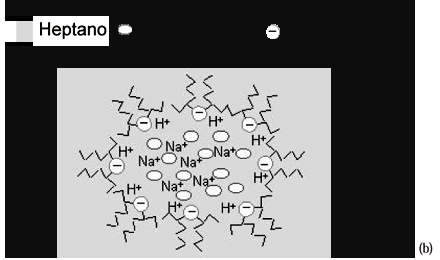
Um modelo um pouco diferente é proposto para a amostra M4 na Figura 9. Neste caso inicialmente tem-se a formação das microemulsão inversas, Figura 9 (a). Em seguida com a adição de ácido nítrico o H+ irá ocupar o lugar do Na+ já que o acido sulfônico é mais fraco ficando, portanto preferencialmente na interface água-heptano enquanto o Na+ pode ser mais difusamente distribuído no interior das gotículas, Figura 9 (b). Com a adição da solução de silicato de sódio, temos a polimerização do silicato preferencialmente na região de pH menor, que está na interface com H+, precipitando então uma casca esférica de sílica, Figura 9 (c). Portanto neste modelo a precipitação da sílica em ambiente organizado da microemulsão irá seguir o molde criado pela gotícula da fase aquosa da microemulsão. A forma e o tamanho são definidos pela natureza da microemulsão, justificando a formação das partículas de sílica esféricas e ocas.
Em algumas preparações pode-se observar a formação de partículas sólidas menores dentro das partículas ocas obtidas. Durante o processo de polimerização dos silicatos na casca da microemulsão os grupos silicatos não estão presentes apenas na região de interface água / n-heptano, estendendo-se para o interior da gotícula. Parte do silicato de sódio se difunde para o interior da gotícula de água da microemulsão formando as partículas de sílica sólidas. Partículas ocas e esféricas são obtidas de sistemas com a precipitação ocorrendo na casca da microemulsão e para que isto aconteça adiciona-se primeiramente, a solução de ácido nítrico e depois a solução de silicato de sódio na microemulsão.
Efeito da concentração da solução de silicato de sódio
O aumento da concentração de silicato de sódio na microemulsão das amostras M0, M1 e M6 foi estudado e os resultados estão nas Figuras 1, 2 e 5. Comparando-se as micrografias das amostras M0 e M1, Figuras 1 e 2, constata-se que obteve-se partículas esféricas de sílica com tamanhos médios de mesma ordem de grandeza. A massa final de sílica esférica, utilizando-se solução mais concentrada de silicato de sódio, obtida na amostra M1 é maior que para a amostra M0. Para a amostra M6, obtida com a solução original de silicato de sódio, o resultado da micrografia da Figura 5 indica a existência de agregados de sílica sem forma definida. Este resultado está relacionado ao fato de que a concentração elevada de silicato de sódio causa grande perturbação na organização molecular da microemulsão e desestabiliza a estrutura da interface, quebrando as gotículas formadas na microemulsão. A solução original de silicato de sódio aumenta a força iônica da microemulsão. Este aumento da força iônica juntamente com a formação de produtos da reação de polimerização de sílica causa a ruptura da estrutura organizada da microemulsão que orienta a forma e a distribuição do tamanho de partículas. As micrografias das amostras M0, M1 e M6 indicam que a melhor concentração de silicato de sódio para a obtenção de maior quantidade de sílica esférica é a solução de silicato de sódio 1:10 (silicato de sódio:água).
Efeito da purificação
As micrografias das Figuras 2, 6 e 7 correspondem às amostras M1, M7 e M10, respectivamente preparadas pelo mesmo método, e enfatizam o efeito da separação e purificação de sílica da microemulsão. A amostra M1 foi purificada primeiramente três vezes com etanol quente e depois três vezes com água quente. A amostra M7 foi purificada apenas três vezes com água quente e a amostra M10 primeiramente três vezes com água quente e depois três vezes com etanol quente.
As amostras M1 e M10, Figuras 2 e 7, consistem de partículas de sílica com a superfície sem partículas pequenas agregadas. Para a amostra M7, Figura 6, as partículas estão parcialmente cobertas por um sólido, provavelmente o surfactante que não foi totalmente eliminado durante o processo de purificação. Apesar das amostras M1 e M10 não apresentarem diferenças visíveis em suas fotos é importante ressaltar a ação tensoativa do surfactante na superfície das partículas. Na purificação da amostra M10 com a água houve formação de uma solução turva e espumante, enquanto na amostra M1, o etanol utilizado para lavagem desestabiliza a espuma devido à baixa tensão superficial das bolhas e facilita a purificação da sílica precipitada eliminando as partículas finas adsorvidas/agregadas.
As atribuições relativas aos modos de vibração, no IR das amostras M1 e M10 estão na Tabela 3.
A banda larga e intensa na região de 1300 a 1000 cm-1, é atribuída ao estiramento assimétrico Si-O, o pico na região de 950 cm-1 ao estiramento assimétrico SiO- e aquele em 790 cm-1 ao estiramento simétrico Si-O. A banda larga na região 3500 cm-1, é atribuída aos estiramentos do grupo silanol e da água. Observa-se também em torno de 1644 cm-1 a deformação O-H referente à água.
Nos espectros da amostra M7, observa-se em torno de 1731 cm-1 o estiramento C=O do grupo éster referente ao surfactante AOT16 e em 2952 cm-1 o desdobramento assimétrico C-H, do grupamento metila17, também referente ao AOT. Os estiramentos simétrico e assimétrico de SO3- que deveriam ocorrer de 1.000 a 1.230 cm-1 devem estar encobertos pela banda referente à sílica. É importante ressaltar que nesta amostra a purificação da sílica obtida foi feita apenas com água. Nos espectros da amostra M1 estas bandas não aparecem, pois a sílica obtida foi purificada com etanol e água removendo o AOT. Não foi observado evento térmico na análise térmogravimétrica referente à reação de tensoativo presente na sílica.
Pelos resultados de micrografias eletrônicas e dos espectros vibracionais pôde-se escolher o melhor método de purificação para sílica obtida. A lavagem com etanol quente e depois com água quente, descrita para a amostra M1 resulta em partículas livres de resíduo do tensoativo AOT.
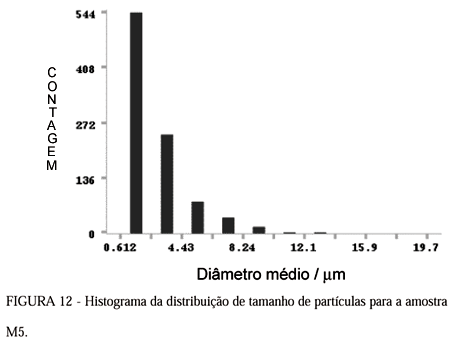
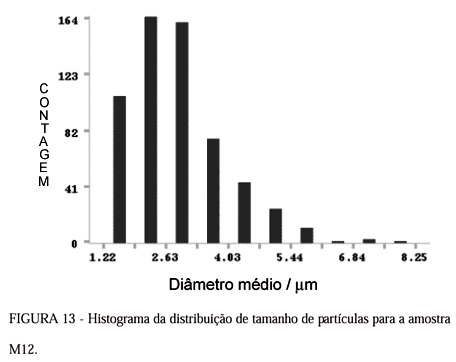
A influência da razão W (razão água/surfactante) e da ordem de mistura dos reagentes não puderam ser avaliadas apenas pelas medidas de MEV. Estes efeitos foram estudados através de medidas de tamanho médio de partícula e os resultados da análise de imagens das micrografias com o programa computacional Image Craf estão nas Figuras 10 13. Estes permitiram a construção de histogramas de distribuição média de tamanho de partícula para as amostras M1, M2, M5 e M12, respectivamente, e nas Tabelas 4 - 7 estão os parâmetros estatísticos para estas mesmas amostras.
Efeito do W (razão água / surfactante)
Para uma análise do efeito do W temos que comparar os histogramas das amostras M1, com W=11, e a amostra M12, com W=56. O histograma mostrado na Figura 10 correspondente à amostra M1 apresentou moda igual a 1,55 m m e o histograma mostrado na Figura 13 correspondente à amostra M12 apresentou moda igual a 2,07 mm. Para a amostra M12 as partículas são maiores devido ao fato da maior quantidade de água adicionada no sistema ter aumentado o tamanho das gotículas da microemulsão que serviram de moldes ou microreatores para a precipitação da sílica.
Comparando-se os resultados das Tabelas 4 e 7, referentes às amostras M1 e M12, respectivamente, pode-se inferir que os resultados ilustrados no histograma discutidos em relação às modas destas amostras estão coerentes com os dados das tabelas. O valor do diâmetro médio calculado para amostras M1, 2,63 mm, é relativamente menor que o diâmetro médio calculado de 3,01 mm para a amostra M12. Assim sendo, através dos histogramas apresentados nas Figuras 10 e 13 e dos resultados das Tabelas 4 e 7, pode-se afirmar que o efeito do W é proporcional ao tamanho médio de partícula. Para W maior como no caso da amostra M12, W=56, tem-se tamanhos médios de partículas maiores.
Outros resultados, tais como: perímetro, volume das esferas e razão do aspecto são fornecidos para as duas amostras, sendo que este último refere-se à forma das partículas. Quando a razão do aspecto é igual a 1, a forma atribuída é a de uma esfera perfeita. Os valores médios da razão do aspecto são 1,39 e 1,30 para as amostras M1 e M12, respectivamente. Portanto a forma esférica das partículas de sílica também pôde ser constatada e quantitativamente atribuída pela técnica adotada no programa Image Craft.
Efeito da forma de mistura dos reagentes
O efeito do método de mistura dos reagentes pôde ser estudado comparando-se os histogramas das Figuras. 11 e 12 referentes às amostras M2 e M5, respectivamente. Para a amostra M2 a moda de 2,18 mm com tamanhos de partículas pouco maiores que da amostra M5 com moda de 1,53 mm. A diferença destas duas amostras é que a amostra M2 foi preparada a partir de duas microemulsões (A e B). Ao misturar as duas microemulsões inversas ocorre interação entre as gotículas dispersas. Essa interação resulta na troca entre as soluções polares e/ou na coalescência das gotículas. Pela análise dos valores das modas pode-se inferir que houve coalescência das gotículas uma vez que o W no caso da amostra M2 em cada recipiente é a metade do W da amostra M5 preparada em um único recipiente. Esta coalecência entre as gotículas das duas microemulsões permite que a mistura das soluções polares aconteça de maneira mais controlada do que no caso da microemulsão em único recipiente. Neste último exemplo a solução de silicato de sódio deve ser inserida nas gotículas da microemulsão pré-estabilizada. Comparando-se os resultados das Tabelas 5 e 6, referentes às amostras M2 e M5, respectivamente, pode-se inferir que os resultados ilustrados no histograma discutidos em relação às modas destas amostras estão coerentes com os valores dos parâmetros das tabelas 5 e 6.
Conclusões
A partir das microscopia eletrônica de varredura e do programa computacional "Image Craft" estudou-se diferentes efeitos de síntese na formação de partículas de sílica esférica obtidas em microemulsão inversa. Para a obter partículas esféricas de sílica com uma faixa de distribuição de tamanho mais estreita, deve-se preparar duas microemulsões inversas, misturando-se a microemulsão com silicato de sódio na microemulsão com ácido nítrico.
A relação de 1:10 (silicato de sódio: água) é a mais indicada para se obter a maior quantidade de sílica sem alterar a forma ou o tamanho das partículas. A purificação mais eficiente para a sílica consiste da lavagem em duas etapas, primeiramente com etanol quente e depois com água quente.
Agradecimentos
Os autores agradecem o apoio financeiro do projeto e JF a bolsa de mestrado recebido da Fapesp.
Recebido em 08.03.2002
Aceito em 28.03.2002
- 1 ARRIAGADA, F.J.; OSSEO, K.A. Syntesis of nanosize in aerosol OT reverse microemulsions. J. Coll. Interf. Sci., v.170, p.817,1995.
- 2 ARSHADY, R. Microspheres and microcapsules, a survey of manufacturing techniques. 3. Solvent evaporation. Poly. Eng. Sci., v.30, p.915-924, 1990.
- 3 ASSARE, K.O.; ARRIAGADA. Preparation of SiO2 nanoparticles in a non - ionic reverse micelar system. J. Coll. Interf. Sci., v.50, p.321339, 1990.
- 4 CASADO, J.; IZQUIERDO, C.; FUENTES, S. Microemulsions as a new working medium in physical chemistry. J. Chem. Educ., v.71, p.446-450, 1994.
- 5 FLOR, J.; PIRES, A. M.; RANGEL, F. L. C.; JAFELICCI JR., M. ; DAVOLOS, M. R. Partículas de sílica esféricas de microemulsão analisadas por "Image Craft". In: CONGRESSO BRASILEIRO DE CERÂMICA, 44., 2000, São Pedro, S.P. 1 CD-ROM.
- 6 GREINER-BAER, G.; VOGEL, G.; SCHMIDT, W.; SCHAEFER, M.; BAEZ, H.; BERGMANN, H.; HOFFMANN, U.; HERMANN, M.; ABICHT, U. U.S. Patent No. 282 675, 19 Sept., 1990.
- 7 JAFELICCI JR, M.; DAVOLOS, M. R.; SANTOS, F. J.; ANDRADE; S.J. Hollow silica particles from microemulsion. J. Non-Cryst. Solids, v.247, p.98-102, 1999.
- 8 MATSUMOTO, K.; TAGUCHI, T. U.S. Patent No. 4 666 465, 1987.
- 9 OGASAWA, T.; YONEHARA, H.; OKABAYASHI, H.; et al. Raman and IR studies of the interaction between aerosol OT and polyaminopropylsiloxane.Vib. Spectrosc., v. 20, p.198-194, 1999.
- 10 PERAREK, K.J.; JACOB, J.S.; MATHIOWITZ, E. double-walled polymer microspheres for controlled drug-release. Nature, v.360, p.258-260, 1994.
- 11 SOCRATES, G. Infrared characteristic group frequencies. 2nd ed. New York: Wiley, 1994, 170p.
- 12 SPECKMAN, D. M.; JACKSON, C. A. Synthesis of idium oxide microspheres for antistatic spacacraft coatings. Mater. Res. Soc., v.372, p.247-252, 1995.
- 13 THOMA, K.; SCHLUETERMANN, B. Factors influencing the stability of enteric coated drugs after temperature stress. Pharmamazie, v.47, p.30, 1992.
- 14 VIT, J.; SALSBUR, R.L.; HENDERSON, D.J. U.S. Patent No. 4 693 986, 15 Sept., 1987.
- 15 WILCOX D.L.; BERG, M. Microsphere fabrication and aplications: An overview. Mater. Res. Soc., v.372, p.3-13, 1995.
- 16 ZAMPRONIO, C.G.; DAVOLOS, M.R.; STUCCHI, E.B.; JAFELICCI, M.Jr. Spherical particles of pure and manganese doped zinc oxide and zinc hidroxicarbonate. Mater. Res. Soc., v.372, p.69-74, 1995.
- 17 ZHANG, S.C.; MESSING, G.L.; LEE, S.Y.; SANTORO; R.J. Formation of solid and holow spherical particles by spray pyrolysis. Mater. Res. Soc., v.372, p.49-56, 1995.
Datas de Publicação
-
Publicação nesta coleção
23 Abr 2003 -
Data do Fascículo
2002
Histórico
-
Recebido
08 Mar 2002 -
Aceito
28 Mar 2002