RESUMO
Muitos fitopatógenos de ampla distribuição geográfica como os fungos fitopatogênicos do gênero Rhizoctonia, estão sujeitos a extremas flutuações de temperatura em seus habitats. Para sobreviver a tais flutuações térmicas, esses organismos desenvolveram a habilidade de regular seus valores fenotípicos para adaptações térmicas bem como a outras variações ambientais específicas. O objetivo do presente estudo foi determinar o efeito do estresse térmico na evolucionabilidade para crescimento micelial de duas populações hospedeiro-distintas de Rhizocctonia solani AG-1 IA infectando arroz (OS6) ou Urochloa (BBT1) e compará-las a uma população de R. oryzae-sativae de arroz (OS5), espécie adaptada a temperaturas mais elevadas. As populações foram submetidas a duas temperaturas de crescimento: 25°C e 35°C (temperatura ótima e de estresse para R. solani AG-1 IA). Baseando-se em medidas do crescimento micelial, estimaram-se os coeficientes de variância genotípica (IG), variância ambiental (IE) e herdabilidade no sentido amplo (h2) como medidas de evolucionabilidade. Enquanto a população OS5 de R. oryzae-sativae foi pouco influenciada pelo estresse térmico, a 35oC detectou-se redução de h2 nas populações BBT1 e OS6 de R. solani AG-1 IA. Entretanto, os valores relativamente altos de h2 a 35oC (0,63 ± 0,07) indicaram que tanto a população BBT1 quanto a OS6 de R. solani AG-1 IA têm potencial de adaptação ao estresse térmico.
Palavras-chave
Variância genética; adaptação térmica; estresse ambiental; evolucionabilidade
ABSTRACT
A large number of widely distributed plant pathogens such as the phytopathogenic fungi of the genus Rhizoctonia are subject to extreme temperature fluctuations in their habitats. To survive such thermal fluctuations, these organisms have developed the capability of regulating their phenotypic values for specific thermal adaptations and to other specific environmental variations. The objective of this study was to determine the effects of thermal stress on the evolvability for mycelial growth in two host-distinct populations of Rhizoctonia solani AG-1 IA infecting either rice (OS6) or Urochloa (BBT1), and to compare them with a population of R. oryzae-sativae from rice (OS5), a species adapted to higher temperatures. The populations were subjected to two growth temperatures: 25°C and 35°C (optimal and stress temperatures for R. solani AG-1 IA). Based on mycelial growth, estimates of genotypic variance (IG), environmental variance (IE) and broad sense heritability (h2) were determined as measures of evolvability. The population OS5 of R. oryzae-sativae was almost not influenced by temperature stress, while at 35oC there was a reduction in h2 for the populations BBT1 and OS6 of R. solani AG-1 IA. However, the relatively high h2 values for mycelial growth at 35oC (0.63 ± 0.07) indicate that both populations BBT1 and OS6 of R. solani AG-1 IA have potential for adaptation to temperature stress.
Keywords
Genetic variance; thermal adaptation; environmental stress; evolvability
Na América do Sul o fungo basidiomiceto Thanatephorus cucumeris (Rhizoctonia solani em sua fase assexual) emergiu na década de 1990 como um importante patógeno da queima das folhas e morte de pastagens do gênero Urochloa (99 Ciat. Annual Report: Tropical Forages Program. Cali: Centro Internacional de Agricultura Tropical, 1993. (Documento, 166).). R. solani compreende várias unidades taxonômicas correspondentes a espécies filogenéticas e/ou biológicas, denominadas de grupos de anastomose (AGs) (1313 González, D.; Carling, D.E.; Kuninaga, S.; Vilgalys, R.; Cubeta, M.A. Ribosomal DNA systematics of Ceratobasidium and Thanatephorus with Rhizoctonia anamorphs. Mycologia, New York, v.93, p.1138-1150, 2001.). Em levantamento efetuado nos Llanos orientais colombianos, R. solani AG-1 IA predominou como patógeno da queima da folha e morte de Urochloa (22 Alvarez, E.; Latorre, M.; Bonilla, X.; Sotelo, G.; Miles, J.W. Diversity of Rhizoctonia spp. causing foliar blight on Brachiaria in Colombia and evaluation of Brachiaria genotypes for foliar blight resistance. Plant Disease, Chichester, v.97, n.6, p.772-779, 2013., 2525 Ramos-Molina, L.M.; Chavarro-Mesa, E.; Pereira, D.A.D.S.; Silva-Herrera, M.D.R.; Ceresini, P.C. Rhizoctonia solani AG-1 IA infecta arroz e braquiária nos Llanos Colombianos. Pesquisa Agropecuária Tropical, Goiânia, v.46, n.1, p.67-71, 2016.). Em extensa amostragem na Amazônia brasileira, foi também observada predominância de R. solani AG-1 IA em pastagens de Urochloa do estado de Rondônia (88 Chavarro Mesa, E.; Ceresini, P.C.; Ramos Molina, L.M.; Pereira, D.A.S.; Schurt, D.A.; Vieira, J.R.; Poloni, N.M.; Mcdonald, B.A. The Urochloa foliar blight and collar rot pathogen Rhizoctonia solani AG-1 IA emerged in South America via a host shift from rice. Phytopathology, St. Paul, v.105, n.11, p.1475-1486, 2015.).
O fungo R. solani AG-1 IA apresenta ampla distribuição geográfica como patógeno necrotrófico habitante do solo, e infecta Poáceas e Fabáceas em regiões de clima tropical e subtropical, causando principalmente a queima da bainha no arroz (77 Ceresini, P.C. Rhizoctonia como fitopatógeno: biologia e diversidade de Rhizoctonia solani em agroecossistemas tropicais e perspectivas de manejo da rizoctoniose usando resistência de plantas. In: Freitas, A.S.; Dornelas, G.A.; Silva, J.C.P.; Salum, L.A.; Pimenta, L.; Pedroso, L.A.; Faria, M.D.R.; Paula, P.V.A.A.; Martins, S.A. (Ed.). Sanidade de raízes. São Carlos: Suprema Gráfica e Editora, 2014. p.177-190., 1717 Jones, R.K.; Belmar, S.B. Characterization and pathogenicity of Rhizoctonia spp. isolated from rice, soybean, and other crops grown in rotation with rice in Texas. Plant Disease, Chichester, v.73, p.1004-1010, 1989.). Além de patógeno de Urochloa, há relatos da associação de R. solani AG-1 IA à mela da soja (77 Ceresini, P.C. Rhizoctonia como fitopatógeno: biologia e diversidade de Rhizoctonia solani em agroecossistemas tropicais e perspectivas de manejo da rizoctoniose usando resistência de plantas. In: Freitas, A.S.; Dornelas, G.A.; Silva, J.C.P.; Salum, L.A.; Pimenta, L.; Pedroso, L.A.; Faria, M.D.R.; Paula, P.V.A.A.; Martins, S.A. (Ed.). Sanidade de raízes. São Carlos: Suprema Gráfica e Editora, 2014. p.177-190., 1717 Jones, R.K.; Belmar, S.B. Characterization and pathogenicity of Rhizoctonia spp. isolated from rice, soybean, and other crops grown in rotation with rice in Texas. Plant Disease, Chichester, v.73, p.1004-1010, 1989.) e à mancha bandeada do milho (66 Cardona, R.; Rodríguez, H.; Nass, H. Mancha bandeada en maíz causada por Rhizoctonia solani en el estado Portuguesa, Venezuela. Fitopatologia Venezolana, Maracay, v.12, n.2, p.32-33, 1999.). Observações sobre a biologia de populações de R. solani AG-1 IA feitas na última década sugerem que este patógeno possui alto potencial evolutivo (88 Chavarro Mesa, E.; Ceresini, P.C.; Ramos Molina, L.M.; Pereira, D.A.S.; Schurt, D.A.; Vieira, J.R.; Poloni, N.M.; Mcdonald, B.A. The Urochloa foliar blight and collar rot pathogen Rhizoctonia solani AG-1 IA emerged in South America via a host shift from rice. Phytopathology, St. Paul, v.105, n.11, p.1475-1486, 2015., 1414 González-Vera, A.D.; Bernardes-De-Assis, J.; Zala, M.; Mcdonald, B.A.; Correa-Victoria, F.; Graterol-Matute, E.J.; Ceresini, P.C. Divergence between sympatric rice- and maize-infecting populations of Rhizoctonia solani AG 1 IA from Latin America. Phytopathology, St. Paul, v.100, n.2, p.172-182, 2010., 2323 Poloni, N.M.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Garcia, I.L.; Ceresini, P.C. Evidência de que o fungo Rhizoctonia solani AG-1 IA adaptado à Urochloa na Colômbia mantém ampla gama de hospedeiros incluindo o milho. Summa Phytopathologica, Botucatu, v.42, p.228-232, 2016.). Há evidências para a emergência de populações especializadas de R. solani AG-1 IA via troca [do arroz para o milho (1414 González-Vera, A.D.; Bernardes-De-Assis, J.; Zala, M.; Mcdonald, B.A.; Correa-Victoria, F.; Graterol-Matute, E.J.; Ceresini, P.C. Divergence between sympatric rice- and maize-infecting populations of Rhizoctonia solani AG 1 IA from Latin America. Phytopathology, St. Paul, v.100, n.2, p.172-182, 2010.)] ou salto de hospedeiros [do arroz para a soja (55 Bernardes de Assis, J.; Peyer, P.; Rush, M.C.; Zala, M.; McDonald, B.A.; Ceresini, P. C. Divergence between sympatric rice- and soybean-infecting populations of Rhizoctonia solani anastomosis group-1 IA. Phytopathology, St. Paul, v.98, n.12, p.1326-1333, 2008.)]. Quanto à origem das populações de R. solani AG-1 IA que infectam Urochloa na América do Sul, é indicado que tenham emergido de populações que originalmente infectavam o arroz (88 Chavarro Mesa, E.; Ceresini, P.C.; Ramos Molina, L.M.; Pereira, D.A.S.; Schurt, D.A.; Vieira, J.R.; Poloni, N.M.; Mcdonald, B.A. The Urochloa foliar blight and collar rot pathogen Rhizoctonia solani AG-1 IA emerged in South America via a host shift from rice. Phytopathology, St. Paul, v.105, n.11, p.1475-1486, 2015.).
Muitos fitopatógenos que apresentam ampla distribuição geográfica, como R. solani AG-1 IA, estão sujeitos a extremas flutuações de temperatura em seus habitats, especialmente devido às diferenças climáticas entre esses ambientes. Logo, para sobreviver a flutuações climáticas, esses organismos desenvolveram a habilidade de constantemente regular seus valores fenotípicos para adaptações térmicas específicas (3030 Zhan, J.; Mcdonald, B.A. Thermal adaptation in the fungal pathogen Mycosphaerella graminicola. Molecular Ecology, Oxford, v.20, p.1689-1701, 2011.). Para espécies do complexo Rhizoctonia spp. o crescimento micelial é um importante componente adaptativo, uma vez que os danos às plantas resultam principalmente da infecção por hifas assexuais (1919 Lehtonen, M.J.; Ahvenniemi, P.; Wilson, P.S.; German-Kinnari, M.; Valkonen, J. P. T. Biological diversity of Rhizoctonia solani (AG-3) in a northern potato-cultivation environment in Finland. Plant Pathology, Loughborough, v.57, p.141–151, 2008.). Além disso, o rápido crescimento micelial de Rhizoctonia spp. lhe confere alta habilidade de competição saprofítica (2121 Menzies, J.D. The first century of Rhizoctonia solani. In: Parmeter, J.R. (Ed.). Rhizoctonia solani: Biology and Pathology. Berkeley. University of California Press, 1970. p.62-92.).
Condições de estresse térmico em temperaturas acima do ótimo, por sua vez, resultam em supressão do crescimento micelial fúngico em função de alterações nas características morfológicas e fisiológicas das hifas, por exemplo septura e crescimento anormais, redução da quantidade de quitina na parede celular, desnaturação de proteínas, desintegração de mitocôndrias e autólise extensa. Relata-se, inclusive, diminuição no teor total de proteínas intracelulares e um aumento acentuado em proteínas danificadas oxidativamente (11 Abrashev, R.; Stoitsova, S.; Krumova, E.; Pashova, S.; Paunova-Krasteva, T.; Vassilev, S.; Dolashka-Angelova, P.; Angelova, M. Temperature-stress tolerance of the fungal strain Aspergillus niger 26: physiological and ultrastructural changes. World Journal of Microbiology and Biotechnology, Hull, v.30, n.5, p.1661-1668, 2014.).
Análises experimentais do crescimento micelial sob condições de estresse de temperatura, associadas às medidas de variância genética aditiva e de evolucionabilidade deste carácter, nos permitiriam inferir sobre o potencial adaptativo de R. solani AG-1 IA à variações térmicas ambientais, de forma semelhante ao procedimento usado para determinar a adaptabilidade evolutiva do patógeno a novos hospedeiros (2222 Pereira, D.A.D.S.; Ceresini, P.C.; Castroagudín, V.L.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Negrisoli, M.M.; Campos, S.N.; Pegolo, M.E.S.; Takada, H.M. Population genetic structure of Rhizoctonia oryzae-sativae from rice in Latin America and its adaptive potential to emerge as a pathogen on Urochloa Pastures. Phytopathology, St. Paul, v.107, n.1, p.121-131, 2016., 2323 Poloni, N.M.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Garcia, I.L.; Ceresini, P.C. Evidência de que o fungo Rhizoctonia solani AG-1 IA adaptado à Urochloa na Colômbia mantém ampla gama de hospedeiros incluindo o milho. Summa Phytopathologica, Botucatu, v.42, p.228-232, 2016., 2727 Vicentini, S.N.C.; Santos, D.A.P.D.; Castroagudín, V. L.; Dorigan, A.F.; Ceresini, P.C. Adaptabilidade e danos potenciais de Rhizoctonia oryzae-sativae ao milho. Summa Phytopathologica, Botucatu, v.43, n.3, p.1-7, 2017.). Isso porque evolucionabilidade é definida como a capacidade para a evolução adaptativa ou do potencial adaptativo de uma população, i.e., medidas de resposta à seleção (1515 Houle, D. Comparing evolvability and variability of quantitative traits. Genetics, Rockville, v.130, p.195–204, 1992., 2828 Willi, Y.; Frank, A.; Heinzelmann, R.; Kälin, A.; Spalinger, L.; Ceresini, P.C. The adaptive potential of a plant pathogenic fungus, Rhizoctonia solani AG-3, under heat and fungicide stress. Genetica, Netherland, v.139, n.7, p.903-908, 2011., 2929 Willi, Y.; Van Buskirk, J.; Hoffmann, A.A. Limits to the adaptive potential of small populations. Annual Review of Ecology, Evolution, and Systematics, Palo Alto, v.37, n.1, p.433-458, 2006.) que, no caso de fitopatógenos, pode ser imposta por estresses ambientais (2828 Willi, Y.; Frank, A.; Heinzelmann, R.; Kälin, A.; Spalinger, L.; Ceresini, P.C. The adaptive potential of a plant pathogenic fungus, Rhizoctonia solani AG-3, under heat and fungicide stress. Genetica, Netherland, v.139, n.7, p.903-908, 2011., 3030 Zhan, J.; Mcdonald, B.A. Thermal adaptation in the fungal pathogen Mycosphaerella graminicola. Molecular Ecology, Oxford, v.20, p.1689-1701, 2011.) ou por variantes biológicas dos hospedeiros (2222 Pereira, D.A.D.S.; Ceresini, P.C.; Castroagudín, V.L.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Negrisoli, M.M.; Campos, S.N.; Pegolo, M.E.S.; Takada, H.M. Population genetic structure of Rhizoctonia oryzae-sativae from rice in Latin America and its adaptive potential to emerge as a pathogen on Urochloa Pastures. Phytopathology, St. Paul, v.107, n.1, p.121-131, 2016., 2323 Poloni, N.M.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Garcia, I.L.; Ceresini, P.C. Evidência de que o fungo Rhizoctonia solani AG-1 IA adaptado à Urochloa na Colômbia mantém ampla gama de hospedeiros incluindo o milho. Summa Phytopathologica, Botucatu, v.42, p.228-232, 2016., 2727 Vicentini, S.N.C.; Santos, D.A.P.D.; Castroagudín, V. L.; Dorigan, A.F.; Ceresini, P.C. Adaptabilidade e danos potenciais de Rhizoctonia oryzae-sativae ao milho. Summa Phytopathologica, Botucatu, v.43, n.3, p.1-7, 2017.).
Assim sendo, este estudo teve dois objetivos: (i) determinar se populações de R. solani AG-1 IA associadas à Urochloa e ao arroz, respondem de forma semelhante ao estresse de temperatura elevada; (ii) testar o efeito do aumento de temperatura sobre a variância genética e a herdabilidade para crescimento micelial de duas populações de R. solani AG-1 IA obtidas de Urochloa ou do arroz. Uma terceira população de outra espécie de Rhizoctonia associada ao arroz (R. oryzae-sativae, classificada como Ceratobasidium oryzae-sativae em sua fase sexuada) foi incluída neste estudo para efeito comparativo. O fungo R. oryzae-sativae (agente causal da mancha agregada da bainha do arroz) é adaptado a temperaturas mais elevadas, com ótimo de crescimento a 32oC (33 Amirmijani, A.R.; Khodaparast, S.A.; Padasht, F.; Rabiei, B. Biology of Rhizoctonia oryzae-sativae causal agent of rice aggregate sheath spot disease in Guilan Province. Iranian Journal of Plant Pathology, Tehran, v.49, n.1, p.15-16, 2013.) e ocorre naturalmente em áreas de arroz na Colômbia (2222 Pereira, D.A.D.S.; Ceresini, P.C.; Castroagudín, V.L.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Negrisoli, M.M.; Campos, S.N.; Pegolo, M.E.S.; Takada, H.M. Population genetic structure of Rhizoctonia oryzae-sativae from rice in Latin America and its adaptive potential to emerge as a pathogen on Urochloa Pastures. Phytopathology, St. Paul, v.107, n.1, p.121-131, 2016., 2525 Ramos-Molina, L.M.; Chavarro-Mesa, E.; Pereira, D.A.D.S.; Silva-Herrera, M.D.R.; Ceresini, P.C. Rhizoctonia solani AG-1 IA infecta arroz e braquiária nos Llanos Colombianos. Pesquisa Agropecuária Tropical, Goiânia, v.46, n.1, p.67-71, 2016.). Nossa hipótese foi de que o estresse imposto pelo aumento da temperatura afetaria, de forma semelhante, o potencial adaptativo de R. solani AG-1 IA, obtido de Urochloa e de arroz.
MATERIAL E MÉTODOS
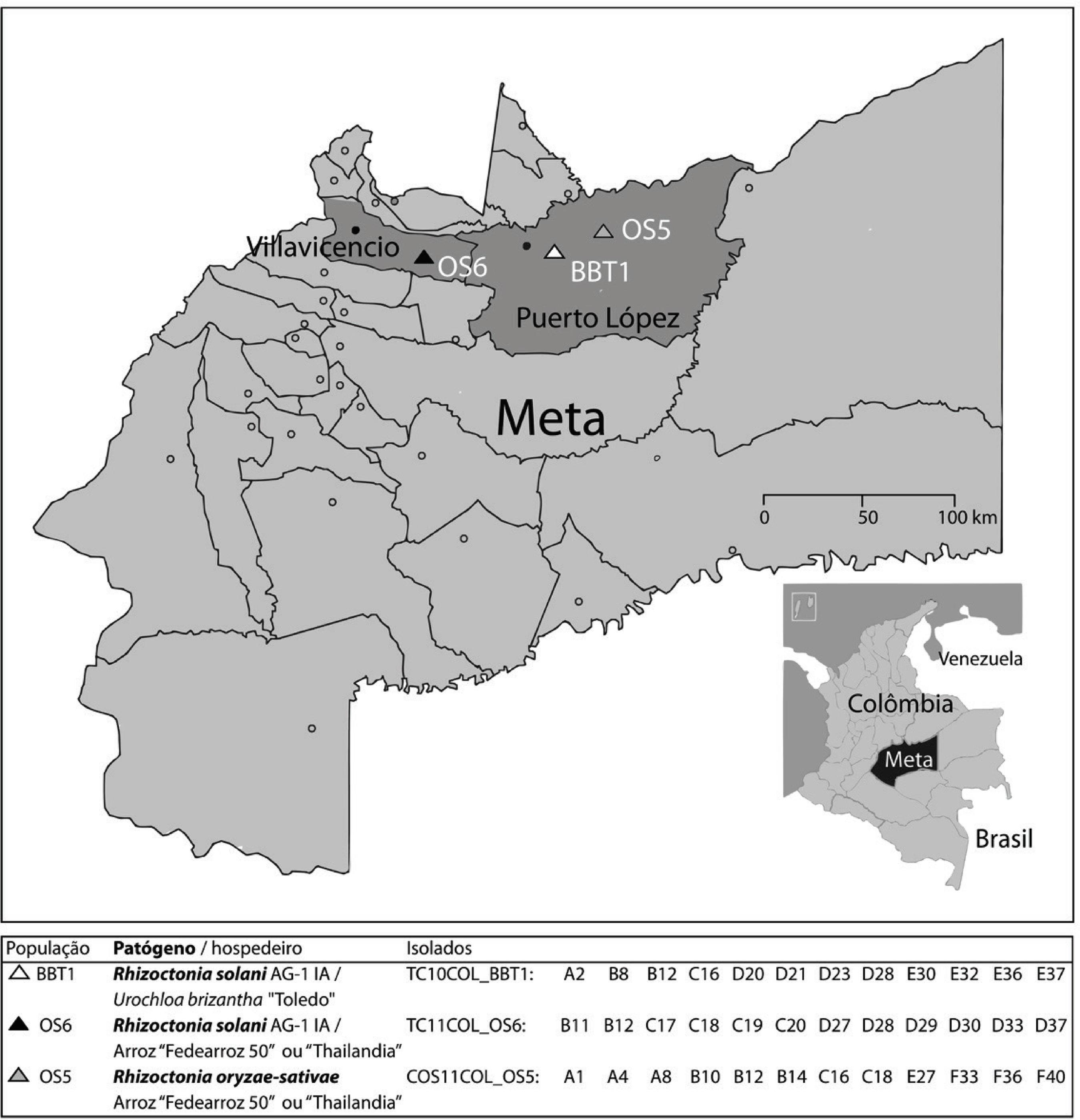
Em 2010, campos de arroz e Urochloa foram amostrados em três áreas de produção no Estado de Meta, nos Llanos orientais colombianos (Figura 1). Plantas com sintomas de queima da folha de Urochloa, queima da bainha ou de mancha agregada do arroz, foram coletadas de dois a três focos de infestação (com pelo menos 10 m de distância entre eles) em cada linha, com um total de 4 a 6 linhas por campo. No município de Puerto Lopez foram obtidas amostras de dois hospedeiros: Urochloa brizantha cv. Toledo (BBT1) e arroz (OS6). Já no município de Villavicencio, um terceiro conjunto de amostras foi coletado de arroz (OS5).
Localização geográfica das áreas onde amostrou-se populações de Rhizoctonia solani AG-1 IA de Urochloa brizantha (BBT1) e do arroz (OS6) e de R. oryzae-sativae do arroz (OS5) nos Llanos orientais Colombianos a. a Pontos redondos vazios indicam cedes dos municípios.
Para realizar os isolamentos dos patógenos, fragmentos de material vegetal infectado foram desinfestados com hipoclorito de sódio a 1%, e posteriormente transferidos para meio batata-dextrose-ágar (BDA). Os isolamentos foram incubados a 25°C no escuro, durante três dias, e em seguida purificados em meio BDA. Ao todo 36 isolados de Rhizoctonia spp foram obtidos, doze de cada população.
A identificação dos isolados amostrados foi baseada na detecção via reação de polimerase em cadeia (PCR) com marcadores específicos para R. solani AG1-IA (2020 Matsumoto, M. Trials of direct detection and identification of Rhizoctonia solani AG 1 and AG 2 subgroups using specifically primed PCR analysis. Mycoscience, Nonoichi, v.43, p.185-189, 2002.) e para R. oryzae-sativae (1616 Johanson, A.; Turner, H.C.; Mckay, G.J.; Brown, A.E. A PCR-based method to distinguish fungi of the rice sheath-blight complex, Rhizoctonia solani, R. oryzae and R. oryzae-sativae. FEMS Microbiology Letters, Oxford, v.162, n.289-294, 1998.), conforme descrito anteriormente (88 Chavarro Mesa, E.; Ceresini, P.C.; Ramos Molina, L.M.; Pereira, D.A.S.; Schurt, D.A.; Vieira, J.R.; Poloni, N.M.; Mcdonald, B.A. The Urochloa foliar blight and collar rot pathogen Rhizoctonia solani AG-1 IA emerged in South America via a host shift from rice. Phytopathology, St. Paul, v.105, n.11, p.1475-1486, 2015., 2222 Pereira, D.A.D.S.; Ceresini, P.C.; Castroagudín, V.L.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Negrisoli, M.M.; Campos, S.N.; Pegolo, M.E.S.; Takada, H.M. Population genetic structure of Rhizoctonia oryzae-sativae from rice in Latin America and its adaptive potential to emerge as a pathogen on Urochloa Pastures. Phytopathology, St. Paul, v.107, n.1, p.121-131, 2016.). Vinte e quatro isolados obtidos das populações BBT1 de Urochloa e OS6 de arroz foram identificados como R. solani AG-1 IA e os outros 12 obtidos da população OS5 de arroz foram identificados como R. oryzae-sativae. Todos os isolados apresentaram distintos genótipos multilocos microssatélites (88 Chavarro Mesa, E.; Ceresini, P.C.; Ramos Molina, L.M.; Pereira, D.A.S.; Schurt, D.A.; Vieira, J.R.; Poloni, N.M.; Mcdonald, B.A. The Urochloa foliar blight and collar rot pathogen Rhizoctonia solani AG-1 IA emerged in South America via a host shift from rice. Phytopathology, St. Paul, v.105, n.11, p.1475-1486, 2015., 2222 Pereira, D.A.D.S.; Ceresini, P.C.; Castroagudín, V.L.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Negrisoli, M.M.; Campos, S.N.; Pegolo, M.E.S.; Takada, H.M. Population genetic structure of Rhizoctonia oryzae-sativae from rice in Latin America and its adaptive potential to emerge as a pathogen on Urochloa Pastures. Phytopathology, St. Paul, v.107, n.1, p.121-131, 2016.).
Para determinar o efeito do estresse térmico sobre o crescimento micelial de Rhizoctonia spp., o delineamento experimental utilizado foi o inteiramente casualizado em esquema fatorial (3 x 2), com cinco repetições, cujos fatores foram representados por três populações dos patógenos (R. solani AG1-IA BBT1 de Urochloa e OS6 do arroz e R. oryzae-sativae OS5 do arroz) e duas temperaturas de crescimento (25 e 35oC).
Cada população foi composta por doze isolados do patógeno. Para preparo de inóculo dos fungos, discos de micélio com 6 mm de diâmetro foram transferidos para placas de Petri contendo 20 mL de meio BDA (suplementado com 50 μg/mL de cloranfenicol e estreptomicina). As culturas foram incubadas a temperatura de 25° no escuro, considerada ótima, e a 35°C, considerada de estresse para R. solani AG-1 IA (1010 Costa-Souza, E.; Kuramae, E.E.; Nakatani, A.K.; Basseto, M.A.; Prabhu, A.S.; Ceresini, P.C. Caracterização citomorfológica, cultural, molecular e patogênica de Rhizoctonia solani Kühn associado ao arroz em Tocantins, Brasil. Summa Phytopathologica, Botucatu, v.33 n.2, p.129-136, 2007.). A avaliação do crescimento micelial foi feita medindo-se o diâmetro das colônias, após 24 h de incubação. O experimento foi repetido uma vez.
Os dados de crescimento micelial (x) foram transformados em logaritmo (x+1). Primeiramente, foram analisados os efeitos de populações como fator fixo, de isolados dentro de cada população, do ambiente e da interação isolado x ambiente. O efeito de isolados foi considerado como efeito aleatório e o do ambiente como efeito fixo. A análise de variância foi realizada usando o procedimento estatístico PROC MIXED implementado no programa SAS (2626 Sas Institute. SAS OnlineDoc. Version 9.1.3. Cary: SAS Institute, 2008.). As médias do crescimento micelial do fungo dentro de cada população e em diferentes ambientes foram comparadas pelo teste de t de SNK (Student-Newman-Keuls), implementado no SAS.
Para análise do efeito do ambiente sobre os componentes de evolucionabilidade (1515 Houle, D. Comparing evolvability and variability of quantitative traits. Genetics, Rockville, v.130, p.195–204, 1992.), a variância apresentada pelos isolados dentro de cada população foi interpretada como variância genética (VG), o erro experimental foi considerado como variância ambiental (VE), e a variância fenotípica (VP) como o resultado da soma das variâncias genética e ambiental (2828 Willi, Y.; Frank, A.; Heinzelmann, R.; Kälin, A.; Spalinger, L.; Ceresini, P.C. The adaptive potential of a plant pathogenic fungus, Rhizoctonia solani AG-3, under heat and fungicide stress. Genetica, Netherland, v.139, n.7, p.903-908, 2011.). Os componentes de variância foram determinados por procedimento estatístico implementado no programa R (2424 R Development Core Team. R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing, 2008. ).
As variâncias obtidas foram padronizadas pelo quadrado da média do crescimento micelial dos genótipos (ou isolados) do patógeno dentro de cada população (m2i, i = 1...n genótipos), onde: VG/m2i = IGi; VE/m2i = IEi; e VP/m2i = IP, sendo então consideradas medidas de evolucionabilidade ou de resposta à seleção (1515 Houle, D. Comparing evolvability and variability of quantitative traits. Genetics, Rockville, v.130, p.195–204, 1992.).
A herdabilidade para o caráter crescimento micelial (h2) foi calculada como a razão entre a variância genética (IG) e a variância fenotípica (IP), ambas padronizadas (IP = IG + IE). Os intervalos de confiança a 95% para as estimativas de h2 foram calculados por meio de análise de bootstrap ordinário ou não-paramétrico (1111 Davison, A.C.; Hinkley, D.V. Bootstrap methods and their application. New York: Cambridge University Press, 1997. 592p.) baseada em 999 re-amostragens de dados originais, onde em cada re-amostragem obteve-se os componentes de variâncias padronizadas e as respectivas herdabilidades. O bootstrap foi implementado no ambiente R onde utilizaram os pacotes da distribuição base e o pacote “lme4” disponível no http://CRAN.R-project.org/package=lme4 (44 Bates, D.; Maechler, M. lme4: Linear mixed-effects models using S4 classes. R package version 0.999375-34. Linz: Foundation for Open Access Statistics, 2010., 1111 Davison, A.C.; Hinkley, D.V. Bootstrap methods and their application. New York: Cambridge University Press, 1997. 592p.), conforme o modelo misto considerado.
Tanto as estimativas de h2 quanto de IG predizem a resposta à seleção R (R = h2irP, onde i = intensidade de seleção e rP = desvio padrão fenotípico do atributo antes da seleção, de acordo com Falconer & Mackay (1212 Falconer, D.S.; Mackay, T.F.C. Introduction to quantitative genetics. 4th ed. Harlow: Longmans Green, 1996. 464p.); ou R = IGX, onde X = intensidade de seleção, de acordo com Houle (1515 Houle, D. Comparing evolvability and variability of quantitative traits. Genetics, Rockville, v.130, p.195–204, 1992.)). Dessa forma, ambos podem ser consideradas medidas de evolucionabilidade ou do potencial adaptativo de uma população (1414 González-Vera, A.D.; Bernardes-De-Assis, J.; Zala, M.; Mcdonald, B.A.; Correa-Victoria, F.; Graterol-Matute, E.J.; Ceresini, P.C. Divergence between sympatric rice- and maize-infecting populations of Rhizoctonia solani AG 1 IA from Latin America. Phytopathology, St. Paul, v.100, n.2, p.172-182, 2010., 2020 Matsumoto, M. Trials of direct detection and identification of Rhizoctonia solani AG 1 and AG 2 subgroups using specifically primed PCR analysis. Mycoscience, Nonoichi, v.43, p.185-189, 2002., 2121 Menzies, J.D. The first century of Rhizoctonia solani. In: Parmeter, J.R. (Ed.). Rhizoctonia solani: Biology and Pathology. Berkeley. University of California Press, 1970. p.62-92., 2929 Willi, Y.; Van Buskirk, J.; Hoffmann, A.A. Limits to the adaptive potential of small populations. Annual Review of Ecology, Evolution, and Systematics, Palo Alto, v.37, n.1, p.433-458, 2006.).
RESULTADOS E DISCUSSÃO
Quanto ao crescimento micelial, sob diferentes temperaturas, os efeitos dos fatores população e isolados dentro de populações foram significativos indicando diferenças entre as populações e entre isolados de Rhizoctonia spp. dentro de populações (Tabela 1).
Modelo linear geral testando os efeitos de população, isolados e ambiente (temperatura) e suas interações sobre o crescimento micelial in vitro dos fitopatógenos Rhizoctonia solani AG-1 IA de Urochloa brizantha (BBT1) e do arroz (OS5) e R. oryzae-sativae do arroz (OS6) nos Llanos orientais Colombianos a a Significativo pelo teste F a p ≤ 0.001 .
Observaram-se diferenças significativas entre a população OS5 de R. oryzae-sativae e as populações BBT1 e OS6 de R. solani AG-1 IA. O aumento da temperatura de 25 para 35°C promoveu, de forma similar, redução na taxa de crescimento micelial de R. solani AG-1 IA nas populações BBT1 e OS6 (Figura 2). O oposto ocorreu com a população OS5, cujos isolados de R. oryzae-sativae apresentaram aumento significativo de crescimento com o aumento da temperatura. Dessa maneira, nossos resultados confirmaram o relato que R. oryzae-sativae do arroz é mais adaptada (em termos de crescimento micelial) à temperaturas mais elevadas (33 Amirmijani, A.R.; Khodaparast, S.A.; Padasht, F.; Rabiei, B. Biology of Rhizoctonia oryzae-sativae causal agent of rice aggregate sheath spot disease in Guilan Province. Iranian Journal of Plant Pathology, Tehran, v.49, n.1, p.15-16, 2013.).
Resposta fenotípica para crescimento micelial sob condições ótimas e de estresse de temperatura em populações de Rhizoctonia solani AG- 1 IA de Urochloa e do arroz e de R. oryzae-sativae do arroz a. a Barras de mesma cor seguidas de mesma letra minúscula não são significativamente diferentes pelo teste t a p = 0.05. Barras de coresdiferentes seguidas de mesma letra maiúscula também não são significativamente diferentes pelo mesmo teste.
Observou-se também, que os isolados de R. solani AG-1 IA das populações BBT1 e OS6 da Colômbia apresentaram comportamento semelhante aos descritos por Costa-Souza et al. (1010 Costa-Souza, E.; Kuramae, E.E.; Nakatani, A.K.; Basseto, M.A.; Prabhu, A.S.; Ceresini, P.C. Caracterização citomorfológica, cultural, molecular e patogênica de Rhizoctonia solani Kühn associado ao arroz em Tocantins, Brasil. Summa Phytopathologica, Botucatu, v.33 n.2, p.129-136, 2007.), que relatam que a temperatura ótima para o crescimento micelial do patógeno da queima da bainha do arroz do Brasil era de 25°C. No geral, a temperatura de 35°C representou condição de estresse para as populações de R. solani AG-1 IA de Urochloa e de arroz amostradas na Colômbia.
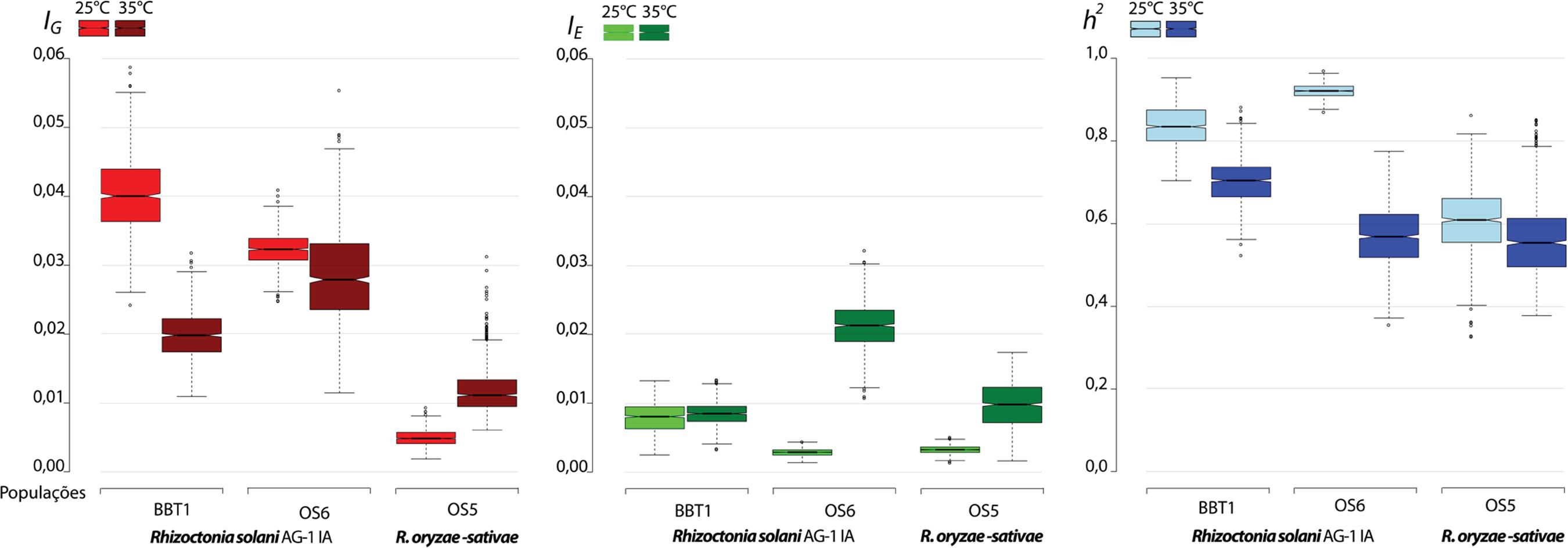
A respeito do efeito de estresse térmico sobre as medidas de evolucionabilidade das populações dos patógenos, de fato observou-se que o aumento da temperatura promoveu mudanças significativas na variância genotípica IG das populações.
Enquanto para as populações BBT1 e OS6 de R. solani AG-1 IA a IG diminuiu significativamente, para a população OS5 de R. oryzae-sativae detectou-se aumento significativo da IG a 35oC (Figura 3). Sob condição de estresse térmico a 35oC, a h2 diminuiu significativamente nas populações BBT1 (de 0,84 a 25oC para 0,70 a 35oC) e OS6 (de 0,92 para 0,56) de R. solani AG-1 IA, mantendo-se estável na população OS5 de R. oryzae-sativae do arroz (de 0,61 a 0,56).
Efeito da temperatura sobre os componentes de evolucionabilidade para o crescimento micelial in vitro de populações Rhizoctonia solani AG-1 IA de Urochloa brizantha (BBT1) e do arroz (OS6) e R. oryzae-sativae do arroz (OS5) dos Llanos orientais Colombianos a 25 e a 35oC a. a A temperatura de 35oC é considerada condição de estresse térmico para R. solani AG-1 IA (1010 Costa-Souza, E.; Kuramae, E.E.; Nakatani, A.K.; Basseto, M.A.; Prabhu, A.S.; Ceresini, P.C. Caracterização citomorfológica, cultural, molecular e patogênica de Rhizoctonia solani Kühn associado ao arroz em Tocantins, Brasil. Summa Phytopathologica, Botucatu, v.33 n.2, p.129-136, 2007.). Os componentes de evolucionabilidade IG, IE e h2 correspondem a medidas de variância genética (VG), ambiental (VE) e de herdabilidade (h2) padronizadas pelo quadrado da média do crescimento no respectivo ambiente (1515 Houle, D. Comparing evolvability and variability of quantitative traits. Genetics, Rockville, v.130, p.195–204, 1992.). Os diagramas de caixas (boxplots) contém a linha da mediana aproximadamente em seu centro e 50% dos dados (entre os quartís 25 e 75%) gerados por bootstrap considerando 999 re-amostragem. As barras verticais indicam os valores máximos e mínimos observados e os círculos os valores atípicos. O entalhe marca o intervalo de confiança de 95% para as medianas.
Quando R. solani AG-3 PT da batata, cujo ótimo de temperatura é 24oC, foi submetido a condições de estresse de temperatura (27oC) observou-se, também, diminuição de h2 para crescimento micelial (2828 Willi, Y.; Frank, A.; Heinzelmann, R.; Kälin, A.; Spalinger, L.; Ceresini, P.C. The adaptive potential of a plant pathogenic fungus, Rhizoctonia solani AG-3, under heat and fungicide stress. Genetica, Netherland, v.139, n.7, p.903-908, 2011.). É plausível que as duas populações de R. solani AG-1 IA que apresentaram diminuição da h2 para crescimento micelial sob estresse térmico (em relação à população R. oryzae-sativae, adaptada a altas temperaturas) tenham experimentado acúmulo diferencial de mutações deletérias ao longo de sua história evolutiva, com efeito epistático negativo agravado sob estresse (1818 Kishony, R.; Leibler, S. Environmental stresses can alleviate the average deleterious effect of mutations. Journal of Biology, London, v.2, n.14, 2003.). Outras hipóteses prevêem que a diminuição da h2 ocorre porque o estresse aumenta a variação ambiental sem afetar necessariamente a variação genética aditiva, ou porque o estresse impede que os organismos alcancem seu potencial genético sob uma condições limitantes de nutrição com, consequente redução da variância genética (2828 Willi, Y.; Frank, A.; Heinzelmann, R.; Kälin, A.; Spalinger, L.; Ceresini, P.C. The adaptive potential of a plant pathogenic fungus, Rhizoctonia solani AG-3, under heat and fungicide stress. Genetica, Netherland, v.139, n.7, p.903-908, 2011., 2929 Willi, Y.; Van Buskirk, J.; Hoffmann, A.A. Limits to the adaptive potential of small populations. Annual Review of Ecology, Evolution, and Systematics, Palo Alto, v.37, n.1, p.433-458, 2006.).
Entretanto, os valores de herdabilidade (h2 = 0,63 ± 0,07, a 35oC) para crescimento micelial sob condições de estresse de temperatura detectados para R. solani AG-1 IA foram ainda relativamente altos (1818 Kishony, R.; Leibler, S. Environmental stresses can alleviate the average deleterious effect of mutations. Journal of Biology, London, v.2, n.14, 2003.) indicando que a contribuição relativa das diferenças genéticas foi maior que a plasticidade fenotípica do patógeno em diferentes condições ambientais (Figura 3). Essa alta herdabilidade para crescimento micelial a 35oC (semelhante, inclusive à espécie R. oryzae-sativae adaptada a altas temperaturas) indica que as populações de R. solani AG-1 IA estudadas tem capacidade de adaptação ao estresse térmico.
AGRADECIMENTOS
Os autores agradecem às agências de fomento pela concessão das seguintes modalidades de bolsas e auxílios: CNPq – Pq2 (307361/2012-8) e CNPq/MCT – Universal 14/2010 (481756/2010-8) a P.C. Ceresini, FAPESP – AP (2010/15704-5) a P.C. Ceresini, e FAPESP – MSc (2013/11944-0) a D.A.S. Pereira. L.M. Ramos-Molina foi discente de doutorado do Programa de Pós-Graduação em Genética e Melhoramento de Plantas, da UNESP Campus de Jaboticabal e bolsista CNPq – DR (140564/2009-8), enquanto. D.A.S. Pereira e S.N.C. Vicentini foram discentes de mestrado do Programa de Pós-Graduação em Agronomia “Sistema de Produção”, da UNESP Campus de Ilha Solteira e bolsistas CAPES (Coordenação de Formação de Pessoal de Nível Superior).
REFERÊNCIAS
-
1Abrashev, R.; Stoitsova, S.; Krumova, E.; Pashova, S.; Paunova-Krasteva, T.; Vassilev, S.; Dolashka-Angelova, P.; Angelova, M. Temperature-stress tolerance of the fungal strain Aspergillus niger 26: physiological and ultrastructural changes. World Journal of Microbiology and Biotechnology, Hull, v.30, n.5, p.1661-1668, 2014.
-
2Alvarez, E.; Latorre, M.; Bonilla, X.; Sotelo, G.; Miles, J.W. Diversity of Rhizoctonia spp. causing foliar blight on Brachiaria in Colombia and evaluation of Brachiaria genotypes for foliar blight resistance. Plant Disease, Chichester, v.97, n.6, p.772-779, 2013.
-
3Amirmijani, A.R.; Khodaparast, S.A.; Padasht, F.; Rabiei, B. Biology of Rhizoctonia oryzae-sativae causal agent of rice aggregate sheath spot disease in Guilan Province. Iranian Journal of Plant Pathology, Tehran, v.49, n.1, p.15-16, 2013.
-
4Bates, D.; Maechler, M. lme4: Linear mixed-effects models using S4 classes. R package version 0.999375-34. Linz: Foundation for Open Access Statistics, 2010.
-
5Bernardes de Assis, J.; Peyer, P.; Rush, M.C.; Zala, M.; McDonald, B.A.; Ceresini, P. C. Divergence between sympatric rice- and soybean-infecting populations of Rhizoctonia solani anastomosis group-1 IA. Phytopathology, St. Paul, v.98, n.12, p.1326-1333, 2008.
-
6Cardona, R.; Rodríguez, H.; Nass, H. Mancha bandeada en maíz causada por Rhizoctonia solani en el estado Portuguesa, Venezuela. Fitopatologia Venezolana, Maracay, v.12, n.2, p.32-33, 1999.
-
7Ceresini, P.C. Rhizoctonia como fitopatógeno: biologia e diversidade de Rhizoctonia solani em agroecossistemas tropicais e perspectivas de manejo da rizoctoniose usando resistência de plantas. In: Freitas, A.S.; Dornelas, G.A.; Silva, J.C.P.; Salum, L.A.; Pimenta, L.; Pedroso, L.A.; Faria, M.D.R.; Paula, P.V.A.A.; Martins, S.A. (Ed.). Sanidade de raízes São Carlos: Suprema Gráfica e Editora, 2014. p.177-190.
-
8Chavarro Mesa, E.; Ceresini, P.C.; Ramos Molina, L.M.; Pereira, D.A.S.; Schurt, D.A.; Vieira, J.R.; Poloni, N.M.; Mcdonald, B.A. The Urochloa foliar blight and collar rot pathogen Rhizoctonia solani AG-1 IA emerged in South America via a host shift from rice. Phytopathology, St. Paul, v.105, n.11, p.1475-1486, 2015.
-
9Ciat. Annual Report: Tropical Forages Program. Cali: Centro Internacional de Agricultura Tropical, 1993. (Documento, 166).
-
10Costa-Souza, E.; Kuramae, E.E.; Nakatani, A.K.; Basseto, M.A.; Prabhu, A.S.; Ceresini, P.C. Caracterização citomorfológica, cultural, molecular e patogênica de Rhizoctonia solani Kühn associado ao arroz em Tocantins, Brasil. Summa Phytopathologica, Botucatu, v.33 n.2, p.129-136, 2007.
-
11Davison, A.C.; Hinkley, D.V. Bootstrap methods and their application New York: Cambridge University Press, 1997. 592p.
-
12Falconer, D.S.; Mackay, T.F.C. Introduction to quantitative genetics 4th ed. Harlow: Longmans Green, 1996. 464p.
-
13González, D.; Carling, D.E.; Kuninaga, S.; Vilgalys, R.; Cubeta, M.A. Ribosomal DNA systematics of Ceratobasidium and Thanatephorus with Rhizoctonia anamorphs. Mycologia, New York, v.93, p.1138-1150, 2001.
-
14González-Vera, A.D.; Bernardes-De-Assis, J.; Zala, M.; Mcdonald, B.A.; Correa-Victoria, F.; Graterol-Matute, E.J.; Ceresini, P.C. Divergence between sympatric rice- and maize-infecting populations of Rhizoctonia solani AG 1 IA from Latin America. Phytopathology, St. Paul, v.100, n.2, p.172-182, 2010.
-
15Houle, D. Comparing evolvability and variability of quantitative traits. Genetics, Rockville, v.130, p.195–204, 1992.
-
16Johanson, A.; Turner, H.C.; Mckay, G.J.; Brown, A.E. A PCR-based method to distinguish fungi of the rice sheath-blight complex, Rhizoctonia solani, R. oryzae and R. oryzae-sativae FEMS Microbiology Letters, Oxford, v.162, n.289-294, 1998.
-
17Jones, R.K.; Belmar, S.B. Characterization and pathogenicity of Rhizoctonia spp. isolated from rice, soybean, and other crops grown in rotation with rice in Texas. Plant Disease, Chichester, v.73, p.1004-1010, 1989.
-
18Kishony, R.; Leibler, S. Environmental stresses can alleviate the average deleterious effect of mutations. Journal of Biology, London, v.2, n.14, 2003.
-
19Lehtonen, M.J.; Ahvenniemi, P.; Wilson, P.S.; German-Kinnari, M.; Valkonen, J. P. T. Biological diversity of Rhizoctonia solani (AG-3) in a northern potato-cultivation environment in Finland. Plant Pathology, Loughborough, v.57, p.141–151, 2008.
-
20Matsumoto, M. Trials of direct detection and identification of Rhizoctonia solani AG 1 and AG 2 subgroups using specifically primed PCR analysis. Mycoscience, Nonoichi, v.43, p.185-189, 2002.
-
21Menzies, J.D. The first century of Rhizoctonia solani In: Parmeter, J.R. (Ed.). Rhizoctonia solani: Biology and Pathology Berkeley. University of California Press, 1970. p.62-92.
-
22Pereira, D.A.D.S.; Ceresini, P.C.; Castroagudín, V.L.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Negrisoli, M.M.; Campos, S.N.; Pegolo, M.E.S.; Takada, H.M. Population genetic structure of Rhizoctonia oryzae-sativae from rice in Latin America and its adaptive potential to emerge as a pathogen on Urochloa Pastures. Phytopathology, St. Paul, v.107, n.1, p.121-131, 2016.
-
23Poloni, N.M.; Ramos-Molina, L.M.; Chavarro-Mesa, E.; Garcia, I.L.; Ceresini, P.C. Evidência de que o fungo Rhizoctonia solani AG-1 IA adaptado à Urochloa na Colômbia mantém ampla gama de hospedeiros incluindo o milho. Summa Phytopathologica, Botucatu, v.42, p.228-232, 2016.
-
24R Development Core Team. R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing, 2008.
-
25Ramos-Molina, L.M.; Chavarro-Mesa, E.; Pereira, D.A.D.S.; Silva-Herrera, M.D.R.; Ceresini, P.C. Rhizoctonia solani AG-1 IA infecta arroz e braquiária nos Llanos Colombianos. Pesquisa Agropecuária Tropical, Goiânia, v.46, n.1, p.67-71, 2016.
-
26Sas Institute. SAS OnlineDoc. Version 9.1.3. Cary: SAS Institute, 2008.
-
27Vicentini, S.N.C.; Santos, D.A.P.D.; Castroagudín, V. L.; Dorigan, A.F.; Ceresini, P.C. Adaptabilidade e danos potenciais de Rhizoctonia oryzae-sativae ao milho. Summa Phytopathologica, Botucatu, v.43, n.3, p.1-7, 2017.
-
28Willi, Y.; Frank, A.; Heinzelmann, R.; Kälin, A.; Spalinger, L.; Ceresini, P.C. The adaptive potential of a plant pathogenic fungus, Rhizoctonia solani AG-3, under heat and fungicide stress. Genetica, Netherland, v.139, n.7, p.903-908, 2011.
-
29Willi, Y.; Van Buskirk, J.; Hoffmann, A.A. Limits to the adaptive potential of small populations. Annual Review of Ecology, Evolution, and Systematics, Palo Alto, v.37, n.1, p.433-458, 2006.
-
30Zhan, J.; Mcdonald, B.A. Thermal adaptation in the fungal pathogen Mycosphaerella graminicola Molecular Ecology, Oxford, v.20, p.1689-1701, 2011.
Datas de Publicação
-
Publicação nesta coleção
14 Out 2019 -
Data do Fascículo
Jul-Sep 2019
Histórico
-
Recebido
10 Set 2017 -
Aceito
04 Fev 2019