Resumos
OBJETIVO: Avaliar a cicatrização da ferida incisional da parede abdominal de ratos hepatectomizados quanto à concentração de colágeno, reação inflamatória e angiogênese. MÉTODOS: Utilizaram-se 48 ratos distribuídos aleatoriamente para laparotomia com e sem hepatectomia. As cicatrizes foram estudadas no 3º, 7º e 14º dia de pós-operatório. Analisou-se a densidade do colágeno por método histoquímico e a angiogênese por método imunohistoquímico. RESULTADOS: A análise do colágeno total mostrou menor concentração no plano da pele e da tela subcutânea, nas cicatrizes abdominais do grupo experimento (p3=0,011; p7=0,004 e p14=0,008). A densidade de colágeno I foi inferior no grupo hepatectomizado, principalmente no 3º dia, tanto na pele e tela subcutânea (p=0,038) quanto no plano aponeurótico (p=0,026). Houve menor concentração de colágeno III nos dois planos estudados, embora não significante. A resposta inflamatória foi semelhante em todos os tempos, nos dois grupos. Verificou-se que a angiogênese desenvolveu-se mais precocemente no grupo controle (p3=0,005 e p7=0,012) e mais tardiamente no grupo experimento (p14=0,048). CONCLUSÃO: A hepatectomia leva ao atraso do processo cicatricial, interferindo na síntese do colágeno e na angiogênese.
Fígado; Regeneração; Hepatectomia; Cicatrização de feridas
OBJECTIVE: To evaluate the wound healing of the abdominal wall incision in hepatectomized rats as for the concentration of collagen, inflammatory reaction and angiogenesis. METHODS: We used 48 rats randomly assigned to laparotomy with or without hepatectomy. The scars were studied in the 3rd, 7th and 14th postoperative days. We analyzed the density of collagen by the histochemical method and angiogenesis, by immunohistochemistry. RESULTS: The analysis showed a lower total collagen concentration in skin and subcutaneous tissue in the abdominal scars of the experiment group (p3 = 0.011, p7 = 0.004 and p14 = 0.008). The density of collagen I was lower in the hepatectomy group, especially in the third day, in the skin, subcutaneous tissue (p = 0.038) and in the aponeurotic plane (p = 0.026). There was a lower concentration of collagen III in the two abdominal wall layers studied, although not statistically significant. The inflammatory response was similar at all times in both groups. It was found that angiogenesis was developed earlier in the control group (p3 = 0.005 and p7 = 0.012) and later in the experimental group (p14 = 0.048). CONCLUSION: Hepatectomy leads to a delay in the healing process, interfering with collagen synthesis and angiogenesis.
Liver; Regeneration; Hepatectomy; Wound healing
ARTIGO ORIGINAL
Cicatrização da parede abdominal após hepatectomia parcial
Maria de Lourdes Pessole Biondo-Simões - TCBC-PRI; Flávia Thaiana BonatoII; Aline Moraes MenachoII; Mariana DrechmerII; Tereza Cristina Santos CavalcantiIII; Saulo José Alves FelizolaIV
IProfessora Adjunto IV do Departamento de Cirurgia da Faculdade de Medicina da UFPR - PR-BR
IIAlunas do Programa de Iniciação Científica da UFPR - PR-BR
IIIProfessora do Departamento de Anatomia Patológica da UFPR - PR-BR
IVResidente do Departamento de Anatomia Patológica do Hospital Erasto Gaertner - PR-BR- PR-BR
Endereço para correspondência Endereço para correspondência: Maria de Lourdes P. Biondo Simões E-mail: biondo@avalon.sul.com.br
RESUMO
OBJETIVO: Avaliar a cicatrização da ferida incisional da parede abdominal de ratos hepatectomizados quanto à concentração de colágeno, reação inflamatória e angiogênese.
MÉTODOS: Utilizaram-se 48 ratos distribuídos aleatoriamente para laparotomia com e sem hepatectomia. As cicatrizes foram estudadas no 3º, 7º e 14º dia de pós-operatório. Analisou-se a densidade do colágeno por método histoquímico e a angiogênese por método imunohistoquímico.
RESULTADOS: A análise do colágeno total mostrou menor concentração no plano da pele e da tela subcutânea, nas cicatrizes abdominais do grupo experimento (p3=0,011; p7=0,004 e p14=0,008). A densidade de colágeno I foi inferior no grupo hepatectomizado, principalmente no 3º dia, tanto na pele e tela subcutânea (p=0,038) quanto no plano aponeurótico (p=0,026). Houve menor concentração de colágeno III nos dois planos estudados, embora não significante. A resposta inflamatória foi semelhante em todos os tempos, nos dois grupos. Verificou-se que a angiogênese desenvolveu-se mais precocemente no grupo controle (p3=0,005 e p7=0,012) e mais tardiamente no grupo experimento (p14=0,048).
CONCLUSÃO: A hepatectomia leva ao atraso do processo cicatricial, interferindo na síntese do colágeno e na angiogênese.
Descritores: Fígado. Regeneração. Hepatectomia. Cicatrização de feridas.
INTRODUÇÃO
Falhas na cicatrização da parede abdominal continuam sendo problema para os cirurgiões. Apesar dos avanços tecnológicos, problemas como deiscências e hérnias incisionais continuam apresentando altas incidências. Nos Estados Unidos são realizadas 200.000 correções cirúrgicas de hérnias incisionais ao ano1. Entre os fatores de risco conhecidos para deiscência da sutura da parede abdominal estão o tipo e a magnitude do ato operatório. Operações de emergência, períodos de instabilidade hemodinâmica perioperatórios, procedimentos envolvendo vias biliares, doenças hepáticas e tratamento cirúrgico de aneurisma de aorta estão associados com aumento na incidência da falha na cicatrização aguda2.
Gómez et al.3 relataram hérnias incisionais incidindo em 11,6% dos pacientes submetidos a transplante hepático, Müller et al.4 em 12%, Piazzese et al.5 em 4,9% e Vardanian et al.6 em 4,6%. Situação semelhante é descrita para os pacientes submetidos a hepatectomias parciais. Rudow et al.7 relataram incidência de 20%, enquanto D'Angelica et al.8, 9,8%. Segundo van't et al.9 situações mais graves com evisceração levaram à morte 25% dos doentes em até 60 dias. Dentre os que sobreviveram, 69% deles evoluíram com hérnias incisionais.
Cada vez mais tem-se estimulado a doação hepática intervivos, quando o doador chega a ceder 60% do seu fígado. Isto é possível porque o fígado remanescente é capaz de regenerar-se. Embora o termo "regeneração hepática" não seja biologicamente adequado, visto que não ocorre regeneração dos lobos ressecados, mas hiperplasia e hipertrofia dos lobos remanescentes (crescimento compensatório), este termo ficou consagrado na literatura10,11.
Todas as células hepáticas: hepatócitos, células endoteliais, células de Küpffer, células de Ito e células ductais proliferam. Entretanto, como os hepatócitos constituem 90% do parênquima e 60% do número total de células, a maioria dos estudos de regeneração monitora estas células10,11.
Durante a proliferação dos hepatócitos ocorre a liberação de fatores de crescimento como: fator de crescimento do hepatócito (HGF), fator transformador de crescimento alfa (TGF-α), fator de crescimento epidérmico (EGF) e fator de crescimento de fibroblastos (FGF)11.
O EGF estimula a síntese de DNA na maioria das células epiteliais e nos hepatócitos10,11. Os níveis de RNAm para a síntese de EGF elevam-se no início da regeneração hepática, indicando que este fator de crescimento promove expressão gênica e crescimento hepático11.
O TGF-α é capaz de estimular mitoses por mecanismo autócrino e parácrino. Seu efeito potencial sobre os hepatócitos pode ser parte do sinal mitogênico que direciona o estroma de células adjacentes para a proliferação10. O HGF foi o primeiro fator mitogênico identificado, no sangue, em altas concentrações durante o processo regenerativo, sendo considerado o mais potente estimulador da proliferação hepática12,13.
O fator transformador de crescimento beta (TGF-β) é capaz de estimular reversivelmente o crescimento de fibroblastos11. Sabe-se que o TGF-β1 e o TGF-β2 são importantes mediadores da fase aguda da reparação tecidual aumentando a resistência das feridas14,15. A presença do TGF-β é importante para iniciar e sustentar a cicatrização dos tecidos16. O HGF possui seu efeito totalmente inibido pelo TGF-β10. In vitro este fator mostrou-se um potente inibidor da proliferação dos hepatócitos10. In vivo, foi demonstrado que existe aumento da expressão de TGF-β após lesão tóxica, nas células hepáticas não parenquimatosas, ou seja, nas células de Küpffer, células estreladas e células endoteliais, porém não há aumento nos hepatócitos. Durante a regeneração hepática a elevação dos níveis de TGF-β não ocorre até que a maior parte da proliferação dos hepatócitos acabe.
Foi demonstrado que durante a regeneração hepática os níveis de TGF-β1 diminuem e a expressão de HGF aumenta, estimulando a proliferação dos hepatócitos17. É interessante ressaltar que durante o processo cicatricial normal, dos outros tecidos, os níveis de TGF-â sobem.
Kuhn et al. verificaram, em um estudo feito em ratos, que havia deficiência da resistência das cicatrizes abdominais durante a regeneração hepática. Encontraram altos níveis de HGF e baixos de TGF-β2. Este achado os levou a sugerir que possa existir priorização da regeneração hepática sobre a fibroplasia da cicatriz da parede abdominal18.
Considerando a alta incidência de complicações da cicatrização da ferida abdominal e as modificações das concentrações dos fatores de crescimento, percebe-se a importância de se estudar a cicatrização da parede abdominal após hepatectomias. O entendimento das causas que levam às deiscências de sutura e às falhas na cicatrização é necessário, para que se possa pensar em meios de prevenção e correção dessas complicações.
Este estudo teve por objetivo avaliar o processo de cicatrização da ferida incisional da parede abdominal de ratos hepatectomizados e compará-lo com o da ferida incisional de ratos não hepatectomizados.
MÉTODOS
O projeto que deu origem a este estudo foi avaliado pelo Comitê de Ética em Pesquisa com Animais do Setor de Ciências da Saúde da Universidade Federal do Paraná e aprovado recebeu o nº A.N. 009.005.07.09.
Foram utilizados 48 ratos (Rattus norvegicus albinus, Rodentia mammalia), machos, com idade entre 100 e 120 dias e peso de 250 ± 50 gramas, originários do Biotério Central da UFPR. Foram mantidos em quarentena por uma semana antes do início do estudo, e durante toda a pesquisa, no Laboratório da Disciplina de Técnica Cirúrgica e Cirurgia Experimental da UFPR, alojados em grupos de três a cinco animais por caixa, própria para a espécie. A temperatura foi de 20 ± 2ºC, o ciclo claro/escuro de 12 horas e a umidade relativa do ar, a própria do ambiente. Receberam água e ração padrão para a espécie ad libitum.
Sorteados, 21 deles compuseram o grupo controle (C) e 27 o grupo hepatectomizado (H). Estes grupos foram novamente sorteados para os subgrupos C3, C7 e C14 e H3, H7 e H14 conforme a data prevista para a avaliação do experimento, três, sete e 14 dias. Os subgrupos do controle tiveram sete ratos e do experimento, nove.
Depois de terem sido pesados e marcados, foram submetidos à anestesia por injeção intramuscular de 0,2ml/100g de peso de uma mistura de um mililitro de quetamina (50mg) com um mililitro de xilazina (20mg).
Após a depilação da parede abdominal ventral foi realizada uma laparotomia mediana com 4cm de extensão, iniciando imediatamente abaixo do processo xifoide. Nos animais do grupo H foi realizada uma hepatectomia parcial, retirando-se o lobo mediano, com suas porções centrais, junto com o lobo lateral esquerdo. Esta ressecção representa 67 a 70% da massa hepática19.
Revisada a hemostasia, procedeu-se à laparorrafia com dois planos de síntese tipo chuleio contínuo com fio monofilamentar 5.0 de náilon. O primeiro plano englobou o peritônio, o músculo e a aponeurose e o segundo, a pele.
Recuperados da anestesia, os ratos foram devolvidos às suas gaiolas com livre acesso à água e à ração, padrão comercial. Receberam, imediatamente após o término do ato operatório, diclofenaco de sódio na dose de 10mg/kg, por via intramuscular com finalidade analgésica e anti-inflamatória19. Para a eutanásia foi feita dose letal de tiopental sódico intraperitoneal (120mg/kg).
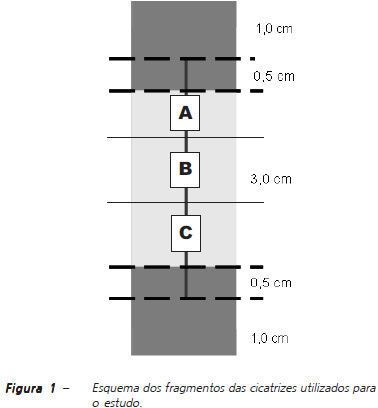
Depois de constatada a morte dos animais, procedeu-se à retirada de parte da parede abdominal ventral que continha a cicatriz na sua região central, deixando-se 2cm laterais e 1cm acima e abaixo dela. Separada a pele do conjunto peritônio-músculo aponeurótico e ambos estendidos sobre papel de filtro, foi descartado o meio centímetro superior e inferior dos dois retalhos. O restante foi fracionado em três porções com 1 x 4cm, constituindo os fragmentos A, B e C (Figura 1).
As frações A e C foram fixadas em formol a 10% e encaminhadas para estudo histopatológico. Emblocadas forneceram cortes seriados com 4mm de espessura que foram montados em lâminas e corados pela hematoxilina-eosina e pelo Picrosirius, assim como pelo método de imuno-histoquímica com anticorpo anti-CD 34.
Pela coloração da hematoxilina-eosina foi obtida a avaliação morfológica geral da cicatriz. Foi avaliado o processo inflamatório por leitura de três campos com ampliação de 400 vezes, conforme padronização descrita por Vizzotto et al20 (Tabela 1). Para a contagem das células adotou-se a escala: nenhuma célula = 0; até 50 células = 1; de 50 a 100 células = 2 e mais de 100 células = 3, positiva para monomorfonucleares e negativa para polimorfonucleares20.
Após a atribuição dos índices, procedeu-se ao somatório destes, de maneira que cada grupo de animais teve um escore final, permitindo assim a classificação dos grupos em três fases do processo inflamatório (Tabela 2)20.
A coloração pelo Picrosirius foi utilizada para reconhecer, ao microscópio com luz polarizada, a densidade do colágeno na cicatriz e as frações de colágeno I e III, pois as fibras mais espessas e fortemente birrefringentes apresentam-se coradas em tons de laranja a vermelho (colágeno I) e as fibras mais finas e dispersas, fracamente birrefringentes coradas de verde (colágeno III)21.
Pelo método de imuno-histoquímica foi avaliada a angiogênese; o número de vasos foi contado em três campos de grande aumento. O CD 34 é uma proteína glicosilada exclusiva de membranas, que é expressada por células hematopoiéticas imaturas e células endoteliais. O anti-CD 34 reconhece a molécula CD 34 e desta forma permite a identificação das células que a possuem.
Para a comparação dos grupos controle e experimento em cada dia de avaliação, foi usado o teste não-paramétrico de Mann-Whitney. A comparação dos momentos de avaliação, dentro dos grupos, foi feita considerando-se o teste não-paramétrico de Kruskal-Wallis. Valores de p<0,05 indicaram significância estatística.
RESULTADOS
Pôde-se perceber que o colágeno total se encontrava em menor concentração nas cicatrizes abdominais do grupo experimento, em todos os tempos, no plano pele e tela subcutânea (p3=0, 011; p7=0, 004 e p14=0, 008). No plano aponeurótico havia menor densidade de colágeno total apenas no 7º e 14º dias (p7 =0, 017 e p14 =0, 022) (Figuras 2 e 3).
A fração do colágeno I apresentou-se em me-nor concentração no grupo experimento, no plano pele e tela subcutânea no 3º e 14º dias (p3=0,038 e p14= 0,002), e no plano aponeurótico no 3º e 7º dias (p3=0,026 e p7=0,017).
A fração de colágeno III foi menor no grupo experimento nos três tempos, tendo sido significante no 7º dia no plano pele e tela subcutânea (p=0,026). No plano aponeurótico não houve diferença significante.
A reação inflamatória, no 3º dia, era predominantemente do tipo aguda (p=0,461) e no 7º dia do tipo crônica nas cicatrizes do grupo controle, enquanto nas do grupo experimento havia reação do tipo subaguda e crônica (p=0,192). A mesma situação foi observada no 14º dia (p=0,103).
A análise da angiogênese demonstrou maior número de vasos nas cicatrizes do grupo controle no 3º dia (p=0,011) e no 7º dia (p=0,038). No 14º dia, observou-se tendência a maior número de vasos no grupo experimento (p=0,181) (Figura 4).
DISCUSSÃO
Apesar do progresso das técnicas cirúrgicas e do melhor acompanhamento no pós-operatório, as informações da literatura mostram que a incidência de falhas na cicatrização não mudou nos últimos anos3,4,9. Trabalhos sugerem que as cicatrizes pós hepatectomia são menos resistentes do que as de outros procedimentos cirúrgicos4,7,18.
Foi demonstrado que existe aumento na síntese de colágeno no fígado remanescente após hepatectomia parcial até o 7º dia, não existindo mais essa diferença a partir do 14º dia. Além disso, registraram diminuição na degradação do colágeno, sugerindo que esse processo favoreça o acúmulo desta proteína na regeneração hepática precoce22.
A análise do colágeno, feita no presente estudo, mostrou menor densidade de colágeno nas cicatrizes dos planos pele/tela subcutânea e aponeurose. Pode-se ainda verificar que esta diferença se deveu à menor densidade da fração de colágeno I, especialmente nos tempos iniciais, o que leva a supor que exista atraso na síntese desta proteína pelos fibroblastos. É possível argumentar que esta menor densidade possa levar à menor resistência das cicatrizes e ser a responsável pelo maior número de deiscências e hérnias incisionais observadas em indivíduos hepatectomizados3-9.
A resposta inflamatória do grupo hepatectomizado mostrou-se prolongada, porém não o foi de modo significante. Reação inflamatória prolongada poderia ser uma boa justificativa para explicar a menor densidade de colágeno. Entretanto não foi possível confirmar esta informação neste estudo. Talvez uma amostra maior possa esclarecer esta dúvida.
O processo inflamatório atrasa a progressão das fases da cicatrização, possivelmente por mudanças na si-nalização realizada por fatores de crescimento. Dados da literatura mostram que o nível de TGF-β2, responsável pela proliferação de fibroblastos, início e manutenção da resposta cicatricial, só aumenta após a proliferação da maior parte dos hepatócitos. A hiperplasia e a recuperação da massa hepática são priorizadas em relação à cicatrização18.
A hepatectomia e a regeneração hepática levam ao atraso da recuperação da incisão da parede abdominal possivelmente por retardar a secreção de algumas citocinas (TGF-β2) em detrimento de outras (HGF), assim como diferente mobilização celular, demonstrada pelo maior tempo de inflamação12,18.
Não é conhecido se um processo de cura de um tecido interfere com o de outro num mesmo organismo, porém se sabe da importância das citocinas no processo de cura ou reparação e que elas são expressas em quantidades e momentos diferentes em cada tecido. Autores sugerem que procedimentos simultâneos levam a maior risco de falha e podem prejudicar a recuperação da pare-de abdominal1,3,5.
Considerando a alta incidência de complicações da cicatrização da ferida abdominal e as modificações das concentrações dos fatores de crescimento, percebe-se a importância de se estudar a cicatrização da parede abdominal após hepatectomias. São necessários mais estudos com dosagens dos principais fatores envolvidos para melhor compreensão e possível reversão do atraso cicatricial provocado pela regeneração hepática.
Observou-se no 3º e 7º dias que tanto o colágeno tipo I quanto a angiogênese se mostravam aumentados no grupo controle. Pode-se explicar tal fato pela maior chegada de fatores de crescimento e oxigênio ao local, estimulando fibroblastos.
Seria interessante testar a resistência das cicatrizes, mas por motivos técnicos, tal fato não foi realizado neste momento, sendo objeto de estudos subsequentes.
Os dados analisados neste estudo permitem concluir que a hepatectomia leva ao atraso do processo cicatricial, interferindo na síntese do colágeno e na angiogênese.
Recebido em 19/03/2010
Aceito para publicação em 14/05/2010
Conflito de interesse: nenhum
Fonte de financiamento: nenhuma
Trabalho desenvolvido na Disciplina de Técnica Cirúrgica e Cirurgia Experimental da Faculdade de Medicina da Universidade Federal do Paraná-UFPR- PR-BR.
- 1. Luijendijk RW, Hop WC, van den Tol MP, de Lange DC, Braaksma MM, Ijzermans JN, Boelhouwer RU, de Vries BC, Salu MK, Wereldsma JC, Bruijninckx CM, Jeekel J. A comparision of suture repair with mesh repair for incisional hernia. N Engl J Med 2000; 343(6):392-8.
- 2. Carlson MA. Acute wound failure. Surg Clin North Am 1997; 77(3):607-36.
- 3. Gómez R, Hidalgo M, Marques E, Marin L, Loinaz C, Gonzalez I, Garcia I, Moreno E. Incidence and predisposing factors for incisional hernia in patients with liver transplantation. Hernia 2001; 5(4):172-6.
- 4. Müller V, Lehner M, Klein P, Hohenberger W, Ott R. Incisional hernia repair after orthotopic liver transplantation: a technique employing an inlay/onlay polypropylene mesh. Langenbecks Arch Surg 2003; 388(3):167-73.
- 5. Piazzese E, Montalti R, Beltempo P, Bertelli R, Puviani L, Pacilè V, Nardo B, Cavallari A. Incidence, predisposing factors, and results of surgical treatment of incisional hernia after orthotopic liver transplantation. Transplant Proc 2004; 36(10):3097-8.
- 6. Vardanian AJ, Farmer DG, Ghobrial RM, Busuttil RW, Hiatt JR. Incisional hernia after liver transplantation. J Am Coll Surg 2006; 203(4):421-5.
- 7. Rudow DL, Brown RS Jr, Emond JC, Marratta D, Bellemare S, Kinkhabwala M. One-year morbidity after donor right hepatectomy. Liver Transpl 2004; 10(11):1428-31.
- 8. D'Angelica M, Maddineni S, Fong Y, Martin RC, Cohen MS, Ben-Porat L, Gonen M, DeMatteo RP, Blumgart LH, Jarnagin WR. Optimal abdominal incision for partial hepatectomy: increased late complications with Mercedes-type incisions compared to extended right subcostal incisions. World J Surg 2006; 30(3):410-8.
- 9. van't RM, De Vos Van Steenwijk PJ, Bonjer HJ, Steyerberg EW, Jeekel J. Incisional hernia after repair of wound dehiscense: incidence and risk factors. Am Surg 2004; 70(4):281-6.
- 10. Ramalho FS, Ramalho LNZ, Zucoloto S, Silva Jr OC. Regeneração hepática: algumas definições num universo de incertezas. Acta Cir Bras 1993; 8(4):177-89.
- 11. Michalopoulos GK, DeFrances MC. Liver regeneration. Science 1997; 276(5309):60-6.
- 12. Liu ML, Mars WM, Zarnegar R, Michalopoulos GK. Uptake and distribution of hepatocyte growth factor in normal and regenerating adult rat liver. Am J Pathol 1994; 144(1):129-40.
- 13. Goupil D, Ethier C, Zarnegar R, Gascon-Barré M. Hepatic expression of regeneration marker genes following partial hepatectomy in the rat. Influence of 1,25-dihydroxyvitamin D3 in hypocalcemia. J Hepatol 1997; 26(3):659-68.
- 14. Wright T, Hill D, Polo M, Soler P, Pratt B, Nichols E. The modulation of acute incisional wound healing with rTGF-â2 and fibrin sealant [abstract]. Wound Repair Regen 1997; 5:A128.
- 15. Polo M, Smith PD, Kim YJ, Wang X, Ko F, Robson MC. Effect of TGF-βeta2 on proliferative scar fibroblast cell kinetics. Ann Plast Surg 1999; 43(2):185-90.
- 16. Bennett NT, Schultz GS. Growth factors and wound healing: biochemical properties of growth factors and their receptors. Am J Surg 1993; 165(6):728-37.
- 17. Steer CJ. Liver regeneration. FASEB J 1995; 9(14):1396-400.
- 18. Kuhn MA, Smith PD, Wachtel TL, Wright TE, Rogazewski A, Nguyen K, Robson MC, Franz MG. Abdominal wall repair is delayed during hepatic regeneration. J Surg Res 2001; 95(1):54-60.
- 19. Higgins GM, Anderson RM. Experimental pathology of the liver: Restoration of the liver of the white rats following partial surgical removal. Arch Pathol 1931; 12:186-202.
- 20. Vizzotto Jr AO, Noronha L, Scheffel DLH, Campos ACI. Influência da cisplatina administrada no pré e no pós-operatório sobre a cicatrização de anastomoses colônicas em ratos. J Bras Patol Med Lab 2003; 39(2):143-9.
- 21. Junqueira LC, Cossermelli W, Brentani R. Differential staining of collagen type I, II and III by Sirius Red and polarization microscopy. Arch Histol Jpn 1978; 41(3):267-74.
- 22. Yamamoto H, Murawaki Y, Kawasaki H. Hepatic collagen synthesis and degradation during liver regeneration after partial hepatectomy. Hepatology 1995; 21(1):155-61.
Endereço para correspondência:
Datas de Publicação
-
Publicação nesta coleção
16 Jun 2011 -
Data do Fascículo
Abr 2011
Histórico
-
Recebido
19 Mar 2010 -
Aceito
14 Maio 2010