Resumos
OBJETIVO: avaliar os efeitos da administração crônica de três diferentes doses de Ritonavir nos fígados e rins de ratas prenhes e seus conceptos do ponto de vista morfológico. MÉTODOS: Quarenta ratas albinas EPM-1 Wistar, prenhes, foram aleatoriamente divididas em quatro grupos: Contr (controle do veículo) e três grupos experimentais, Exp20, Exp60 e Exp180, que receberam, respectivamente, 20, 60 e 180 mg/kg por dia de Ritonavir por via oral. A droga e o veículo (propilenoglicol) foram administrados por gavagem, desde o primeiro até o 20º dia da prenhez. No último dia do experimento, todos os animais foram anestesiados e sacrificados. Em seguida, fragmentos dos fígados e rins maternos e fetais foram coletados e preparados para análise em microscopia de luz. RESULTADOS: não observamos nenhuma alteração morfológica nas vísceras estudadas nos Grupos Contr e Exp20. No Grupo Exp60, encontramos, no fígado materno, hepatócitos com sinais de atrofia e de apoptose (eosinofilia citoplasmática e núcleos picnóticos) e vasodilatação marcante dos capilares sinusóides (congestão). No rim materno, encontramos áreas eosinofílicas e núcleos hipercromáticos na parede dos túbulos contorcidos proximais. O fígado e rins maternos do Grupo Exp180 tiveram alterações morfológicas mais intensas do que no Grupo Exp60. Não observamos alterações histomorfológicas nos fígados e rins fetais em todos os grupos, o que pode ser decorrente da ação protetora da glicoproteína P. CONCLUSÕES: nossos resultados mostram que a administração de Ritonavir a ratas prenhes causou alterações morfológicas nos fígados e rins maternos em doses mais altas que a convencional. Já a ausência de anormalidades nos órgãos fetais pode ser explicada pelo papel protetor da glicoproteína P.
Ritonavir; Ritonavir; Prenhez; Hepatopatias; Nefropatias; Anti-retrovirais
PURPOSE: to evaluate the effect of the chronic administration of three different doses of Ritonavir in the liver and kidneys of pregnant albino rats and their concepts from a morphological standpoint. METHODS: forty pregnant albino EPM-1 Wistar rats were randomly divided into four groups: Contr (vehicle control), and three experimental groups, Exp20, Exp60, Exp180, which received daily 20, 60 or 180 mg/kg of Ritonavir, respectively. The drug and the vehicle (propyleneglycol) were orally administered by gavage, from the first up to the 20th day of pregnancy. At the last experimental day, all the animals were sacrificed under deep anesthesia, and fragments from the maternal and fetal liver and kidneys were taken and prepared for histological analysis by light microscope. RESULTS: no morphological changes were identified in Exp20 and control group. In the Exp60 group, we found hepatocytes with signs of atrophy and apoptosis (eosinophilic cytoplasm and picnotic nuclei) and marked sinusoid capillary vasodilation (congestion). The proximal convoluted tubules of maternal kidneys and liver showed eosinophilic areas and hyperchromatic nuclei, as well as signs of vasodilation. The maternal kidneys and livers of the Exp180 rats presented more prominent morphological changes than the ones of Exp60. Regarding the fetal organs, no histomorphological abnormalities were observed in all the groups. CONCLUSIONS: our results show that the administration of Ritonavir to pregnant rats, in higher than conventional doses causes morphological changes in the maternal liver and kidneys. On the other hand, the lack of abnormalities in the fetal organs may be due to the protective role of glycoprotein P.
Ritonavir; Ritonavir; Pregnancy, animal; Liver diseases; Kidney diseases; Anti-retroviral agents
ARTIGOS ORIGINAIS
Análise morfológica dos fígados e rins no binômio materno-fetal após tratamento de ratas prenhes com Ritonavir durante toda a prenhez
Morphological analysis of liver and kidneys of pregnant rats and their fetuses upon chronic Ritonavir administration
Adelino Moreira de CarvalhoI; Ricardo Santos SimõesII; Fábio Hideo Martins OliveiraIII; Manuel de Jesus SimõesIV; Ricardo Martins Oliveira-FilhoV; Mary Uchiyama NakamuraVI; Luiz Kulay JúniorVII
IDocente da Faculdade de Ciências Médicas da Universidade José do Rosário Vellano UNIFENAS Alfenas (MG), Brasil
IIResidente do Departamento de Obstetrícia da Escola Paulista de Medicina da Universidade Federal de São Paulo UNIFESP São Paulo (SP), Brasil
IIIResidente do Departamento de Obstetrícia da Faculdade de Ciências Médicas da Irmandade da Santa Casa de Misericórdia de São Paulo São Paulo (SP), Brasil
IVProfessor Associado do Departamento de Morfologia da Escola Paulista de Medicina da Universidade Federal de São Paulo UNIFESP São Paulo (SP), Brasil
VProfessor do Departamento de Farmacologia do Instituto de Ciências Biomédicas da Universidade de São Paulo USP São Paulo (SP), Brasil
VIProfessora Associada do Departamento de Obstetrícia da Escola Paulista de Medicina da Universidade Federal de São Paulo UNIFESP São Paulo (SP), Brasil
VIIProfessor Titular do Departamento de Obstetrícia da Escola Paulista de Medicina da Universidade Federal de São Paulo UNIFESP São Paulo (SP), Brasil
Correspondência Correspondência: Adelino Moreira de Carvalho Avenida Dona Conceição, 320 Jardim Panorama CEP 37130-000 Alfenas/MG Fone: (35) 3299-3539 E-mail: adelino.carvalho@unifenas.br
RESUMO
OBJETIVO: avaliar os efeitos da administração crônica de três diferentes doses de Ritonavir nos fígados e rins de ratas prenhes e seus conceptos do ponto de vista morfológico.
MÉTODOS: Quarenta ratas albinas EPM-1 Wistar, prenhes, foram aleatoriamente divididas em quatro grupos: Contr (controle do veículo) e três grupos experimentais, Exp20, Exp60 e Exp180, que receberam, respectivamente, 20, 60 e 180 mg/kg por dia de Ritonavir por via oral. A droga e o veículo (propilenoglicol) foram administrados por gavagem, desde o primeiro até o 20º dia da prenhez. No último dia do experimento, todos os animais foram anestesiados e sacrificados. Em seguida, fragmentos dos fígados e rins maternos e fetais foram coletados e preparados para análise em microscopia de luz.
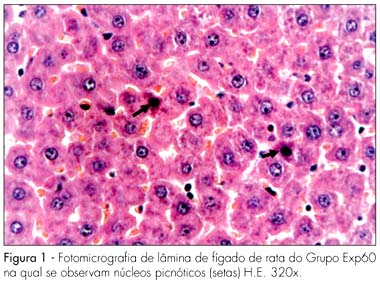
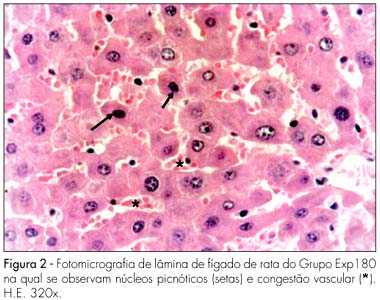
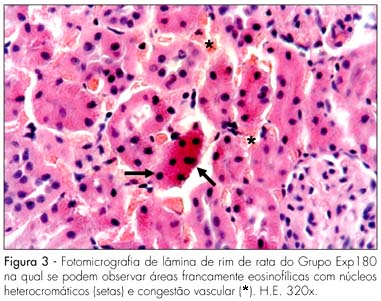
RESULTADOS: não observamos nenhuma alteração morfológica nas vísceras estudadas nos Grupos Contr e Exp20. No Grupo Exp60, encontramos, no fígado materno, hepatócitos com sinais de atrofia e de apoptose (eosinofilia citoplasmática e núcleos picnóticos) e vasodilatação marcante dos capilares sinusóides (congestão). No rim materno, encontramos áreas eosinofílicas e núcleos hipercromáticos na parede dos túbulos contorcidos proximais. O fígado e rins maternos do Grupo Exp180 tiveram alterações morfológicas mais intensas do que no Grupo Exp60. Não observamos alterações histomorfológicas nos fígados e rins fetais em todos os grupos, o que pode ser decorrente da ação protetora da glicoproteína P.
CONCLUSÕES: nossos resultados mostram que a administração de Ritonavir a ratas prenhes causou alterações morfológicas nos fígados e rins maternos em doses mais altas que a convencional. Já a ausência de anormalidades nos órgãos fetais pode ser explicada pelo papel protetor da glicoproteína P.
Palavras-chaves: Ritonavir/toxicidade; Ritonavir/efeitos adversos; Prenhez; Hepatopatias/induzido quimicamente; Nefropatias/induzido quimicamente; Anti-retrovirais
ABSTRACT
PURPOSE: to evaluate the effect of the chronic administration of three different doses of Ritonavir in the liver and kidneys of pregnant albino rats and their concepts from a morphological standpoint.
METHODS: forty pregnant albino EPM-1 Wistar rats were randomly divided into four groups: Contr (vehicle control), and three experimental groups, Exp20, Exp60, Exp180, which received daily 20, 60 or 180 mg/kg of Ritonavir, respectively. The drug and the vehicle (propyleneglycol) were orally administered by gavage, from the first up to the 20th day of pregnancy. At the last experimental day, all the animals were sacrificed under deep anesthesia, and fragments from the maternal and fetal liver and kidneys were taken and prepared for histological analysis by light microscope.
RESULTS: no morphological changes were identified in Exp20 and control group. In the Exp60 group, we found hepatocytes with signs of atrophy and apoptosis (eosinophilic cytoplasm and picnotic nuclei) and marked sinusoid capillary vasodilation (congestion). The proximal convoluted tubules of maternal kidneys and liver showed eosinophilic areas and hyperchromatic nuclei, as well as signs of vasodilation. The maternal kidneys and livers of the Exp180 rats presented more prominent morphological changes than the ones of Exp60. Regarding the fetal organs, no histomorphological abnormalities were observed in all the groups.
CONCLUSIONS: our results show that the administration of Ritonavir to pregnant rats, in higher than conventional doses causes morphological changes in the maternal liver and kidneys. On the other hand, the lack of abnormalities in the fetal organs may be due to the protective role of glycoprotein P.
Keywords: Ritonavir/toxicity; Ritonavir/adverse effects; Pregnancy, animal; Liver diseases/chemically induced;Kidney diseases/chemically induced;Anti-retroviral agents
Introdução
Desde o seu reconhecimento como entidade nosológica, há cerca de duas décadas, a síndrome da imunodeficiência adquirida (AIDS) representa um desafio médico, devido à sua alta taxa de mortalidade e ao número cada vez maior de infectados.
Recentemente, o programa de combate a AIDS/HIV das Nações Unidas (UNAIDS e WHO) relatou que o mundo registrou 5 milhões de novas infecções, 3,1 milhões de mortes, em 2005, e um total de 4,9 milhões de pessoas infectadas a cada ano. As mulheres respondem por 50% de toda a população HIV positiva no mundo1.
O Ministério da Saúde do Brasil, em 2005, revelou que existem aproximadamente 600.000 portadores do HIV e mais de 12.000 grávidas contaminadas. A taxa de mulheres portadoras do vírus no momento do parto gira em torno de 0,5%. A taxa de mortalidade por AIDS no Brasil encontra-se estabilizada desde 1999, com média de 6,3 mortes por 100.000 habitantes. Esse índice é fruto da distribuição gratuita de anti-retrovirais. O Brasil é citado como o primeiro país em desenvolvimento a oferecer a terapia anti-retroviral gratuita e universal, e um dos primeiros a obter sucesso com essa política2.
Desde o estudo do Pediatric AIDS Clinical Group, conhecido como Protocolo 076 (ACTG 076), no qual se demonstrou redução da taxa de transmissão vertical em 70% com a administração de anti-retrovirais à gestante, os benefícios desta terapia vêm sendo amplamente estudados em associação com outras intervenções, como cesárea eletiva e supressão de aleitamento materno, a fim de reduzir a taxa de transmissão vertical3,4. Embora inicialmente preconizada a monoterapia, há recomendações recentes de que as gestantes não devem ser privadas do uso de combinações de drogas potentes, visto que, atualmente, esses esquemas estão relacionados a menor taxa de transmissão vertical5,6.
Portanto, o desafio é muito grande e exige, além de outras medidas como promoção da saúde e prevenção da síndrome, o tratamento medicamentoso. Neste sentido, há, hoje, um arsenal terapêutico que tem permitido melhor qualidade de vida e maior sobrevida para os portadores do vírus da AIDS ou com a condição patológica já instalada. O arsenal é rico, mas associado a efeitos adversos que, em muitos aspectos, precisam ser mais pesquisados, especialmente quanto à sua toxicidade para as grávidas e seus conceptos. Neste aspecto, pesquisas reforçam que o tratamento farmacológico da mulher grávida portadora do HIV ou com a síndrome já estabelecida não se associou a alterações dignas de nota em vários indicadores da normalidade fetal, tais como redução do índice de Apgar, baixo peso fetal, parto prematuro, entre outros; insistem que o tratamento farmacológico da grávida HIV positiva é uma exigência, que traz mais benefícios que problemas para a mulher e para o feto7,8.
Dependendo da região do mundo, alta percentagem da população total dos infectados pelo HIV são mulheres em idade reprodutiva, passíveis de engravidar e algumas, inclusive, na vigência de terapia anti-retroviral9. A utilização de algumas dessas drogas está formalmente contra-indicada nesse período. Cada vez mais, tem-se usado a associação de drogas com bons resultados terapêuticos, tanto para a mulher grávida quanto para seu concepto, mas persiste a preocupação com possíveis efeitos colaterais, carecendo-se de estudos mais bem controlados10.
Dentro do espírito de conhecer melhor um dos integrantes do arsenal terapêutico disponível, propusemo-nos estudar o fármaco Ritonavir, enfocando seus possíveis efeitos sobre os fígados e rins de ratas prenhes e de seus conceptos, levando em consideração os aspectos morfológicos dessas vísceras.
Embora não haja estudos bem controlados, o Food and Drug Administration (FDA) americano classificou o Ritonavir na categoria B de risco para o feto. Por isto, interessou-nos estudar esse medicamento em relação a possíveis efeitos indesejáveis sobre a prenhez e os fetos. No presente trabalho, nossa atenção voltou-se para a análise dos efeitos do uso crônico do Ritonavir sobre os fígados e rins das matrizes e de suas crias.
Métodos
Foram utilizadas ratas (Rattus norvegicus albinus) adultas, virgens, pesando aproximadamente 200 g, fornecidas pelo Centro de Desenvolvimento de Modelos de Experimentação (Cedeme) da Escola Paulista de Medicina da Universidade Federal de São Paulo (Unifesp/EPM). Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Unifesp/EPM (parecer nº. 0276/02).
Os animais foram mantidos confinados em gaiolas plásticas, no biotério da Disciplina de Histologia, com temperatura ambiente controlada a 22ºC e iluminação artificial, obtida com lâmpadas fluorescentes, sendo o fotoperíodo de 12 horas claro (7:00-19:00 h) e 12 horas escuro, com alimentação e água ad libitum.
Após um período de sete dias, os animais foram acasalados na proporção de um macho para três fêmeas, por período de duas horas. O início da gestação (dia zero da prenhez) foi determinado pelo encontro de espermatozóides na vagina da rata11. Quarenta ratas prenhes foram então distribuídas, aleatoriamente, em quatro grupos numericamente iguais: Contr, animais que receberam 1 mL de propilenoglicol; Exp20, Exp60 e Exp180, animais tratados, respectivamente, com 20, 60 e 180 mg/kg por dia de solução oral de Ritonavir. O veículo e a droga foram administrados por gavagem, uma vez ao dia, desde o dia zero até o 20º dia da prenhez.
Ao termo (20º dia), todos os animais foram anestesiados com mistura de xilazina (0,1 mg/kg) e cetamina (0,1 mg/kg), por via intraperitoneal. Após laparotomia, fragmentos dos fígados e rins das ratas e de seus fetos foram retirados e mergulhados em formol a 10% tamponado (tampão fosfato 10 mM, pH 7,4), e processados para estudo histológico à microscopia de luz. O preparo e o estudo histológicos foram realizados no Laboratório de Obstetrícia Fisiológica e Experimental do Departamento de Obstetrícia da Unifesp/EPM. Após os procedimentos habituais de inclusão em parafina, os blocos foram cortados (5 µm) e as lâminas coradas pela hematoxilina-eosina. As lâminas foram avaliadas em microscópio de luz marca Carl Zeiss.
Na leitura das lâminas, considerou-se padrão de normalidade para o fígado: bom estado de conservação, homogeneidade de aspecto, identificação de lóbulos hepáticos íntegros, espaço porta íntegro e veias hepáticas bem definidas; cordões sinusóides presentes, íntegros, confluindo para veia centro-lobular. Nos capilares sinusóides entendeu-se como normal a presença de algumas hemácias. Nas células hepáticas, consideraram-se normais aquelas com um ou mais núcleos íntegros, em geral centralizados, e nucléolos bem evidentes. No citoplasma, foi considerado padrão de normalidade encontrar áreas basófilas e eosinófilas.
Nos rins, a normalidade obedeceu aos quesitos: bem conservados, apresentando corpúsculos renais e túbulos contorcidos proximais e distais íntegros; os glomérulos formados por capilares, podócitos, células endoteliais e mesangiais sem alterações histológicas. Outros itens avaliados: cápsula de Bowman íntegra, presença de células cúbicas ou poliédricas, apresentando citoplasma eosinófilo e núcleo arredondado. Na região medular, analisaram-se as alças de Henle junto aos capilares e túbulos coletores, estes com citoplasma bem delimitado e núcleo esférico, quando dentro da normalidade.
Quando houve alteração da coloração padrão já bem estabelecida para as estruturas hepáticas, alteração na morfologia de núcleos, rompimento de limites de alguma organela citoplasmática, presença de congestão vascular, tudo isto foi entendido como provocado, provavelmente, pela droga em sua(s) dose(s) de aplicação.
Resultados
Nos fígados maternos, notamos que os Grupos Contr e Exp20 apresentaram padrões de normalidade. Foram visualizados facilmente lóbulos hepáticos, espaços porta e veias hepáticas bem delineadas. Os hepatócitos formavam cordões confluentes para a veia centro-lobular. Entre os cordões, observavam-se sinusóides hepáticos com núcleos arredondados e volumosos, geralmente eucromáticos. Já no Grupo Exp60, que recebeu 60 mg/kg de peso corporal de Ritonavir, o fígado apresentou alterações morfológicas, tais como: congestão vascular e alguns hepatócitos com núcleos picnóticos (Figura 1). Este quadro morfológico está acentuado no Grupo Exp180 (180 mg/kg), no qual se observa grave congestão vascular, palidez celular e numerosos hepatócitos com núcleos picnóticos (Figura 2). O quadro detectado em Exp60 e Exp180 esteve presente na quase totalidade das lâminas desses grupos, evidenciando alteração abrangente e significativa.
Quanto aos fígados fetais, morfologicamente não foram observadas quaisquer alterações perceptíveis à microscopia de luz em nenhum dos grupos estudados. Observaram-se núcleos de hepatócitos bem evidentes, células da linhagem eritrocitária em diferentes fases do desenvolvimento e megacariócitos. Não se evidenciaram os limites dos lóbulos hepáticos, padrão compatível com a normalidade morfológica nessa etapa do desenvolvimento da cria.
A morfologia dos rins maternos apresentou-se muito semelhante nos Grupos Contr e Exp20, nos quais notamos corpúsculos renais e túbulos contorcidos proximais e distais dentro dos padrões da normalidade. No entanto, no Grupo Exp60, houve nítida dilatação dos vasos sangüíneos peritubulares. No Grupo Exp180, por sua vez, houve acentuada dilatação vascular ao redor dos túbulos contorcidos, e identificamos núcleos intensamente corados (heterocromáticos) e citoplasma eosinofílico (Figura 3).
O aspecto morfológico dos rins fetais mostrou-se semelhante em todos os grupos estudados, tanto no córtex quanto na medula, sem sinais de alteração celular. Observaram-se glomérulos, túbulos contorcidos (na cortical), e ductos coletores e alças de Henle (na medular) típicos.
Discussão
O Ritonavir é um sal do ácido paratoluenossulfônico, com ampla distribuição tecidual, metabolizado pelo fígado e por ele excretado, embora uma pequena quantidade, inferior a 5%, seja eliminada pelos rins12. É um inibidor de protease viral com especificidade para o vírus HIV 1, utilizado com freqüência nos esquemas de anti-retrovirais combinados para gestantes contaminadas.
Com relação à ação do Ritonavir em animais, em estudo prévio utilizando as mesmas doses aqui empregadas, notamos que a taxa de mortalidade materna e fetal era significativamente maior nas ratas que receberam 60 e 180 mg/kg de peso corporal (2/10 e 4/10 mortes maternas, respectivamente)13. Por outro lado, não observamos nenhuma alteração nos fetos, presumindo que esta proteção possa ser devida à ação protetora da glicoproteína P, presente na placenta. Deve ser mencionado que já se demonstrou que apenas quantidades irrisórias de Ritonavir atravessam a barreira placentária em humanos14.
A dose de Ritonavir administrada no Grupo Exp20 foi proporcionalmente semelhante à recomendada para uso terapêutico em humanos, isto é, 20 mg/kg de peso corporal por dia13. Os Grupos Exp60 e Exp180 foram tratados com doses três e nove vezes superiores à dose menor, porque o metabolismo hepático da rata estima-se ser três vezes mais eficiente do que aquele encontrado em humanos e também porque a depuração renal desses animais é duas vezes mais eficiente.
Com relação aos resultados, no Grupo Contr não se observaram quaisquer alterações morfológicas à microscopia de luz nos fígados e rins tanto das ratas quanto de suas crias. Não se registraram também alterações morfológicas nos fígados maternos e fetais do Grupo Exp20. No tocante ao fígado, observa-se uma discordância entre nossos achados e os apresentados por outros pesquisadores15,16. Segundo estes autores, doses acima de 60% da dose terapêutica, isto é, maiores que 12 mg/kg de peso corpóreo, aproximadamente, estão relacionadas à toxicidade hepática em ratas. Efetivamente, o Grupo Exp20 recebeu o equivalente a 20 mg/kg de peso corpóreo e não se observou nenhum efeito hepatotóxico.
Já no Grupo Exp60, nos fígados maternos, observaram-se importantes alterações morfológicas, tais como congestão vascular e alguns sinais indicativos de necrose, como hepatócitos com núcleos irregulares e hipercromáticos, provavelmente decorrentes de efeito tóxico do Ritonavir. Neste grupo, administrou-se a concentração equivalente a três vezes a dose terapêutica, o que per se pode explicar a toxicidade celular, ou seja, alta dose do fármaco. Nos rins maternos deste mesmo grupo detectamos apenas vasos sangüíneos discretamente dilatados.
No Grupo Exp180 (180 mg/kg de Ritonavir), nos fígados maternos evidenciaram-se vísceras muito comprometidas, provavelmente pelo efeito tóxico do fármaco, fato este também registrado em outras pesquisas17. A dose, neste caso, foi nove vezes a terapêutica, o que permite interpretar como um efeito dose-dependente, pois as alterações morfológicas foram muito mais intensas: houve uma congestão vascular muito mais expressiva e numerosos núcleos picnóticos. Deve-se ter também em mente que, talvez, as doses pudessem ter até um efeito deletério maior, pois é fato bem estabelecido que a metabolização hepática das ratas é três vezes mais rápida que a do ser humano e a depuração renal é duas vezes maior.
Já nos rins maternos do Exp180, verificaram-se alterações acentuadas, em especial intensa vasodilatação ao redor dos túbulos proximais, apresentando células com núcleos intensamente corados e citoplasma eosinófilo (Figura 3). Estes efeitos provavelmente vinculam-se ao fato de ser o fígado um órgão alvo da concentração preferencial do Ritonavir e de ser esta droga de metabolismo e eliminação hepáticos, restando apenas menos de 5% do fármaco para eliminação renal12,18. Esse comprometimento dos rins maternos, na dose de 180 mg/kg de peso corpóreo, confirma o achado em humanos por vários pesquisadores, que relatam casos de insuficiência renal decorrentes do uso do Ritonavir19-21.
Outro fato marcante foi a ausência de quaisquer alterações morfológicas perceptíveis em microscopia de luz nos fígados e rins das crias. A fundamentação científica que consideramos mais adequada para essa condição é a relatada proteção que a glicoproteína P placentária exerce, impedindo que quantidades apreciáveis do Ritonavir possam penetrar por meio da placenta, fato este já identificado e comprovado na literatura14,22,23. Este papel protetor parece estender-se a outros fármacos, o que nos leva à ponderação de que a glicoproteína P possa representar um papel dual na questão da chegada de fármacos ao compartimento fetal, por um lado tendo uma função protetora contra xenobióticos indesejáveis, e, por outro, constituindo um obstáculo à entrada de fármacos cuja ação no compartimento intra-uterino seja desejada, por exemplo, com propósitos terapêuticos.
Embora não se possa fazer uma correlação direta entre a toxicidade de um fármaco em animais, ainda que sejam do grupo antropóide, e o ser humano, especialmente diante de uma enfermidade que tem tratamento, mas não tem cura, como a AIDS, os achados deste trabalho podem trazer algum suporte para a terapêutica.
Recebido: 27/11/2006
Aceito com modificações: 28/06/2007
- 1. Hokey DA, Weiner DB. DNA vaccines for HIV: challenges and opportunities. Springer Semin Immunopathol. 2006; 28(3):267-79.
- 2. Dourado I, Veras MASM, Barreira D, Brito AM. Tendências da epidemia de Aids no Brasil após a terapia anti-retroviral. Rev Saúde Pública. 2006; 40 Supl.:9-17.
- 3. Ioannidis JP, Abrams EJ, Ammann A, Bulterys M, Goedert JJ, Gray L, et al. Perinatal transmission of human immunodeficiency virus type 1 by pregnant women with RNA virus loads <1000 copies/ml. J Infect Dis. 2001; 183(4):539-45.
- 4. Martinez AM, Hora VP, Santos AL, Mendoza-Sassi R, Von Groll A, Soares EA, DAvila N, Silveira J, Leal RG, Tanuri A, Soares MA; HIV/AIDS Unit. Determinants of HIV-1 mother-to-child transmission in Southern Brazil. An Acad Bras Cienc. 2006; 78(1):113-21.
- 5. Germinario RJ. Anti-retroviral protease inhibitors - a two edged sword? IUBMB Life. 2003; 55(2):67-70.
- 6. Kageyama M, Namiki H, Fukushima H, Terasaka S, Togawa T, Tanaka A, et al. Effect of chronic administration of ritonavir on function of cytochrome P450 3A and P-glycoprotein in rats. Biol Pharm Bull. 2005; 28(1):130-7.
- 7. Lambert JS, Watts DH, Mofenson L, Stiehm ER, Harris DR, Bethel J, et al. Risk factors for preterm birth, low birth weight, and intrauterine growth retardation in infants born to HIV-infected pregnant women receiving zidovudine. Pediatric AIDS Clinical Trials Group 185 Team. AIDS. 2000; 14(10):1389-99.
- 8. Tuomala RE, Shapiro DE, Mofenson LM, Bryson Y, Culnane M, Hughes MD, et al. Antiretroviral therapy during pregnancy and the risk of an adverse outcome. N Engl J Med. 2002; 346(24):1863-70.
- 9. Okong P. HIV/AIDS and womens health in Uganda: lingering gender inequity. J Obstet Gynaecol Can. 2006; 28(11):980-2.
- 10. Thorne C, Newell ML. Safety of agents used to prevent mother-to-child transmission of HIV: is there any cause to concern? Drug Saf. 2007; 30(3):203-13.
- 11. Hamilton JB, Wolfe JM. The effect of male hormone substances on birth and prenatal development in the rat. Anat Rec. 1938; 70:433-40.
- 12. Denissen JF, Grabowski BA, Johnson MK, Buko AM, Kempf DJ, Thomas SB, et al. Metabolism and disposition of the HIV-1 protease inhibitor ritonavir (ABT-538) in rats, dogs, and humans. Drug Metab Dispos. 1997; 25(4):489-501.
- 13. Carvalho AM, Oliveira-Filho RM, Simões MJ, Amed AA, Kulay L Jr. Effect of chronic ritonavir administration on pregnant rats and their fetuses. Clin Exp Obstet Gynecol. 2004; 31(3):229-31.
- 14. Mirochnick M. Antiretroviral pharmacology in pregnant women and their newborns. Ann N Y Acad Sci. 2000; 918:287-97.
- 15. Markowitz M, Saag M, Powderly WG, Hurley AM, Hsu A, Valdes JM, et al. A preliminary study of ritonavir, an inhibitor of HIV-1 protease, to treat HIV-1 infection. N Engl J Med. 1995; 333(23):1534-9.
- 16. Picard O, Rosmorduc O, Cabane J. Hepatotoxicity associated with ritonavir. Ann Intern Med. 1998; 129(8):670-1.
- 17. Minkoff H, Augenbraun M. Antiretroviral therapy for pregnant women. Am J Obstet Gynecol. 1997; 176(2):478-89.
- 18. Sulkowski MS, Mehta SH, Chaisson RE, Thomas DL, Moore RD. Hepatotoxicity associated with protease inhibitor-based antiretroviral regimens with or without concurrent ritonavir. AIDS. 2004; 18(17):2277-84.
- 19. Duong M, Sgro C, Grappin M, Biron F, Boibieux A. Renal failure after treatment with ritonavir. Lancet. 1996; 348(9028):693.
- 20. Deray G, Bochet M, Katlama C, Bricaire F. Nephrotoxicity of ritonavir. Presse Med. 1998; 27(35):1801-3.
- 21. Hussain S, Khayat A, Tolaymat A, Rathore MH. Nephrotoxicity in a child with perinatal HIV on tenofovir, didanosine and lopinavir/ritonavir. Pediatr Nephrol. 2006; 21(7):1034-6.
- 22. Huisman MT, Smit JW, Crommentuyn KM, Zelcer N, Wiltshire HR, Beijnen JH, et al. Multidrug resistance protein 2 (MRP2) transports HIV protease inhibitors, and transport can be enhanced by other drugs. AIDS. 2002; 16(17):2295-301.
- 23. Huisman MT, Smit JW, Wiltshire HR, Beijnen JH, Schinkel AH. Assessing safety and efficacy of directed P-glycoprotein inhibition to improve the pharmacokinetic properties of saquinavir coadministered with ritonavir. J Pharmacol Exp Ther. 2003; 304(2):596-602.
Datas de Publicação
-
Publicação nesta coleção
29 Out 2007 -
Data do Fascículo
Jul 2007
Histórico
-
Recebido
27 Nov 2006 -
Aceito
28 Jun 2007