Resumos
OBJETIVO: verificar a quantidade de células CD68+ no estroma das vilosidades coriônicas na placenta de gestações submetidas ou não ao trabalho de parto. MÉTODOS: estudo transversal, com gestantes saudáveis a termo, das quais 31 placentas foram examinadas pela técnica de imunoistoquímica. Vinte placentas foram obtidas após partos vaginais (GVAG) e 11 obtidas em cesarianas eletivas (GCES). Lâminas foram preparadas com amostras de vilosidades coriônicas e submetidas à marcação com anticorpo anti-CD68, específico para macrófagos. Foram contadas as células marcadas e as não marcadas dentro das vilosidades. Testes estatísticos não-paramétricos foram utilizados para a análise. RESULTADOS: entre 6.424 células contadas no estroma das vilosidades das 31 placentas, 1.135 células (17,6%) foram marcadas pelo CD68+. Em cada amostra placentária, a média de células coradas pelo anticorpo anti-CD68 foi de 22±18 para o grupo GVAG e de 20±16 para o grupo GCES. CONCLUSÕES: não houve diferenças significantes no percentual de macrófagos (CD68+) em associação com o trabalho de parto.
Antígenos CD; Amostra da vilosidade coriônica; Diagnóstico pré-natal; Placenta; Macrófagos; Imunoistoquímica; Trabalho de parto
PURPOSE: to verify the amount of CD68+ cells in chorionic villosities in placentae from gestations submitted or not to labor. METHODS: transversal study with healthy near-term pregnant women, among whose placentae, 31 have been examined by immunohistochemical technique. Twenty placentae were obtained after vaginal delivery (VAGG) and eleven after elective cesarean sections (CESG). Slides were prepared with chorionic villosities samples and labeled with anti-CD68 antibody, specific for macrophages. Labeled and nonlabeled cells were counted inside the villosities. Non-parametric statistical tests were used for the analysis. RESULTS: among the 6,424 cells counted in the villosities' stroma from the 31 placentae, 1,135 cells (17.6%) were stained by the CD68+. The mean of cells labeled by the anti-CD68 was 22±18 for the VAGG group and 20±16 for the CESG, in each placentary sample. CONCLUSIONS: there were no significant differences in the percentage of macrophages (CD68+) in association with labor.
Antigens, CD; Chorionic villi sampling; Prenatal diagnosis; Macrophages; Placenta; Immunohistochemistry; Labor, obstetric
ARTIGO ORIGINAL
Os macrófagos na placenta durante o trabalho de parto
The macrophages in the placenta during labor
Júlio Augusto Gurgel AlvesI;Lilia Maria Carneiro CâmaraII; Fabrício da Silva CostaIII; Rebeca Silveira RochaIV; Maria Neile Torres de AraújoII
IMédico Assistente da Maternidade Escola Assis Chateaubriand da Universidade Federal do Ceará - UFC - Fortaleza (CE), Brasil; Pós-graduando (Doutorado) em Saúde Coletiva no Programa Associado da Universidade Estadual do Ceará e Universidade Federal do Ceará - UECE/UFC - Fortaleza (CE), Brasil
IIDoutora, Professora Adjunto da Disciplina de Imunologia do Departamento de Patologia e Medicina Legal da Universidade Federal do Ceará - UFC - Fortaleza (CE), Brasil
IIIDoutor, Professor Adjunto da Disciplina de Ginecologia e Obstetrícia do Curso de Medicina da Universidade Estadual do Ceará - UECE - Fortaleza (CE), Brasil; Serviço de Obstetrícia do Hospital Geral de Fortaleza - HGF - Fortaleza (CE), Brasil
IVPós-graduanda (Mestrado) em Saúde Pública da Universidade Estadual do Ceará - UECE - Fortaleza (CE), Brasil
Correspondência Correspondência: Júlio Augusto Gurgel Alves Rua Gustavo Sampaio, 2.330 - Parquelândia CEP 60455-001 - Fortaleza/CE Fax: (85) 3296-2433 E-mail: juliogurgel@oi.com.br
RESUMO
OBJETIVO: verificar a quantidade de células CD68+ no estroma das vilosidades coriônicas na placenta de gestações submetidas ou não ao trabalho de parto.
MÉTODOS: estudo transversal, com gestantes saudáveis a termo, das quais 31 placentas foram examinadas pela técnica de imunoistoquímica. Vinte placentas foram obtidas após partos vaginais (GVAG) e 11 obtidas em cesarianas eletivas (GCES). Lâminas foram preparadas com amostras de vilosidades coriônicas e submetidas à marcação com anticorpo anti-CD68, específico para macrófagos. Foram contadas as células marcadas e as não marcadas dentro das vilosidades. Testes estatísticos não-paramétricos foram utilizados para a análise.
RESULTADOS: entre 6.424 células contadas no estroma das vilosidades das 31 placentas, 1.135 células (17,6%) foram marcadas pelo CD68+. Em cada amostra placentária, a média de células coradas pelo anticorpo anti-CD68 foi de 22±18 para o grupo GVAG e de 20±16 para o grupo GCES.
CONCLUSÕES: não houve diferenças significantes no percentual de macrófagos (CD68+) em associação com o trabalho de parto.
Palavras-chave: Antígenos CD/análise; Amostra da vilosidade coriônica/métodos; Diagnóstico pré-natal/métodos; Placenta/imunologia; Macrófagos/imunologia; Imunoistoquímica; Trabalho de parto
ABSTRACT
PURPOSE: to verify the amount of CD68+ cells in chorionic villosities in placentae from gestations submitted or not to labor.
METHODS: transversal study with healthy near-term pregnant women, among whose placentae, 31 have been examined by immunohistochemical technique. Twenty placentae were obtained after vaginal delivery (VAGG) and eleven after elective cesarean sections (CESG). Slides were prepared with chorionic villosities samples and labeled with anti-CD68 antibody, specific for macrophages. Labeled and nonlabeled cells were counted inside the villosities. Non-parametric statistical tests were used for the analysis.
RESULTS: among the 6,424 cells counted in the villosities' stroma from the 31 placentae, 1,135 cells (17.6%) were stained by the CD68+. The mean of cells labeled by the anti-CD68 was 22±18 for the VAGG group and 20±16 for the CESG, in each placentary sample.
CONCLUSIONS: there were no significant differences in the percentage of macrophages (CD68+) in association with labor.
Keywords:Antigens, CD/analysis; Chorionic villi sampling/methods; Prenatal diagnosis/methods; Macrophages/immunology; Placenta/imunology; Immunohistochemistry; Labor, obstetric
Introdução
Os mecanismos envolvidos no desencadeamento do trabalho de parto continuam sendo uma incógnita para a medicina. Sabe-se que o período de evolução de uma gravidez é um dos fatores essenciais para o seu êxito. Dentre os fatores envolvidos no relaxamento miometrial para garantir esse tempo necessário de evolução, destaca-se a progesterona. Por outro lado, a distensão miometrial, níveis elevados de estrógenos e de citocinas inflamatórias são exemplos de fatores que estimulam a contratilidade uterina. Há evidências de que ocorra infiltração de leucócitos e macrófagos na interface materno-fetal no início do trabalho de parto1,2 em placentas humanas e de camundongos1,3. Há evidências também de que fenômenos imunoinflamatórios com ativação de macrófagos no miométrio e no colo uterino estão associados ao desencadeamento do trabalho de parto1,2.
O aumento do fator alfa de necrose tumoral (TNF-α), interleucina-1 (IL-1), IL-2 e IL-8 no líquido amniótico, a maior expressão do RNA mensageiro da IL-6 e IL-8 no cório-decídua, no colo uterino e no miométrio e a maior expressão do RNA mensageiro da IL-1beta e IL-8 no âmnio sugerem que os macrófagos possam estar fortemente associados ao trabalho de parto3,4.
A quantidade de macrófagos e linfócitos T aumenta no estroma das vilosidades coriônicas nos casos de trabalho de parto prematuro com vilosites inespecíficas5. Detectou-se também uma maior concentração de macrófagos (células CD14+ e CD 68+) entre o miométrio e a placa basal de placentas humanas em caso de pré-eclâmpsia e trabalho de parto prematuro5.
A porção materna da placenta tem sido mais estudada do que a fetal com intuito de evidenciar a função dos macrófagos sobre a tolerância materno-fetal e sobre o mecanismo do parto. Porém, as vilosidades coriônicas representam 80% do tecido placentário e há possibilidades de o feto humano participar do desencadeamento do parto. Em gestações de camundongos, foi detectado o aumento da concentração de proteína A do surfactante (SP-A) no líquido amniótico no final da gestação. Esta age como um fator estimulante para a migração de macrófagos para o miométrio e ativação de fatores bioquímicos responsáveis pelo início do trabalho de parto7. Evidenciou-se também que a proteína SP-A tem sido demonstrada nas membranas amnióticas humanas quando existem corioamnionite7.
Outro fato que reforça a importância das condições fetais como um dos fatores determinantes para o início do trabalho de parto é a produção do cortisol fetal no final da gravidez humana. Próximo ao termo, há aumento da pela produção de cortisol e de sulfato de dehidroepiandrosterona (DHEAS) adrenal fetal de seres humanos. Esse último serve como substrato para a produção placentária de estrogênio, um antagonista da progesterona que pode contribuir com o desencadeamento do parto8.
Os macrófagos fetais, conhecidos como células de Hofbauer, são as células predominantes no estroma das vilosidades coriônicas da placenta durante toda gestação9-11. As células de Hofbauer desempenham um papel central no desenvolvimento e manutenção da placenta humana porque secretam citocinas importantes para o crescimento e diferenciação do trofoblasto12.
Há evidências de que citocinas inflamatórias aumentem durante o trabalho de parto, principalmente interleucina-1 (IL-1) e o fator alfa de necrose tumoral (TNF-a). Essas citocinas são secretadas pelos macrófagos que são as células mais frequentes do estroma viloso placentário. Não há estudos nos quais se avalia a população de macrófagos em associação ao trabalho de parto nas vilosidades coriônicas de placentas a termo. Neste estudo, compararemos a quantidade de macrófagos nas vilosidades coriônicas de placentas a termo após parto vaginal e após parto cesariano eletivo. A hipótese inicial é de que haja um maior número de macrófagos nas vilosidades coriônicas de placentas coletadas após parto vaginal.
Métodos
Desenho do estudo
Após a obtenção do consentimento livre e esclarecido, conforme protocolo aprovado pelo Comitê de Ética em Pesquisa Clínica do Centro de Ciências da Saúde e Complexo Hospitalar da Universidade Federal do Ceará, foram obtidas amostras de tecido placentário dentro de 30 minutos após o parto. Foram selecionadas pacientes consecutivas com gestação única a termo, sem quaisquer complicações clínicas ou obstétricas para se estudar a presença de macrófagos em suas placentas.
Trinta e uma placentas foram selecionadas de pacientes na idade gestacional entre a 38ª e a 41ª semana, nas quais não havia dados clínicos ou bioquímicos sugestivos de infecção, pré-eclâmpsia, restrição do crescimento fetal, diabetes gestacional ou hipertensão crônica. Vinte dessas placentas eram de pacientes que evoluíram para parto vaginal (grupo GVAG) e onze delas de pacientes submetidas a cesarianas eletivas (grupo GCES). As indicações para a cesariana nesse último grupo foram cesárea anterior, apresentação pélvica e pós-datismo; todas as pacientes foram submetidas a cesarianas eletivas, ou seja, não experimentaram a prova de trabalho de parto.
Amostras do tecido placentário
Foram coradas pelo menos duas lâminas para cada amostra de tecido placentário, sendo uma lâmina para o estudo da morfologia pelo método da hematoxilina-eosina e a outra com o anticorpo monoclonal anti-CD68. As vilosidades terminais foram o local escolhido para contagem das células marcadas, selecionadas dentre as menores vilosidades, cujo corte transversal mostrava-se arredondado ou ovalado, com bordas completamente visíveis e contendo cerca de 9 a 11 células mononucleares em seu interior. Foram analisadas, em média, 25 seções transversais das vilosidades terminais por lâmina representativa de cada amostra placentária. As células foram consideradas marcadas quando a superfície estava completamente contornada pelo cromógeno. As células endoteliais, trofoblásticas e endovasculares foram excluídas da contagem realizada ao microscópio óptico com aumento de 40 e 100 vezes. Ao final, pelo menos 250 células foram contadas em cada amostra placentária.
Fragmentos de tecido viloso foram identificados macroscopicamente após dissecção de um cotilédone central a partir da superfície materna. Esses fragmentos foram congelados em nitrogênio líquido ou embrulhados em papel alumínio e armazenados a -70 ºC. As secções de cada placenta foram coradas com hematoxilina e eosina para se excluirem anormalidades tais como vilosite, necrose, hidropsia e outras.
Foram realizados cortes histológicos de 5 micra (5 µm) no criostato à temperatura de 25 °C. Depois de preparadas, as lâminas foram fixadas em acetona (Synth, Diadema - SP) e metanol (Reagen - Rio de Janeiro- RJ) durante dois minutos à temperatura ambiente. Após a TBS (0,01 M e pH 7,4) lavagem por cinco minutos, as lâminas foram tratadas com peróxido de hidrogênio a 3% durante dez minutos para bloquear a atividade das peroxidases endógenas. As lâminas foram incubadas durante a noite com o anticorpo anti-CD68 (anticorpo anti-humano de camundongo, clone KP1, com especificidade para macrófagos; Dako, Dennmark), diluída em 1:50 em solução tampão "tris buffered saline" (TBS). Antígeno CD68 está localizada no lisossomo e fagossomo de macrófagos e monócitos humanos13,14 e os anticorpos que reagem com eles têm sido amplamente utilizados para identificar os macrófagos nos tecidos humanos15,16.
Controles negativos foram realizados utilizando soro normal dos camundongos (eBioscience, San Diego, EUA) em vez de anticorpos primários. Controles positivos foram realizados utilizando cortes histológicos de linfonodo de adultos humanos. Após duas lavagens em TBS, as secções foram incubadas por 30 minutos com imunoglobulinas de coelho anticamundongo conjugadas com peroxidase pré-absorvida diluídas de 1:50 em soro com albumina sérica bovina a 5%, em temperatura ambiente. Após duas lavagens em TBS, as lâminas foram incubadas com o complexo avidina-biotina peroxidase em uma câmara úmida durante 30 minutos e, depois, lavadas duas vezes em TBS e incubadas com 3,3-diaminobenzidina (Sigma, Steinhein-Alemanha) contendo 0,01% de peróxido de hidrogênio. Na etapa seguinte, as lâminas foram contrastadas com hematoxilina de Harris por um minuto, desidratadas com uma bateria de concentrações crescentes de álcool e xilol e montadas em resina sintética.
Análise estatística
Os dados foram analisados por meio do teste Kolmogorov-Smirnov para estudo da distribuição placentária no que diz respeito ao percentual de positividade de células. O teste de Mann-Whitney foi utilizado para comparar as GVAG (placentas de partos vaginais) e GCES (placentas de cesarianas eletivas). Foi considerado significante p<0,05. Os cálculos foram realizados por meio o programa estatístico Statistical Package for the Social Sciences (SPSS).
Resultados
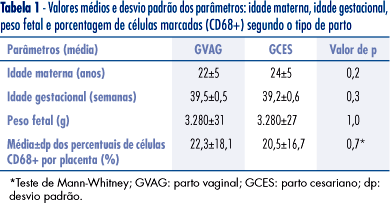
Os parâmetros clínicos do GVAG e GCES foram muito semelhantes. As médias da idade materna, a idade gestacional e o peso ao nascer não apresentaram diferenças significantes.
Dentre as 6.424 células contadas no estroma das vilosidades coriônicas, 1.135 (17,6%) foram consideradas CD68+ (Figura 1). Observou-se que cada placenta era homogênea, ou seja, mantinha a mesma proporção de células marcadas nas vilosidades coriônicas.
Porém, entre as placentas, houve diferença significativa na porcentagem de células marcadas. Houve casos em que a placenta apresentou apenas 4,5% de células marcadas e outros casos em que a placenta apresentou mais de 60% de marcação celular. O teste Kolmogorov-Smirnov confirmou que a diferença entre as placentas não obedece a uma distribuição normal.
No GVAG, a média de células marcadas em cada amostra placentária foi de 22,3±18,1% e a mediana apresentou um valor de 15,7%. As placentas de menor e maior marcação apresentaram 5,7 e 63% de células coradas, respectivamente.
No GCES, a média de células marcadas em cada amostra placentária foi cerca de 20,5±16,7% e a mediana apresentou um valor de 15,7%. As placentas de menor e maior marcação apresentaram 4,5 e 61,6% de células coradas, respectivamente.
As células anti-CD68+ estavam uniformemente distribuídas dentro do estroma das vilosidades coriônicas. Não foram encontradas em maior número na vizinhança do trofoblasto ou na periferia das vilosidades (Tabela 1).
Por meio do teste de Mann-Whitney, não foram verificadas diferenças significantes entre a razão de células marcadas pelo total de células contadas nas diferentes regiões das vilosidades coriônicas em associação à mudança do tipo de parto (Tabela 2).
O teste de Mann-Whitney foi utilizado para comparar a proporção de células marcadas (anti-CD68+) nas vilosidades coriônicas das placentas do GVAG e do GCES em relação à ocorrência ou não de trabalho de parto. Com aplicação do teste, não foi encontrada diferença significante (Tabela 2).
Discussão
A placenta é um órgão privilegiado que mantém um grande número de macrófagos em seu estroma mesmo sem dispor de drenagem linfática. No caso de corioamnionite, há uma maior concentração de macrófagos nas membranas amnióticas provenientes da transformação de trofoblastos da placenta17.
Nossa observação de que células CD68+ (macrófagos) constituíram 17,6% das células do estroma viloso está de acordo com as de outros pesquisadores que encontraram porcentagens semelhantes: 1718 e 15%19. O percentual de macrófagos em nosso estudo foi menor do que outros estudos que relataram taxas entre 40 e 50%12,20. Essa diferença pode ser explicada por variações metodológicas como o uso de anticorpos monoclonais diferentes, tipo anti-CD14. O anticorpo anti-CD14 reage com os receptores de lipopolissacarídeos e o anti-CD68, com a macrosialina.
Houve diferença na porcentagem de células marcadas pelo anticorpo anti-CD68 entre as 31 placentas estudadas e a causa não foi o fato de a paciente ter entrado em trabalho de parto ou não. É possível que haja um fator determinante não identificado neste estudo. Talvez um estudo mais amplo e com maior número de variáveis independentes favoreça a descoberta do motivo dessa diferença. Por exemplo, sabe-se que a obesidade materna está associada à maior concentração de macrófagos na placenta21.
Não se observou maior concentração de macrófagos na periferia das vilosidades nem próximo aos trofoblastos, como já havia sido descrito em estudo anterior. Essa observação pode ter sido diferente pelo fato de terem sido estudadas apenas vilosidades terciárias, onde a quantidade de tecido estromal é pequena e não há um grande distanciamento entre a parte central das vilosidades e a camada trofoblástica periférica.
Não foi observada uma maior quantidade dessas células marcadas pelo anti-CD68 nas placentas das pacientes que entraram em trabalho de parto. O fato de não ocorrer um aumento quantitativo de células CD68+ não exclui a possibilidade de essas células estarem mais ativadas e participando do desencadeamento do parto. Porém, esse achado sugere que não há uma migração dessas células em direção à interface materno-fetal, como ocorre no caso das placentas dos camundongos durante o trabalho de parto22.
Esse achado está de acordo com outro estudo em seres humanos que não encontrou macrófagos fetais, de fetos masculinos, no miométrio materno. A maior infiltração etrial de leucócitos e macrófagos, que ocorre durante o trabalho de parto, são células de origem materna23.
Recebido 21/1/09
Aceito com modificações 19/2/09
- 1. Thomson AJ, Telfer JF, Young A, Campbell S, Stewart CJ, Cameron IT, et al. Leukocytes infiltrate the myometrium during human parturition: further evidence that labour is an inflammatory process. Hum Reprod. 1999;14(1):229-36.
- 2. Mackler AM, Iezza G, Akin MR, McMillan P, Yellon SM. Macrophage trafficking in the uterus and cervix precedes parturition in the mouse. Biol Reprod. 1999;61(4):879-83.
- 3. Gravett GM, Witkin SS, Haluska GJ, Edwards LJ, Cook MJ, Novy MJ. An experimental model for intraamniotic infection and pattern labor in rhesus monkeys. Am J Obstet Gynecol. 1994;171(6):1660-7.
- 4. Osman I, Young A, Ledingham MA, Thomson AJ, Jordan F, Greer IA, et al. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Mol Hum Reprod. 2003;9(1):41-5.
- 5. Greco MA, Wieczorek R, Sachdev R, Kaplan C, Nuovo GJ, Demopoulos RI. Phenotype of villous stromal cells in placentas with cytomegelovirus, syphilis, and nonspecific villitis. Am J Pathol. 1992;141(4):835-42.
- 6. Kim JS, Romero R, Cushenberry E, Kim YM, Erez O, Nien JK, et al. Distribution of CD14+ and CD68+ macrophages in the placental bed and basal plate of women with preeclampsia and preterm labor. Placenta. 2007;28(5-6):571-6.
- 7. Han YM, Romero R, Kim YM, Kim JS, Richani K, Friel LA, et al. Surfactant protein-A mRNA expression by human fetal membranes is increased in histological chorioamnionitis but not in spontaneous labour at term. J Pathol. 2007;211(4):489-96.
- 8. Sirianni R, Mayhew BA, Carr BR, Parker CR Jr, Rainey WE. Corticotropin-releasing hormone (CRH) and urocortin act through type 1 CRH receptors to stimulate dehydroepiandrosterone sulfate production in human fetal adrenal cells. J Clin Endocrinol Metab. 2005;90(9):5393-400.
- 9. Wood GW. Mononuclear phagocytes in the human placenta. Placenta. 1980;1(2):113-23.
- 10. Bulmer JN, Johnson PM. Macrophage populations in the human placenta and amminiocorion. Clin Exp Immunol. 1984;57(2):393-403.
- 11. Goldstein J, Braverman M, Salafia C, Buckley P. The phenotype of human placental macrophages and its variation with gestacional age. Am J Pathol. 1988;133(3):648-59.
- 12. Khan S, Katabuchi H, Araki M, Nishimura R, Okamura H. Human villous macrophage-conditioned media enhance human trophoblast growth and differentiation in vitro. Biol Reprod. 2000;62(4):1075-83.
- 13. Kaiserling E, Xiao JC, Ruck P, Horny HP. Aberrant expression of macrophage-associated antigens (CD68 and Ki-M1P) by Schwann cells in reactive and neoplastic neural tissue. Light- and electron-microscopic findings. Mod Pathol. 1993;6(4):463-8.
- 14. Saito N, Pulford KA, Breton-Gorius J, Massé JM, Mason DY, Cramer EM. Ultrastructural localization of the CD68 macrophage-associated antigen in human blood neutrophils and monocytes. Am J Pathol. 1991;139(5):1053-9.
- 15. Pulford KA, Sipos A, Cordell JL, Stross WP, Mason DY. Distribution of the CD68 macrophage/myeloid associated antigen. Int Immunol. 1990;2(10):973-80.
- 16. Falini B, Flenghi L, Pileri S, Gambacorta M, Bigerna B, Durkop H, et al. PG-M1: a new monoclonal antibody directed against a fixative-resistant epitope on the macrophage-restricted form of the CD68 molecule. Am J Pathol. 1993;142(5):1359-72.
- 17. Kim SS, Romero R, Kim JS, Abbas A, Espinoza J, Kusanovic JP, et al. Coexpression of myofibroblast and macrophage markers: novel evidence for an in vivo plasticity of chorioamniotic mesodermal cells of the human placenta. Lab Invest. 2008;88(4):365-74.
- 18. Kabawat SE, Mostoufi-Zadeh M, Driscoll SG, Bhan AK. Implantation site in normal pregnancy. A study with monoclonal antibodies. Am J Pathol. 1985;118(1):76-84.
- 19. Yagel S, Livni N, Zacut D, Gallily R. Characterization and localization of human placental mononuclear phagocytes by monoclonal antibodies and other cell markers. Isr J Med Sci. 1990;26(5):243-9.
- 20. Nakamura Y, Ohta Y. Immunohistochemical study of human placental stromal cells. Hum Pathol. 1990;21(9):936-40.
- 21. Challier JC, Basu S, Bintein T, Minium J, Hotmire K, Catalano PM, et al. Obesity in pregnancy stimulates macrophage accumulation and inflammation in the placenta. Placenta. 2008;29(3):274-81.
- 22. Yellon SM, Mackler AM, Kirby MA. The role of leukocyte traffic and activation in parturition. J Soc Gynecol Investig. 2003;10(6):323-38.
- 23. Leong AS, Norman JE, Smith R. Vascular and myometrial changes in the human uterus at term. Reprod Sci. 2008;15(1):59-65.
Datas de Publicação
-
Publicação nesta coleção
23 Abr 2009 -
Data do Fascículo
Fev 2009
Histórico
-
Recebido
21 Jan 2009 -
Aceito
19 Fev 2009